Abstract
目的
通过构建pH和基质金属蛋白酶(matrix metalloproteinase, MMP)双响应性粒径可变纳米递药系统,协同提高化疗药物在肿瘤组织的高效滞留和高效穿透,增强肿瘤治疗效果。
方法
构建了透明质酸(hyaluronic acid, HA)碳量子点(carbon quantum dots, CD)偶联明胶纳米粒(gelatin nanoparticle, GNP),通过pH敏感的亚胺连接化疗药物阿霉素(doxorubicin, DOX),得到GNP@HA-CD-DOX纳米粒并进行表征,考察粒径变化能力、释药行为、血液相容性、细胞摄取和肿瘤球深层穿透能力、体内肿瘤分布以及治疗效果。
结果
GNP@HA-CD-DOX纳米粒粒径为(162.93±2.55) nm,在MMP处理下可降解释放出粒径约40 nm的HA-CD-DOX。该纳米粒DOX载药量为(4.94±0.22)%,DOX可以在肿瘤微环境和溶酶体中响应低pH释放。GNP@HA-CD-DOX无明显溶血现象;与MMP-2共孵育后粒径减小,能够明显提高细胞摄取和肿瘤球中的深层穿透。GNP@HA-CD-DOX在荷瘤小鼠模型上表现出优于小粒径HA-CD-DOX的肿瘤分布和抗肿瘤能力,且安全性较好。
结论
该pH和MMP酶双响应粒径可变的纳米递药系统协同提高药物在肿瘤的滞留和深层穿透,提高了抗肿瘤效果,为肿瘤治疗提供了新的思路。
Keywords: MMP酶, 粒径可变, 明胶纳米粒, 碳量子点, 阿霉素
Abstract
Objective
To construct a pH and matrix metalloproteinase (MMP) dual-responsive nano drug delivery system with adjustable particle size so as to synergistically enhance the retention and penetration of chemotherapeutic drugs in tumor tissues and improve tumor treatment effect.
Methods
Hyaluronic acid (HA) carbon quantum dots (CD) coupled with gelatin nanoparticle (GNP) were constructed, and were connected with doxorubicin (DOX), a chemotherapeutic drug, through pH-sensitive imine to produce GNP@HA-CD-DOX nanoparticles. The changes of particle size, drug release behavior, hemocompatibility, cell uptake and deep penetration of tumor spheroids, in vivo tumor targeting and therapeutic effect were analyzed.
Results
GNP@HA-CD-DOX nanoparticles had a particle size of (162.93±2.55) nm, which could be degraded to release HA-CD-DOX with a particle size of about 40 nm under the treatment of MMP. The drug loading of DOX was (4.94±0.22)%. DOX was released in the tumor microenvironment and lysosomes in response to the low pH. No obvious hemolysis was observed in GNP@HA-CD-DOX. GNP@HA-CD-DOX showed a reduction in particle size after co-incubation with MMP-2. The MMP-sensitive GNP@HA-CD-DOX had significantly improved cell uptake and better deep penetration in tumor spheres. GNP@HA-CD-DOX displayed better distribution in tumor and anti-tumor ability in tumor-bearing mice compared with the small particle size HA-CD-DOX group. In addition, it has better safety.
Conclusion
The pH and MMP dual-sensitive nano-tech drug delivery system with adjustable particle sizes synergistically enhances the retention and deep penetration of drugs in tumors as well as the anti-tumor effect, suggesting new approaches to tumor treatment.
Keywords: Matrix metalloproteinase, Adjustable particle size, Gelatin nanoparticle, Carbon quantum dots, Doxorubicin
肿瘤是严重威胁人类健康的重大疾病。肿瘤细胞生长旺盛,造成了肿瘤局部血管不完整,丰富的细胞外基质导致肿瘤组织间质压高,这些因素严重阻碍了药物在肿瘤部位的分布。适宜尺度(100~200 nm)的纳米药物可以利用肿瘤组织血管不完整的特点,通过高渗透和高滞留(enhanced permeation and retention, EPR)效应滞留于肿瘤部位[1-2]。然而,由于肿瘤致密的间质,这种尺度的纳米粒往往难以穿透至肿瘤深部,而较小尺度的纳米粒(30~50 nm)能够穿过肿瘤组织间隙,可实现药物的深部递送[3-5]。由此可见,在同一递药系统中同时实现药物在肿瘤的蓄积和深层穿透将大大提高药物的抗肿瘤效果。
肿瘤微环境响应性粒径可变递药系统的构建为克服“高滞留”与“高穿透”这对矛盾提供了可行的方案[6]。肿瘤微环境呈微酸性,且基质金属蛋白酶(matrix metalloproteinase, MMP)等酶含量丰富,利用这些特点,可以实现纳米粒粒径的响应性收缩[7-8]。有研究者构建了pH响应性电荷翻转和MMP酶响应性粒径可变纳米粒[9-11],实现了肿瘤深层穿透。
近年来,碳量子点(carbon quantum dots, CD)在肿瘤治疗的应用受到了越来越多的关注。CD粒径较小(约10 nm),易于肿瘤深层穿透,且CD表面的基团便于进行进一步修饰和载药[12-13]。以透明质酸(hyaluronic acid, HA)作为功能基团的CD能够通过与肿瘤细胞表面CD44的亲和作用实现肿瘤细胞的主动靶向,避免了额外的靶向分子修饰[14]。胶原蛋白衍生物明胶具有良好的生物可降解性和生物相容性,能够被MMP-2特异性降解[15]。基于此,我们采用HA作为功能基团制备CD,构建MMP-2酶响应性CD-明胶偶联的纳米粒(gelatin nanoparticle, GNP),再通过pH敏感的亚胺键连接化疗药物阿霉素(DOX),用于4T1乳腺癌的靶向治疗,以期协同实现化疗药物的高效滞留和高效穿透,有望为乳腺癌的治疗提供新的思路。
1. 材料与方法
1.1. 实验材料和设备
三乙胺、柠檬酸一水合物购于国药试剂有限公司,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)购于北京百灵威科技有限公司,支化聚乙烯亚胺(PEI,相对分子质量10000)购于上海阿拉丁试剂有限公司,N-羟基琥珀酰亚胺(NHS)、对醛基苯甲酸(p-CBA)购于上海萨恩化学技术有限公司,盐酸阿霉素购于大连美仑生物技术有限公司,HA(相对分子质量3 000~10 000)购于山东福瑞达生物医药有限公司,A型明胶、25%戊二醛购于美国Sigma Aldrich公司,MMP-2购于美国Abcam公司。鼠源性乳腺癌细胞4T1细胞系购于中科院上海细胞所。雌性BALB/C小鼠和昆明小鼠购于成都达硕实验动物公司。动物实验符合我国《实验动物福利伦理审查指南(GB/T 35892-2018)》相关要求。
VECTOR 22傅立叶红外光谱仪(Bruker,德国),Bruer INOVA 400 MHz核磁共振波谱仪(Varian,美国),Cary 100紫外分光光度计(Varian,美国),RF-5301荧光分光光度计(Shimadzu,日本),ZEN3690激光粒度及Zeta电位分析仪(Malvern,英国),BHITACHI-600型透射电子显微镜(Hitachi,日本),DMi1倒置生物显微镜(Leica,德国),Varioskan Flash多功能酶标仪(Thermo Fisher Scientific,美国),激光共聚焦显微镜(LSM 800,Zeiss,德国),流式细胞仪(FACSCelesta,BD,美国),IVIS® Lumina Series Ⅲ小动物成像系统(PerkinElmer,美国)。
1.2. 透明质酸碳量子点(HA-CD)的合成
采用以柠檬酸为碳源、HA和PEI为功能性基团制备CD。称取柠檬酸200 mg,PEI 400 mg,HA 120 mg至安瓿瓶中,分别加入去离子水,80 ℃烘箱加热溶解;在磁力搅拌下将柠檬酸与HA依次加入PEI中分散均匀,转移至25 mL高温反应釜中,180 ℃烘箱反应1 h,自然冷却至室温,置超滤管(截留相对分子质量50 000)中,3 500 r/min超滤30 min,重复4次,调节至pH7.4,得HA-CD。通过红外光谱和核磁共振氢谱鉴定。
1.3. GNP的制备
称取A型明胶粉末625 mg置于烧杯中,加入超纯水在42 ℃油浴加热下溶解,搅拌下匀速加入丙酮,静置沉淀,弃去上层混合液。加入超纯水少量,42 ℃加热溶解,1 mol/L盐酸溶液调节至pH2.75,置于圆底烧瓶,40 ℃恒温油浴搅拌,逐滴加入丙酮至体系显淡蓝色。将25%戊二醛溶液70 μL 稀释于1 mL丙酮中,缓慢滴加于上述淡蓝色体系中,交联反应7.5 h得粗产物。随后40 ℃旋转蒸发除去粗产物中丙酮至体积约8 mL,加入1 mol/L甘氨酸溶液200 μL中止反应,4 ℃冷藏过夜。紫外检测器254 nm波长监测下,pH6.0磷酸盐缓冲液为冲洗剂,CL-4B葡聚糖凝胶色谱柱纯化。
1.4. GNP@HA-CD-DOX纳米粒的构建及表征
取纯化后的GNP溶液4 mL至烧杯中,称取EDC 200 mg、NHS 300 mg,1 mol/L盐酸溶液调节pH4.5~5.5,缓慢搅拌30 min活化羧基,CL-4B琼脂糖色谱柱分离过量EDC/NHS,1 mol/L氢氧化钠溶液调节pH7.8。称取40 mg HA-CD分散至4 mL pH7.8 PBS中,磁力搅拌下缓慢滴加EDC/NHS活化羧基GNP,反应6 h,终止反应。加入3倍量体积甲醇于上述反应体系,体系呈现絮状沉淀物,静置6 h待沉淀完全,离心,弃上清液,加入pH7.8 PBS缓冲液,超声波粉碎仪探头超声分散,重复分离3次至上清液无色透明,得GNP@HA-CD,通过红外光谱和核磁共振氢谱鉴定。
精密称取盐酸阿霉素(DOX·HCl)12.0 mg至反应管中,加入无水DMSO溶解,加入三乙胺64 μmol,搅拌10 h,得脱盐酸阿霉素;随后加入对醛基苯甲酸2.48 mg,反应24 h形成p-CBA-DOX中间体,加入EDC 3.16 mg、NHS 4.74 mg反应3 h,活化p-CBA对位羧基。在搅拌下上述活化的p-CBA-DOX逐滴缓慢加入至GNP@HA-CD中,反应6 h,停止反应。置透析袋中(截留相对分子质量 8 000~14 000)透析3次,冻干备用,通过红外光谱和核磁共振氢谱鉴定。
将各样品GNP、GNP@HA-CD、GNP@HA-CD-DOX稀释到一定浓度后,采用纳米粒度电位仪,测试样品粒径分布与Zeta电位。
1.5. GNP@HA-CD-DOX的MMP酶响应性考察
取GNP@HA-CD-DOX 0.5 mL(GNP质量浓度0.2 μg/mL)加入0.5 mL新配含钙离子HEPES缓冲液,混合均匀,加入300 ng MMP-2,置离心管中于37 ℃、75 r/min摇床孵育,于预定时间点0 h、24 h取样,测定粒径评价纳米粒的MMP酶响应性。同时采用透射电镜观察MMP-2孵育前后纳米粒的外观。
1.6. GNP@HA-CD-DOX的载药量考察
为避免CD荧光的干扰,采用紫外分光光度计考察DOX的载药量。配置质量浓度为25.40、20.32、12.70、6.35、3.175、1.60 μg/mL的DOX标准溶液,以484 nm作为检测波长测量吸光度值(Abs),以Abs对质量浓度 (μg/mL)进行线性回归,绘制标准曲线,建立回归方程。根据GNP@HA-CD-DOX最终体积,设定同批次相同质量浓度GNP@HA-CD为空白对照,测定其载药量。
1.7. GNP@HA-CD-DOX体外药物释放考察
以去离子水将样品稀释至DOX质量浓度为100 μg/mL,以游离DOX作为参考对照组,每次取样1 mL加样于透析袋中(截留分子量 8 000~14 000),分别浸入50 mL不同pH(pH7.4、pH6.8、pH5.5)的释放介质中。在75 r/min、37 ℃摇床孵育48 h,每组于预定时间点0.5、1、2、4、8、12、24、48 h取样200 μL,同时补充等体积介质继续孵育。DOX释放样品使用荧光分光光度计于激发波长482 nm、发射波长555 nm条件下测定各荧光度值,通过标准曲线计算释放介质中药物含量及累积释放量。
1.8. GNP@HA-CD-DOX血液相容性初步考察
取健康昆明种小鼠全血,3 000 r/min×5 min离心,用生理盐水配制成浓度为2%红细胞悬液备用。分别以重悬于生理盐水和1%Triton X 的2%红细胞悬液作为空白对照(blank)和阳性对照(control)。GNP@HA-CD-DOX以生理盐水依次稀释为40.0、20.0、10.0、5.0、1.0 μg/mL浓度梯度(以DOX质量浓度计),加入等体积2%红细胞悬液,混匀,最终质量浓度为20.0、10.0、5.0、2.5、0.5 μg/mL。各组样品于37 ℃、75 r/min摇床孵育,分别于1、2、4 h时间点2500 r/min×5 min离心,分离出上清液,拍照,同时将各管上清液各取100 μL样品加入96孔板中,用化学发光仪于545 nm波长处测定各Abs,按下式计算各样品溶血率:
 |
1.9. MMP-2条件下细胞摄取考察
将18 mm×18 mm无菌盖玻片置于6孔细胞培养板中,将4T1细胞以5×105/孔的密度接种,37 ℃、体积分数为5%CO2及饱和湿度条件下培养。将HA-CD-DOX、GNP@HA-CD-DOX以及GNP@HA-CD-DOX+MMP(GNP@HA-CD-DOX与MMP-2预先孵育24 h)3组制剂以无血清培养基稀释,加入细胞中培养4 h,DOX质量浓度为100 μg/mL。取出细胞培养板中的盖玻片,多聚甲醛固定、DAPI染色后,倒置于滴有抗荧光淬灭剂的载玻片上封片处理,用共聚焦显微镜观察细胞摄取情况。为了定量考察细胞摄取能力,另采用流式细胞术检测DOX的荧光强度,评价细胞摄取水平。4T1细胞处理成单细胞悬液后按1×106/孔密度接种于6孔培养板中,37 ℃、体积分数为5%CO2及饱和湿度条件下培养。分组及培养方法同前,另设PBS组。培养4 h后,PBS清洗,胰酶消化细胞后,用流式细胞仪检测。
1.10. MMP-2条件下肿瘤球穿透性考察
取96孔培养板,每孔快速加入90 ℃融化的2%琼脂糖培养基70 μL,细胞培养箱中放置1 h固化定形。4T1细胞单细胞悬液1×103/孔密度接种于铺有琼脂糖的的96孔板,37 ℃、体积分数为5%CO2条件下培养3~5 d,直至肿瘤细胞自发聚集生长形成形状规整完好的致密球状。设定游离DOX组、HA-CD-DOX组、GNP@HA-CD-DOX与MMP-2预先孵育24 h(GNP@HA-CD-DOX+MMP-2)组和GNP@HA-CD-DOX组,每组DOX质量浓度为10 μg/mL,培养6 h。随后小心吸取肿瘤球,PBS清洗,体积分数为4%多聚甲醛固定30 min,置于载玻片上,采用激光共聚焦沿Z轴断层扫描肿瘤球,并按不同深度成像拍片。
1.11. GNP@HA-CD-DOX在荷瘤小鼠的组织分布
由于GNP@HA-CD-DOX具有正电性,近红外染料吲哚菁绿(ICG)为负电性分子,故我们采用电性吸附法制备近红外荧光染料ICG标记GNP@HA-CD-DOX(GNP@HA-CD-DOX@ICG)和HA-CD-DOX(HA-CD-DOX@ICG)进行活体成像,以判断该纳米粒在荷瘤小鼠的肿瘤分布情况。雌性BALB/C小鼠(6~8周龄)麻醉后,于第二乳垫下接种0.1 mL 6×106 mL−1 4T1细胞,待肿瘤长出至体积约50~80 mm3时,随机分为4组(每组3只),经尾静脉注射PBS、游离ICG、HA-CD-DOX@ICG和GNP@HA-CD-DOX@ICG,给药剂量为ICG:1.5 mg/kg。给药1 h、4 h、8 h 和24 h后,在激发波长788 nm、发射波长808 nm条件下,对小鼠进行活体成像,并在成像后剖出肿瘤组织,采用小动物活体光学成像系统,进行离体拍照,并利用Living Image®分析软件选择肿瘤部位作为感兴趣的区域(range of interest, ROI),软件自动计算ROI内的荧光强度,进行半定量分析。
1.12. GNP@HA-C-DOX对荷瘤小鼠治疗效果评价
建立原位乳腺癌荷瘤小鼠模型(建模方法同1.11),待肿瘤长出至体积约50~80 mm3时,随机分为4组,每组5只,经尾静脉分别给予PBS、游离DOX、HA-CD-DOX和GNP@HA-CD-DOX,DOX给药剂量为4 mg/kg,每次给药时间间隔2 d,共给药5次。自治疗之日起,检测肿瘤生长和体质量,按公式V=长×宽2×0.5计算肿瘤体积,绘制肿瘤生长曲线和体质量变化曲线。治疗结束后处死小鼠,心脏灌流后分离肿瘤,拍照对比肿瘤体积并称重,然后体积分数为4%多聚甲醛固定,进行石蜡切片和HE染色。
1.13. GNP@HA-C-DOX的安全性初步评价
为了考察两种制剂的体内安全性,取健康昆明种小鼠,雌雄各半,随机分为HA-CD-DOX组和GNP@HA-CD-DOX组,DOX给药4 mg/kg,另设PBS组作为对照组。每组3只,小鼠经尾静脉隔日给药1次,共给药5次,给药结束后,采用血细胞测定仪测定各项指标。
1.14. 统计学方法
组间比较采用单因素方差分析,组间两两比较采用t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. GNP@HA-CD-DOX纳米粒的表征和MMP-2酶响应性考察
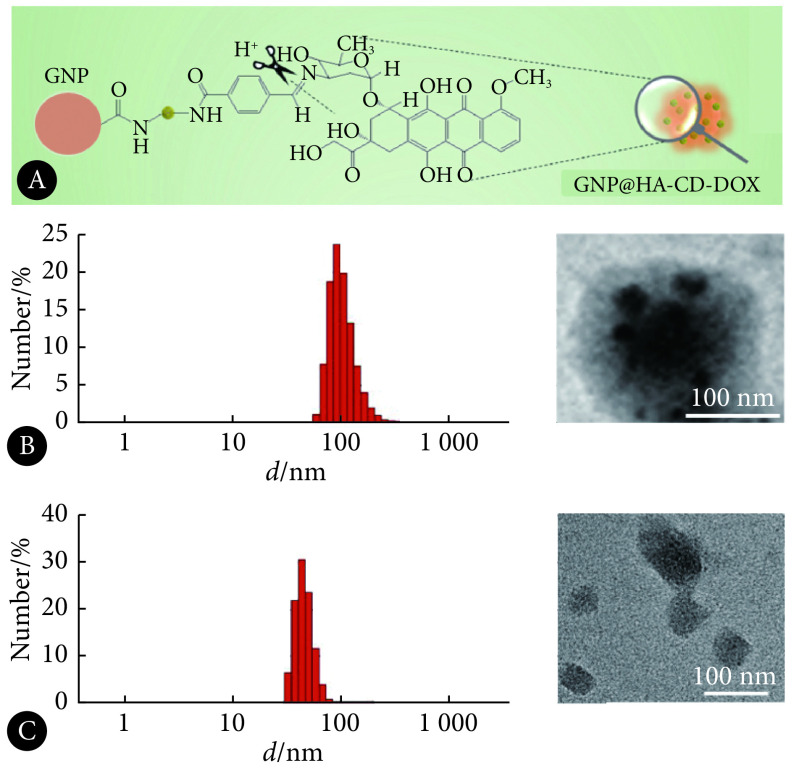
GNP@HA-CD-DOX的结构示意图见图1A。粒径和电位表征见表1。GNP粒径为(120.23±1.99) nm;Zeta电位为(−5.30±0.22) mV,略带负电。经修饰HA-CD后,粒径增大为(156.10±2.21) nm,由于HA-CD具有正电性,故经HA-CD修饰后,GNP@HA-CD呈现正电性。GNP@HA-CD-DOX水合粒径增大为(162.93±2.55) nm,其电镜形态观察如图1B。
图 1.
Schematic illustration of GNP@HA-CD-DOX and MMP-2 enzyme responsiveness of GNP@HA-CD-DOX
GNP@HA-CD-DOX结构示意图和MMP-2酶响应性定性考察
A: Schematic illustration of GNP@HA-CD-DOX; B: Size and morphology of GNP@HA-CD-DOX co-incubated with MMP-2 enzyme for 0 h; C: Size and morphology of GNP@HA-CD-DOX co-incubated with MMP-2 enzyme for 24 h.
表 1. Particle size and zeta potential of GNP, GNP@HA-CD and GNP@HA-CD-DOX.
GNP、GNP@HA-CD和GNP@HA-CD-DOX粒径分析
| Sample | Particle size/nm | PDI | Zeta potential/mV |
| PDI: Polydispersity index. | |||
| GNP | 120.23±1.99 | 0.176±0.011 | −5.30±0.22 |
| GNP@HA-CD | 156.10±2.21 | 0.133±0.025 | +11.53±0.31 |
| GNP@HA-CD-DOX | 162.93±2.55 | 0.165±0.016 | +10.70±0.36 |
GNP@HA-CD-DOX与MMP-2酶共孵育24 h后,由于核心部分GNP被降解,粒径减小,由约160 nm变为约40~50 nm,与透射电镜形态观察结果一致,见图1C。该结果证明了GNP@HA-CD-DOX的MMP-2酶响应性。
2.2. GNP@HA-CD-DOX的体外释放行为和血液相容性考察
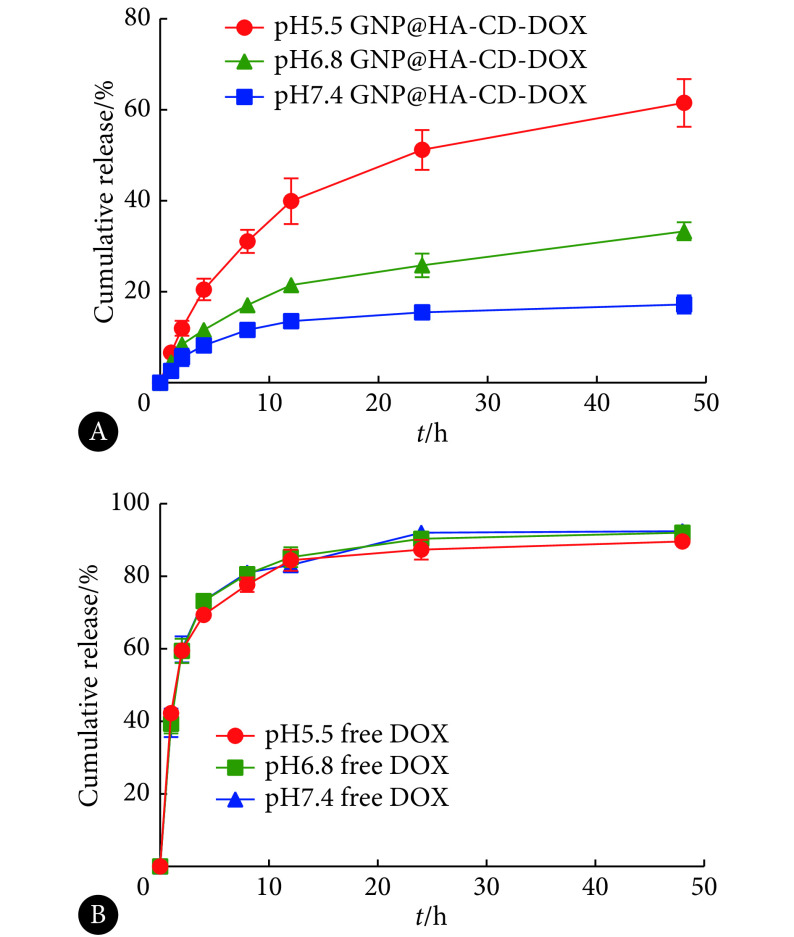
建立的回归方程为Abs=0.019 6C−0.006 0,R2=0.999 8。DOX载药量测定为(4.94±0.22)%。由图2可知,在pH7.4、pH6.8、pH5.5条件下孵育48 h,GNP@HA-CD-DOX载药释放量为17%、33.33%、61.53%,逐渐加快。而在3个pH条件下,游离DOX的释放快速、完全,无法区分。结果表明GNP@HA-CD-DOX具有pH敏感性药物释放特征。
图 2.
In vitro drug release profile of GNP@HA-CD-DOX (A) and free DOX (B) in different pH release medium (n=3)
GNP@HA-CD-DOX(A)和游离DOX(B)在不同pH下药物释放曲线(n=3)
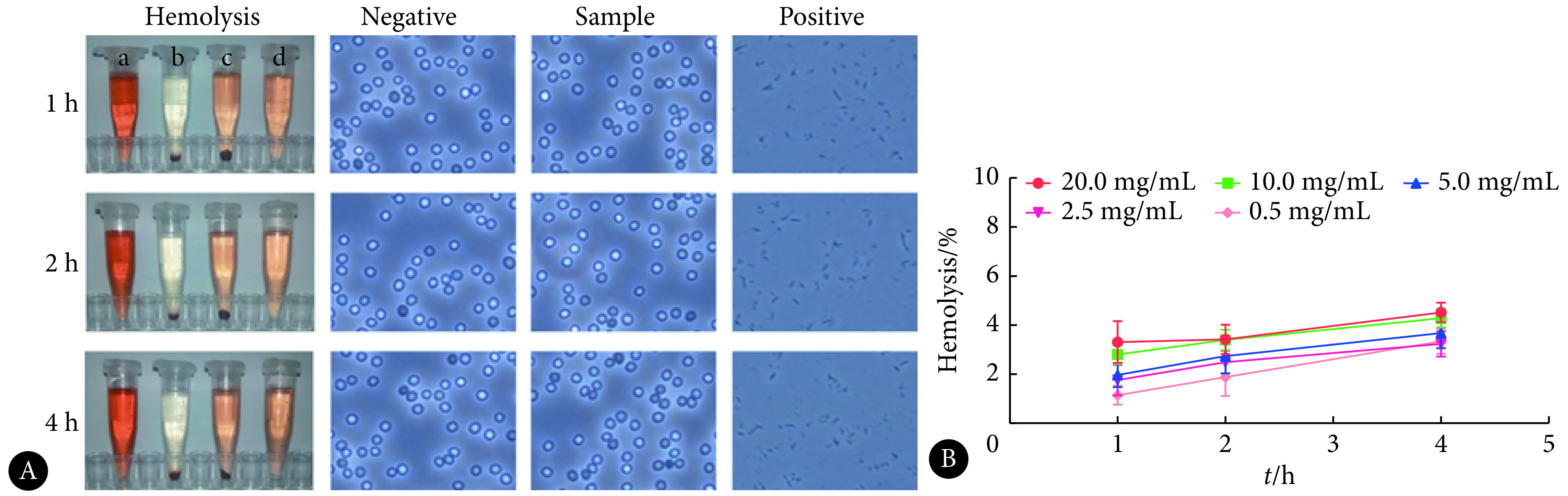
GNP@HA-CD-DOX没有观察到明显的溶血现象(图3)。阳性对照组在各时间点的显微镜观察中可见红细胞完全裂解,阴性对照组红细胞形态良好,纳米药物实验组与阴性对照组红细胞形态结果一致,表明在DOX质量浓度为20.0 μg/mL时,GNP@HA-CD-DOX未造成溶血。GNP@HA-CD-DOX制剂在不同DOX质量浓度下的溶血率随时间延长有所增加,但溶血率均小于5%,表明GNP@HA-CD-DOX在DOX≤20.0 μg/mL时无明显溶血现象。
图 3.
Photo images of hemolysis and red blood cell morphology of GNP@HA-CD-DOX at DOX concentration of 20 μg/mL (A, ×20) and percentage of hemolysis of GNP@HA-CD-DOX at different concentrations (B, n=3)
GNP@HA-CD-DOX(DOX:20 μg/mL)溶血情况及红细胞形态图(A,×20)及不同DOX质量浓度的GNP@HA-CD-DOX制剂在不同时间点的溶血率(B,n=3)
a: Positive control+red blood cell; b: Negative control+red blood cell; c: GNP@HA-CD-DOX+red blood cell; d: GNP@HA-CD-DOX.
2.3. 细胞摄取
见图4。激光共聚焦结果显示,未与MMP-2预先孵育的GNP@HA-CD-DOX组由于粒径较大,不易被细胞摄取;而与MMP-2预先孵育的GNP@HA-CD-DOX组由于明胶核心降解,释放出小粒径纳米粒,有利于细胞摄取。流式细胞仪检测结果与激光共聚焦结果趋势相同,MMP-2预先孵育的GNP@HA-CD-DOX组细胞摄取阳性率与HA-CD-DOX组相近,并且高于GNP@HA-CD-DOX组(P<0.001)。以上结果表明,GNP@HA-CD-DOX与MMP-2共孵育后粒径减小,能够更有效地被4T1细胞所摄取。
图 4.
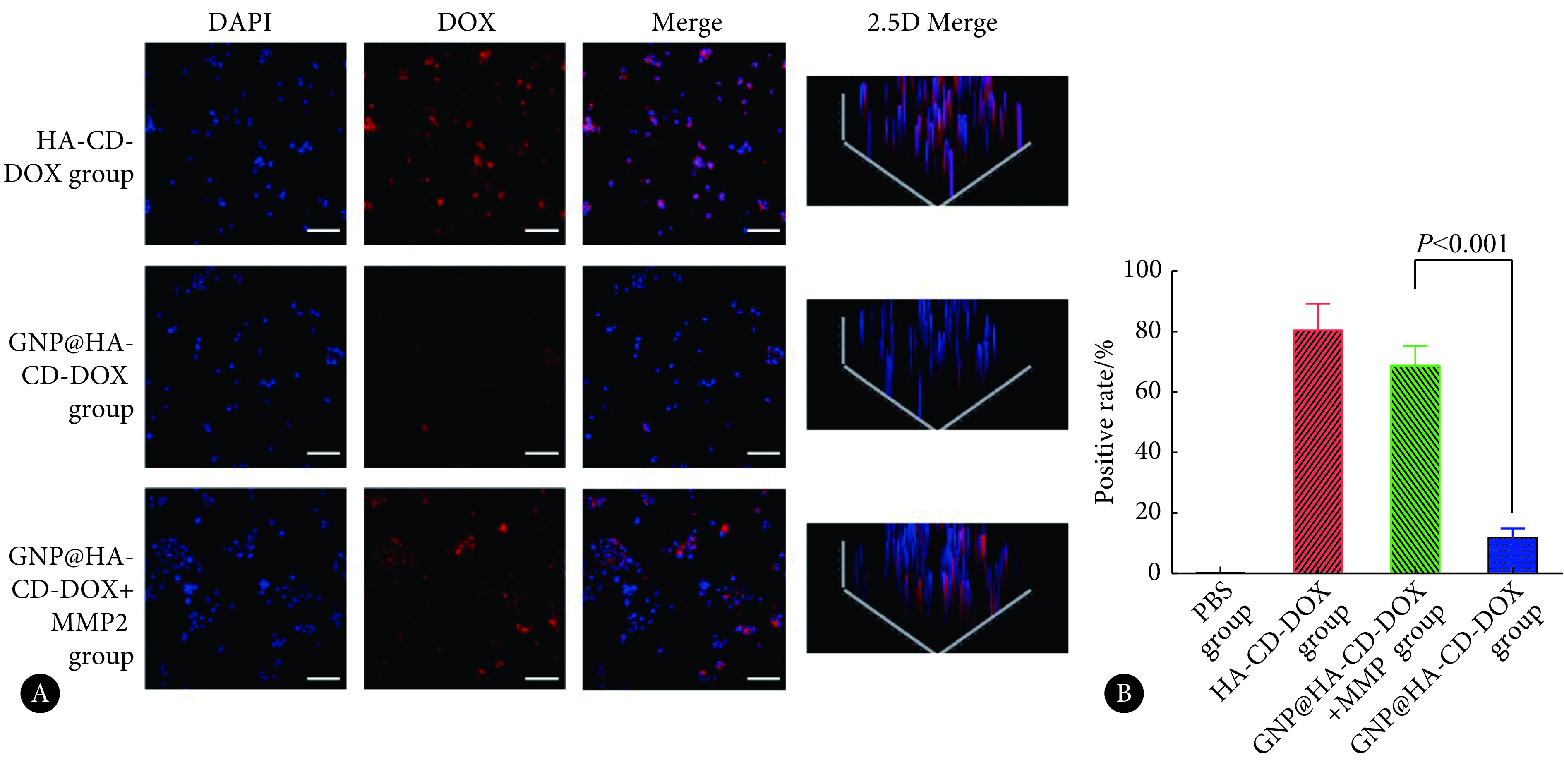
Confocal laser scanning microscopy images (A) and statistical analysis of flow cytometry results (B) of cellular internalization by 4T1 cells (scale bar=20 μm, n=3)
激光共聚焦(A)和流式细胞术(B)考察4T1细胞的摄取情况(标尺:20 μm,n=3)
2.4. 肿瘤球穿透性
GNP@HA-CD-DOX组由于粒径较大,穿透肿瘤球的能力差,因此荧光主要集中在肿瘤球外周,而且荧光强度较弱。而GNP@HA-CD-DOX与MMP-2共孵育24 h 后,在肿瘤球深部也可见荧光信号,而且荧光信号强度接近小粒径HA-CD-DOX组(图5)。这一结果表明,GNP核心被MMP-2降解后,释放出小粒径HA-CD-DOX,在肿瘤球扩散阻力较小,因此穿透肿瘤球的能力得到了提高,具有更强的穿透效应。
图 5.
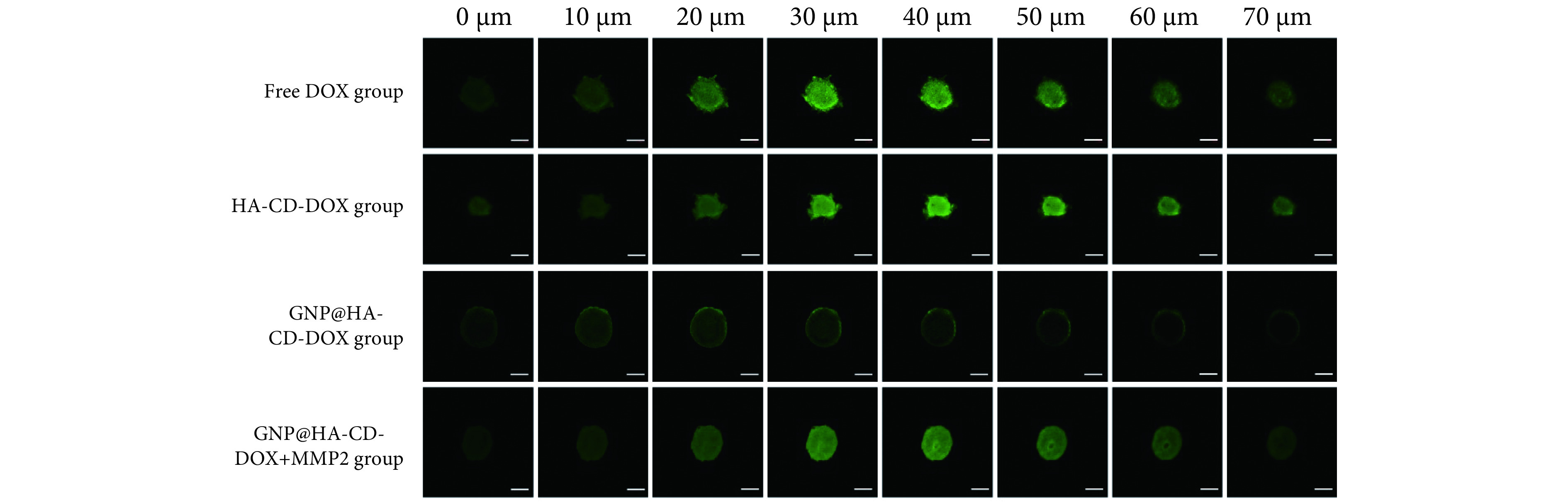
Penetration on 4T1 tumor spheroids after incubation for 24 h (scale bar=100 μm)
孵育24 h后4T1细胞肿瘤球上的深层穿透考察(标尺:100 μm)
2.5. GNP@HA-CD-DOX在荷瘤小鼠的体内分布
结果见图6。由活体成像和离体肿瘤组织荧光成像可知,GNP@HA-CD-DOX@ICG具有较高的肿瘤分布和滞留效应,在8 h时肿瘤蓄积最强,且在给药后24 h仍能在肿瘤部位观察到明显的荧光信号。小粒径HA-CD-DOX@ICG和游离ICG尽管在初始阶段在肿瘤部位有较高荧光,表明二者可以快速分布至肿瘤,但是由于其清除快、肿瘤滞留能力差,给药8 h后几乎无荧光。在1 h时,HA-CD-DOX@ICG组在肿瘤部位的荧光强度高于GNP@HA-CD-DOX@ICG组(P<0.001);而随着时间推移,GNP@HA-CD-DOX@ICG组的肿瘤蓄积逐渐增加,在8 h和24 h时,GNP@HA-CD-DOX@ICG组荧光强度高于HA-CD-DOX@ICG组(P<0.01)。由此可见,相较小粒径纳米粒和游离药物,大粒径GNP@HA-CD-DOX提高了肿瘤滞留效应。
图 6.
In vivo biodistribution of different formulations post administration through the tail vein (A), image of ex vivo distribution in tumor at different time points (B) and semiquantitative analysis of ex vivo distribution in tumor (C, n=3) at different time pointsc
尾静脉给药后各时间点活体成像结果(A)、离体肿瘤分布情况(B)及半定量分析(C,n=3)
**P<0.01, ***P<0.001. a: Free ICG group; b: HA-CD-DOX@ICG group; c: GNP@HA-CD-DOX@ICG group.
2.6. GNP@HA-CD-DOX对原位乳腺癌模型的治疗效果
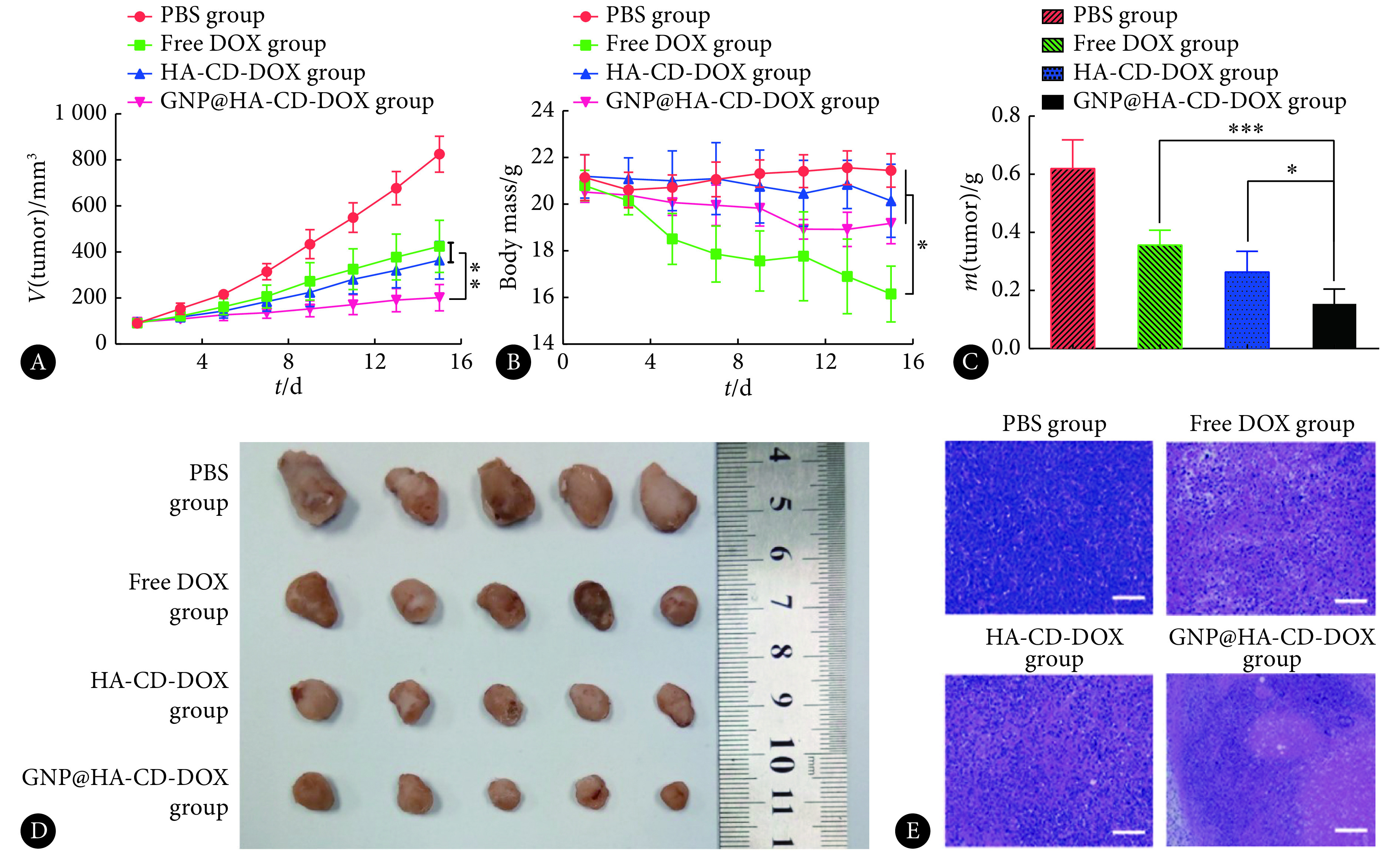
原位肿瘤生长抑制效果见图7。PBS组肿瘤体积快速增长;游离DOX组对小鼠肿瘤增长具有一定的抑制效果,肿瘤体积结果显示,在第15天时,GNP@HA-CD-DOX组肿瘤体积小于HA-CD-DOX组和游离DOX组(P<0.01);由于较好的肿瘤滞留行为,GNP@HA-CD-DOX组对肿瘤生长的抑制优于HA-CD-DOX组;治疗结束时,GNP@HA-CD-DOX组肿瘤质量最轻(P<0.05)。肿瘤治疗过程中小鼠体质量变化情况表明,PBS组小鼠体质量并无明显变化;游离DOX组小鼠体质量下降明显;由于载体对于DOX的递送与保护作用,HA-CD-DOX组与GNP@HA-CD-DOX组小鼠体质量下降程度低于游离DOX组。肿瘤组织切片表明,与游离DOX组和HA-CD-DOX组相比,GNP@HA-CD-DOX引起了明显的肿瘤凋亡和坏死。
图 7.
Tumor volume changes in orthotopic 4T1 tumor-bearing mice (A, n=5), changes of body weight of orthotopic 4T1 tumor-bearing mice (B, n=5), isolated tumor mass (C, n=5), isolated tumor images of orthotopic 4T1 tumor model (D), HE staining of tumor sections (E, scale bar=100 μm)
4T1原位移植瘤体积变化情况(A,n=5)、小鼠体质量变化情况(B,n=5)、离体肿瘤质量比较图(C,n=5)、离体肿廇图(D)和肿瘤组织切片HE染色图(E,标尺: 100 μm)
*P<0.05, **P<0.01, ***P<0.001.
2.7. GNP@HA-CD-DOX的安全性评价
结果见表2。GNP@HA-CD-DOX组、HA-CD@DOX组和对照组间各指标差异均无统计学意义,表明各组制剂均无明显毒性,GNP@HA-CD-DOX是一种安全性较好的纳米递药系统。
表 2. Blood biochemistry results.
血常规指标检测值
| Item | n | Group | ||
| HA-CD@DOX | GNP@HA-CD-DOX | PBS | ||
| WBC: White blood cell count; RBC: Red blood cell count; HGB: Hemoglobin; HCT: Hematocrit; MCV: Mean corpusular volume; MCH: Mean corpusular hemoglobin; MCHC: Mean corpusular hemoglobin concentration; PLT: Platelet count. | ||||
| WBC/109 L−1 | 3 | 3.43±0.21 | 3.80±0.90 | 4.83±1.10 |
| RBC/1012 L−1 | 3 | 8.30±0.98 | 8.94±1.40 | 8.91±0.63 |
| HGB/(g/L) | 3 | 120.33±18.18 | 144.00±14.00 | 126.67±7.09 |
| HCT/% | 3 | 41.60±5.59 | 50.40±6.81 | 44.80±3.76 |
| MCV/fL | 3 | 51.33±0.31 | 54.63±2.03 | 52.40±1.66 |
| MCH/pg | 3 | 13.90±0.46 | 15.07±0.75 | 14.47±0.35 |
| MCHC/(g/L) | 3 | 267.00±13.11 | 278.33±1.53 | 261.00±15.87 |
| PLT/109 L−1 | 3 | 684.00±273.65 | 691.67±108.26 | 706.00±313.96 |
3. 讨论
研究表明,纳米药物粒径与其在肿瘤组织的滞留呈正相关,在肿瘤组织,扩散是主要的转运机制,其扩散速率与粒径呈负相关。理想的纳米药物在具有较好的肿瘤组织滞留同时具有较强的组织穿透能力。本研究构建了GNP@HA-CD,进一步以p-CBA将DOX以酸敏感亚胺键连接于GNP@HA-CD,构建了pH和MMP-2酶双响应性粒径可变多级递药系统GNP@HA-CD-DOX,小粒径CD附着于大粒径GNP表面,形成了复合结构体系,粒径约160 nm。
肿瘤微环境的pH、氧化还原电位、酶、自由基、缺氧性环境等内源性刺激常被利用以构建肿瘤微环境响应性纳米药物递送系统[16]。MMP是参与肿瘤发生、发展和转移的主要细胞外酶[17]。制备产物的MMP-2酶响应性降解是该纳米粒实现粒径变化的关键特性。明胶能够被肿瘤组织高表达的MMP-2特异性降解。粒径测定初步表明本研究制备的GNP@HA-CD-DOX具有良好的酶响应性粒径可变特征。一般来说,当纳米粒尺寸小于30~50 nm时,纳米粒更容易渗透到实体瘤深部[18]。本研究结果表明,GNP@HA-CD-DOX在MMP-2作用下,释放出小粒径载药纳米粒,提高了药物的细胞摄取和3D肿瘤球模型上的深层穿透。
尽管小粒径HA-CD-DOX具有较好的摄取作用与穿透效果,但其肿瘤滞留效应差,体内治疗效果不佳。本课题所制备的GNP@HA-CD-DOX具有良好的EPR效应与HA主动靶向性,经血液循环有效靶向至肿瘤部位并滞留于此,在肿瘤组织细胞高表达MMP-2作用下,GNP降解,释放出小粒径HA-CD-DOX发挥其穿透与治疗作用。在给药剂量4 mg/kg条件下,4T1细胞原位乳腺癌模型上的治疗结果表明GNP@HA-CD-DOX组明显优于HA-CD-DOX组和游离药物组。
MMP酶响应性粒径可变多级递药策略在抗肿瘤治疗方面显示出一定的应用潜力,但仍面临一些问题[19]。MMP的表达与肿瘤的类型与发展阶段密切相关[20],此外,MMP对天然基质纳米粒降解过程相对缓慢,如能更加及时快速地释放功能性小纳米粒,进一步发挥穿透作用,有望进一步提高粒径可变多级递药体系对肿瘤的治疗效果。
综上所述,本课题构建了主动靶向MMP与pH双重响应性粒径可变多级递药体系GNP@HA-CD-DOX,该纳米递药系统在HA的主动靶向与EPR效应作用下靶向分布于肿瘤部位,在肿瘤微环境中MMP-2作用下,GNP核心降解,释放出小粒径的HA-CD-DOX穿透至肿瘤组织深部,同时,在肿瘤组织微环境与溶酶体酸性条件下释放DOX,发挥杀伤肿瘤细胞的作用。该递药策略利用肿瘤微环境的特点,不但克服了小粒径HA-CD-DOX肿瘤组织滞留差的问题,而且发挥了HA-CD-DOX肿瘤穿透效应的优势,实现了滞留与穿透作用的协调统一,提高了肿瘤治疗效果,有望为肿瘤治疗提供新的思路。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No.81690261、No.81773658)资助
Contributor Information
曼 李 (Man LI), Email: manli@scu.edu.cn.
勤 何 (Qin HE), Email: qinhe317@126.com.
References
- 1.ZHOU Q, DONG C, FAN W, et al. Tumor extravasation and infiltration as barriers of nanomedicine for high efficacy: The current status and transcytosis strategy. Biomaterials, 2020, 240: 119902[2020-02-18]. https://doi.org/10.1016/j.biomaterials.2020.119902.
- 2.LI Z, XIAO C, YONG T, et al Influence of nanomedicine mechanical properties on tumor targeting delivery. Chem Soc Rev. 2020;49(8):2273–2290. doi: 10.1039/C9CS00575G. [DOI] [PubMed] [Google Scholar]
- 3.OJHA T, PATHANK V, SHI Y, et al Pharmacological and physical vessel modulation strategies to improve EPR-mediated drug targeting to tumors. Adv Drug Deliv Rev. 2017;119:44–60. doi: 10.1016/j.addr.2017.07.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.SUN Q, OJHA T, KIESSLING F, et al Enhancing Tumor Penetration of Nanomedicines. Biomacromolecules. 2017;18(5):1449–1459. doi: 10.1021/acs.biomac.7b00068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.WANG J, MAO W, LOCK L L, et al The role of micelle size in tumor accumulation, penetration, and treatment. ACS Nano. 2015;9(7):7195–7206. doi: 10.1021/acsnano.5b02017. [DOI] [PubMed] [Google Scholar]
- 6.胡川, 高会乐 肿瘤微环境响应性与调节性递药系统研究进展. 药学学报. 2020;55(7):1520–1527. [Google Scholar]
- 7.PARK H, SARAVANAKUMAR G, KIM J, et al. Tumor microenvironment sensitive nanocarriers for bioimaging and therapeutics. Adv Healthc Mater, 2021, 10(5): e2000834[2020-10-19]. https://doi.org/10.1002/adhm.202000834.
- 8.HE Q, CHEN J, YAN J, et al Tumor microenvironment responsive drug delivery systems. Asian J Pharm Sci. 2020;15(4):416–448. doi: 10.1016/j.ajps.2019.08.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.JIA N, LI W, LIU D, et al Tumor microenvironment stimuli-responsive nanoparticles for programmed anticancer drug delivery. Mol Pharm. 2020;17(5):1516–1526. doi: 10.1021/acs.molpharmaceut.9b01189. [DOI] [PubMed] [Google Scholar]
- 10.CUN X, CHEN J, RUAN S, et al A Novel strategy through combining iRGD peptide with tumor-microenvironment-responsive and multistage nanoparticles for deep tumor penetration. ACS Appl Mater Interfaces. 2015;7(49):27458–27466. doi: 10.1021/acsami.5b09391. [DOI] [PubMed] [Google Scholar]
- 11.CUN X, LI M, WANG S, et al A size switchable nanoplatform for targeting the tumor microenvironment and deep tumor penetration. Nanoscale. 2018;10(21):9935–9948. doi: 10.1039/C8NR00640G. [DOI] [PubMed] [Google Scholar]
- 12.PANWAR N, SOEHARTONO A M, CHAN K K, et al Nanocarbons for biology and medicine: Sensing, imaging, and drug delivery. Chem Rev. 2019;119(16):9559–9656. doi: 10.1021/acs.chemrev.9b00099. [DOI] [PubMed] [Google Scholar]
- 13.DU J, XU N, FAN J, et al. Carbon dots for in vivo bioimaging and theranostics. Small, 2019, 15(32): e1805087[2019-12-18]. https://doi.org/10.1002/smll.201805087.
- 14.LI J, LI M, TIAN L, et al. Facile strategy by hyaluronic acid functional carbon dot-doxorubicin nanoparticles for CD44 targeted drug delivery and enhanced breast cancer therapy. Int J Pharm, 2020, 578, 119122[2020-02-05]. https://doi.org/10.1016/j.ijpharm.2020.119122.
- 15.KAEMMERER E, MELCHELS F P W, HOLZAPFEL B M, et al Gelatine methacrylamide-based hydrogels: An alternative three-dimensional cancer cell culture system. Acta Biomaterialia. 2014;10(6):2551–2562. doi: 10.1016/j.actbio.2014.02.035. [DOI] [PubMed] [Google Scholar]
- 16.候博, 王当歌, 高晶, 等 微环境激活型纳米递药系统用于肿瘤免疫治疗的研究进展. 药学学报. 2019;54(10):1802–1809. [Google Scholar]
- 17.COX T R The matrix in cancer. Nat Rev Cancer. 2021;21(4):217–238. doi: 10.1038/s41568-020-00329-7. [DOI] [PubMed] [Google Scholar]
- 18.CABRAL H, MATSUMOTO Y, MIZUNO K, et al Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nat Nanotechnol. 2011;6(12):815–823. doi: 10.1038/nnano.2011.166. [DOI] [PubMed] [Google Scholar]
- 19.YAO Q, KOU L, TU Y, et al MMP-responsive ‘Smart’ drug delivery and tumor targeting. Trends Pharmacol Sci. 2018;39(8):766–781. doi: 10.1016/j.tips.2018.06.003. [DOI] [PubMed] [Google Scholar]
- 20.EGEBLAD M, WERB Z New functions for the matrix metalloproteinases in cancer progression. Nat Rev Cancer. 2002;2(3):161–174. doi: 10.1038/nrc745. [DOI] [PubMed] [Google Scholar]