Abstract
目的
探索阿奇霉素/鼠李糖脂自组装纳米粒(AZI-RHL NPs)在体外对铜绿假单胞菌(Pseudomonas aeruginosa, P. aeruginosa)生物被膜的清除作用。
方法
制备并表征AZI-RHL NPs。采用微量肉汤稀释法测定AZI-RHL NPs对游离P. aeruginosa的最低抑菌浓度(MIC)。采用结晶紫染色法和SYTO 9/PI死活菌染色法评价AZI-RHL NPs对生物被膜的清除作用。采用荧光标记法探究NPs对生物被膜胞外聚合物(EPS)的清除作用。通过结晶紫染色法观察NPs对P. aeruginosa在人正常肺上皮细胞(BEAS-2B)黏附中的抑制作用。通过测定NPs与黏蛋白溶液孵育后的粒径变化考察其与黏蛋白的相互作用,以推测其黏液穿透能力。
结果
AZI-RHL NPs的粒径约为(121.4±6.0) nm,表面带负电,具有高包封率高载药量,对AZI的包封率为96.72%,载药量为45.08%,对RHL的包封率为99.38%,载药量为53.07%。AZI-RHL NPs对游离P. aeruginosa的MIC是AZI组的一半。AZI-RHL NPs可有效破坏生物被膜的结构,去除EPS中的蛋白质和多糖,在清除生物被膜的同时降低膜内细菌存活率,并抑制P. aeruginosa在BEAS-2B细胞上的黏附,避免残余细菌形成新的生物被膜。与黏蛋白溶液共孵育后NPs粒径无明显变化,提示NPs与黏蛋白相互作用较弱,推测其可穿透黏液到达P. aeruginosa感染部位。
结论
AZI-RHL NPs通过“穿透黏液-破坏生物被膜-杀死膜内细菌-抑制残余细菌再黏附”的“除膜四部曲”策略,有效提高了P. aeruginosa生物被膜的清除,为治疗包括P. aeruginosa在内的由生物被膜引起的顽固性感染提供了一种可复制的通用型策略。
Keywords: 阿奇霉素, 鼠李糖脂, 自组装纳米粒, 铜绿假单胞菌, 抗生物被膜
Abstract
Objective
To investigate the in vitro eradicative effect of self-assembled azithromycin/rhamnolipid nanoparticles (AZI-RHL NPs) on Pseudomonas aeruginosa (P. aeruginosa) biofilm.
Methods
AZI-RHL NPs were prepared and characterized. The minimum inhibitory concentration (MIC) of AZI-RHL NPs on planktonic P. aeruginosa was measured by the broth microdilution method. The eradicative effect of AZI-RHL NPs on P. aeruginosa biofilm was evaluated via crystal violet staining and SYTO 9/PI live/dead staining. Fluorescence labeling was used to measure the eradicative effect of NPs on extracellular polymeric substances (EPS). In addition, crystal violet staining was performed to evaluate the inhibitory effect of AZI-RHL NPs on the adhesion of P. aeruginosa on human bronchial epithelial BEAS-2B cells. To investigate the ability of AZI-RHL NPs to penetrate mucus, the interaction between NPs and mucin was measured via particle size changes after co-incubation with mucin solution.
Results
The AZI-RHL NPs had a particle size of about 121 nm and were negatively charged on the surface, displaying a high encapsulation efficiency and a high drug loading capacity of 96.72% and 45.08% for AZI, respectively and 99.38% and 53.07% for RHL, respectively. The MIC of AZI-RHL NPs on planktonic P. aeruginosa was half of that of using AZI alone. AZI-RHL NPs displayed the capacity to effectively destroy the biofilm structure and remove the proteins and polysaccharides in EPS, eradicating biofilms in addition to reducing the survival rate of bacteria in the biofilm. AZI-RHL NPs were shown to have inhibited P. aeruginosa adhesion on BEAS-2B cells and prevented the residual bacteria from forming a new biofilm. There was no significant change in the particle size of NPs after co-incubation with mucin solution, indicating a weak interaction between NPs and mucin, and suggesting that NPs could penetrate the mucus and reach the P. aeruginosa infection sites.
Conclusion
AZI-RHL NPs were able to effectively enhance the removal of P. aeruginosa biofilm through a four-step strategy of biofilm eradication, including penetrating the mucus, disintegrating the biofilm structure, killing the bacteria dispersed from biofilm, and preventing the adhesion of residual bacteria. We hope that this study will provide a replicable common strategy for the treatment of refractory infections caused by P. aeruginosa and other types of biofilms.
Keywords: Azithromycin, Rhamnolipid, Self-assembled nanoparticles, Pseudomonas aeruginosa, Antibiofilm
铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)是一种常见的条件致病菌,可导致医院获得性肺炎、呼吸机相关性肺炎以及囊性纤维化患者慢性肺部感染等[1-2]。P. aeruginosa能够通过多种机制产生耐药性,不易被清除,其感染难以根治、反复发作,严重危及人类生命健康[3]。生物被膜的形成是P. aeruginosa最典型的耐药机制之一。生物被膜是指细菌嵌入自身分泌的胞外聚合物(extracellular polymeric substance, EPS)中形成的具有三维结构的微生物聚集体。细菌可通过形成致密的EPS屏障,阻碍抗生素渗透、屏蔽宿主免疫系统,以及上调抗性基因的表达等,使其对抗生素的抗性较游离细菌强10~1 000倍,令传统抗生素难以发挥疗效[4]。因此,如何突破生物被膜屏障、恢复细菌对抗生素的敏感性,已成为生物被膜相关感染的治疗中亟待解决的问题。
近年来相关研究表明,大环内酯类抗生素阿奇霉素(azithromycin, AZI)能够降低P. aeruginosa的致病性、减轻P. aeruginosa感染的炎症反应[5-6]。但生物被膜的存在显著降低了AZI的抗菌作用,使其单用时所需剂量较大,且需设计复杂的药物递送体系保证AZI的疗效[7-8]。本课题组前期研究结果表明,阴离子表面活性剂鼠李糖脂(rhamnolipid, RHL)不仅能有效破坏生物被膜结构,而且可抑制残余细菌的再黏附,阻断其形成新的生物被膜[9-10]。目前未见有关RHL和AZI联合治疗P. aeruginosa所致顽固性感染的报道。因此,本实验构建了一种制备简单的AZI/RHL自组装纳米粒(azithromycin-rhamnolipid nanoparticles, AZI-RHL NPs),并对其抗P. aeruginosa生物被膜的作用、抑制细菌再黏附以及穿透黏液的能力等进行了评价,为治疗包括P. aeruginosa在内的、由生物被膜引起的顽固性感染提供了一种可复制的通用型策略。
1. 材料与方法
1.1. 细菌和细胞
P. aeruginosa(PAO1菌株,ATCC);人正常肺上皮细胞(BEAS-2B细胞,中国典型培养物保藏中心)。
1.2. 药品与主要试剂、仪器
阿奇霉素,结晶紫,三聚磷酸钠(上海麦克林生化科技有限公司);鼠李糖脂,FITC标记的刀豆蛋白A(FITC-concanavalin A, FITC-Con A),Type Ⅱ型黏蛋白(美国Sigma-Aldrich公司);磷钨酸(北京中镜科仪技术有限公司);LB肉汤(青岛海博生物技术有限公司);PBS缓冲液(武汉博士德生物工程有限公司);二甲基亚砜(DMSO),无水甲醇,冰醋酸(天津致远化学试剂有限公司);LIVE/DEAD BacLight Bacterial Viability Kits(美国Invitrogen公司);异硫氰酸荧光素(FITC)(上海翊圣生物科技有限公司);壳聚糖(50×103)(浙江金壳药业);胎牛血清,DMEM培养基(美国Gibco公司)。
磁力搅拌器(WH-610D,德国Wiggens);马尔文粒径仪(NANO ZS-90,英国Malvern);透射电子显微镜(JEM1400,日本JOEL);高效液相色谱(1260,美国Agilent);超净工作台(SW-CJ-2FD,苏州苏净集团);恒温培养箱(CDNP-9272,上海精宏);全温振荡器(HZQ-QX,哈尔滨东联电子);多功能酶标仪(Flex Station 3,美国Molecular devices);激光共聚焦显微镜(FV3000,日本Olympus);细胞成像系统(EVOS FL Auto,美国Thermo Fisher)。
1.3. 实验方法
1.3.1. AZI-RHL NPs的制备
称取RHL和AZI分别溶于蒸馏水和DMSO中。在搅拌的条件下,将AZI溶液逐滴加入RHL溶液中,使AZI/RHL的质量比为1∶1。滴加完毕后,室温搅拌15 min,制得AZI-RHL NPs。
1.3.2. AZI-RHL NPs的表征
AZI-RHL NPs的粒径及电势通过马尔文粒径仪测定。AZI-RHL NPs经2%磷钨酸染色后,通过透射电子显微镜观察其外观形态。AZI-RHL NPs的包封率和载药量通过高效液相色谱进行检测。AZI的色谱条件:流动相为磷酸盐缓冲液(pH8.2)∶乙腈35∶65(V/V),检测波长210 nm;RHL的色谱条件:流动相为磷酸盐缓冲液(pH5.5)∶乙腈43∶57(V/V),检测波长210 nm。AZI-RHL NPs在LB培养基中的稳定性通过与培养基共孵育后的粒径分布进行评价。
1.3.3. AZI-RHL NPs对游离P. aeruginosa最低抑菌浓度(MIC)的测定
使用微量肉汤稀释法测定药物对游离P. aeruginosa的MIC值[11]。将配制好的AZI、RHL和AZI-RHL NPs溶液用LB培养基稀释至600、300、150、75、37.5、18.75、9.375和4.69 μg/mL。将过夜培养的PAO1菌液用LB培养基稀释至600 nm处的光密度(OD600)值为0.05,并在此基础上继续稀释15倍。在96孔板中加入100 μL不同质量浓度的药物溶液与100 μL稀释后的菌液,以不含细菌的LB培养基为对照组。将96孔板置于37 ℃、150 r/min的恒温摇床中振荡培养24 h,根据CLSI指南以肉眼观察无明显浊度的孔所对应的药物浓度为MIC值[12]。MIC值越小,药物抗菌能力越强。
1.3.4. AZI-RHL NPs对P. aeruginosa生物被膜清除作用的测定
1.3.4.1. 结晶紫染色法
结晶紫能够与生物被膜中的细菌和胞外多糖结合,测定570 nm处的吸光度可以反映结晶紫结合的多少,从而对生物被膜的生物量进行表征。采用结晶紫染色法评价药物对P. aeruginosa生物被膜的清除作用。将过夜培养的PAO1菌液稀释至OD600值为0.05,以每孔200 μL加入到96孔板中,于37 ℃恒温培养箱中静置培养24 h,使细菌形成生物被膜。将AZI、RHL和AZI-RHL NPs溶液各用LB培养基稀释至300、150 μg/mL。吸弃原培养基,用PBS清洗后,依次在每孔中加入200 μL稀释后的药物溶液,以未加药物溶液的菌液为对照组,于37 ℃恒温培养18 h;吸弃药物溶液,用PBS清洗2次,甲醇固定,再以质量分数0.1%结晶紫溶液染色,洗涤烘干后于每孔中加入200 μL无水乙醇,振荡孵育30 min。使用酶标仪测定OD570值,用OD570值对生物被膜的生物量进行表征,OD570值越大说明生物被膜的生物量越多,生物被膜的清除程度越低。
1.3.4.2. SYTO 9/碘化丙啶(PI)死活菌染色法
为了考察药物对生物被膜中细菌活性的影响并更直观地了解药物对生物被膜形态结构的影响,本研究采用SYTO 9/PI死活菌染色法进行进一步评价。将稀释至OD600值为0.05的菌液按每孔2 mL加入到12孔板中,并将高温灭菌后的盖玻片斜插于每孔中,37 ℃恒温培养24 h,使生物被膜形成并附着在盖玻片上。将AZI、RHL和AZI-RHL NPs溶液用LB培养基稀释至300 μg/mL,以每孔2 mL加入到另一个12孔板中。附着有生物被膜的盖玻片经PBS清洗后,斜插于含药物溶液的12孔板中,以未加药物溶液的菌液为对照组,37 ℃恒温培养18 h。经处理的盖玻片用PBS清洗后,放入SYTO 9/PI混合染料中避光孵育15 min,洗去多余染料,置于载玻片上,使用激光共聚焦显微镜观察。生物被膜中的活细菌可以被SYTO 9标记成绿色,死细菌可以被PI标记而呈现红色,同时测定图像中SYTO 9荧光强度,进行荧光半定量分析。
1.3.5. AZI-RHL NPs对P. aeruginosa生物被膜EPS的影响
荧光染料FITC中的异硫氰基团能与蛋白质中游离的氨基结合,可用于标记生物被膜中的蛋白质,而FITC-Con A能够与生物被膜中的甘露糖结合,可用于标记生物被膜中的多糖成分。采用1.3.4.2中的斜插玻片法培养P. aeruginosa生物被膜。将附有生物被膜的盖玻片分别置于300 μg/mL的AZI、RHL和AZI-RHL NPs中,以未加药物溶液的菌液为对照组,37 ℃恒温培养18 h。为探究不同药物对EPS中蛋白和多糖的影响,经药物处理的盖玻片用PBS清洗后,一半放入FITC染料中对蛋白进行染色,另一半放入FITC-Con A染料中对多糖进行染色。孵育45 min后,洗去多余染料,置于载玻片上,使用激光共聚焦显微镜观察,测定荧光强度并进行荧光半定量分析。
1.3.6. AZI-RHL NPs抑制P. aeruginosa细胞黏附的评价
细菌在细胞上的黏附是引发感染以及在体内形成生物被膜的关键步骤。本研究采用结晶紫染色法考察药物对P. aeruginosa与BEAS-2B细胞间黏附的影响。BEAS-2B细胞以每孔1×104细胞接种至24孔板中,于37 ℃、体积分数5%CO2培养箱中培养24 h。将AZI、RHL和AZI-RHL NPs溶液用含10%胎牛血清的DMEM培养基稀释;过夜培养的PAO1菌液用同样的培养基稀释至OD600值为0.2。吸弃原培养基,在每孔中加入1 mL药物溶液与200 μL细菌稀释液,使药物溶液的最终质量浓度为75 μg/mL;以未加药物溶液和菌液的培养基作为空白对照组,仅加菌液的培养基作为阳性对照组。于培养箱中孵育2 h后,吸弃药物溶液,用PBS清洗2次,质量分数4%多聚甲醛固定,再以质量分数0.1%结晶紫溶液染色,洗涤烘干,使用细胞成像系统定性观察细菌与BEAS-2B细胞的黏附情况。
1.3.7. AZI-RHL NPs与黏蛋白相互作用的考察
为探究AZI-RHL NPs与黏蛋白之间是否存在相互作用,本研究以壳聚糖纳米粒(chitosannanoparticles, CS NPs)为阳性对照[10],测定制剂与黏蛋白溶液孵育前后的粒径分布。
1.3.7.1. 阳性对照CS NPs的制备和稳定性考察
精确称取壳聚糖溶于体积分数1%醋酸溶液中。壳聚糖溶液经0.45 μm滤膜过滤后,调至pH5.0。精确称取三聚磷酸钠溶于蒸馏水中。将壳聚糖溶液置于磁力搅拌器上,一边搅拌一边逐滴加入三聚磷酸钠溶液,使壳聚糖/三聚磷酸钠的质量比为5∶1。滴加完毕后,室温搅拌15 min,制得CS NPs。取等体积的CS NPs和PBS缓冲液混合,搅拌孵育15 min、30 min、1 h和1.5 h,分别取不同时间点的样品,通过马尔文粒径仪测定粒径,对CS NPs的稳定性进行考察。
1.3.7.2. 评价黏蛋白的相互作用
精确称取800 mg黏蛋白,用蒸馏水溶解至质量浓度为8 mg/mL。黏蛋白溶液经搅拌过夜,过滤除去沉淀后即得。取相同浓度的AZI-RHL NPs、CS NPs分别与等体积的黏蛋白溶液混合,搅拌孵育15 min、30 min、1 h和1.5 h。分别取不同时间点的样品,通过马尔文粒径仪测定粒径,观察其粒径变化。
1.4. 统计学方法
数据以
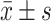 表示。多组间比较采用单因素方差分析,两组间比较采用Bonferroni法,P<0.05为差异有统计学意义。
表示。多组间比较采用单因素方差分析,两组间比较采用Bonferroni法,P<0.05为差异有统计学意义。
2. 结果
2.1. AZI-RHL NPs的表征
当AZI/RHL质量比为1∶1时,自组装形成的NPs粒径为(121.4±6.0) nm,多分散指数(polydispersity index, PDI)为0.159±0.018,电势为(−33.4±0.4) mV。AZI-RHL NPs具有较高的包封率和载药量,对AZI的包封率为96.72%,载药量为45.08%,对RHL的包封率为99.38%,载药量为53.07%。AZI-RHL NPs的外观形态通过透射电子显微镜进行观察,结果如图1A所示。经磷钨酸负染色的AZI-RHL NPs形态规则,呈灰白色类球形,平均直径约为116 nm,与粒径仪测定结果一致。此外,AZI-RHL NPs与LB培养基室温孵育的24 h期间,粒径无明显变化,如图1B所示,表明NPs在体外药效学评价中的稳定性较好。
图 1.
Characterization of AZI-RHL NPs
AZI-RHL NPs的表征
A: The transmission electron microscope image of AZI-RHL NPs. The arrow indicates AZI-RHL NPs; B: The stability of AZI-RHL NPs in LB medium (n=3).
2.2. AZI-RHL NPs对游离P. aeruginosa的MIC
微量肉汤稀释法测得RHL的MIC值大于600 μg/mL,无明显的抗菌活性。AZI对游离P. aeruginosa的MIC值为150 μg/mL,而AZI-RHL NPs对游离P. aeruginosa的MIC值为75 μg/mL,是AZI的一半,该结果表明相比于游离药物AZI,AZI-RHL NPs具有更强的抗菌活性。
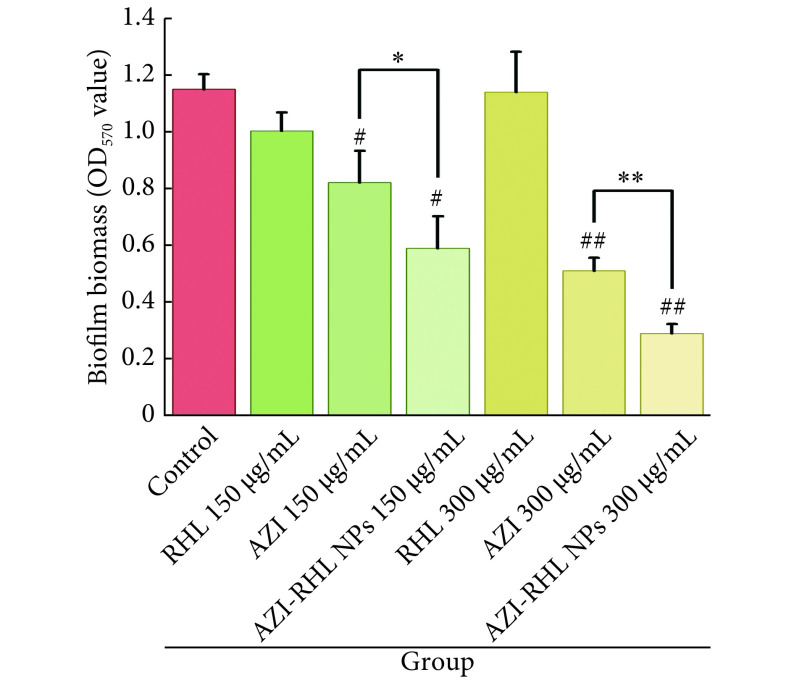
2.3. AZI-RHL NPs对P. aeruginosa生物被膜的清除作用
结果如图2所示。在150 μg/mL和300 μg/mL的质量浓度下,RHL对P. aeruginosa生物被膜均无明显的清除作用。与对照组相比,AZI和AZI-RHL NPs均可清除已形成的生物被膜,且清除程度随着药物浓度的增加而增加。在150 μg/mL和300 μg/mL的质量浓度下,AZI-RHL NPs对生物被膜的清除程度均高于AZI,两者间的差异有统计学意义(P<0.01)。该结果表明,AZI-RHL NPs制剂可更好地清除已形成的P. aeruginosa生物被膜。
图 2.
The eradicative effect of AZI-RHL NPs on P. aeruginosa biofilm was evaluated with the crystal violet staining method (n=6)
结晶紫染色法评价AZI-RHL NPs对P. aeruginosa生物被膜的清除作用(n=6)
# P<0.05, ##P<0.01, vs. control group; *P<0.05, **P<0.01.
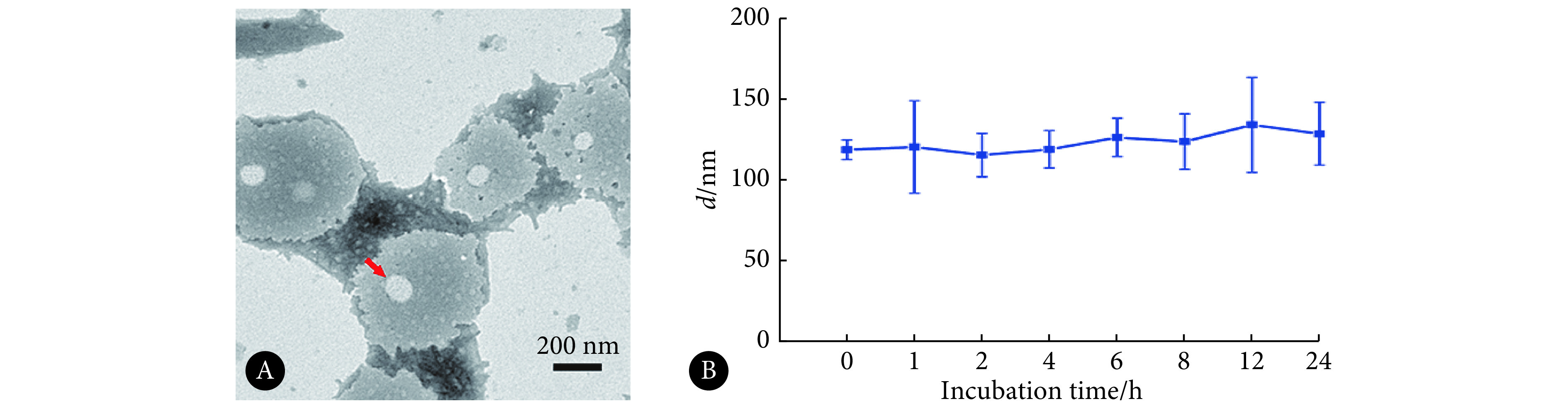
结果如图3A所示。对照组中可见大量的绿色荧光,表明P. aeruginosa形成了致密的生物被膜;而RHL组的结果与对照组类似,说明RHL无法对生长在生物被膜中的P. aeruginosa发挥杀伤作用,也未对生物被膜的形态结构有显著影响。相比于对照组,用AZI处理后的生物被膜中可见一定数量的红色荧光,说明在300 μg/mL时,AZI能够杀死P. aeruginosa生物被膜中的部分细菌;但存在的大量绿色荧光表明AZI对P. aeruginosa生物被膜的致密结构影响较小,尚有大量活菌残留。与AZI组相比,相同质量浓度的AZI-RHL NPs呈现出更佳的抗P. aeruginosa生物被膜的作用,其不仅能破坏致密的生物被膜结构,而且可有效地杀死生物被膜内绝大多数的P. aeruginosa。荧光半定量分析结果示(图3C),AZI组和RHL组与对照组间SYTO 9荧光强度的差异无统计学意义,但AZI-RHL NPs与其他各组间SYTO 9荧光强度的差异均有统计学意义(P<0.01),说明AZI-RHL NPs能够显著清除P. aeruginosa生物被膜。
图 3.
The eradicative effect of AZI-RHL NPs on P. aeruginosa biofilm
AZI-RHL NPs对P. aeruginosa生物被膜的清除作用
A: SYTO 9/PI live/dead kits staining; B: FITC and FITC-ConA fluorescence staining; C-E: Quantitative analysis of CLSM images of SYTO 9, proteins and polysaccharides. n=6. ## P<0.01, vs. control group; *P<0.05, **P<0.01.
2.4. AZI-RHL NPs对P. aeruginosa生物被膜EPS的影响
结果如图3B所示。对照组中大面积的绿色荧光表明P. aeruginosa生物被膜能够大量分泌EPS中的蛋白和多糖。与对照组相比,RHL组和AZI组中的绿色荧光存在不同程度上的减少,但仍较明显。而在AZI-RHL NPs组中,可见绿色荧光显著减少,荧光的分布较其他组更分散。荧光半定量分析结果(图3D、3E)示,对于蛋白和多糖,AZI-RHL NPs与对照组间的差异均有统计学意义(P<0.01),表明AZI-RHL NPs能够有效地清除P. aeruginosa生物被膜EPS中的多糖和蛋白质。
2.5. AZI-RHL NPs抑制P. aeruginosa与BEAS-2B细胞间的黏附作用
结果如图4所示。空白对照组中的BEAS-2B细胞生长良好,无细菌黏附。在阳性对照组中,大量细菌黏附于BEAS-2B细胞,形成紫色斑块,如图4B中黄色箭头所示,其中大多数细菌黏附在细胞周围,仅少量细菌分布在无细胞存在的空白区域。与阳性对照组相比,经RHL和AZI处理后细胞上黏附的P. aeruginosa显著下降,但视野中仍可观察到黏附形成的紫色斑块,如图4D中黄色箭头所示。与其他组比较,在使用AZI-RHL NPs处理后,视野中P. aeruginosa的总数最少,且黏附于BEAS-2B细胞上的细菌数量最少,说明制剂能有效地抑制细菌在细胞上的黏附。
图 4.

Crystal violet staining was used to evaluate the ability of AZI-RHL NPs to inhibit the adhesion of P. aeruginosa on BEAS-2B cells
结晶紫染色法评价AZI-RHL NPs抑制P. aeruginosa与BEAS-2B细胞间黏附
A: Blank group; B: Control group; C: RHL group; D: AZI group; E: AZI-RHL NPs group. Arrows indicate PA adhere on BEAS-2B cells.
2.6. AZI-RHL NPs与黏蛋白的相互作用
CS NPs在PBS中的稳定性结果如图5A所示。阳性对照组CS NPs在与PBS缓冲液孵育期间粒径无明显变化,但在与黏蛋白溶液孵育15 min后(图5B),粒径从122.4 nm变化为293.5 nm;孵育1.5 h后,粒径增大至354.0 nm,且粒径峰明显变宽,说明CS NPs与黏蛋白发生了聚集。而AZI-RHL NPs在与黏蛋白溶液孵育的1.5 h期间均未出现显著的粒径变化(图5C),表明AZI-RHL NPs与黏蛋白孵育期间未发生明显聚集,相互作用较弱。
图 5.
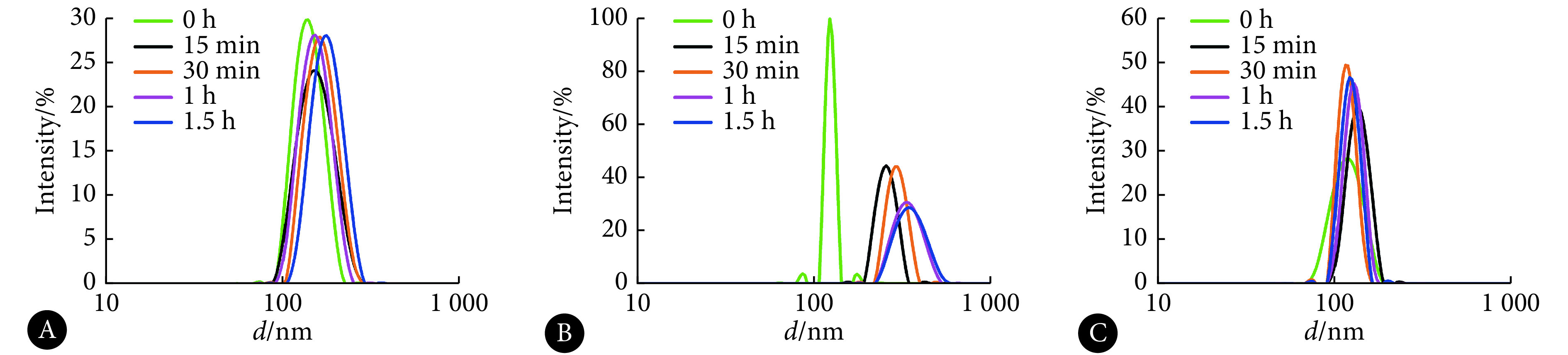
The particle size changes after incubation for different duration of time
孵育不同时间后的粒径变化
A: CS NPs and PBS solution; B: CS NPs and mucin solution; C: AZI-RHL NPs and mucin solution.
3. 讨论
P. aeruginosa因易产生耐药性,被WHO和CDC列为“迫切需要采取行动的公共卫生威胁”[13]。生物被膜为细菌提供了庇护场所,显著增强了细菌对抗生素的抗性,使其较游离细菌更难被清除。因此破坏并清除生物被膜已成为治疗细菌顽固性感染的重要策略。本研究首次将具有抗菌和抗炎作用的AZI与具有抗黏附和破坏生物被膜作用的RHL联用,采用简单的纳米沉淀法构建了粒径均一、包封率和载药量较高的AZI-RHL NPs,通过提高P. aeruginosa生物被膜的清除,治疗P. aeruginosa生物被膜引起的顽固性感染。
本研究发现,AZI-RHL NPs能够显著降低AZI对游离P. aeruginosa的MIC值,呈现出比AZI更强的抗菌作用。RHL虽然无抗菌活性,但其表面活性作用能使其插入到P. aeruginosa细胞膜中,干扰细胞膜结构的完整性,通过提高AZI的摄取增强其抗菌效果。
此外,AZI-RHL NPs对P. aeruginosa生物被膜呈现有效的清除作用。与游离细菌不同,生物被膜可增强P. aeruginosa对抗菌药物的抗性,导致抗生素不仅对生物被膜无效,长期使用还会诱发耐药[14-15]。我们前期的研究显示,RHL具有改变细菌和细胞表面亲疏水作用力,破坏生物被膜结构并促使其分散的能力[16]。但本研究中RHL单独使用时并未呈现出对P. aeruginosa生物被膜的分散作用,这可能是因为RHL无杀菌作用,未被杀死的细菌繁殖快,重新形成了新的生物被膜。而AZI-RHL NPs同时包载了AZI和RHL,RHL通过破坏生物被膜结构的完整性,使AZI能够有效杀灭暴露出来的内部细菌,实现了“破坏生物被膜-杀死膜内菌”。同时,我们还发现,P. aeruginosa生物被膜的清除与AZI-RHL NPs能够清除EPS中的多糖和蛋白质有关,与文献报道一致[17]。
生物被膜结构遭到破坏后,从内部分散出来的P. aeruginosa如果未能被完全杀灭,残余细菌可随着生命活动散落到周围组织中,在时机适宜时重新黏附在细胞表面,形成新的生物被膜,导致感染灶的转移以及二次感染的发生[18-19]。本研究中AZI-RHL NPs可通过抑制P. aeruginosa与细胞的黏附,有效地抑制生物被膜的再形成。这可能与RHL能够抑制细菌黏附素,从而减少细菌在细胞上的黏附有关;AZI则能够通过杀死P. aeruginosa减少其在细胞上的黏附。至此,AZI-RHL NPs有效地实现了“破坏生物被膜-杀死膜内细菌-抑制残余细菌再黏附”。
最后,本研究还对AZI-RHL NPs穿透黏液的能力进行了初步的考察。P. aeruginosa通常定植在肺部感染患者气道的厚重黏液中,黏液的存在能够阻碍抗生素的渗透、降低局部药物的浓度,故对于P. aeruginosa肺部感染的治疗,药物能否穿透黏液层并到达感染部位至关重要[20]。黏液层的网状结构仅允许粒径小于500 nm的粒子通过,且黏蛋白具有负电性,带正电荷的粒子易与其发生静电作用而被捕获[21]。本研究构建的AZI-RHL NPs粒径约121 nm,大小均一,能够避免分子排阻作用,同时电势为−33.4 mV,与黏蛋白相互作用弱,具备穿透黏液层的能力,能够将药物运输至细菌定植部位并发挥抗生物被膜的疗效。
综上所述,本文构建的AZI/RHL自组装纳米粒通过“穿黏液-破坏生物被膜-杀死膜内细菌-抑制残余细菌再黏附”的“除膜四步曲”策略,提高了P. aeruginosa的清除率,为治疗P. aeruginosa引起的顽固性感染提供了新的思路。AZI-RHL NPs清除生物被膜的体内药效及其作用机制需进一步深入研究。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 81973264、No. 81773659)和广东省自然科学基金(No. 2019A1515011954、No. 2021A1515012621)资助
References
- 1.PANG Z, RAUDONIS R, GLICK B R, et al Antibiotic resistance in Pseudomonas aeruginosa: Mechanisms and alternative therapeutic strategies . Biotechnol Adv. 2019;37(1):177–192. doi: 10.1016/j.biotechadv.2018.11.013. [DOI] [PubMed] [Google Scholar]
- 2.MALHOTRA S, HAYES D J, WOZNIAK D J. Cystic fibrosis and Pseudomonas aeruginosa: The host-microbe interface. Clin Microbiol Rev, 2019, 32(3): e00138-18[2021-05-28]. https://pubmed.ncbi.nlm.nih.gov/31142499/. doi: 10.1128/CMR.00138-18.
- 3.BASSETTI M, VENA A, CROXATTO A, et al How to manage Pseudomonas aeruginosa infections . Drugs Context. 2018;7:212527[2021-05-28]. https://doi.org/10.7573/dic.212527. doi: 10.7573/dic.212527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.陈小楠, 申元娜, 李彭宇, 等 细菌生物膜的特征及抗细菌生物膜策略. 药学学报. 2018;53(12):2040–2049. [Google Scholar]
- 5.DOULL I Cystic fibrosis 2019: Year in review. Paediatr Respir Rev. 2020;35:95–98[2021-05-28]. https://doi.org/10.1016/j.prrv.2020.04.001. doi: 10.1016/j.prrv.2020.04.001. [DOI] [PubMed] [Google Scholar]
- 6.HUBBLE V B, HUBBARD B A, MINROVIC B M, et al Using small-molecule adjuvants to repurpose azithromycin for use against Pseudomonas aeruginosa . ACS Infect Dis. 2019;5(1):141–151. doi: 10.1021/acsinfecdis.8b00288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.WAN F, BOHR S S, KLODZINSKA S N, et al Ultrasmall TPGS-PLGA hybrid nanoparticles for site-specific delivery of antibiotics into Pseudomonas aeruginosa biofilms in lungs . ACS Appl Mater Interfaces. 2020;12(1):380–389. doi: 10.1021/acsami.9b19644. [DOI] [PubMed] [Google Scholar]
- 8.HUANG Z, ZHOU T, YUAN Y, et al Synthesis of carbon quantum dot-poly lactic-co-glycolic acid hybrid nanoparticles for chemo-photothermal therapy against bacterial biofilms. J Colloid Interface Sci. 2020;577:66–74[2021-05-28]. https://doi.org/10.1016/j.jcis.2020.05.067. doi: 10.1016/j.jcis.2020.05.067. [DOI] [PubMed] [Google Scholar]
- 9.SHEN Y, ZOU Y, CHEN X, et al Antibacterial self-assembled nanodrugs composed of berberine derivatives and rhamnolipids against Helicobacter pylori . J Control Release. 2020;328:575–586[2021-05-28]. https://doi.org/10.1016/j.jconrel.2020.09.025. doi: 10.1016/j.jconrel.2020.09.025. [DOI] [PubMed] [Google Scholar]
- 10.LI P, CHEN X, SHEN Y, et al Mucus penetration enhanced lipid polymer nanoparticles improve the eradication rate of Helicobacter pylori biofilm . J Control Release. 2019;300:52–63[2021-05-28]. https://doi.org/10.1016/j.jconrel.2019.02.039. doi: 10.1016/j.jconrel.2019.02.039. [DOI] [PubMed] [Google Scholar]
- 11.BELANGER C R, LEE A H, PLETZER D, et al Identification of novel targets of azithromycin activity against Pseudomonas aeruginosa grown in physiologically relevant media . Proc Natl Acad Sci U S A. 2020;117(52):33519–33529. doi: 10.1073/pnas.2007626117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.KAISER S J, MUTTERS N T, BLESSING B, et al Natural isothiocyanates express antimicrobial activity against developing and mature biofilms of Pseudomonas aeruginosa . Fitoterapia. 2017;119:57–63[2021-05-28]. https://doi.org/10.1016/j.fitote.2017.04.006. doi: 10.1016/j.fitote.2017.04.006. [DOI] [PubMed] [Google Scholar]
- 13.DE OLIVEIRA D, FORDE B M, KIDD T J, et al. Antimicrobial resistance in ESKAPE pathogens. Clin Microbiol Rev, 2020, 33(3): e00181-19[2021-05-28]. https://pubmed.ncbi.nlm.nih.gov/32404435/. doi: 10.1128/CMR.00181-19.
- 14.OLIVARES E, BADEL-BERCHOUX S, PROVOT C, et al Clinical impact of antibiotics for the treatment of Pseudomonas aeruginosa biofilm infections . Front Microbiol. 2019;10:2894[2021-05-28]. https://doi.org/10.3389/fmicb.2019.02894. doi: 10.3389/fmicb.2019.02894. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.CIOFU O, TOLKER-NIELSEN T Tolerance and resistance of Pseudomonas aeruginosa biofilms to antimicrobial agents—How P. aeruginosa can escape antibiotics . Front Microbiol. 2019;10:913[2021-05-28]. https://doi.org/10.3389/fmicb.2019.00913. doi: 10.3389/fmicb.2019.00913. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.SHEN Y, LI P, CHEN X, et al Activity of sodium lauryl sulfate, rhamnolipids, and N-acetylcysteine against biofilms of five common pathogens. Microb Drug Resist. 2020;26(3):290–299. doi: 10.1089/mdr.2018.0385. [DOI] [PubMed] [Google Scholar]
- 17.THI M, WIBOWO D, REHM B. Pseudomonas aeruginosa biofilms. Int J Mol Sci, 2020, 21(22): 671[2021-05-28]. https://doi.org/10.3390/ijms21228671.
- 18.LILLEHOJ E P, GUANG W, HYUN S W, et al Neuraminidase 1-mediated desialylation of the mucin 1 ectodomain releases a decoy receptor that protects against Pseudomonas aeruginosa lung infection . J Biol Chem. 2019;294(2):662–678. doi: 10.1074/jbc.RA118.006022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.GUILHEN C, FORESTIER C, BALESTRINO D Biofilm dispersal: Multiple elaborate strategies for dissemination of bacteria with unique properties. Mol Microbiol. 2017;105(2):188–210. doi: 10.1111/mmi.13698. [DOI] [PubMed] [Google Scholar]
- 20.TURCIOS N L Cystic fibrosis lung disease: An overview. Respir Care. 2020;65(2):233–251. doi: 10.4187/respcare.06697. [DOI] [PubMed] [Google Scholar]
- 21.ZIERDEN H C, JOSYULA A, SHAPIRO R L, et al Avoiding a sticky situation: Bypassing the mucus barrier for improved local drug delivery. Trends Mol Med. 2021;27(5):436–450. doi: 10.1016/j.molmed.2020.12.001. [DOI] [PMC free article] [PubMed] [Google Scholar]