Abstract
传递体是一种类脂质的新型给药载体,具有优良的变形性、压差渗透性、两亲性等特点,主要在经皮给药和口服给药领域有较多应用,但传递体的处方组成使其对于静脉注射等全身给药途径的稳定性和有效性有待考量,或可通过处方的增加和改良以扬长避短,未来传递体凭借其变形性,或可在生理屏障(如血脑屏障等)的透过、在经皮免疫的疫苗研发等方面显示出其独特的优势。本文对传递体在主要性质、处方工艺因素、评价方法、主要给药途径及问题等方面进行了概述、例证和探讨,对传递体研究的思路加以归纳,对其研究前景予以展望。
Keywords: 传递体, 变形性, 表面活性剂, 处方工艺, 经皮给药, 口服给药
Abstract
The transformersome is a new kind of lipoid drug delivery carrier. It has a number of excellent properties, including deformability, pressure permeability, and amphiphilicity. It has been widely used in the field of percutaneous and oral administration of medication. However, due to factors concerning its formulation, the stability and effectiveness of intravenous injection and other systemic routes of administration of transfersomes should be carefully examined. As an alternative, the formulation can be enhanced or improved in order to better exploit the strengths and avoid the weaknesses. Because of its deformability, transfersome may have distinctive potential strengths in the penetration of physiological barriers, for example, the blood-brain barrier, and in the research and development of transdermal immunization vaccines. This review has summarized five aspects of transfersomes, including the main properties, the formulation and process influencing factors, evaluation methods, main administration routes, and problems. Herein, we have given some examples and analysis, summarized the research achievements and assessd prospects for future development.
Keywords: Transfersomes, Deformability, Surfactant, Formulation process, Transdermal administration, Oral administration
传递体又称为柔性脂质体,其处方工艺是在脂质体的基础上,加入合适的表面活性剂,不加或少加胆固醇同法制备的,具有高度变形性的新型脂质载体[1]。传递体作为一种新型给药手段,具有许多优良的性质和较广泛的载药应用,特别在经皮递送领域表现出了极大的优势。
1. 传递体的主要性质
1.1. 变形性
传递体是一种自聚集的囊泡,粒径略小于脂质体,由于加入了表面活性剂降低了囊泡的表面张力,能够穿过尺寸为其大小1/10至1/5的间隙,通过时发生自身形变,通过前后载体结构几乎不发生改变和破裂[2]。传递体高变形能力与其处方组分密切相关。遇小孔隙时,脂质体双分子层嵌插的疏水性胆固醇,不会自动向高压部位水溶液聚集。压力高于应力时,磷脂亲水端被挤压散开,脂质膜破裂,不具有变形性。但对于传递体系统,表面活性剂的亲水端会流动聚集在破损部位的水溶液中填补空隙,维持膜的完整性。
1.2. 压差渗透性
传递体凭借其向水性,可以顺应皮肤的渗透压差进入皮肤深层。当传递体封闭给药时,不会因为失水导致皮肤内外产生水化梯度,药物主要以缓释储库形式滞留在表皮和真皮层;当传递体涂抹于皮肤表面非封闭给药时,蒸发带走水分,传递体囊泡为了阻止失水过程的发展,顺着渗透压差变形移动进入皮肤深层[3]。一般情况下,传递体的皮肤整体透过量与纯水相当,并可通过血液和淋巴的转运分布于全身[2]。
2. 处方工艺因素对传递体质量的影响
传递体主要由磷脂和表面活性剂构成。磷脂种类和纯度、表面活性剂种类及用量、药物的性质、制备方法和制备工艺中的pH值、溶液的离子强度、温度等都对传递体的性质有较大的影响。
2.1. 磷脂
传递体常用的磷脂主要为磷脂酰胆碱,包括不饱和的大豆磷脂(soybean phospholipids, SPC)或蛋黄卵磷脂(egg phospholipids, EPC)[4]。
不同的磷脂其酰基链的长度和饱和度不同,可影响传递体的相变温度,从而影响一定温度下传递体胶晶或液晶的状态。磷脂酰基链越短,形成双分子层更薄,变形性更好。卢耀文等[5]制备槲皮素传递体,发现SPC传递体由于不饱和脂肪酸含量更高,双键的存在使得脂膜排列更加疏松,透皮效果高于EPC传递体。
磷脂的纯度和浓度对透皮吸收也有影响。ITA等[6]分别用50%、78.6%、95%纯度的磷脂制备传递体,发现纯度越高,透皮吸收效果越佳,可能与磷脂影响角质层超微结构,发生脂质融合从而透皮促渗有关。吴玉等[7]制备磷脂终浓度(质量分数)为0.4%、0.2%及0.1%的传递体,且磷脂浓度(质量分数)为0.2%时透皮效果最好,可能与不同磷脂浓度下,传递体的形成状态不同以及脂质融合不足或竞争削弱相关。
近年来,复合磷脂的研究和应用使传递体的变形性、稳定性、膜融合性、相变温度以及难溶性药物载药量等方面都有了较大的改善。吴玉等[8]将二棕榈酰磷脂酰胆碱与二肉豆蔻酰磷脂酰胆碱2∶3(质量比)混合后,得到复合磷脂制剂的包封率、稳定性和变形性都有显著提高。
2.2. 表面活性剂
传递体的常用到的表面活性剂有:脱氧胆酸钠、十二烷基硫酸钠、癸酸钠、聚氧乙烯蓖麻油、泊洛沙姆、1,2-丙二醇、司盘类及吐温类等。陈思思等[9]将混合中药挥发油(柠檬烯-柠檬醛)作为表面活性剂,有效提高了传递体的变形性。
表面活性剂的亲水疏水平衡值(hydrophile-lipophile balance number, HLB)值对传递体的包封率、透皮效果等都有较大的影响。一般HLB值小的表面活性剂与脂质双分子层的亲和力较高,透皮能力较强。但会与脂质膜“相似相溶”,与药物竞争性嵌合在双分子层中,并破环磷脂层的连续性导致药物泄漏。
表面活性剂与磷脂的比例,对于传递体的变形性有所影响。使用表面活性剂∶磷脂=15∶85(质量比)的比例时,所得到传递体的变形性最高,但同时包封率也最低[5]。故而在应全面平衡包封率、变形性及稳定性等因素的条件下,筛选合适种类和比例的表面活性剂。
2.3. pH值
在制备过程中,传递体的水相是由具有一定离子强度的缓冲液构成的,缓冲液的性质直接影响水相内传递体的状态和药物的反应。陈雅娉等[10]使用脱氧胆酸钠(sodium deoxycholate, SDC)作为表面活性剂制备传递体时,考察了不同pH值下传递体的包封率,结果显示pH为7.4时包封率最大,粒径最小。分析认为当溶液pH值增大时,SDC的离子化水平提高,亲水能力逐渐增强,表面张力的降低作用逐渐增强,故而粒径减小,但当溶液pH值超过一定范围后,溶液黏度增加,使得检测粒径相对增大。
杨艳等[11]制备盐酸特比奈芬传递体时,发现随pH升高包封率持续上升,且升至9.0时包封率可达93.4%。该现象可能与盐酸特比奈芬在不同pH条件下的溶解度不同,导致其在体系中的分配发生改变相关,提示在考虑pH值时也要注意药物的溶解度和解离状态,从而改善包封、减少泄漏。
2.4. 制备方法
传递体的制备方法常用薄膜分散-超声法、逆向蒸发法、注入法、冻融法、pH梯度法、高压微流射法等。其中薄膜分散法利于脂溶性药物传递体的制备;乙醇注入法具有更高的安全性[11];冻融法有利于温敏性药物;pH梯度法包封率较高。每种方法各有利弊,需要根据药物的性质和实验的要求选取合适的方法进行制备。部分制备方法简介如下。
2.4.1. 薄膜分散-超声法
其法是将磷脂、表面活性剂、亲脂性药物及其他亲脂性辅料溶于溶剂中充分混合后于旋转蒸发仪上去除溶剂,形成一层材料薄膜。接着将亲水性的药物或辅料溶于水性介质中,并以此溶液溶解薄膜,形成药物与辅料的水溶液分散体。此时形成的传递体大小不一,单室多室并存。需在一定的功率下超声适宜的时间,通过超声的空化效应和分散效应,使磷脂双分子层、表面活性剂与药物剂辅料重排组合,多室传递体被超声波分散均匀,多形成小单室结构,此时传递体制剂的粒径较小且分散性较好。
2.4.2. 逆向蒸发法
逆向蒸发法的主要制备过程是,将含有亲水性药物的水溶液,与磷脂、其他亲脂性的药物和辅料的有机溶液混合,通过如恒温搅拌、超声等方法乳化形成W/O的乳剂;后于旋转蒸发仪上除去油相溶剂形成凝胶;进一步减压蒸发得到传递体悬液,或在机械振荡仪上振荡至液体形成,也可得到传递体悬液。
在此过程中,亲水性的药物在乳化阶段就已包载在W/O乳剂的水性核心,随着有机溶剂的去除,油相的磷脂层不断聚集堆积,形成凝胶的构型。若有机溶剂进一步挥发至干,相邻乳滴的油相相互结合形成磷脂双分子层,同时两乳滴破裂,释放出内部的药液,使水相成为连续相,形成传递体的悬液[12]。
在转相的过程中,必然会导致水相药液的损失,包封率往往较低。水溶性药物在常规制备方法下包载效果均较差,其原因包括:溶液环境影响药物解离度;药物拥有自发向低浓度外水相分布的趋势;若药物HLB值不是很大,易在内核与磷脂层重分配导致泄漏。蒋国强等[13]对含有盐酸二甲双胍的凝胶施加电场,并缓慢注入磷脂溶液,使连续相由油相转变为水相的过程中药物仍吸附在乳滴内,减少因乳滴破裂造成的损失,使水溶性盐酸二甲双胍的包封率由(33.2±3.0)%提高到了(73.2±4.1)%。
2.4.3. 注入法
常用乙醇注入法和乙醚注入法,溶剂的选择取决于药物的热敏性和其他理化性质,而制备过程中的温度、注入速度、有机溶剂与水溶液的分散程度都会影响传递体的粒径和性质。通常是将磷脂和脂溶性的药物及辅料溶于合适的有机溶剂,将该溶液缓慢注入含亲水性药物及辅料的恒温水相中,恒温水相的温度应高于有机溶剂的沸点,使其在注入混合的过程中得以挥发去除。在此过程中,磷脂在接触水相后,通过亲水疏水作用自发排列成双分子层结构,将亲水性药物包裹在内核中。随着有机溶剂的逐渐蒸发,亲脂性药物及辅料与磷脂膜融合,形成载药传递体系统。
2.5. 其他因素
对传递体性质影响的其他因素还有很多,包括胆固醇加入与否、制备温度、药物本身性质等。
胆固醇在脂质体中可以起到稳定脂质双分子层的作用,在传递体中亦然。但过多加入胆固醇会明显影响传递体的变形性。同时,传递体的粒径也受胆固醇用量的影响,粒径在一定范围内随用量增加而增大,而由于胆固醇的膜稳定作用包封率也会增大。
温度对传递体的影响主要体现在相变温度以上时,传递体将由胶晶状态转变为液晶状态,从而增加膜的流动性。同时由于磷脂含有不饱和键,若在水化等过程中温度过高,溶液离子会使磷脂的疏水键断裂,反而降低流动性,导致药物的渗漏[14]。
药物性质对传递体的影响首先考虑其亲水亲脂性。当药物的亲水性或疏水性较强时,药物分子可以避免膜间的流穿,若药物在包封环境下同时带电荷,可与磷脂发生静电吸附,则具有较高的包封率。
3. 传递体的评价方法
传递体的质量评价中,除了外观、粒径、电位、透射电镜、扫描电镜等常见的表征外,流动性、变形性、包封率等也是评价传递体稳定性和功能性的重要手段。同时随着计算机科技的进步,分子动力学模拟方法也逐渐成为预测传递体质量的高效辅助工具。
3.1. 包封率
加入表面活性剂会对包封率的测定产生影响,同样包封率的检测手段也可使同一批次的样品实验结果产生差异。陈丽萍等[15]将广藿香作为模型药物,以胆酸钠为表面活性剂,研究超速离心法、鱼精蛋白法、超滤离心法以及微柱离心法对传递体包封率的影响,将回收率和分离度作为评价指标。结果显示超速离心法的RSD值较大,且检测包封率较低;微柱离心法由于传递体与葡聚糖表面位点结合而渗漏的原因包封率远低于其他方法。超滤离心法与鱼精蛋白法均操作简便,方法稳定性好,但超滤离心法成本较高。
3.2. 变形性
变形性又称为弹性,是传递体与脂质体相比特有的评价项目。主要反映其透膜变形的能力。陈思思等[10]将传递体于0.49 MPa的高压膜挤出器中,挤过50 nm的聚碳酸酯径迹蚀刻膜,以完全挤过的时间长短作为传递体变形性评价的标准,时间越短则代表变形性越好。
魏燕等[16]通过变形指数(deformation index, DI)的计算,更为精确地描述了传递体的变形能力,即
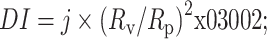 |
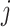 为一定时间内的过膜体积;Rv为挤出后传递体的粒径;Rp为膜孔的孔径。
为一定时间内的过膜体积;Rv为挤出后传递体的粒径;Rp为膜孔的孔径。
3.3. 流动性
传递体膜的流动性是其变形性和渗透性的基础,也密切影响其包封率和稳定性。陈雅娉等[1]通过荧光探针对非诺贝特传递体进行了流动性的考察。根据荧光偏振技术测定各向异性值r,通过对不同SDC:SPC比例组r值的比较,发现随SDC比例的上升,r值减小,流动性增强。推而广之可考察不同处方工艺因素对膜流动性的影响。
3.4. 分子动力学模拟
随着计算机科学技术的发展,对载药系统微观动力学的模拟可以更好地解释递药穿膜原理,更高效地对处方组成等前期研究提供指导。YIN[17]通过组分和环境等信息,模拟出了二棕榈酰磷脂酰胆碱/胆固醇的相变图,并可得出相变温度等基础信息。借助Helfrich模型及其推导公式[18],可计算出磷脂层的的形态、结构和弹性等信息。TSAI等[19]借助囊泡作用数目和溶剂参与面积,得到了构象分布密度图以推测融合机制及过程。MENG等[20]则利用物质的极性大小等因素,计算药物的跨膜自由能以预测其穿膜能力。吴智敏等[21]利用传递体系统的径向分布密度和自由能推测出了传递体在跨膜过程中囊泡的相互作用,预测了传递体在变形、稳定、载药方面的能力。
4. 传递体主要给药途径
传递体由于其优良的变形能力和其他性质,主要在经皮、口服等给药途径中有广泛的应用。
4.1. 经皮给药
传递体高经皮渗透能力的主要原理有四:利用传递体的高度变形性,顺利穿过数层甚至十数层角质层;利用皮肤天然的渗透压差作为驱动力,促进传递体透过角质层的细胞通道;利用磷脂双分子层的成分,使角质层细胞的脂质疏松排列,减小渗透阻力;通过附属器穿越皮肤屏障[4]。传递体作为一种优良的经皮给药载体,可包载多种类型和功能的药物,已有各类小分子药物传递体递药系统的研究报道[22-23]。生物大分子药物传递体递药系统的研究也方兴未艾,如胰岛素、白介素-2、干扰素-α、超氧化物歧化酶、牛血清白蛋白、过氧化物歧化酶等都通过传递体实现了有效的经皮递送。
为了使经皮给药具有更强的皮肤渗透性,还可通过表面修饰,对传递体的功能进行进一步的增加、改善和强化。较早时期,曾利用带正电的壳聚糖与皮肤负电荷糖蛋白结合促进真皮渗透[24]。或利用透明质酸受体配体结合、疏水基团相似相溶及吸湿性渗透的原理,提高传递体在皮肤中的定位和渗透能力[25]。近几年,王娟等[26]利用渗透促进剂活化的PEG修饰,利用其促进角质层孔道开放和PEG的囊泡柔顺性,大大提高了传递体的变形性和透皮能力。
4.2. 口服给药
传递体也可用于口服胃肠道给药。一方面由于传递体的高度变形性易于透过小肠上皮细胞间的紧密连接,促进药物通过毛细血管进入体循环。另一方面,由于传递体处方中含有如胆酸钠或脱氧胆酸钠的胆盐,可仿胆汁作为乳化剂,促进肠道脂类物质和脂溶性药物的吸收。
SONG等[27]将鲑鱼降钙素包裹在传递体中,并用Caco-2细胞和家兔模型评价,发现脱氧胆酸钠的加入可使降钙素的胃肠道吸收透膜率提高10.8倍、体内生物利用度提高7.1倍。陈雅娉等[1]建立了非诺贝特的传递体口服给药系统,并以Beagle犬为对象评价了体内生物利用度情况,与微粉化胶囊和脂质体相比较,传递体组生物利用度分别为前两者的5.13倍和1.57倍。可见传递体口服给药系统也具有明显的制剂学优势。
5. 问题与展望
相较于传统脂质体,传递体同样具有两亲性、靶向修饰性等载体优势,同时传递体又由于拥有优良的变形性、压差渗透性以及胆盐表面活性剂的肠道乳化作用,更适用于经皮给药和口服给药的递药途径。另外,由于传递体处方中胆固醇的减少与表面活性剂的添加,使得其粒径远小于常规脂质体,能够实现特殊部位的被动靶向和渗透。
尽管传递体载体新兴、递药优良,但对于其剂型的优化、完善,作用机理的深化,药动药效的研究以及质控评价方法的规范等方面都还有许多需要深入探讨的问题。设计中稳定性和功能性的提高,将为传递体的广泛应用起到推动性的作用。
传递体的不稳定性表现在:①物理不稳定性。磷脂双分子层是一种动态的膜系统,形态结构一直都在流动变化中,容易在温度、pH或电解质浓度等因素的影响下产生溶解、融合或聚集。②化学不稳定性。传递体的磷脂双分子层含有较多的不饱和脂肪键,容易在pH、氧气等因素的影响下发生水解或氧化,生成过氧化物、溶血卵磷脂等有毒副作用的化合物,降低膜的变形流动能力,并加剧药物的渗漏和传递体的沉淀聚集[21]。同时若包载药物能于磷脂膜相互作用,会产生以游离药物为架桥的相邻磷脂交联、吸附、聚集和沉降,严重影响制剂的稳定性。
传递体的功能不完善性体现在:①传递体的变形性依赖于对处方的深入考察,若变形性不足时,反而会堵塞皮肤孔道,影响渗透效果。②传递体在透皮或透膜时,脂质相似相溶可能会导致传递体成分的丢失和改变。③传递体系统的载药量普遍较低,药物递送的高效性不足。④传递体的给药途径单一,绝大部分仅用于透皮给药,少部分药物用于胃肠道给药,在其给药途径的扩大和优势性能的拓展方面任重而道远,可探索利用传递体透过各类生理屏障或细胞屏障的能力,如血脑屏障、眼结膜屏障等。
2020年抗病毒药物及疫苗的研究再次成为热点。普通抗病毒的化学药物溶解性和渗透性大多较差、生物利用度较低;核酸和蛋白类的药物活性虽强,但生物稳定性差。另外,病毒需要寄生才能繁殖,抗病毒药或多或少会对机体细胞产生毒性,由于大多数抗病毒药物都不具有靶向性,会对机体血流量大或主导代谢的组织、器官和细胞等产生毒副作用。同时,在病毒性脑膜炎等特殊部位的疾病中,血脑屏障等生理屏障和细胞屏障,使得抗病毒药物难以到达病灶部位发挥作用。故而将抗病毒药物与适宜的载体相结合的递药手段显得尤为重要。
而传递体作为一种具有生物相容性的载药系统,亲水核和疏水层可包封药物类型广泛,能大大改善药物因溶解度低导致的生物利用度不高的问题。渗透性较差,或者需要局部给药的抗病毒药物可以利用传递体的高变形性,轻松通过比自身粒径小的孔隙,促进药物的深部渗透。传递体表面亦可修饰特异性的配体或抗体,利用靶头的主动靶向性,提高抗病毒药物的有效富集,减少全身不良反应和毒副作用,并减少抗病毒药物的给药剂量,并提高疗效。对于跨越屏障给药,传递体更显示出了较强的优势,通过变形和渗透,可跨越一般药物和载体难以通过的屏障壁垒,达到预定部位发挥治疗作用。
同时,传递体还是一种优良的经皮免疫递药载体。在病毒的防治过程中,疫苗是一种经济、低毒、高效的疾病预防手段。普通的疫苗大多需要注射给药,顺应性较差,且作为一种破坏性给药的方法,安全性需要高度重视。若可将疫苗包载于传递体中用于经皮给药免疫,可显示出较大的优势:①与肌肉注射相比,药物经皮免疫可通过真皮层的淋巴管吸收直接进入淋巴循环,引起更强的抗性免疫;②经皮免疫一旦出现不良反应和毒副作用,可立即中断给药,安全性较好,可避免肝脏对药物首过效应的干扰,同时易形成储库持续作用,增强免疫效果;③传递体作为经皮免疫的载体,能通过高度变形性和皮肤水化渗透梯度的作用,使蛋白类、反义核苷酸类、核酶类及脱氧核酶类等透皮极难的生物药物的稳定性及淋巴转运效果大大提高;④相比于注射制剂,经皮给药剂型的制备工艺简单,无菌性、无抗原性要求较低,生产成本大大缩减,可使更多有效且必要的疫苗纳入医疗卫生保障系统,促进国家“健康中国”战略的发展。
总之,传递体凭借其高度的变形性和优良的生物相容性,为药物高效的透皮、透膜递送提供了颇具前景的思路、方法和尝试。传递体系统将会是透皮给药发展的新趋势,同时也应将其优良性质更多应用于其他透膜递药系统中,为解决大分子药物的屏障透过能力提出新的思路和方案。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. U20A20411)资助
Contributor Information
易 梁 (Yi LIANG), Email: m15966331615@163.com.
志荣 张 (Zhi-rong ZHANG), Email: zrzzl@vip.sina.com.
References
- 1.董王明, 江昌照, 叶金翠, 等 经皮给药制剂促透方法研究进展. 中国新药杂志. 2020;29(18):2089–2097. [Google Scholar]
- 2.徐馨. 苦参碱类生物碱传递体凝胶剂的研制及临床应用. 哈尔滨: 东北农业大学, 2018.
- 3.代旭栋, 李云, 李双双, 等 皮肤外用脂质体的研究进展. 国际药学研究杂志. 2020;47(11):914–921. [Google Scholar]
- 4.瞿叶清, 钱丽萍, 董洁, 等. 传递体处方成分的研究进展//中国药学会. 2013年中国药学大会暨第十三届中国药师周论文集. 南宁: 中国药学会, 2013: 7.
- 5.卢耀文, 杨升云, 龙晓英, 等 处方组成对槲皮素传递体透皮作用的影响. 中国医药工业杂志. 2017;48(4):523–528. [Google Scholar]
- 6.ITA K B, PREEZ J D, LANE M E, et al Dermal delivery of selected hydrophilic drugs from elastic liposomes: Effect of phospholipid formulation and surfactants. Pharm Pharmacol. 2007;59:1215–1222. doi: 10.1211/jpp.59.9.0005. [DOI] [PubMed] [Google Scholar]
- 7.吴玉, 陈军, 方芸, 等 马钱子碱传递体的体外透皮与促渗性质研究. 中国中药杂志. 2016;41(16):3009–3015. doi: 10.4268/cjcmm20161611. [DOI] [PubMed] [Google Scholar]
- 8.吴玉. 马钱子碱复合磷脂传递体的构建与评价. 南京: 南京中医药大学, 2017.
- 9.陈思思, 郑杭生, 王娟, 等 三七总皂苷传递体的制备及其治疗大鼠急性软组织损伤作用研究. 中草药. 2015;46(14):2070–2075. doi: 10.7501/j.issn.0253-2670.2015.14.009. [DOI] [Google Scholar]
- 10.陈雅娉. 传递体促进难溶性药物口服吸收的研究. 上海: 复旦大学, 2009.
- 11.杨艳. 盐酸特比萘芬传递体的研究. 广州: 广州中医药大学, 2013.
- 12.程晓丹, 李学明, 顾立 脂质体对水溶性药物包封方法的研究进展. 华西药学杂志. 2009;24(2):194–197. [Google Scholar]
- 13.蒋国强, 朱德权. 一种对水溶性药物有较高包封率的脂质体的制备方法. 中国专利: 200410096075.0, 2005-07-06.
- 14.卢坤, 洪士聪, 文秀英, 等. 大黄素传递体的制备和质量评价//中国药学会医院药学专业委员会. 全国医院药学(药物安全性)学术会议论文集. 银川: 中国医院药学杂志, 2011: 5.
- 15.陈丽萍, 吴智敏, 杨畅, 等 广藿香酮传递体包封率测定方法的筛选研究. 中南药学. 2019;17(11):1864–1868. [Google Scholar]
- 16.魏燕, 张永生, 郑杭生, 等 盐酸青藤碱传递体的制备及其对大鼠类风湿性关节炎的药效评价. 中草药. 2017;48(23):4872–4879. doi: 10.7501/j.issn.0253-2670.2017.23.009. [DOI] [Google Scholar]
- 17.YIN W, PARASKEVI G, JULIAN E, et al DPPC-cholesterol phase diagram using coarse-grained molecular dynamics simulations. BBA Biomembranes. 2016;1858(11):2846–2857. doi: 10.1016/j.bbamem.2016.08.005. [DOI] [PubMed] [Google Scholar]
- 18.CHRISTOPH A, AMIR H, DANIEL H A local instantaneous surface method for extracting membrane elastic moduli from simulation: Comparison with other strategies. J Chem Phys. 2018;514:31–43. doi: 10.1016/j.chemphys.2018.03.004. [DOI] [Google Scholar]
- 19.TSAI HHGAV I N, CHANG C M, LEE J B Multi-step formation of a hemifusion diaphragm for vesicle fusion revealed by all-atom molecular dynamics simulations. BBA Biomembranes. 2014;1838(6):1529–1535. doi: 10.1016/j.bbamem.2014.01.018. [DOI] [PubMed] [Google Scholar]
- 20.MENG F C, XU W R Drug permeability prediction using PMF method. J Mol Model. 2013;19(3):991–997. doi: 10.1007/s00894-012-1655-1. [DOI] [PubMed] [Google Scholar]
- 21.吴智敏. 基于分子动力学模拟的传递体经皮给药性能评价方法学研究. 北京: 北京中医药大学, 2019.
- 22.JOSHI A , KULKARNI R , CHAUDHARI R In-vitro andex-vivo evaluation of raloxifene hydrochloride delivery using nano-transfersome based formulations . J Drug Deliv Sci Tec. 2018;45:151–158. doi: 10.1016/j.jddst.2018.02.006. [DOI] [Google Scholar]
- 23.RAMEZANI V, HONARVAR M, SEYEDABADI M, et al Formulation and optimization of transfersome containing minoxidil and caffeine. J Drug Deliv Sci Tec. 2018;44:129–135. doi: 10.1016/j.jddst.2017.12.003. [DOI] [Google Scholar]
- 24.李玲玲. 壳聚糖修饰盐酸利多卡因柔性脂质体研究. 长沙: 中南大学, 2012.
- 25.侯琳. 载药传递体的构建及其透皮释药的研究. 青岛: 中国海洋大学, 2014.
- 26.王娟, 郑杭生, 魏燕, 等 盐酸青藤碱挥发油边缘活化PEG修饰传递体的离体皮肤渗透研究. 中草药. 2016;47(20):3602–3609. doi: 10.7501/j.issn.0253-2670.2016.20.009. [DOI] [Google Scholar]
- 27.SONG K H, CHUNG S J, SHIM C K Enhanced intestinal absorption of salmon calcitonin (sCT) from proliposomes containing bile salts. J Control Release. 2005;106(3):298–308. doi: 10.1016/j.jconrel.2005.05.016. [DOI] [PubMed] [Google Scholar]


