Abstract
目的
用标准微生物学方法测定4种幽门螺杆菌实验室常用检测方法的灵敏度并纵向比较各方法的差异性。
方法
用幽门螺杆菌标准菌株(SS1)为参照,以菌落形成单位(CFU)为测定能力定量分析单位,以不同浓度梯度稀释的SS1菌液为模拟样本,分别对幽门螺杆菌培养法、快速脲酶试验法、抗原检测法、荧光定量PCR法进行测定能力的试验研究,记录4种幽门螺杆菌常用检测方法对应的不同浓度的CFU值并进行差异性分析。
结果
幽门螺杆菌培养法检测灵敏度为2.0×10 CFU/mL,快速脲酶试验法检测灵敏度为2.0×107 CFU/mL,抗原检测法检测灵敏度为2.0×105 CFU/mL,荧光定量PCR法检测灵敏度为2.0×102 CFU/mL。
结论
幽门螺杆菌实验室不同检测方法的灵敏度差异显著。培养法和荧光定量PCR法的敏感性较高,但培养法耗时长、操作复杂;抗原检测和快速脲酶试验需要的时间短,但试验敏感性较低。临床以及实验室可根据检测目的选择能识别幽门螺杆菌对应变化的检测方法。
Keywords: 幽门螺杆菌, 检测方法, 灵敏度
Abstract
Objective
To measure with standard microbiology methods the sensitivity of 4 commonly used testing methods for Helicobacter pylori (Hp) and to conduct a comparative study of the correlations and differences across the 4 methods.
Methods
With the Hp standard strain (SS1) as the reference, colony forming units (CFU) as the units of quantitative analysis for detection performance, and gradient dilution of SS1 suspension as the simulation sample, we measured the sensitivity of 4 Hp testing methods, including bacterial culture, rapid urease test, antigen test, and quantitative fluorescent PCR. CFU values at different concentrations corresponding to the 4 commonly used Hp testing methods were documented and the correlations and differences were analyzed accordingly.
Results
The sensitivity of Hp bacterial culture, rapid urease test, antigen test and quantitative fluorescent PCR was 2.0×10 CFU/mL, 2.0×105 CFU/mL, 2.0×105 CFU/mL, and 2.0×102 CFU/mL, respectively.
Conclusion
The testing turnover time and sensitivity of different laboratory methods for Hp testing varied significantly. The quantitative fluorescent PCR and bacterial culture both showed relatively high sensitivity, but bacterial culture has complicated operation procedures and is too time-consuming. The rapid urease test and antigen test both were simple and quick to perform, but showed low sensitivity. For clinical and laboratory testing of Hp, appropriate testing method that can identify the corresponding changes of Hp should be selected according to the actual testing purpose.
Keywords: Helicobacter pylori, Testing methods, Sensitivity
自1984年澳大利亚学者WARREN和MARSHAL首次从胃炎和消化性溃疡患者的胃黏膜中分离出幽门螺杆菌(Helicobacter pylori, Hp)以来[1],国内外学者对Hp的研究不断深入,有关Hp临床检测方法的研究取得了可喜的成绩,临床上检测Hp感染主要分为侵入性检测和非侵入性检测[2]。侵入性检测为胃镜采集胃组织标本进行直接涂片染色镜检、病理组织切片检测、细菌培养、快速脲酶试验、PCR检测等;非侵入性检测包括尿素呼气实验、粪抗原检测、15N-尿氨排出实验等[3-5]。目前,临床治疗Hp感染主要采用抗生素疗法,抗生素的广泛使用及滥用引起Hp的耐药率逐年上升[6-9]。疫苗及新型抗菌药物的开发是当前Hp研究的热点,建立稳定可靠的Hp实验室检测方法对疫苗或新型药物的药效评价、Hp感染模型的监测等环节至关重要[10-11]。实验室常用于Hp的检测方法主要有涂片染色镜检、细菌培养、快速脲酶试验、抗原检测、荧光定量PCR检测等,各种方法检测性能存在较大的差异,从而影响实验结果的判定。虽然国内已有这些关于不同Hp实验室检测方法评价对比的报道[3-5],但这些报道主要是收集其他研究者的成果而进行比较,并未提供自身验证的数据,存在着全球不同实验室之间进行的不同实验无法具体量化进行对比的问题。为了能对不同实验方法的优缺点进行细致量化的对比,本研究在同一实验室内对Hp培养法、快速脲酶试验法、抗原检测法、荧光定量PCR法这4种方法进行验证,对比分析它们的灵敏度及相关性,对实验室评估Hp感染模型的定植情况、疫苗效果的评价具有一定的指导意义。
1. 材料与方法
1.1. 材料
1.1.1. 菌株
幽门螺杆菌悉尼株(Helicobacter pyloriSydneystrains, SS1)来自于河北医科大学。
1.1.2. 主要试剂及仪器
TB Green Premix Dimer EraserTM(Perfect Real Time)购自TaKaRa公司;COLUMBIA BLOOD AGAR BASE购自英国OXOID公司;Primer由北京擎科生物有限公司合成;无菌小牛血清购自明海生物有限公司;无菌脱纤维羊血购自青岛海博生物技术有限公司;幽门螺杆菌抗原检测试剂盒(胶体金法)购自珠海银科医学公司;快速脲酶检测试剂由实验室自配,其配方为:尿素10 g、酚红0.2 g、NaH2PO4 0.21 g、Na2HPO4 0.51 g,加去离子水至500 mL,过滤除菌。荧光定量PCR仪(qTOWER3)购自德国耶拿分析仪器股份公司;酶标仪(DNM-9602)购自北京普朗新技术有限公司。
1.2. 幽门螺杆菌培养检测
在超净工作台内,将Hp冻存液接种于哥伦比亚血平板培养基,在微需氧(5% O2、10% CO2、85% N2)37 ℃条件下培养72 h,用生理盐水洗脱细菌,然后按10倍浓度梯度稀释,取100 μL各浓度梯度的菌液分别均匀涂布于哥伦比亚血平板培养基上,按上述条件培养48 h后观察结果并计数,确定Hp培养检测的敏感度,以能正确检出阳性结果的Hp菌液最低浓度作为该方法的灵敏度。同时涂片革兰染色镜检,观察Hp的形态。
1.3. 幽门螺杆菌快速脲酶试验
取10倍浓度梯度菌液各10 μL,分别加入100 μL实验室自配的快速脲酶试剂中,室温条件下避光孵育30 min后观察脲酶试剂显色情况,检测孔内出现玫瑰红色即为阳性,仍为黄色者为阴性,同时在578 nm波长处测定各检测孔的光密度(optical density, OD)值,确定Hp快速脲酶试验的敏感度,以能正确检出阳性结果的Hp菌液最低浓度作为该方法的灵敏度。
1.4. 幽门螺杆菌抗原检测
取10倍浓度梯度菌液各50 μL,分别加入幽门螺杆菌抗原检测卡的加样孔内,室温静置15 min后读取结果,确定Hp抗原检测的敏感度。质控区(C)和检测区(T)同时出现红色条带,则检测结果为阳性;仅质控区(C)出现红色条带,则检测结果为阴性;若质控区(C)未出现红色条带,则为无效检测,需另取样本重新检测。以能正确检出阳性结果的Hp菌液最低浓度作为该方法的灵敏度。
1.5. 幽门螺杆菌荧光定量PCR检测
荧光定量PCR扩增引物选用Hp特异性16S rRNA片段进行扩增[12],扩增程序为:预变性95 ℃,30 s;循环反应95 ℃,5 s,60 ℃,30 s,共40个循环。将上述各浓度梯度的菌液1 mL,煮沸裂解后作为模板用于荧光定量PCR扩增,确定Hp荧光定量PCR检测方法的敏感度,以能正确检出阳性结果的Hp菌液最低浓度作为该方法的灵敏度。
2. 结果
2.1. 幽门螺杆菌培养检测敏感性
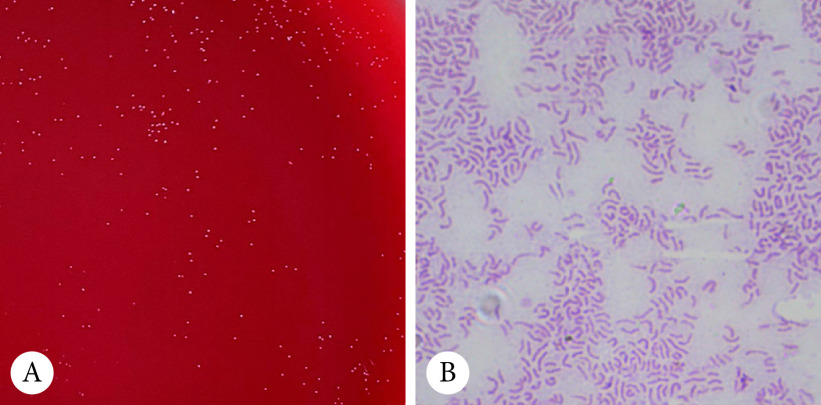
Hp培养48 h在哥伦比亚血平板培养基上的菌落形态呈半透明针尖状(图1A),涂片镜检可见典型的S形、弯曲状或海鸥状的革兰染色阴性细菌(图1B)。对每个浓度梯度菌液的培养结果进行菌落计数,计数结果见表1。
图 1.
Hp culture and Gram staining
Hp培养结果
A: Colony morphology of Hp cultured for 48 h; B: Gram staining morphology of Hp (×1000 oil lens).
表 1. Bacterial colony count of Hp culture.
Hp培养菌落计数结果
| Log dilution | Plate count 1 | Plate count 2 | Plate count 3 |

|
| 0 | Countless | Countless | Countless | / |
| 1 | Countless | Countless | Countless | / |
| 2 | Countless | Countless | Countless | / |
| 3 | Countless | Countless | Countless | / |
| 4 | Countless | Countless | Countless | / |
| 5 | Countless | Countless | Countless | / |
| 6 | 175 | 207 | 187 | 190±16 |
| 7 | 78 | 69 | 83 | 77±7 |
| 8 | 15 | 9 | 12 | 12±3 |
| 9 | 0 | 0 | 0 | 0 |
| 10 | 0 | 0 | 0 | 0 |
根据Hp菌落计数结果,推算出原液菌落个数为2.0×109 CFU/mL。Hp菌落数为2.0×109 CFU/mL的菌液稀释1.0×109倍后,培养不到阳性克隆,提示Hp培养法可以检测到菌落数为2.0×10 CFU/mL的菌液样本。
2.2. 幽门螺杆菌快速脲酶试验敏感性
快速脲酶试验结果见表2。结果显示,Hp菌落数为2.0×109 CFU/mL的菌液稀释1.0×103倍后快速脲酶试验检测不到阳性结果,提示当Hp菌落数低于2.0×107 CFU/mL后快速脲酶试验将不再敏感。
表 2. OD value of rapid urease test of Hp.
Hp快速脲酶试验OD值结果
| Log dilution | Test 1 | Test 2 | Test 3 |
|
| 0 | 2.136 | 2.103 | 2.121 | 2.120±0.017 |
| 1 | 1.045 | 1.296 | 1.006 | 1.116±0.157 |
| 2 | 0.028 | 0.044 | 0.090 | 0.054±0.032 |
| 3 | 0.000 | 0.000 | 0.000 | 0.000 |
| 4 | 0.000 | 0.000 | 0.000 | 0.000 |
| 5 | 0.000 | 0.000 | 0.000 | 0.000 |
| 6 | 0.000 | 0.000 | 0.000 | 0.000 |
| 7 | 0.000 | 0.000 | 0.000 | 0.000 |
| 8 | 0.000 | 0.000 | 0.000 | 0.000 |
| 9 | 0.000 | 0.000 | 0.000 | 0.000 |
| 10 | 0.000 | 0.000 | 0.000 | 0.000 |
2.3. 幽门螺杆菌抗原检测敏感性
不同浓度梯度的菌液抗原检测结果见表3。Hp菌落数为2.0×109 CFU/mL的菌液稀释1.0×105倍后检测不到阳性结果,提示Hp抗原法可检测到2.0×105 CFU/mL的菌液样本。
表 3. Antigen test results of Hp.
Hp抗原检测结果
| Log dilution | Test 1 | Test 2 | Test 3 |
| *Positive result; #Weak positive result; △Negative result. | |||
| 0 | +* | + | + |
| 1 | + | + | + |
| 2 | + | + | + |
| 3 | + | + | + |
| 4 | ±# | ± | ± |
| 5 | −△ | − | − |
| 6 | − | − | − |
| 7 | − | − | − |
| 8 | − | − | − |
| 9 | − | − | − |
| 10 | − | − | − |
2.4. 荧光定量PCR检测敏感性
对不同浓度梯度的菌液进行荧光定量PCR检测的结果见图2。结果显示, Hp菌落数为2.0×109 CFU/mL的菌液稀释1.0×108倍后检测不到Ct值及扩增曲线,提示Hp荧光定量PCR法可检测到2.0×102 CFU/mL的菌液样本。
图 2.
Sensitivity of quantitative fluorescent PCR assay of Hp
Hp荧光定量PCR法检测的敏感性结果
1-10: 2.0×109 CFU/mL, 2.0×108 CFU/mL, 2.0×107 CFU/mL, 2.0×106 CFU/mL, 2.0×105 CFU/mL, 2.0×104 CFU/mL, 2.0×103 CFU/mL, 2.0×102 CFU/mL, 2.0×10 CFU/mL, 2.0×100 CFU/mL; 11: Negative control.
3. 讨论
Hp具有广泛致病性,持续感染除引起胃炎、胃溃疡、胃癌[13],还可导致心血管疾病[14]、特发性血小板紫癜[15]、结肠癌[16]、神经系统性疾病[17]等。世界上超过一半的人口长期被Hp感染[18],我国人群中Hp感染率高达56.22%,并以每年1%~2%的速度增加[19]。近年来,Hp的疫苗及新型抗菌药物的开发是Hp研究的热点内容,准确定量检测对于科研实验室建立Hp感染模型、评价疫苗的效果等具有重要意义[20]。
临床上采集胃组织活检标本进行细菌分离培养,可对分离得到的细菌进行药敏试验、基因测序分型等分析。Hp是一种微需氧菌,对营养要求高,培养法的成功率较低,推荐在哥伦比亚培养基、脑心浸液肉汤、布鲁斯培养基中加入全血或血清,从而最大限度的提高Hp培养法的敏感性[21]。本研究采用Hp菌液验证培养法的敏感性,菌落数为2.0×10 CFU/mL的菌液仍能培养到阳性克隆,与陈敬等[22]发表的结果一致,即将相同浓度的Hp菌液加入胃组织后进行培养的方法敏感性低于Hp菌液,这可能是由于胃组织中的正常菌群对培养基的污染,抑制了Hp的生长[23-24]。因此有研究推荐在选择性培养基中使用万古霉素(10 mg/L)、两性霉素B(10 mg/L)、头孢磺啶或甲氧苄啶(5 mg/L)等抗生素补充剂,提高Hp的培养率[25]。此外,Hp病灶分布不均,取样位置也影响Hp的分离率,研究发现取胃窦和胃底部黏膜进行培养Hp的分离率最高[26]。培养法是Hp感染诊断的金标准,但培养耗时长、要求高、难度大、成功率低,临床较少开展,主要用于科研。
Hp能产生丰富的尿素酶,其产量占整个细菌的6%,尿素酶能分解尿素产生NH3使反应体系的pH值升高,体系中的酸碱指示剂变色则提示尿素酶阳性[27]。快速脲酶试验操作简便、检测快速,临床常在内镜活检时取胃组织进行快速脲酶试验辅助诊断Hp,快速脲酶试验也是实验室评价Hp动物感染模型最常用的方法之一。但该方法需要高密度的细菌,研究发现胃组织中细菌的量低于104 CFU/g时检测结果为阴性[28],而本研究采用Hp菌液进行验证发现菌液中Hp数量低于2.0×107 CFU/mL时检测结果为阴性。近期使用抗生素、铋剂、质子泵抑制剂等药物治疗后其敏感性均会降低[29]。还有研究发现,5岁以下的儿童使用快速脲酶试验检测可能会出现假阴性结果[30]。此外,胃肠道感染细菌如空肠螺杆菌、变性杆菌等都能产生尿素酶分解尿素,造成假阳性的结果[31]。因此,快速脲酶试验不单独用于Hp根除效果的评价。
Hp主要定植于胃黏膜上皮细胞,Hp的代谢产物、菌体等随着胃黏膜的更新脱落到消化道内,进而随粪便一同排除,因此能够在粪便中检测到Hp的存在。研究证明,Hp粪抗原检测具有较好的敏感性和特异性[32]。KAKIUCHI等[33]采用Hp标准株(ATCC 43504)对抗原检测试剂盒Quick Chaser® H. pylori进行敏感性测试,菌液浓度低于6.25×105 CFU/mL后将不再敏感。本研究采用SS1标准株菌液对抗原检测试剂盒进行验证,结果发现菌液中Hp数量低于2.0×105 CFU/mL时检测不到阳性结果。提示当样本中抗原浓度较低时易出现假阴性的结果。Hp粪抗原检测具有快速、简便、标本易采集等优点,可用于评估Hp感染的根除情况,是近年来临床上逐步开展的检测项目之一。
荧光定量PCR检测技术发展迅速,具有高灵敏度和高特异度的优点,被广泛用于病原微生物感染的诊断,该技术可根据荧光信号的强度实现对特异性产物的鉴别和定量[34]。近年来,较多研究建立了Hp的荧光定量PCR检测方法,均具有较好的敏感性,本研究建立的荧光定量PCR的敏感性为2.0×102 CFU/mL,与多数研究的结果相当。荧光定量PCR法检测方便、快速,可用于胃黏膜、唾液、胃液、粪便、牙菌斑等多种标本中的Hp。此外,该技术还可用于监测抗生素耐药相关基因的突变情况[35]。荧光定量PCR法可实现对Hp基因组的定量检测,为临床评估Hp根除的疗效、实验室评估感染模型的感染情况、疫苗的保护效果等提供依据。
对比各检测方法对Hp菌液的敏感性,其中培养法和荧光定量PCR法的敏感性较高,分别达到2.0×10 CFU/mL和2.0×102 CFU/mL;抗原检测和快速脲酶试验敏感性较低,当样本中菌落数分别低于2.0×105 CFU/mL和2.0×107 CFU/mL时就不再敏感。Hp培养法检测操作复杂、培养难度大,成功率低,耗时长,往往需要72 h才能获得阳性克隆。快速脲酶试验操作简便、快捷,在30 min内肉眼即可观察得到结果,但此法灵敏度最低,受感染细菌数量变化的影响较大。抗原检测法15 min内即可获得检测结果,该法可直接检测粪便标本中的Hp,标本容易获得,适用于Hp感染患者的连续检测。荧光定量PCR法检测灵敏度较高,1 h内即可获得检测结果,且适用于检测各种标本类型中的Hp,具有较好的应用前景。
综上所述,Hp不同检测方法的灵敏度差异较大,各检测方法受各种因素影响,从而影响对Hp感染状况的判断。在实际应用过程中应采用多种检测方法综合监测Hp的感染情况,建立一套可靠的Hp实验室检测方法,为Hp疫苗开发、新药研究的动物模型评估提供基础。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家重点研发项目(No. 2019YFF0216501-2)、四川省科技厅项目(No. 2021YFS0054)和西藏农牧学院柔性引进人才项目(No. RXYJ1905)资助
Contributor Information
人捷 刘 (Ren-jie LIU), Email: 652904414@qq.com.
保宁 王 (Bao-ning WANG), Email: 345182273@qq.com.
References
- 1.MARSHALL B J, WARREN J R Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984;1(8390):1311–1315. doi: 10.1016/s0140-6736(84)91816-6. [DOI] [PubMed] [Google Scholar]
- 2.WANG Y K, KUO F C, LIU C J, et al Diagnosis of Helicobacter pylori infection: Current options and developments . World J Gastroenterol. 2015;21(40):11221–11235. doi: 10.3748/wjg.v21.i40.11221. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.方汝花, 周倩 幽门螺杆菌感染的常见临床实验室检测. 医学信息(上旬刊). 2011;24(7):4631. [Google Scholar]
- 4.周洪 幽门螺杆菌实验检测技术的研究进展. 中国医药指南. 2012;10(22):103–105. doi: 10.3969/j.issn.1671-8194.2012.22.063. [DOI] [Google Scholar]
- 5.廖远泉, 王玲玲, 郭喜, 等 幽门螺杆菌生物学特征及其感染的实验室检测. 中华临床实验室管理电子杂志. 2020;8(2):71–77. doi: 10.3877/cma.j.issn.2095-5820.2020.02.002. [DOI] [Google Scholar]
- 6.毛家琪, 庄丽维 幽门螺杆菌感染的诊疗进展. 医学综述. 2020;26(21):4253–4257. doi: 10.3969/j.issn.1006-2084.2020.21.018. [DOI] [Google Scholar]
- 7.THUNG I, ARAMIN H, VAVINSKAYA V, et al Review article: the global emergence of Helicobacter pylori antibiotic resistance . Aliment Pharmacol Ther. 2016;43(4):514–533. doi: 10.1111/apt.13497. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.HE X J, ZENG X P, JIANG C S, et al Efficacy and safety of antofloxacin-based triple therapy for Helicobacter pylori eradication failure in China . Dig Dis Sci. 2022;67(1):208–215. doi: 10.1007/s10620-021-06856-z. [DOI] [PubMed] [Google Scholar]
- 9.韩一凡, 于新娟, 王莉莉, 等 中国幽门螺杆菌耐药情况研究. 胃肠病学和肝病学杂志. 2017;26(6):664–669. doi: 10.3969/j.issn.1006-5709.2017.06.011. [DOI] [Google Scholar]
- 10.SCHMIDT S T, PEDERSEN G K, CHRISTENSEN D Rational design and in vivo characterization of vaccine adjuvants . ILAR J. 2018;59(3):309–322. doi: 10.1093/ilar/ily018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.王保宁, 潘兴, 黄筱钧, 等 重组幽门螺杆菌多表位疫苗工程菌株的构建及其微生物学特性研究. 四川大学学报(医学版) 2015;46(3):354–358. [Google Scholar]
- 12.ROUSSEL Y, WILKS M, HARRIS A, et al Evaluation of DNA extraction methods from mouse stomachs for the quantification of H. pylori by real-time PCR . J Microbiol Methods. 2005;62(1):71–81. doi: 10.1016/j.mimet.2005.01.011. [DOI] [PubMed] [Google Scholar]
- 13.周成林, 杨洋, 董苏荣, 等 幽门螺杆菌的耐药机制及基因检测研究进展. 中华检验医学杂志. 2020;43(12):1243–1247. doi: 10.3760/cma.j.cn114452-20200106-00010. [DOI] [Google Scholar]
- 14.SHAN J, BAI X, HAN L, et al Association between atherosclerosis and gastric biomarkers concerning Helicobacter pylori infection in a Chinese healthy population . Exp Gerontol. 2018;112:97–102. doi: 10.1016/j.exger.2018.09.009. [DOI] [PubMed] [Google Scholar]
- 15.KIM B J, KIM H S, JANG H J, et al. Helicobacter pylori eradication in idiopathic thrombocytopenic purpura: A meta-analysis of randomized trials. Gastroenterol Res Pract, 2018, 2018: 6090878[2021-06-21]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6198559/. doi: 10.1155/2018/6090878.
- 16.YANG F, XU Y L, ZHU R F Helicobacter pylori infection and the risk of colorectal carcinoma: A systematic review and meta-analysis . Minerva Med. 2019;110(5):464–470. doi: 10.23736/S0026-4806.19.05942-1. [DOI] [PubMed] [Google Scholar]
- 17.WANG B N, ZHANG J, CHEN S H, et al. Helicobacter pylori and gastrointestinal and neurological diseases: Study protocol of an umbrella review of systematic reviews and meta-analyses. Medicine (Baltimore), 2019, 98(52): e18460[2021-06-21]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6946528/. doi: 10.1097/MD.0000000000018460.
- 18.QARIA M A, QUMAR S, SEPE L P, et al. Cholesterol glucosylation-based survival strategy in Helicobacter pylori. Helicobacter, 2021, 26(2): e12777[2021-06-21]. https://onlinelibrary.wiley.com/doi/10.1111/hel.12777. doi: 10.1111/hel.12777.
- 19.张万岱, 胡伏莲, 萧树东, 等 中国自然人群幽门螺杆菌感染的流行病学调查. 现代消化及介入诊疗. 2010;15(5):265–270. doi: 10.3969/j.issn.1672-2159.2010.05.001. [DOI] [Google Scholar]
- 20.SHI Y, LIU X F, ZHUANG Y, et al Helicobacter pylori-induced Th17 responses modulate Th1 cell responses, benefit bacterial growth, and contribute to pathology in mice . J Immunol. 2010;184(9):5121–5129. doi: 10.4049/jimmunol.0901115. [DOI] [PubMed] [Google Scholar]
- 21.HAZELL S L, MARKESICH D C, EVANS D J, et al Influence of media supplements on growth and survival of Campylobacter pylori . Eur J Clin Microbiol Infect Dis. 1989;8(7):597–602. doi: 10.1007/BF01968136. [DOI] [PubMed] [Google Scholar]
- 22.陈敬, 刘钰, 汤重发, 等 小鼠胃组织中幽门螺杆菌SYBR GreenⅡ实时定量PCR检测方法的建立及验证. 中国生物制品学杂志. 2016;29(12):1308–1315. [Google Scholar]
- 23.MIENDJE V Y, VAN B C, FONTAINE V Comparative evaluation of 3 selective media for primary isolation of Helicobacter pylori from gastric biopsies under routine conditions . Diagn Microbiol Infect Dis. 2010;68(4):474–476. doi: 10.1016/j.diagmicrobio.2010.08.009. [DOI] [PubMed] [Google Scholar]
- 24.PERETZ A, ON A, KOIFMAN A, et al An efficiency comparison between three invasive methods for the diagnosis of Helicobacter pylori infections: Culture from stomach biopsy, rapid urease test (CUTest®), and histologic examination of gastric biopsy . Ann Clin Lab Sci. 2015;45(2):148–151. [PubMed] [Google Scholar]
- 25.PATEL S K, PRATAP C B, JAIN A K, et al Diagnosis of Helicobacter pylori: What should be the gold standard? . World J Gastroenterol. 2014;20(36):12847–12859. doi: 10.3748/wjg.v20.i36.12847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.LANGNER M, MACHADO R S, PATRICIO F R, et al Evaluation of gastric histology in children and adolescents with Helicobacter pylori gastritis using the Update Sydney System . Arq Gastroenterol. 2009;46(4):328–332. doi: 10.1590/S0004-28032009000400015. [DOI] [PubMed] [Google Scholar]
- 27.Campylobacter-like organisms in the stomach of patients and healthy individuals. Lancet, 1984, 1(8390): 1348-1349.
- 28.BRANDI G, BIAVATI B, CALABRESE C, et al Urease-positive bacteria other than Helicobacter pylori in human gastric juice and mucosa . Am J Gastroenterol. 2006;101(8):1756–1761. doi: 10.1111/j.1572-0241.2006.00698.x. [DOI] [PubMed] [Google Scholar]
- 29.NISHIKAWA K, SUGIYAMA T, KATO M, et al A prospective evaluation of new rapid urease tests before and after eradication treatment of Helicobacter pylori, in comparison with histology, culture and 13C-urea breath test . Gastrointest Endosc. 2000;51(2):164–168. doi: 10.1016/S0016-5107(00)70412-3. [DOI] [PubMed] [Google Scholar]
- 30.SEO J H, PARK J S, RHEE K H, et al Limitations of urease test in diagnosis of pediatric Helicobacter pylori infection . World J Clin Pediatr. 2015;4(4):143–147. doi: 10.5409/wjcp.v4.i4.143. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.GODBOLE G, MEGRAUD F, BESSEDE E. Review: Diagnosis of Helicobacter pylori infection. Helicobacter, 2020, 25 (Suppl 1): e12735[2021-06-21]. https://onlinelibrary.wiley.com/doi/10.1111/hel.12735. doi: 10.1111/hel.12735.
- 32.VAIRA D, MALFERTHEINER P, MEGRAUD F, et al Diagnosis of Helicobacter pylori infection with a new non-invasive antigen-based assay. HpSA European study group . Lancet. 1999;354(9172):30–33. doi: 10.1016/S0140-6736(98)08103-3. [DOI] [PubMed] [Google Scholar]
- 33.KAKIUCHI T, OKUDA M, HASHIGUCHI K, et al. Evaluation of a novel stool antigen rapid test kit for detection of Helicobacter pylori infection. J Clin Microbiol, 2019, 57(3): e01825-18[2021-06-21]. https://doi.org/10.1128/JCM.01825-18.
- 34.KAZEMI E, KAHRIZI D, MORADI M T, et al Association between Helicobacter pylori hopQI genotypes and human gastric cancer risk . Cell Mol Biol (Noisy-le-grand) 2016;62(1):6–9. [PubMed] [Google Scholar]
- 35.HSIEH M S, LIU C J, HSU W H, et al. Gastric juice-based PCR assay: An alternative testing method to aid in the management of previously treated Helicobacter pylori infection. Helicobacter, 2019, 24(2): e12568[2021-06-21]. https://onlinelibrary.wiley.com/doi/full/10.1111/hel.12568. doi: 10.1111/hel.12568.