Abstract
血浆D-二聚体是纤维蛋白被纤溶酶降解时产生的特殊交联纤维蛋白衍生物,D-二聚体在妊娠期随孕周增加而增加,传统用于筛查正常人群静脉血栓形成的血浆D-二聚体参考值(≤0.5 mg/L)不适用于妊娠人群。因D-二聚体检测方法及计量单位不统一,目前尚无统一妊娠及产褥期D-二聚体正常参考值,各个地域或实验室,应通过大样本不同孕期血液样本凝血功能检测,建立自己的妊娠期不同孕周的D-二聚体参考值。现有越来越多研究探讨D-二聚体与妊娠静脉血栓栓塞(venous thromboembolism, VTE)、妊娠期高血压疾病(gestational hypertensive disorders, GHD)、妊娠结局间的关联。本文就D-二聚体产生与测量、正常妊娠期D-二聚体参考值、D-二聚体与部分病理妊娠关联进行综述,加深临床医生对妊娠期D-二聚体的认识。
Keywords: D-二聚体, 妊娠, 静脉血栓栓塞, 妊娠期高血压疾病, 抗磷脂抗体综合征(APS)
Abstract
Plasma D-dimer, a special cross-linked fibrin derivative, is produced when fibrin is degraded by plasminase. During pregnancy, D-dimer increases along with the increase of gestational age, and the reference value of plasma D-dimer (≤0.5 mg/L) traditionally used for the screening of venous thrombosis in the normal population is not applicable to the pregnant population. Due to the lack of uniform D-dimer detection methods or measurement units, there is currently no unified D-dimer reference values for pregnancy or puerperium. Each region or laboratory should establish its own pregnancy D-dimer reference value for different gestational weeks through blood coagulation function testing of large numbers of samples of different gestational periods. More and more studies have been conducted to investigate the association between D-dimer and venous thromboembolism (VTE) during pregnancy, gestational hypertensive disorders (GHD) and pregnancy outcome. We reviewed, herein, the generation and measurement of D-dimer, the reference values of D-dimer during normal pregnancy, and the association between D-dimer and some pathological pregnancies, intending to help clinicians develop a more thorough understanding of D-dimer during pregnancy.
Keywords: D-dimer, Pregnancy, Venous thromboembolism, Gestational hypertensive disorders, Antiphospholipid antibody syndrome (APS)
D-二聚体是凝血系统激活和纤维蛋白溶解的特异性指标,凝血酶裂解纤维蛋白原形成纤维蛋白单体,在活化的凝血因子ⅩⅢ及Ga2+作用下可溶性纤维蛋白单体相互聚合形成不溶于水的交联纤维蛋白多聚体凝块,纤溶酶降解交联的纤维蛋白,释放纤维蛋白降解产物。D-二聚体是血液中发现的最小的纤溶特异性降解产物,它只能在凝血酶形成和随后的交联纤维蛋白降解后产生,它的存在提示体内高凝状态和继发性纤溶亢进[1]。妊娠是一种特殊的生理平衡状态,为了适应妊娠和分娩,凝血和纤溶活性增强并维持在较高水平,促凝因子增加,血液系统呈高凝状态。随着大家对静脉栓塞性疾病的关注,尤其是近年来产科抗磷脂综合征相关的脐带血栓导致的胎儿宫内死亡增多[2],许多产科医生对D-二聚体的关注度越来越高,但是D-二聚体升高在孕期的指导意义并不确切,这给医生和孕妇都带来了困扰和担心。因此,我们对D-二聚体在孕期的参考值及临床意义进行综述,期望通过综述大家能对D-二聚体有更加理性及正确的认识,重视其在产科中临床价值,各个地域或实验室通过自身大样本血液凝血功能检测建立不同孕周的参考值。
1. D-二聚体产生机制与测量的问题
交联纤维蛋白在纤溶降解过程中产生D-二聚体,只有在先前已经形成交联纤维蛋白并且纤溶酶已经切割了该分子的情况下,D-二聚体才能存在于血浆中。D-二聚体的产生需要三种酶:凝血酶、激活的凝血因子ⅩⅢ和纤溶酶[1]。纤维蛋白原是由三对多肽链(Aα, Bß, γ)形成的分子量约340 kDa的对称性聚合体。连接两半分子的氨基末端形成纤维蛋白原的中心球状部分为E结构域;而羧基端则形成了分子的两个远端D结构域[3]。凝血酶作用于E结构域裂解纤维蛋白原产生纤维蛋白单体(纤维蛋白原单体A和B),纤维蛋白单体分子间通过D结构域和D-E结构域的非共价力结合在一起。活化的凝血因子ⅩⅢ共价连接D结构域,将可溶性纤维蛋白单体相互聚合形成不溶于水的交联纤维蛋白多聚体凝块。纤溶酶降解交联的纤维蛋白,释放纤维蛋白降解产物(fibrin degradation product, FDPs),从而暴露D-二聚体抗原表位[1]。识别FDPs中D-D结构域的单克隆抗体是检测D-二聚体的关键。最初的降解产物是高分子量的复合物,然后进一步降解,产生末端D-二聚体-E复合物。从血管内血栓形成开始,D-二聚体将在2 h内被检测到,半衰期约8 h[3]。
目前全世界大约有二十多种不同的定量分析方法在临床上使用[4],常见检测方法有以下几种:自身红细胞凝集法(whole-bloodagglutination assays),它利用针对D-二聚体表位和红细胞表位的双特异性抗体进行检测,D-二聚体水平升高时,抗原抗体结合的增多而导致红细胞凝集。乳胶凝集法(latex agglutination assays),该方法将获得的单抗包被于乳胶颗粒上,当血中D-二聚体与乳胶颗粒发生抗原抗体反应时,致敏的乳胶颗粒发生絮状沉淀反应进行定性或半定量测定。乳胶免疫比浊测定法(latex immunotrurbidimetry),即在乳胶凝集法的基础上,利用自动凝血分析仪通过检测透射光强度的变化计算样本D-二聚体含量。酶联免疫吸附法 (enzyme-linked immunosorbent assays, ELISA)和酶联荧光分析法 (enzyme-linked immunofluorescentassays, ELFA)均为双抗体夹心定量检测。免疫金标法(immune colloidal gold),是将单克隆抗体吸附在多孔薄膜并黏放在有多层吸收垫的塑料盘上,被检标本加入后即与该抗体相结合,然后加入胶体金标记的抗体在薄膜上产生红色斑点,斑点与抗原呈比例。表1[3-5]列举了以上D-二聚体检测方法优缺点。针对不同片段制备的单克隆抗体对同一份血浆中不同片段的结合能力不同,目前尚无国际统一标准的单抗,也无统一的参考方法。不同的测试方法使用两种不同类型的单位来定量分析:一种为纤维蛋白原当量单位(fibrinogen equivalent units, FEU),它将D-二聚体的质量与纤维蛋白原的质量联系起来,相对分子质量为340×103。另一种为D-二聚体单位(D-dimer units, DDU),它仅与D-二聚体本身的质量有关,相对分子质量为195×103。不同的化验结果会产生1.75倍的差异,故D-二聚体所涉及的单位类型对于设定阈值和解释D-二聚体分析结果非常重要。除了这两种类型的单位,D-二聚体实验报告的量级单位也有多种形式。如1000 ng DDU/mL,可表示为1.0 mg DDU/L,1000 μg DDU/L,或1.0 μg DDU/mL;1750 ng FEU/mL,可表示为1.75 mg FEU/L,1750 μg FEU/L,或1.75 μg FEU/mL,通常建议直接采用制造商的单位,不建议进行形式和量纲的转换。
表 1. The strengths and weaknesses of the main D-dimer examination methods available.
| Detection method | Advantages | Disadvantages |
| Whole-blood agglutination assays | Rapid test; point-of-care-testing; sample type: whole blood | Low specificity; manual |
| Latex agglutination assays | Rapid test; Automated | Intermediate specificity |
| Latex immunotrurbidimetry | High sensitivity; good repeatability; batch test; automated | Intermediate specificity |
| Enzyme-linked immunosorbent assays (ELISA) | High sensitivity | Low specificit (50%); time-consuming; manual |
| Enzyme-linked immunofluorescent assays (ELFA) | High sensitivity; automated | Low-intermediate; high Specificity (70%) |
| Immune colloidal gold | Easy to perform; suitable for emergency treatment | Low specificity |
2. 妊娠期D-二聚体带来的困惑
2.1. 缺乏正常妊娠期D-二聚体参考值
目前没有统一的测量D-二聚体的方法,也尚未建立妊娠各期单一的D-二聚体的正常参考值,这是困扰临床决策的主要原因。妊娠期血液高凝状态是妊娠对围产期出血所作的准备,此时D-二聚体正常生理改变趋势及正常参考值显得尤为重要。MORSE[6]纳入同一组孕妇进行妊娠期D-二聚体水平的研究,以当时实验室D-二聚体正常水平<280 ng/mL做参考,研究证实了D-二聚体随着妊娠进展而显著升高,建立了妊娠期D-二聚体正常参考值:孕16周前D-二聚体<280 ng/mL,孕16~26周D-二聚体<465 ng/mL,孕27~34周D-二聚体<640 ng/mL。EPINEY等[7]研究了150名无并发症单胎孕妇产时到产后45 d的D-二聚体水平 (产后即刻,产后第1、3、10、30、45天):产时D-二聚体显著升高,若以500 ng/mL为临界值,无论什么分娩方式,产时、产后第1天和第3天均高于临界值,产后第1天和产后第3天D-二聚体水平较产前急剧下降(大约在第0天和第1天之间下降2倍,在第1天和第3天之间又下降2倍)。如在阴道分娩组 D-二聚体产时为3989 ng/mL,产后第1天为2262 ng/mL,产后第3天为1262 ng/mL。产后第30天、第45天,阴道分娩组79%、93%的妇女以及剖腹产组70%、83%的妇女的水平低于500 ng/mL。若以500 ng/mL为临界值,在分娩4周后D-二聚体测量再次有助于排除静脉血栓栓塞。随后多个研究报告了健康孕妇正常的D-二聚体质量浓度范围(表2[8-19])。
表 2. Study on mass concentration range of D- dimer during pregnancy.
妊娠期D-二聚体质量浓度范围的研究
| Research | Testing instrument | Measurement unit | Descriptive index | D-dimer mass concentration range | |||
| Non-pregnant
control group |
First trimester | Second trimester | Last trimester | ||||
| KHALAFALLAH A A,
et al. 2012[8] (Australia), n=632 |
Sysmex®CA 1500 analyser | mg/L |
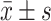
|
0.35±0.22 | 0.53±0.38 | 1.01±0.65 | 1.95±1.30 |
| GONG J M, et al. 2016[9](China),
n=11601 |
STA-Revolution coagulation analyzer | mg/L | Mean (95% CI) | 0.26
(0-0.56) |
0.61
(0-1.67) |
1.11
(0-2.81) |
3.36
(0-27.08) |
| WANG M, et al. 2013[10](China),
n=1423 |
STA-Revolution coagulation analyzer | mg/L | P95 | 0.56 | 0.66 | 2.29 | 3.12 |
| HEDENGRAN K K, et al. 2016[11](Denmark), n=714 | STA-Revolution coagulation analyzer | mg/L | P2.5-P97.5 | / | 0.2-0.9 | 0.2-1.5 | 0.4-2.8 |
| JIN Y, et al. 2018[12] (China), n=565 |
VIDAS® (BioMerieux, Lyon, France) | mg/L | Median
(P2.5-P97.5) |
/ | 0.93
(0.15-2.40) |
/ | 2.06
(0.60-5.90) |
| KAWAGUCHI S, et al. 2013[13] (Japan), n=1185 |
Mitsubishi Kagaku Iatron Inc., Tokyo, Japan) | μg/mL | Median (P95) | / | 0.54 (2.41) | 1.22 (5.03) | 2.13 (5.85) |
| CUI C, et al. 2017[14] (China), n=744 |
Automated coagulation analyzerACL TOP | μg/mL | Median
(P2.5-P97.5) |
0.08
(0.02-0.23) |
0.10
(0.01-0.31) |
0.24
(0.05-0.73) |
0.50
(0.14-2.82) |
| WANG W, et al. 2021[15] (China), n=760 |
ExC810 fully auto coagulation analyzer | μg/mL | P2.5-P97.5 | / | 0.03–1.15 | 0.08–2.13 | 0.15–3.60 |
| MURPHY N, et al. 2014[16](England), n=760 | Sysmex CA-7000 | ng/mL | Median (P5-P95) | / | 137
(54-456) |
397
(195-838) |
599
(299-1 305) |
| MOHMAD SALLIH N,
et al. 2019[17](Malaysian), n=123 |
HaemosILD-dimer HS500 | ng/mL | Median (P95) | 265 (<799) | 481
(<1070) |
1073
(357-1748) |
1533
(771-2410) |
| SIENNICK A A, et al. 2020[18](Poland), n=71 | VIDAS analyzer | ng/mL | Median (P2.5-P97.5) | / | 355
(167-721) |
597
(298-1653) |
928
(483-2256) |
| GUTIERREZ G I, 2018[19] (Spain), n=102 |
ACL-TOP 300 automated | μg/L | Median (P2.5-P97.5) | / | 405
(169-1202) |
786
(393-3258) |
1 244
(551-3333) |
表2显示,目前为止,妊娠期D-二聚体质量浓度并没有统一的参考值,上述各项研究的结果并不统一。这可能是源于研究人群不统一,研究设计方案不同,实验分析仪器及分析方法不同、实验标准与计量单位不同。所以不同实验室结果之间无法直接比较,我们也无法直接参考及使用上述研究中的结论。但从列表中可以看出D-二聚体质量浓度在妊娠期改变的总体趋势,即D-二聚体随孕周增加而升高,孕晚期较孕早期及孕中期升高显著,且孕中晚期大部分孕妇D-二聚体质量浓度大于非妊娠期的常规参考值。妊娠期间D-二聚体质量浓度的改变趋势也更支持一点:即不能使用非妊娠期参考值来定义妊娠期D-二聚体是否正常。那对于参考值我们如何选取?或许我们需要“因地制宜”,各个地域或实验室应该通过大样本健康妊娠孕产妇进行血液凝血功能检测,根据不同孕周的限定,建立特有的孕周相关的D-二聚体参考值。
2.2. D-二聚体与妊娠静脉血栓栓塞(venous thromboembolism, VTE)
VTE包括肺栓塞(pulmonary embolism, PE)及深静脉血栓栓塞(deepvein thrombosis, DVT)。BOUNAMEAUX等[20]首次提出D-二聚体在PE治疗中的潜在作用,研究人员发现在PE患者中D-二聚体检测对确认诊断价值不大,但设定一个临界值如500 μg/L,极少数PE患者的D-二聚体质量浓度低于此值,故D-二聚体具有很高的阴性预测价值。非妊娠妇女D-二聚体联合临床验前概率作为诊断PE及DVT的有效工具。有研究表明妊娠及产褥期妇女VTE发病率是非孕期的4~5倍[21],那在这类人群中D-二聚体的价值如何?CHAN等[22]在为期8年的多中心随访研究中发现有可能通过应用更高的D-二聚体质量浓度临界值来排除有症状妊娠患者DVT。HU等[23]研究中发现高龄产妇产后24 h内预测VTE的D-二聚体水平的最佳截断值为5.545 mg/L,特异性为70.0%,敏感性为75.4%,并提出D-二聚体≥5.50 mg/L(OR=5.874, 95%CI: 2.678~12.886)是VTE的独立危险因素。BELLESINI等[24]系统评价和荟萃分析中发现D-二聚体阴性且验前概率为低/中(10%/30%)或不太可能(低于10%)的疑似VTE孕妇人群,未行治疗,随访3个月,血栓发生率为 1/312(95%CI: 0.06~1.83),D-二聚体结合验前概率预测血栓的敏感性为99.5%(95%CI: 95.0%~100.0%; 异质性I2=0%),阴性预测值为100%(95%CI: 99.19%~100.0%;异质性 I2=0%)。SADEGHI等[25]的一项前瞻性横截面研究中发现无论孕周多少,使用D-二聚体水平诊断PE的临界值高于1447 μg/L〔敏感性87.5%,特异性63.04%,阴性预测值为98.3%;曲线下面积(AUC)=0.735;P=0.003〕。当同时使用D-二聚体和Wells评分预测PE时,以1962 μg/L作为临界值,发生PE的可能性很大,敏感性为99%,特异性为78.12%,阴性预测值为99%。目前妊娠期VTE的诊断仍是一个挑战,妊娠生理改变常让妊娠妇女出现呼吸短促、心动过速、下肢疼痛等临床症状,我们不可能让所有出现这些临床症状的妊娠妇女均行CT肺动脉造影或放射性肺通气/灌注扫描或加压下肢静脉超声检查,此时准确、无创、简易且经济的诊断方法尤为重要,而D-二聚体优势就比较突出。在临床工作中,可能因妊娠期D-二聚体生理变化及相关知识匮乏,我们总是倾向于忽略D-二聚体在妊娠期VTE的筛查或诊断价值。上述研究已证实妊娠人群中D-二聚体联合预测规则如Wells评分或验前概率可作为筛查VTE的良好方法,我们所需的是妊娠期D-二聚体的正常与异常的具体临界值。目前已有的研究或因样本量小,或因纳入评价的数据有限,研究结果并不具备普遍性,我们仍无法直接作为参考。未来需行前瞻性、多中心、大样本人群研究,结合适当的预测规则如Wells评分等,确定孕期最佳D-二聚体参考值,进一步明确D-二聚体在妊娠期VTE的筛查试验中的临界值和具体方案。
2.3. D-二聚体与妊娠期高血压疾病(gestational hypertensive disorders, GHD)
GHD是一组妊娠与高血压升高并存的疾病,严重影响母婴健康,是孕产妇和围产儿病死率升高的主要原因[26]。D-二聚体水平是否能预测妊娠期高血压疾病的发生?能否预测疾病病情程度?HAIRE等[27]发现早发型子痫前期组纤维蛋白最大形成率、血浆纤溶酶原激活物抑制物-1、血浆纤溶酶原激活物抑制物-2和D-二聚体水平均显著高于非妊娠对照组。WANG等[28]发现D-二聚体质量浓度>1108 ng/mL是妊娠相关急性肾损伤的独立预测因子。KIM等[29]及RODRÍGUEZ-PEÑA等[30]的研究证实D-二聚体水平升高与重度妊娠期高血压或子痫前期密切相关。CHEN等[31]发现母体血清D-二聚体水平随着高血压的进展呈逐渐升高的趋势。GHD病理生理为全身小血管痉挛和血管内皮损伤,而且似乎是一种凝血障碍状态,纤维蛋白形成增加,纤溶系统激活及微血栓形成,这或许是D-二聚体水平升高预测GHD病情严重程度的原因。微血栓的形成和过量的纤维蛋白沉积影响到多个母体器官,临床中比较常见受累部位为肾脏,这可能是高质量浓度D-二聚体与妊娠相关急性肾损伤有关的原因。上述研究为我们揭示了D-二聚体与GHD的某种关联,D-二聚体升高似乎代表着更严重的微血栓形成,更严重的微血栓形成也似乎代表着更严重的脏器功能损害。这种D-二聚体与GHD特别是伴严重表现的子痫前期的强烈相关性也为我们对相关病情的评估提供了另一个有价值的参考指标。但上述研究较多为回顾性研究,没有连续评估妊娠期间D-二聚体质量浓度的变化,以后我们可能进行前瞻性、大样本、多中心临床研究进一步探讨D-二聚体与GHD的相关性。
2.4. D-二聚体与妊娠结局
复发性流产为临床上较棘手的问题,发生原因很多,其中,抗磷脂抗体综合征(antiphospholipid antibody syndrome, APS)是临床上常见原因之一。APS是一种以持续抗磷脂抗体、血栓形成、反复流产、妊娠并发症和偶有血小板减少为特征的全身性、自身免疫性、血栓形成前疾病[32]。D-二聚体在这类患者中对于流产预测是否有一定价值,在抗凝治疗中是否有一定指导意义?BAO等[33]纳入1096例因APS发生复发性流产患者,探讨早孕期(5周至11周)患者D-二聚体水平的动态变化是否能预测妊娠结局。研究中每隔2周连续监测血浆D-二聚体水平。结果显示D-二聚体在各采血时间点均<0.50 mg/L FEU的患者活产率最高,为92.88%(287/309);D-二聚体基线水平(孕5周)>0.50 mg/L FEU且妊娠11周抽血时降至0.50 mg/L FEU以下的患者活产率为89.53%(265/296);D-二聚体基线水平<0.50 mg/L FEU且在末次抽血时升至0.50 mg/L FEU以上的患者活产率最差,为61.86%(60/97),基线D-二聚体水平是预测活产的最强预测因子。SHI等[34]的系统评价和荟萃分析也提示着血浆D-二聚体水平<0.50 mg/L者的活产率高于>0.50 mg/L者(RR=1.16, 95%CI:1.09~1.23, P<0.001)。YUAN等[35]近期开展了在中国人群中首个也是规模最大的一项关于孕晚期血浆D-二聚体水平与不良分娩结局关系的队列研究,回顾分析了11570名孕妇血浆D-二聚体水平及相关妊娠并发症及妊娠结局资料,发现妊娠晚期D-二聚体<0.65 mg/L与D-二聚体水平>1.55 mg/L的孕妇相比,早产(preterm birth, PTB)、低出生体质量(low birth weight, LBW)和小于胎龄儿(small for gestational age, SGA)风险显著降低。在ZENG等[36]的研究中,以0.53 mg/L FEU为参考值,妊娠早期,D-二聚体水平升高(n=421)的女性比正常水平(n=417)的女性更容易患先兆子痫(P=0.018,OR=2.8)和胎儿窘迫(P=0.009,OR=1.7)。D-二聚体的存在提示体内高凝状态,D-二聚体的降低也提示着高凝状态的缓解,这可能是D-二聚体升高预测不良妊娠结局可能的原因,这些研究结果在某种程度上也解答了为什么在管理妊娠合并APS的患者中,在使用抗凝药物降低D-二聚体水平时母儿结局可能会相对良好的一个临床现象。但目前而言,D-二聚体与妊娠结局的研究均为回顾性观察研究,研究人群及数量不同,研究设计没有提供孕妇孕前体质量指数、孕期体质量增加、社会经济水平以及影响妊娠结局的一些未发现的变量,缺乏对变量的调整,可能导致统计偏差。
3. 小结
综上所述,D-二聚体是纤维蛋白被纤溶酶降解时产生的特殊交联纤维蛋白衍生物,D-二聚体水平在妊娠期随孕周增加而升高,传统用于筛查正常人群静脉血栓形成的血浆D-二聚体参考值(≤0.5 mg/L)不适用于妊娠人群。因为针对不同片段制备的单克隆抗体对同一份血浆中不同片段的结合能力不同,D-二聚体分析方法有很多种,D-二聚体检测浓度及计量单位与仪器有关,不同实验室结果之间无法直接比较,我们也无法直接参考及使用目前实验得出的参考范围。各个地域或实验室,应通过大样本不同孕期血液样本凝血功能检测,建立自己的妊娠期不同孕周的D-二聚体参考值。越来越多前瞻性研究已证实D-二聚体在妊娠期VTE诊断的价值,但仍然需要前瞻性、多中心、扩大人群的研究进一步明确其阴性预测临界值。D-二聚体在GHD及妊娠不良结局中有一定预测作用。在GHD中,异常浓度的D-二聚体可能预测严重子痫前期,在因APS复发性先兆流产患者中,D-二聚体可指导相关抗凝药物的使用。我们不应该因妊娠期血浆D-二聚体的正常参考值的缺失而忽视D-二聚体检测在妊娠期的意义,在临床工作中,应结合患者病情,重视D-二聚体浓度的改变,监测高危孕妇D-二聚体值,结合其它预测指标,更好预测并监测进展,改善母儿妊娠结局。
* * *
利益冲突 所有作者均声明不存在利益冲突
Contributor Information
炼 段 (Lian DUAN), Email: 805288189@qq.com.
国琳 何 (Guo-lin HE), Email: heguolin19@163.com.
References
- 1.JOHNSON E D, SCHELL J C, RODGERS G M The D-dimer assay. Am J Hematol. 2019;94(7):833–839. doi: 10.1002/ajh.25482. [DOI] [PubMed] [Google Scholar]
- 2.徐金凤, 陈代娟, 田园, 等 产科抗磷脂综合征致妊娠晚期死胎5例报道. 实用妇产科杂志. 2019;35(10):794–796. [Google Scholar]
- 3.OLSON J D D-dimer: An overview of hemostasis and fibrinolysis, assays, and clinical applications. Adv Clin Chem. 2015;69:1–46. doi: 10.1016/bs.acc.2014.12.001. [DOI] [PubMed] [Google Scholar]
- 4.LINKINS L A, TAKACH LAPNER S Review of D-dimer testing: Good, bad, and ugly. Int J Lab Hematol. 2017;39(S1):98–103. doi: 10.1111/ijlh.12665. [DOI] [PubMed] [Google Scholar]
- 5.THACHIL J, LIPPI G, FAVALORO E J D-Dimer testing: Laboratory aspects and current issues. Methods Mol Biol. 2017;1646:91–104. doi: 10.1007/978-1-4939-7196-1_7. [DOI] [PubMed] [Google Scholar]
- 6.MORSE M Establishing a normal range for D-dimer levels through pregnancy to aid in the diagnosis of pulmonary embolism and deep vein thrombosis. J Thromb Haemost. 2004;2(7):1202–1204. doi: 10.1111/j.1538-7836.2004.00776.x. [DOI] [PubMed] [Google Scholar]
- 7.EPINEY M, BOEHLEN F, BOULVAIN M, et al D-dimer levels during delivery and the postpartum. J Thromb Haemost. 2005;3(2):268–271. doi: 10.1111/j.1538-7836.2004.01108.x. [DOI] [PubMed] [Google Scholar]
- 8.KHALAFALLAH A A, MORSE M, AL-BARZAN A M, et al D-Dimer levels at different stages of pregnancy in Australian women: A single centre study using two different immunoturbidimetric assays. Thromb Res. 2012;130(3):e171–e177. doi: 10.1016/j.thromres.2012.05.022. [DOI] [PubMed] [Google Scholar]
- 9.GONG J M, SHEN Y, HE Y X Reference intervals of routine coagulation assays during the pregnancy and puerperium period. J Clin Lab Anal. 2016;30(6):912–917. doi: 10.1002/jcla.21956. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.WANG M, LU S, LI S, et al Reference intervals of D-dimer during the pregnancy and puerperium period on the STA-R evolution coagulation analyzer. Clin Chim Acta. 2013;425:176–180. doi: 10.1016/j.cca.2013.08.006. [DOI] [PubMed] [Google Scholar]
- 11.HEDENGRAN K K, ANDERSEN M R, STENDER S, et al. Large D-dimer fluctuation in normal pregnancy: A longitudinal cohort study of 4, 117 samples from 714 healthy danish women. Obstet Gynecol Int, 2016, 2016: 3561675[2021-11-29]. https://doi.org/10.1155/2016/3561675.
- 12.JIN Y, LU J, JIN H, et al Reference intervals for biochemical, haemostatic and haematological parameters in healthy Chinese women during early and late pregnancy. Clin Chem Lab Med. 2018;56(6):973–979. doi: 10.1515/cclm-2017-0804. [DOI] [PubMed] [Google Scholar]
- 13.KAWAGUCHI S, YAMADA T, TAKEDA M, et al Changes in d-dimer levels in pregnant women according to gestational week. Pregnancy Hypertens. 2013;3(3):172–177. doi: 10.1016/j.preghy.2013.03.003. [DOI] [PubMed] [Google Scholar]
- 14.CUI C, YANG S, ZHANG J, et al Trimester-specific coagulation and anticoagulation reference intervals for healthy pregnancy. Thromb Res. 2017;156:82–86. doi: 10.1016/j.thromres.2017.05.021. [DOI] [PubMed] [Google Scholar]
- 15.WANG W, LONG K, DENG F, et al. Changes in levels of coagulation parameters in different trimesters among Chinese pregnant women. J Clin Lab Anal, 2021, 35(4): e23724[2021-11-29]. https://doi.org/10.1002/jcla.23724.
- 16.MURPHY N, BROADHURST D I, KHASHAN A S, et al Gestation-specific D-dimer reference ranges: A cross-sectional study. BJOG. 2015;122(3):395–400. doi: 10.1111/1471-0528.12855. [DOI] [PubMed] [Google Scholar]
- 17.MOHMAD SALLIH N, SUBBIAH I, ALI A, et al Reference ranges for D-dimer levels in Malaysian women in the three trimesters of pregnancy. Malays J Pathol. 2019;41(1):7–13. [PubMed] [Google Scholar]
- 18.SIENNICKA A, KŁYSZ M, CHEŁSTOWSKI K, et al. Reference values of D-dimers and fibrinogen in the course of physiological pregnancy: The potential impact of selected risk factors-a pilot study. Biomed Res Int, 2020, 2020: 3192350[2021-12-04]. https://doi.org/10.1155/2020/3192350.
- 19.GUTIÉRREZ GARCÍA I, PÉREZ CAÑADAS P, MARTÍNEZ URIARTE J, et al D-dimer during pregnancy: establishing trimester-specific reference intervals. Scand J Clin Lab Invest. 2018;78(6):439–442. doi: 10.1080/00365513.2018.1488177. [DOI] [PubMed] [Google Scholar]
- 20.BOUNAMEAUX H, CIRAFICI P, DE MOERLOOSE P, et al Measurement of D-dimer in plasma as diagnostic aid in suspected pulmonary embolism. Lancet. 1991;337(8735):196–200. doi: 10.1016/0140-6736(91)92158-x. [DOI] [PubMed] [Google Scholar]
- 21.HEIT J A, KOBBERVIG C E, JAMES A H, et al Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Ann Intern Med. 2005;143(10):697–706. doi: 10.7326/0003-4819-143-10-200511150-00006. [DOI] [PubMed] [Google Scholar]
- 22.CHAN W S, LEE A, SPENCER F A, et al D-dimer testing in pregnant patients: Towards determining the next 'level' in the diagnosis of deep vein thrombosis. J Thromb Haemost. 2010;8(5):1004–1011. doi: 10.1111/j.1538-7836.2010.03783.x. [DOI] [PubMed] [Google Scholar]
- 23.HU W, XU D, LI J, et al. The predictive value of D-dimer test for venous thromboembolism during puerperium in women age 35 or older: A prospective cohort study. Thromb J. 2020: 26[2021-12-06]. https://10.1186/s12959-020-00241-y.
- 24.BELLESINI M, ROBERT-EBADI H, COMBESCURE C, et al D-dimer to rule out venous thromboembolism during pregnancy: A systematic review and meta-analysis. J ThrombHaemost. 2021;19(10):2454–2467. doi: 10.1111/jth.15432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.SADEGHI S, GOLSHANI M, SAFAEIAN B New cut-off point for D-dimer in the diagnosis of pulmonary embolism during pregnancy. Blood Res. 2021;56(3):150–155. doi: 10.5045/br.2021.2021069. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.谢幸, 孔北华, 段涛, 主编, 妇产科学. 第9版. 北京: 人民卫生出版社, 2018: 83.
- 27.HAIRE G, EGAN K, PARMAR K, et al Alterations in fibrin formation and fibrinolysis in early onset-preeclampsia: Association with disease severity. Eur J Obstet Gynecol Reprod Biol. 2019;241:19–23. doi: 10.1016/j.ejogrb.2019.07.035. [DOI] [PubMed] [Google Scholar]
- 28.WANG B, JIANG Q, WU X. Association of D-dimers with acute kidney injury in pregnant women: A retrospective study. J Int Med Res, 2020, 48(11): 300060520966899[2021-12-04]. https://doi.org/10.1177/0300060520966899.
- 29.KIM S J, AHN H J, PARK J Y, et al The clinical significance of D-dimer concentrations in patients with gestational hypertensive disorders according to the severity. Obstet Gynecol Sci. 2017;60(6):542–548. doi: 10.5468/ogs.2017.60.6.542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.RODRÍGUEZ-PEÑA Y, IBÁÑEZ-PINILLA M Elevated levels of D-dimer tested by immunoturbidimetryare associated with the extent of severity of pre-eclampsia. Int J Gynaecol Obstet. 2020;150(2):241–247. doi: 10.1002/ijgo.13163. [DOI] [PubMed] [Google Scholar]
- 31.CHEN Y, CHEN Y, WANG X, et al. Second trimester maternal serum D-dimer combined with alpha-fetoprotein and free β-subunit of human chorionic gonadotropin predict hypertensive disorders of pregnancy: A systematic review and retrospective case-control study. J Transl Med, 2021, 19(1): 94 [2021-03-02]. https://pubmed.ncbi.nlm.nih.gov/33653375. doi: 10.1186/s12967-021-02718-4.
- 32.RODRIGUES V O, SOLIGO A, PANNAIN G D Antiphospholipid antibody syndrome and infertility. Rev Bras Ginecol Obstet. 2019;41(10):621–627. doi: 10.1055/s-0039-1697982. [DOI] [PubMed] [Google Scholar]
- 33.BAO S H, SHENG S L, LIAO H, et al. Use of D-dimer measurement to guide anticoagulant treatment in recurrent pregnancy loss associated with antiphospholipid syndrome. Am J ReprodImmunol, 2017, 78(6): 29024233[2021-12-07]. https://doi.org/10.1111/aji.12770.
- 34.SHI T, GU Z D, DIAO Q Z. Meta-analysis on aspirin combined with low-molecular-weight heparin for improving the live birth rate in patients with antiphospholipid syndrome and its correlation with D-dimer levels. Medicine (Baltimore), 2021, 100(25): e26264[2021-12-07]. https://pubmed.ncbi.nlm.nih.gov/34160390. doi: 10.1097/MD.0000000000026264.
- 35.YUAN X, GAO Y, ZHANG M, et al Association of maternal D-dimer level in late pregnancy with birth outcomes in a Chinese cohort. Clin Chim Acta. 2020;501:258–263. doi: 10.1016/j.cca.2019.10.048. [DOI] [PubMed] [Google Scholar]
- 36.ZENG J, LI Y, DONG Y, et al. Predictive values of D-dimer for adverse pregnancy outcomes: A retrospective study. Clin Chem Lab Med, 2020, 59(3): e99−e101[2020-03-05]. https://doi.org/10.1515/cclm-2020-0392.


