Abstract
目的
制备一种可滞留于肿瘤部位且具有高光转化效率的超大分子光敏剂,用于提高肿瘤光动力疗法(photodynamic therapy, PDT)的疗效。
方法
合成一种以四氨基苯卟啉(Tapp)为基体的共价有机框架材料Tapp-COF,并表征该材料的光谱特征、能隙特征、单线态氧产生能力等。然后用薄膜水化法将Tapp-COF制备,得到一种生理环境中不稳定的纳米胶束T-C@PP,用同样的方法将Tapp也制备成胶束T@PP作为对照,测试其粒径、电位、表面形貌、稳定性等。将小鼠黑色素瘤B16F10细胞接种在C57小鼠皮下,将T-C@PP或T@PP注射到小鼠肿瘤内部,进行或不进行光照。评估该纳米胶束的体外光动力杀伤效能、光敏剂胶束与肿瘤细胞共培养情况,验证纳米胶束的肿瘤滞留能力与肿瘤杀伤效果。
结果
Tapp-COF的光动力转化效能比Tapp高,可产生更多的活性氧。T-C@PP在生理环境中不稳定,与细胞共培养一段时间后可发生吸附性的聚集。T-C@PP在没有光照的条件下细胞毒性较低,但在660 nm激光照射下,即使较低浓度也能很好地杀死肿瘤细胞。T-C@PP可以滞留在肿瘤组织中,体内肿瘤杀伤效果比T@PP更好。
结论
本实验制备了一种基于Tapp-COF的高效纳米光敏剂胶束T-C@PP,在生理条件下可以通过自聚集来实现肿瘤滞留。该纳米胶束安全性好,在肿瘤光动力治疗中具有潜在的应用前景。
Keywords: 共价有机框架, 四氨基苯卟啉, 纳米胶束, 肿瘤抑制, 光动力疗法
Abstract
Objective
To prepare supramolecular photosensitizer that can be retained at the site of tumors and that has high light conversion efficiency so as to improve the efficacy of tumor photodynamic therapy (PDT).
Methods
A covalent organic framework material based on amino tetraphenyl porphyrin (Tapp), henceforth referred to as Tapp-COF, was synthesized. The spectral characteristics, energy gap characteristics and singlet oxygen generation ability of the material were characterized. Then, Tapp-COF was processed by thin film hydration method to derive T-C@PP, a nano micelle unstable in physiological environment. The same method was used to process Tapp in order to make T@PP micelles, which were used as the controls. The particle size, potential, surface morphology and stability were examined. B16F10 mouse melanoma cells were injected subcutaneously into C57 mice and T-C@PP or T@PP were injected intratumorally, followed by light exposure or no light exposure. We assessed the in vitro photodynamic killing efficiency of the nano micelles and the status of tumor cells co-cultured with the photosensitizer micelles and validated the tumor retention ability and killing efficiency of the micelles.
Results
Compared with Tapp, Tapp-COF displayed higher photodynamic conversion efficiency, and could produce more ROS. The T-C@PP micelles were unstable in physiological environment, and adsorptive aggregation would occur after co-culturing with tumor cells for a period of time. T-C@PP showed low cytotoxicity when there was no light exposure, but could kill tumor cells at relatively low concentration under 660 nm laser irradiation. T-C@PP could be retained in tumor tissue, and had better in vivo killing efficiency that that of T@PP.
Conclusion
In this study, highly efficient TPP-COF based T-C@PP micelles were prepared. Under physiological conditions, these micelles could achieve tumor retention through self-aggregation. Possessing sound safety, the nano micelles showed promise for potential application in tumor PDT.
Keywords: Covalent organic framework, Amino tetraphenyl porphyrin, Nano micelles, Tumor inhibition, Photodynamic therapy
肿瘤光动力疗法(photodynamic therapy, PDT)因其高目的性、非侵入性、低损伤性,在肿瘤临床治疗上颇受重视[1-2]。光动力疗法依靠光敏剂,实现光能向化学能的转变,在光的照射下产生活性中间体。由于细胞对于活性物质比较敏感,较容易在活性物质的作用下发生凋亡[3],进而杀伤细胞。如果杀伤的对象是肿瘤细胞,就可以实现肿瘤的抑制。
电子的空间效应指出,共轭效应使分子轨道上的最高占据分子轨道(the highest occupied molecular orbital, HOMO)和最低未占据分子轨道(the lowest unoccupied molecular orbital, LUMO)之差减小,分子轨道能隙降低,分子中价电子更容易被激发[4]。因此,提高光敏剂的共轭效应可以在一定程度上提升其吸收光的能力。目前在临床上已经开始使用的用于PDT的光敏剂大多具有卟啉环结构,卟啉环具有芳香性,共轭效应显著,分子轨道的能隙低,能够很好地吸收光能[5-6],并在光照下可以生成单线态氧等活性中间体,是性能优异的光敏剂。
但是,大部分具有卟啉结构的光敏剂都是疏水的,很难直接作为药剂使用[7]。解决这一问题的方法之一是将光敏剂制成能够在水中良好分散的纳米胶束,利用渗透滞留效应(EPR)实现肿瘤部位的聚集[8]。但是EPR效应实际能够起到的肿瘤滞留效应往往不够强,需要配合其他方法才能有效提高药物在肿瘤部位的积累[9]。因此,我们采用自聚集策略,设计了一种能够在生理环境中相互聚集的纳米胶束。
四氨基苯卟啉(Tapp)是一种卟啉衍生物,并且由于在卟啉环的亚甲基位点上引入了四个相互对称的氨基苯,共轭效应进一步增强。四个相互对称的氨基基团则有利于Tapp的功能性修饰,使之有逐步聚合形成网状或框架状超大聚合体分子的潜力。我们制备了一种基于Tapp的共价有机框架Tapp-COF[10],并用PEG2k-PLGA2k将其制备成生理环境中不稳定的纳米胶束T-C@PP,用同样的方法将Tapp也制备成胶束T@PP作为对比。对胶束在不同环境下的形态变化进行探究,并将胶束与细胞共培养,观察胶束的聚集与光敏剂的释放情况。最终通过动物实验验证胶束的瘤内滞留性与肿瘤抑制效果。
1. 材料和方法
1.1. 仪器和材料
1.1.1. 主要试剂和材料
小鼠黑色素瘤细胞B16F10来源于ATCC,雌性C57实验小鼠购买自成都达硕,光敏剂Tapp,活性氧标记物二苯并呋喃(DBF),单线态氧定性标记物四甲基哌啶(TEMP),细胞核荧光染料(DAPI),细胞膜红色荧光染料(DID)购买自上海泰坦,PEG2k-PLGA2k购买自西安瑞禧,单线态氧生物探针DCFH-DA购买自上海碧云天,胞活性检测试剂CCK-8购买自美国APExBIO,DMEM高糖完全培养基购买自江苏凯基,胎牛血清购买自安徽Biosharp,细胞培养用无菌PBS,D-Hanks溶液,胰酶-EDTA细胞消化液,红细胞溶血阳性诱导剂Triton X-100购买自北京索莱宝,丙酮、乙酸乙酯、二氧六环、二甲亚砜等基础化学试剂购买自成都科龙化工。本研究中涉及的动物实验均按照《实验动物福利伦理审查指南(GB/T 35892-2018)》要求进行。
1.1.2. 主要仪器
X射线晶体衍射仪(日本Rigaku Ultima Ⅳ),紫外-可见光分光光度计(日本Varian,CARY 100),荧光分光光度计(日本Shimadzu, LC-VP),多功能酶标仪(上海闪谱,Super Max 3000FA),激光粒度-Zeta电位分析仪(英国Malvern, Zetasizer Nano ZS90),扫描电子显微镜(日本捷欧路,JSM-7500 F Scanning),电化学工作站(上海辰华,ChI-660E),电子自旋共振波谱仪(德国布鲁克,EMX-PLUS),激光共聚焦显微镜(德国Leica,TCS SP5 AOBs),小动物活体成像仪(美国Caliper,IVIS),兽用生化分析仪(深圳迈瑞, BS-240VET)等。
1.2. 实验方法
1.2.1. Tapp-COF的合成与理化性能测试
取30 mg Tapp,15 mg对苯二甲醛,在玛瑙研钵里面,加入500 μL二氧六环进行研磨,磨至二氧六环完全挥发,研磨3次,得到黑紫色物质,再用乙酸乙酯洗涤,洗至上清液无色,离心后冷冻干燥,得到黑紫色粉末。随后测试其反应前后在乙酸乙酯中的溶解性,并用X射线晶体衍射仪检测其结晶性,用扫描电子显微镜观察其微观形貌。
1.2.2. Tapp-COF的分子轨道测试
称取Tapp-COF,溶于DMSO中,测试其光度吸收光谱,荧光发射光谱。用电化学工作站测试其氧化还原电位,并计算其HOMO与LUMO。物质吸收光的能力与其分子轨道的能隙有关[11],分子轨道的能隙等于HOMO与LUMO的能量差,而材料的HOMO与LUMO可以通过循环伏安法测得的氧化还原电位近似计算得到。用Ag/AgCl为参比电极,二茂铁电极对为内参,计算方法为HOMO/LUMO=−e(还原电位/氧化电位+4.44)[12]。Tapp按照同样的方法处理测试。
1.2.3. Tapp-COF的光敏性能探究
为了说明Tapp-COF能够更好地吸收光能并产生活性氧,我们用500 μg/mL的DBF溶液作为活性氧指示剂来检测光敏剂的活性氧产生能力。DBF是一种在415 nm波长左右具有特征光度吸收峰的化合物,而该化合物很容易与活性氧反应,反应后的产物在415 nm处的特征吸收峰消失,因此,可以通过测试DBF特征吸收峰强度的变化来比较不同体系的活性氧水平[13]。将Tapp-COF加入到DBF溶液里,以660 nm,400 mW/cm2激光光照处理1~5 min,随后用紫外-可见分光光度计测量其吸收光谱。另一方面,以TEMP为单线态氧指示剂,用ESR电子自旋共振波谱仪确定活性氧的类型。TEMP能够在单线态氧存在的条件下,氧化生成TEMPO,这种化合物能够在ESR下检测出特征三重峰,因此可以用来定性检测活性物质的种类[14]。Tapp按照同样的处理方法作为对照。
1.2.4. 纳米胶束制备与稳定性表征
采用薄膜分散法制备T-C@PP[15],取5 mg Tapp-COF,150 mg PEG2k-PLGA2k,溶解于100 mL丙酮中,以80 r/min的速度旋蒸,旋干丙酮后,在玻璃瓶底部形成均匀的红褐色薄膜。随后,加入10 mL去离子水,(另一组加10 mL生理盐水做对照),用超声清洗机将薄膜分散在水相里,然后在探头型超声机中,以150 W 功率处理10 min,得到红褐色澄清透明乳液,即T-C@PP。用激光粒度-Zeta电位分析仪观察其粒径分布,Zeta电位,多分散性指数PDI等,再用扫描电子显微镜(SEM)观察其微观表面形貌。Tapp按同样方法处理制备得到T@PP作为对照。
1.2.5. 细胞内活性氧水平测试
在共聚焦培养皿中正常培养B16F10细胞,在细胞生长到合适数量时,分别加入溶解有T-C@PP和T@PP的无血清培养基,共同孵育4 h。将细胞分为光照组和黑暗组,光照组按照400 mW/cm2功率密度照射5 min,黑暗组不进行光照。光照处理后,除去原有培养基后加入DCFH-DA活性氧探针[16],直接在激光共聚焦显微镜下定性观察各组细胞的活性氧的产生情况。绿色越强代表活性氧水平越高。
1.2.6. 胶束与细胞共培养
由于Tapp与Tapp-COF材料本身都具有红色荧光,所以可以直接在激光共聚焦显微镜下进行定位。将B16F10细胞接种在共聚焦小皿上,加入T-C@PP共同培养4 h,用DAPI对细胞核进行染色定位,在激光共聚焦显微镜下观察其荧光分布情况。另外一组,T-C@PP与细胞共同培养4 h后,洗去游离胶束,重新添加新鲜培养基继续培养24 h,观察长时间共培养后胶束的分布情况。T@PP按照同样的方法处理与T-C@PP进行对比。
1.2.7. 胶束的急性光毒性检测
用CCK-8法测试细胞毒性[17]。B16F10小鼠黑色素瘤细胞用含有10%胎牛血清的DMEM培养基培养。将细胞接种在96孔板中,待细胞生长到指数生长期后,分别加入0.2, 0.5, 1.0, 2.0 μg/mL的T-C@PP和T@PP,然后将其分为光照组和对照组,光照组用660 nm激光照射5 min,功率密度为400 mW/cm2,对照组不做光照处理。处理后放置30 min,随后加入CCK-8溶液检测其急性光毒性。
1.2.8. 胶束的溶血测试
取小鼠新鲜血液,以2 000 r/min 的转速离心10 min,用移液枪小心吸出上层血清,然后用生理盐水重新将红细胞悬浮。然后在红细胞悬浮液中加入不同浓度的T@PP或T-C@PP,其中,以纯生理盐水做阴性对照,0.5% Triton X - 100做阳性对照,37 ℃下处理3 h 后离心,取上清液并检测其545 nm处的吸光度,以此测试胶束的溶血情况。
1.2.9. 瘤内滞留试验
采用C57小鼠作为实验模型鼠,将B16F10细胞接种在C57小鼠皮下,待肿瘤体积生长到100 mm3后进行实验。采用瘤内注射的方法将T-C@PP或T@PP注射到小鼠肿瘤内部。利用光敏剂本身具有的荧光进行定位,注射后在0、2、4、8、24 h分别用小动物活体成像仪观察小鼠肿瘤部位的荧光强度,并用荧光半定量法进行统计。另外,再设置PEG2k-PLGA2k包载DID的DID@PP作为对比,以进一步探究造成瘤内滞留的原因。
1.2.10. 体内药效验证
同样的,在肿瘤体积增长到100 mm3后开始进行治疗,治疗方案设计为,将小鼠分为5组,其中一组为生理盐水对照组,另外四组分别为T@PP(−)、 T@PP(+)、T-C@PP(−)、T-C@PP(+),其中(−)表示注射胶束但不进行激光照射,(+)表示注射胶束后进行激光照射治疗。第1天,将所有小鼠按照分组瘤内注射100 μL 1 mg/mL的胶束,待充分浸润肿瘤后,光照组在660 nm激光400 mW/cm2下照射10 min。第2天和第3天不再注射,但光照组继续用同样的激光进行治疗。随后继续饲养,第14天将小鼠安乐死并剖出肿瘤,实验期间记录小鼠的肿瘤大小变化及小鼠体质量变化。
1.2.11. 安全性评估
雌性C57模型小鼠按上述方法进行治疗后,取出小鼠血液,2 000 r/min 离心10 min,小心吸出血清,用兽用生化分析仪分析小鼠血清的肝肾功能指标,评估本治疗方案的安全性。
1.3. 统计学方法
计量数据用
 表示。两组之间比较采用配对t检验,P<0.05为差异有统计学意义。
表示。两组之间比较采用配对t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. Tapp和Tapp-COF的理化性能
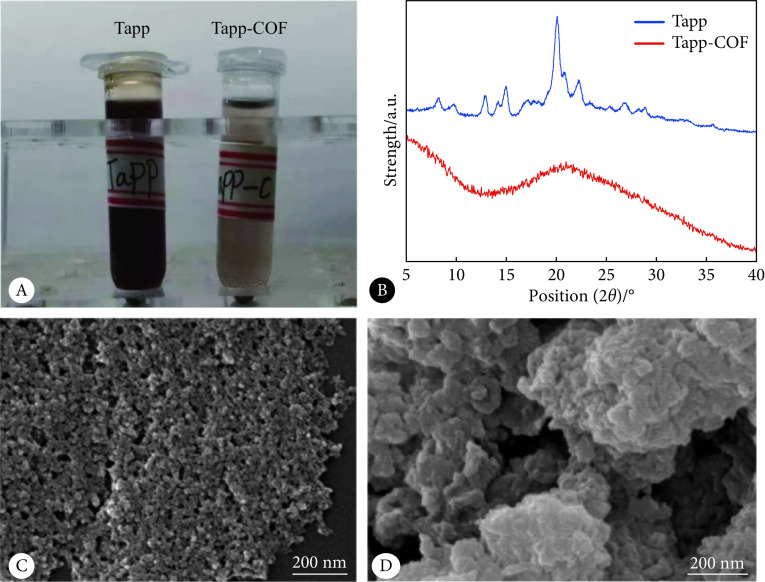
图1A显示Tapp可以在乙酸乙酯中溶解,呈红紫色溶液,而Tapp-COF由于分子量大,在乙酸乙酯中溶解性大幅降低。图1B是用X射线晶体衍射仪分析的二者晶型,Tapp是典型的晶体有机物,而Tapp-COF的结晶度有所下降,图1C、1D分别是用扫描电子显微镜观察的Tapp单体与Tapp-COF的表面形貌,与Tapp的直径1~5 nm微小晶粒相比,Tapp-COF呈现出不规则的片层堆积状态。
图 1.
The physical properties of Tapp and Tapp-COF
Tapp与Tapp-COF的物理性质
A:Solubility of Tapp and Tapp-COF in ethyl acetate; B: X-ray diffraction pattern of Tapp and Tapp-COF ; C: SEM image of Tapp; D: SEM image of Tapp-COF.
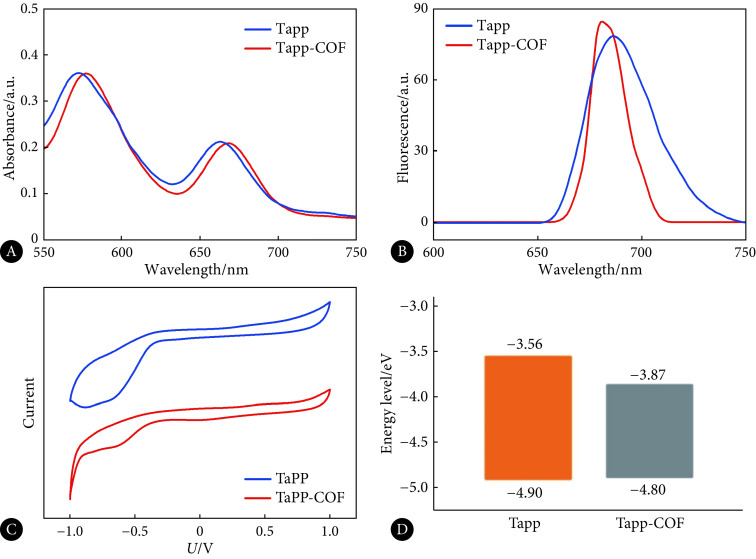
图2A、2B分别是Tapp和Tapp-COF的光度吸收光谱和荧光发射光谱,与Tapp相比,Tapp-COF的光度吸收光谱发生红移,荧光发射光谱发生蓝移,这说明Tapp-COF的大共轭结构使其相比于Tapp能够吸收能量更低的光。图2C中可以得出两种材料的氧化/还原电位,结果显示,Tapp的氧化/还原电位是0.46 V/−0.88 V, Tapp-COF的氧化/还原电位是0.36 V/−0.57 V,图2D为两种材料的HOMO/LUMO计算结果,计算得出Tapp的HOMO/LUMO=−3.56 eV/−4.9 eV, Tapp-COF的HOMO/LUMO=−3.87 eV/−4.8 eV,因此Tapp分子轨道能隙宽度约为1.34 eV,Tapp-COF分子轨道能隙宽度约为0.93 eV。结果表明,大共轭结构能够明显降低材料的氧化还原电位之差,这间接证明了Tapp-COF的价电子比Tapp的价电子更容易受到激发,解释了Tapp-COF吸收光谱发生红移动的原因。
图 2.
Spectroscopic and electrochemical analysis of Tapp and Tapp-COF
Tapp与Tapp-COF的光谱学与电化学分析
A: Absorption spectrum of Tapp and Tapp-COF; B: Fluorescence emission spectrum of Tapp and Tapp-COF; C: Cyclic voltammetry characteristic curve of Tapp and Tapp-COF; D: The HOMO/LUMO of Tapp and Tapp-COF (calculated from redox potential).
图3A、3B分别是Tapp和Tapp-COF在DBF溶液中进行不同时间光照后的光度吸收光谱图,其特征波长处的吸光强度随着光照时间的增加而减小,说明DBF在光照作用下产生了消耗,但在两组光敏剂中的消耗速率不同。图3C是以415 nm处特征吸收峰完全消失时的活性氧相对含量为100%计算得到的活性氧的相对产量。可以看出,相同质量浓度下,Tapp-COF相比Tapp,光照下产生活性氧的速率更快,二者之间的差异有统计学意义。进一步探究Tapp和Tapp-COF光照后产生活性物质的种类,图3D显示了Tapp和Tapp-COF在660 nm光照下产生的活性物质的类型是单线态氧。
图 3.

Ability and types of ROS produced by laser irradiation of Tapp and Tapp-COF
Tapp与Tapp-COF激光照射下的活性氧产生能力及产生活性氧类型
A: Consumption of DBF under irradiation in Tapp group; B: Consumption of DBF under irradiation in Tapp-COF group; C: Comparison of DBF consumption rate between Tapp and Tapp-COF under illumination (The laser parameters in A, B, and C were 660 nm, 400 mW/cm2); D: ESR diagram of Tapp and Tapp-COF before and after laser irradiation. **P<0.01,****P<0.000 1, Tapp vs. Tapp-COF,n=3.
2.2. PEG-PLGA胶束的稳定性
图4A显示纳米胶束在纯水中放置24 h后的粒径图,约110 nm,PDI=0.264,Zeta电位为−12.6 mV,图4B是用生理盐水处理24 h后的纳米粒子粒径图,可以看出,生理盐水处理后测得纳米粒子的平均粒径上升,且PDI增大,Zeta电位变化为1.41 mV。图4C显示T-C@PP在纯水和生理盐水中72 h 内的粒径变化趋势,在生理盐水中检测出粒径明显上升,而在纯水中粒径基本保持稳定,8 h后两者的水合粒径差异有统计学意义。图4D和图4E分别是T-C@PP在生理盐水处理前后的扫描电子显微镜图像,可以看出,纯水环境中,胶束形态规则,粒径约100 nm;生理盐水处理后胶束出现较明显的聚集,边界不清晰,扫描电子显微镜下的形态类似于铺在硅基板上的一层薄膜。这说明胶束结构在生理盐水长期处理后已经被破坏。
图 4.
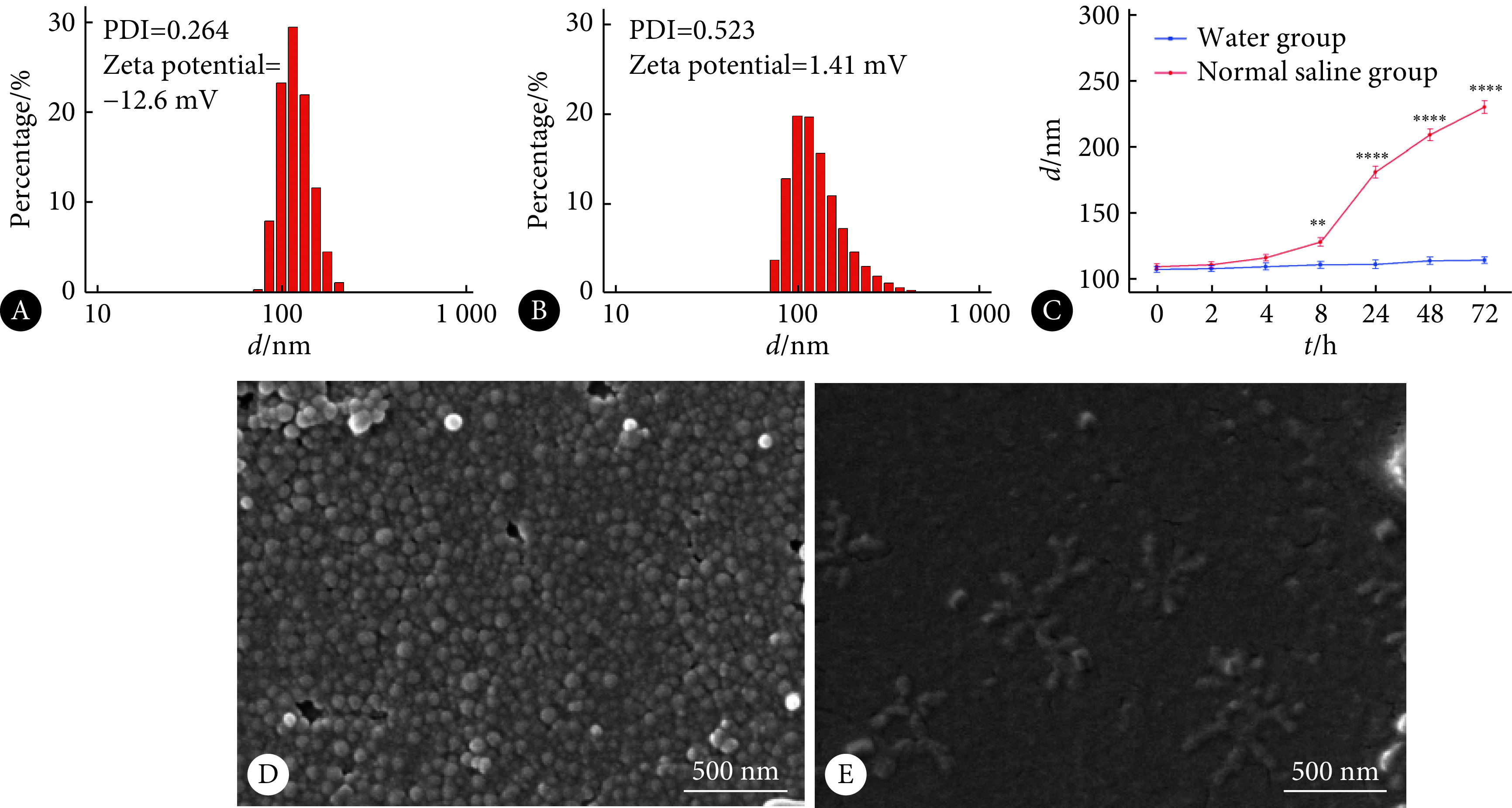
Nano morphological changes of T-C@PP before and after treatment with normal saline
T-C@PP生理盐水处理前后的纳米形态变化
A: Particle size, potential, PDI of untreated group; B: Particle size, potential, PDI after normal saline treatment ; C: Comparison of particle size changes between normal saline treated group and untreated group; D: SEM of micelles of water group; E: SEM of micelles treated with normal saline. **P<0.01, ****P<0.000 1, vs. with water group,n=3.
2.3. 肿瘤细胞内的活性氧水平
图5A可以看出,肿瘤细胞与光敏胶束共培养,光照后活性氧水平明显提高。另外,对照组在光照后并没有出现活性氧水平增高,说明活性氧不是仅靠激光照射产生。同样处理条件下,T-C@PP组的活性氧水平高于T@PP组,这也验证了Tapp-COF的光转化效率比Tapp更高。
图 5.
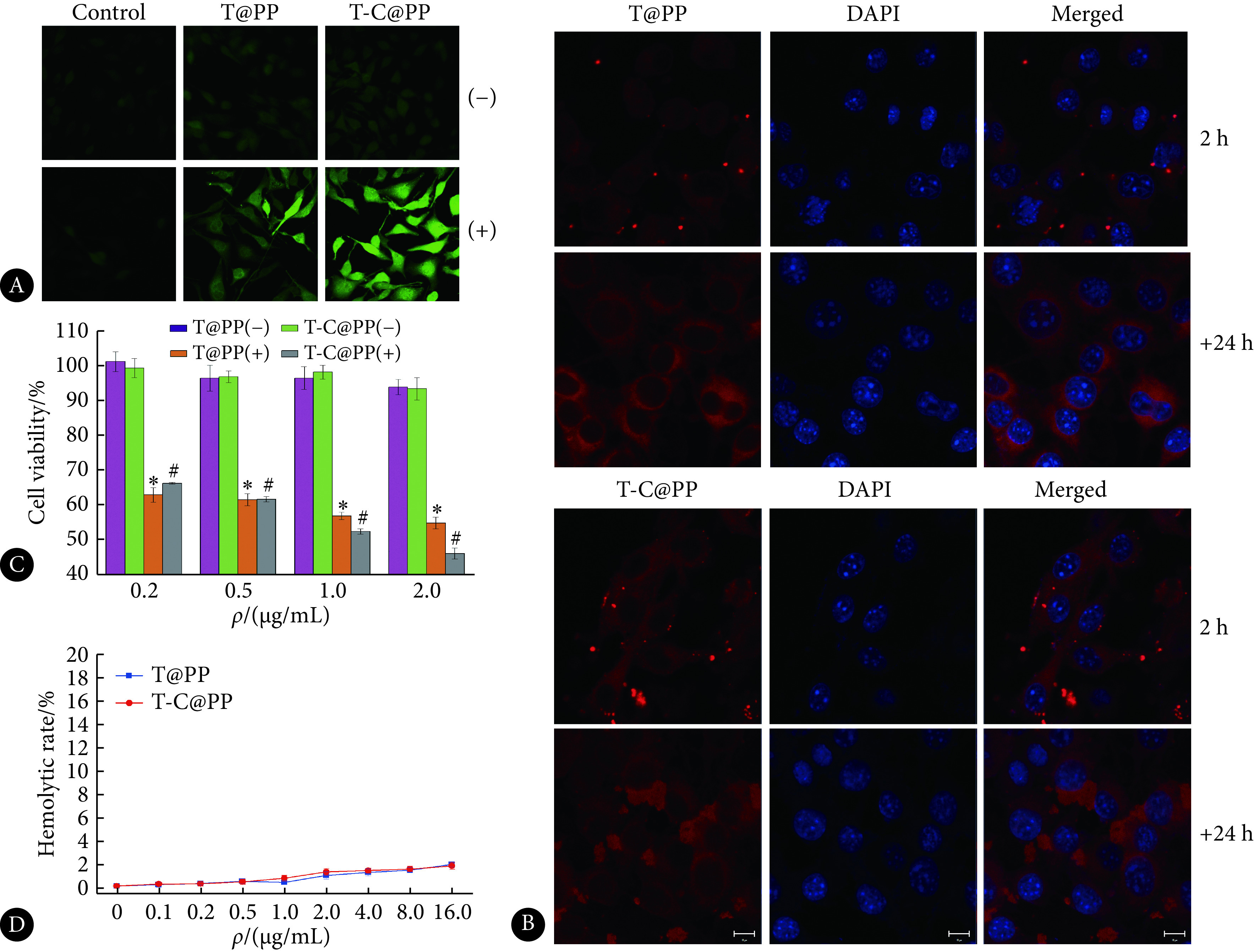
Cell experiment results of T@PP and T-C@PP
T@PP与T-C@PP的细胞实验结果
A: Intracellular ROS level after T@PP and T-C@PP treatment (the magnification is 630×); B: The state of Tapp and Tapp-COF being cultured with cells (all scale bars are 10 μm); C: The photoacute toxicity of T@PP and T-C@PP; D: The hemolysis rate of Tapp and Tapp-COF. *P<0.000 1, vs. T@PP(−); #P<0.000 1, vs. T-C@PP(−),n=5.
2.4. 肿瘤细胞与纳米胶束共培养的结果
图5B是用激光共聚焦显微镜拍摄的肿瘤细胞与两种胶束共培养的情况。两种胶束与肿瘤细胞共培养2 h后,都还是较稳定的纳米形态,可以清晰地看出点状分布的强荧光信号。再另外培养24 h,T@PP和T-C@PP两组出现了明显的不同的形态。T@PP组中荧光信号均匀地分布在细胞里面,而T-C@PP组则出现了大面积的片层状堆积,这与之前的材料本身的性状对应。这说明,在与肿瘤细胞共培养24 h后,胶束被破坏,释放出胶束内部的光敏剂。相比之下,T@PP胶束则不具备这种性质。
2.5. 急性光毒性和溶血率
图5C可以看出在400 mW/cm2、660 nm激光照射5 min后,肿瘤细胞会出现显著的急性死亡,即使0.2 μg/mL光敏剂下,激光照射后细胞活性仅剩60%左右,相比之下,未进行光照的细胞并没有出现显著的活性降低,这说明是光敏剂经激光照射后产生的活性氧造成了细胞急性死亡,且在各组中,光照前后的细胞活性差异有统计学意义(P<0.000 1)。溶血实验说明两种胶束处理后的红细胞溶血率均低于2%,因此可以认为两种纳米胶束均不会引起红细胞溶血,可以安全使用。
2.6. 胶束瘤内滞留
图6A是T@PP和T-C@PP的体内荧光分布图,可以看出,T@PP在注射后24 h内,出现了大幅度的全身扩散。图6B荧光半定量数据说明,T@PP在注射24 h后,肿瘤部位荧光残余量约为注射时的1/10。与此相比,T-C@PP组中,注射24 h后,肿瘤部位残余荧光量并没有出现显著下降,这是由于胶束破坏后内部的Tapp-COF释放出来并更趋向于聚集,而相互聚集后形成的大颗粒物质不容易随着体液循环被带走,因此滞留于肿瘤部位,而T@PP破坏后裸露出来的Tapp没有这种聚集倾向,且可以在耳朵等皮肤薄弱区域检测到荧光信号,说明Tapp已经发生了游离。为了进一步验证肿瘤滞留效应是由Tapp-COF的性能决定,我们另外设置的PEG-PLGA包载的DID作为对照,如图6C,6D中所示,注射DID@PP后,6 h内肿瘤内部的荧光信号就出现了明显减弱,组间数据差异性显著,具有统计学意义,这进一步说明了造成肿瘤滞留效果的原因是Tapp-COF的性质,而不是胶束本身。
图 6.
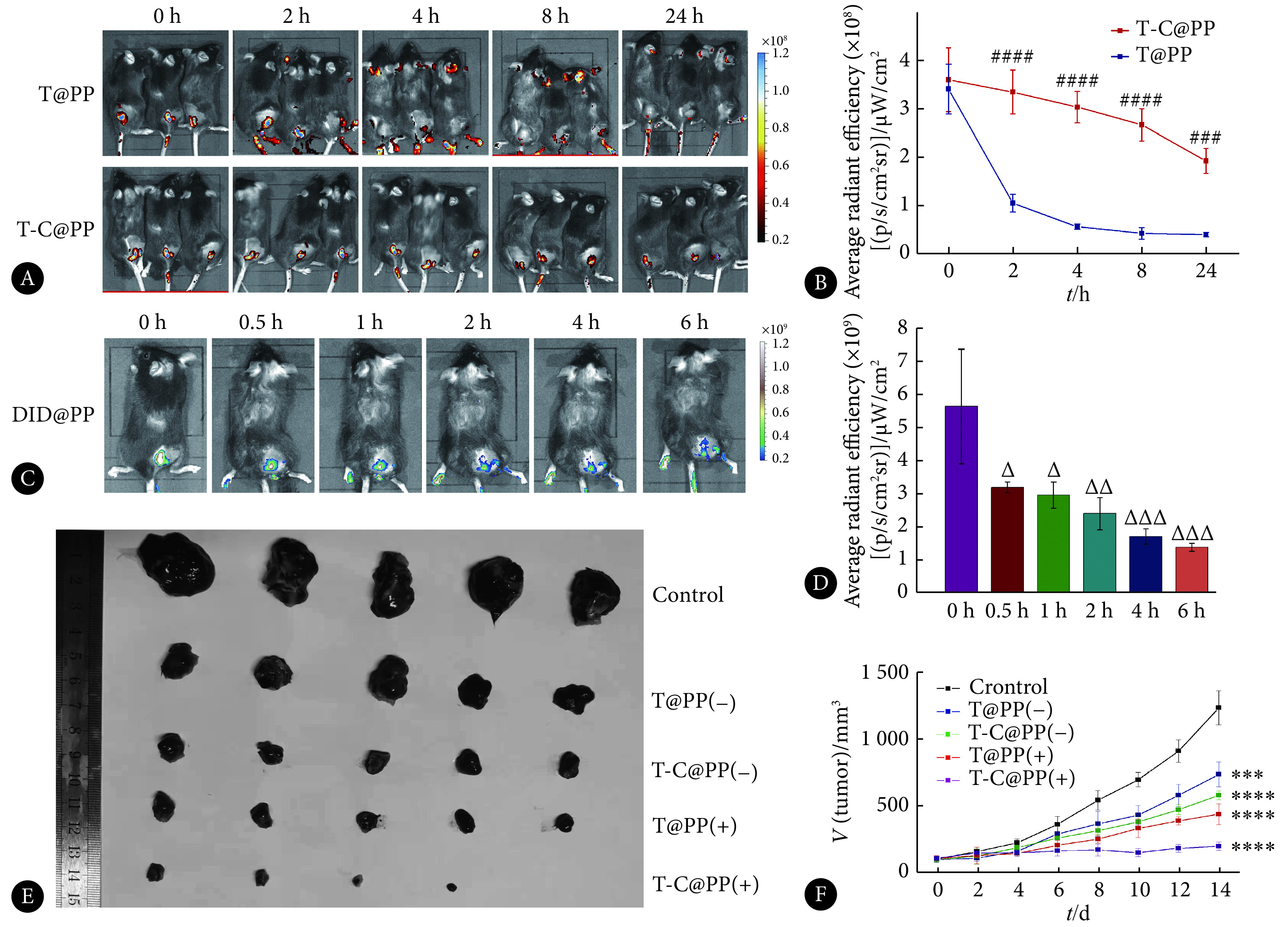
Tumor retention of micelles and the efficiency of photodynamic therapyin vivo
胶束的肿瘤滞留性与体内光动力治疗效果
A: in vivo fluorescence imaging at different time after intratumoral injection of T@PP and T-C@PP; B: Fluorescence semi quantitative statistics at each time point of T@PP and T-C@PP (###P<0.001, ####P<0.000 1, vs. T@PP,n=3); C: in vivo fluorescence imaging within 6 h after intratumoral injection of DID@PP; D: Fluorescence semi quantitative statistics of DID@PP within 6 h (ΔP<0.01, ΔΔP<0.001, ΔΔΔP<0.000 1, vs. 0 h,n=3); E: Morphology of tumor dissected after 14 days of treatment; F: Tumor volume statistics within 14 days (***P<0.001,****P<0.000 1, vs. control at 14 d,n=5-6).
2.7. 体内药效
图6E是荷瘤小鼠治疗14 d后的肿瘤形态图,图6F是14 d内对小鼠肿瘤大小的统计结果。可以看出,注射过光敏剂的小鼠,即使没有激光照射,相比于对照组也能够一定程度上抑制肿瘤,这是由于饲养小鼠的环境并非完全无光,而该光敏剂本身的吸光范围较宽,自然光下也可能造成了一定程度上肿瘤杀伤。另一方面,与未光照相比,激光照射后的小鼠肿瘤大小明显降低,相比于对照组差异性显著,具有统计学意义。T@PP未光照组14 d后肿瘤体积平均739 mm3,光照组平均382 mm3,T-C@PP未光照组平均641 mm3,光照组平均123 mm3。
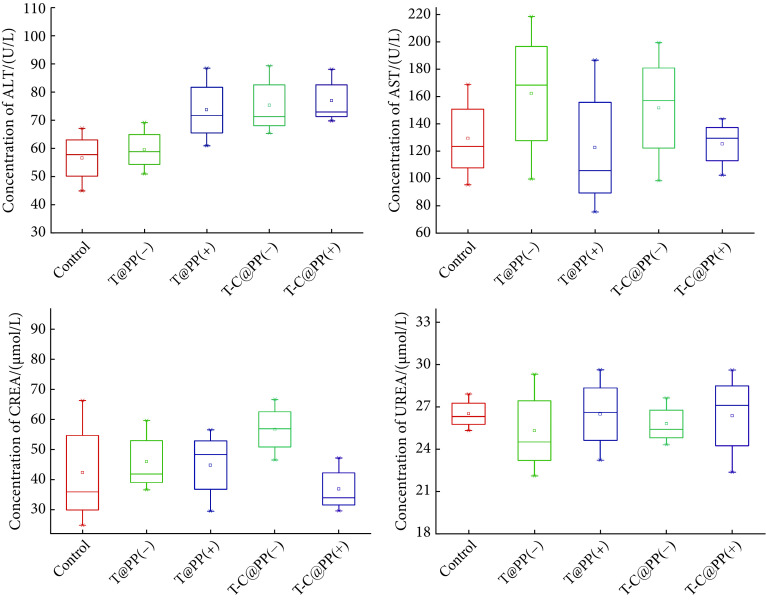
2.8. 安全性评估
图7示小鼠的肝功能指标谷丙转氨酶(ALT)和谷草转氨酶(AST),肾功能指标血肌酐(CREA)和尿素(UREA)在各个治疗组中均在正常范围内,相比于对照组差异无统计学意义,说明本治疗方案不会造成肝肾功能损伤,可以安全使用。
图 7.
Safety assessment of the treatment regimens
治疗方案的安全性评估
Normal level: ALT (30-110 U/L), AST (60-220 U/L), CREA (22-97 μmol/L), UREA(18-33 mmol/L), n=3.
3. 讨论
目前临床治疗上应用于光动力疗法的光敏剂大多是基于卟啉结构的衍生物,或者会在体内代谢产生卟啉结构的物质,如Ce6,5-ALA等[18-19].卟啉结构广泛存在于生物体内,叶绿素和血红素就是最典型的卟啉衍生物。相比于金属化合物类光敏剂,卟啉结构光敏剂能够在一定程度上被机体代谢,一般不会造成严重的积累性毒性[20]。同时,经过特殊修饰设计后的卟啉光敏剂往往也具备很高的光转化效率,能够更有效率的产生活性物质。
光敏剂的低水溶性限制了PDT的发展,大部分卟啉衍生物光敏剂同样有这个问题。纳米制剂的应用能够一定程度上解决水溶性的问题,且可带来一定的肿瘤蓄积增强。要进一步提高肿瘤处光敏剂浓度,可以设法将进入肿瘤部位的纳米制剂滞留在肿瘤组织中,纳米胶束的自聚集就是一个可行的策略。
因此,本研究选用Tapp作为光敏剂基本单元,Tapp具有四个相互对称的氨基,能够很容易进行修饰,这种对称的化合物可以被设计成框架结构。用Tapp和对苯二甲醛制备得到的Tapp-COF由于共轭效用相比于Tapp具备更高的光转化效率,能够更快产生活性氧。然后我们用PEG2k-PLGA2k将Tapp-COF制备成一种能够在水中良好分散的胶束T-C@PP,并将Tapp按照同样的方法制备得到T@PP作为对比。PEG-PLGA是一种被证实安全的生物医用高分子材料,能够通过薄膜分散法将不溶于水的药物包载,形成在水中均匀分散的纳米胶束[21]。我们发现,T-C@PP在与B16F10细胞共培养一段时间后,由于胶束在生理环境中不稳定,很容易被破坏,Zeta电位的变化说明T-C@PP在电解质的作用下双电层结构发生改变,胶束被破坏,裸露出来的不溶性Tapp-COF发生聚集,检测出平均粒径增大[22]。胶束破坏后暴露出的Tapp-COF能够发生吸附性聚集,而T@PP不具备吸附性特点,这是由于Tapp-COF分子中有大量的氨基和醛基,有相互之间形成亚氨键动态平衡的趋势,所以T-C@PP中的Tapp-COF被释放出来后倾向于相互聚集,最终形成这种可以直接观察到的片状荧光信号,说明聚集性是由Tapp-COF的性质决定[23]。在动物实验中我们验证了这一聚集性,实现了光敏剂的瘤内滞留,并且在对肿瘤进行激光照射治疗后,小鼠体内的黑色素瘤的生长受到明显的抑制,T-C@PP组具有如此高的肿瘤抑制率是因为它具有高的光转换效率与肿瘤滞留效应。同时,该治疗方案被证明是安全的,具有一定的应用潜力。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
优秀青年科学基金(No. 82022070)资助
Contributor Information
兆杰 周 (Zhao-jie ZHOU), Email: zzj97615@163.com.
凌 张 (Ling ZHANG), Email: zhangling83@scu.edu.cn.
References
- 1.LUBY B M, WALSH C D, ZHENG G Advanced Photosensitizer activation strategies for smarter photodynamic therapy beacons. Angew Chem Int Ed. 2019;58(9):2558–2569. doi: 10.1002/anie.201805246. [DOI] [PubMed] [Google Scholar]
- 2.RAJORAM A, LOU J W H, ZHENG G Advancing porphyrin's biomedical utility via supramolecular chemistry. Chem Soc Rev. 2017;46(21):6433–6469. doi: 10.1039/C7CS00525C. [DOI] [PubMed] [Google Scholar]
- 3.唐茂涵, 张艳杰, 刘银, 等 三甲氧苄嗪对脂肪来源间充质干细胞氧化应激损伤的影响及机制研究. 四川大学学报(医学版). 2017;48(2):173–178. [Google Scholar]
- 4.AJAYAGHOSH A Donor-acceptor type low band gap polymers: Polysquaraines and related systems. Chem Soc Rev. 2003;32(4):181–191. doi: 10.1039/B204251G. [DOI] [PubMed] [Google Scholar]
- 5.SONG Q, JIAO Y, WANG Z, et al Tuning the energy gap by supramolecular approaches: Towards near-infrared organic assemblies and materials. Small. 2016;12(1):24–31. doi: 10.1002/smll.201501661. [DOI] [PubMed] [Google Scholar]
- 6.WANG J, LI Y, DENG L, et al. High-performance photothermal conversion of narrow-bandgap Ti2O3 nanoparticles. Adv Mater, 2017, 29(3): 1603730[2022-01-17]. https://doi.org/10.1002/adma.201603730.
- 7.FENG L, CHENG L, DONG Z, et al Theranostic liposomes with hypoxia-activated prodrug to effectively destruct hypoxic tumors post-photodynamic therapy. ACS Nano. 2017;11(1):927–937. doi: 10.1021/acsnano.6b07525. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.MAEDA H, TSUKIGAWA K, FANGJ A retrospective 30 years after discovery of the enhanced permeability and retention effect of solid tumors: Next-generation chemotherapeutics and photodynamic therapy-problems, solutions, and prospects. Microcirculation. 2016;23(3):173–182. doi: 10.1111/micc.12228. [DOI] [PubMed] [Google Scholar]
- 9.YANG G, XU L, XU J, et al Smart nanoreactors for pH-responsive tumor homing, mitochondria-targeting, and enhanced photodynamic-immunotherapy of cancer. Nano Lett. 2018;18(4):2475–2484. doi: 10.1021/acs.nanolett.8b00040. [DOI] [PubMed] [Google Scholar]
- 10.WANG H M, JIANG J Q, XIAO J H, et al Porphyrin with amino acid moieties: A tumor photosensitizer. Chem Biol Interact. 2008;172(2):154–158. doi: 10.1016/j.cbi.2007.11.016. [DOI] [PubMed] [Google Scholar]
- 11.IUCHI T, SEO T Temperature measurement of semitransparent silicon wafers based upon absorption edge wavelength shift. Int J Thermophys. 2010;31(8/9):1533–1543. doi: 10.1007/s10765-010-0786-9. [DOI] [Google Scholar]
- 12.ZOU Y, CHEN X F, YANG P, et al. Regulating the absorption spectrum of polydopamine. Sci Adv, 2020, 6(36): eabb4696[2022-01-17]. https://doi.org/10.1126/sciadv.abb4696.
- 13.GUO W, WANG F, DING D, et al TiO2–x based nanoplatform for bimodal cancer imaging and NIR-triggered chem/photodynamic/photothermal combination therapy . Chem Mater. 2017;29(21):9262–9274. doi: 10.1021/acs.chemmater.7b03241. [DOI] [Google Scholar]
- 14.ZHU P, CHEN Y, SHI J Nanoenzyme-augmented cancer sonodynamic therapy by catalytic tumor oxygenation. ACS Nano. 2018;12(4):3780–3795. doi: 10.1021/acsnano.8b00999. [DOI] [PubMed] [Google Scholar]
- 15.CHAN J M, ZHANG L, YUET K P, et al PLGA-lecithin-PEG core-shell nanoparticles for controlled drug delivery. Biomaterials. 2009;30(8):1627–1634. doi: 10.1016/j.biomaterials.2008.12.013. [DOI] [PubMed] [Google Scholar]
- 16.LI K T, CHEN Q, WANG D W, et al Mitochondrial pathway and endoplasmic reticulum stress participate in the photosensitizing effectiveness of AE-PDT in MG63 cells. Cancer Med. 2016;5(11):3186–3193. doi: 10.1002/cam4.895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.SHI L, POHLA H, BUCHNER A, et al. MOP-dependent enhancement of methadone on the effectiveness of ALA-PDT for A172 cells by upregulating phosphorylated JNK and BCL2. Photodiagnosis Photodyn Ther, 2020, 30: 101657[2022-01-17]. https://doi.org/10.1016/j.pdpdt.2020.101657.
- 18.RYUA R, KIM Y W, LEE M Y. Chlorin e6-mediated photodynamic therapy modulates adipocyte differentiation and lipogenesis in 3T3-L1 cells. Photodiagnosis Photodyn Ther, 2020, 31: 101917[2022-01-17]. https://doi.org/10.1016/j.pdpdt.2020.101917.
- 19.SHINODA Y, KATO D, ANDO R, et al. Systematic review and meta-analysis of in vitro anti-human cancer experiments investigating the use of 5-aminolevulinic acid (5-ALA) for photodynamic therapy. Pharmaceuticals, 2021, 14(3): 229[2022-01-17]. https://doi.org/10.3390/ph14030229.
- 20.MONTGOMERY B D, ANDERSON K E, BONKOVSKY H L Porphyria. NEJM. 2017;377(9):862–872. doi: 10.1056/NEJMra1608634. [DOI] [PubMed] [Google Scholar]
- 21.ZHANG K, TANG X, ZHANG J, et al. PEG-PLGA copolymers: Their structure and structure-influenced drug delivery applications. J Control Release, 2014, 183: 77−86[2022-01-17]. https://doi.org/10.1016/j.jconrel.2014.03.026.
- 22.WANG Y Z, SHAN X Y, WANG D W, et al. Mitigating self-discharge of carbon-based electrochemical capacitors by modifying their electric-double layer to maximize energy efficiency. J Energy Chem, 2019, 38: 214−218[2022-01-17]. https://doi.org/10.1016/j.jechem.2019.04.004.
- 23.XIN Y, YUAN J Schiff's base as a stimuli-responsive linker in polymer chemistry. Polym Chem. 2012;3(11):3045–3055. doi: 10.1039/c2py20290e. [DOI] [Google Scholar]