Abstract
目的
评估全身麻醉下丘脑底核(subthalamic nucleus, STN)脑深部电刺激术(deep brain stimulation, DBS)的疗效及安全性,为全麻DBS手术相关临床研究提供基础。
方法
以2019年1月–2021年12月在我院接受全麻DBS手术及局麻DBS手术的各30例原发性帕金森病患者为研究对象。所有患者均接受双侧丘脑底核电极植入,术中通过脑电双频指数(bispectral index, BIS)监测和控制麻醉深度,利用微电极记录(microelectrode recording, MER)双侧丘脑底核特征性放电,验证靶点位置。所有患者均一次性完成脑深部电极、延伸导线及刺激发生器(implantable pulse generator, IPG)植入,术后薄层CT扫描重建电极图像,验证电极植入精度。采用统一帕金森病评价量表第三部分(Unified Parkinson’s Disease Rating Scale-Ⅲ)评价手术前后运动症状改善情况,记录和分析术中MER结果以及手术相关并发症发生情况。
结果
所有患者均顺利完成植入手术,电极位置准确,全麻组及局麻组患者在手术前后的UPDRS-Ⅲ评分、药物剂量差异均无统计学意义。术后未发生颅内出血、脑梗塞及感染,5例患者出现暂时性精神行为异常,均在术后48 h内消失。
结论
全麻STN-DBS手术治疗帕金森病的术后疗效与传统局麻下电极植入手术疗效相当,在严格管理情况下,手术和麻醉相关并发症发生率低,并且能提高患者的手术舒适度。
Keywords: 帕金森病, 脑深部刺激, 丘脑底核, 全麻
Abstract
Objective
To assess the efficacy and safety of bilateral subthalamic nucleus deep brain stimulation (STN-DBS) under general anesthesia and to provide the basis for clinical research related to DBS surgeries under general anesthesia.
Methods
A total of 60 patients with primary Parkinson's disease who underwent DBS surgery between January 2019 and December 2021at West China Hospital were enrolled for the study. Among them, 30 had the surgery while they were asleep, i.e., under general anesthesia, and 30, while they were awake, i.e., under local anesthesia. All the patients underwent bilateral STN-DBS surgery. Bispectral index (BIS) was used to monitor and control the depth of anesthesia. Microelectrode recording (MER) technology was used to record the characteristic signals of the bilateral subthalamic nuclei and verify their location during the operation. All patients completed the implantation of deep electrodes, connecting wires, and implantable stimulation generator (IPG) at one time. Postoperative thin-slice CT scans were done to reconstruct electrode images and to verify the accuracy of electrode implantation. The Unified Parkinson's Disease Rating Scale-Ⅲ (UPDRS-Ⅲ) was used to evaluate the preoperative vs. postoperative improvement in motor symptoms, and the results of intraoperative MER and the occurrence of surgery-related complications were documented and analyzed.
Results
All patients successfully completed the implantation surgery. The electrodes were accurately implanted at the right position and there was no significant difference between the general anesthesia group and the local anesthesia group in UPDRS-Ⅲ scores and medication dosage differences before and after the operation. No intracranial hemorrhage, cerebral infarction, or infection occurred after the operation, and 5 patients had temporary mental and behavioral abnormalities, which disappeared within 48 hours after the operation.
Conclusion
The postoperative therapeutic effect of STN-DBS surgery for primary Parkinson's disease under general anesthesia is comparable to that of the traditional STN-DBS surgery under local anesthesia. When the operation is performed under general anesthesia, the incidence of surgery and anesthesia-related complications is low if patients are managed strictly, and patients would also experience improved surgical comfort.
Keywords: Parkinson's disease, Deep brain stimulation, Subthalamic nucleus, General anesthesia
原发性帕金森病(Parkinson’s disease, PD)是常见的中枢神经系统变性疾病,隐袭起病,进展缓慢,主要病理改变为黑质多巴胺能神经元退行性变和路易小体形成,导致纹状体多巴胺递质减少。主要临床特征为运动迟缓、静止性震颤、肌强直和姿势平衡障碍[1],同时伴各种非运动症状,如嗅觉障碍、便秘、睡眠障碍等[2]。参照国内外相关指南,对于药物疗效欠佳的进展期PD患者,可以考虑药物联合手术的综合治疗。脑深部电刺激手术(deep brain stimulation, DBS)被认为是晚期PD患者的首选外科手术,其中丘脑底核电刺激术(subthalamic nucleus stimulation, STN-DBS)因可更大程度地减少患者用药量而被广泛采用[3-4]。
经典的STN-DBS手术在电极植入过程中,通常使用局部麻醉,使患者在清醒状态下接受脑部手术,因此术中患者易出现恐慌、焦虑,以及难以耐受头部长时间固定等影响手术操作的问题,特别是部分症状严重的患者,在药物“关”期时无法良好地配合完成术中测试,导致手术时间延长从而降低手术效果[5-6]。近年来有学者开始探索新的治疗方式,尝试通过全身麻醉,对原发性PD患者施行DBS[7-8],但此方法还存在很大的争议。本研究旨在通过分析在我科行全身麻醉下双侧STN-DBS手术的30例原发性PD患者术前资料及术后症状改善情况,为临床开展全身麻醉下STN-DBS手术提供新的依据。
1. 资料与方法
1.1. 研究对象
本研究为回顾性研究,以2019年1月–2021年12月在我院接受双侧STN-DBS治疗,且符合纳入标准的PD患者为研究对象(四川大学华西医院伦理委员会:伦理批准号2021年审1495号),局部麻醉组和全身麻醉组各纳入30名患者。
纳入标准:①全麻下或局麻下完成的STN-DBS手术患者;②患者为诊断明确的原发性PD〔符合国际运动障碍协会(MDS)PD诊断标准[1]〕。③术前左旋多巴冲击试验对运动症状(UPDRS-Ⅲ评分)的改善率>30%,且认知功能正常[9]。④刺激器工作正常,线路通畅。⑤手术前后临床和影像学随访资料完整。
排除标准:①既往有严重颅脑外伤、畸形或颅脑手术史患者。②临床随访时间小于3个月或相关资料不完整。
1.2. 研究方法
1.2.1. 术前靶点定位
术前行无框架头部3.0TMRI薄层扫描(扫描序列包括:T1加权和T2加权图像,扫描层厚1.5~2 mm、层间距为0 mm)。使用SPS手术计划系统(Surgi-plan, Elekta AB Sweden),进行手术预计划设计,规划穿刺针道,避开脑沟、脑室及血管等重要组织。手术当日在局麻下安装立体定向框架,然后行头颅CT薄层平扫(层厚1 mm、层间距为0)。利用SPS系统,将CT影像与术前头部MRI图像进行融合[10],导入预计划方案,确认丘脑底核坐标数据。
1.2.2. 麻醉及监测方式
局麻组患者在切皮前予以罗哌卡因1支(75 mg/10 mL/支)局部头皮浸润麻醉,全麻组患者常规经口气管插管全身麻醉,使用常规全麻药物丙泊酚,术中使用芬太尼镇痛。麻醉诱导阶段使用短效肌松药,气管插管成功以后不再继续追加肌松药。以脑电双频指数(BIS)监测和控制麻醉深度,调整麻醉药物剂量,使BIS值维持在60左右,直至术中电生理监测完成。
1.2.3. 手术方式
麻醉成功以后,患者取仰卧位,消毒铺巾后安装Leksell立体定向手术弧架,设定穿刺靶点坐标及角度,在穿刺导针引导下,在双侧额部皮肤上标记穿刺点,做弧形头皮切口,常规颅骨钻孔,安装固定颅骨锁。核对靶点坐标后,切开硬脑膜,缓慢植入脑穿刺针至目标靶点上方20 mm处。拔除穿刺针芯,缓慢植入微电极,自靶点上10 mm开始,进行微电极记录(MER)。通常记录至STN核团放电结束或靶点下方5 mm。根据MER记录结果,植入DBS电极至相应位置,固定电极,将多余电极埋藏至皮下,逐层缝合头皮切口。手术第二阶段均采用全身麻醉,拆除手术头架,患者取平卧位,重新消毒铺巾后,在胸廓锁骨下胸大肌以浅皮下植入刺激发生器(IPG),经颈部皮下植入延伸导线,并与IPG妥善连接。检测确认线路通畅,刺激器参数正常后,缝合切口,结束手术。患者植入脑深部电极为4触点,0.5 mm间隔DBS电极,植入IPG品牌包括:RZ可充电电池(品驰公司,PINS),RC/PC可充电/不可充电电池(美敦力公司,Medronic),景昱不可充电电池(景昱医疗,Sceneray)。所有患者植入电极手术结束后立即行薄层CT(1 mm)扫描,并与术前MRI图像融合来验证靶点位置(图1),同时排除颅内出血等相关并发症。术后2 h恢复正常服药,6 h后恢复正常饮食,术后立即复查头部CT并与与术前MRI图像融合,验证电极植入位点。脑深部电极与刺激发生器植入一次性完成,术后第一天鼓励患者正常下床活动,术后短期内使用抗生素预防感染。
图 1.
The fusion of postoperative CT and preoperative MRI image to verify the accuracy of electrode implantation
术后复查CT与术前MRI图像融合,验证电极植入位点
A: The fusion of postoperative CT and preoperative MRI image; B: The actual position of the electrodes were reconstructed by the LEADDBS system through the preoperative MRI image and postoperative thin-slide CT. The silver parts are bilateral four contact electrodes; the orange parts are the subthalamic nuclei.
1.2.4. 术后程控
术后3~4周,参照本中心快速程控法[11],进行刺激器开机,以避免微毁损效应影响术后程控和疗效。
1.2.5. 随访
出院后定期随访,记录患者手术后3个月和6个月UPDRS-Ⅲ评分,药物使用情况及并发症。
1.2.6. 疗效评估
采用统一帕金森病评价量表第三部分(UPDRS-Ⅲ)评分来评价患者手术后运动症状,由于术前左旋多巴冲击试验对运动症状UPDRS-Ⅲ评分的改善率>30%作为纳入条件,术后UPDRS-Ⅲ评分降低且改善率>30%被认为具有临床意义〔改善率=(术前评分−术后评分)/术前评分〕,记录和分析术中MER结果以及手术相关并发症发生情况。
1.2.7. 统计学方法
计数资料以相对数构成率(%)表示,呈正态分布的计量资料以
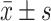 表示。采用配对t检验,P≤0.05为差异有统计学意义。
表示。采用配对t检验,P≤0.05为差异有统计学意义。
2. 结果
局部麻醉组和全身麻醉组患者年龄、性别比、病程和术前评分等基线资料差异无统计学意义,两组围手术期的UPDRS-Ⅲ评分及药物使用剂量差异也无统计学意义。全麻组患者术后3个月和6个月UPDRS-Ⅲ评分(药物“关”期)评分与术前相比降低明显,同时术后使用左旋多巴等效剂量与术前差异也有统计学意义,术后3个月和6个月的症状改善率分别为(51.87±6.80)%和(54.93±7.30)%(表1)。
表 1. The baseline characteristics and perioperative outcomes of patients with Parkinson’s disease under local anesthesia and general anesthesia.
原发性PD的全麻患者和局麻患者的基本资料及围手术期主要结果对照
| Item | Local anesthesia group (n=30) | General anesthesia group (n=30) | P |
| LEDD: Levodopa equivalent daily doses; UPDRS-Ⅲ: Unified Parkinson’s disease rating scale-Ⅲ. | |||
| Characteristics | |||
| Age/yr. | 59.7±9.0 | 62.9±6.6 | 0.119 |
| Male/case (%) | 18(60.0) | 15 (50.0) | 0.436 |
| Duration of disease/years | 9.9±4.2 | 9.1±3.2 | 0.410 |
| Medication (mg/d) | |||
| LEDDs before operation | 773.5±44.5 | 856.8±52.0 | 0.229 |
| LEDDs after operation | 495.5±40.3 | 514.8±41.5 | 0.740 |
| Preoperative UPDRS-Ⅲ score | 43.6±10.4 | 40.8±11.1 | 0.313 |
| Postoperative UPDRS-Ⅲ score | |||
| After 3 months | 18.2±4.7 | 19.0±3.5 | 0.495 |
| After 6 months | 18.2±4.4 | 18.7±3.6 | 0.678 |
所有患者术中生命体征控制平稳,未发生术中知晓;术后未发生颅内出血、脑梗塞及感染。全麻组5例患者全麻苏醒后出现幻觉、烦躁等暂时性精神行为异常,均在术后24 h内消失;22例患者术后短期内自觉相同服药情况下,PD症状改善更佳或药物“开”期时间延长;19例患者术后出现药物“开”期异动,其中15例患者异动轻微,患者无明显不适,未予治疗,4例患者异动明显,给予减少左旋多巴用量后,异动症状明显改善。所有患者均在术后3~4 d正常出院。至最后一次随访,没有发现术后感染、设备异常等情况。
3. 讨论
PD患者接受STN-DBS手术的关键点之一,即为安全、准确地将DBS电极植入到目标靶点。局麻STN-DBS手术虽然已经得到有力推广,但术中患者头部长时间固定于一个特定位置,易导致患者难以耐受手术,再加上患者术中普遍会出现紧张、恐惧等情绪,为手术麻醉管理带来挑战,甚至影响到患者的术中测试。即使顺利完成手术的患者,也会经历局麻手术的不良体验。为了改善患者手术舒适度,同时便于手术过程的管理及术中患者生命体征管理,在全麻下行脑深部电刺激术成为一个合适的选择。但是在全麻状态下,术者无法进行术中DBS电极刺激测试疗效来验证电极植入精准度,因此,全麻DBS手术的开展还存在一定的技术挑战及争议。近年来,立体定向手术计划系统已经普遍运用于DBS手术,该系统的图像融合功能,可以将不同时间段采集的图像进行融合从而精准定位目标靶点,为手术的开展提供了良好的技术支撑。本团队采用了上述经典的CT-MRI图像融合技术,能够帮助精确定位丘脑底核[10],为脑深部电极的准确植入提供了依据。
在全球范围内全麻下脑深部电极植入术尚不成熟,技术层面还在进一步研究。所以我们回顾国内近5年大型中心报道的局部麻醉下双侧STN-DBS手术的原发性PD患者的资料和并发症发生的情况[12-15],我中心的局麻组及全麻组在术后(“关”期)UPDRS-Ⅲ评分及改善率等方面都比较接近。考虑到在数据对比性的方面,不同帕金森中心患者的基础资料也不同,在手术技术和术后调控水平也不同,本中心虽然对比了国内领先帕金森中心的数据,且本中心于2020年初开始正式采用全麻下脑深部电极植入术,但完成病例数有限,术后随访时间不够长,相关技术细节及远期疗效还需要更多大样本量的研究来充分验证。
STN-DBS手术的电极植入精度将直接影响到术后疗效。局麻状态下,可以通过临时电刺激来验证电极位置,而全麻患者则无法进行。本组患者使用了MER技术来弥补上述不足。该方法可以敏感捕捉STN核团高频、簇状放电,并可根据采集的电信号特点,推断电极位置,被不少DBS手术中心采用。但值得注意的是,麻醉过深,将显著抑制STN核团电活动,导致MER记录失败。为确保患者在电极植入测试过程中处于浅麻醉和无感知状态,本组患者在手术过程中,使用BIS来持续监测并控制麻醉深度。在患者完成麻醉诱导和插管后,逐渐缓慢减少麻醉药物用量,使患者BIS值逐渐上升,在进行术中MER测试时,将BIS指数维持在60左右。在此状态下,本组患者成功采集到STN核团放电,准确植入电极后未发生术中知晓事件。本组患者术后3~6个月帕金森病运动症状缓解明显,药物使用量显著降低,通过与同期报道的局麻植入手术结果对照分析[12-15],全身麻醉下的双侧STN-DBS手术对PD患者运动功能的改善与局部麻醉相当。
患者术前均已充分告知全麻或局麻手术过程,并由患者自愿选择全麻或局麻电极植入过程。全麻手术患者均对局麻电极植入过程表示不同程度焦虑或恐惧,而自愿接受全麻手术。所有患者术中生命体征控制平稳,术后均未诉术中不适感。而对比本团队既往局麻手术病例情况以及文献报道[12-15],大多数接受局麻手术的患者术中均有不同程度的不适感,例如:疼痛、焦虑、恐慌,无法承受长时间仰卧位等不适[16]。因此,在全麻下完成脑深部电极植入手术,患者在舒适感方面更胜一筹,体验感更佳,针对一些精神状况不稳定,配合能力较差的患者,使用全麻下手术的接受度将更高。
有文献报道[17]局麻下脑深部电极植入术,围术期颅内出血及梗塞的发生率为1%~3%。本组患者围术期未发生颅内出血、脑梗塞及感染,5例患者出现暂时性精神行为异常,均在术后24 h内消失,考虑与全麻药物使用有关。根据以往文献报道,全身麻醉对记忆力和认知功能有不同程度的影响[18-19],但结合最近的研究表明,全身麻醉对认知功能的影响可在短期内(通常 1 周)恢复[20]。FLUCHERE等[21]对不同麻醉方式下STN-DBS治疗PD的疗效进行对比分析,结果发现局部麻醉和全身麻醉对认知功能的影响并无显著性差异。虽然全麻STN-DBS手术对患者的认知功能会造成短期的轻微影响,但患者手术体验更佳,围术期间严重并发症发生概率低,已经展现出良好的应用前景。全身麻醉和局部麻醉两种方式下的电极植入手术方式各有利弊,应该根据患者和手术中心的具体情况综合考虑。
UPDRS-Ⅲ评分是评价STN-DBS手术治疗原发性PD患者术后效果最为重要的参考指标。本次研究中,在全麻下行双侧STN-DBS手术后3个月和6个月UPDRS-Ⅲ评分(药物“关”期)较术前明显降低,表明在全麻下患者依然可以取得显著的效果。同时,对比分析全麻组和局麻组患者围手术期有效左旋多巴等效剂量和术后3个月、6个月UPDRS-Ⅲ评分(药物“关”期)之间的差异,两组之间围手术期的UPDRS-Ⅲ评分及药物使用剂量均无明显差异,这表明全麻STN-DBS手术治疗PD的术后疗效与传统局麻下电极植入手术疗效相当。由于在两种麻醉方式下进行双侧STN-DBS手术有其优缺点,因此探索全麻手术方案并不是为了确定哪种方法对最终电极放置有重要影响或获得更好的运动改善,应根据患者和手术中心的具体情况综合考虑。在严格管理情况下,手术和麻醉相关并发症发生率低,并且能提高患者的手术舒适度。综上所述,全麻下行双侧STN-DBS手术治疗原发性PD显示了良好的应用前景。然而,未来的大型随机临床研究应验证临床证据的准确性;此外,可能会出现一些更新和更好的基于睡眠的DBS技术。
* * *
利益冲突 所有作者均声明不存在利益冲突
Contributor Information
艺峰 师 (Yi-feng SHI), Email: 278584963@qq.com.
鹏 李 (Peng LI), Email: lipeng_md@163.com.
References
- 1.STEBBINS G, GOETZ C, BURN D, et al How to identify tremor dominant and postural instability/gait difficulty groups with the movement disorder society unified Parkinson's disease rating scale: comparison with the unified Parkinson's disease rating scale. Move Dis. 2013;28(5):668–670. doi: 10.1002/mds.25383. [DOI] [PubMed] [Google Scholar]
- 2.POSTUMA R, BERG D, STERN M, et al MDS clinical diagnostic criteria for Parkinson's disease. Move Dis. 2015;30(12):1591–1601. doi: 10.1002/mds.26424. [DOI] [PubMed] [Google Scholar]
- 3.BENABID A, POLLAK P, LOUVEAU A, et al Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol. 1987;50:344–346. doi: 10.1159/000100803. [DOI] [PubMed] [Google Scholar]
- 4.LIU Y, LI W, TAN C, et al Meta-analysis comparing deep brain stimulation of the globus pallidus and subthalamic nucleus to treat advanced Parkinson disease. J Neurosurg. 2014;121(3):709–718. doi: 10.3171/2014.4.Jns131711. [DOI] [PubMed] [Google Scholar]
- 5.BLASBERG F, WOJTECKI L, ELBEN S, et al Comparison of awake vs. asleep surgery for subthalamic deep brain stimulation in Parkinson's disease. Neuromodulation. 2018;21(6):541–547. doi: 10.1111/ner.12766. [DOI] [PubMed] [Google Scholar]
- 6.HAGELWEIDE K, SCHÖNBERGER A, KRACHT L, et al Motor cognition in patients treated with subthalamic nucleus deep brain stimulation: Limits of compensatory overactivity in Parkinson's disease. Neuropsychologia. 2018;117:491–499. doi: 10.1016/j.neuropsychologia.2018.07.007. [DOI] [PubMed] [Google Scholar]
- 7.WANG J, PONCE F, TAO J, et al Comparison of awake and asleep deep brain stimulation for Parkinson's disease: A detailed analysis through literature review. Neuromodulation. 2020;23(4):444–450. doi: 10.1111/ner.13061. [DOI] [PubMed] [Google Scholar]
- 8.HO A, ALI R, CONNOLLY I, et al Awake versus asleep deep brain stimulation for Parkinson's disease: a critical comparison and meta-analysis. J Neurol Neurosurg Psychiatry. 2018;89(7):687–691. doi: 10.1136/jnnp-2016-314500. [DOI] [PubMed] [Google Scholar]
- 9.中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 中华医学会《中华全科医师杂志》编辑委员会, 神经系统疾病基层诊疗指南编写专家组 帕金森病基层诊疗指南(2019年) 中华全科医师杂志. 2020;19(1):5–17. doi: 10.3760/cma.j.issn.1671-7368.2020.01.003. [DOI] [Google Scholar]
- 10.GEEVARGHESE R, O'GORMAN TUURA R, LUMSDEN D, et al Registration accuracy of CT/MRI fusion for localisation of deep brain stimulation electrode position: An imaging study and systematic review. Stereotact Funct Neurosurg. 2016;94(3):159–163. doi: 10.1159/000446609. [DOI] [PubMed] [Google Scholar]
- 11.LI P, MAO B, SHANG H, et al Pilot study on a fast postoperative programming approach to subthalamic nucleus stimulation in Parkinson's disease. Neurology India. 2011;59(5):669–673. doi: 10.4103/0028-3886.86538. [DOI] [PubMed] [Google Scholar]
- 12.王澍,赵萌,王军,等 不同麻醉方式下帕金森病脑深部电刺激术疗效对比分析. 中国现代神经疾病杂志. 2020;20(12):41–49. doi: 10.3969/j.issn.1672-6731.2020.12.006. [DOI] [Google Scholar]
- 13.曲婧,刘济源,李变芳,等 帕金森病患者不同麻醉方式下脑深部电刺激术中丘脑底核电生理监测对比分析. 中国现代神经疾病杂志. 2020;20(12):34–40. doi: 10.3969/j.issn.1672-6731.2020.12.005. [DOI] [Google Scholar]
- 14.党圆圆, 夏小雨, 杨艺, 等 全麻下单纯影像学引导的帕金森病丘脑底核脑深部电刺激手术的效果分析. 中华神经创伤外科电子杂志. 2020;6(6):350–355. doi: 10.3877/cma.j.issn.2095-9141.2020.06.006. [DOI] [Google Scholar]
- 15.刘叔衡, 曹中生, 曹纹平, 等 全身麻醉和CT-MRI图像融合技术在帕金森病DBS手术中的应用. 立体定向和功能性神经外科杂志. 2017;30(6):369–372. [Google Scholar]
- 16.BRODSKY M, ANDERSON S, MURCHISON C, et al Clinical outcomes of asleep vs awake deep brain stimulation for Parkinson disease. Neurology. 2017;89(19):1944–1950. doi: 10.1212/wnl.0000000000004630. [DOI] [PubMed] [Google Scholar]
- 17.CHEN T, MIRZADEH Z, CHAPPLE K, et al Complication rates, lengths of stay, and readmission rates in "awake" and "asleep" deep brain simulation. J Neurosurg. 2017;127(2):360–369. doi: 10.3171/2016.6.JNS152946.Epub2016Sep23. [DOI] [PubMed] [Google Scholar]
- 18.COMBS H, FOLLEY B, BERRY D, et al Cognition and depression following deep brain stimulation of the subthalamic nucleus and globus pallidus pars internus in Parkinson's disease: A meta-analysis. Neuropsychol Rev. 2015;25(4):439–454. doi: 10.1007/s11065-015-9302-0. [DOI] [PubMed] [Google Scholar]
- 19.LIU Z, HE S, LI L General anesthesia versus local anesthesia for deep brain stimulation in Parkinson's disease: A meta-analysis. Stereotact Funct Neurosurg. 2019;97(5/6):381–390. doi: 10.1159/000505079.Epub2020Jan21. [DOI] [PubMed] [Google Scholar]
- 20.NIR T, JACOB Y, HUANG K, et al Resting-state functional connectivity in early postanaesthesia recovery is characterised by globally reduced anticorrelations. Brit J Anaesth. 2020;125(4):529–538. doi: 10.1016/j.bja.2020.06.058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.FLUCHERE F, WITJAS T, EUSEBIO A, et al Controlled general anaesthesia for subthalamic nucleus stimulation in Parkinson's disease. J Neurol Neurosurg Psychiatry. 2014;85(10):1167–1173. doi: 10.1136/jnnp-2013-305323. [DOI] [PubMed] [Google Scholar]



