Abstract
目的
通过2016–2017年及2019–2020年两次人群调查,了解成都市甲状腺疾病患病率及碘营养状况及相关危险因素数据,为卫生行政决策提供依据。
方法
分别于2016年10月–2017年12月、2019年12月–2020年2月进行人群抽样调查。第一次调查采用分层整群随机抽样方法,选择成都市城市和农村各2个社区居民为调查对象;第二次调查采用序贯整群抽样选择成都市龙泉驿区周边社区居民。两次均选择18岁以上符合入选标准的自然人群为调查对象,第一次进行问卷调查、体格检查、甲状腺超声、血清甲状腺功能和尿碘检查,第二次仅进行甲状腺疾病患病情况问卷及一般情况的调查。统计分析碘营养状况、甲状腺疾病患病率及可能的危险因素。
结果
第一次纳入受试者1859人、第二次纳入16152人。第一次调查结果显示成人尿碘中位质量浓度为172.10 μg/L,碘足量或超足量人群占调查人数60%以上。甲状腺疾病患病率:显性甲亢(0.48%)、亚临床甲亢(0.43%)、Grave’s病(0.43%)、显性甲减(1.34%)、亚临床甲减(16.62%)、甲状腺抗体阳性(16.73%)、甲状腺过氧化物酶抗体阳性(12.96%)、甲状腺球蛋白抗体阳性(10.06%)、甲状腺肿(0.81%)、单个结节(14.85%)、多个结节(14.42%)、甲状腺结节(29.26%)。碘过量是亚临床甲减的危险因素(比值比=1.50, 95%可信区间:1.07~2.10,P<0.05),碘缺乏是多个甲状腺结节的危险因素(比值比=1.45,95%可信区间:1.02~2.05,P<0.05)。两次调查甲亢、甲减、桥本氏甲状腺炎三种甲状腺疾病总患病率分别为6.58%和5.95%,没有明显差异。第二次调查缺乏甲状腺结节的准确数据。
结论
近年来成都市居民碘营养水平适宜,甲亢、甲减、桥本氏甲状腺炎三种甲状腺疾病患病率保持稳定,甲状腺结节患病率上升。应该继续实施食盐加碘政策并做好监测,同时积极寻找甲状腺结节的病因。
Keywords: 碘营养, 甲状腺疾病, 患病率, 危险因素
Abstract
Objective
To investigate the prevalence of thyroid disorders, iodine nutritional status and relevant risk factors among adults in Chengdu city on the basis of two population-based surveys, one conducted between 2016 and 2017 and the other, between 2019 and 2020, and to provide references for making health-related administrative decisions.
Methods
Two population-based sampling surveys were conducted. The first one was done between October 2016 and December 2017, using stratified cluster random sampling to select subjects from 2 urban and 2 rural communities in Chengdu. Then, between December 2019 and February 2020, sequential cluster sampling was used to select subjects from communities in the peripheral regions of Longquanyi District, Chengdu. Both surveys covered natural populations of people who were 18 or older and who met the inclusion criteria. In the first survey, questionnaires, physical examination, thyroid ultrasound, and examinations of serum thyroid biochemical markers and urine iodine were performed, while in the second survey, only questionnaire concerning thyroid disorders and physical examination were performed. Statistical analysis of the nutritional status of iodine, the prevalence of thyroid disorders, and potential risk factor was conducted.
Results
A total of 1859 subjects were enrolled for the first survey and 16152 for the second. According to the results of the first survey, the median urine iodine concentration was 172.10 μg/L, and the group with adequate or more than adequate iodine accounted for more than 60% of the surveyed population. The prevalence of thyroid disorders was found to be 0.48% for overt hyperthyroidism, 0.43% for subclinical hyperthyroidism, 0.43% for Grave's disease, 1.34% for overt hypothyroidism, 16.62% for subclinical hypothyroidism, 16.73% for positive thyroid antibody, 12.96% for TPOAb positive, 10.06% for TGAb positive, 0.81% for goiter, 14.85% for single nodule, 14.42% for multi-nodules, and 29.26% for thyroid nodules. Excess iodine is a risk factor for subclinical hypothyroidism (OR=1.50, 95% confidence interval [CI]: 1.07-2.10, P<0.05), and iodine deficiency is a risk factor for multiple thyroid nodules (OR=1.45, 95% CI: 1.02-2.05, P<0.05). The total prevalence of hyperthyroidism, hypothyroidism and Hashimoto's thyroiditis in the two surveys was 6.58% and 5.95%, respectively, showing no significant difference. The second survey lacked accurate data on thyroid nodules.
Conclusion
The iodine nutritional status of adults in Chengdu in recent years was appropriate. The total prevalence of hyperthyroidism, hypothyroidism and Hashimoto's thyroiditis remained stable, while that of thyroid nodule increased in recent years. We should continue with the implementation of the universal salt iodization policy and reinforce efforts in monitoring. Furthermore, we should make an active effort to look into the etiology of thyroid nodules.
Keywords: Iodine nutrition, Thyroid disorders, Prevalence, Risk factors
甲状腺疾病是内分泌系统常见疾病,涉及许多病因不同的疾病分类,是最主要的公共卫生问题之一。碘是甲状腺激素合成不可或缺的重要元素,碘过量或不足都会引起不同程度的甲状腺疾病[1-2]。中国大陆地区自1996年开始实施全面食盐加碘政策(universal salt iodization, USI),逐步解决了我国长期存在的碘营养不良及碘缺乏病(iodine deficiency disease, IDD)难题,为世界范围内碘缺乏病的防治做出了重要贡献。近年来流行病学调查研究发现某些甲状腺疾病如亚临床甲减、甲状腺结节等患病率逐渐升高,而另一些甲状腺疾病如甲状腺肿患病率下降[3],这是否与碘营养状况改变等因素有关仍然不清楚。成都市位于中国西南部,是典型的内陆城市,生活及饮食习惯与中国其它地区差别较大。我国在2012年修改了USI法规,颁布了食盐加碘的新国家标准(GB26878-2011),四川省也制定了相应的碘盐政策。成都市上一次的碘营养状况和甲状腺疾病的流行病学调查是在2010年,因此本研究旨在新国家标准执行后,就2016–2017年与2019–2020年获得的两次成都市居民碘营养状况及甲状腺疾病患病情况调查数据进行对比,比较甲状腺疾病患病率变化,为卫生行政决策提供参考。
1. 对象与方法
1.1. 研究对象
本研究数据分别来源于两次调查。第一次调查时间为2016年10月–2017年12月,采用分层整群随机抽样,选取来自成都市城区和农村的各2个社区;第二次调查时间为2019年12月–2020年2月,以成都市龙泉驿区周边社区自然人群为调查对象。第一次调查纳入标准为:18周岁或以上、在选定社区居住超过5年、非孕产妇、3个月内未使用过含碘药物和造影剂者。第二次调查纳入标准为:20周岁以上且具有当地户籍或非本地户籍当地居住时间达6个月以上的受试者。第一次调查共计纳入1897人,排除性别、年龄、甲状腺功能等相关信息不全者38人后,最终获得城市居民1055人、农村居民804人数据。第二次调查共获得16388人数据,排除信息不全数据后,共获得16152例有效数据。
1.2. 调查方法
对于第一次调查,问卷调查受试者一般情况、甲状腺疾病个人史及家族史、吸烟史、碘盐使用情况。体格检查身高、体质量、体质量指数(BMI)、血压(BP)、腰围、静息心率(HR)、甲状腺触诊。收集受试者空腹晨血检测:促甲状腺激素(TSH)、对于TSH超出参考值范围者加测游离甲状腺素(FT4)和游离三碘甲状腺氨酸(FT3)以及促甲状腺激素受体抗体(TRAb)、甲状腺过氧化物酶抗体(TPOAb)、甲状腺球蛋白抗体(TGAb)。收集受试者空腹晨尿检测尿碘质量浓度(urine iodine concentration, UIC),具体方法为:收集清洁中段尿5 mL于尿杯后立即放−20 ℃保存,避免反复冻融,尽快冷链统一配送至中心实验室检测。尿碘检测采用电感耦合等离子体质谱法(ICP-MS,Agilent 7700x,美国安捷伦科技有限公司),尿碘检测标准品来自国标检测认证有限公司(GBW09108、GBW9109、GBW9110)[4-5]。甲状腺功能检测采用免疫化学发光法,甲状腺B超使用美国通用公司的B超机(GE LOGIQ 100 PRO, 探头分辨率7.5 Hz)。根据WHO标准,尿碘<100 μg/L为碘摄入不足(deficient iodine intake, DI),100~199 μg/L为碘摄入适量(adequate iodine intake, AI),200~299 μg/L为碘摄入超足量(more than adequate iodine intake, MAI),300 μg/L及以上为碘摄入过量(excessive iodine intake, EI)[6]。第一次调查属于甲状腺疾病和碘营养状况的全国调查(TIDE)项目,已获中国医科大学附属第一医院伦理委员会批准(AF-SOP-07-1.0-01),所有受试者均签署知情同意书。第二次调查采用问卷调查受试者目前明确诊断的甲状腺疾病及家族史、吸烟史,体格检查收集一般情况,所有受试者均签署知情同意书,该研究获四川大学华西医院伦理委员会批准(2018年审491号)。
1.3. 诊断标准
根据《中国甲状腺疾病诊治指南》及历次全国范围内大型流行病学调查,制定本次流行病学调查诊断标准诊断甲状腺疾病[3, 7-8],根据世界卫生组织碘摄入量分类标准对受访人群做出碘营养状况分类,如表1所示。
表 1. Diagnostic criteria for thyroid disorders.
甲状腺疾病诊断标准
| Thyroid disorders | Diagnostic criteria[3, 7-8] |
| Overt hyperthyroidism | TSH<0.27 mIU/L; FT4>22 pmol/L or FT3>6.8 pmol/L |
| Subclinical hyperthyroidism | TSH<0.27 mIU/L; FT4 12.0–22.0 pmol/L; FT3 3.1–6.8 pmol/L |
| Grave’s disease | Overt hyperthyroidism or subclinical hyperthyroidism; TRAb>1.75 IU/L or a diffuse goiter on B-mode ultrasonography |
| Overt hypothyroidism | TSH>4.2 mIU/L; FT4<12 pmol/L |
| Subclinical hypothyroidism | TSH>4.2 mIU/L; FT4 within the normal range |
| Positive thyroid antibody | TGAb positivity or TPOAb positivity |
| TPOAb positivity | TPOAb>34 IU/mL |
| TGAb positivity | TGAb>115 IU/mL |
| Goiter | Female>22.5 mL; Male>25.4 mL |
| Thyroid nodule | One or more nodules (>5 mm) without goiter |
1.4. 统计学方法
计数资料用百分率表示,组间比较采用χ2/趋势χ 2检验或Fisher确切概率法。正态分布的计量资料采用
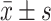 表示, 组间比较采用t检验,非正态分布的计量资料采用中位数(P25,P75)表示,组间比较采用非参秩和检验。采用logistic回归分析不同尿碘水平与甲状腺疾病之间的关系。P<0.05为差异有统计学意义。
表示, 组间比较采用t检验,非正态分布的计量资料采用中位数(P25,P75)表示,组间比较采用非参秩和检验。采用logistic回归分析不同尿碘水平与甲状腺疾病之间的关系。P<0.05为差异有统计学意义。
2. 结果
2.1. 一般资料
第一次研究共纳入成都市成人居民1897人,其中城市居民1071人,农村居民826人,除外性别、年龄、甲状腺功能等信息不全者,最终纳入城市居民1055人(56.75%),农村居民804人(43.25%),共计1859人,应答率98.00%。其中女性1056人,占总人数56.80%。所有受试者平均年龄(47.78±15.72)岁(18~90岁),城市和农村、男性和女性年龄比较差异有统计学意义(P<0.001),农村居民身高低于城市居民(P<0.001),BMI、腰围、收缩压、舒张压、心率均高于城市居民(P<0.05),而女性身高、体质量、BMI、腰围、收缩压、舒张压均低于男性(P<0.05),如表2所示。
表 2. General characteristics, urine iodine and TSH of the subjects.
受试者基本特征与尿碘、TSH情况
| Characteristic | Urban (n=1055) | Rural (n=804) | Male (n=803) | Female (n=1056) | Total (n=1859) |
| *P<0.05, **P<0.01, ***P<0.001, vs. urban subjects; #P<0.01, ##P<0.001, vs. male. Δ Data were shown as median (P25, P75) ; BMI: Body mass index; SBP: Systolic blood pressure; DBP: Diastolic blood pressure; HR: Heart rate; UIC: Urine iodine concentration; TSH: Thyroid stimulating hormone. | |||||
| Age/yr. | 45.80±16.70 | 50.38±13.92*** | 49.72±15.13 | 46.31±16.00## | 47.78±15.72 |
| Height/cm | 161.22±8.25 | 158.47±7.91*** | 165.31±7.00 | 156.02±6.65## | 160.03±8.22 |
| Body mass/kg | 61.35±18.71 | 61.06±10.22 | 66.85±20.16 | 56.95±8.83## | 61.22±15.61 |
| BMI/(kg/m2) | 23.54±6.86 | 24.28±3.44* | 24.43±7.56 | 23.42±3.53## | 23.86±5.65 |
| Waistline/cm | 83.45±11.82 | 85.09±10.03** | 87.23±11.68 | 81.83±10.05## | 84.16±11.11 |
| SBP/mmHg | 120.68±18.87 | 132.15±21.69*** | 128.77±19.03 | 123.27±21.96## | 125.65±20.92 |
| DBP/mmHg | 78.18±10.86 | 84.80±12.92*** | 83.15±12.44 | 79.46±11.85## | 81.06±12.24 |
| HR/min-1 | 77.25±10.30 | 78.79±8.58*** | 77.79±10.20 | 78.01±9.17# | 77.91±9.62 |
| Family history/case (%) | 26 (2.46) | 33 (4.10)* | 27 (3.36) | 32 (3.03) | 59 (3.17) |
| Iodized salt/case (%) | 1016 (96.30) | 791 (98.38)** | 787 (98.01) | 1020 (96.59) | 1807 (97.20) |
| Smoking/case (%) | 219 (20.76) | 240 (29.85)*** | 434 (54.05) | 25 (2.37)## | 459 (24.69) |
| UIC/(μg/L)Δ | 198.40 (135.00, 292.90) | 144.44 (102.62, 206.04)*** | 172.10 (126.00, 255.73) | 172.15 (109.24, 256.27) | 172.10 (118.30, 256.00) |
| TSH/(mIU/L)Δ | 2.73 (1.93, 4.06) | 2.23 (1.52, 3.18)*** | 2.29 (1.57, 3.27) | 2.64 (1.86, 3.96)## | 2.49 (1.73, 3.64) |
2.2. 碘营养状况
如表2所示,城市和农村碘盐使用率为97.20%。尿碘质量浓度中位数为172.10 μg/L,城市高于农村(P<0.001),男女性之间尿碘水平没有明显差异(P=0.136)。尿碘水平分布中,DI、AI、MAI、EI的构成比分别为17.48%、42.93%、22.00%、17.59%。TSH中位数为2.49 mIU/L,城市高于农村(P<0.001),女性高于男性(P<0.001)。
2.3. 甲状腺疾病患病情况及与碘营养的关系
如表3所示,甲状腺疾病患病率为:显性甲亢(0.48%)、亚临床甲亢(0.43%)、Grave’s病(0.43%)、显性甲减(1.34%)、亚临床甲减(16.62%)、甲状腺抗体阳性(16.73%)、TPOAb阳性(12.96%)、TGAb阳性(10.06%)、甲状腺肿(0.81%)、单个甲状腺结节(14.85%)、多个甲状腺结节(14.42%)、甲状腺结节(29.26%)。
表 3. Prevalence of thyroid disorders.
不同人群的甲状腺疾病患病率
| Item | OHE/% | SHE/% | GD/% | OHO/% | SHO/% | Antibody
(+)/%a |
TPOAb
(+)/% |
TGAb
(+)/% |
Goiter/% | Nodule-
one/% |
Nodule-
more/% |
Thyroid
noduleb/% |
| a: TPOAb (+) and/or TGAb (+); b: One or more thyroid nodules; OHE: Overt hyperthyroidism; SHE: Subclinical hyperthyroidism; GD: Grave’s disease; OHO: Overt hypothyroidism; SHO: Subclinical hypothyroidism. | ||||||||||||
| Total (n=1859) | 0.48 | 0.43 | 0.43 | 1.34 | 16.62 | 16.73 | 12.96 | 10.06 | 0.81 | 14.85 | 14.42 | 29.26 |
| District | ||||||||||||
| Urban (n=1055) | 0.28 | 0.57 | 0.28 | 1.61 | 21.33 | 16.68 | 12.42 | 11.37 | 0.47 | 16.97 | 14.98 | 31.94 |
| Rural (n=804) | 0.75 | 0.25 | 0.62 | 1.00 | 10.45 | 16.79 | 13.68 | 8.33 | 1.24 | 12.06 | 13.68 | 25.75 |
| P | 0.358 | 0.085 | 0.457 | <0.001 | <0.001 | 0.950 | <0.001 | <0.001 | 0.066 | 0.003 | 0.431 | 0.004 |
| Gender | ||||||||||||
| Male (n=803) | 0.50 | 0.25 | 0.25 | 1.00 | 11.96 | 9.59 | 8.34 | 4.11 | 0.37 | 11.46 | 8.09 | 19.55 |
| Female (n=1056) | 0.47 | 0.57 | 0.57 | 1.61 | 20.17 | 22.16 | 16.48 | 14.58 | 1.14 | 17.42 | 19.22 | 36.65 |
| P | 0.075 | 0.189 | 0.494 | 0.005 | <0.001 | <0.001 | <0.001 | <0.001 | 0.069 | <0.001 | <0.001 | <0.001 |
| Age/yr. | ||||||||||||
| 18-29 (n=306) | 0.00 | 0.98 | 0.65 | 0.00 | 19.28 | 16.34 | 11.11 | 12.75 | 0.33 | 11.11 | 6.21 | 17.32 |
| 30-39 (n=254) | 1.18 | 0.79 | 0.79 | 0.79 | 14.96 | 18.11 | 14.17 | 14.17 | 0.00 | 10.24 | 4.33 | 14.57 |
| 40-49 (n=492) | 0.41 | 0.20 | 0.20 | 1.63 | 14.43 | 17.28 | 13.62 | 8.54 | 1.42 | 14.84 | 11.99 | 26.83 |
| 50-59 (n=356) | 0.56 | 0.56 | 0.56 | 2.25 | 17.70 | 14.61 | 10.96 | 8.71 | 0.56 | 16.29 | 16.57 | 32.87 |
| 60-69 (n=270) | 0.74 | 0.00 | 0.37 | 1.85 | 15.56 | 19.26 | 15.56 | 10.74 | 0.74 | 17.41 | 22.22 | 39.63 |
| 70- (n=181) | 0.00 | 0.00 | 0.00 | 1.11 | 19.89 | 14.36 | 12.71 | 5.52 | 1.66 | 20.99 | 33.15 | 54.14 |
| Ptrend | 0.961 | 0.050 | 0.302 | 0.060 | 0.879 | 0.750 | 0.537 | 0.008 | 0.157 | <0.001 | <0.001 | <0.001 |
| UIC | ||||||||||||
| DI (n=325) | 0.92 | 0.92 | 1.54 | 2.46 | 18.15 | 20.31 | 16.92 | 12.92 | 0.92 | 14.77 | 22.15 | 36.92 |
| AI (n=798) | 0.50 | 0.13 | 0.38 | 1.25 | 15.04 | 16.17 | 12.03 | 9.65 | 1.13 | 14.41 | 15.16 | 28.82 |
| MAI (n=409) | 0.00 | 0.49 | 0.00 | 0.98 | 15.16 | 16.14 | 12.71 | 9.29 | 0.49 | 14.67 | 11.74 | 26.41 |
| EI (n=327) | 0.61 | 0.61 | 0.00 | 0.92 | 20.80 | 15.29 | 11.62 | 9.17 | 0.31 | 16.21 | 10.09 | 26.30 |
| Ptrend | 0.376 | 0.949 | 0.003 | 0.100 | 0.294 | 0.133 | 0.107 | 0.147 | 0.186 | 0.571 | <0.001 | 0.003 |
城市居民显性甲亢的患病率为0.28%,农村居民0.75%,两区域患病率比较差异无统计学意义(P=0.358);男性与女性患病率之间同样未见明显差异(P=0.075);随着年龄增加,显性甲亢患病率没有明显改变(趋势P=0.961),在不同尿碘水平也未见明显差异(P=0.376)。亚临床甲亢在城市居民的患病率为0.57%,农村为0.25%,两地患病率差异无统计学意义(P=0.085),在男女性之间也未见明显差异(P=0.189)。然而亚临床甲亢有随年龄增加患病率下降的趋势(趋势P=0.050),而不同尿碘水平下患病率没有差异(P=0.949)。Grave’s病患病率在不同区域、性别及年龄之间没有明显差别(P>0.05),但随着尿碘质量浓度增加而下降(趋势P=0.003)。
显性甲减的患病率为1.34%,其中城市居民患病率为1.61%,高于农村患病率1.00%(P<0.001),女性高于男性(P=0.005),与年龄和碘营养状况之间没有明显关联(P>0.05)。亚临床甲减患病率城市高于农村(21.33% vs. 10.45%;P<0.001),女性高于男性(20.17% vs. 11.96%;P<0.001),在不同年龄和碘营养状态下患病率没有明显差异。在校正年龄和性别以后发现,EI是亚临床甲减的危险因素(比值比=1.50,95%可信区间:1.07~2.10,P<0.05),如表4所示。
表 4. Relation between UIC and part of thyroid disorders (n=1859) .
尿碘水平与部分甲状腺疾病的关系(n=1859)
| Thyroid
disorders |
OR(95%CI)a | |||
| DI | AI | MAI | EI | |
| a: Adjusted for age and sex; SHO: Subclinical hypothyroidism; DI: Deficient iodine intake; AI: Adequate iodine intake; MAI: More than adequate iodine intake; EI: Excessive iodine intake; OR: Odds ratio; CI: Confidence interval. *P<0.05. | ||||
| SHO | 1.16 (0.82-1.64) | 1 (ref) | 1.02 (0.72-1.43) | 1.50 (1.07-2.10)* |
| Antibody (+) | 1.19 (0.85-1.67) | 1 (ref) | 1.00 (0.71-1.39) | 0.92 (0.64-1.33) |
| TPOAb (+) | 1.36 (0.95-1.96) | 1 (ref) | 1.08 (0.75-1.56) | 0.98 (0.65-1.48) |
| TGAb (+) | 1.24 (0.82-1.87) | 1 (ref) | 0.90 (0.59-1.36) | 0.83 (0.52-1.31) |
| Thyroid nodule | 1.28 (0.96-1.71) | 1 (ref) | 1.08 (0.81-1.43) | 1.20 (0.88-1.63) |
| Nodule-one | 0.94 (0.65-1.36) | 1 (ref) | 1.13 (0.80-1.59) | 1.34 (0.93-1.93) |
| Nodule-more | 1.45 (1.02-2.05)* | 1 (ref) | 0.96 (0.66-1.40) | 0.91 (0.59-1.41) |
甲状腺抗体阳性率为16.73%,其中城市农村地区抗体阳性率没有差异(P>0.05),女性患病率高于男性(22.16% vs. 9.59%,P<0.001)。TPOAb与TGAb阳性率分别为12.96%、10.06%,均呈现明显的区域差异(P<0.001)和性别差异(P<0.001),其中TGAb阳性率随年龄增加而下降(趋势P=0.008),抗体阳性率与尿碘水平之间没有明显关联(P>0.05),如表4所示。
甲状腺结节(包括单个和多个)的患病率为29.26%,城市高于农村(31.94% vs. 25.75%,P=0.004)、女性高于男性(36.65%vs. 19.55%,P<0.001)。单个与多个甲状腺结节患病率分别为14.85%、14.42%,且随年龄增加患病率上升(趋势P<0.001),70岁以上的老人患病率达到50%以上。单个甲状腺结节患病率与碘营养状况没有明显关联,而多个甲状腺结节患病率在DI组高于其他尿碘水平组,校正年龄和性别因素后发现,DI是多个甲状腺结节的危险因素(比值比=1.45,95%可信区间:1.02~2.05,P<0.05),如表4所示。
2.4. 成都市2016–2017年与2019–2020年部分甲状腺疾病患病率
见表5。第二次调查对成都市龙泉驿区周边多个社区进行问卷调查收集主要甲状腺疾病中的甲亢、甲减、桥本氏甲状腺炎患病情况,以两次调查总人口数标化后得出,2019–2020年标化后的总患病率为5.95%,与2016–2017年间的标化患病率6.58%相比没有明显差异(P>0.05);女性患病率为7.55%,低于2016–2017年抽样调查患病率8.35%(P<0.05)。2019–2020年问卷结果显示甲亢、甲减、桥本氏甲状腺炎总患病率随年龄增加而下降,这在2016–2017年抽样调查结果中没有出现。两次调查结果均提示与吸烟者相比,不吸烟者甲状腺疾病患病率明显更高(P<0.001)。而随着BMI升高,甲状腺疾病患病率有下降趋势(P <0.001)。此外,2019–2020年家族史阳性者甲状腺疾病患病率明显高于家族史阴性者( P<0.001)。
表 5. Standardized prevalence of OHE, OHO, HT between 2016–2017 and 2019–2020.
2016–2017年与2019–2020年甲亢、甲减、桥本氏甲状腺炎标准化患病率
| Item | 2016–2017 prevalence/% | 2019–2020 prevalence/% |
| OHE: Overt hyperthyroidism; OHO: Overt hypothyroidism; HT: Hashimoto's thyroiditis; BMI: Body mass index. *P<0.05, vs. 2016–2017. | ||
| Total | 6.58 | 5.95 |
| Gender | ||
| Male | 3.04 | 2.76 |
| Female | 8.35 | 7.55* |
| P | <0.001 | <0.001 |
| Age/yr. | ||
| 18-29 | 6.40 | 6.53 |
| 30-39 | 5.18 | 6.93 |
| 40-49 | 5.86 | 6.09 |
| 50-59 | 6.46 | 6.30 |
| 60-69 | 8.49 | 5.39 |
| 70- | 6.09 | 4.14 |
| Ptrend | 0.401 | 0.001 |
| Smoking | ||
| Yes | 1.81 | 2.32 |
| No | 6.86 | 6.74 |
| P | <0.001 | <0.001 |
| BMI/(kg/m2) | ||
| <18.5 | 7.22 | 6.90 |
| 18.5-25 | 6.48 | 6.70 |
| >25 | 4.41 | 5.02 |
| Ptrend | <0.001 | <0.001 |
| Family history | ||
| Positive | 11.86 | 22.97 |
| Negative | 5.61 | 5.84 |
| P | 0.082 | <0.001 |
3. 讨论
本文的第一次调查共获得有效数据1859例,发现成人尿碘质量浓度中位数为172.10 μg/L,符合WHO/UNICEF/ICCIDD标准规定的碘适量范围,整体碘营养适中,较2010年的216 μg/L有所下降[7],男性和女性之间尿碘水平没有统计学差异,但是城市地区较农村地区更高,推测可能与成都市区居民收入水平提高,海鲜摄入较过去增加等有关,但是因为没有更详细的饮食问卷调查,还不能肯定此因素的作用。DI(17.48%)与EI(17.59%)构成比接近,符合尿碘代谢的生理变化规律,说明抽样结果代表性较好。四川省于2012年开始实施新颁布的食用盐碘含量标准,食盐中碘含量做了小幅下调,从原标准20~50 mg/kg下调至21~39 mg/kg,根据目前的人群碘营养水平认为食盐碘含量较合适。根据《全国生活饮用水水碘含量调查报告》及历次环境碘水平调查结果,四川省地理环境普遍缺碘,通过食盐加碘预防碘缺乏病十分必要,应该继续实施食盐加碘政策。
显性甲亢(0.48%)患病率与全国整体水平(0.78%)及成都市2010年患病率(1.1%)相比较为稳定,亚临床甲亢及Grave’s病患病率(0.43%,0.43%)与同期全国整体水平(0.44%,0.53%)相当[8-9]。甲亢及亚临床甲亢在不同尿碘水平人群中患病率未见明显差别,而Grave’s病在DI人群中患病率更高,推测可能与DI人群甲状腺抗体阳性率更高有关。
显性甲减和亚临床甲减患病率呈现女性高于男性,农村地区高于城市地区现象,这与农村地区较低的碘营养水平相一致。本研究的多因素Logistic回归分析结果不足以支持DI与甲减和亚临床甲减的关系,但是EI是亚临床甲减的一个危险因素,提示碘摄入过量可能会促进TSH水平上升,这与全国范围内的调查结果相一致。同时我们观察到,城市居民亚临床甲减患病率显著高于农村居民,这是否与城市居民工作和生活方式、精神压力等相关目前还不得而知[10]。在LI等对抗体阳性和阴性人群分层分析时发现,当对年龄作标准化处理后,只有抗体阴性的亚临床甲减患病率随着尿碘浓度的升高而升高,提示这部分升高的亚临床甲减患病率与甲状腺自身免疫无关[8, 11],可能的原因是长期高水平的碘引起的TSH适应性升高,这在动物实验中得到证实:长期高碘喂养的大鼠2型脱碘酶受抑制,诱导TSH水平的升高[12]。需要注意的是,随着年龄的增长,TSH可以呈现生理性升高的趋势,这可能导致真实的亚临床甲减患病率低于调查结果[13]。而另两项研究发现,在TPOAb阴性人群中,显性甲减患病率也与更高的尿碘水平相关[14-15],这在我们的调查结果中没有出现,可能是因为诊断标准的不一致。遗憾的是,本研究未进行反三碘甲状腺原氨酸(rT3)检测,因此无法完全排除正常甲状腺病态综合征的干扰,这是本研究及大部分有关亚临床甲减诊断研究的不足,可能导致其患病率被高估。
甲状腺抗体阳性率在男性和女性之间呈现明显差别,TPOAb阳性率在各年龄组之间未见明显差异,而TGAb阳性率随着年龄的增加逐渐降低。有研究指出随着碘摄入的增加,甲状腺抗体阳性率也增加[16],而另一些研究认为甲状腺抗体的阳性率与碘摄入量呈现U形曲线关系[17]。因此在整体人群经历了碘过量、碘超足量到碘适量并且逐渐趋于稳定以后,可能甲状腺抗体阳性水平会逐渐下降。
甲状腺结节患病率高达29.26%,单个和多个结节患病率几乎持平。一项对1985−2014年间在中国大陆进行的52个研究的meta分析结果指出,自1996年USI后,甲状腺结节的总患病率为22.7%[18],低于成都市水平。有趣的是,DI与多个甲状腺结节明显关联,但是与单个甲状腺结节却没有明显关系。同样的,碘过量也与甲状腺结节没有明显关联,因此目前尚不能将甲状腺结节患病率的增加归因于USI,需要进一步研究以分析其原因。
第二次调查与第一次比较,甲状腺疾病中的甲亢、甲减、桥本氏甲状腺炎总患病率比较稳定。但是问卷调查结果与前一次抽样调查结果之间也出现了不同,如年龄增高,甲亢、甲减、桥本氏甲状腺炎总患病率反而下降,这可能是由于老年患者机体退行性改变,对上述甲状腺疾病的敏感性降低,临床表现不典型而被忽视。此外,BMI与甲亢、甲减、桥本氏甲状腺炎患病率之间似乎呈现负性关联,其原因有待进一步研究。由于没有甲状腺超声数据,因此缺乏甲状腺结节患病率的比较。
强化食盐加碘政策改善了成都地区碘营养不足的状况,成功消除了碘缺乏病,成都市目前碘营养水平适宜。总体来说,大部分甲状腺疾病患病率保持稳定或下降,甲状腺结节患病率上升,因此食盐加碘政策总体利大于弊,应该继续实施并做好监测,同时积极寻找甲状腺结节的病因并做出相应对策。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家卫计委公益性行业科研专项(No. 201402005)、四川省科技计划项目(No. 2014SZ0005)和四川大学华西医院1.3.5工程项目(No. ZYGD18017)资助
References
- 1.ANDERSEN S, IVERSEN F, TERPLING S, et al Iodine deficiency influences thyroid autoimmunity in old age-a comparative population-based study. Maturitas. 2012;71(1):39–43. doi: 10.1016/j.maturitas.2011.10.001. [DOI] [PubMed] [Google Scholar]
- 2.LEUNG A M, BRAVERMAN L E Consequences of excess iodine. Nat Rev Endocrinol. 2014;10(3):136–142. doi: 10.1038/nrendo.2013.251. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.TENG W, SHAN Z, TENG X, et al Effect of iodine intake on thyroid diseases in China. The New England journal of medicine. 2006;354(26):2783–2793. doi: 10.1056/NEJMoa054022. [DOI] [PubMed] [Google Scholar]
- 4.CALDWELL K L, MAXWELL C B, MAKHMUDOV A, et al Use of inductively coupled plasma mass spectrometry to measure urinary iodine in NHANES 2000: Comparison with previous method. Clin Chem. 2003;49(6 Pt 1):1019–1021. doi: 10.1373/49.6.1019. [DOI] [PubMed] [Google Scholar]
- 5.LI Y, DING S, HAN C, et al Concentration-dependent differences in urinary iodine measurements between inductively coupled plasma mass spectrometry and the Sandell-Kolthoff method. Biol Trace Elem Res. 2021;199(7):2489–2495. doi: 10.1007/s12011-020-02381-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.WORLD HEALTH O. Assessment of iodine deficiency disorders and monitoring their elimination: A guide for programme managers. Geneva: World Health Organization, 2007. https://apps.who.int/iris/handle/10665/43781.
- 7.SHAN Z, CHEN L, LIAN X, et al Iodine status and prevalence of thyroid disorders after introduction of mandatory universal salt iodization for 16 years in China: A cross-sectional study in 10 cities. Thyroid. 2016;26(8):1125–1130. doi: 10.1089/thy.2015.0613. [DOI] [PubMed] [Google Scholar]
- 8.LI Y, TENG D, BA J, et al Efficacy and safety of long-term universal salt iodization on thyroid disorders: Epidemiological evidence from 31 provinces of Mainland China. Thyroid. 2020;30(4):568–579. doi: 10.1089/thy.2019.0067. [DOI] [PubMed] [Google Scholar]
- 9.刘洋, 闫哲, 童南伟, 等. 成都地区社区人群甲状腺疾病流行病学调查研究. 广州: 中华医学会第十一次全国内分泌学学术会议, 2012: 146.
- 10.WU K, ZHOU Y, KE S, et al Lifestyle is associated with thyroid function in subclinical hypothyroidism: A cross-sectional study. BMC Endocr Disord. 2021;21(1):112. doi: 10.1186/s12902-021-00772-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.WAN S, QU M, WU H, et al Autoimmune thyroid diseases after 25 years of universal salt iodisation: An epidemiological study of Chinese adults in areas with different water iodine levels. Brit J Nutr. 2020;124(8):853–864. doi: 10.1017/S0007114520001786. [DOI] [PubMed] [Google Scholar]
- 12.LI N, JIANG Y, SHAN Z, et al Prolonged high iodine intake is associated with inhibition of type 2 deiodinase activity in pituitary and elevation of serum thyrotropin levels. Brit J Nutr. 2012;107(5):674–682. doi: 10.1017/S0007114511003552. [DOI] [PubMed] [Google Scholar]
- 13.BIONDI B, CAPPOLA A R, COOPER D S Subclinical hypothyroidism: A review. JAMA. 2019;322(2):153–160. doi: 10.1001/jama.2019.9052. [DOI] [PubMed] [Google Scholar]
- 14.KIM H I, OH H K, PARK S Y, et al Non-immune-related hypothyroidism and its relationship with excess iodine. Eur J Nutr. 2019;58(7):2851–2858. doi: 10.1007/s00394-018-1837-4. [DOI] [PubMed] [Google Scholar]
- 15.PETERSEN M, KNUDSEN N, CARLÉ A, et al Increased incidence rate of hypothyroidism after iodine fortification in Denmark: A 20-year prospective population-based study. J Clin Endocrinol Metab. 2019;104(5):1833–1840. doi: 10.1210/jc.2018-01993. [DOI] [PubMed] [Google Scholar]
- 16.PEDERSEN I B, KNUDSEN N, CARLÉ A, et al A cautious iodization programme bringing iodine intake to a low recommended level is associated with an increase in the prevalence of thyroid autoantibodies in the population. Clin Endocrinol. 2011;75(1):120–126. doi: 10.1111/j.1365-2265.2011.04008.x. [DOI] [PubMed] [Google Scholar]
- 17.WANG B, HE W, LI Q, et al U-shaped relationship between iodine status and thyroid autoimmunity risk in adults. Eur J Endocrinol. 2019;181(3):255–266. doi: 10.1530/EJE-19-0212. [DOI] [PubMed] [Google Scholar]
- 18.ZHAO W, HAN C, SHI X, et al. Prevalence of goiter and thyroid nodules before and after implementation of the universal salt iodization program in mainland China from 1985 to 2014: A systematic review and meta-analysis. PLoS One, 2014, 9(10): e109549[2021-06-28]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4196906/pdf/pone.0109549.pdf. doi: 10.1371/journal.pone.0109549.


