Abstract
9例肠系膜韧带样纤维瘤病患者于2010年1月至2022年5月就诊于温州医科大学附属台州医院,其中男性7例,女性2例,年龄16~59岁;肿瘤位于小肠系膜7例,回盲部系膜1例,横结肠系膜1例;肿瘤最大径3.5~33.0 cm,平均(10.7±8.5)cm,无包膜,界不清,部分病例侵犯肠肌壁组织,切面呈实性,灰白色,质韧。组织病理学检查见梭形的纤维母细胞及肌纤维母细胞平行状、束状或交错排列,埋于大量细胞外胶原内,细胞形态较一致,无明显异型性,核分裂象少见。免疫组织化学检测结果显示,9例患者的肿瘤细胞波形蛋白、β联蛋白均阳性,5例患者α-平滑肌肌动蛋白阳性,Ki-67阳性指数为1%~10%,广谱细胞角蛋白、S-100蛋白、信号转导及转录激活蛋白6、CD117、DOG1、CD34、结蛋白和间变性淋巴瘤激酶均阴性。7例存在CTNNB1基因c.121G>A(p.Thr41Ala)突变,1例c.121G>A(p.Thr41Ala)和c.134C>T(p.Ser45Phe)双突变,1例为野生型。9例患者均接受手术切除,8例无复发及转移;1例半年后复发,再次手术切除后无复发及转移。
Keywords: 胃肠道肿瘤, 韧带样纤维瘤病,肠系膜, 组织病理学, 免疫组织化学, CTNNB1基因, 病例报道
Abstract
Nine cases of mesenteric desmoid-type fibromatosis were diagnosed and treated in Taizhou Hospital, Wenzhou Medical University between January 2010 and May 2022, including 2 females and 7 males, aged 16 to 59 years. The lesions were in the mesentery of small intestine with 7 cases, ileocecal junction with 1 cases and transverse colon with 1 case. The tumors had an unclear boundary and no envelope, the section was solid, gray and tough. The mean maximum diameter was (10.7±8.5) cm (range 3.5-33.0 cm). Microscopically, fusiform fibroblasts and myofibroblasts were parallel, bunched or staggered, buried in a large amount of extracellular collagen. The cell morphology was relatively consistent, without obvious atypia, and mitosis was rare. Immunohistochemistry showed that the tumor cells were positive for vimentin (9/9), β-catenin (9/9), while smooth muscle actin (5/9) stains were focally positive. Ki-67 proliferation index was 1%-10%. Cytokeratin Pan, S-100, STAT6, CD117, DOG1, CD34, desmin and anaplastic lymphoma kinase stains were negative. Genetic analysis showed that there were 7 cases of c.121G>A(p.Thr41Ala) mutation of CTNNB1 gene, 1 case of c.121G>A(p.Thr41Ala) and 1 case of c.134C>T(p.Ser45Phe) double mutation, and 1 case of wild type. Tumors were surgically resected in all 9 cases. Eight cases had no recurrence or metastasis, 1 case had recurrence 6 months later, and no recurrence or metastasis after additional surgical resection.
Keywords: Gastrointestinal tumor; Desmoid-type fibromatosis, mesenteric; Histopathology; Immunohistochemistry; CTNNB1 gene; Case report
DTF是一种成纤维细胞克隆性增生性病变,以浸润性生长和易于局部复发为特征,但不转移,属于中间型局部侵袭性肿瘤。DTF多发生于深部软组织及腹壁等,而原发性或散发性MDF非常罕见[1],且在临床、影像及病理上容易被误诊为梭形细胞肿瘤或炎性增生性病变,需要注意与GIST、孤立性纤维性肿瘤、硬化性肠系膜炎、结节性筋膜炎等进行鉴别。本文对9例原发性MDF病例的临床病理及分子病理学特征进行分析并复习相关文献,以帮助临床医生增加对该病的认识,提高诊断及鉴别诊断水平。本研究符合《赫尔辛基宣言》,通过温州医科大学附属台州医院医学伦理委员会审查(K20230472),豁免患者知情同意。
1. 病例资料
1.1. 一般资料
9例原发性MDF病例均为2010年1月至2022年5月在温州医科大学附属台州医院进行手术治疗的患者,均依据2020版《WHO软组织和骨肿瘤分类》[2]进行病理诊断,临床资料完整,组织切片经两位病理学专家两次独立阅片。男性7例,女性2例,年龄16~59岁,平均年龄为(43.5±16.0)岁,既往有手术史4例。临床表现为腹痛3例,无意中发现腹部肿块2例,体检或其他疾病检查发现3例,小肠系膜巨大肿瘤伴穿孔及继发感染性休克1例,伴直肠腺癌1例。肿块位于小肠系膜7例,回盲部系膜1例,横结肠系膜1例。见表1。
表1.
9例肠系膜韧带样纤维瘤病患者临床和病理资料
| 例 序 | 性 别 | 年龄(岁) | 肿瘤部位 | 病 史 | 临床诊断 | 手术方式 | 肿瘤体积(cm3) | CTNNB1基因突变位点 |
随访时间 (月) |
预 后 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 男 | 57 | 小肠系膜 | 左上腹间歇性疼痛15 d;十余年前因胃穿孔行胃大部切除术 | 盆腔肿块 | 肠系膜肿物+部分小肠切除术 | 6.0×5.0×5.0 | c.121G>A(p.Thr41Ala) | 148 | 无复发 |
| 2 | 男 | 45 | 回肠系膜 | 3个月前无明显诱因下自己发现腹部肿块,发热4 d |
腹腔占位:疑似间 质瘤 |
肠系膜肿物+部分小肠切除术 | 8.0×7.0×7.0 | c.121G>A(p.Thr41Ala) | 142 | 无复发 |
| 3 | 男 | 59 | 小肠系膜 | 十余天前无明显诱因下发现脐周肿块 | 腹部间质瘤 | 肠系膜肿物+部分小肠切除术 | 4.0×3.5×3.0 | c.121G>A(p.Thr41Ala) | 123 | 无复发 |
| 4 | 女 | 16 |
回盲部结肠浆 膜面 |
1个月前因月经不规律进行超声检查,提示子宫上方低回声占位;5岁时因“腹股沟疝”行手术治疗 | 盆腔肿块待查 | 肿物+右半结肠切除术 | 10.5×9.0×8.0 | 野生型 | 101 | 无复发 |
| 5 | 男 | 21 | 回肠系膜根部 | 进食后出现全腹部饱胀不适3个月,15 d前无明显诱因下出现右下腹痛 | 腹盆腔巨大占位 | 肿物+回肠切除术 | 33.0×23.0×14.0 | c.121G>A(p.Thr41Ala) | 75 | 无复发 |
| 6 | 男 | 53 | 横结肠浆膜面 | 体检中结肠镜示“结肠肿块” | 横结肠间质瘤 | 横结肠及肠系膜切除术 | 3.5×3.0×3.0 |
c.121G>A(p.Thr41Ala)、 c.134C>T(p.Ser45Phe) |
60 | 无复发 |
| 7 | 男 | 53 | 小肠浆膜面 | 8 h前无明显诱因下出现寒战,感胸闷气促,呕吐数次,非喷射性,均为胃内容物,CT示“左侧腹腔占位” |
小肠系膜巨大肿瘤 伴穿孔 |
小肠系膜肿瘤+小肠大部切除术 | 11.0×10.0×7.0 | c.121G>A(p.Thr41Ala) | 51 | 半年后复发,再次手术切除后无复发及转移 |
| 8 | 女 | 29 | 空肠系膜 | 5个多月前体检超声检查发现“左上腹肿块”,有剖宫产术史2次 | 疑似肠道间质瘤 | 腹腔肿块+部分空肠切除术 | 13.0×8.0×6.5 | c.121G>A(p.Thr41Ala) | 50 | 无复发 |
| 9 | 男 | 59 | 小肠浆膜面 | 大便次数增多伴黏液血便半年,加重1周,肠镜病理示直肠中分化腺癌;直肠癌根治术中发现小肠系膜肿块;1年余前曾行腹股沟疝手术 | 直肠癌,小肠肿瘤 | 直肠癌根治术;小肠肿瘤切除术(部分小肠切除) | 6.6×6.5×6.0 | c.121A>G(p.Thr41Ala) | 21 | 无复发 |
1.2. 影像学检查结果
9例患者均行中下腹部CT平扫及增强扫描,均显示团块状软组织影,轻-中度不均匀强化,典型病例CT图像见图1。
图1. 小肠系膜韧带样纤维瘤病典型病例CT图像.
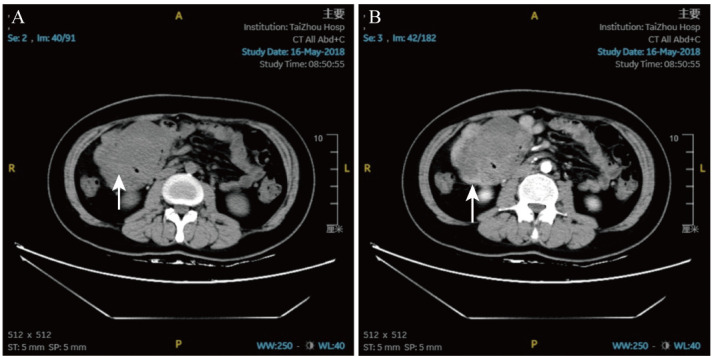
A:CT平扫示右中腹团块状低密度影(箭头所示处为肿瘤);B:CT增强扫描示肿瘤后边缘似强化(箭头所示),局部包绕小肠肠管.
1.3. 肿瘤大体和标本组织病理学检查结果
9例患者肿瘤最大径3.5~33.0 cm,平均(10.7±8.5)cm,无包膜,界不清,部分病例侵犯肠肌壁组织。切面呈实性、灰白色、质地韧,中央坏死出血1例。苏木精-伊红染色结果显示,肿瘤组织由梭形肌纤维母细胞/纤维母细胞、纤维细胞及胶原纤维组成,呈平行、束状或波浪状排列(图2A)。纤维母细胞/肌纤维母细胞细胞核较大,染色质细腻,可见小核仁,细胞质丰富粉染,胞界不清;纤维细胞呈细长梭形,细胞核细长,无核仁,细胞质少,呈嗜酸性(图2B),在不同区域两者比例不一。3例局部区域可见明显胶原成分,呈瘢痕样(图2C),2例部分区域黏液样变性。间质血管管腔扩张,部分区域淋巴细胞浸润。肿瘤呈侵袭性生长,穿插浸润肠壁平滑肌(图2D)及周围脂肪组织,肠黏膜正常。
图2. 韧带样纤维瘤病典型病例肿瘤组织病理学表现(HE染色).
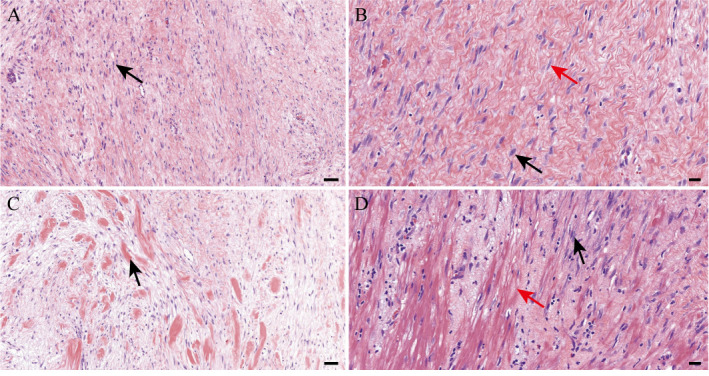
A:肿瘤内梭形细胞呈平行、束状排列(箭头所示),标尺=50 μm. B:纤维母细胞/肌纤维母细胞细胞核较大,染色质细腻或空泡状,可见小核仁(黑色箭头所示);纤维细胞呈细长梭形,细胞核细长,核仁不明显(红色箭头所示),标尺=20 μm. C:局部区域见粗大胶原纤维束(箭头所示),呈瘢痕疙瘩样,标尺=50 μm. D:肿瘤呈侵袭性生长(黑色箭头所示),穿插浸润肠壁固有肌层(红色箭头所示),标尺=20 μm. HE染色:苏木精-伊红染色.
1.4. 肿瘤免疫组织化学检测结果
9例患者肿瘤细胞波形蛋白、β联蛋白均阳性(图3A),5例α-SMA阳性(图3B),Ki-67阳性指数为1%~10%,广谱细胞角蛋白、S-100蛋白、STAT6、CD117、DOG1、CD34、结蛋白和ALK均阴性。
图3. 韧带样纤维瘤病典型病例肿瘤免疫组织化学检测结果.
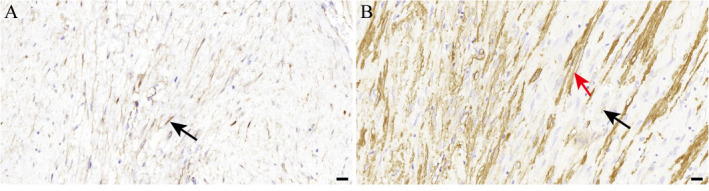
A:肿瘤细胞β联蛋白阳性(箭头所示);B:肿瘤细胞α-SMA弱阳性(黑色箭头所示),侵袭破坏肠壁固有肌层,固有肌层细胞α-SMA强阳性(红色箭头所示). 标尺=20 μm. SMA:平滑肌肌动蛋白.
1.5. 基因突变情况
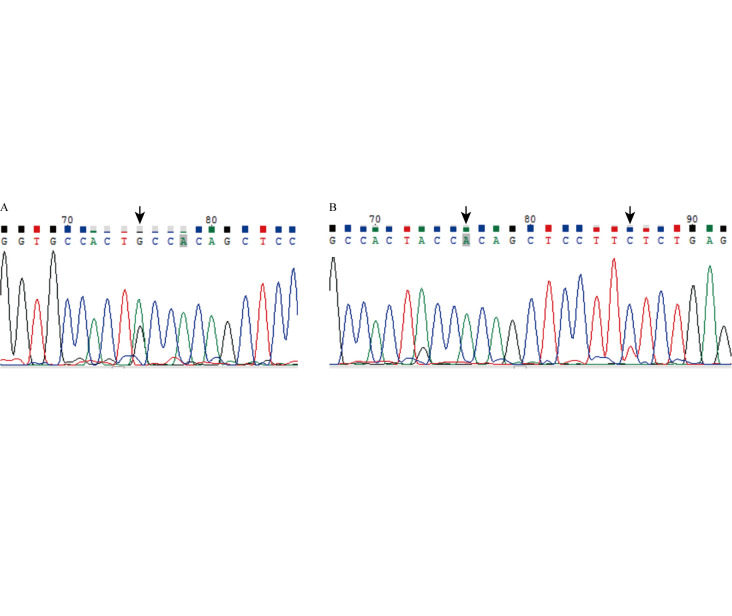
聚合酶链反应扩增及桑格测序结果显示,7例患者存在CTNNB1基因c.121G>A(p.Thr41Ala)突变(图4),1例存在c.121G>A(p.Thr41Ala)及c.134C>T(p.Ser45Phe)双突变,1例为野生型。见表1和图4。
图4. 肠系膜韧带样纤维瘤病典型病例基因突变情况.
A:CTNNB1基因c.121G>A(p.Thr41Ala)突变;B:CTNNB1基因c.121G>A(p.Thr41Ala)和c.134C>T(p.Ser45Phe)双突变. 箭头所指为突变位点. CTNNB1:β1联蛋白.
1.6. 治疗及预后
9例患者均行完整手术切除,未给予其他辅助治疗。随访11~132个月,8例无复发及转移;1例半年后复发,再次手术切除后随访45个月无复发及转移。见表1。
2. 讨论
大部分DTF为散发病例,只有5%~10%的病例与FAP相关[3],本文资料中的病例均无FAP家族史和其他FAP相关病变。研究显示,创伤、手术、怀孕和口服避孕药等因素与DTF的出现及进展相关,激素的作用尚未明确[4]。DTF可以发生在身体的任何部位,按照发病部位,可分为腹壁纤维瘤病、腹壁外纤维瘤病及腹腔内纤维瘤病。MDF属于腹腔内纤维瘤病,本组病例的发病部位多位于小肠系膜(7例),1例位于回盲部系膜,1例位于横结肠系膜,此外,文献报道也可发生在后腹膜、大网膜及胃结肠韧带等部位[1]。
文献报道DTF患者的发病年龄一般为8~87岁,中青年多发,女性多于男性[5]。本文资料中的MDF病例发病年龄为16~59岁,男性多于女性。大多数患者缺乏特异性体征,并且起病隐匿,多表现为无症状腹部肿块,肿块增大时无意中触及,并可引起腹痛、局部不适感、便秘、肠道穿孔及继发感染等症状,有的患者因体检或其他原因导致的剖腹术中偶然发现,临床上根据患者体征无法与胃肠间质瘤等肿瘤鉴别。文献报道,继发于加德纳综合征的MDF可伴发家族性腺瘤性息肉病、骨瘤等特异性临床表现[6]。本文资料病例CT平扫及增强扫描均显示团块状软组织影,病变内部未见出血、坏死及钙化,CT增强扫描结果示轻-中度不均匀强化。于咏梅等[7]报道CT及磁共振示MDF内无囊性变及坏死区,瘤内出现T1、T2加权像低信号条带影可与恶性软组织肿瘤进行鉴别,但最终确诊仍需依靠病理诊断。
本文资料中的MDF大体均为单个结节状肿块,切面有编织状纹理,呈灰白色,质地硬韧,缺乏包膜,边界不清。肿瘤组织由梭形纤维母细胞/肌纤维母细胞、胶原纤维组成,呈平行状、束状或交错排列,细胞形态较一致,纤维母细胞细胞核染色质细腻,细胞质丰富粉染,无明显异型性,核分裂象少见。部分病例局部区域黏液变性,肿瘤细胞呈星芒状。有些病例局部区域可见粗大胶原纤维束,呈瘢痕疙瘩样。肿瘤边缘呈蟹爪状浸润肠壁平滑肌及周围脂肪组织。免疫组织化学结果示肿瘤细胞波形蛋白均阳性,部分病例表达α-SMA,不表达广谱细胞角蛋白、S-100蛋白、STAT6、CD117、DOG1、CD34、结蛋白、MDM2、CDK4和ALK,Ki-67增殖指数较低,与文献报道一致[5]。研究显示,约80%的DTF患者肿瘤细胞显示β联蛋白核表达,伴FAP的病例更常见[2]。本文资料病例免疫组织化学检测结果示肿瘤细胞β联蛋白均核表达,提示β联蛋白核表达对DTF具有较好的敏感性及特异性,究其原因可能与Wnt/β联蛋白信号通路有关。绝大多数DTF肿瘤含有CTNNB1基因或APC基因突变。CTNNB1基因是一种原癌基因,负责调节细胞黏附和转录。当CTNNB1基因发生突变时会导致β联蛋白异常稳定和累积,从而结合TBL1/TBLR1蛋白,刺激Wnt/APC/β联蛋白信号通路下游基因表达,包括S100A4及含胶原三螺旋重复蛋白1等增殖因子,进而导致肿瘤发生。CTNNB1基因突变位于3号外显子氨基端32~45密码子区域,文献报道DTF患者的CTNNB1基因突变中p.Thr41Ala占46.0%,p.Ser45Phe占29.0%,p.Ser45Pro占6.7%[8]。本文资料9例MDF患者携带c.121G>A(p.Thr41Ala)突变7例,携带c.121G>A(p.Thr41Ala)及c.134C>T(p.Ser45Phe)双突变1例,提示MDF患者CTNNB1基因突变中c.121G>A(p.Thr41Ala)更常见,与Huss等[5]的研究结果一致。此外,在FAP相关DTF中,由于产生的是非功能性APC蛋白,导致细胞内β联蛋白过度积累,诱导细胞周期蛋白D1和c-MYC基因表达,刺激细胞增殖及分化,最终导致DTF的发生[9]。DTF患者中CTNNB1基因S45F突变与术后更高复发风险、更高疾病进展可能及对美洛昔康反应不佳相关[10]。本文资料有1例病例存在CTNNB1基因c.121G>A(p.Thr41Ala)和c.134C>T(p.Ser45Phe)双突变,术后随访60个月未见复发。
由于MDF临床上无特异性表现,需要注意与GIST、炎性肌纤维母细胞瘤、平滑肌瘤、结节性筋膜炎、孤立性纤维性肿瘤、胃肠型神经鞘瘤、硬化性肠系膜炎、特发性腹膜后纤维化、纤维肉瘤和去分化脂肪肉瘤等进行鉴别诊断。①与GIST的鉴别诊断要点:GIST瘤细胞可呈梭形、圆形或上皮样,排列较密集,组织学结构多样,免疫组织化学结果示CD34、DOG1、CD117阳性,β联蛋白阴性,存在c-kit基因或PDGFRA基因突变;MDF瘤细胞形态较为一致,其细胞密度较GIST低,异型性较低,细胞核呈β联蛋白阳性,CD34、DOG1、CD117多为阴性,少数局灶阳性,存在CTNNB1基因突变。②与炎性肌纤维母细胞瘤的鉴别诊断要点:炎性肌纤维母细胞瘤内胖梭形肌纤维母细胞和纤维母细胞增生,间质内有不同比例的炎症细胞浸润,免疫组织化学结果示多数病例表达α-SMA、MSA或结蛋白,约50%表达ALK,不表达β联蛋白,具有ALK基因重排;MDF细胞形态较一致,间质内无炎症细胞浸润,免疫组织化学结果示ALK不表达,核表达β联蛋白。③与平滑肌瘤的鉴别诊断要点:平滑肌瘤瘤细胞核两端平钝,胞浆深嗜伊红色,免疫组织化学结果示弥漫强阳性表达结蛋白和α-SMA,不表达β联蛋白;MDF瘤细胞细长梭形,细胞核细长,细胞质丰富粉染,免疫组织化学结果示α-SMA可弱表达,结蛋白通常阴性,核表达β联蛋白。④与结节性筋膜炎的鉴别诊断要点:结节性筋膜炎内不成熟的(肌)纤维母细胞呈漩涡状、束状生长,间质疏松水肿或黏液样,伴有红细胞外渗及慢性炎症细胞浸润,通常存在USP6基因重排,免疫组织化学结果示不表达β联蛋白;MDF间质可局部黏液样,无USP6基因重排,免疫组织化学结果示核表达β联蛋白。⑤与孤立性纤维性肿瘤的鉴别诊断要点:孤立性纤维性肿瘤的瘤细胞丰富区与稀疏区交替,夹杂胶原纤维束,可见血管外皮瘤样区域,肿瘤边界清楚,免疫组织化学结果可见CD34及STAT6表达,β联蛋白阴性,存在NAB2-STAT6融合基因;MDF呈平行状、束状或交错排列,免疫组织化学结果示CD34、STAT6不表达,β联蛋白核阳性。⑥与胃肠型神经鞘瘤的鉴别诊断要点:胃肠型神经鞘瘤的肿瘤细胞呈栅栏状排列,肿瘤周边见淋巴细胞套,免疫组织化学结果示肿瘤细胞表达SOX10和S-100,不表达β联蛋白;MDF无栅栏状排列方式,免疫组织化学结果示肿瘤细胞不表达SOX10和S-100,核表达β联蛋白。⑦与硬化性肠系膜炎的鉴别诊断要点:硬化性肠系膜炎患者的肠系膜弥漫增厚,局部形成结节或团块,不侵犯肠壁组织,镜下见灶性或广泛纤维化,较多炎症细胞浸润及泡沫细胞集聚,无MDF的浸润性生长方式。⑧与特发性腹膜后纤维化的鉴别诊断要点:特发性腹膜后纤维化病变广泛累及后腹膜,少数病例可以累及肠系膜,镜下见纤维组织增生伴胶原化,有明显的玻璃样变性,可见炎症细胞浸润及钙化,常累及腹主动脉周围组织,免疫组织化学结果示β联蛋白不表达。⑨与纤维肉瘤的鉴别诊断要点:纤维肉瘤的肿瘤细胞呈人字形或羽毛状排列,细胞丰富密集,异型性明显,核分裂象多见,可见病理性核分裂象;MDF的肿瘤细胞形态更温和,核分裂象少见,无病理性核分裂象。⑩与去分化脂肪肉瘤的鉴别诊断要点:当去分化成分为低级别时,去分化脂肪肉瘤可呈低级别纤维瘤病样形态,多取材可发现脂肪成分,可见脂肪母细胞,免疫组织化学结果示肿瘤细胞CDK4、MDM2阳性,荧光原位杂交检测MDM2基因扩增;MDF的肿瘤细胞免疫组织化学结果示CDK4、MDM2不表达,无MDM2基因扩增。
据报道,20%的DTF患者会自发消退,提示对于新诊断的DTF患者,可先进行一段时间的观察[11]。2022年美国国立综合癌症网络关于软组织肿瘤的指南指出,如果患者症状轻微且肿瘤的解剖位置不在关键部位,即使对于疾病进展的患者,持续观察也是一个合适的选择[4]。当DTF肿瘤进展后将引起并发症,肿瘤位于腹腔内(包括肠系膜),尽量选择手术切除,如果R0切除将会导致严重的并发症,则可以接受R1切除[12],并可以考虑行放疗。对于难以切除或将导致严重发症的患者,可以接受综合性治疗,包括系统性化疗、激素疗法(三苯氧胺、他莫西芬)、非甾体类抗炎药物、低剂量干扰素以及伊马替尼、阿霉素等。有文献报道MDF患者术后复发率达25%~50%[13-14],FAP综合征或加德纳综合征患者相关MDF复发率高达90%[15]。Yalav等[1]报道11例MDF患者的临床资料,其平均随访时间为(43.4±28.4)个月,复发仅1例,术后约80个月需再次手术,术后30 d内死于吻合口漏和败血症1例,术后1年因其他原因死亡1例。Lahat等[16]对16例DTF患者进行研究,其中包括3例MDF,结果显示充分的手术及充足的切缘可降低复发率。本文资料9例患者中无复发及转移8例,半年后复发1例,再次手术切除后无复发及转移,可能与留有充足的切缘(均为R0切除)且都是散发病例有关。
综上所述,MDF在临床上无特异性表现,诊断较为困难,可通过组织病理学检查、肿瘤免疫组织化学检查和基因检测与多种发生于胃肠道的间叶源性肿瘤鉴别;手术时尽量选择R0切除,R1切除或无法手术切除者可以选择综合治疗。
[缩略语]
韧带样纤维瘤病(desmoid-type fibromatosis,DTF);肠系膜DTF(mesenteric DTF,MDF);胃肠道间质瘤(gastrointestinal stroma tumor,GIST);世界卫生组织(World Health Organization,WHO);平滑肌肌动蛋白(smooth muscle actin,SMA);信号转导及转录激活蛋白(signal transducer and activator of transcription,STAT);间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK);β1联蛋白(catenin beta 1,CTNNB1);家族性腺瘤性息肉病(familial adenomatous polyposis,FAP);鼠双微基因(murine double minute,MDM);细胞周期蛋白依赖激酶(cyclin-dependent kinase,CDK);结肠腺瘤性息肉病基因(adenomatous polyposis coli gene,APC);血小板源性生长因子受体α多肽(platelet-derived growth factor receptor alpha,PDGFRA);肌肉特异性肌动蛋白(muscle-specific actin,MSA)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献(References)
- 1.YALAV O, ERDOGAN O, TEKE Z, et al. Primary mesenteric fibromatosis: a single center experience[J]. Ann Ital Chir, 2020, 91: 283-290. [PubMed] [Google Scholar]
- 2.WHO Classification of Tumours of Editorial Board . WHO classification of tumours. Soft tissue and bone tumours[M]. 5th ed. Lyon: IRAC Press, 2020: 93-95. [Google Scholar]
- 3.GARCIA-ORTEGA D Y, MARTÍN-TELLEZ K S, CUELLAR-HUBBE M, et al. Desmoid-type fibromatosis[J]. Cancers (Basel), 2020, 12(7): 1851. 10.3390/cancers12071851 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.MARTÍNEZ TRUFERO J, PAJARES BERNAD I, TORRES RAMÓN I, et al. Desmoid-type fibromatosis: who, when, and how to treat[J]. Curr Treat Options Oncol, 2017, 18(5): 29. 10.1007/s11864-017-0474-0 [DOI] [PubMed] [Google Scholar]
- 5.HUSS S, NEHLES J, BINOT E, et al. β-catenin (CTNNB1) mutations and clinicopathological features of mesenteric desmoid-type fibromatosis[J]. Histopa-thology, 2013, 62: 294-304. 10.1111/j.1365-2559.2012.04355.x [DOI] [PubMed] [Google Scholar]
- 6.WEHRLI B M, WEISS S W, YANDOW S, et al. Gardner-associated fibromas (GAF) in young patients: a distinct fibrous lesion that identifies unsuspected Gardner syndrome and risk for fibromatosis[J]. Am J Surg Pathol, 2001, 25(5): 645-651. 10.1097/00000478-200105000-00012 [DOI] [PubMed] [Google Scholar]
- 7.于咏梅, 曹长勇, 刘晓萌. 腹部侵袭性纤维瘤病的CT与MRI诊断价值[J]. 医学影像学杂志, 2019, 29(7): 1163-1166. [Google Scholar]; YU Yongmei, CAO Changyong, LIU Xiaomeng. Diagnostic value of CT and MRI in the abdominal aggressive fibromatosis[J]. Journal of Medical Imaging, 2019, 29(7): 1163-1166. (in Chinese) [Google Scholar]
- 8.CRAGO A M, CHMIELECKI J, ROSENBERG M, et al. Near universal detection of alterations in CTNNB1 and Wnt pathway regulators in desmoid-type fibromatosis by whole-exome sequencing and genomic analysis[J]. Genes Chromosomes Cancer, 2015, 54(10): 606-615. 10.1002/gcc.22272 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.LAZAR A J, TUVIN D, HAJIBASHI S, et al. Specific mutations in the beta-catenin gene (CTNNB1) correlate with local recurrence in sporadic desmoid tumors[J]. Am J Pathol, 2008, 173(5): 1518-1527. 10.2353/ajpath.2008.080475 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.HAMADA S, FUTAMURA N, IKUTA K, et al. CTNNB1 S45F mutation predicts poor efficacy of meloxicam treatment for desmoid tumors: a pilot study[J/OL]. PLoS One, 2014, 9(5): e96391. 10.1371/journal.pone.0096391 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.GOUNDER M M, MAHONEY M R, VAN TINE B A, et al. Sorafenib for advanced and refractory desmoid tumors[J]. N Engl J Med, 2018, 379(25): 2417-2428. 10.1056/nejmoa1805052 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.CATES J M, STRICKER T P. Surgical resection margins in desmoid-type fibromatosis: a critical reassess-ment[J]. Am J Surg Pathol, 2014, 38(12): 1707-1714. 10.1097/pas.0000000000000276 [DOI] [PubMed] [Google Scholar]
- 13.LAZAR A J, TUVIN D, HAJIBASHI S, et al. Specific mutations in the beta-catenin gene (CTNNB1) correlate with local recurrence in sporadic desmoid tumors[J]. Am J Pathol, 2008, 173(5): 1518-1527. 10.2353/ajpath.2008.080475 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.GEGA M, YANAGI H, YOSHIKAWA R, et al. Successful chemotherapeutic modality of doxorubicin plus dacarbazine for the treatment of desmoid tumors in association with familial adenomatous polyposis[J]. J Clin Oncol, 2006, 24(1): 102-105. 10.1200/jco.2005.02.1923 [DOI] [PubMed] [Google Scholar]
- 15.SEIDENSAAL K, HARRABI S B, WEYKAMP F, et al. Radiotherapy in the treatment of aggressive fibromatosis: experience from a single institution[J]. Radiat Oncol, 2020, 15(1): 143. 10.1186/s13014-020-01565-9 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.LAHAT G, NACHMANY I, ITZKOWITZ E, et al. Surgery for sporadic abdominal desmoid tumor: is low/no recurrence an achievable goal?[J]. Isr Med Assoc J, 2009, 11(7): 398-402. 10.1007/s00108-009-2404-0 [DOI] [PubMed] [Google Scholar]