Abstract
目的
分析先天性膈疝(CDH)患儿术后死亡的危险因素。
方法
纳入2012年6月至2018年9月山东大学齐鲁儿童医院收治的CDH患儿共126例,描述性分析合并畸形情况。接受手术治疗的120例CDH患儿分为存活组(100例)和死亡组(20例),采用单因素分析及多因素Logistic回归分析的方法分析患儿死亡的危险因素,并对多因素Logistic回归分析有统计学意义的计量资料进行ROC曲线分析。
结果
126例患儿中,合并先天缺陷55例(43.7%),其中多发畸形20例(15.9%)。单因素和多因素Logistic回归分析结果显示,延期手术为保护性因素 ( P<0.05);胎膜早破、术后肺不张、术后上机时间长及术后氧合指数高为危险因素(均 P<0.05)。ROC曲线分析结果显示,当临界值为5.74时,术后氧合指数预测患儿死亡的敏感度为81.0%,特异度为75.0%,曲线下面积为0.841( P<0.01)。
结论
CDH患儿常并发畸形,胎膜早破、术后肺不张、术后上机时间、术后氧合指数大于5.74是CDH患儿术后死亡的高危因素,通过延期手术获得术前稳定的内环境,可以有效降低CDH患儿术后死亡率。
Abstract
Objective
To investigate risk factors of death in newborns with congenital diaphragmatic hernia (CDH).
Method
A total of 126 newborns with CDH from June 2012 to September 2018 were enrolled. Concomitant malformations were recorded by descriptive analysis. Newborns received surgical treatment ( n=120) for CDH were divided into survival group and fatal group. The risk factors of death were analyzed by univariate and multivariate logistic regression and the ROC curve with generated with relevant variables.
Result
There were 55 CDH newborns with concomitant malformations (43.7%), including 20 cases (15.9%) with multi-malformation. Logistic regression analysis showed that premature rupture of membranes (PROM), postoperative atelectasis, long duration of postoperative mechanical ventilation, postoperative high oxygenation index (OI) were related to death (all P<0.05), and the delayed surgery was a protective factor ( P<0.05). In ROC analysis of postoperative OI in predicting death, the area under the curve (AUC) was 0.841, with the cutoff value of 5.74, the sensibility and specificity of OI was 81.0% and 75.0%, respectively( P<0.01).
Conclusions
Newborns with CDH have a high rate of malformations. The risk factors of death were PROM, postoperative atelectasis, postoperative long duration of mechanical ventilation and higher postoperative OI, and delayed surgery may reduce mortality.
Keywords: Hernias, diaphragmatic, congenital/complications; Infant, newborn; Congenital abnormalities/etiology; Cause of death; Risk factors
先天性膈疝(congenital diaphragmatic hernia, CDH)是指由于单侧或双侧膈肌发育缺损导致腹腔内脏器疝入胸腔的一种先天性畸形疾病,约占所有先天性畸形的8% [ 1] ,发病率约为活产新生儿的1/3300 [ 2] ,病死率为20%~40%。早期多用出生后6 h出现呼吸困难、青紫来评估膈疝的轻重程度及预后,但此法评估因素单一,且受新生儿监护水平等复杂临床因素的影响 [ 3] ,有一定局限性。本研究分析了山东大学齐鲁儿童医院新生儿科收治的CDH患儿的资料,旨在探索CDH患儿死亡的危险因素,以供临床评估参考。
1 对象与方法
1.1 对象
2012年6月至2018年9月山东大学齐鲁儿童医院新生儿科收治CDH患儿共126例,所有患儿均为入院时X射线检查确诊CDH的活产新生儿。疾病的诊断标准均参考《实用新生儿学》(第4版) [ 4] 。126例患儿中,产前诊断27例(21.4%);手术治疗120例,术前家长主动放弃6例(其中5例术前即发现有严重先天畸形)。126例患儿中,合并先天缺陷55例(43.7%),其中多发畸形20例(15.9%),各种先天缺陷患病例次见表 1。
表表1 先天性膈疝患儿合并先天缺陷情况
|
先天缺陷类型 |
例次 |
先天缺陷类型 |
例次 |
|
肺发育缺陷 |
41(32.5) |
外观发育缺陷 |
7(5.6) |
|
患侧肺发育不良 |
38(30.2) |
先天性唇腭裂 |
2(1.6) |
|
肺隔离症 |
2(1.6) |
皮-罗综合征 |
2(1.6) |
|
肺囊性病变 |
1(0.8) |
指(趾)畸形 |
2(1.6) |
|
心脏结构发育缺陷 |
19(15.1) |
先天愚型 |
1(0.8) |
|
房室间隔缺损 |
19(15.1) |
先天性遗传代谢病 |
1(0.8) |
|
消化道发育缺陷 |
6(4.8) |
异戊酸血症 |
1(0.8) |
|
肠旋转不良 |
5(3.9) |
其他发育缺陷 |
3(2.4) |
|
肛门狭窄 |
1(0.8) |
乳糜胸 |
2(1.6) |
|
中枢神经发育缺陷 |
1(0.8) |
胸腔异位肾 |
1(0.8) |
|
脑发育不良 |
1(0.8) |
[ n(%)]
1.2 资料收集
收集患儿的临床资料,包括性别、胎龄、出生体质量、阿普加评分、母亲年龄、胎膜早破、手术、气胸、新生儿持续肺动脉高压(persistent pulmonary hypertension of newborn, PPHN)、术后机械通气初始平均气道压及吸入氧浓度、术后血气分析指标、患儿结局(存活或死亡)等。
1.3 死亡危险因素分析
接受手术治疗的120例患儿分为存活组和死亡组,采用单因素分析比较两组差异,然后将单因素分析中 P<0.10的变量纳入多因素Logistic回归模型,计算优势比(odds ratios, OR)及95% CI,分析手术患儿死亡的危险因素。
1.4 统计学方法
应用SPSS 22.0软件进行统计分析。计量资料以 M( Q 1, Q 3)表示,组间比较采用秩和检验;计数资料以例数和百分率[ n(%)]表示,组间比较采用 χ 2检验, P<0.05表示差异有统计学意义。对多因素Logistic回归分析有统计学意义的计量资料进行ROC曲线分析,选取最佳临界值。
2 结果
2.1 手术患儿一般资料分析
手术治疗的120例患儿中,男性64例(53.3%),女性56例(46.7%);早产儿15例(12.5%),足月儿105例(87.5%);入院年龄1 h~25 d;胎龄为39.1(38,40)周,出生体质量为3.2(2.9,3.4)kg,母亲年龄为30(27,33)岁;左侧膈疝95例(79.2%),右侧膈疝25例(20.8%);胸腔镜手术76例(63.3%),常规手术或胸腔镜转开胸手术44例(32%);住院时间为16(12,22)d;出院时存活100例(83.3%),死亡20例(16.7%)。20例死亡患儿中,直接死因依次为PPHN 9例(45%)、术后患侧反复气胸和(或)肺不张7例(35%)、膈肌完全缺失2例(10%)、颅内出血1例(5%)、异戊酸血症1例(5%)。
2.2 手术患儿死亡单因素分析
死亡组和存活组胎膜早破、延期手术、术前PPHN、术后气胸、术后肺不张、术后上机时间、术后氧合指数、合并畸形差异均有统计学意义( P<0.05或 P<0.01),见表 2。
表表2 先天性膈疝患儿术后死亡危险因素的单因素分析结果
|
组 别 |
n |
男 性 |
胎龄(周) |
出生体质量(kg) |
低阿普加评分 * |
羊水多 |
胎膜早破 |
母亲年龄 |
手术时体质量(kg) |
|
死亡组 |
20 |
12(60.0) |
40(39,40) |
3.4(3.3,3.4) |
1(5.0) |
1(5.0) |
11(55.0) |
28(27,33) |
3.13(3.05,3.25) |
|
存活组 |
100 |
52(52.0) |
39(38,40) |
3.1(2.9,3.4) |
12(12.0) |
20(20.0) |
12(21.0) |
30(28,33) |
2.98(2.83,3.4) |
|
χ 2/ Z值 |
— |
0.429 |
2.022 |
2.564 |
0.845 |
2.597 |
9.852 |
0.342 |
0.569 |
|
P值 |
— |
>0.1 |
>0.1 |
>0.1 |
>0.1 |
>0.1 |
<0.01 |
>0.1 |
>0.1 |
|
组 别 |
n |
左侧膈疝 |
延期手术 # |
术前PPHN |
术后气胸 |
术后肺不张 |
术后上机时间 |
术后氧合指数 △ |
合并畸形 |
|
死亡组 |
20 |
15(75.0) |
4(20.0) |
16(80.0) |
13(65.0) |
7(35.0) |
8(3,13) |
6.7(5.6,9.6) |
15(75.0) |
|
存活组 |
100 |
80(80.0) |
57(57.0) |
29(29.0) |
35(35.0) |
5(5.0) |
3(5,2) |
3.8(3.1,5.4) |
35(35.0) |
|
χ 2/ Z值 |
— |
0.253 |
9.129 |
18.496 |
6.250 |
16.667 |
27.429 |
16.179 |
10.971 |
|
P值 |
— |
>0.1 |
<0.01 |
<0.01 |
<0.05 |
<0.01 |
<0.01 |
<0.01 |
<0.01 |
[ n(%)或 M( Q 1,Q 3 )]
2.3 手术患儿死亡多因素分析
将胎膜早破、延期手术、术前PPHN、术后气胸、术后肺不张、术后上机时间、术后氧合指数、合并畸形纳入回归方程,进行Logistic回归分析,结果显示延期手术为保护性因素( P<0.05);胎膜早破、术后肺不张、术后上机时间长、术后氧合指数高为危险因素(均 P<0.05),见表 3。
表表3 先天性膈疝患儿术后死亡危险因素的多因素Logistic回归分析结果
|
因 素 |
β |
SE |
Wald |
P |
OR |
95% CI |
|
胎膜早破 |
2.131 |
0.879 |
5.874 |
<0.05 |
0.119 |
0.021~0.665 |
|
延期手术 * |
-1.934 |
0.923 |
4.387 |
<0.05 |
6.915 |
1.132~42.232 |
|
术前PPHN |
1.212 |
0.863 |
1.973 |
>0.05 |
0.298 |
0.055~1.614 |
|
术后气胸 |
0.759 |
0.845 |
0.807 |
>0.05 |
0.468 |
0.089~2.452 |
|
术后肺不张 |
2.928 |
1.255 |
5.444 |
<0.05 |
0.054 |
0.005~0.626 |
|
术后上机时间长 |
0.439 |
0.169 |
6.756 |
<0.01 |
0.645 |
0.463~0.898 |
|
术后氧合指数高 # |
0.080 |
0.039 |
4.183 |
<0.05 |
0.923 |
0.855~0.997 |
|
先天缺陷 |
1.603 |
0.911 |
3.092 |
>0.05 |
0.201 |
0.034~1.201 |
|
常数 |
6.858 |
1.714 |
16.004 |
<0.01 |
951.031 |
— |
—:无相关数据; *1 min阿普加评分≤7分 [ 5] ; #出生24 h后手术,且需机械通气者术前血气分析酸碱度值为7.25~7.40,动脉血二氧化碳分压为45~60 mmHg; △术后上机1 h内采集的数据,氧合指数=平均动脉压×吸入氧浓度×100/动脉血氧分压;PPHN:新生儿持续肺动脉高压.
—:无相关数据; *出生24 h后手术,且需机械通气者术前血气分析酸碱度值为7.25~7.40,动脉血二氧化碳分压为45~60 mmHg; #术后上机1 h内采集的数据,氧合指数=平均动脉压×吸入氧浓度×100/动脉血氧分压.PPHN:新生儿持续肺动脉高压.
2.4 术后氧合指数判断患儿死亡的价值
ROC曲线分析结果显示,当临界值为5.74时,术后氧合指数预测患儿死亡的敏感度为81.0%,特异度为75.0%,曲线下面积为0.841( P<0.01),见图 1。
图1 .
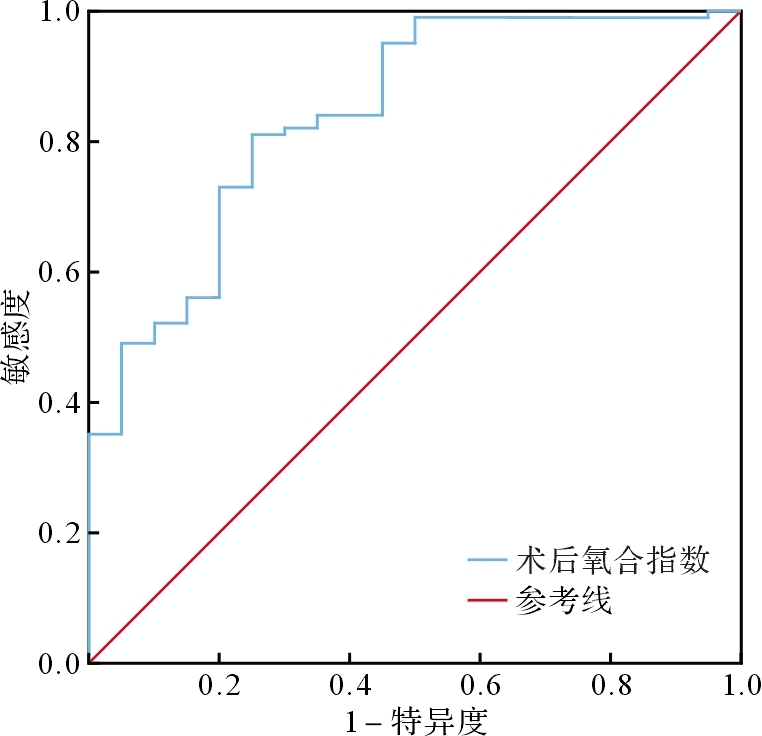
术后氧合指数预测先天性膈疝患儿术后死亡的ROC曲线图
3 讨论
CDH是因胚胎时期膈肌发育缺陷,导致部分腹部脏器通过膈肌缺损处进入胸腔的一种疾病。CDH患儿病死率高,国际CDH协作组针对1600例CDH患儿的统计结果显示,CDH患儿的平均存活率为66%,最高为80%左右 [ 6] 。2015年美国一项122个医学中心针对3738例CDH患儿的调查结果显示,CDH患儿的存活率为75.2% [ 7] 。王合锋等 [ 8] 对CDH患儿的前期研究中发现,胸腔镜手术的成功率为89.4%。本文资料中的患儿总体存活率较高,为79.3%(100/126),可能的原因包括:①产前发现肺/头比严重异常的重症膈疝患儿早期放弃妊娠,或经过产前诊断的严重病例在生产前转运到综合医院,导致重症膈疝的病例数减少;②本中心新生儿重症监护病房转运体系可以实现CDH患儿从产房到手术无缝衔接,多数患儿待内环境稳定以后才进行手术治疗 [ 8] 。
目前认为合并肺发育不良是引起CDH患儿死亡的重要因素。本研究中先天性缺陷分析发现患侧肺发育不良的发病率为30.2%,在先天性缺陷中居首位;死因分析发现PPHN、术后反复气胸和(或)肺不张是CDH患儿死亡的主要原因,而这些因素均与CDH患儿肺发育不良有重要关联。加拿大先天性膈疝诊治指南指出,产前通过胎儿超声计算肺/头比,或通过胎儿磁共振检查测量全胎肺容积及肝脏位置,这些技术手段可以对CDH患儿进行预后评估 [ 2] 。然而由于医疗水平的地区性差异,不同地区CDH的产前诊断率存在较大差异。本研究中CDH患儿的产前诊断率仅为21.4%,多数患儿无法在产前进行预后评估。因此,对于无法产前评估并进行宫内转运的患儿,产后评估作为一种重要的评估手段,有着重要的临床意义。本文资料通过回归性分析发现,胎膜早破、术后肺不张、术后上机时间长、术后氧合指数高是CDH患儿死亡的独立危险因素,延期手术是保护性因素。
围产期的一般情况是否可以作为评估CDH患儿预后的指标目前尚存在争议。有研究认为出生体质量、胎龄、确诊膈疝时的矫正胎龄、性别、母亲年龄、种族、社会经济地位和多胎等因素均与CDH死亡无关 [ 1] ;韩国一项研究则认为羊水过多是死亡的独立危险因素 [ 9] ;还有研究认为阿普加评分0~4分可能增加CDH患儿死亡的风险 [ 10] 。本研究发现胎膜早破增加CDH患儿死亡的风险,可能是因为胎膜早破通过诱发早产、感染/炎症、羊水少等机制对胎肺发育和成熟有影响 [ 11] ,而这些对于CDH患儿的患侧肺而言无疑是“雪上加霜”。但是,上述这些报道均是单中心研究,目前尚未有多中心大样本的研究证实围产期的一般情况与CDH患儿的预后相关。
手术修补缺损是CDH的根本治疗措施,但手术时机的选择尚有争议。CDH的主要病理机制是肺发育不良和PPHN,而不是缺损本身,临床亦观察到急症手术相比延期手术有着更高的病死率 [ 12] 。适当延期手术,积极改善其呼吸、循环功能后再手术,可增加患儿对手术的耐受,提高患儿的存活率 [ 13] 。然而手术延期的时间世界范围内尚未形成共识。据统计,美国2016年仅5%的患儿在出生24 h内接受手术,约半数患儿出生5 d后才接受手术 [ 3] 。加拿大CDH协作组提出的手术适应证包括尿量超过1 mL·kg -1·h -1、吸入氧浓度低于50%、导管前血氧饱和度为85%~95%、与胎龄相符的正常平均动脉压、乳酸浓度低于3 mmol/L、肺动脉压力低于体循环压力,如果经过保守治疗在2周末仍未达到上述指标,需要判断是积极进行修补还是进行姑息治疗 [ 2] 。陈功等 [ 3] 指出,CDH患儿延期24 h、患儿情况适当稳定后尽早手术可避免部分严重膈疝患儿在等候过程中出现危险。因此本研究选择患儿出生后24 h为急症和延期手术的分界点。PPHN治疗原则中明确要求急性期血液酸碱度的目标值需大于7.25,以7.30~7.40为最佳 [ 14] 。因此,本研究中,延期手术定义为患儿出生24 h后进行手术,且需机械通气者术前内环境需要满足以下条件:血气分析酸碱度值在7.25~7.40且动脉血二氧化碳分压为45~60 mmHg,后者符合肺保护策略 [ 15] 。在这个较为“严格”的标准下,本文资料中延期手术者的死亡危险比急症手术者低,CDH患儿的存活率较高。
氧合指数是心肺疾病的重要评估指标,多数学者认为其可帮助判断CDH患儿的预后。韩国一项研究回顾性分析了2000—2016年95例CDH患儿的资料,通过连续监测氧合指数发现,患儿出生后24 h内最佳氧合指数大于11是患儿出生后30 d内死亡发生的独立危险因素 [ 9] 。Terui等 [ 10] 研究发现,最佳氧合指数8.0是CDH患儿预后不良的危险因素,此类患儿出生后90 d存活率仅为52%。CDH患儿血流动力学不稳定,而采集血样可能会引起患儿躁动影响血流动力学,从而影响内环境。本研究选取术后1 h内的氧合指数进行研究,此时患儿处于麻醉未清醒状态,采集动脉血样对于肺动脉压力的影响极小。本文资料显示,氧合指数大于5.74是CDH患儿死亡的独立危险因素。
综上所述,CDH病死率高,肺发育不良引起的并发症如PPHN、反复气胸、肺不张等是CDH死亡的主要原因。胎膜早破、术后肺不张、术后上机时间长、术后氧合指数大于5.74是CDH患儿死亡的危险因素;通过延期手术获得术前稳定的内环境,可以有效降低CDH患儿的病死率。但是,本研究系单中心研究,样本少,特别是产前即诊断为重症CDH的患儿数量较少,因此延期手术对于此类患儿的适用性估计不足,须进一步开展多中心、大样本的研究来证实。
Footnotes
陈栋,胡元军,武玉睿等.先天性膈疝患儿死亡危险因素分析[J].浙江大学学报(医学版),2019,48(01):83-88.
Univ [J Zhejiang.CHEN Dong 1, HU Yuanjun 2, WU Yurui 3, LI Xiaoying 1[ 1.Neonatal Intensive Care Unit, Qilu Children s Hospital of Shandong University, Jinan 250022, China; 2.Department of Neonate Surgery, Qilu Children s Hospital of Shandong University, Jinan 250022, China; 3.Department of Thoracic and Oncological Surgery (Department of Minimally Invasive Surgery), Qilu Children s Hospital of Shandong University, Jinan 250022, China][J].Journal of Zhejiang University,2019,48(01):83-88.
参考文献
- 1.VIEIRA R, PEARSE R, RANKIN J. Mortality factors in infants with congenital diaphragmatic hernia: a systematic review. Birth Defects Res. 2018;110(16):1241–1249. doi: 10.1002/bdr2.1376. [DOI] [PubMed] [Google Scholar]
- 2.PULIGANDLA P S, SKARSGARD E D, OFFRINGA M, et al. Diagnosis and management of congenital diaphragmatic hernia: a clinical practice guideline. CMAJ. 2018;190(4) doi: 10.1503/cmaj.170206. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.陈 功, 郑 珊. 先天性膈疝诊治中的若干争议问题. 临床小儿外科杂志. 2017;16(1):8–11. [Google Scholar]
- 4.邵 肖梅, 叶 鸿瑁, 邱 小汕. 北京: 人民卫生出版社; 4. 2011. 实用新生儿学. [Google Scholar]
- 5.中华医学会围产医学分会新生儿复苏学组 新生儿窒息诊断的专家共识. 中华围产医学杂志. 2016;19(1):3–6. [Google Scholar]
- 6.TSAO K, LALLY K P. Surgical management of the newborn with congenital diaphragmatic hernia. Fetal Diagn Ther. 2011;29(1):46–54. doi: 10.1159/000320244. [DOI] [PubMed] [Google Scholar]
- 7.KANE J M, HARBERT J, HOHMANN S, et al. Case volume and outcomes of congenital diaphragmatic hernia surgery in academic medical centers. Am J Perinatol. 2015;32(9):845–852. doi: 10.1055/s-0034-1543980. [DOI] [PubMed] [Google Scholar]
- 8.王 合锋, 刘 兴峰, 王 洪轩, et al. 胸腔镜手术治疗新生儿先天性膈疝47例. 浙江大学学报(医学版). 2018;47(3):283–288. [Google Scholar]
- 9.OH C. YOUN J K, HAN J W, et al. Predicting survival of congenital diaphragmatic hernia on the first day of life. World J Surg. 2019;43(1):282–290. doi: 10.1007/s00268-018-4780-x. [DOI] [PubMed] [Google Scholar]
- 10.TERUI K, NAGATA K, KANAMORI Y, et al. Risk stratification for congenital diaphragmatic hernia by factors within 24 h after birth. J Perinatol. 2017;37(7):805–808. doi: 10.1038/jp.2017.11. [DOI] [PubMed] [Google Scholar]
- 11.刘 颖. 胎膜早破对胎儿肺发育的影响. 中华全科医师杂志. 2018;17(7):571–573. [Google Scholar]
- 12.WILSON J M, BOWER L K, LUND D P. Evolution of the technique of congenital diaphragmatic hernia repair on ECMO. J Pediatr Surg. 1994;29(8):1109–1112. doi: 10.1016/0022-3468(94)90289-5. [DOI] [PubMed] [Google Scholar]
- 13.中华医学会小儿外科学分会内镜外科学组. 中华医学会小儿外科学分会心胸外科学组 先天性膈疝修补术专家共识及腔镜手术操作指南(2017版) 中华小儿外科杂志. 2018;39(1):1–8. [Google Scholar]
- 14.中华医学会儿科分会新生儿学组 新生儿肺动脉高压诊治专家共识. 中华儿科杂志. 2017;55(3):163–168. [Google Scholar]
- 15.中华医学会儿科分会新生儿学组 新生儿机械通气常规. 中华儿科杂志. 2015;53(5):327–330. [Google Scholar]


