Abstract
目的
探讨重组人成纤维细胞生长因子21(rhFGF21)对成牙骨质细胞增殖和矿化的作用及其机制。
方法
采用苏木精-伊红染色、免疫组织化学染色和免疫荧光法检测成纤维细胞生长因子21(FGF21)在大鼠牙周组织和成牙骨质细胞OCCM-30中的表达和分布;采用CCK-8法检测经不同浓度rhFGF21处理OCCM-30的增殖情况;采用碱性磷酸酶染色和茜素红染色分别检测OCCM-30矿化诱导3、7 d后的矿化状态;通过实时定量聚合酶链反应(PCR)及蛋白免疫印迹法(Western blot)检测成骨相关基因Runx2和Osterix的转录及蛋白表达情况;通过PCR阵列分析评估OCCM-30内转化生长因子β(TGFβ)/骨形态发生蛋白(BMP)信号通路基因的表达变化。
结果
FGF21在大鼠牙周组织和OCCM-30中存在表达;rhFGF21对OCCM-30的增殖能力无明显影响,但50 ng/mL rhFGF21能促进OCCM-30矿化能力增强(P<0.001);实时定量PCR结果显示Runx2和Osterix的转录水平在50 ng/mL rhFGF21矿化诱导3 d时上升,5 d时下降;Western blot结果显示,Runx2及Osterix的蛋白表达水平在矿化诱导过程中增强,rhFGF21上调细胞内Bmpr1b的表达。
结论
rhFGF21能够促进OCCM-30矿化,这与TGFβ/BMP信号通路的激活有关。
Keywords: 成纤维细胞生长因子21, 牙骨质再生, 成牙骨质细胞, 转化生长因子β/骨形态发生蛋白信号通路
Abstract
Objective
To investigate the effect of recombinant human fibroblast growth factor 21 (rhFGF21) on the proliferation and mineralization of cementoblasts and its mechanism.
Methods
Hematoxylin eosin, immunohistochemical staining, and immunofluorescence were used to detect the expression and distribution of fibroblast growth factor 21 (FGF21) in rat periodontal tissues and cementoblasts (OCCM-30), separately. Cell Counting Kit-8 was used to detect the proliferation of OCCM-30 under treatment with rhFGF21. Alkaline phosphatase staining and Alizarin Red staining were used to detect the mineralization state of OCCM-30 after 3 and 7 days of mineralization induction. The transcription and protein expression of the osteogenic-related genes Runx2 and Osterix were detected by real-time quantitative polymerase chain reaction (PCR) and Western blot analysis. The expression levels of genes of transforming growth factor β (TGFβ)/bone morphogenetic protein (BMP) signaling pathway in OCCM-30 were detected through PCR array analysis.
Results
FGF21 was expressed in rat periodontal tissues and OCCM-30. Although rhFGF21 had no significant effect on the proliferation of OCCM-30, treatment with 50 ng/mL rhFGF21 could promote the mineralization of OCCM-30 cells after 7 days of mineralization induction. The transcriptional levels of Runx2 and Osterix increased significantly at 3 days of mineralization induction and decreased at 5 days of mineralization induction. Western blot analysis showed that the protein expression levels of Runx2 and Osterix increased during mineralization induction. rhFGF21 up-regulated Bmpr1b protein expression in cells.
Conclusion
rhFGF21 can promote the mineralization ability of OCCM-30. This effect is related to the activation of the TGFβ/BMP signaling pathway.
Keywords: fibroblast growth factor 21, cementum regeneration, cementoblasts, transforming growth factor β/bone morphogenetic protein signaling pathway
慢性牙周炎(chronic periodontitis,CP)是最常发生于成人牙周组织的慢性疾病,其典型临床表现为牙槽骨吸收和牙齿与牙龈组织之间的附着丧失[1]。通常在牙周治疗后牙周的炎症状态可以控制,但维护不当则会造成牙周组织进一步破坏,最终引发牙齿脱落[2]。目前CP的治疗主要依靠基础治疗手段,包括口腔卫生宣教、龈上洁治、龈下刮治和根面平整。治疗的主要目的是控制感染,重建牙周组织的结构和功能。CP导致的牙骨质、牙周膜纤维和牙槽骨的不可逆丢失需要牙周再生手术才能恢复[3]。然而,牙周再生手术后再生的牙周组织量通常是有限的。因此,一些学者[4]–[5]提出,可以在手术期间进行牙根表面处理,以提高牙根表面的生物相容性,促进新生牙周组织形成。牙骨质再生被视为牙周组织成功再生的金标准[6]。成牙骨质细胞可以形成牙骨质,并在牙骨质矿化中发挥重要作用[7]。因此,通过成牙骨质细胞促进牙骨质再生为牙周组织再生提供了一种新的策略。
成纤维细胞生长因子(fibroblast growth factor,FGF)21是非典型FGF亚家族的一员,可以通过激素方式调节机体糖和脂质代谢[8],因此FGF21在治疗2型糖尿病、肥胖症和高甘油三酯血症等代谢性疾病中具有重要应用价值[9]–[10]。研究[11]表明,FGF21转基因小鼠表现出严重的骨质流失,而FGF21基因敲除小鼠表现出高骨量表型。同时,FGF21可以有效抑制高糖环境中人骨髓间充质干细胞的成骨分化过程[12],且可以有效抑制口腔种植体植入后的骨组织吸收[13]。因此,FGF21被认为在骨代谢中发挥重要调节作用。然而,关于FGF21与牙骨质再生之间关系的研究鲜有报道。
由于成骨细胞和成牙骨质细胞存在许多相似的生物学特征,而目前关于FGF21对成牙骨质细胞的作用尚无明确定论。因此,本研究选用永生化小鼠成牙骨质细胞OCCM-30来探究FGF21对成牙骨质细胞矿化作用的影响及其机制,以期判断其在牙周组织再生中的潜在治疗价值。
1. 材料和方法
1.1. 细胞与主要试剂
本研究采用永生化小鼠来源成牙骨质细胞OCCM-30作为研究对象。
α-MEM、DMEM、胎牛血清培养基(Gibco公司,美国),胰蛋白酶、青霉素和链霉素双抗、β-甘油磷酸盐、抗坏血酸、氯化十六烷基吡啶(Sigma公司,美国),重组人成纤维细胞生长因子21(recombinant human fibroblast growth factor,rhFGF-21)(R&D Systems公司,美国),CCK-8试剂盒、NBT/BCIP试剂盒、DAPI、Cy3标记山羊抗兔IgG、AP标记山羊抗兔IgG(碧云天生物技术有限公司),碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒、BCA蛋白定量试剂盒(南京建成科技有限公司),Triton X-100、茜素红染液(北京索莱宝科技有限公司),RNA分离试剂盒(成都福际生物技术有限公司),EasyQuick RT试剂盒(江苏康为世纪生物科技股份有限公司),Super EvaGreen® qPCR Master Mix试剂盒(苏州宇恒生物科技有限公司),Runx2抗体(ab23981,1∶1 000)、Osterix抗体(ab209484,1∶1 000)(Abcam公司,英国),骨形态发生蛋白受体1b(bone morphogenetic protein receptor 1b,Bmpr1b)抗体(bs-6639R,1∶500,北京博奥森生物技术有限公司),FGF21抗体(abs133911,1∶1 000)、GAPDH抗体(abs-132004,1∶1 000)[爱必信(上海)生物科技有限公司]。
1.2. 实验方法
1.2.1. 大鼠牙周组织形态学检测
选择5~6周龄雄性Wistar大鼠3只,体重180 g±20 g,购自北京维通利华实验动物技术有限公司。吉林大学机构动物护理和使用委员会批准了本研究的动物实验方案(审批号:SY202102008)。施行二氧化碳吸入安乐死,解剖得到其上颌骨,并于4%多聚甲醛中固定24 h,室温脱钙8周。脱钙完成后,将组织脱水并包埋,平行于上颌磨牙的近远中方向进行切片,厚度约为5 µm。苏木精-伊红(hematoxylin eosin,HE)染色观察组织学特征,免疫组织化学(immunohistochemistry,IHC)染色观察FGF21表达情况,其中IHC阴性对照以PBS作为一抗封闭液。
1.2.2. 免疫荧光染色
用4%多聚甲醛固定OCCM-30细胞20 min,Triton X-100通透20 min,加入BSA封闭20 min。随后加入一抗(FGF21抗体)封闭液孵育过夜,加入Cy3标记山羊抗兔IgG孵育1 h,用DAPI染细胞核,于荧光显微镜下观察并拍照。
1.2.3. OCCM-30的培养与矿化诱导
用完全培养基(DMEM、10%胎牛血清、100 U/mL青霉素和100 µg/mL链霉素)培养OCCM-30,设定温度为恒温37 °C,CO2浓度5%。更换矿化诱导培养基(calcifying media,CM)(含α-MEM、10%胎牛血清、100 U/mL青霉素和100 µg/mL链霉素、10 mmol/L β-甘油磷酸盐和50 µg/mL抗坏血酸)对OCCM-30进行矿化诱导。
1.2.4. CCK-8检测
将OCCM-30接种于96孔板中1 d。用rhFGF21浓度为0(Control组)、12.5、25、50和100 ng/mL的完全培养基和不含rhFGF21的CM分别培养细胞。培养1、2、3 d后,加入CCK-8试剂,根据说明书在37 °C下避光孵育2 h,酶标仪在450 nm波长下测定各孔吸光度。
1.2.5. ALP检测
将OCCM-30接种于6孔板中,并于细胞80%汇合后更换为CM。添加含0、12.5、25、50和100 ng/mL浓度的rhFGF21。培养3 d后,使用ALP活性检测试剂盒对细胞ALP活性进行测定。样品中的蛋白质浓度使用BCA蛋白定量试剂盒进行定量,最终结果与总蛋白质浓度进行标准化。
1.2.6. ALP染色和茜素红染色
诱导OCCM-30细胞3、7 d分别进行ALP染色和茜素红染色,按照1.2.5中的方式添加rhFGF21。ALP染色按照NBT/BCIP试剂盒说明书进行,用扫描仪扫描图像。茜素红染色时,先将细胞固定20 min,在37 °C下用1%茜素红染液染色30 min。使用扫描仪捕获图像,并在显微镜下拍摄照片。用氯化十六烷基吡啶检测钙沉积的含量,并用酶标仪在562 nm处测量吸光度。
1.2.7. 实时定量聚合酶链反应(quantitative real‐time polymerase chain reaction,qRT-PCR)
将OCCM-30接种于6孔板中,矿化诱导1、3和5 d后,根据说明书用RNA分离试剂盒得到总RNA样品,用微量分光光度计测量样品中的RNA浓度和质量。根据EasyQuick RT试剂盒说明书进行反转录以合成cDNA,按Super EvaGreen® qPCR Master Mix试剂盒说明书,用荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪器进行检测。管家基因GAPDH作为内参,使用2−ΔΔct方法评估定量变化。Runx2、Osterix和GAPDH引物均由上海生物工程股份有限公司合成,引物序列如下。GAPDH:F5′-GGTTGTCTCCTGCGACTTCA-3′和R5′-TGGTCCAGGGTTTCTTACTCC-3′;Runx2:F5′-ACCCAGCCACCTTTACCTACA-3′和R5′-TAGAGATATGGAGTGCTGCTGGT-3′;Osterix:F5′-GGGAAAGGAGGCACAAAGA-3′和R5′-GGGAAGGGTGGGTAGTCATT-3′。
1.2.8. 蛋白免疫印迹法(Western blot)
用含苯甲基磺酰氟(phenylmethyl sulfonyl fluoride,PMSF)的RIPA缓冲液裂解OCCM-30。通过BCA法蛋白定量分析评估蛋白浓度后,用10%十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白质,半干转法转移至硝酸纤维素膜。室温下用5%脱脂牛奶封闭膜1 h,用Runx2抗体、Osterix抗体、Bmpr1b抗体和GAPDH抗体于4 °C下孵育过夜。PBS冲洗后,加入AP标记山羊抗兔IgG孵育1 h。然后采用BCIP/NBT试剂盒检测显影条带并拍照。
1.2.9. PCR阵列分析
将OCCM-30培养于60 mm细胞培养皿1 d,以0(对照组)、25和50 ng/mL浓度在CM中添加rhFGF21。总RNA使用Trizol试剂盒提取。按照说明书,使用包含90个转化生长因子β(transforming growth factor β,TGFβ)/骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路关键基因试剂盒进行PCR阵列分析。根据2−ΔΔct方法,计算得到log2(fold change)。将|log2(fold change)|>1且P<0.05的基因被定义为差异表达基因。
1.3. 数据处理及统计分析
所有数据以均数±标准差表示。采用GraphPad Prism 7.0软件进行统计分析。经Shapiro-Wilk检验,所有数据均符合正态分布。采用单因素方差分析和Dunnett's t检验来评估各组之间的差异。P<0.05被认为差异具有统计学意义。
2. 结果
2.1. FGF21在大鼠牙周组织和OCCM-30中的表达
对大鼠牙周组织进行HE染色及IHC染色后,在大鼠牙骨质、牙周膜和牙槽骨中观察到FGF21的阳性表达(图1)。免疫荧光染色结果显示,在OCCM-30的细胞质和细胞核中可见FGF21呈阳性表达,染色区域主要位于细胞质内(图2)。
图 1. FGF21在大鼠牙周组织中的表达.
Fig 1 Expression of FGF21 in rat periodontal tissue
A、D:HE染色;B、E:IHC染色,阴性对照(PBS);C、F:IHC染色,箭头示FGF21阳性表达的细胞。
图 2. FGF21在OCCM-30中的表达 免疫荧光染色.
Fig 2 Expression of FGF21 in OCCM-30 immunofluorescence staining
A:FGF21;B:DAPI;C:合并。
2.2. rhFGF21对OCCM-30增殖的影响
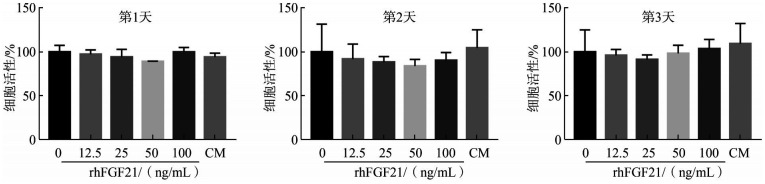
CCK-8检测结果见图3。不同浓度rhFGF21培养OCCM-30 1、2和3 d后的细胞活性差异无统计学意义(P>0.05),表明rhFGF21对OCCM-30的增殖能力无明显影响。
图 3. CCK-8检测OCCM-30的细胞活性.
Fig 3 Cell viability of OCCM-30 evaluated by CCK-8 assay
纵坐标“细胞活性/%”为各组与rhFGF21浓度为0(Control组)时的结果比较。
2.3. rhFGF21对OCCM-30矿化的影响
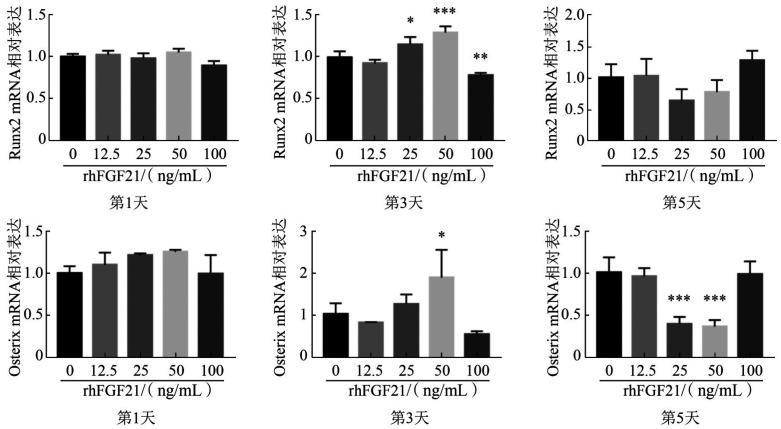
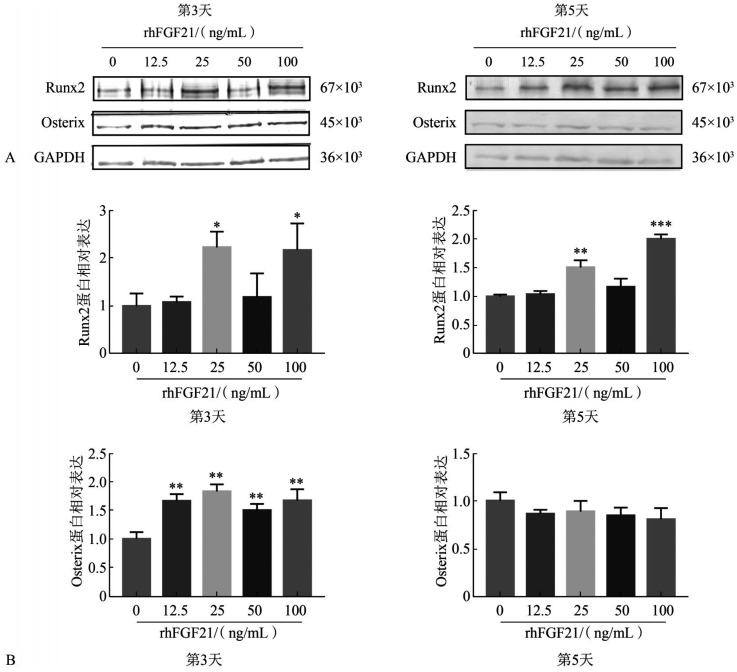
ALP活性测定及ALP染色结果见图4,不同浓度rhFGF21矿化诱导OCCM-30后,细胞矿化程度差异无统计学意义(P>0.05)。茜素红染色结果见图5,与对照组相比,50 ng/mL rhFGF21组OCCM-30矿化能力增强(P<0.001),而其余各组间差异无统计学意义。qRT-PCR结果显示,与对照组相比,不同浓度rhFGF21矿化诱导1 d时Runx2的转录水平差异无统计学意义(P>0.05);3 d时25 ng/mL和50 ng/mL rhFGF21组出现升高,而100 ng/mL组出现降低;5 d时25 ng/mL和50 ng/mL组出现降低趋势但差异无统计学意义(图6上)。不同浓度rhFGF21矿化诱导1 d时Osterix的转录水平差异无统计学意义(P>0.05),3 d时50 ng/mL组出现升高(P<0.05),5 d时25 ng/mL和50 ng/mL组出现降低(P<0.001)(图6下)。Western blot检测结果示,25 ng/mL和100 ng/mL组Runx2蛋白表达水平在诱导后3 d和5 d均升高,而Osterix蛋白表达水平只在3 d时升高,5 d时无明显改变(图7)。这些检测结果均表明,rhFGF21可以促进OCCM-30的矿化。
图 4. ALP活性测定及ALP染色检测细胞矿化程度.
Fig 4 ALP activity and ALP staining to detect the mineralization state of OCCM-30
A:ALP活性;B:ALP染色,从左到右rhFGF21浓度依次为0、12.5、25、50、100 ng/mL。
图 5. 茜素红染色检测细胞矿化程度.
Fig 5 Alizarin red staining to detect the mineralization state of OCCM-30
A:茜素红染色,从左到右rhFGF21浓度依次为0、12.5、25、50、100 ng/mL,下图为× 100;B:钙沉积定量分析,与0 ng/mL rhFGF21组相比,***P<0.001。
图 6. qRT-PCR检测Runx2和Osterix的mRNA表达水平.
Fig 6 The mRNA levels of Runx2 and Osterix were quantified using the qRT-PCR
上:Runx2 mRNA表达;下:Osterix mRNA表达。从左到右依次为:第1天、第3天、第5天。与0 mg/mL rhFGF21组相比,*P<0.05,**P<0.01,***P<0.001。
图 7. Western blot检测Runx2和Osterix的蛋白表达水平.
Fig 7 The protein level of Runx2 and Osterix were determined using Western blot
A:Western blot检测;B:Western blot蛋白定量分析。左:第3天;右:第5天。与0 ng/mL rhFGF21组相比,*P<0.05,**P<0.01,***P<0.001。
2.4. rhFGF21能够调节OCCM-30内TGFβ/BMP信号通路
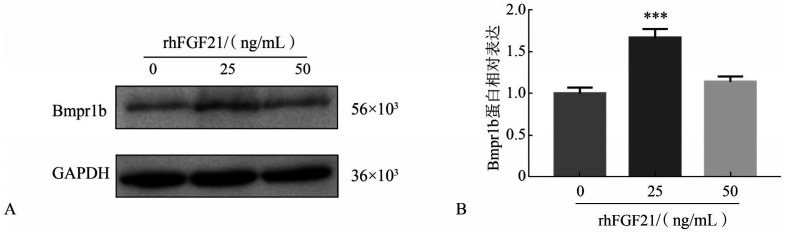
PCR阵列分析结果显示,与对照组相比,25 ng/mL组有14个和19个基因分别上调和下调,50 ng/mL组有19个和8个基因分别上调和下调(图8)。基于此分析结果,使用Western blot对通路中关键蛋白Bmpr1b进行分析,分析结果显示:25 ng/mL组可促进矿化诱导1 d后细胞内Bmpr1b的表达(图9)。
图 8. TGFβ/BMP信号通路的PCR阵列分析.
Fig 8 PCR array analysis of the TGFβ/BMP signalling pathway
图 9. Western blot测定Bmpr1b蛋白表达水平.
Fig 9 The protein level of Bmpr1b determined using western blot
A:Western blot检测;B:Western blot蛋白定量分析,与0 ng/mL rhFGF21组相比,***P<0.001。
3. 讨论
为揭示FGF21在牙骨质再生中的作用,本研究首先阐明了FGF21在大鼠牙周组织和OCCM-30中的表达和分布情况。IHC染色显示FGF21在牙周组织中广泛表达,免疫荧光染色结果显示FGF21的阳性表达主要位于OCCM-30细胞的细胞质中,少量位于细胞核中。早期研究[9]显示FGF21表达于肝脏、胰腺以及脂肪组织中,本研究证实FGF21的表达也同样存在于大鼠牙周组织和OCCM-30中。鉴于FGF21能够通过自分泌和旁分泌调节周围组织和细胞[9]。因此,可以假设FGF21在局部牙周组织中发挥某种作用。为了进一步探索FGF21在牙骨质再生中的作用,本研究进行了体外实验。
体外细胞毒性实验证实,在0~100 ng/mL的浓度范围内,rhFGF21对OCCM-30细胞无明显的细胞毒性,这表明rhFGF21可能是一种安全的药物(图3)。ALP染色和活性测定结果表明,rhFGF21矿化诱导3 d对细胞的矿化程度无显著影响(图4)。而浓度为50 ng/mL的rhFGF21可以在细胞矿化诱导7 d后上调其矿化能力(图5)。研究[13]表明,FGF21可以改善口腔种植体骨缺损大鼠的骨密度。还有研究[14]发现,FGF21可以通过激活BMP/Smad信号传导促进C2C12细胞的成骨分化。本研究结果与之前学者的研究结果一致,表明rhFGF21可以促进OCCM-30细胞的矿化。同时,本研究对成骨相关的关键转录因子Runx2和Osterix的mRNA及蛋白表达水平进行了检测。结果显示,浓度为25 ng/mL和50 ng/mL的rhFGF21可以在诱导3 d后上调细胞内Runx2和Osterix的转录水平。然而与对照组相比,第5天时Runx2和Osterix的转录水平出现降低。Runx2和Osterix的蛋白表达水平在第3天表现出类似的趋势,但在第5天没有表现出相应的下降。由于基因表达过程复杂, mRNA往往需要经历转录后、翻译、翻译后处理或修饰和蛋白质降解等调节机制才能最终合成蛋白质[15]。这可能解释了本实验中观察到的Runx2和Osterix的mRNA表达水平与其相应的蛋白质水平并不完全匹配的现象。综上所述,该实验发现在25 ng/mL和50 ng/mL浓度下,rhFGF21对OCCM-30矿化有促进作用。
为了进一步探索rhFGF21影响OCCM-30矿化的可能机制,本研究使用PCR阵列分析检测了细胞TGFβ/BMP信号通路内基因表达的差异。由于rhFGF21在25 ng/mL和50 ng/mL浓度下对细胞矿化诱导明显,因此选用rhFGF21浓度为25 ng/mL和50 ng/mL的CM培养细胞。结果表明,与对照组相比,经rhFGF21处理的细胞中BMP配体的表达发生显著变化,尤其是Bmp3和Bmp5的表达水平上调,而Bmp1的表达水平降低。在TGFβ/BMP信号通路中,BMP配体与Ⅱ型BMP受体结合后激活Ⅰ型BMP受体,Ⅰ型BMP受体可通过Smad或非Smad途径介导下游BMP信号以调节靶基因的转录[16]–[18]。值得注意的是,用rhFGF21刺激细胞后,细胞内Bmpr1b的表达水平上调。另外在50 ng/mL组中该通路的下游效应子Smad4显著上调。同时还发现2个处理组的Smad2和Smad3分别下调。研究[19]–[20]表明,随着Smad2和Smad3水平的降低,细胞中Runx2的表达水平上调。这可能解释了为什么rhFGF21在刺激细胞后Runx2蛋白表达增加。此外,经rhFGF21处理的细胞中分泌型BMP拮抗剂Chrd的表达显著上调,50 ng/mL组的成骨促进基因Dlx2表达显著上调。以上结果均表明,rhFGF21对OCCM-30细胞的TGFβ/BMP信号通路具有调节作用。本研究进一步选择Bmpr1b这一通路关键蛋白进行Western blot,以确定细胞中TGFβ/BMP信号通路是否被激活。结果表明,经rhFGF21刺激后细胞中Bmpr1b蛋白的表达显著升高,这表明TGFβ/BMP信号通路被激活,据此笔者推断rhFGF21通过调节TGFβ/BMP信号通路促进OCCM-30矿化。因此,本研究发现一定浓度的rhFGF21可以促进OCCM-30的矿化,且这一过程可能与细胞内TGFβ/BMP信号通路的激活有关。
综上所述,本研究结果表明FGF21作为一种糖及脂质代谢的调节因子,在大鼠牙周组织和OCCM-30中存在表达;体外研究表明rhFGF21对OCCM-30的增殖能力并无明显影响,而一定浓度下其可增强细胞矿化能力,且这与TGFβ/BMP信号通路的激活有关。本研究结果提示,除了治疗2型糖尿病等代谢性疾病外,FGF21还可能在牙周再生方面具有潜在的治疗价值。
Funding Statement
[基金项目] 国家自然科学基金(81901036,82170994);吉林省科技发展计划项目(20200201358JC);吉林省财政厅医疗卫生人才项目(jcsz2020304-22,jcsz2021893-16);吉林大学研究生创新研究计划(101832020CX305)
Supported by: The National Natural Science Foundation of China (81901036, 82170994); Jilin Province Science and Technology Development Plan Project (20200201358JC); Jilin Finance Department Medical and Health Talent Program (jcsz2020304-22, jcsz2021893-16); Graduate Innovation Fund of Jilin University (101832020CX305).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Cao RY, Li QL, Wu QQ, et al. Effect of non-surgical periodontal therapy on glycemic control of type 2 diabetes mellitus: a systematic review and Bayesian network meta-analysis[J] BMC Oral Heal. 2019;19(1):176. doi: 10.1186/s12903-019-0829-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kruse AB, Kowalski CD, Leuthold S, et al. What is the impact of the adjunctive use of omega-3 fatty acids in the treatment of periodontitis? A systematic review and meta-analysis[J] Lipids Health Dis. 2020;19(1):100. doi: 10.1186/s12944-020-01267-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Su JL, Cai SX. Effects of Quartz Splint Woven fiber periodontal fixtures on evaluating masticatory efficiency and efficacy[J] Medicine. 2018;97(44):e13056. doi: 10.1097/MD.0000000000013056. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Rathe F, Junker R, Chesnutt BM, et al. The effect of enamel matrix derivative (emdogain®) on bone formation: a systematic review[J] Tissue Eng B Rev. 2009;15(3):215–224. doi: 10.1089/ten.teb.2008.0065. [DOI] [PubMed] [Google Scholar]
- 5.Kitamura M, Akamatsu M, Machigashira M, et al. FGF-2 stimulates periodontal regeneration: results of a multi-center randomized clinical trial[J] J Dent Res. 2011;90(1):35–40. doi: 10.1177/0022034510384616. [DOI] [PubMed] [Google Scholar]
- 6.Wang YZ, Li Y, Shao P, et al. IL1β inhibits differentiation of cementoblasts via microRNA-325-3p[J] J Cell Biochem. 2020;121(3):2606–2617. doi: 10.1002/jcb.29482. [DOI] [PubMed] [Google Scholar]
- 7.Cao ZG, Zhang H, Zhou X, et al. Genetic evidence for the vital function of Osterix in cementogenesis[J] J Bone Miner Res. 2012;27(5):1080–1092. doi: 10.1002/jbmr.1552. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Bernardo B, Lu M, Bandyopadhyay G, et al. FGF21 does not require interscapular brown adipose tissue and improves liver metabolic profile in animal models of obesity and insulin-resistance[J] Sci Rep. 2015;5:11382. doi: 10.1038/srep11382. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Kliewer SA, Mangelsdorf DJ. A dozen years of discovery: insights into the physiology and pharmacology of FGF21[J] Cell Metab. 2019;29(2):246–253. doi: 10.1016/j.cmet.2019.01.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kim AM, Somayaji VR, Dong JQ, et al. Once-weekly administration of a long-acting fibroblast growth factor 21 analogue modulates lipids, bone turnover markers, blood pressure and body weight differently in obese people with hypertriglyceridaemia and in non-human primates[J] Diabetes Obes Metab. 2017;19(12):1762–1772. doi: 10.1111/dom.13023. [DOI] [PubMed] [Google Scholar]
- 11.Wei W, Dutchak PA, Wang XD, et al. Fibroblast growth factor 21 promotes bone loss by potentiating the effects of peroxisome proliferator-activated receptor γ[J] Proc Natl Acad Sci USA. 2012;109(8):3143–3148. doi: 10.1073/pnas.1200797109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.李 茜, 陈 程, 安 振梅, et al. 高糖环境下FGF-21对人骨髓间充质干细胞成骨分化的影响[J] 四川大学学报(医学版) 2016;47(5):649–654. [Google Scholar]; Li X, Chen C, An ZM, et al. Effects of FGF-21 on osteogenic differentiation of human bone marrow mesenchymal stem cells in high glucose environment[J] J Sichuan Univ Med Sci Ed. 2016;47(5):649–654. [PubMed] [Google Scholar]
- 13.Yang S, Guo Y, Zhang W, et al. Effect of FGF-21 on implant bone defects through hepatocyte growth factor (HGF)-mediated PI3K/AKT signaling pathway[J] Biomed Pharmacother. 2019;109:1259–1267. doi: 10.1016/j.biopha.2018.10.150. [DOI] [PubMed] [Google Scholar]
- 14.Ishida K, Haudenschild DR. Interactions between FGF-21 and BMP-2 in osteogenesis[J] Biochem Biophys Res Commun. 2013;432(4):677–682. doi: 10.1016/j.bbrc.2013.02.019. [DOI] [PubMed] [Google Scholar]
- 15.Santos C, Nogueira FCS, Domont GB, et al. Proteomic analysis and functional validation of a Brassica oleracea endochitinase involved in resistance to Xanthomonas campestris[J] Front Plant Sci. 2019;10:414. doi: 10.3389/fpls.2019.00414. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kondkar AA, Sultan T, Azad TA, et al. Association analysis of polymorphisms rs12997 in ACVR1 and rs1043784 in BMP6 genes involved in bone morphogenic protein signaling pathway in primary angle-closure and pseudoexfoliation glaucoma patients of Saudi origin[J] BMC Med Genet. 2020;21(1):145. doi: 10.1186/s12881-020-01076-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.MacKenzie B, Wolff R, Lowe N, et al. Twisted gastrulation limits apoptosis in the distal region of the mandibular arch in mice[J] Dev Biol. 2009;328(1):13–23. doi: 10.1016/j.ydbio.2008.12.041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Tsang HT, Edwards TL, Wang XN, et al. The hereditary spastic paraplegia proteins NIPA1, spastin and spartin are inhibitors of mammalian BMP signalling[J] Hum Mol Genet. 2009;18(20):3805–3821. doi: 10.1093/hmg/ddp324. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Li HL, Fan JF, Fan LY, et al. MiRNA-10b reciprocally stimulates osteogenesis and inhibits adipogenesis partly through the TGF-β/SMAD2 signaling pathway[J] Aging Dis. 2018;9(6):1058–1073. doi: 10.14336/AD.2018.0214. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cheung KSC, Sposito N, Stumpf PS, et al. microRNA-146a regulates human foetal femur derived skeletal stem cell differentiation by down-regulating SMAD2 and SMAD3[J] PLoS One. 2014;9(6):e98063. doi: 10.1371/journal.pone.0098063. [DOI] [PMC free article] [PubMed] [Google Scholar]