Abstract
目的
本研究通过模拟天然骨单位进行同心圆结构的设计,并修饰氧化石墨烯(GO),探究新的仿生微纳米结构表面对巨噬细胞RAW264.7破骨分化的影响。
方法
实验分为光滑钛片组(SS)、微沟槽组(CMS)和微沟槽表面修饰GO组(GO-CMS),利用扫描电子显微镜(SEM)、接触角测量仪、原子力显微镜、X射线光电子能谱分析仪和拉曼光谱仪研究材料表面的理化性能,通过细胞活性检测、SEM和激光共聚焦显微镜研究修饰后的材料表面对RAW264.7的细胞生物学行为的影响,通过抗酒石酸酸性磷酸酶(TRAP)免疫荧光染色、TRAP定量检测和荧光实时定量聚合酶链反应(qRT-PCR)研究其对巨噬细胞破骨分化的影响。
结果
巨噬细胞沿着微沟槽排列成同心圆状,修饰GO后,材料表面含氧基团增多,亲水性增加。GO-CMS组诱导形成的破骨细胞体积小,数量少,TRAP表达量最少,TRAP单位酶活性也最低。GO-CMS组虽然促进巨噬细胞的增殖,但破骨分化相关基因的表达低于SS组,差异具有统计学意义(P<0.05)。
结论
同心圆微沟槽限制了破骨细胞的融合及封闭区的形成,GO修饰类骨单位同心圆微沟槽抑制了巨噬细胞RAW264.7的破骨分化。
Keywords: 类骨单位, 同心圆微沟槽, 氧化石墨烯, 巨噬细胞, 破骨分化
Abstract
Objective
This study aimed to investigate the effect of new biomimetic micro/nano surfaces on the osteoclastic differentiation of RAW264.7 macrophages by simulating natural osteons for the design of concentric circular structures and modifying graphene oxide (GO).
Methods
The groups were divided into smooth titanium surface group (SS), concentric microgrooved titanium surface group (CMS), and microgroove modified with GO group (GO-CMS). The physicochemical properties of the material surfaces were studied using scanning electron microscopy (SEM), contact-angle measurement, atomic force microscopy, X-ray photoelectron spectroscopy analysis, and Raman spectroscopy. The effect of the modified material surface on the cell biological behavior of RAW264.7 was investigated by cell-activity assay, SEM, and laser confocal microscopy. The effect on the osteoclastic differentiation of macrophages was investigated by tartrate-resistant acid phosphatase (TRAP) immunofluorescence staining and quantitative real-time polymerase chain reaction (qRT-PCR) experiments.
Results
Macrophages were arranged in concentric circles along the microgrooves, and after modification with GO, the oxygen-containing groups on the surface of the material increased and hydrophilicity increased. Osteoclasts in the GO-CMS group were small in size and number and had the lowest TRAP expression. Although it promoted the proliferation of macrophages in the GO-CMS group, the expression of osteoclastic differentiation-related genes was lower than that in the SS group, and the difference was statistically significant (P<0.05).
Conclusion
Concentric circular microgrooves restricted the fusion of osteoclasts and the formation of sealing zones. Osteomimetic concentric microgrooves modified with GO inhibited the osteoclastic differentiation of RAW 264.7 macrophages.
Keywords: osteomimetic, concentric microgroove, graphene oxide, macrophages, osteoclastic differentiation
随着种植外科的发展,种植修复已成为牙齿缺失的一种可行的治疗方案。种植体骨结合是种植体保持长期稳定的关键,目前仍有大量研究[1]致力于改进种植体表面的理化特性提高骨结合进而降低失败率。
天然骨单位中心是哈弗氏管,直径约200 µm,哈弗氏骨以(20±10)µm间隔的同心带排列的方式螺旋环绕哈弗氏管所构成,其中骨细胞沿同心圆环形生长[2]。Zhang等[3]研究发现曲线微沟槽结构可促进骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)向成骨谱系分化,从仿生学与接触诱导的角度,在种植体材料表面设计类骨单位同心圆的形貌改性可能影响细胞骨架排列进而影响骨修复相关细胞行为。破骨细胞的功能受生物材料的理化性质影响,特别是表面结构[4]–[6]。而表面规律的同心圆微图形影响巨噬细胞破骨分化的表型研究少有报道。
氧化石墨烯(graphene oxide,GO)作为碳纳米材料的衍生物,表面分布大量羧基、羟基或环氧基,含氧基团的增加改善了材料表面的亲水性,促进细胞的黏附、生长及成骨分化。课题组前期研究[7]表明GO对骨免疫有一定的调节作用。Dou等[8]的一项研究表明GO作为药物载体,可以被内吞进破骨细胞,但这种化合物是否可以抑制破骨细胞成熟及功能分化有待进一步研究。
本研究结合天然骨单位的同心圆结构,并根据破骨细胞的前体细胞——巨噬细胞的大小,设计类骨单位的同心圆钛表面,并在其表面修饰GO,旨在通过同心圆微沟槽和GO的双重作用抑制破骨,进一步研究复合改性对巨噬细胞增殖与破骨分化功能的影响。
1. 材料和方法
1.1. 主要试剂和设备
GO(777676,Sigma公司,美国),高糖DMEM培养基(BI公司,以色列),胎牛血清(10270-106,Gibco公司,美国),抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(BB-44212,南京贝博生物有限公司),Western及IP细胞裂解液(P0013J)、蛋白酶抑制剂混合物(P1005)、BCA蛋白浓度测定试剂盒(P0010)、TRAP检测试剂盒(P0332)(上海碧云天生物技术有限公司),核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)(462-TEC-010,R&D公司,美国),细胞计数试剂盒(cell count kit,CCK-8)(CK04,Dojindo公司,日本),罗丹明鬼笔环肽(PHDR1,Cytoskeleton公司,美国),DAPI(D9542,Sigma公司,美国),重组Anti-TRAP/CD40L antibody(ab52750)、Goat Anti-Rabbit IgG H&L(ab150077)(Abcam公司,英国),RNA快速提取试剂盒(HRP304-01,上海惠凌生物技术有限公司),NovoScript®PlusAll-in-one 1 st Strand cDNA Synthesis SuperMix(E-047-01B)、NovoStart® SYBR qPCR SuperMix Plus(E096-01B)(苏州近岸蛋白质科技有限公司)。
酶标仪(Cytation 5,BioTek公司,美国),接触角测量仪(DSA30,KRUSS公司,德国),扫描电子显微镜(scanning electron microscope,SEM)(SUPRA55,ZEISS公司,德国),激光共聚焦显微镜(TCS SP8,Leica公司,德国),X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)分析仪(PHI Quantum 2000,PHI公司,美国),拉曼光谱分析仪(IDSPeC,ARCTIC公司,瑞士),原子力显微镜(Cypher S,Oxford公司,英国)。
1.2. 方法
1.2.1. 材料制备
同心圆微沟槽钛片:采用光刻技术制备,由厦门大学萨本栋微米纳米科学技术研究院提供,同心圆直径200 µm,沟槽间隔10 µm,深度10 µm。修饰GO:材料片丙酮超声、无水乙醇冲洗后浸泡于2.5 mol/L NaOH水溶液30 min。之后5% 3-氨基丙基三乙氧基硅烷[(3-aminopropyl)triethoxysilane,APTES]溶液浸泡2 h进行硅烷化修饰,然后用无水乙醇和蒸馏水浸泡冲洗后于1.0 mg/mL的GO溶液60 °C避光浸泡24 h,超纯水浸泡冲洗烘干备用。所有样本使用前均置于孔板中正反面紫外各照30 min。材料的分组:光滑钛片组(SS)、微沟槽组(CMS)、微沟槽表面修饰GO组(GO-CMS)。
1.2.2. 材料理化性能检测
材料清洗室温干燥,表面喷金后SEM观察其表面形貌。亲水性测量:每次滴加2 µL去离子水在材料表面,每个样品随机取5个测量点测量,取其平均值。利用原子力显微镜检测材料的表面纳米粗糙度,拉曼光谱分析仪表征GO涂层特征峰,XPS分析仪检测材料表面的元素构成。
1.2.3. 巨噬细胞RAW264.7的培养及破骨诱导
巨噬细胞采购于中国科学院细胞库(TCM13),培养基:高糖DMEM与10%血清及1%双抗;传代:弃培养基,PBS润洗1遍,加2 mL培养基轻轻吹打,1 000 r/min离心5 min,弃上清,加完全培养基重悬细胞,1∶3或1∶4传代。破骨诱导:接种细胞后次日更换为含50 ng/mL RANKL诱导液的培养基,2 d更换一次含诱导液的培养基,诱导5 d即可看到成形的多核破骨细胞,使用TRAP染色实验进一步验证。
1.2.4. 材料表面巨噬细胞RAW264.7细胞活性检测
采用CCK-8进行细胞活性检测。将材料放入24孔板中,细胞接种密度为每孔2×104个,在接种后第1、3、5天进行测量。于相应的时间点用镊子取出材料片,PBS轻轻润洗,每孔加500 µL培养基,加入50 µL CCK-8试剂37 °C孵育2 h,酶标仪测量450 nm波长处的光密度(optical density,OD)值,每组重复检测3次。
1.2.5. 材料表面巨噬细胞RAW264.7黏附形态观察
材料置于24孔板中,RAW264.7以密度为每孔5×104个进行接种。培养1 d后收集样品,预热的PBS轻轻漂洗1次,经2.5%戊二醛4 °C固定过夜,0.1 mol/L二甲胂酸盐缓冲液清洗3次,之后用50%、70%和90%乙醇依次脱水处理,每次5 min,最后用100%乙醇脱水2次,置于六甲基二硅氮烷(hexamethyldisilazane,HMDS)30 min,室温干燥后喷金,SEM观察细胞生长分布及形态。
1.2.6. 材料表面巨噬细胞RAW264.7免疫荧光染色
以密度为每毫升5×104个接种于24孔板,培养1 d后转到新的孔板,PBS润洗2次,4%多聚甲醛室温固定10 min,PBS润洗1次,接着用0.5%Triton X-100室温孵育5 min,PBS润洗1次后用1%牛血清白蛋白室温孵育30 min,PBS润洗2次后RITC/phalloidin室温避光30 min,PBS润洗后用DAPI染液室温避光作用5 min,PBS洗1次,然后将材料片倒扣在滴有抗荧光淬灭封片剂的激光共聚焦扫描显微镜专用的小皿中,激光共聚焦显微镜观察。
1.2.7. 材料表面巨噬细胞RAW264.7破骨诱导免疫荧光染色
接种密度为每毫升2×104个,破骨诱导培养5 d后,免疫荧光染色观察破骨细胞及TRAP荧光分布。将接种培养5 d的材料片转至新孔板,PBS润洗2次后用4%多聚甲醛室温固定10 min,PBS清洗1次,接着用0.5%Triton X-100室温孵育5 min,PBS润洗1次后用1%牛血清白蛋白室温孵育30 min,PBS润洗2次后用一抗Anti-TRAP/CD40L antibody 37 °C孵育2 h,PBS润洗后用二抗避光室温孵育30 min,润洗后RITC/phalloidin室温避光30 min,最后PBS润洗后用DAPI染液室温避光作用5 min,PBS洗1次,将材料片倒扣在滴有抗荧光淬灭封片剂的激光共聚焦扫描显微镜专用的小皿中,激光共聚焦显微镜观察。
1.2.8. 材料表面TRAP定量检测
将RAW264.7接种于6孔板,密度为每孔1×105个,次日加诱导液,2 d换一次液,待细胞培养至5 d后,终止培养,用PBS洗涤2遍,将培养板置于冰上,收集各组的细胞样品于EP管中,各加入200 µL不含磷酸酶抑制剂的裂解液,反复吹打使细胞裂解完全。10 000 r/min离心10 min收集各分组上清液,采用TRAP检测试剂盒和BCA蛋白浓度测定试剂盒来检测各组的TRAP活性。
计算公式:将TRAP检测的标准曲线横坐标设置为微摩尔数,代入标准曲线方程得出样本的微摩尔数,除以孵育时间(min),计算出的酶活性单位用U表示。然后计算出每个样本孔的蛋白质量,把酶活性除以蛋白质量,最后单位表示为U/mg。
1.2.9. 材料表面破骨分化相关基因检测
采用荧光实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)法检测破骨相关基因mRNA的表达水平。将细胞接种在材料表面,置于6孔板,密度为每孔1×105个,次日加诱导液,2 d换一次液,分别诱导1 d和3 d后,用RNA提取试剂盒提取材料片上细胞RNA,逆转录后使用NovoStart®SYBR qPCR SuperMix Plus试剂盒检测各分化阶段的破骨分化标志基因Acp5(TRAP)、Mmp9(MMP9)和Ctsk(Cathepsin K)的表达。相关基因的引物序列见表1。
表 1. 破骨分化相关基因的引物序列.
Tab 1 The primer sequences of osteoclastic differentiation related genes
| 基因 | 引物序列(5′-3′) |
| Acp5 | F:CACTCCCACCCTGAGATTTGT |
| R:CATCGTCTGCACGGTTCTG | |
| Mmp9 | F:ATGTCACTTTCCCTTCACCTTC |
| R:TGCCGTCCTTATCGTAGTCA | |
| Ctsk | F:AATTATGGCTGTGGAGGCGG |
| R:TGCATTTAGCTGCCTTTGCC | |
| Gapdh | F:AAATGGTGAAGGTCGGTGTGAAC |
| R:CAACAATCTCCACTTTGCCACTG |
注:Gapdh,磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase)。
1.3. 统计分析
采用GraphPad Prism 8软件对实验数据进行统计分析,并采用ANOVA单因素方差分析对结果进行显著性分析,P<0.05表明差异具有统计学意义。
2. 结果
2.1. 材料的表面形貌和亲水性检测
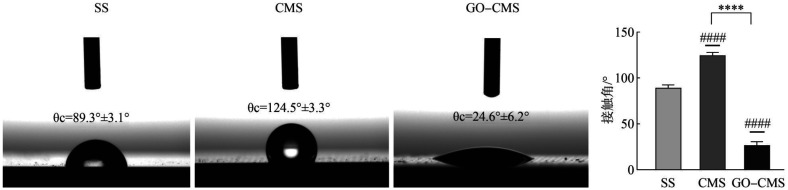
修饰GO涂层后,GO-CMS组SEM高倍下可见一层膜样结构覆盖在材料表面,而低倍下同心圆结构仍然可见,因此GO涂层并没有填满同心圆微沟槽(图1)。接触角测量(图2)发现,与SS组相比,CMS组接触角增大,修饰GO涂层后(GO-CMS组)增加了材料表面的亲水性,接触角明显下降,差异具有统计学意义(P<0.05)。
图 1. 材料的表面形貌 SEM.
Fig 1 Surface morphology of materials SEM
图 2. 材料表面的接触角测量图(左)和柱状图(右).
Fig 2 Contact angle measurement graph (left) and histogram (right) of the material surface
CMS组和GO-CMS组相比较,****P<0.000 1;与SS组相比,####P<0.000 1。
2.2. 材料理化性能检测
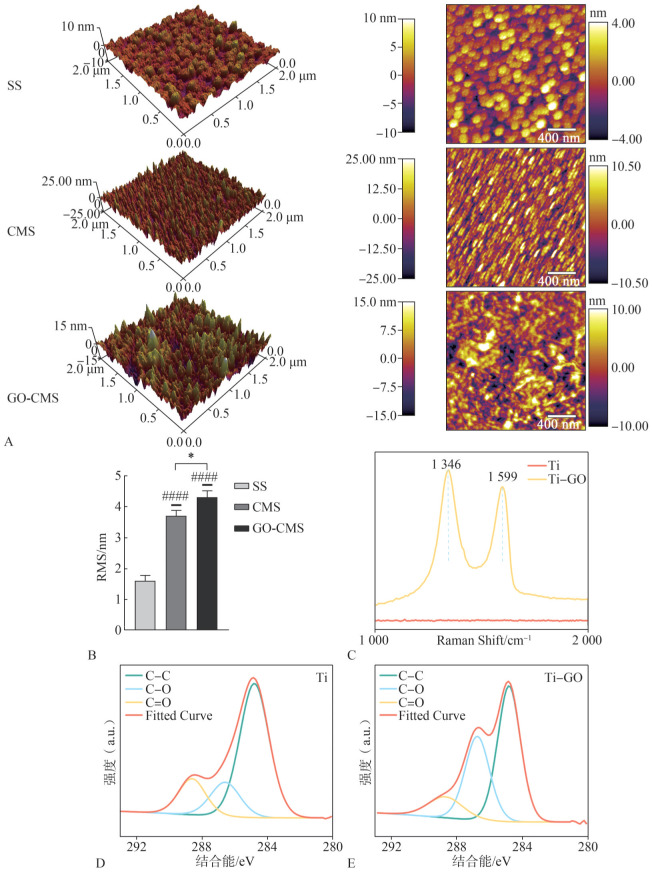
SS、CMS和GO-CMS组的原子力显微镜分析见图3A,结合均方根粗糙度(root-mean-square roughness,RMS)检测结果(图3B)可知,修饰微沟槽后粗糙度提高,差异具有统计学意义(P<0.05)。GO-CMS组粗糙度大于CMS和SS组,差异具有统计学意义(P<0.05)。图3C为修饰GO后的拉曼光谱图,在1 346和1 599 cm−1处为GO的拉曼特征峰,表明成功涂覆了GO涂层。修饰GO涂层后的XPS分析结果可见,在284.8 eV出现C-C的特征峰,286.8 eV出现一个C-O键的特征峰,288.8 eV出现C=O双键特征峰。与修饰前(图3D)相比,修饰GO后,材料表面含氧基团(C-O)的比例增大(图3E)。
图 3. 材料理化性能检测.
Fig 3 Material physicochemical property testing
A:原子力显微镜图;B:RMS;C:拉曼光谱图;D:Ti的XPS分析图;E:修饰GO后的XPS分析图。CMS组和GO-CMS组相比较,*P<0.05;与SS组相比,####P<0.000 1。
2.3. 巨噬细胞RAW264.7的培养及破骨诱导
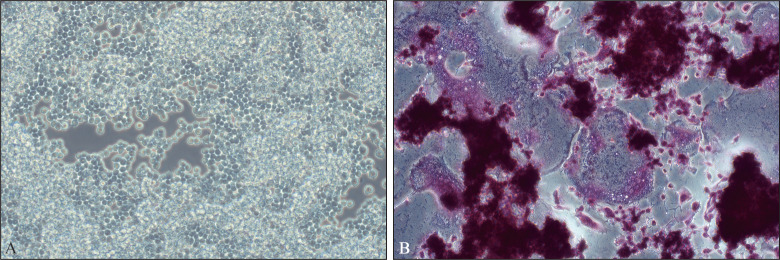
如图4A所示,RAW264.7为圆形透亮的小鼠巨噬细胞,贴壁生长,图4B为用RANKL诱导培养5 d后的TRAP染色图,可见蓝紫色颗粒定位于胞浆中,满足破骨细胞的判定依据:可见3个及3个以上的细胞核;TRAP染色阳性。由此得出结论,该细胞状态良好,可以诱导形成多核破骨细胞。
图 4. RAW264.7细胞培养及破骨诱导.
Fig 4 RAW264.7 cell culture and osteoclast induction
A:RAW264.7培养3 d的光镜图 × 200;B:诱导5 d的TRAP染色图 × 200。
2.4. 材料表面巨噬细胞RAW264.7活性检测
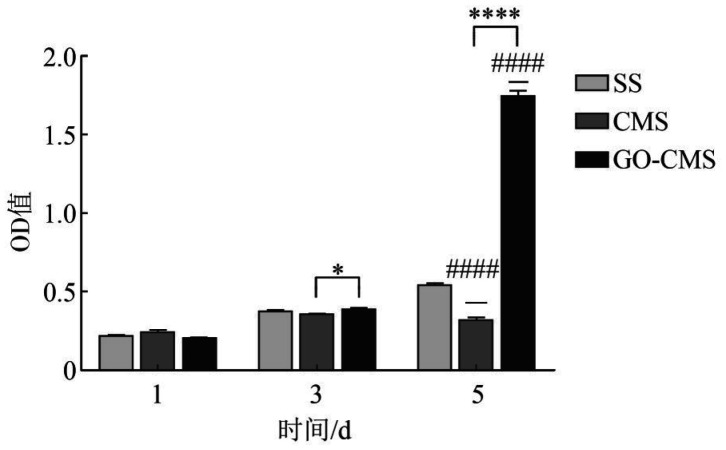
巨噬细胞RAW264.7在材料表面培养1、3和5 d时的CCK-8实验结果见图5。第3天时,GO-CMS组的细胞活性高于CMS组,且这个差异在第5天变得更加明显,差异具有统计学意义(P<0.05)。同时,第5天时CMS组OD低于SS组,说明微沟槽抑制了巨噬细胞的增殖,差异具有统计学意义(P<0.05)。
图 5. 3组材料表面巨噬细胞RAW264.7增殖检测.
Fig 5 Proliferation assay of macrophages RAW264.7 on the surface of three groups of materials
CMS组和GO-CMS组相比较,*P<0.05,****P<0.000 1;与SS组相比,####P<0.000 1。
2.5. SEM观察材料表面巨噬细胞RAW264.7的形态
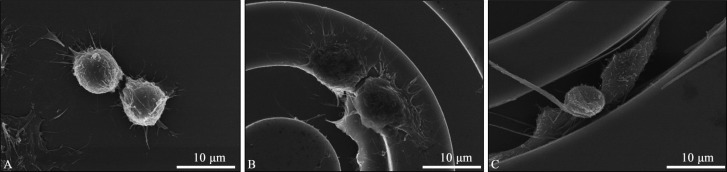
巨噬细胞在材料表面培养1 d后的SEM观察结果见图6,与SS组相比,CMS组的巨噬细胞沿着沟槽方向生长,GO-CMS组的巨噬细胞进入沟槽里面,同样顺着沟槽方向排列成同心圆状。
图 6. 3组材料表面巨噬细胞RAW264.7的SEM图.
Fig 6 SEM of macrophages RAW264.7 on the surface of three groups of materials
A:SS组;B:CMS组;C:GO-CMS组。
2.6. 材料表面巨噬细胞RAW264.7免疫荧光染色
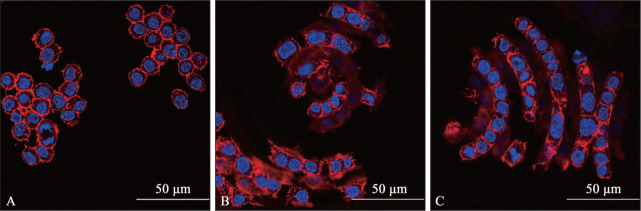
巨噬细胞RAW264.7在SS组表面无序排列,而在CMS和GO-CMS组,巨噬细胞顺着沟槽方向排列成同心圆状,沟槽宽度正好与巨噬细胞的大小相匹配(图7)。
图 7. 3组材料表面巨噬细胞RAW264.7免疫荧光染色.
Fig 7 Immunofluorescence staining of macrophages RAW264.7 on the surface of three groups of materials
A:SS组;B:CMS组;C:GO-CMS组。红色为细胞骨架,蓝色为细胞核。
2.7. 材料表面巨噬细胞RAW264.7破骨诱导TRAP免疫荧光染色
如图8所示,巨噬细胞RAW264.7在材料片上诱导培养5 d,进行免疫荧光染色,SS组可见明显巨大的破骨细胞肌动蛋白环,数量也较另外两组多,CMS和GO-CMS组几乎看不到大的破骨细胞,且数量更少。而对于TRAP荧光分布可见CMS和GO-CMS组低于对照组SS,说明同心圆微沟槽和GO可能抑制了TRAP的表达,仍需要进一步定量分析。
图 8. 材料表面RAW264.7破骨诱导TRAP免疫荧光染色.
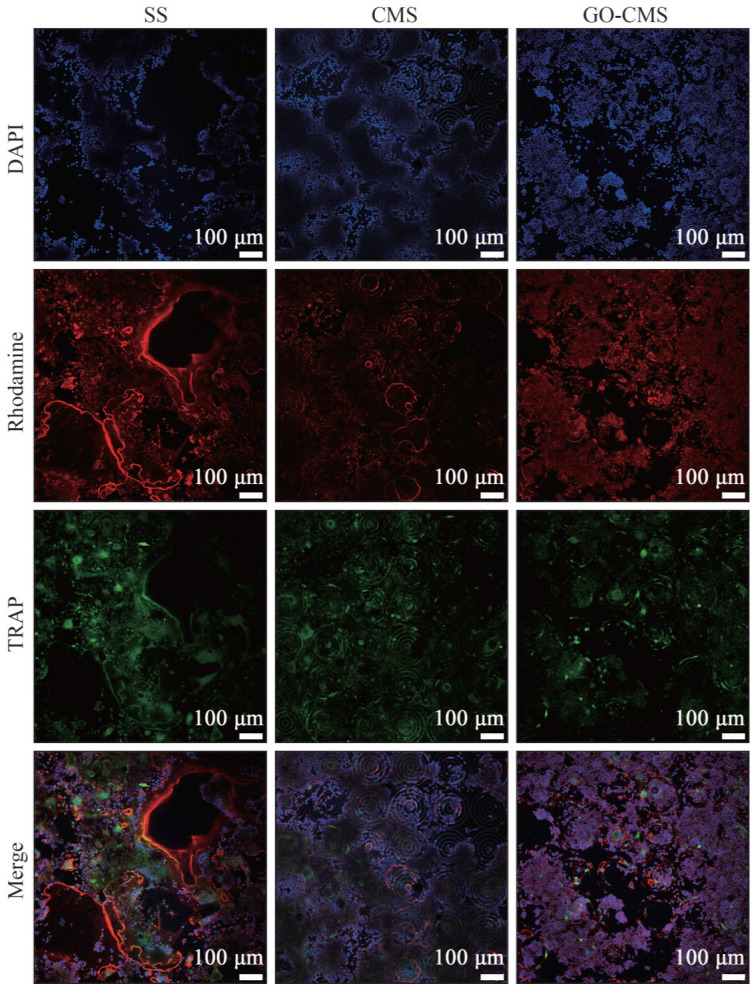
Fig 8 Immunofluorescence staining of RAW264.7 osteoclast-induced TRAP on the material surface
蓝色为细胞核,红色为细胞骨架,绿色为TRAP。
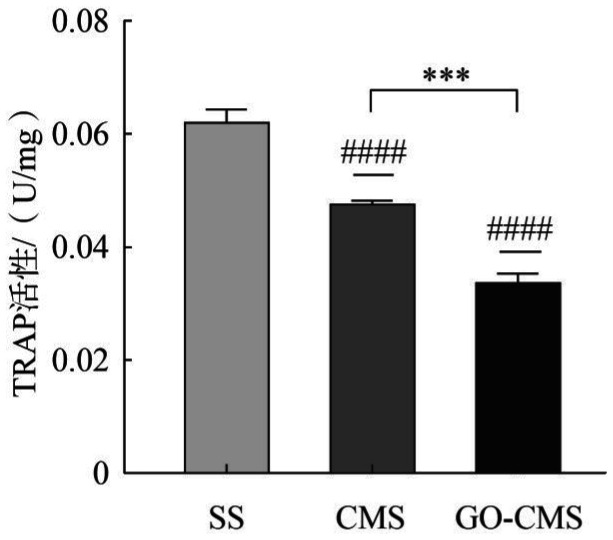
2.8. 材料表面TRAP定量检测
将RAW264.7接种于6孔板诱导培养至5 d后,终止培养,进行TRAP定量检测。如图9所示,同心圆微沟槽抑制TRAP的表达(CMS组与SS组相比),同时GO-CMS组与CMS组相比,TRAP活性下降,差异具有统计学意义(P<0.001)。GO-CMS与对照组SS相比,TRAP活性明显下降。
图 9. RAW264.7在GO修饰材料表面通过RANKL诱导培养5 d的TRAP定量检测.
Fig 9 Quantitative detection of TRAP of RAW264.7 cultured on the surface of GO-modified material induced by RANKL for 5 days
CMS组和GO-CMS组相比较,***P<0.001;与SS组相比,####P<0.000 1。
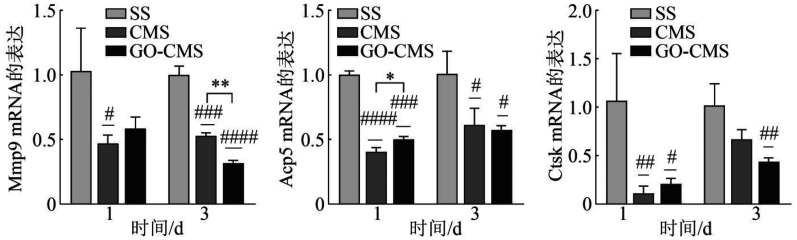
2.9. 破骨分化相关基因检测
巨噬细胞接种于3组材料表面,分别诱导1 d和3 d后,检测各阶段的破骨分化相关基因的表达。无论是第1天还是第3天,CMS组和GO-CMS组破骨分化相关基因Mmp9、Acp5和Ctsk的表达均低于SS组。对于Mmp9的表达,第1天时CMS组表达量最低,第3天时GO-CMS组表达量低于SS和CMS组,差异均具有统计学意义(P<0.05)。而Acp5和Ctsk的表达,第1天时CMS表达量最低,与SS组相比,CMS和GO-CMS组表达量下降,第3天时差异缩小,但均比SS组低,差异具有统计学意义(P<0.05)(图10)。
图 10. qRT-PCR检测破骨分化相关基因的表达.
Fig 10 qRT-PCR to detect the expression of genes related to osteoclastic differentiation
CMS组和GO-CMS组相比较,*P<0.05,**P<0.01;与SS组相比,#P<0.05,##P<0.01,###P<0.001,####P<0.000 1。
3. 讨论
种植体的长期成功取决于骨结合[9],钛种植体骨整合过程中的关键阶段是初始骨重建,在此过程破骨细胞前体、破骨细胞、BMSCs和成骨细胞之间相互作用[10]。破骨前体细胞为单细胞核,分化程度较低,并具有向骨表面移动的能力,并逐步分化为多核、分化程度更高的破骨细胞[11]。成熟的破骨细胞附着在矿化的骨基质上,形成一个封闭区,启动骨吸收[12]。破骨细胞除了调节再吸收腔隙中的pH外,还分泌Mmp9和Ctsk来降解骨基质胶原[13]。
近年来,骨植入材料对破骨细胞影响也逐渐被认识,破骨细胞的功能受生物材料的理化性质影响,特别是表面微结构与粗糙度[14]–[16]。Makihira等[17]研究表明钛表面微结构导致的粗糙度的增加增强了TRAP和CTSK的表达,通过激活RANK-TRAF6信号网络促进了破骨细胞的分化。Davison等[18]制备不同表面结构的双相磷酸钙(BCP),发现钛涂层BCP表面结构尺寸(小于1 µm)促进破骨细胞和新生骨形成,而较大的表面结构(2~4 µm)抑制了破骨细胞的融合以及TRAP的活性。表面规律微图形影响巨噬细胞破骨分化的表型研究少有报道,仅有动物实验研究[19]发现,平行沟槽化的种植体表面促进骨结合的同时明显减少了破骨细胞形成的骨吸收陷窝。本研究的免疫荧光染色结果显示,CMS组不能融合成大的破骨细胞,且数量较少,抑制了TRAP的活性,减少了TRAP的表达。
同时同心圆微沟槽抑制了Acp5、Mmp9和Ctsk的表达,进而抑制破骨分化。因此,不同的表面结构对破骨细胞的融合起到不同的影响,虽然纳米级粗糙度增加了细胞黏附,形成了稳定的封闭区,增加破骨细胞的活性[17],而本研究中微米级沟槽很好地抑制了破骨前体细胞融合成多核破骨细胞,同时圆形微沟槽的隔断影响封闭区的完整性进而抑制破骨分化。沟槽的存在也增加了材料的微米粗糙度,这也与Geblinger等[20]的研究一致,微米级的表面形貌可以影响封闭区的动力学,从而抑制破骨细胞的融合,影响破骨分化。Zhang等[14]研究发现在较光滑的表面上,不存在阻碍破骨细胞融合的地形特征,因此,细胞能在这些表面上形成大尺寸的破骨细胞。相比之下,在粗糙的表面上,地形特征可能会阻碍细胞融合过程,从而产生尺寸较小的破骨细胞。
GO作为碳纳米材料的衍生物,由碳原子凝聚成二维的蜂窝晶格结构,表面分布大量羧基、羟基或环氧基,从CCK-8活性检测可见,修饰GO后RAW264.7的细胞活性明显上升,这与材料亲水性的提高有很大关系。GO-CMS组与CMS组相比,修饰GO后细胞更容易进入沟槽内,RAW264.7顺着同心圆微沟槽方向排列成同心圆状,表明同心圆微沟槽同样对巨噬细胞铺展过程中产生“接触诱导”,使得肌动蛋白的聚合受到机械力的影响,将形成并沿沟槽方向延伸,从而增加细胞的接触与交流[21]–[23]。粗糙的表面微结构可以增加细胞的可接触面积,进一步提高细胞黏附,这可能是促进表面细胞生长的积极因素。同心圆微沟槽增大了细胞与材料表面的接触面积,提高了材料表面的储水能力,GO涂层丰富的含氧基团使得材料表面亲水性提高,同心圆微沟槽和GO涂层对细胞行为有积极影响,协同促进了巨噬细胞的迁移和增殖。
已经有大量的研究[24]–[26]证实GO有很好的成骨促进效能。此外,研究[27]–[29]显示修饰有GO的复合材料可以促进巨噬细胞往抗炎型M2方向极化,GO对骨免疫有一定的调节作用,修饰有GO的复合材料可以促进巨噬细胞往M2方向极化[27],但GO对破骨细胞的影响少有报道。Dou等[8]的研究中GO作为药物载体,可以被内吞进破骨细胞,进而影响其功能。Zeng等[30]在研究不同比例的GO对破骨细胞影响时发现,破骨细胞生成并不受影响。推测GO可能被破骨细胞吸收然后降解,导致对破骨细胞的活性没有显著影响。GO被巨噬细胞内吞,这些活化的巨噬细胞随后通过抑瘤素M和核转录因子-κB途径增强BMSCs的成骨功能。此外,它通过血管内皮生长因子途径刺激了人脐静脉内皮细胞的血管生成,这对骨再生也很重要[31]。
由本实验结果可知,GO-CMS具有较好的破骨抑制功能,降低了TRAP的表达,也抑制了破骨分化相关基因的表达,可能因为GO增大材料亲水性使得巨噬细胞更容易进入沟槽,沟槽的隔断作用限制了更多进入沟槽的巨噬细胞融合成破骨细胞,此外,GO强化了同心圆微沟槽的破骨抑制效果,也可能是因为巨噬细胞内吞GO,极化后的巨噬细胞形态发生改变[32],进而融合成破骨细胞受阻。Zhou等[15]的研究表明,微纳米表面形貌可以促使巨噬细胞向M2型极化,M2型巨噬细胞在抗炎过程中发挥关键作用,进而抑制破骨细胞活性。而破骨细胞内吞GO,也会影响其破骨分化功能。
综上所述,GO修饰的类骨单位同心圆结构增大材料亲水性,促进了RAW264.7的增殖,通过GO与微沟槽的叠加抑制破骨细胞融合与封闭区的形成,进一步抑制破骨功能分化,对促进种植的早期骨结合,尤其是骨质疏松症等骨愈合受损的患者具有更为突出的意义,为未来研究种植体改性提供新思路。
Funding Statement
[基金项目] 福建省自然科学基金面上项目(2022J011408);厦门医学院自然科学类项目(K2021-06);厦门市医疗卫生指导性项目(3502Z20214ZD1318)
Supported by: Natural Science Foundation of Fujian Province (2022J011408); The Natural Science Foundation of Xiamen Medical College (K2021-06); The Xiamen Medical and Health Guidance Project (3502Z20214ZD1318).
Footnotes
利益冲突声明:作者声明本文无利益冲突。
References
- 1.Xu J, Zhang J, Shi Y, et al. Surface modification of biomedical Ti and Ti alloys: a review on current advances[J] Materials (Basel) 2022;15(5):1749. doi: 10.3390/ma15051749. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Wu X, Wang S. Biomimetic calcium carbonate concentric microgrooves with tunable widths for promoting MC3T3-E1 cell functions[J] Adv Healthc Mater. 2013;2(2):326–333. doi: 10.1002/adhm.201200205. [DOI] [PubMed] [Google Scholar]
- 3.Zhang Q, Lin S, Zhang T, et al. Curved microstructures promote osteogenesis of mesenchymal stem cells via the RhoA/ROCK pathway[J] Cell Prolif. 2017;50(4):e–12356. doi: 10.1111/cpr.12356. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Zhou L, You J, Wang Z, et al. 3D printing monetite-coated Ti-6Al-4V surface with osteoimmunomodulatory function to enhance osteogenesis[J] Biomater Adv. 2022;134:112562. doi: 10.1016/j.msec.2021.112562. [DOI] [PubMed] [Google Scholar]
- 5.Boyan BD, Berger MB, Nelson FR, et al. The biological basis for surface-dependent regulation of osteogenesis and implant osseointegration[J] J Am Acad Orthop Surg. 2022;30(13):e894–e898. doi: 10.5435/JAAOS-D-21-00523. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Liao B, Xu C, Wang Z, et al. Preparation of chitosan-tannic acid coating and its anti-osteoclast and antibacterial activities in titanium implants[J] J Bone Miner Metab. 2022;40(3):402–414. doi: 10.1007/s00774-022-01309-7. [DOI] [PubMed] [Google Scholar]
- 7.Su J, Du Z, Xiao L, et al. Graphene oxide coated titanium surfaces with osteoimmunomodulatory role to enhance osteogenesis[J] Mater Sci Eng C Mater Biol Appl. 2020;113:110983. doi: 10.1016/j.msec.2020.110983. [DOI] [PubMed] [Google Scholar]
- 8.Dou C, Ding N, Luo F, et al. Graphene-based microRNA transfection blocks preosteoclast fusion to increase bone formation and vascularization[J] Adv Sci (Weinh) 2017;5(2):1700578. doi: 10.1002/advs.201700578. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Brånemark R, Brånemark PI, Rydevik B, et al. Osseointegration in skeletal reconstruction and rehabilitation: a review[J] J Rehabil Res Dev. 2001;38(2):175–181. [PubMed] [Google Scholar]
- 10.Young PS, Tsimbouri PM, Gadegaard N, et al. Osteoclastogenesis/osteoblastogenesis using human bone marrow-derived cocultures on nanotopographical polymer surfaces[J] Nanomedicine (Lond) 2015;10(6):949–957. doi: 10.2217/nnm.14.146. [DOI] [PubMed] [Google Scholar]
- 11.Feng X, Teitelbaum SL. Osteoclasts: new insights[J] Bone Res. 2013;1(1):11–26. doi: 10.4248/BR201301003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Portes M, Mangeat T, Escallier N, et al. Nanoscale architecture and coordination of actin cores within the sealing zone of human osteoclasts[J] Elife. 2022;11:e75610. doi: 10.7554/eLife.75610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Amarasekara DS, Yun H, Kim S, et al. Regulation of osteoclast differentiation by cytokine networks[J] Immune Netw. 2018;18(1):e8. doi: 10.4110/in.2018.18.e8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhang Y, Chen SE, Shao J, et al. Combinatorial surface roughness effects on osteoclastogenesis and osteogenesis[J] ACS Appl Mater Interfaces. 2018;10(43):36652–36663. doi: 10.1021/acsami.8b10992. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Zhou Y, Tang C, Deng J, et al. Micro/nano topography of selective laser melting titanium inhibits osteoclastogenesis via mediation of macrophage polarization[J] Biochem Biophys Res Commun. 2021;581:53–59. doi: 10.1016/j.bbrc.2021.09.021. [DOI] [PubMed] [Google Scholar]
- 16.Yu X, Xu R, Zhang Z, et al. Different cell and tissue behavior of micro-/nano-tubes and micro-/nano-nets topographies on selective laser melting titanium to enhance osseointegration[J] Int J Nanomedicine. 2021;16:3329–3342. doi: 10.2147/IJN.S303770. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Makihira S, Mine Y, Kosaka E, et al. Titanium surface roughness accelerates RANKL-dependent differentiation in the osteoclast precursor cell line, RAW264.7[J] Dent Mater J. 2007;26(5):739–745. doi: 10.4012/dmj.26.739. [DOI] [PubMed] [Google Scholar]
- 18.Davison NL, Su J, Yuan H, et al. Influence of surface microstructure and chemistry on osteoinduction and osteoclastogenesis by biphasic calcium phosphate discs[J] Eur Cell Mater. 2015;29:314–329. doi: 10.22203/ecm.v029a24. [DOI] [PubMed] [Google Scholar]
- 19.Shin SY, Han DH. Influence of a microgrooved collar design on soft and hard tissue healing of immediate implantation in fresh extraction sites in dogs[J] Clin Oral Implants Res. 2010;21(8):804–814. doi: 10.1111/j.1600-0501.2010.01917.x. [DOI] [PubMed] [Google Scholar]
- 20.Geblinger D, Zink C, Spencer ND, et al. Effects of surface microtopography on the assembly of the osteoclast resorption apparatus[J] J R Soc Interface. 2012;9(72):1599–1608. doi: 10.1098/rsif.2011.0659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Nagayama K, Hanzawa T. Cell type-specific orientation and migration responses for a microgrooved surface with shallow grooves[J] Biomed Mater Eng. 2022;33(5):393–406. doi: 10.3233/BME-211356. [DOI] [PubMed] [Google Scholar]
- 22.Hu P, Gao Q, Zheng H, et al. The role and activation mechanism of TAZ in hierarchical microgroove/nanopore topography-mediated regulation of stem cell differentiation[J] Int J Nanomedicine. 2021;16:1021–1036. doi: 10.2147/IJN.S283406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Zhang X, Aoyama T, Yasuda T, et al. Effect of microfabricated microgroove-surface devices on the morphology of mesenchymal stem cells[J] Biomed Microdevices. 2015;17(6):116. doi: 10.1007/s10544-015-0016-0. [DOI] [PubMed] [Google Scholar]
- 24.Şelaru A, Herman H, Vlăsceanu GM, et al. Graphene-oxide porous biopolymer hybrids enhance in vitro osteogenic differentiation and promote ectopic osteogenesis in vivo[J] Int J Mol Sci. 2022;23(1):491. doi: 10.3390/ijms23010491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Liu M, Hao L, Huang Q, et al. Tea polyphenol-reduced graphene oxide deposition on titanium surface enhances osteoblast bioactivity[J] J Nanosci Nanotechnol. 2018;18(5):3134–3140. doi: 10.1166/jnn.2018.14649. [DOI] [PubMed] [Google Scholar]
- 26.Fu C, Yang X, Tan S, et al. Enhancing cell proliferation and osteogenic differentiation of MC3T3-E1 pre-osteoblasts by BMP-2 delivery in graphene oxide-incorporated PLGA/HA biodegradable microcarriers[J] Sci Rep. 2020;10(1):6249. doi: 10.1038/s41598-020-63110-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Sun J, Li L, Xing F, et al. Graphene oxide-modified silk fibroin/nanohydroxyapatite scaffold loaded with urine-derived stem cells for immunomodulation and bone regeneration[J] Stem Cell Res Ther. 2021;12(1):591. doi: 10.1186/s13287-021-02634-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Han J, Kim YS, Lim MY, et al. Dual roles of graphene oxide to attenuate inflammation and elicit timely polarization of macrophage phenotypes for cardiac repair[J] ACS Nano. 2018;12(2):1959–1977. doi: 10.1021/acsnano.7b09107. [DOI] [PubMed] [Google Scholar]
- 29.Hung HS, Kung ML, Chen FC, et al. Nanogold-carried graphene oxide: anti-inflammation and increased differentiation capacity of mesenchymal stem cells[J] Nanomaterials (Basel) 2021;11(8):2046. doi: 10.3390/nano11082046. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Zeng Y, Zhou M, Chen L, et al. Alendronate loaded graphene oxide functionalized collagen sponge for the dual effects of osteogenesis and anti-osteoclastogenesis in osteoporotic rats[J] Bioact Mater. 2020;5(4):859–870. doi: 10.1016/j.bioactmat.2020.06.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Xue D, Chen E, Zhong H, et al. Immunomodulatory properties of graphene oxide for osteogenesis and angiogenesis[J] Int J Nanomedicine. 2018;13:5799–5810. doi: 10.2147/IJN.S170305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Tylek T, Blum C, Hrynevich A, et al. Precisely defined fiber scaffolds with 40 µm porosity induce elongation driven M2-like polarization of human macrophages[J] Biofabrication. 2020;12(2):025007. doi: 10.1088/1758-5090/ab5f4e. [DOI] [PubMed] [Google Scholar]