Abstract
Introduction:
Megaloblastic anemias secondary to Vitamin B12 deficiency are a group of pathologies produced by defective nuclear DNA synthesis.
Objective:
To describe the maturation alterations found in hematopoietic precursors of the bone marrow in a series of patients with megaloblastic anemia.
Methods:
Were included patients attended at the Regional Hospital of Concepción with bone marrow samples sent for the study of cytopenia by flow cytometry whose final diagnosis was megaloblastic anemia. The immunophenotype was performed with CD45, CD34, CD117, HLA-DR, markers of neutrophil (CD13, CD11b, CD10, CD16) and/or erythroblast (CD105, CD71, CD36) maturation.
Results:
From the flow cytometry laboratory database, 8 patients with megaloblastic anemia were identified, and myelodysplastic syndromes (n=9) and normal or reactive bone marrow (n=10) were used as controls. 44% were men, with a median age of 58 years. Megaloblastic anemia was associated with a higher proportion of size and complexity of erythroid and myeloid progenitors compared to lymphocytes compared to controls. The total percentage of erythroblasts and the proportion of CD34+ myeloid cells associated with erythroid lineage was higher in megaloblastic anemia, associated with a maturation arrest in the CD105+ precursor stage (69% vs 19% and 23%, p<0.001). The heterogeneity of CD36 and CD71 in megaloblastic anemia was similar to myelodysplastic syndromes.
Conclusions:
Megaloblastic anemia produces a heterogeneous involvement of hematopoiesis, characterized by a greater size and cellular complexity of precursors of the neutrophil and erythroid series and a maturation arrest of the erythroblasts.
Keywords: Anemia, Megaloblastic; cytometry, flow; marrow, bone; Vitamin B 12 Deficiency; cobalamin
Resumen
Introducción:
Anemias megaloblásticas secundarias a la deficiencia de vitamina B12 son patologías producidas por una síntesis defectuosa del ADN nuclear.
Objetivo:
Describir las alteraciones madurativas encontradas en precursores hematopoyéticos de la médula ósea de una serie de pacientes con anemia megaloblástica.
Métodos:
Se incluyeron pacientes atendidos en el Hospital Regional de Concepción con muestras de médula ósea enviadas para estudio de citopenias por citometría de flujo cuyo diagnóstico fue anemia megaloblástica. El inmunofenotipo se realizó con CD45, CD34, CD117, HLA-DR, marcadores de maduración de serie de neutrófilo (CD13, CD11b, CD10, CD16) y/o eritroblasto (CD105, CD71, CD36).
Resultados:
Se identificaron 8 pacientes con anemia megaloblástica y como controles se utilizaron síndromes mielodisplásicos (n=9) y médula ósea normal o reactiva (n=10). El 44% eran hombres, con una mediana de edad de 58 años. La anemia megaloblástica se asoció con una mayor proporción de tamaño y complejidad de progenitores eritroides y mieloides con respecto de los linfocitos en comparación a los controles. El porcentaje total de eritroblastos y la proporción de células mieloides CD34+ comprometidas con el linaje eritroide fue mayor en anemia megaloblástica, asociado a una parada madurativa en la etapa de precursor CD105+ (69% vs 19% y 23%, p <0.001). La heterogeneidad de CD36 y CD71 en anemia megaloblástica fue similar a los síndromes mielodisplásicos.
Conclusiones:
la anemia megaloblástica produce una afectación heterogénea de la hematopoyesis, caracterizada por un mayor tamaño y complejidad celulares de precursores de la serie neutrófilo y eritroide y una detención madurativa de los eritroblastos.
Palabras clave: Anemia megaloblástica, citometría de flujo, célula de médula ósea, deficiencia de cobalamina, deficiencia de ácido fólico, deficiencia de vitamina B12, hematopoyesis, eritroblastos
Remark
| 1) Why was this study conducted? |
| To describe the characteristic alterations of megaloblastic anemia found by flow cytometry in bone marrow, after finding no related information on this topic in the literature. |
| 2) What were the most relevant results of the study? |
| The results of the study describe a characteristic pattern of alterations (arrest in maturation associated with an increased relation in FSC/SSC ratio) in bone marrow precursors of patients with megaloblastic anemia, mainly affecting erythroblast series. |
| 3) What do these results contribute? |
| These results allow for diagnosis of this disorder even before the plasma levels of vitamin B12 have been determined and therefore guide treatment, especially in centers where the accessibility to this laboratory parameter is not permanent. |
Introduction
Megaloblastic anemia corresponds to a group of pathologies produced by defective synthesis of nuclear DNA due to deficiency of vitamin B12 or folic acid 1 , 2 . The clinical manifestations are systemic, being able to be hematological, neurological and psychiatric. The diagnosis is usually clinical, supported by general exams such as the hemogram, indirect evidence of ineffective hematopoiesis in the biochemical profile (elevation of LDH and indirect bilirubin), associated with low plasma levels of vitamin B12 and the elevation of metabolites such as methylmalonic acid and homocysteine 2 - 4 .
The study of the bone marrow in patients with megaloblastic anemia is not routine and is performed in cases where other causes of bone marrow failure must be ruled out, such as malignant hematologic diseases. The morphological findings include hypercellular bone marrow, with an increase in the size of the hematopoietic precursors due to asynchrony in maturation between the nucleus and cytoplasm. These characteristics must be interpreted cautiously due to overlapping with those observed in other pathologies such as myelodysplastic syndromes 5 .
Flow cytometry is a complementary diagnostic tool that can describe the maturation of myeloid progenitors and is often used in the initial diagnostic approach of the patient with bone marrow failure.
The present report aims to describe the maturational alterations in the hematopoietic cells of the bone marrow observed with flow cytometry in patients with megaloblastic anemia presented at diagnosis with intense cytopenias.
Material and Methods
A retrospective observational study was conducted. Data from the flow cytometry laboratory of the Regional Hospital of Concepción contained in the FileMaker software was obtained from cases of patients referred for cytopenic study and ultimately diagnosed with megaloblastic anemia. For these purposes, the words "anemia" and "megaloblastic" were used in samples sent between January 2015 and December 2018. Megaloblastic anemia was defined as anemia associated with one or more cytopenia in the presence of reduced plasma levels of vitamin B12.
The bone marrow samples from each patient were collected in tubes conditioned with anticoagulant (EDTA) and processed before 48 hours, according to the usual surface labeling protocol (stain-lyse-wash). For immunophenotype, two 8-color tubes panel were used, which included fluorescences (V450, V500, FITC, PE, PerCP-Cy5.5, PE-Cy7, APC and APC-H7), with markers of immature hematopoietic precursor (HLA-DR, CD45, CD34 and CD117), associated with markers of differentiation into neutrophil (CD16, CD13, CD11b, CD10) and/or erythroblast (CD36, CD105, CD71) 6 , the proportion of CD36+ CD71+ without expression of CD13 and CD33 was considered to measure the erythroid differentiation of CD34+ cells. In the neutrophil and erythroblast series, immunophenotypic classification of maturation stages was performed according to the acquisition patterns of the previously marked antigens, as published by other authors 7 - 9 . The heterogeneity in CD36 and CD71 expression in erythroblasts was evaluated by measuring the negative proportion to both markers in the erythroid population in the dot/plot between them once platelets (CD45- CD36 + CD71-) were excluded. Physical parameters were estimated by taking a ratio between the complexity peak channel (side scatter, SSC) and cell size (forward scatter, FSC) of neutrophils and erythroblasts about a similar parameter of the total lymphocyte population.
The acquisition was carried out on FACSCantoII® cytometer using DIVA software (BD Biosciences, San José, California). The analysis of the cytometry was carried out by Infinicyt® software (Cytognos, Salamanca, Spain). The institutional ethics committee approved the study.
Statistical analysis
Categorical data were presented as median, n and percentages and numerical data as median and range. The Ji 2 test was used to analyze differences between categorical variables and the Kruskal-Wallis test for numerical ones. Statistical analysis was performed with SPSS statistical software, considering a p <0.05 to be significant.
Results
Eight patients with megaloblastic anemia were identified, and samples from patients diagnosed with myelodysplastic syndrome (n= 9) and normal/reactive bone marrow or bone marrow unaffected by myeloid pathology (n= 10) were used as controls. In the total series, 12/27 (44%) were male, and 15/27 (36%) were female, with a median age of 58 years (19-81). The other characteristics of patients with megaloblastic anemia are shown in Table 1.
Table 1. Demographic and clinical characteristics of patients with megaloblastic anemia (n= 8).
| Clinical parameter | Mean |
|---|---|
| Age, years (range) | 61 (40-81) |
| Male, (n) | 5 |
| Laboratory Parameter | |
| White blood cells, cells/mm3 (range) | 2,680 (1,120-6,970) |
| Hemoglobin, g/dL (rango) | 6.1 (4.6-7.9) |
| Hematocrit, % (rango) | 17.6 (14.0-22.0) |
| Platelets, cells/mm3 (rango) | 92,000 (21,000-155,000) |
| MCV, fL (rango) | 113 (99-125) |
| LDH, U/L (rango) | 2,819 (996-4,568) |
| Erythroblasts in bone marrow, % | 39 (9-54) |
MCV: mean corpuscular volume, LDH: lactodehydrogenase;
The reference diagnoses in the myelodysplastic syndrome group were refractory cytopenia with multilineage dysplasia (n= 4), refractory anemia with excess of blasts (n = 4) and unclassified myelodysplastic syndrome (n= 1) and in normal bone marrow non-Hodgkin's lymphoma (n= 2), Hodgkin's lymphoma (n= 2), and reactive bone marrow (n= 6). The results of the immunophenotypic analysis are shown in Table 2. The proportion of immature hematopoietic cells (CD34+ and CD34-/CD117+) was similar among the three groups. In megaloblastic anemia, a higher proportion of CD34+ cells without CD13 expression than that of normal bone marrow and myelodysplastic syndromes was observed (58% vs. 50% and 29%, p= 0.03), which was associated with a higher differentiation of CD34+ cells to the erythroid line than to normal bone marrow and myelodysplastic syndromes (29% vs. 16% and 14%, p <0.005), a finding that was not observed in CD34-/CD117+ progenitors.
Table 2. Flow cytometry analysis results summary.
| Parameter | MA (n= 8) | NRBM (n= 10) | MDS (n= 9) |
|---|---|---|---|
| Immature myeloid cells | |||
| %CD34+ cells (total) | 1.8 | 1.1 | 3.7 |
| %CD34+CD13- | 58 | 50 | 29 |
| %CD34+ CD36+CD71+ | 29* | 16 | 14 |
| %CD34-CD117+ (total) | 4 | 1.2** | 3.1 |
| %CD34-CD117+ CD13- | 45 | 29 | 37 |
| Neutrophil precursors | |||
| % neutrophils (total) | 35 | 68** | 43 |
| % Stage I | 10 | 1.3 | 2.8 |
| % Stage II | 26 | 13** | 35 |
| % Stage I + II | 35 | 14** | 40 |
| Erythroblasts precursors | |||
| % erythroblast (total) | 35 | 68** | 43 |
| % CD105+ precursors | 69** | 19 | 23 |
| % CD36-CD71- erythroblasts | 23 | 3.3** | 25 |
| Physical parameters | |||
| FSC-A erythroid/lymphocyte | 0.8 | 0.7 | 0.7 |
| SSC-A erythroid/lymphocyte | 1.0* | 0.5 | 0.5 |
| FSC-A neutrophil/lymphocyte | 4.7* | 2.4 | 2.4 |
| SSC-A neutrophil/lymphocyte | 18.0** | 4.8 | 6.8 |
MA: megaloblastic anemia; NRBM: normal/reactive bone marrow; MDS: myelodysplastic syndrome; FSC-A: forward scatter; SSC-A: side scatter; NS: not statistically significant; * <0.05; ** <0.01.
The neutrophil series was found in less proportion in megaloblastic anemia compared to normal bone marrow and myelodysplastic syndromes (35% vs. 68% and 43%, p <0.001). A maturation arrest was observed, with an increase in stages I and II in megaloblastic anemia and myelodysplastic syndromes compared to normal bone marrow (35% vs. 40% and 14%, p <0.0001).
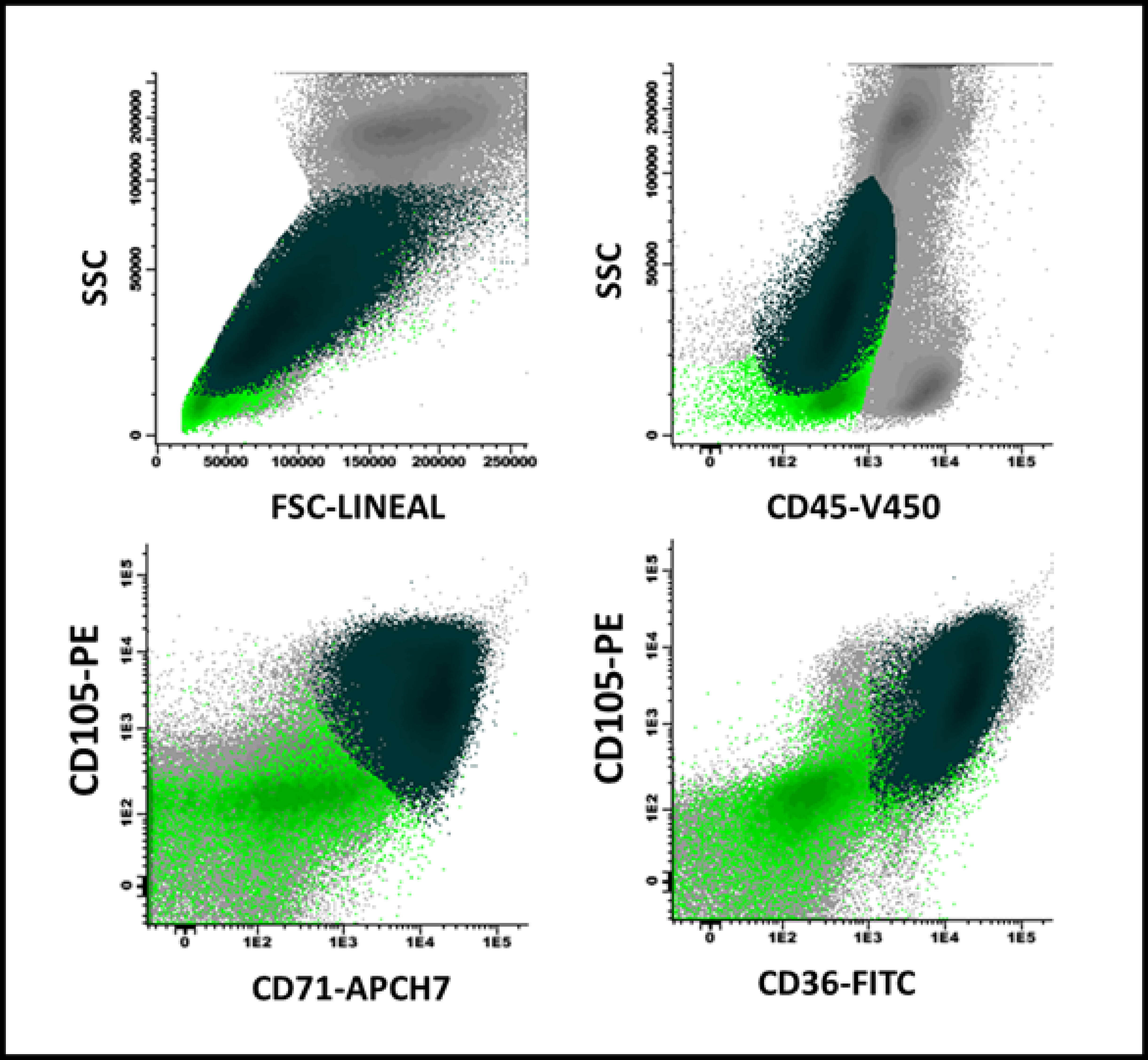
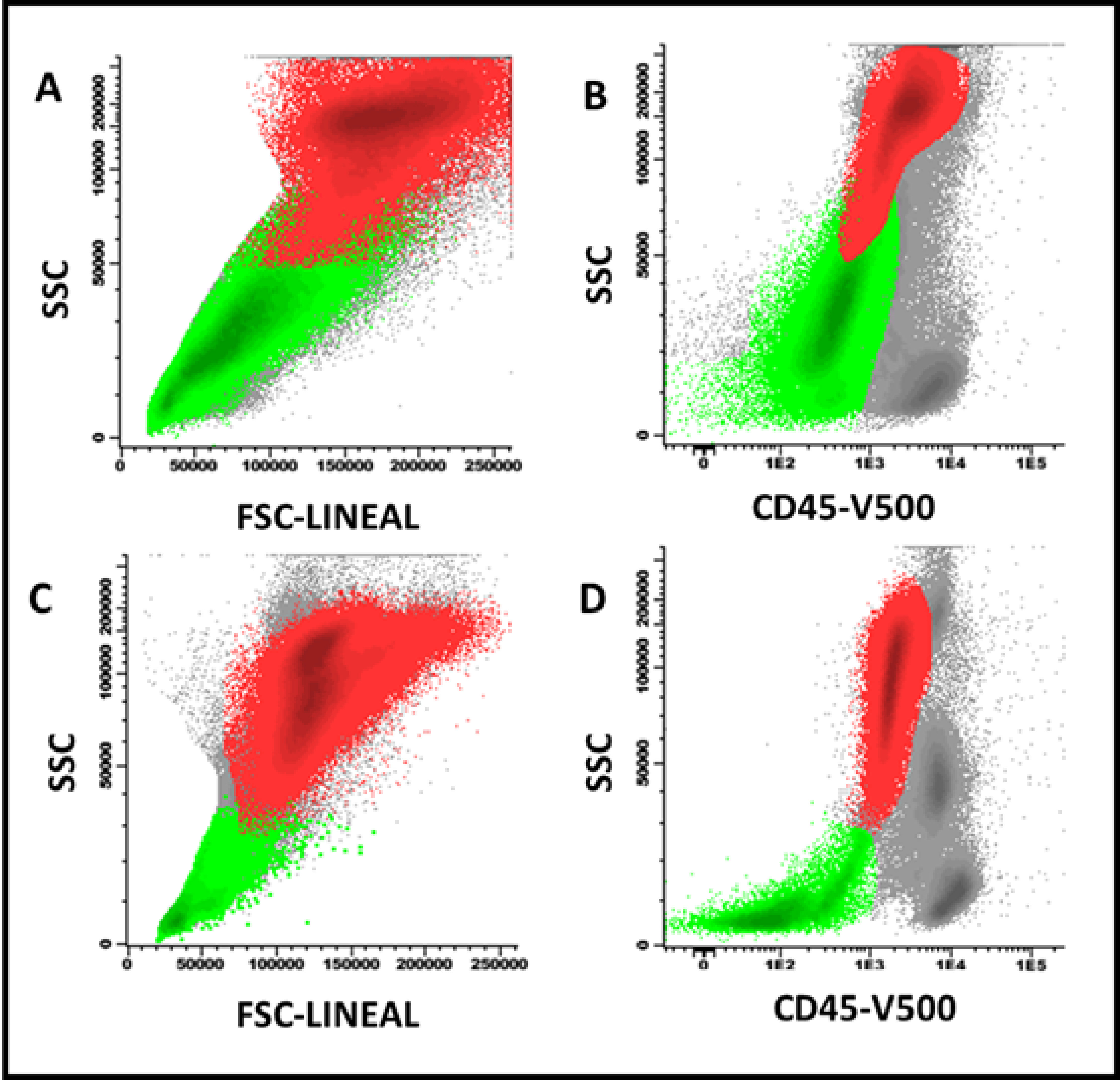
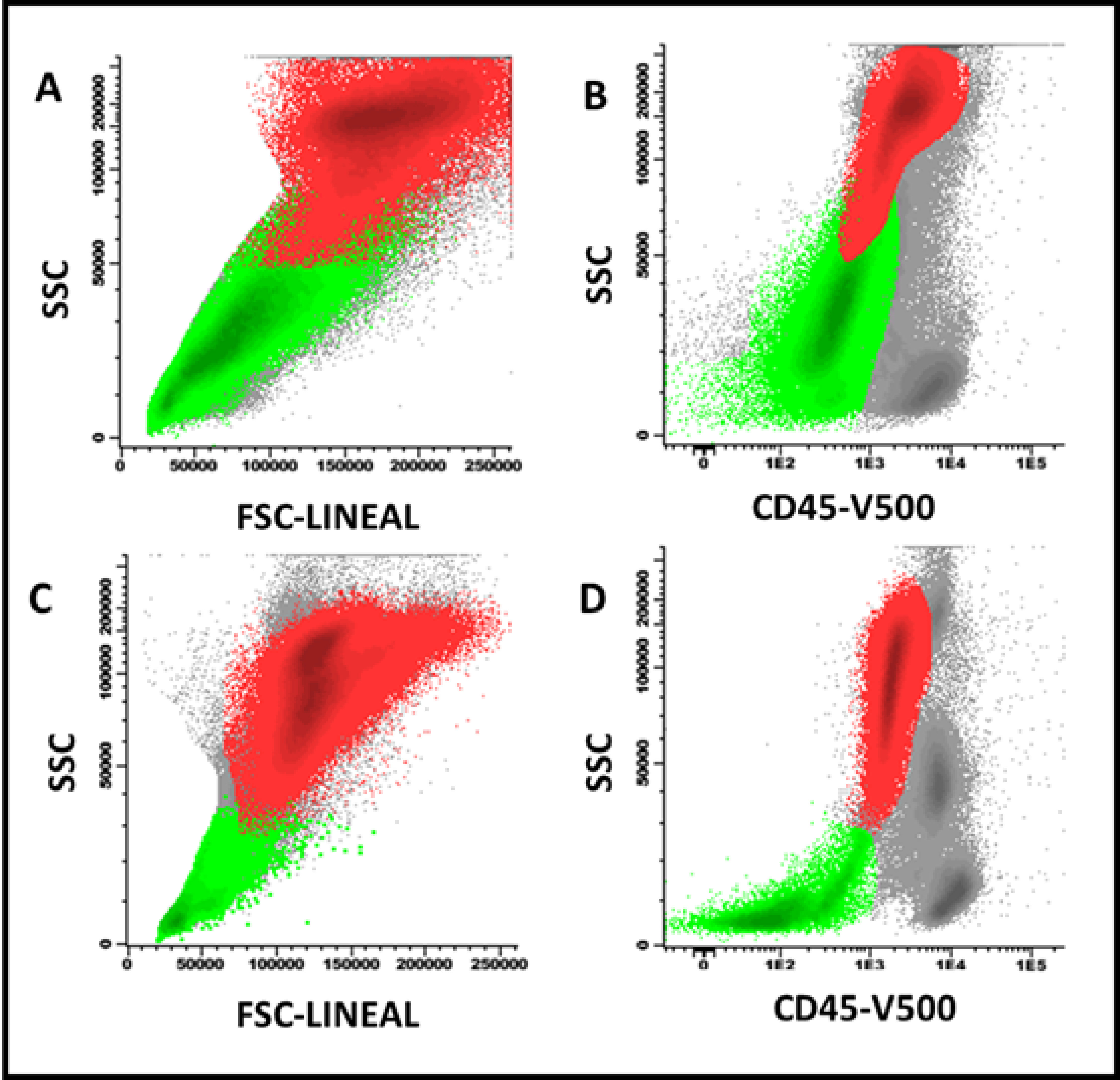
In megaloblastic anemia, an important expansion of erythroid progenitors was observed with respect to normal bone marrow and myelodysplastic syndromes (29% vs 8% and 16%, p <0.001). Likewise, a higher percentage of CD105+ precursors was evidenced than in normal bone marrow and myelodysplastic syndromes (69% vs 19% and 23%, p <0.001) (Figure 1). The heterogeneity in the expression of CD36 and CD71 was similar to that observed in myelodysplastic syndromes and, in turn, higher with respect to normal bone marrow (23% vs 25% and 3.3%, p <0.001). Physical parameters showed a higher size (FSC) and cellular complexity (SSC) ratio in neutrophil and erythroblast populations compared to similar parameters in lymphocyte populations in megaloblastic anemia compared to myelodysplastic syndromes and normal bone marrow. In one case the resolution of the described phenotypic alterations was documented once vitamin B12 was administered intramuscularly (10,000 IU per day for three days), with nine days of difference between both studies (Figure 2).
Figure 1. Maturation arrest in erythroid series in a patient with megaloblastic anemia: There is a predominance of CD105+ precursors (81% of the total erythroblast population, with high FSC/SSC ratio) in dark green, over the more mature ones (light green), which in turn expressed CD36 and CD71 (lower portion of the figure) heterogeneously.
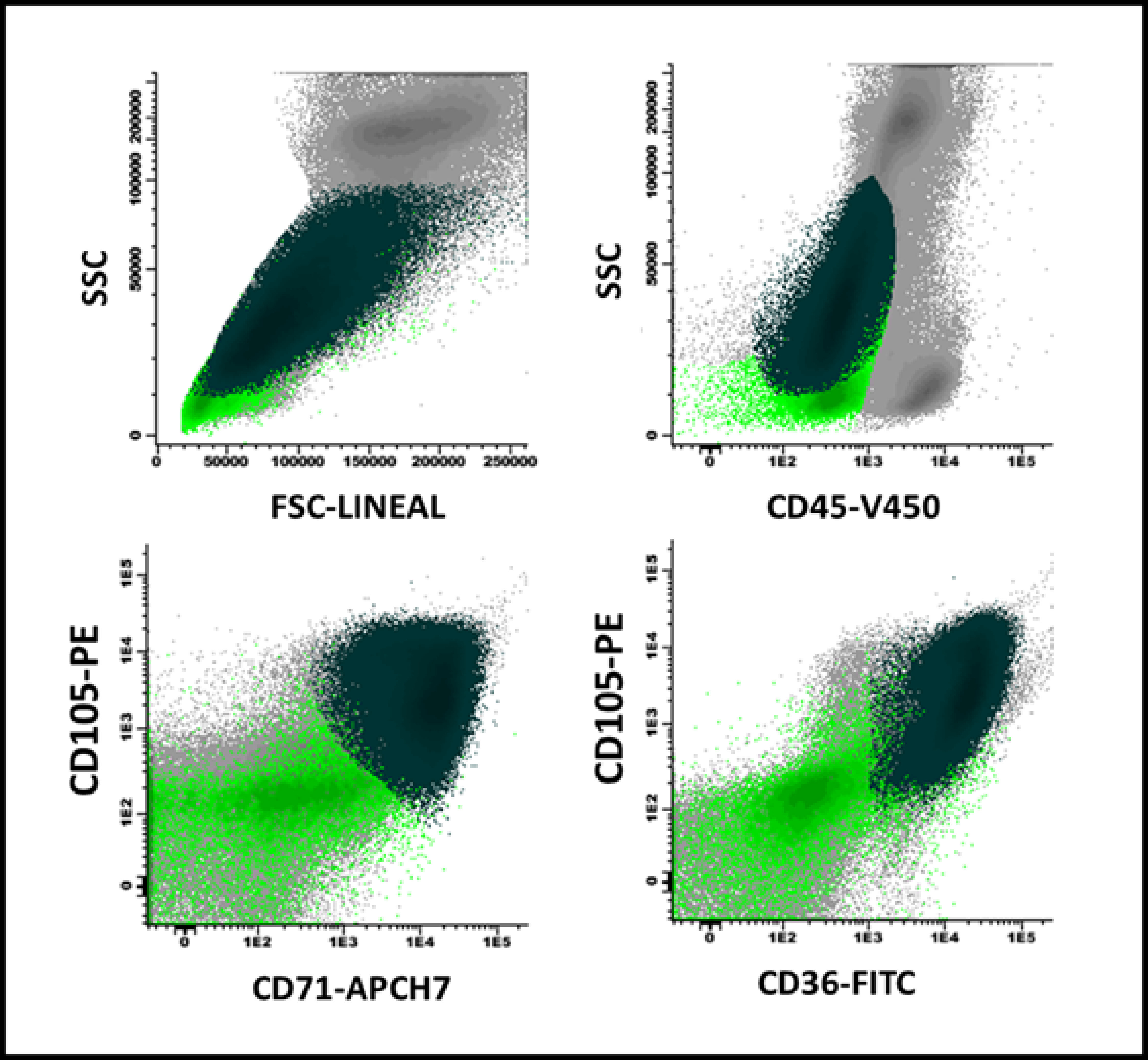
Figure 2. Effect of vitamin B12 administration on FSC/SSC precursors of erythroblasts (light green) and neutrophils (red) in a patient with megaloblastic anemia. A and B: before B12 administration; C and D: 9 days later, an increased proportion of neutrophils and a decrease in the FSC/SSC ratio of both cell groups was observed before total recovery in peripheral blood cell counts.
Discussion
In the present study, it was observed that patients with megaloblastic anemia and deep cytopenias have a global alteration of the bone marrow, which mainly affects the erythroid series, and is manifested by an expansion of the total population secondary to an accumulation of precursors in the intermediate stages without adequate differentiation. This produces ineffective hematopoiesis, with clinical and laboratory evidence of marrow insufficiency.
The clinical presentation of megaloblastic anemia is variable, and a marrow study is usually not required. In patients with typical clinical and laboratory manifestations, low serum levels of vitamin B12 allow us to confirm the diagnosis. Other tests used are methylmalonic acid and homocysteine levels, with the last being more specific; however, both studies are not available in most centers and can be altered by other factors 3 , 5 , 10 . Nevertheless, in some cases severe cytopenias appear, forcing us to rule out other causes of marrow failure (i.e. acute leukemias, myelodysplastic syndromes, etc). This requires an invasive study, as in our series 5 . Flow cytometry is a complementary diagnostic tool with short-term results in this diagnostic process, especially in cases where morphology is not specific and there is no permanent availability for measuring plasma levels of vitamin B12, as in our center.
The main differential diagnosis by morphology in megaloblastic anemia are myelodysplastic syndromes. Flow cytometry in myelodysplastic syndromes is used as a complementary tool to morphology for diagnosis, however, to our knowledge, no findings have been described to date related to differential diagnosis with megaloblastic anemia 11 . In this way, what has been observed in our series (maturation arrest of erythroblasts series associated with an increase of FSC/SSC ratio of erythroblast and neutrophil precursors) can contribute to the differentiation between both disorders.
The limitations of our report include the low number of cases, which reflects the previously mentioned lack of need for marrow study in most cases of megaloblastic anemia suspicion and also does not correspond to the reality of the clinical spectrum of vitamin B12 deficiency ranging from asymptomatic cases to those with myeloid insufficiency and symptoms of other systems. On the other hand, the retrospective and single-center character of the study may not represent the reality of other public hospitals in the country, so it would be interesting to incorporate more centers in future research on this subject.
References
- 1.Koury MJ, Horne DW, Brown ZA. Apoptosis of late-stage erythroblasts in megaloblastic anemia association with DNA damage and macrocyte production. Blood. 1997;89(12):4617–4623. doi: 10.1182/blood.V89.12.4617. [DOI] [PubMed] [Google Scholar]
- 2.Ballas SK, Pielichowski HJ, Stoll DB. Further characterization of the erythrocyte membrane protein abnormality in megaloblastic anemia. J Med. 1982;13(1-2):15–34. [PubMed] [Google Scholar]
- 3.Stabler SP. Vitamin B12 Deficiency. N Engl J Med. 2013;368(2):149–160. doi: 10.1056/NEJMcp1113996. [DOI] [PubMed] [Google Scholar]
- 4.Green R. Vitamin B12 deficiency from the perspective of a practicing hematologist. Blood. 2017;129(19):2603–2611. doi: 10.1182/blood-2016-10-569186. [DOI] [PubMed] [Google Scholar]
- 5.Sutton L, Mba N. Hematogones detected by flow cytometry in a child with vitamin B12 deficiency a case report. Pediatr Dev Pathol. 2017;20(2):172–175. doi: 10.1177/1093526616686241. [DOI] [PubMed] [Google Scholar]
- 6.van Dongen JJM, Lhermitte L, Böttcher S, Almeida J. van der Velden VHJ.Flores-Montero J EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes. Leukemia. 2012;26(9):1908–1975. doi: 10.1038/leu.2012.120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Matarraz S, López A, Barrena S, Fernandez C, Jensen E, Flores-Montero J. Bone marrow cells from myelodysplastic syndromes show altered immunophenotypic profiles that may contribute to the diagnosis and prognostic stratification of the disease a pilot study on a series of 56 patients. Cytometry B Clin Cytom. 2010;78(3):154–168. doi: 10.1002/cyto.b.20513. [DOI] [PubMed] [Google Scholar]
- 8.Orfao A, Matarraz S, Pérez-Andrés M, Almeida J, Teodosio C, Berkowska MA. Immunophenotypic dissection of normal hematopoiesis. J Immunol Methods. 2019;475:112684–112684. doi: 10.1016/j.jim.2019.112684. [DOI] [PubMed] [Google Scholar]
- 9.Mello FV, Land MGP, Costa ES, Teodósio C, Sanchez ML, Bárcena P. Maturation-associated gene expression profiles during normal human bone marrow erythropoiesis. Cell Death Discov. 2019;5(1):1–12. doi: 10.1038/s41420-019-0151-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Green R, Datta Mitra A. Megaloblastic anemias nutritional and other causes. Med Clin North Am. 2017;101(2):297–317. doi: 10.1016/j.mcna.2016.09.013. [DOI] [PubMed] [Google Scholar]
- 11.Matarraz S, López A, Barrena S, Fernandez C, Jensen E, Flores J. The immunophenotype of different immature, myeloid and B-cell lineage-committed CD34+ hematopoietic cells allows discrimination between normal/reactive and myelodysplastic syndrome precursors. Leukemia. 2008;22(6):1175–1183. doi: 10.1038/leu.2008.49. [DOI] [PubMed] [Google Scholar]