









L’Health Technology Assessment (HTA) è riconosciuto come lo strumento principe per bilanciare l’esigenza di raggiungere la più ampia accessibilità/copertura possibile al netto degli alti costi che l’innovazione registra all’affaccio sul mercato, utilizzato con l’obiettivo di accertare il valore complessivo di una tecnologia con riferimento all’utilità sociale della prestazione sanitaria erogata/offerta [1].
L’HTA, inteso come la valutazione sistematica e multidimensionale di una nuova tecnologia nel settore sanitario, ha un ruolo chiave nel fornire le informazioni evidence based necessarie affinché i decision maker prendano le giuste decisioni al fine di promuovere la vera innovazione ad alto valore [2].
L’HTA, inoltre, è impiegato oggi come strumento di supporto alle decisioni politiche e gestionali in tema di salute e si configura come strumento di governance, in quanto consente di guidare in maniera razionale i sistemi sanitari. In tale prospettiva appare evidente come anche la Sanità Pubblica, ossia la scienza che si occupa di promuovere la salute della comunità dei cittadini, debba avvalersi di tale strumento per supportare scelte di valore per l’intera popolazione [3].
Le Malattie Batteriche Invasive (MaBI) hanno un rilevante impatto clinico, organizzativo ed economico sul Servizio Sanitario Nazionale (SSN) e includono frequenti patologie anche gravi: meningiti, batteriemie, sepsi, polmoniti e altri quadri clinici con isolamento di batteri da siti normalmente sterili. Le MaBI sono causate da batteri diversi che colpiscono in maniera sporadica e difficilmente prevedibile, o che più raramente possono dare origine a focolai epidemici. L’identificazione esatta del patogeno è essenziale per avviare interventi di sanità pubblica finalizzati al contenimento della diffusione dei batteri più frequentemente responsabili di MaBI prevenibili con la vaccinazione, ovvero Neisseria meningitidis (meningococco), Streptococcus pneumoniae (pneumococco) e Haemophilus influenzae (emofilo) [4].
La diffusione di questi patogeni avviene tramite contatti con soggetti malati o portatori sani: i batteri vengono ospitati a livello del nasofaringe da dove possono essere trasmessi ad altri tramite goccioline (droplets) che, emesse parlando, tossendo o starnutendo, possono depositarsi sulla congiuntiva, sulla bocca, sulla mucosa nasale. Considerato che le droplets si diffondono in un’area ristretta, soltanto un contatto ravvicinato (< 1 m) e non protetto permette la trasmissione di tali batteri [4].
Streptococcus pneumoniae (pneumococco) è un batterio gram positivo, che si presenta nella tipica forma lanceolata o piriforme (cocco), generalmente in coppia (diplococco) o disposto in corte catenelle. Tali patogeni sono capsulati, asporigeni, aerobianaerobi facoltativi e non possiedono l’enzima catalasi. Il principale fattore di virulenza dello S. pneumoniae è rappresentato dalla capsula polisaccaridica, dotata di un intrinseco potere antifagocitario che, insieme alla produzione di sostanze tossiche (come pneumolisina e autolisina), aumenta la diffusione sistemica e l’invasività del patogeno. La capsula è anche in grado di neutralizzare gli anticorpi specifici che l’organismo produce durante la fase avanzata dell’infezione [4].
S. pneumoniae è l’agente più comune di MaBI e può causare quadri clinici noti come malattie invasive pneumococciche (MIP), che includono patologie gravi quali meningite e sepsi, o meno gravi, come batteriemie o polmoniti batteriemiche. È, inoltre, frequentemente responsabile di quadri localizzati come polmonite, infezioni delle alte vie respiratorie, otite media acuta. I gruppi più colpiti sono i bambini sotto i 5 anni e gli anziani sopra i 65 anni [5]. Lo stato di portatore è molto frequente nei bambini di età < 5 anni (30-60%), ma il batterio è presente anche negli adulti, sebbene in percentuale inferiore [6, 7].
Attualmente si conoscono oltre 90 sierotipi capsulari di S. pneumoniae, riuniti in circa 40 sierogruppi, di cui solo alcuni sono contenuti nei vaccini disponibili in commercio [5]. Solo un ristretto numero di essi è virulento ed è responsabile di infezioni gravi: più dell’80% dei ceppi isolati da pazienti con infezione invasiva da pneumococco è imputabile ai sierotipi 1, 3, 4, 5, 6, 7, 8, 9, 14, 18, 19, 23. Non bisogna sottovalutare, inoltre, che in tutto il mondo è in costante crescita il fenomeno della multi-antibiotico resistenza che complica l’approccio terapeutico a tali patologie [4]. Ciò, in aggiunta all’esistenza di un numero limitato di sierotipi virulenti, ha favorito lo sviluppo di vaccini per tale microorganismo, come fondamentali strumenti di prevenzione [8].
Considerato che le MaBI si associano frequentemente a gravi complicanze e mortalità, è importante monitorarne la diffusione e caratterizzare i patogeni che le causano. Per tale motivo, dal 2007 è stato implementato in Italia un sistema di sorveglianza nazionale, coordinato dall’Istituto Superiore di Sanità (ISS) che prevede la segnalazione di tutti i casi di MIB causate da meningococco, pneumococco ed emofilo e di tutte le meningiti batteriche [8].
Dal 2015 al 2019 il numero di casi notificati di MIP è progressivamente aumentato, verosimilmente in conseguenza di una maggiore sensibilità diagnostica e attenzione al problema. L’incidenza di MIP per 100.000 abitanti, in Italia, è aumentata dal 2,1 nel 2015 al 2,8 nel 2019, dati inferiori alla media europea che secondo i dati dell’European Centre for Disease Prevention and Control risultano di 5,6 nel 2015 e di 5,8 nel 2019 (più alto tra gli adulti ≥ 65 anni e i neonati) [9]. Nel 2020 (ultimi dati disponibili), invece, verosimilmente anche a causa della pandemia da COVID-19, è stato registrata una riduzione dei casi notificati di MIP con valori di incidenza pari a 0,84 per l’Italia e a 2,6 per la media europea [9].
Secondo quanto riportato nell’ultimo rapporto dell’Istituto Superiore di Sanità (ISS), relativo al triennio 2019-2021 [10], in Italia si osserva un trend in diminuzione nel numero di segnalazioni di MIP fino a registrare nel 2021 valori pari a 0,81. Viene confermato un tipico andamento stagionale e un maggiore numero di casi durante i mesi invernali.
Nel 2021 sono stati segnalati 480 casi di MIP; nel 2020 e 2019, rispettivamente, 501 e 1680. L’incidenza delle MIP risulta maggiore nei bambini < 1 anno e negli adulti > 64 anni. Nel 2021 l’incidenza (x 100.000 abitanti) della MIP nei bambini < 1 anno è stata di 2,47, in linea con l’incidenza riscontrata nel 2020 (2,65) ma in netta diminuzione rispetto a quella del 2019 (6,50). Negli adulti > 64 anni, nel 2021 l’incidenza si è attestata al 2,02, anch’essa in linea rispetto al 2020 (2,04) ma in diminuzione rispetto al 2019 (7,37). Il quadro clinico più frequente nel periodo 2019-2021 è stato rappresentato da sepsi/batteriemia (tra il 37 e il 55% dei casi), seguito dalla polmonite associata a sepsi/batteriemia (tra il 25 e il 36%), e dalla meningite associata o meno a sepsi/batteriemia (tra il 18 e il 25% dei casi). Quadri clinici di polmonite, pleurite e peritonite con isolamento da siti sterili diversi dal sangue sono stati rari [10].
Informazioni sul sierotipo risultano disponibili per il 58,9% dei casi notificati nel 2019, per il 44,9% dei casi nel 2020 e per il 46,8% dei casi nel 2021. La diversa attitudine delle singole regioni a partecipare alla sorveglianza, e negli ultimi due anni anche il sovraccarico delle strutture sanitarie dovuto alla emergenza da COVID-19, hanno determinato una diminuzione del numero dei casi con sierotipizzazione. Tale dato sottolinea come sia fondamentale promuovere il ricorso alla tipizzazione e alla condivisione dei dati, al fine di stabilire l’esatta quota di casi prevenibili con la vaccinazione e rilevare l’eventuale aumento di sierotipi non presenti nei vaccini attualmente utilizzati (fenomeno del “rimpiazzo dei sierotipi” o replacement) [10-12].
I sierotipi prevalenti nella popolazione generale nel 2021 sono stati, in ordine di frequenza decrescente, 8, 3, 23A, 19A, 10A, 9N, 11A e 15A, di questi solo i sierotipi 3 e 19A sono compresi nel vaccino 13-valente (PCV13 – 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F). Tutti i sierotipi maggiormente riscontrati, a eccezione del 23A e del 15A, sono presenti nel vaccino polisaccaridico 23-valente (PPSV23 – 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F, 33F) [10].
I sierotipi identificati nei bambini 0-4 anni nel 2021 sono stati, in ordine di frequenza decrescente, 11A, 3, 8, 10A e 15A. In particolare, nel triennio 2019-2021 si è osservato un aumento costante dei sierotipi 3 e 10A. Considerando la classe di età > 64 anni, i sierotipi 8, 3, 23A, 10A, 15A, 9N, 19A, e 23B sono stati quelli maggiormente rappresentati nel 2021 [10].
Nei bambini 0-4 anni il numero di casi segnalati prevenibili con la vaccinazione 13-valente si mantiene basso, mentre casi prevenibili dal 10-valente non sono stati segnalati nel biennio 2020-2021. Negli adulti > 64 anni la percentuale di casi prevenibili da PPSV23 è diminuita dal 73,7% (448/608 casi) nel 2019 al 64,5% (89/138 casi) nel 2021 mentre la percentuale di casi prevenibili da PCV13 è diminuita dal 31,6% (192/608 casi) al 28,3% (39/138 casi) [10].
Va comunque evidenziato che le attitudini di alcune regioni a inviare gli isolati per la sierotipizzazione ai laboratori regionali o presso l’ISS e le differenze regionali nelle coperture vaccinali possono influenzare la rappresentatività di questi dati. Inoltre, la bassa numerosità dei casi in bambini 0-4 anni, causa ampie fluttuazione delle percentuali anche a fronte di piccole variazioni di frequenza [10].
Per l’importante impatto delle malattie causate da pneumococco nell’infanzia e nella popolazione anziana, negli obiettivi del Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 [13], viene indicato specificamente il raggiungimento e mantenimento nei nuovi nati di coperture vaccinali ≥ 95% per la vaccinazione antipneumococcica e il raggiungimento, nei sessantacinquenni, di coperture del 75%. Nel nuovo PNPV 2023-2025, attualmente in valutazione in Conferenza Stato-Regioni [14], viene indicato il raggiungimento, a medio termine, nei nuovi nati di coperture vaccinali ≥ 90% per la vaccinazione antipneumococcica e il raggiungimento, a medio-lungo termine, nei sessantacinquenni, di coperture ≥ 75%.
Attualmente, in Italia, per l’immunizzazione dell’età pediatrica, sono disponibili:
tre vaccini coniugati, ottenuti legando alcune proteine alle sostanze (polisaccaridi) della superficie dello pneumococco, per rendere il vaccino più efficace anche nei primi mesi di vita. Questi vaccini sono: il vaccino glicoconiugato 10-valente (PCV10 - 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F) e il vaccino coniugato 13-valente (PCV13 - 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F) [15]; il vaccino coniugato 15-valente (PCV15 - 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F, 33F), di recente approvazione (ottobre 2022). Si precisa, inoltre, che è in attesa di approvazione, per l’utilizzo in età pediatrica, anche il vaccino coniugato 20-valente (PCV20 - 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F, 33F);
il vaccino polisaccaridico 23 valente (PPSV23 - 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19F, 19A, 20, 22F, 23F, 33F) [5].
Il vaccino polisaccaridico (PPV23) [16], autorizzato all’immissione in commercio il 3 maggio 2000 (AIC poi rinnovata il 3 maggio 2010), è indicato per l’immunizzazione attiva contro l’infezione pneumococcica in bambini di età ≥ 2 anni, adolescenti e adulti. La vaccinazione primaria consiste di una singola dose. La rivaccinazione dopo un intervallo < 3 anni non è raccomandata perché aumenta il rischio di reazioni avverse, mentre è generalmente ben tollerata quando viene effettuata a intervalli ≥ 3 anni tra una dose e l’altra. Rispetto alla vaccinazione primaria è stato osservato un modesto incremento della percentuale di reazioni locali, di spontanea risoluzione. La rivaccinazione è raccomandata negli individui a elevato rischio di grave infezione pneumococcica vaccinati da oltre 5 anni o soggetti a una rapida diminuzione dei livelli anticorpali pneumococcici [5, 8].
Il vaccino PCV10 [17], che contiene i polisaccaridi dei 10 sierotipi sopra riportati, autorizzato all’immissione in commercio con procedura centralizzata il 30 marzo 2009, è stato poco utilizzato in quanto quasi contemporaneamente (dicembre 2009) è stato autorizzato il PCV13 [18] che copre anche i sierotipi 3, 6A e 19A.
Secondo quanto riportato nel Riassunto delle Caratteristiche del Prodotto (RCP) il PCV10 è indicato per l’immunizzazione attiva contro la patologia invasiva, la polmonite e l’otite media acuta causata da S. pneumoniae in neonati e bambini da 6 settimane a 5 anni d’età [17].
Le indicazioni terapeutiche del PCV13 riportate in RCP sono: immunizzazione attiva per la prevenzione di patologia invasiva, polmonite e otite media acuta, causate da S. pneumoniae in neonati, bambini e adolescenti di età compresa tra 6 settimane e 17 anni; immunizzazione attiva per la prevenzione di patologia invasiva e di polmonite, causata da S. pneumoniae in adulti di età ≥ 18 anni e anziani [18].
Da segnalare che le indicazioni terapeutiche del PCV13 sono state progressivamente estese: inizialmente autorizzato per tutti i nuovi nati da 6 settimane e fino a 5 anni di età, nel settembre 2011 l’indicazione d’uso è stata estesa agli adulti di età ≥ 50 anni, quindi nel febbraio 2013 ai soggetti di età compresa tra 6 e 17 anni e a maggio 2013 ai soggetti di età compresa tra 18 e 50 anni [15, 18].
Inoltre, la vaccinazione antipneumococcica è consigliata nei soggetti di qualsiasi età a rischio di contrarre la malattia per la presenza di patologie o condizioni predisponenti [14]:
alcoolismo cronico;
asplenia anatomica o funzionale e candidati alla splenectomia;
cardio/pneumo/epatopatie croniche;
diabete mellito;
emoglobinopatie quali anemia falciforme e talassemia;
epatopatie croniche, inclusa la cirrosi epatica e le epatopatie croniche evolutive da alcool;
immunodeficienze congenite o acquisite;
infezione da HIV;
insufficienza renale/surrenalica cronica, sindrome nefrosica;
malattie polmonari croniche;
neoplasie diffuse;
patologie onco-ematologiche (leucemie, linfomi e mieloma multiplo);
patologie richiedenti un trattamento immunosoppressivo a lungo termine;
portatori di impianto cocleare;
soggetti con perdite liquorali da traumi o intervento;
trapianto d’organo o di midollo;
difetti congeniti e acquisiti del complemento.
In questi casi, secondo quanto riportato nel nuovo PNPV 2023-2025, in corso di approvazione [14], è previsto un numero di dosi come da scheda tecnica a seconda dell’età e in funzione della patologia o condizione. Per bambini > 2 anni e adulti, è prevista la schedula sequenziale PCV/PPSV23 (una prima dose di PCV seguita ad almeno 8 settimane di distanza da una dose di PPSV23). Invece, una sola dose di PCV è prevista a partire dalla coorte dei 65enni. L’offerta va eventualmente integrata con schedula sequenziale (PCV + PPSV) in funzione della tipologia di vaccino PCV utilizzato.
Per quanto concerne la vaccinazione in età pediatrica, è importante sottolineare che se da un punto di vista teorico la “miglior protezione disponibile” nei confronti dello pneumococco sembrerebbe offerta dal PCV13, che include tre sierotipi in più del PCV10, in realtà, il presupposto che i 3 sierotipi aggiuntivi del PCV13 riducano l’incidenza delle MIP non è dimostrato da studi testa a testa tra i due vaccini. Pertanto, allo stato attuale delle conoscenze scientifiche, l’efficacia di PCV10 e PCV13 nel ridurre l’overall burden delle MIP, secondo il recente statement dell’Organizzazione Mondiale della Sanità (OMS), è comparabile [5]. La mancata corrispondenza tra numero di sierotipi aggiuntivi del PCV13 e prevenzione delle MIP è dovuta a numerosi fattori non sempre noti: variabile circolazione dei sierotipi; efficacia dei due vaccini per ciascun sierotipo; durata della protezione; protezione crociata (cross protection); capacità di indurre protezione indiretta (herd immunity); fenomeno del rimpiazzo (replacement) dei sierotipi; quadri clinici di MIP non sottoposti a sorveglianza o di difficile diagnosi eziologica [5, 19, 20].
Pertanto, la “migliore protezione disponibile” non si correla necessariamente con il numero maggiore di sierotipi contenuti in un vaccino ma bensì con le prove di immunogenicità, effectiveness e le evidenze scientifiche a supporto di una maggiore protezione nei confronti dei sierotipi circolanti e del relativo burden clinico-epidemiologico.
La Sanità odierna è costantemente alla ricerca di strategie efficaci nell’ambito della prevenzione; fra tutte, la vaccinazione occupa sicuramente un ruolo di assoluta preminenza. Per questo motivo, soprattutto in considerazione del rilevante impatto clinico, organizzativo ed economico sul SSN, legato alle MIP, sono stati recentemente approvati nuovi vaccini contro lo S. pneumoniae, tra cui il vaccino coniugato PCV15 [21, 22]. PCV15 è un vaccino antipneumococcico coniugato indicato per la prevenzione della malattia da pneumococco negli adulti e nei bambini; è costituito da polisaccaridi pneumococcici da 15 sierotipi coniugati con la proteina carrier CRM197 e include i sierotipi 22F e 33F, sierotipi comunemente associati alla malattia invasiva da pneumococco e non contenuti nel vaccino antipneumococcico coniugato attualmente disponibile.
Gli studi a oggi condotti su questo nuovo vaccino dimostrano come questa nuova tecnologia sanitaria generi una robusta risposta immunitaria per tutti i 15 sierotipi inclusi e rafforzano il potenziale per questo vaccino di proteggere sia bambini che adulti dalla malattia pneumococcica [21]. I sierotipi di pneumococco non presenti negli attuali vaccini antipneumococcici, come il 22F o il 33F, presenti invece in PCV15, sono comunemente associati a malattia invasiva da pneumococco in tutto il mondo. I sierotipi 22F e 33F attualmente causano il 13% delle MIP negli Stati Uniti e dal 7 al 13% in Europa negli adulti con età superiore ai 65 anni. In Italia, nel 2017, i sierotipi 22F e 33F sono stati causa di MIP per il 9% dei casi osservati nella popolazione adulta sulla base dei dati di sorveglianza dell’ISS. Inoltre, il sierotipo 3 rimane una delle cause principali delle MIP negli adulti e nei bambini nonostante sia contenuto nei vaccini attualmente disponibili [5]. Negli Stati Uniti, il 15% delle MIP negli adulti con età superiore ai 65 anni sono causate dal sierotipo 3; in Europa il valore è compreso tra il 12 e il 18% (in Italia nel 2017 il 16,7%) [4]. Il programma di sviluppo clinico di Fase 3 di PCV15 comprende diversi trials clinici volti a studiare la sicurezza, la tollerabilità e l’immunogenicità del vaccino in varie popolazioni ad aumentato rischio di malattia pneumococcica, inclusi gli adulti anziani sani, i bambini e le persone con immunocompromissione o affette da malattie croniche.
Le malattie causate da sierotipi non coperti dagli attuali vaccini coniugati pneumococcici stanno aumentando nel mondo e possono variare tra nazione e nazione. Inoltre, si continuano a osservare casi di malattia pneumococcica da sierotipi contenuti nei vaccini attualmente disponibili. Pertanto, la continua innovazione scientifica nella prevenzione della malattia da pneumococco deve mirare a proteggere dai sierotipi a maggior rischio per specifiche popolazioni e, contemporaneamente, mantenere livelli di risposta immunitaria quando vengono aggiunti nuovi sierotipi.
In un contesto come quello attuale, la disponibilità di nuove tecnologie vaccinali deve essere valutata al fine di massimizzare i risultati in termini di salute e garantire alla collettività un’adeguata protezione per le malattie prevenibili tramite vaccinazione. La vaccinazione rappresenta un mezzo importante per ridurre il carico epidemiologico ed economico delle MIP, garantendo benefici clinici significativi per tutti gli individui, soprattutto quelli più fragili come bambini e anziani, nonché importanti benefici economici per il nostro SSN. Pertanto, l’immunizzazione contro lo S. pneumoniae rappresenta una priorità per la salute pubblica, in particolare nei Paesi, come il nostro, in cui l’invecchiamento della popolazione è in continuo aumento.
Negli ultimi due secoli la ricerca scientifica orientata allo sviluppo dei vaccini ha avuto un progresso coerente con la necessità di ridurre l’impatto delle malattie infettive. Tra gli elementi che orientano la ricerca in campo vaccinale vi è lo sviluppo di nuove tecnologie che guidano la conoscenza scientifica a superare eventuali barriere preesistenti nella lotta verso un determinato patogeno, ovvero a migliorare eventualmente anche uno strumento vaccinale già disponibile.
Sulla base delle premesse descritte, il presente report si pone come obiettivo principale quello di effettuare una valutazione, secondo la metodologia dell’Health Technology Assessment (HTA), del nuovo vaccino coniugato antipneumococcico 15-valente per la prevenzione delle infezioni da S. pneumoniae in età pediatrica, al fine di fornire una visione d’insieme sull’impatto clinico, epidemiologico, economico, organizzativo ed etico del suo utilizzo nel contesto di cura italiano.
L’HTA è impiegato oggi come strumento di supporto alle decisioni politiche e gestionali in tema di salute. Le caratteristiche salienti dell’HTA sono rappresentate dalla sua multidisciplinarietà e interdisciplinarietà, indispensabili per analizzare da più prospettive l’impatto della tecnologia sanitaria, e dalle sue finalità di veicolo delle informazioni scientifiche al mondo decisionale. Altro aspetto fondamentale del processo di HTA è la sistematicità: alimentano una valutazione HTA, infatti, le evidenze scientifiche, adeguatamente raccolte, analizzate e sintetizzate [23]. Tali evidenze riguardano diversi aspetti della tecnologia, descritti nei nove domini del core model, tool prodotto dallo European Network per l’Health Technology Assessment (EUnetHTA) con l’obiettivo di standardizzare processi e contenuti dell’HTA [24]. Tali domini comprendono: il problema di salute e l’uso corrente della tecnologia, le caratteristiche della tecnologia, la sicurezza, l’efficacia, i costi e la valutazione economica, gli aspetti etici, organizzativi, legati al paziente, gli aspetti sociali e, infine, quelli legali [24].
Il presente report, principalmente focalizzato sul contesto italiano, è stato costruito seguendo il framework EuNetHTA (Core Model). I domini inseriti nel presente report HTA sono i seguenti:
dominio CUR (problema di salute, popolazione target e uso corrente della tecnologia);
dominio TEC (descrizione e caratteristiche tecniche del vaccino);
dominio SAF (sicurezza della tecnologia sanitaria in valutazione);
dominio EFF (efficacia della tecnologia sanitaria in valutazione);
dominio ECO (costi e valutazione economica);
dominio ORG (aspetti organizzativo-gestionali della tecnologia sanitaria);
dominio ETH (analisi etica).
Pertanto, la presente valutazione HTA, focalizzata al contesto di cura italiano, affronta le seguenti tematiche:
caratteristiche epidemiologiche, cliniche ed economiche delle infezioni da S. pneumoniae nel bambino;
la vaccinazione antipneumococcica in età pediatrica: i vaccini attualmente disponibili in Italia;
il vaccino coniugato antipneumococcico 15-valente per la prevenzione delle infezioni da S. pneumoniae in età pediatrica: immunogenicità, efficacia e sicurezza;
la valutazione dell’impatto clinico ed economico dell’introduzione del vaccino coniugato antipneumococcico 15-valente (PCV15) nel contesto italiano attraverso un modello a trasmissione dinamica;
gli aspetti organizzativi della vaccinazione antipneumococcica in età pediatrica e le nuove sfide per una strategia preventiva efficace e appropriata contro le MIP in Italia;
l’analisi etica dell’introduzione del vaccino coniugato antipneumococcico 15-valente per la popolazione pediatrica in Italia.
Il report si chiude, infine, con gli elementi chiave per il processo decisionale che sintetizzano quanto descritto nel report. L’elaborazione di questo Report è avvenuta, secondo la metodologia HTA, attraverso la creazione di un gruppo di lavoro multidisciplinare che ha identificato, analizzato e, successivamente, sintetizzato tutte le informazioni disponibili sull’argomento. Sono state, quindi, eseguite revisioni della letteratura scientifica esistente e le evidenze sono state selezionate secondo criteri di inclusione precostituiti, organizzate sulla base dei domini HTA seguendo il Core Model® di EuNetHTA) [24]. La stesura del presente report si è conclusa il 24 marzo 2023.
L’infezione da Streptococcus pneumoniae (S. pneumoniae o pneumococco) rappresenta in tutto il mondo un’importante causa di mortalità e morbosità [1].
S. pneumoniae è un organismo anaerobio facoltativo di forma lanceolata, gram-positivo, che si presenta tipicamente in coppia o in catene corte [2]. Fondamentale nella sua struttura è la capsula polisaccaridica che avvolge la parete cellulare e funge da fattore di virulenza poiché ostacola i meccanismi di clearance immunitaria dell’ospite [3], sfuggendo alla fagocitosi e impedendo l’accesso dei granulociti alla parete sottostante [4]. I polisaccaridi della capsula aiutano nell’identificazione e nella sierotipizzazione dei batteri: a oggi esistono fino a 100 sierotipi di polisaccaridi riconosciuti [5].
S. pneumoniae si caratterizza per la capacità di colonizzare il rinofaringe: infatti il 20-30% degli adulti sani e quasi il 40-50% dei bambini sani sono portatori [6]. In generale più del 95% dei bambini presenta un episodio di colonizzazione pneumococcica nasofaringea entro i 2 anni di età [7].
L’infezione normalmente non si verifica a meno che un paziente non abbia fattori di rischio predisponenti, entri in contatto con un ceppo particolarmente virulento di S. pneumoniae e abbia un’alterazione delle barriere naturali o del sistema immunitario [8].
S. pneumoniae provoca uno spettro di malattie che vanno da forme invasive e gravi (Malattie Invasive Pneumococciche, MIP), quali meningite, setticemia e polmonite batteriemica [9], a infezioni localizzate più lievi ma più comuni (non-MIP), come la sinusite, l’otite media acuta (OMA) e la polmonite non batteriemica [10]. Inoltre, in seguito alla diffusione batteriemica possono istaurarsi, in pazienti debilitati, quadri di artrite secondaria a polmonite e meningite [11, 12].
Le MIP derivano dalla penetrazione degli pneumococchi attraverso il rinofaringe o altre strutture delle vie aeree superiori con invasione di siti normalmente sterili e colpiscono con maggior frequenza i bambini fino a 2 anni di età e gli adulti oltre i 65 anni, soprattutto in presenza di fattori di rischio [13]. Lo S. pneumoniae è riconosciuto come l’agente eziologico più comune della meningite batterica [14], la quale presenta un alto tasso di mortalità [15] e di complicanze del sistema nervoso centrale (SNC) [16].
La polmonite, che rappresenta la manifestazione clinica più comune dell’infezione da pneumococco [17], può derivare dall’aspirazione di pneumococchi o dalla diffusione degli stessi dalle vie aeree superiori a quelle inferiori, spesso insieme ad altri batteri e virus [18]. Va ricordato come la polmonite acquisita in comunità rivesta un’importanza notevole sia per le problematiche connesse alla sua gestione clinica, sia per le ricadute in termini di impegno assistenziale e costi per la collettività, nonché per la sua elevata frequenza nella popolazione generale [19]. Un’alta incidenza della patologia si riscontra nelle popolazioni pediatriche e anziane e negli individui immunocompromessi [9].
Infine, le otiti medie acute colpiscono prevalentemente neonati e bambini piccoli e rappresentano una delle ragioni principali di trattamento antibiotico in età pediatrica [20, 21]. Quando si parla di otite media si intende un’infiammazione dell’orecchio medio senza riferimento all’eziologia o alla patogenesi [22]; qualora insorgano segni e sintomi di infiammazione la patologia diviene acuta [23]. La forma ricorrente è definita tale quando si hanno tre o più episodi documentati nei 6 mesi precedenti o quattro o più episodi nei 12 mesi precedenti con più di un episodio negli ultimi 6 mesi [23], mentre la forma cronica si verifica quando l’otite persiste per oltre 3 mesi dalla data di insorgenza (se nota) o dalla data di diagnosi (se di insorgenza non nota) [24]. L'OMA è l’infezione batterica pediatrica più comune e colpisce fino al 75% dei bambini prima dei 5 anni di età [25]. Il rischio di otiti medie acute si associa a una moltitudine di fattori di natura genetica, costituzionali (sesso maschile, età infantile, cambiamenti nell’anatomia della tromba di Eustachio) e modificabili (basso status socioeconomico, frequenza all’asilo nido e esposizione al fumo) [26].
È stato stimato dall’Organizzazione Mondiale della Sanità (OMS) che le infezioni da pneumococco sono responsabili dell’11% delle morti nei bambini al di sotto dei 5 anni di età [27]. Al fine di ridurre il loro burden, nel corso degli ultimi 20 anni, sono stati introdotti tre vaccini pneumococcici coniugati per la vaccinazione nel bambino, i quali hanno portato a importanti cambiamenti nell’epidemiologia delle MIP a livello europeo [28].
Il primo vaccino, autorizzato in Italia nel 2001 e diretto verso i sierotipi 4, 6B, 9V, 14, 18C, 19F e 23F (PCV7), ha portato a una significativa riduzione delle malattie invasive e non invasive dovute ai sierotipi vaccinali [29], sia nei bambini che negli adulti, da ricondurre ad un effetto di immunità di gregge [30]. Tuttavia, è stato osservato un graduale incremento delle MIP dovute a sierotipi non coperti da vaccino, a causa del fenomeno di replacement [31].
In particolare, dopo l’introduzione di PCV7 è stato osservato un aumento del sierotipo 19A [32] e in minor misura dei sierotipi 1 e 7F [31]. Successivamente il PCV7 è stato rimpiazzato dal PCV10 e dal PCV13, contenenti rispettivamente tre (1, 5 e 7F) e sei (1, 3, 5, 6A, 7F e 19A) sierotipi aggiuntivi [33], che hanno a loro volta portato a una riduzione delle MIP da sierotipi vaccinali ma contemporaneamente all’emergere di nuovi sierotipi non vaccinali (8, 12F, 22F, 33F e 15B/C) [28].
Sulla base di queste premesse, l’obiettivo di questo capitolo è quello di raccogliere e sistematizzare le evidenze sulle malattie pneumococciche nella popolazione pediatrica italiana analizzando i dati relativi tanto all’infezione che alle sue conseguenze con un focus sul contributo dei diversi sierotipi e anche sul carriage.
Per la stesura del capitolo sono state condotte diverse revisioni di letteratura e sono state consultate fonti istituzionali, quali l’ultimo rapporto epidemiologico annuale (anno 2018) sulla malattia pneumococcica invasiva dell’European Centre for Disease Prevention and Control (ECDC) [34], basato sui dati informazioni provenienti dal Sistema di sorveglianza Tessy (The European Surveillance System) per le malattie infettive nei Paesi dell’Unione Europea (UE) e dell’Area Economica Europea (European Economic Area, EEA) e il sistema di sorveglianza delle malattie batteriche invasive da S. pneumoniae in Italia.
La sorveglianza nazionale delle Malattie Batteriche Invasive (MaBI) causate da S. pneumoniae è attiva in Italia dal 1994 presso l’Istituto Superiore di Sanità (ISS), insieme alla sorveglianza delle altre malattie invasive causate da N. meningitidis e H. influenzae [35].
I casi di malattia batterica invasiva sono notificati dall’operatore sanitario che effettua la diagnosi tramite una specifica scheda di segnalazione al Servizio di Igiene Pubblica competente. L’Azienda Sanitaria Locale (ASL) responsabile verifica la completezza dei dati ed effettua la registrazione del caso sulla piattaforma informatizzata MaBI. Allo stesso tempo, l’operatore sanitario o la struttura che ha osservato e notificato il caso provvede alla raccolta e all’invio del ceppo isolato e/o del campione clinico in caso di esame colturale negativo per la conferma di laboratorio a un Laboratorio di riferimento Regionale e/o al Laboratorio di riferimento Nazionale presso l’ISS, che provvede a integrare le informazioni inserite dalla ASL nella piattaforma MaBI. I dati ottenuti dalla sorveglianza delle malattie batteriche invasive causate da S. pneumoniae vengono poi condivisi dall’ISS con l’ECDC. Inoltre, ogni anno viene pubblicato un report contenente i dati consolidati relativi all’anno precedente, in cui sono presentati i dati principali per ogni agente patogeno: numero di casi totali e distribuzione per Regione, incidenza totale e suddivisa per classi di età, distribuzione dei sierogruppi/sierotipi circolanti, casi prevenibili mediante la vaccinazione.
Per questo capitolo sono stati consultati i report del MaBI dal 2011 al 2021 [35] e sono stati analizzati i dati di maggiore rilevanza riguardanti l’incidenza e la distribuzione sierotipica dello S. pneumoniae nella popolazione giovanile.
Per completare la descrizione del quadro epidemiologico è stata eseguita una revisione sistematica sui database PubMed, Scopus e Web of Science aggiornata al 30 novembre 2022. La ricerca è stata condotta mediante l’utilizzo delle stringhe riportate nella Tabella I ed è stata volta all’identificazione degli studi italiani relativi all’epidemiologia delle malattie pneumococciche.
Stringhe di ricerca per le revisioni di letteratura sui dati epidemiologici delle infezioni da S. pneumoniae.
| Database | Stringa di ricerca | Filtri applicati |
|---|---|---|
| PubMed | (“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease) AND (Italy OR italian) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (frequency OR distribution OR epidemiolog* OR prevalence OR incidence) | - |
| Web of science | ALL=[(“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease) AND (Italy OR italian) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (frequency OR distribution OR epidemiolog* OR prevalence OR incidence)] | - |
| Scopus | TITLE-ABS-KEY [(“streptococcus pneumoniae” OR pneumococcus OR pneumococcal AND infection OR s. AND pneumoniae OR pneumococcal AND disease) AND (italy OR italian AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR ipd OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (frequency OR distribution OR epidemiolog* OR prevalence OR incidence)] | - |
Con riferimento alle complicanze delle malattie pneumococciche, il lavoro è stato articolato su due diversi piani, uno internazionale e l’altro italiano. Rispetto al primo sono stati innanzitutto rielaborati i dati sanitari riportati dal report dell’ECDC [34], ed è stata poi condotta su PubMed una revisione della letteratura internazionale, prendendo in considerazione solo revisioni sistematiche già pubblicate. La ricerca, aggiornata al 30 novembre 2022, è stata realizzata attraverso la stringa riportata in Tabella II. Per il focus sul burden clinico dell’infezione pneumococcica in Italia è stata invece condotta una revisione sistematica di letteratura consultando tre differenti database elettronici (PubMed, Web of Science e Scopus), per ciascuno dei quali, in Tabella II, sono riportati maggiori dettagli riguardanti le stringhe di ricerca. Anche in questo caso la ricerca è stata aggiornata al 30 novembre 2022.
Stringhe di ricerca per le revisioni di letteratura sull’impatto clinico delle infezioni da S. pneumoniae.
| Database | Stringa di ricerca | Filtri applicati |
|---|---|---|
| Ricerca di revisioni sistematiche (dati di letteratura internazionale) | ||
| PubMed | (“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “ invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (complication OR sequelae OR hospitalization OR death OR drug resistance, microbial) | Systematic review, English, Humans |
| Ricerca di letteratura nazionale | ||
| PubMed | (“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease) AND (Italy OR italian) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “ invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (complication OR sequelae OR hospitalization OR death OR drug resistance, microbial) | English/Italian language |
| Web of science | (((ALL=((“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease))) AND ALL=((Italy OR italian) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric))) AND ALL=((meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier))) AND ALL=((complication OR sequelae OR hospitalization OR death OR drug resistance, microbial)) | English/Italian language |
| Scopus | (“streptococcus pneumoniae” OR pneumococcus OR pneumococcal AND infection OR s.pneumoniae OR pneumococcal disease) AND (italy OR italian) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR ipd OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (complication OR sequelae OR hospitalization OR death OR drug AND resistance, AND microbial) AND (LIMIT-TO (AFFILCOUNTRY, “Italy”)) AND (LIMIT-TO (LANGUAGE, “English”) OR LIMIT-TO (LANGUAGE, “Italian”)) | English/Italian language; Country (Italy) |
Anche la sistematizzazione delle evidenze sull’impatto economico delle infezioni da S. pneumoniae è stata suddivisa in due parti: la prima riguardante la letteratura internazionale e la seconda quella nazionale. Per quanto riguarda la letteratura internazionale, sono state ricercate e consultate solo le revisioni sistematiche riportate nel database PubMed, utilizzando la stringa di ricerca presente in Tabella III (aggiornata al 30 novembre 2022). In seguito, per la letteratura nazionale, sono stati consultati tre database (PubMed, Web of Science e Scopus) utilizzando le stringhe riportate in Tabella III e aggiornando la ricerca al 30 novembre 2022.
Stringhe di ricerca per le revisioni di letteratura sull’impatto economico delle infezioni da S. pneumoniae.
| Database | Stringa di ricerca | Filtri applicati |
|---|---|---|
| Ricerca di revisioni sistematiche (dati di letteratura internazionale) | ||
| PubMed | (“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (cost OR costs OR cost of illness OR cost analysis OR economic burden OR economic impact) | Systematic Review, English, Humans |
| Ricerca di letteratura nazionale | ||
| PubMed | (“streptococcus pneumoniae” OR pneumococcus OR pneumococcal infection OR S. pneumoniae OR pneumococcal disease) AND (Italy OR italian) AND (children OR newborns OR infants OR toddlers OR adolescents OR pediatric) AND (meningitis OR pneumonia OR bacteremia OR “invasive pneumococcal disease” OR IPD OR sepsis OR septicemia OR otitis OR serotypes OR serogroups OR carriage OR colonization OR carrier) AND (cost OR costs OR cost of illness OR cost analysis OR economic burden OR economic impact) | English/Italian language |
| Web of science | English/Italian language; Country (Italy) | |
| Scopus | English/Italian language; Country (Italy) | |
Sono stati considerati eleggibili tutti gli studi contenenti dati sulla popolazione pediatrica/giovanile (fascia d’età 0-18 anni) relativi a:
incidenza, prevalenza e distribuzione delle malattie da S. pneumoniae (MIP e non-MIP) e del carriage, per la revisione della letteratura sui dati epidemiologici;
complicanze, ospedalizzazioni, mortalità e antibiotico-resistenza, per la revisione della letteratura sui dati del burden clinico;
costi delle malattie da S. pneumoniae, per la revisione della letteratura sull’impatto economico.
Per le revisioni della letteratura internazionale, sono state incluse solo le revisioni sistematiche, pubblicate in lingua inglese, condotte in paesi sia europei che extra europei.
Per le revisioni della letteratura nazionale, sono stati considerati eleggibili solo studi primari scritti in lingua inglese e italiana e condotti sulla popolazione pediatrica italiana.
Sono stati esclusi tutti i lavori non rispondenti agli obiettivi della ricerca, ai filtri preimpostati resi disponibili dal database consultato, di cui non è stato possibile reperire il full text o privi di informazioni pertinenti o sufficienti per le nostre finalità.
Gli articoli trovati sono stati inseriti in un foglio di lavoro Excel dedicato per essere, successivamente, valutati secondo specifici criteri di inclusione/esclusione. Dopo la rimozione dei duplicati, si è proceduto con uno screening per titolo e abstract e, successivamente, con la lettura dei full text dei lavori ritenuti eleggibili. Inoltre, gli articoli sono stati sottoposti a un processo di snowballing, esaminando i riferimenti bibliografici e le citazioni presenti, al fine di identificare ulteriori lavori rispondenti ai criteri di inclusione.
Il processo di selezione dei lavori è stato effettuato in maniera indipendente da almeno due ricercatori, per ogni revisione sistematica condotta. In caso di dubbi riguardanti l’inclusione/esclusione di un lavoro, gli stessi sono stati risolti mediante discussione con un ricercatore senior.
Nell’ambito del processo di estrazione dei dati, i lavori inclusi sono stati inseriti in apposite tabelle riassuntive. Nello specifico, le revisioni sistematiche incluse sono state riassunte in una tabella riportante informazioni sul nome del primo autore e anno di pubblicazione; numero di studi inclusi in ciascuna revisione sistematica analizzata; setting; principali informazioni riguardanti la popolazione target (numero di soggetti inclusi, età, sesso); sierotipi dello S. pneumoniae, quando specificati; risultati principali sul burden clinico della malattia, in termini di complicanze, antibiotico-resistenza, ospedalizzazioni e mortalità.
Gli studi primari inclusi nella revisione sistematica di letteratura italiana, invece, sono stati inseriti in una tabella riportante informazioni sul nome del primo autore e anno di pubblicazione; setting o regione italiana in cui si è svolto lo studio; disegno di studio e sua durata; caratteristiche della popolazione target (numero di soggetti inclusi, età, sesso) e principali risultati.
L’ultimo report dell’ECDC [34], pubblicato nel 2020 e contenente dati relativi alla sorveglianza sanitaria della malattia pneumococcica invasiva nell’intervallo temporale 2014-2018, ne stima un tasso medio di incidenza pari a 6,4 per 100.000 abitanti, con valori di 14,4 casi confermati per 100.000 abitanti tra i bambini di età < 1 anno, rispetto ai 18,7 casi per 100.000 tra gli adulti di età ≥ 65 anni. Nel complesso, in tutte le fasce di età considerate, il sesso più colpito risulta quello maschile, con un rapporto tra maschi e femmine di 1,2:1 (Fig. 1).
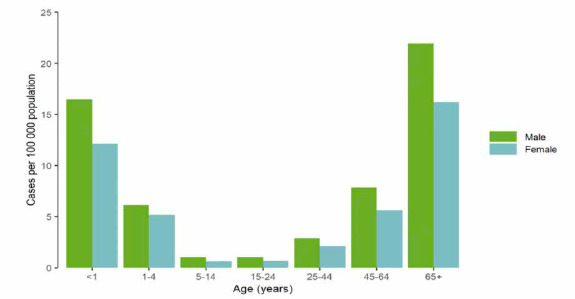
Distribuzione dei casi confermati UE/EEA di malattia invasiva pneumococcica (MIP) per 100.000 abitanti, stratificati per età e sesso. Anno 2018 (Fonte dati: ECDC. Invasive Pneumococcal Disease. Annual epidemiological report for 2018. Stockholm 2020) [34].
La distribuzione stagionale dei casi di MIP segue un modello simile a quello di molte altre malattie respiratorie, con un numero di casi più basso durante l’estate e in rapido aumento con l’inizio dell’autunno. Per quel che riguarda la distribuzione sierotipica dello pneumococco, essa varia in considerazione delle differenti fasce d’età. Al di sotto del primo anno di vita, infatti, cinque sono i sierotipi risultati maggiormente predominanti, quali 8, 10A, 3, 19A e 24F e, tra questi, 24F, 3 e 19A soprattutto nella fascia di età 1-4 anni con una frequenza, rispettivamente, del 12,2, 9,2 e 8,4% (Tab. IV).
Prevalenza dei cinque sierotipi più frequenti di S. pneumoniae da casi confermati di MIP, per fascia di età. Anno 2018 (Fonte dati: ECDC. Invasive Pneumococcal Disease. Annual epidemiological report for 2018. Stockholm 2020) [34].
| Fasce d’età | < 1 | 1-4 | 5-14 | 15-24 | 25-44 | 45-64 | ≥ 65 |
|---|---|---|---|---|---|---|---|
| % dei 5 sierotipi più frequenti per fascia d’età | 8 (11,0%) | 24F (12,2%) | 8 (10%) | 8 (32,5%) | 8 (28%) | 8 (21,5%) | 3 (14,7%) |
| 10A (8,4%) | 3 (9,2%) | 19A (8,3%) | 12F (10%) | 3 (11,3) | 3 (14,6%) | 8 (14,0%) | |
| 3 (7,6%) | 19A (8,4%) | 12F (7,5%) | 19A (8,7%) | 12F (9,5%) | 19A (7,2%) | 19A (7,6%) | |
| 19A (7,0% | 12F (7,3%) | 23B (7,1%) | 3 (7,3%) | 19A (7,6%) | 12F (7,1%) | 22F (7,4%) | |
| 24F (6,5%) | 23B (7,3%) | 3 (5%) | 33F (4,7%) | 9N (4,5%) | 22F (6,4%) | 9N (5,4%) |
Più nello specifico, sempre dai dati riferiti al 2018, emerge che, tra tutti i casi presenti in bambini di età < 5 anni, il 7% è stato attribuito a uno dei sierotipi contenuti nel vaccino pneumococcico coniugato (PCV) 7-valente (4, 6A, 6B, 9V, 14, 18C, 19F + 23F), l’1% a un sierotipo presente nel PCV10-valente/non PCV7-valente (1, 5 e 7F), il 16% a un sierotipo presente nel PCV13-valente/non PCV10-valente (3 e 19A) e il 75% a un sierotipo non incluso nei vaccini citati. Inoltre, dalle segnalazioni dei Paesi che, in modo sistematico, hanno eseguito una sierotipizzazione dei casi in bambini di età < 5 anni, dal 2013 al 2017, si nota una diminuzione della percentuale di sierotipi presenti nel PCV7 dal 14 al 6% e di quelli presenti nel PCV10/non PCV7 dal 5 all’1%, un leggero aumento della proporzione di sierotipi presenti nel PCV13/non PCV10 dal 13 al 16% e un aumento dei sierotipi non presenti nei PCVs dal 68 al 75% (Fig. 2).
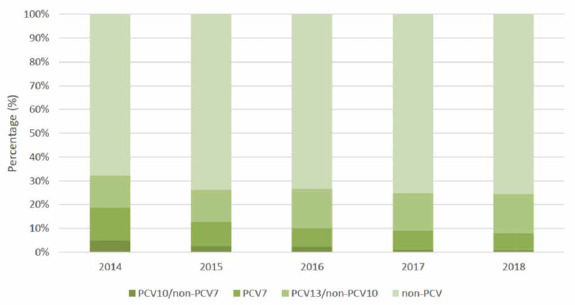
Casi confermati di MIP nei bambini di età < 5 anni: distribuzione dei sierotipi contenuti nei vaccini pneumococcici coniugati (PCV) per anno, dal 2014 al 2018 (Fonte dati: ECDC. Invasive Pneumococcal Disease. Annual epidemiological report for 2018. Stockholm 2020) [34].
Informazioni aggiuntive sulle manifestazioni cliniche delle forme invasive di malattia sono state rese disponibili per il 34% dei casi totali segnalati (8.423 casi), riportando, nel complesso, casi di polmonite batteriemica (43%), meningite (19%), meningite e setticemia (1%) e altre tipologie di manifestazioni (2%).
Nell’ambito della popolazione pediatrica, nei soggetti di età < 1 anno e di età compresa tra 5-14 anni, la meningite è risultata la manifestazione più comune. Nei bambini di età compresa tra 1-4 anni, invece, sono risultate ugualmente frequenti sia la setticemia sia la polmonite batteriemica, quest’ultima più comune a partire dai 15 anni di età.
Per quanto riguarda la suscettibilità antimicrobica non è disponibile una stratificazione per età. Nel complesso, sono stati riportati 5.001 casi di MIP con suscettibilità alla penicillina, di cui l’82% (n = 4.081) segnalato come sensibile, il 16% (n = 825) con suscettibilità intermedia e il 2% (n = 95) come resistente. I dati sulla suscettibilità all’eritromicina sono stati invece resi disponibili per 5.003 casi di MIP, di cui l’82% (n = 4.090) segnalato come sensibile, lo 0,6% (n = 29) con suscettibilità intermedia e il 18% (n = 883) come resistente, mentre, rispetto alle cefalosporine (4.112 casi), il 93% (n = 3.815) dei casi è risultato sensibile, il 6% (n = 262) con suscettibilità intermedia e l’1% (n = 31) resistente.
Molto più esigui sono, infine, i dati riguardanti la mortalità infantile causata da pneumococco. Dalle segnalazioni disponibili si nota un tasso di mortalità correlato con la MIP che aumenta con l’età, raggiungendo un valore di circa il 4% nella popolazione di età < 15 anni.
La Figura 3 riporta i casi totali (tutte le fasce di età) di malattia pneumococcica invasiva causati da S. pneumoniae riportati dal MaBI in Italia per il periodo 2011-2021. Si evidenzia un incremento nel tempo dei casi totali registrati dal 2011 al 2019 nella popolazione generale. Tale andamento può essere attribuibile a una maggiore sensibilità del sistema di sorveglianza, oltre che a un effettivo incremento dei casi. Il numero più alto di episodi è stato rilevato nel 2017 (1.721 casi): di questi il 58% (997 casi) faceva riferimento a persone sopra i 64 anni di età mentre il 5,88% (99 casi) alla popolazione pediatrica di 0-14 anni.
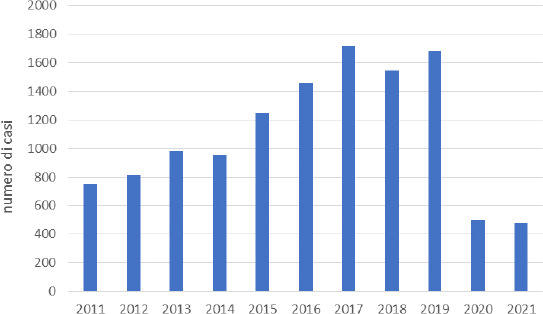
Numero totale di casi di malattia invasiva S. pneumoniae in Italia negli anni 2011-2021 (Fonte dei dati: MaBI).
Nel 2020 è evidente un brusco calo delle segnalazioni (501 casi di MIP rispetto ai 1.680 casi nel 2019 e ai 1.547 casi nel 2018) che può essere attribuito sia all’adozione di norme di prevenzione messe in atto per il controllo dell’emergenza sanitaria da SARS-CoV-2, che a una sottonotifica dovuta al sovraccarico delle strutture sanitarie in tale periodo a causa della pandemia [36].Sia nel 2020 che nel 2021, il numero più alto di episodi è stato riscontrato nella popolazione anziana > 64 anni (n = 283; 56,5% per il 2020 e n = 281; 58,5% per il 2021).
In generale, nel periodo di osservazione 2011-2021, ci sono stati 12.138 casi totali registrati dal MaBi. Tra questi, circa il 7,5% (915 casi) degli episodi è stato registrato nella popolazione più giovane di 0-14 anni (di cui 232 casi tra i neonati d’età inferiore a 1 anno e 395 casi tra i bambini tra 1 e 4 anni) e il 57,6% (6.997 casi) nella popolazione anziana d’età superiore ai 64 anni.
La Figura 4, invece, mostra l’incidenza delle malattie batteriche invasive da S. pneumoniae nel periodo 2011-2021 in Italia, suddivisa per fasce d’età. L’incidenza media per l’intera popolazione nel periodo considerato è stata di 1,9 casi/100.000 soggetti. Le fasce d’età con la maggiore incidenza risultano essere quella dei bambini sotto i 5 anni di età (soprattutto quelli di età inferiore a un anno) e gli anziani di età superiore ai 64 anni. Infatti, l’incidenza media nel periodo 2011-2021 è di 3,0 casi/100.000 soggetti per i bambini (0-4 anni) e di 4,8 casi /100.000 soggetti per gli anziani > 64 anni di età. L’incidenza media delle altre fasce di età è di 0,6 casi/100.000 soggetti nella fascia 5-9 anni, 0,3 casi /100.000 soggetti nella fascia 10-14 anni, 0,2 casi/100.000 soggetti nella fascia 15-24 anni e 1,1 casi/100.000 soggetti nella fascia 25-64 anni.
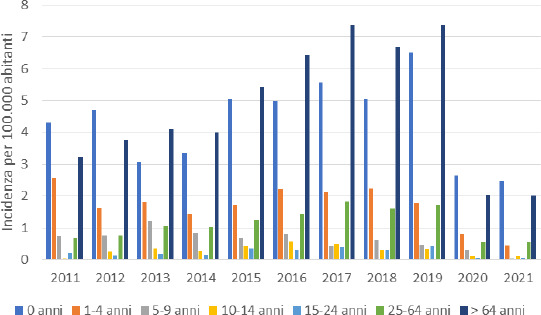
Incidenza (per 100.000 abitanti) della malattia invasiva S. pneumoniae in Italia (Fonte dei dati: MaBI).
È opportuno precisare che il tasso d’incidenza è influenzato dalla proporzione dei casi di malattia batterica invasiva per i quali è stata eseguita una diagnosi e una caratterizzazione dell’agente eziologico. Questo implica che nei casi in cui vi sia stato un mancato accertamento eziologico o una mancata notifica di un caso di malattia, il tasso di incidenza può risultare sottostimato [36].
La Tabella V riporta, in maggiore dettaglio, i dati relativi all’incidenza della malattia batterica invasiva causata da S. pneumoniae nella popolazione giovanile (0-14 anni). Considerando le varie fasce d’età, l’incidenza media più alta è stata riscontrata nei bambini nel primo anno di vita (4,33/100.000 soggetti) e la più bassa nella fascia di età 10-14 anni (0,29/100.000 soggetti), con un andamento decrescente inversamente proporzionale all’età. In linea con il maggior burden di malattia pneumococcica nel primo anno di vita, i calendari di immunizzazione riconoscono, infatti, come prioritaria proprio questa fascia d’età.
Incidenza (per 100.000 abitanti) della malattia invasiva da S. pneumoniae nella popolazione giovanile (Fonte dati: MaBI).
| Anno | 0 anni | 1-4 anni | 5-9 anni | 10-14 anni |
|---|---|---|---|---|
| 2011 | 4,32 | 2,58 | 0,74 | 0,04 |
| 2012 | 4,7 | 1,62 | 0,75 | 0,25 |
| 2013 | 3,05 | 1,81 | 1,21 | 0,36 |
| 2014 | 3,34 | 1,44 | 0,84 | 0,28 |
| 2015 | 5,03 | 1,72 | 0,7 | 0,42 |
| 2016 | 5 | 2,2 | 0,81 | 0,56 |
| 2017 | 5,56 | 2,11 | 0,42 | 0,49 |
| 2018 | 5,04 | 2,23 | 0,61 | 0,31 |
| 2019 | 6,5 | 1,78 | 0,48 | 0,32 |
| 2020 | 2,65 | 0,81 | 0,3 | 0,11 |
| 2021 | 2,47 | 0,44 | 0,04 | 0,11 |
| Incidenza media | 4,33 | 1,7 | 0,63 | 0,29 |
Osservando l’andamento dell’incidenza per le singole fasce d’età, nei bambini nel primo anno di vita è stato registrato un abbassamento dell’incidenza dal 2011 (4,32/100.000 soggetti) al 2013 (3,05/100.000 soggetti) e poi un incremento fino al 2019 (6,50/100.000 soggetti). Invece per il gruppo dei bambini di 1-4 anni l’incidenza più alta si è avuta nel 2011 (2,58/100.000 soggetti) con un decremento nel 2014 (1,44/100.000 soggetti) e poi un aumento successivo fino al 2018 (2,23/100.000 soggetti). Per i bambini di 5-9 anni l’incidenza più alta è stata osservata nel 2013 (1,21/100.000 soggetti) e la più bassa nel 2021 (0,04/100.000 soggetti), con un andamento opposto a quello delle precedenti fasce di età. Infine, per la fascia 10-14 anni, l’incidenza più alta è riportata per il 2016 (0,56/100.000 soggetti) e la più bassa nel 2011 (0,04/100.000 soggetti).
Nelle Tabelle VI e VII è riportata la distribuzione dei casi di malattia batterica invasiva da S. pneumoniae in base alla presentazione del quadro clinico (meningite, polmonite e sepsi/batteriemia) dei casi registrati tra i diversi gruppi d’età della popolazione giovanile (0-14 anni).
Casi di meningite da S. pneumoniae (Fonte dei dati: MaBI).
| 0 anni | 1-4 anni | 5-9 anni | 10-14 anni | Casi totali nella popolazione giovanile | Casi totali nella popolazione generale | |
|---|---|---|---|---|---|---|
| 2011 | 12 (4,42%) | 17 (6,27%) | 8 (2,95%) | 0 (0%) | 37 (13,65%) | 271 |
| 2012 | 12(4,56%) | 9 (3,42%) | 6 (2,28%) | 6 (2,28%) | 33 (12,55%) | 263 |
| 2013 | 8 (2,56%) | 20 (7,60%) | 11 (3,52%) | 7 (2,24%) | 46 (14,74%) | 312 |
| 2014 | 7 (2,11%) | 10 (3,02%) | 8 (2,42%) | 4 (1,21%) | 29 (8,76%) | 331 |
| 2015 | 13 (3,39%) | 6 (1,56%) | 6 (1,56%) | 6 (1,56%) | 31 (8,07%) | 384 |
| 2016 | 12 (2,70%) | 12 (2,70%) | 10 (2,25%) | 8 (1,80%) | 42 (9,46%) | 444 |
| 2017 | 16 (3,29%) | 12 (2,46%) | 4 (0,82%) | 9 (1,85%) | 41 (8,42%) | 487 |
| 2018 | 10 (2,47%) | 8 (1,98%) | 7 (1,73%) | 5 (1,24%) | 30 (7,43%) | 404 |
| 2019 | 13 (3,42%) | 7 (1,84%) | 5 (1,32%) | 6 (1,58%) | 31 (8,16%) | 380 |
| 2020 | 2 (1,59%) | 2 (1,59%) | 5 (3,97%) | 3 (2,38%) | 12 (9,52%) | 126 |
| 2021 | 3 (3,49%) | 2 (2,33%) | - | 3 (3,49%) | 8 (9,30%) | 86 |
| Totale | 108 (3,09%) | 105 (3,01%) | 70 (2%) | 57 (1,63%) | 340 (9,75%) | 3.488 |
Casi di polmonite e sepsi/batteriemia da S. pneumoniae (Fonte dei dati: MaBI).
| 0 anni N (%) | 1-4 anni N (%) | 5-9 anni N (%) | 10-14 anni N (%) | Casi totali nella popolazione giovanile N (%) | Casi totali nella popolazione generale N | ||
|---|---|---|---|---|---|---|---|
| 2011 | Sepsi | 12 (2,50%) | 42 (8,76%) | 13 (2,71%) | 1 (0,21%) | 68 (14,2%) | 479 |
| Altro* | 0 | 0 | 0 | 0 | 0 | 0 | |
| 2012 | Sepsi | 13 (2,36%) | 26 (4,74%) | 15 (2,73%) | 1 (0,18%) | 55 (10,0%) | 549 |
| Altro* | 0 | 1 (33,3%) | 0 | 0 | 1 (33%) | 3 | |
| 2013 | Sepsi | 8 (1,21%) | 20 (3,03%) | 23 (3,48%) | 3 (0,45%) | 54 (8,17%) | 661 |
| Altro* | 0 | 0 | 0 | 0 | 0 | 4 | |
| 2014 | Sepsi | 10 (1,61%) | 22 (3,53%) | 16 (2,57%) | 4 (0,64%) | 52 (8,35%) | 623 |
| Altro* | 0 | 0 | 0 | 0 | 0 | 1 | |
| 2015 | Sepsi | 12 (1,39%) | 30 (3,48%) | 14 (1,62%) | 6(0,69%) | 62 (7,19%) | 862 |
| Altro* | 0 | 1 (25%) | 0 | 0 | 1 (25%) | 4 | |
| 2016 | Polmonite con Sepsi/Batteriemia | 2 (0,42%) | 7 (1,49%) | 4 (0,85%) | 5(1,07%) | 18 (3,84%) | 469 |
| Sepsi/Batteriemia | 10 (1,74%) | 23 (4%) | 10 (1,74%) | 3(0,52%) | 46 (8%) | 575 | |
| Altro quadro clinico con Sepsi/Batteriemia | 1 (2,5%) | 3 (7,5%) | 0 | 0 | 4 (10%) | 40 | |
| Altro** | 0 | 0 | 0 | 0 | 0 | 3 | |
| 2017 | Polmonite con Sepsi/Batteriemia | 1 (0,17%) | 14 (2,33%) | 1 (0,17%) | 2(0,33%) | 18 (3%) | 600 |
| Sepsi/Batteriemia | 8 (1,35%) | 12 (3,72%) | 7 (1,18%) | 3 (0,51%) | 30 (5,07%) | 592 | |
| Altro quadro clinico con Sepsi/Batteriemia | 2 (5,41%) | 7 (18,9%) | 0 | 0 | 9 (24,3%) | 37 | |
| Altro** | 0 | 0 | 1 (33%) | 0 | 1 (33%) | 3 | |
| 2018 | Polmonite con Sepsi/Batteriemia | 1 (0,19%) | 17 (3,29%) | 0 | 0 | 18 (3,5%) | 516 |
| Sepsi/Batteriemia | 10 (1,70%) | 18 (3,06%) | 9 (1,53%) | 3 (0,51%) | 40 (6,80%) | 588 | |
| Altro quadro clinico con Sepsi/Batteriemia | 2 (6,66%) | 1 (3,33%) | 1 (3,33%) | 1 (3,33%) | 5 (17%) | 30 | |
| Altro** | 0 | 0 | 0 | 0 | 0 | 9 | |
| 2019 | Polmonite con Sepsi/Batteriemia | 6 (0,99%) | 6 (0,99%) | 3 (0,49%) | 2 (0,33%) | 17 (2,82%) | 603 |
| Sepsi/Batteriemia | 9 (1,38%) | 17 (2,62%) | 5 (0,77%) | 1 (0,15%) | 32 (4,94%) | 649 | |
| Altro quadro clinico con Sepsi/Batteriemia | 0 | 4 (10,3%) | 0 | 0 | 4 (10,3%) | 39 | |
| Altro** | 0 | 0 | 0 | 0 | 0 | 9 | |
| 2020 | Polmonite con Sepsi/Batteriemia | 1 (0,60%) | 2 (1,22%) | 0 | 0 | 3 (1,83%) | 164 |
| Sepsi/Batteriemia | 8 (4,30%) | 10 (5,38%) | 3 (1,61%) | 0 | 21 (11,29%) | 186 | |
| Altro quadro clinico con Sepsi/Batteriemia | 0 | 1 (8,33%) | 0 | 0 | 1 (8,33%) | 12 | |
| Altro** | 0 | 0 | 0 | 0 | 0 | 13 | |
| 2021 | Polmonite con Sepsi/Batteriemia | 0 | 0 | 0 | 0 | 0 | 121 |
| Sepsi/Batteriemia | 6 (2,27%) | 6 (2,27%) | 1 (0,39%) | 0 | 13 (4,92%) | 264 | |
| Altro quadro clinico con Sepsi/Batteriemia | 1 (0,25%) | 0 | 0 | 0 | 1 (1,25%) | 4 | |
| Altro** | 0 | 0 | 0 | 0 | 0 | 5 | |
| Totale | 123 (1,41%) | 290 (3,33%) | 126 (1,45%) | 35 (0,40%) | 574 (6,58%) | 8.712 | |
| * Altro include: 3 polmoniti nel 2012; 3 polmoniti e un’artrite settica nel 2013; una peritonite nel 2014; due polmoniti, una pleurite e una peritonite nel 2015; 3 polmoniti nel 2016 (prendendo in considerazione la popolazione totale). ** Altro include casi di polmonite o altro quadro clinico con isolamento da sito sterile diverso da sangue. | |||||||
I dati riguardanti i casi registrati dal 2011 al 2015 comprendenti quadri clinici misti caratterizzati da sepsi e meningite sono stati classificati come “meningite” mentre dal 2016 al 2021 i dati riportati includono i quadri di meningite associati a sepsi/batteriemia e i quadri di meningite con solo isolamento da liquor. Risulta evidente che per quanto riguarda la meningite, la fascia d’età maggiormente colpita della popolazione pediatrica è stata quella dei bambini d’età inferiore ai 5 anni, con 213 casi (108 episodi tra i bambini < 1 anno e 105 tra i bambini 1-4 anni di età) sul totale dei casi di meningite registrati dal 2011 al 2021 (340 casi), con un andamento decrescente inversamente proporzionale all’età. Se si considerano i casi totali di meningite da S. pneumoniae in tutte le fasce d’età, dal 2011 al 2021, la popolazione pediatrica (0-14 anni) ha contribuito per circa il 10% del totale (340/3.488) e la fascia 0-4 anni per il 6,11% del totale (213/3.488).
Il 2017 è stato l’anno con più casi di meningite (487): nel dettaglio l’8,42% (41) dei casi è stato riportato nei giovani di 0-14 anni. Al contrario, il 2021 è stato l’anno con meno casi registrati (86) e di questi il 9,30% erano casi segnalati nella popolazione giovanile.
Gli episodi riguardanti altre manifestazioni cliniche diverse dalla meningite rientranti nello spettro della malattia invasiva pneumococcica sono riportati nella Tabella VI. I casi di polmoniti batteriemiche sono stati classificati come “sepsi” nel periodo 2011-2015, mentre dal 2016 al 2021 è stato possibile classificare i casi con un quadro clinico più preciso. Le manifestazioni cliniche di polmonite con sepsi/batteriemia, sepsi/batteriemia e i casi definiti sotto altra voce sono state riportate con una maggiore frequenza nel gruppo d’età 1-4 anni, con 290 episodi su 574 casi della popolazione giovanile (50,5%) e rappresentando il 3,3% delle notifiche rispetto ai casi della popolazione totale.
Considerando la distribuzione dei casi nel periodo esaminato, il 2011 e il 2016 sono stati gli anni con più episodi registrati (68 casi) nella popolazione giovanile, in cui è prevalso principalmente il quadro della sepsi/batteriemia. Il 2021 risulta l’anno con il minor numero di episodi (14 casi).
La sorveglianza MaBI riporta i sierotipi tipizzati di S. pneumoniae riscontrati nella popolazione giovanile solo per la fascia d’età 0-4 anni. Durante il periodo 2011-2015 i ceppi tipizzati di S. pneumoniae sono stati circa 35 e tra quelli maggiormente riscontrati sono emersi il sierotipo 12F, 23B, 8, 12B, 15B, 10A, 22F, 1, 14 e 19A. Nel 2016 e 2017 sono stati tipizzati 31 ceppi: quelli riportati più frequentemente sono stati i sierotipi 3, 9, 10A, 12 F, 15B/C, 19F, 22F, 23B e 24F. Nel 2018, 2019 e 2020 i sierotipi rilevati sono stati 11 e di questi quelli riscontrati con maggiore frequenza sono stati il 10A, 3 e 8.
La Figura 5 mostra il numero totale di sierotipi tipizzati di S. pneumoniae nei bambini (0-4 anni) nel periodo 2011-2021, e i sierotipi prevenibili mediante la vaccinazione anti-pneumococcica 13-valente e 15-valente.
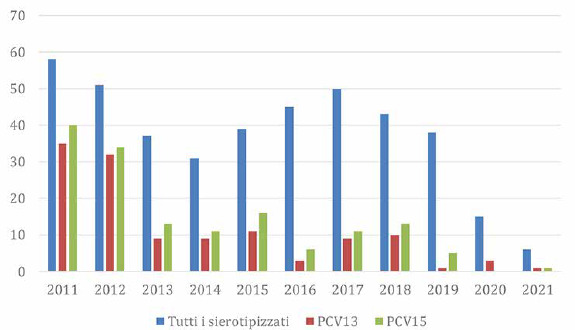
Numero di sierotipi totali e prevenibili mediante la vaccinazione anti-pneumococcica 13-valente e 15-valente, in Italia nel periodo 2011-2021 (Fonte dati: MaBI).
L’andamento nel tempo del numero di sierotipi totali tipizzati mostra una diminuzione progressiva dal 2011 al 2014, poi un aumento fino al 2017 e di nuovo un abbassamento dal 2018 in poi. Invece, per quanto riguarda il numero di sierotipi prevenibili mediante vaccinazione 13-valente e 15-valente, l’andamento nel periodo di riferimento differisce da quello dei sierotipi totali. In particolare, nel caso dei sierotipi prevenibili mediante vaccinazione 15-valente, dopo l’abbassamento del numero nel 2016, si è avuto un nuovo aumento dal 2017. In generale, la quantità di casi da sierotipi prevenibili mediante vaccinazione 15-valente risulta sempre maggiore rispetto a quella da sierotipi prevenibili mediante vaccinazione 13-valente, a eccezione del 2020.
La Tabella VIII riporta nel dettaglio il numero di sierotipi prevenibili mediante la vaccinazione anti-pneumococcica 13-valente e 15-valente nei bambini di 0-4 anni nel periodo 2011-2021. Si evidenzia come tra i sierotipi prevenibili mediante vaccinazione 13- e 15-valente, quelli maggiormente riscontrati nel periodo 2011-2021 siano stati: 1, 3, 14, 19 A, 19F e 22F e 33F.
Numero di sierotipi prevenibili mediante la vaccinazione anti-pneumococcica 13-valente e 15-valente nei bambini di 0-4 anni nel periodo 2011-2021 (Fonte dati: MaBI).
| 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | Totale | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 11 (45,8) | 4 (16,6%) | 4 (16,6%) | 3 (12,5%) | 0 | 1 (4,2%) | 0 | 1 (4,2%) | 0 | 0 | 0 | 24 |
| 3 | 0 | 6 (28,6%) | 1 (4,8%) | 0 | 3 (14,3%) | 0 | 3 (14,3%) | 4 (19,1%) | 1 (4,8%) | 2 (9,5%) | 1 (4,8%) | 21 |
| 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 5 | 1 (100%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| 6A | 0 | 0 | 0 | 1 (50%) | 0 | 0 | 0 | 1 (50%) | 0 | 0 | 0 | 2 |
| 6B | 1 (33,3%) | 2 (66,6%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 3 |
| 7F | 4 (40%) | 3 (30%) | 1 (10%) | 0 | 0 | 0 | 0 | 0 | 2 (20%) | 0 | 0 | 10 |
| 9V | 2 (100%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 |
| 14 | 3 (16,6%) | 8 (44,4%) | 1 (5,5%) | 1 (5,5%) | 0 | 1 (5,5%) | 3 (16,6%) | 1 (5,5%) | 0 | 0 | 0 | 18 |
| 18C | 1 (50%) | 1 (50%) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 |
| 19A | 9 (34,6%) | 7 (26,9%) | 0 | 4 (15,4%) | 4 (15,4%) | 1 (3,8%) | 0 | 0 | 0 | 1 (3,8%) | 0 | 26 |
| 19F | 3 (21,4%) | 1 (1,1%) | 1 (7,1%) | 0 | 3 (21,4%) | 0 | 3 (21,4%) | 3 (21,4%) | 0 | 0 | 0 | 14 |
| 22f | 4 (21,1%) | 1 (5,3%) | 3 (15,8%) | 0 | 4 (21,1%) | 2 (10,5%) | 1 (5,3%) | 2 (10,5%) | 2 (10,5%) | 0 | 0 | 19 |
| 23F | 2 (0,4%) | 1 (0,2%) | 1 (0,2%) | 0 | 1 (0,2%) | 0 | 0 | 0 | 0 | 0 | 0 | 5 |
| 33f | 1 (8,3%) | 2 (16,6%) | 1 (8,3%) | 2 (16,6%) | 1 (8,3%) | 1 (8,3%) | 1 (8,3%) | 1 (8,3%) | 2 (16,6%) | 0 | 0 | 12 |
| Totale | 42 (26,4%) | 36 (22,6%) | 13 (8,2%) | 11 (6,9%) | 16 (10,1%) | 6 (3,8%) | 11 (6,9%) | 13 (8,2%) | 7 (4,40%) | 3 (1,88%) | 1 (0,6%) | 159 |
Infine, in Figura 6 è riportato il numero di sierotipi tipizzati 22F e 33F, prevenibili con il vaccino 15-valente, e il sierotipo 3, nei bambini di 0-4 anni. Nel 2020 e 2021 non risultano casi dovuti ai sierotipi 22F e 33F.
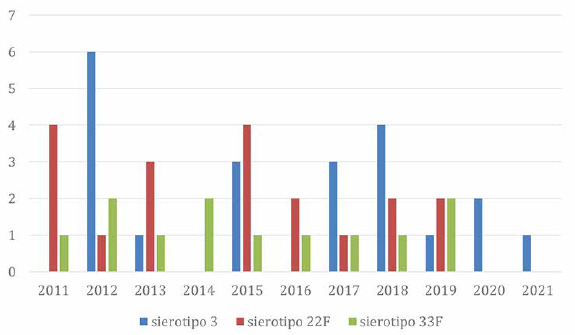
Numero di sierotipi 3, 22F e 33F nei bambini tra 0 e 4 anni in Italia (Fonte dati: MaBI).
È opportuno però ricordare che le diverse attitudini di alcune Regioni a inviare gli isolati per la sierotipizzazione ai laboratori regionali o presso l’ISS e le differenze regionali nelle coperture vaccinali possono influenzare la rappresentatività di questi dati. Inoltre, la bassa numerosità dei casi nei bambini di 0-4 anni causa ampie fluttuazione delle percentuali anche a fronte di piccole variazioni di frequenza [36].
Dalla revisione sistematica di letteratura degli studi italiani riportanti dati epidemiologici sono stati selezionati 43 articoli: 18 relativi alle MIP, 12 inerenti alle malattie pneumococciche non invasive e 13 allo stato di portatore (Appendice 1, Fig. 1; Appendice 2, Tab. I).
Si riporta di seguito la descrizione di quanto emerso dalle fonti consultate partendo dall’epidemiologia del carriage nasofaringeo passando poi alle malattie non invasive, per terminare con la descrizione delle MIP, analizzando in ogni sezione le evidenze sul contributo dei diversi sierotipi.
I dati disponibili relativi alla prevalenza in Italia dello stato di portatore di S. pneumoniae nella popolazione pediatrica derivano da studi pubblicati tra il 2001 e il 2016, quattro dei quali sono riferiti all’era precedente l’utilizzo dei vaccini anti-pneumococco in Italia [37-40], mentre i restanti nove sono stati condotti successivamente all’introduzione della vaccinazione nella popolazione pediatrica italiana [41-49].
Nel periodo antecedente all’uso del vaccino PCV7 nei bambini sani di età < 6-7 anni in Italia si è osservata una prevalenza di carriage nasofaringeo variabile dal 3,8 [37] al 18,29% [40]. In questo periodo solamente uno studio ha riportato dati di prevalenza stratificati per età, registrando una prevalenza di portatori pari al 6,2% nei soggetti di età inferiore ai 2 anni, a 9,5% nella fascia 2-5 anni e a 8,5% nei bambini con età superiore ai 5 anni, non rilevando una differenza significativa tra i diversi gruppi [38].
Uno studio di Marchisio et al. [47] che ha indagato le variazioni stagionali dello stato di portatore ha riportato una prevalenza del 3,8% in autunno e del 4,7% in primavera, senza differenze significative.
Le analisi univariate e multivariate indicano come fattore di rischio per il carriage nasofaringeo una sinusite nei precedenti 3 mesi (unico fattore di rischio associato nell’analisi multivariata di Marchisio et al. con un OR di 2,48, IC 95% 1,11-5,0) [38] e il vivere con più di tre persone nella stessa casa (solo fattore associato nelle analisi univariate di Petrosillo et al. con un OR di 1,70, IC 95% 1,04-2,79) [39].
In questo periodo pre-vaccinale i sierotipi più comuni isolati sono stati quelli successivamente ricompresi nei vaccini PCV7 o PCV13: 23F (presente dall’11,2 al 25,8% dei casi rispetto al totale dei positivi, contenuto nel PCV7), 6A (20%) contenuto nel PCV13, 6B (dal 9,9 all’11,7%) contenuto nel PCV7, 3 (11,6%) contenuto nel PCV13, 19F (dal 7,0 all'11,2%) contenuto nel PCV7, 19A (dal 4,7 al 10,7%) contenuto nel PCV13, 14 (6,6%) contenuto nel PCV7 [38, 39].
Nel periodo successivo all’introduzione della vaccinazione la letteratura italiana presenta dati riferiti agli 2010-2014: cinque studi prendono in considerazione bambini al di sotto di 5-6 anni di età [41-44, 46], due lavori trattano la popolazione sana dai 6 ai 17 anni [45, 47], mentre altri due si occupano di popolazioni particolari sempre dai 6 ai 17 anni, quali quella oncologica e quella affetta da fibrosi cistica [48, 49].
Nei bambini sani con età inferiore ai 5-6 anni si è osservata una prevalenza variabile dal 27 [43] al 50,1% [41]. Pasinato et al. [44] è il solo studio che ha indagato la prevalenza anche nei bambini con infezioni respiratorie, riportando un valore totale del 55,5%, maggiore tuttavia nei bambini con infezioni respiratorie (61,3%), rispetto a quelli sani (50%) con un Rischio Relativo di colonizzazione (RR) di 1,23 (IC 90% 1,13-1,33).
Stratificando per età il trend generale è quello di un aumento della prevalenza del carriage all’aumentare dell’età, con tre studi che mostrano una prevalenza variabile dal 7,1 [42] al 22% nel primo anno di vita [41] fino a un valore massimo del 60% nel terzo-quarto anno [41]. Tra i fattori associati a un maggior rischio di carriage nasofaringeo sono stati ritrovati la presenza di fratelli o sorelle a casa (sino a un PR di 2,23 per due o più persone dall’analisi multivariata di Zuccotti et al. [43]) e frequentare un asilo (PR di 2,27 dalla sopracitata analisi multivariata [43]), mentre nell’analisi multivariata di Camilli et al. si osserva inaspettatamente che avere almeno un genitore fumatore riduce il rischio con un OR di 0,70 (IC 95% 0,61-0,80), anche se da un’ulteriore analisi su un sottogruppo di bambini con dati più dettagliati a disposizione, avere madri fumatrici mostra un OR di 3,66 (IC 95% 1,53-8,73) [42].
Per quanto riguarda invece lo stato vaccinale si riscontrano prevalenze simili tra bambini vaccinati completamente e non vaccinati, rispettivamente 61,9 e 54% (p = 0,08) in Pasinato et al. [44] e le diverse analisi univariate e multivariate non dimostrano un’associazione tra l’immunizzazione e la colonizzazione da qualsiasi sierotipo [43].
Negli anni successivi all’introduzione della vaccinazione nella popolazione di età inferiore a 5-6 anni aumenta nei portatori la percentuale di sierotipi coperti da vaccini, arrivando, come mostrato da Ansaldi et al. [41], al 10,3% per i sierotipi contenuti nel PCV7, 20,3% per quelli del PCV10 e 27,5% per quelli del PCV13. In particolare, i sierotipi più comunemente rilevati nei portatori sono stati il 19A (dall'8,1 all'8,8% dei casi sul totale dei colonizzati [41, 43]) e il 6C (dal 7,9 al 10,3% [42, 46]); percentuali ancora più alte sono state raggiunte dal 15A con il 23,4% [46], dal 10F con 22,9% [41] e dal 35F con il 18,9% [44].
La prevalenza di sierotipi del PCV13 si riduce nei bambini vaccinati con PCV13 rispetto ai non vaccinati: in Zuccotti et al. [43] passa dal 4% dei bambini non vaccinati allo 0% dei vaccinati con PCV13, mentre in Mameli et al. [46], unico studio di coorte che ha valutato i bambini con 3 PCR al tempo 0 e a 6 e 12 mesi di distanza e nel quale la percentuale di vaccinati appropriatamente con PCV13 aumentava dal 27,7% del T0, al 67,2% del T6, fino al 92% del T12, il sierotipo 19A si è attestato al 4,0, 0,0 e 1,6% rispettivamente al T0, T6 e T12, ma al tempo stesso il 15A (non vaccinale) è incrementato durante lo studio dal 4,0, all'8,5, al 23,4%, dal T0 al T12. Questo dimostra una certa protezione data dalla vaccinazione completa verso il carriage dei sierotipi di S. pneumoniae contenuti nel PCV13, seppur si assista contestualmente a un graduale shift della prevalenza verso i sierotipi non vaccinali.
Nei ragazzi sani dai 6 ai 17 anni riscontriamo, invece, una prevalenza di colonizzazione più elevata, con valori dal 51,6 [45] al 57,9% [47].
Diversamente da quanto osservato nei bambini più piccoli, la stratificazione in gruppi di età mostra come la prevalenza diminuisca all’aumentare dell’età, con valori a 6-9 anni del 70,8-74,9%, per passare a un 42,7-51,8% a 10-14 anni, finendo a un 29,4-32,7% a partire dai 15 anni [45, 47].
Nello studio di Principi et al. all’analisi univariata i portatori sono risultati più spesso maschi (p < 0,001), con genitori non fumatori (p = 0,03), allattati esclusivamente al seno per almeno 3 mesi (p = 0,02), con prick test negativo ad allergeni (p = 0,004), vaccinati contro il meningococco (p = 0,01) e mai vaccinati per influenza (p = 0,001) [47], mentre in Esposito et al. non è stata trovata un’associazione tra il carriage dello S. pneumoniae e quello dello Staphilococcus aureus [45]. I sierotipi maggiormente presenti in questa fascia di età sono il 19F, il 5, il 9V e il 4, tutti compresi nel PCV7 o nel PCV13, rispettivamente riscontrati nel 31,5, 17,4, 8,1 e 6,8% dei casi; addirittura dallo studio di Principi et al. [47] emerge come i sierotipi presenti nel PCV7 o nel PCV13 mostrino prevalenze persino maggiori nei soggetti vaccinati rispetto ai non vaccinati, anche se con una differenza non significativa. Questo implica una probabile assenza di efficacia a lungo termine della vaccinazione nei confronti dello stato di portatore e la necessità di indagare più approfonditamente l’utilizzo di un possibile booster negli adolescenti al fine di aumentare l’immunità di gregge.
In riferimento, invece, ai ragazzi di 6-17 anni di età affetti da fibrosi cistica o da cancro si riscontra una prevalenza di portatori rispettivamente del 19,8 e del 18,8% (20% nei tumori ematologici e 11,9% nei tumori solidi) [48, 40]. Anche in questo caso osserviamo una diminuzione del carriage nei ragazzi di età maggiore con una prevalenza del 28,6 e del 44,8% nei minori di 10 anni, 17,6 e 36,8% nella fascia 10-14 anni e del 12,7 e 18,4% nei più grandi [48, 49] Le analisi multivariate dimostrano solamente una riduzione del rischio con l’assunzione di qualsiasi antibiotico negli ultimi 3 mesi negli affetti da fibrosi cistica (OR 0,23, IC 95% 0,07-0,69 per antibiotici per via sistemica e OR 0,26, IC 95% 0,08-0,77 per antibiotici per via inalatoria) [48] o con la profilassi con cotrimossazolo nei ragazzi con cancro (OR 0,41, IC 95% 0,19-0,89) [49], mentre non si osserva una differenza significativa tra vaccinati e non vaccinati. I sierotipi più comuni anche per questi gruppi sono il 19F, 5, 9V e 4.
I dati disponibili relativi alle malattie non invasive in Italia dovute a S. pneumoniae nella popolazione pediatrica derivano da dodici studi pubblicati tra il 1992 e il 2014, sette dei quali valutano il tasso di ospedalizzazione per polmoniti acquisite in comunità [50-56], e sei l’incidenza delle otiti medie e delle complicanze associate [52, 57-61].
Come detto nell’introduzione, la polmonite rappresenta la manifestazione clinica più comune dell’infezione da pneumococco. Su un campione di 640 bambini ricoverati in ospedale a Siena dal 1992 al 2006 con una coltura positiva per S. pneumoniae, 334 (52,2%) avevano una malattia pneumococcica localizzata [50].
I bambini sotto i 5 anni di età e gli anziani sono le fasce di età più colpite dalla polmonite pneumococcica. Lo studio di Baldo et al. [51], pubblicato nel 2016, ha analizzato tutti i ricoveri per polmonite dal 2004 al 2013 nell’Italia nord-orientale tramite la raccolta delle cartelle cliniche che presentavano una diagnosi primaria o secondaria di polmonite batterica. Ne è emerso un tasso medio annuo di ospedalizzazione per polmonite di 204,6 per 100.000 abitanti con un picco nei bambini di età compresa tra 0 e 4 anni (325,6 per 100.000 nei maschi, 288,9 per 100.000 nelle femmine) e negli adulti di età superiore ai 65 anni (844,9 per 100.000 nei maschi, 605,7 per 100.000 nelle femmine).
Sempre riguardo ai tassi di ospedalizzazione per polmonite pneumococcica, due studi italiani hanno analizzato l’impatto che l’avvento dei vaccini coniugati ha avuto su di essi. Lo studio di Ansaldi et al. [52] ha esaminato l’effetto del programma di immunizzazione con PCV7 sui ricoveri ospedalieri per polmonite o altre patologie pneumococciche in soggetti di 0-2 anni nati prima e dopo l’introduzione del programma. L’incidenza su 10.000 anni persona è passata da 1,91, nella coorte di bambini nati prima dell’introduzione del programma vaccinale, a 0,56 nella corte di bambini nati dopo l’introduzione del vaccino. Lo stesso si è visto sulla popolazione pediatrica toscana in uno studio che ha considerato una fascia di età più ampia, cioè 0-9 anni, durante l’epoca pre-vaccinale (2002-2007) e nel periodo post-vaccinale (2009-2014): il tasso medio annuo di ospedalizzazione per polmoniti e otiti pneumococciche è diminuito del 29,1%, da 1142,5/100.000 a 809,5/100.000 [53].
Uno studio retrospettivo su una popolazione pediatrica parzialmente vaccinata composta da più di 5.000 bambini ricoverati in ospedale tra il 1999 e il 2009 per polmonite pneumococcica, oltre a valutare l’incidenza delle coinfezioni microbiche e delle complicanze, ha rilasciato il tasso di ospedalizzazione annuale totale per pneumococco stratificato per fascia di età: 28,04 per 100.000 (IC 95%: 26,42-31,23) tra 0 e 5 anni, 0,98 (IC 95%: 0,60-1,37) tra 6 e 12 anni; e 10,06 (IC 95%: 8,48-11,64) tra 13 e 18 anni. Tra i bambini di età < 5 anni i tassi di ricovero per polmonite pneumococcica sono aumentati di 4,15 volte da 12,84 per 100.000 (IC 95%: 7,35-18,34) nel 2001 a 53,27 (IC 95%: 42,67-63,87) nel 2006 per poi stabilizzarsi successivamente. Nel 2009 invece il tasso era di 45,41 (IC 95%: 35,93-54,90) per 100.000 [54].
Per quanto concerne i sierotipi coinvolti nelle polmoniti, uno studio osservazionale condotto tra il 2007 e il 2009 su un’ampia coorte di bambini italiani ricoverati per polmonite in 83 ospedali italiani, ha identificato il sierotipo 1 come il più frequente tra i bambini più grandi e quello più spesso associato a forme complicate. Nei bambini più piccoli invece (< 2 anni) la distribuzione dei sierotipi pneumococcici è risultata più omogenea, con frequenze che andavano dal 5,3 (sierotipi 4, 5 e 18) al 15,8% (sierotipi 19A e 19F). In particolare, il sierotipo 19A è risultato il più frequente [56], ma anche quello significativamente associato a un’età minore [55].
Alcuni studi sulla popolazione pediatrica italiana hanno analizzato l’impatto a livello epidemiologico di questa patologia spesso, tuttavia, soffermandosi sui casi senza una diagnosi eziologica. Uno studio di coorte ha voluto determinare l’incidenza e le complicanze dell’OMA nei bambini di età < 6 anni, arruolando 5.776 partecipanti provenienti da cinque nazioni nel periodo 2008-2009. Sono state revisionate retrospettivamente le cartelle cliniche e i dati di follow-up prospettico attraverso la collaborazione sia dei medici che dei genitori. Lo studio ha stimato un’incidenza di otite pari a 256/1.000 anni-persona (IC 95% 243-270); l’Italia è risultata la nazione con l’incidenza più bassa (195, IC 95% 171-222), nonché quella con la percentuale più alta di bambini che hanno avuto un solo episodio di otite (86,1%) [57].
Un altro studio italiano ha analizzato tramite il database Pedianet gli episodi di otite acuta non eziologicamente identificata nei bambini di età compresa tra 0 e 6 anni tra il 2003 e il 2007. I tassi di incidenza/100 anni persona sono stati calcolati sia con riferimento agli episodi complessivi di otite che per quelli singoli e ricorrenti. Il tasso di incidenza totale nel periodo di 5 anni è stato di 16,8 episodi per 100 anni-persona (IC 95%: 16,7-16,9), inclusi episodi singoli (15,9 episodi per 100 anni-persona; IC 95%: 15,7-16,1) e ricorrenti (0,9 episodi per 100 anni-persona; IC 95%: 0,9-0,9). Analogamente si è visto che, stratificando per fasce di età, il tasso complessivo è variato da 14,2 (IC 95%: 13,8-14,6) nella fascia di età 0-1 anno a 12,2 (11,8-12,5) nella fascia 5-6 anni con un picco di incidenza nella fascia 3-4 anni (22,2 (IC 95%: 21,8-22,7)), seguita da quella di 1-2 anni, mentre il tasso più basso è stato riscontrato nei bambini di età compresa tra 5 e 6 anni [58].
Con riferimento all’impatto della vaccinazione, uno studio veneto si è posto l’obiettivo di valutare le tendenze nell’incidenza dell’OMA nei bambini di età inferiore ai 15 anni, identificati in Pedianet dal 2010 al 2017, seguendo i cambiamenti nei tassi di incidenza annuale nel periodo precoce di introduzione del vaccino (2010-2013) e in quello più tardivo (2014-2017). Dividendo la popolazione pediatrica dello studio per fasce di età si è visto che nei bambini di 0-2 anni il tasso di incidenza di OMA era di 126 per 1.000 anni-persona (IC 95%: 123-129) nel 2010 e di 79 (IC 95%: 77-82) nel 2017. Nei bambini di 2-4 anni è passato da 213 (IC 95%: 205-221) nel 2010 a 178 (IC 95%: 169-186) nel 2017, mentre nella fascia di età 5-14 anni è passato da 60 (IC 95%: 57-63) nel 2010 a 38 (IC 95%: 36-40) nel 2017 [59]. Lo studio ha quindi dimostrato una riduzione del 6% all’anno dell’incidenza delle OMA sia nel periodo precoce che in quello più tardivo dopo l’introduzione della vaccinazione, senza cambiamenti significativi del trend tra i due periodi [59].
I vaccini hanno anche contribuito a variare notevolmente i tassi di ospedalizzazione per OMA. Ad esempio, in Liguria si è visto come in una coorte di circa 12 mila neonati il tasso di ospedalizzazione (incidenza/10.000 anni persona) è variato da 45,22 (IC 95%: 40,37-50,05) nella coorte di nascita prima dell’introduzione del programma di immunizzazione pneumococcica a 28,77 (IC 95%: 25,02-32,92) nella coorte dei nati dopo l’introduzione dello stesso [52].
Uno studio italiano si è proposto di valutare il ruolo eziologico dei principali patogeni batterici associati allo sviluppo di OMA, ovvero S. pneumoniae, H. influenzae non tipizzabile, ma anche Moraxella catarrhalis, Streptococcus pyogenes e Staphylococcus aureus, nei bambini con OMA e perforazione spontanea della membrana timpanica. Lo studio è stato condotto tra il 2015 e il 2016 e ha coinvolto 177 bambini nella fascia di età da 6 mesi a 7 anni completamente vaccinati sia per H. influenzae che per S. pneumoniae (con PCV7 o PCV13). Si è visto che l’H. influenzae non tipizzabile è stato l’agente patogeno più frequentemente identificato in 90 campioni (50,8%), seguito da M. catarrhalis (62 casi, 35,0%) e poi da S. pneumoniae (48 casi, 27,1%). È interessante notare come H. influenzae non tipizzabile è stato maggiormente ritrovato anche nei bambini con co-infezioni, insieme a M. catarrhalis in 17 casi (9,6%), S. pyogenes in 11 casi (6,2%) e S. pneumoniae in 10 casi (5,6%). H. influenzae non tipizzabile e S. pneumoniae sono stati identificati significativamente più frequentemente nei bambini di età inferiore ai 2 anni [60].
L’OMA può associarsi infine a diverse complicanze, come la perforazione della membrana timpanica e la mastoidite, e le evidenze riportano come la frequenza di quest’ultima non si sia ridotta negli ultimi anni, forse a causa dell’aumento dell’antibiotico resistenza [61].
I dati disponibili relativi alle MIP nella popolazione pediatrica italiana derivano da 18 studi, che analizzano la situazione italiana a partire dal 1997 fino al 2017. Di questi sette sono riferiti all’epoca pre-vaccinale [62-68] e 11 al periodo successivo alla diffusione della vaccinazione pneumococcica [69-79].
La disponibilità di studi primari sulle MIP è di grande importanza in considerazione delle possibili limitazioni dei dati della sorveglianza nazionale.
Infatti, Quattrone et al. [79], valutando la qualità delle informazioni epidemiologiche fornite dalla sorveglianza nella regione Toscana nel periodo 2016-2017, hanno dimostrato un’importante sottostima dell’incidenza riconducibile, tra i vari motivi, al processo di notifica in parte ancora non digitalizzato e alla non piena consapevolezza dell’importanza della notifica di malattie infettive da parte degli operatori sanitari.
In epoca pre-vaccinale, in Italia, l’incidenza delle MIP e dei relativi sierotipi nei bambini sono stati valutati principalmente attraverso studi di sorveglianza attiva.
Da aprile 2001, per 12 mesi, in Piemonte e in Puglia è stato condotto uno studio di sorveglianza attiva da cui è emersa un’incidenza di MIP di 11,3/100.000 in Piemonte e 5,9/100.000 in Puglia nei bambini al di sotto dei 2 anni. Più nello specifico, in Puglia è stata riscontrata una incidenza di MIP nelle fasce 0-11 mesi e 0-4 anni, rispettivamente, di 7,1 e 2,8/100.000 mentre, nelle stesse fasce d’età, in Piemonte, del 5,6 e 6,3/100.000. I casi confermati con emocoltura o PCR hanno evidenziato una prevalenza di diagnosi di meningiti [62].
Nel 2003 nel Nord Est dell’Italia è stato portato avanti uno studio prospettico di sorveglianza attiva che ha visto la collaborazione di pediatri di libera scelta e pediatri ospedalieri al fine di stimare l’incidenza delle MIP nei bambini di età compresa fra 0 e 36 mesi. I casi sospetti sono stati 32, 12 confermati con emocoltura, di cui quattro casi di batteriemia in bambini fra 0 e 12 mesi, un caso di meningite fra 13 e 24 mesi, e cinque casi di batteriemia, uno di meningite e uno di polmonite fra i bambini di 25-36 mesi. I casi di MIP si sono verificati soprattutto nei mesi più freddi. L’incidenza annuale cumulativa nel 2003 è risultata pari a 58,9/100.000 (IC 95% 30,38-102,71) [63].
Un interessante studio prospettico di sorveglianza di 12 mesi è stato progettato per valutare l’incidenza di MIP nella provincia di Firenze, nel periodo compreso tra dicembre 2005 e novembre 2006, in bambini di età compresa tra 0 e 14 anni. Il tasso di incidenza di MIP confermata con metodi colturali è risultato complessivamente di 3,6/100.000, maggiore tuttavia nelle fasce di età più precoci (4,7/100.000 sotto i 5 anni, 11,5/100.000 sotto i 2 anni e 11,2/100.000 nel primo anno di vita). Utilizzando metodi molecolari, il tasso di incidenza di MIP nei bambini al di sotto dei 14 anni di età è risultato di 19,9/100.000, anche in questo caso maggiore al di sotto dei 5 anni di età (35,1/100.000) e in particolare, al di sotto di 2 anni (51,8/100.000) e di 1 anno di età (55,8/100.000) [64].
Un’analisi dei sierotipi responsabili di MIP in epoca pre-vaccinale è stata riportata da Zanchi et al [65]. Dal loro studio su 26 isolati di malattie invasive da S. pneumoniae raccolti nel periodo 1992-2005 nella provincia senese da pazienti pediatrici con età inferiore a 12 anni ricoverati presso la clinica di malattie infettive di Siena è emerso che il 34,6% dei sierotipi osservati erano contenuti nel vaccino PCV7. Tra i sierotipi prevalenti sono stati riscontrati l’1 (34,6% del totale dei sierotipi solati), il 6A (11,5%) e il 14 (11,5%). Al di sotto dei 5 anni le percentuali sono state del 21,4% per l’1 e il 6A e del 14,3% per il 14.
Due articoli italiani hanno analizzato specificatamente i casi e l’impatto della meningite pneumococcica nella popolazione pediatrica negli anni che vanno dal 2000 al 2006, integrando dati derivanti sia dal sistema di sorveglianza che da flussi ospedalieri.
Lo studio lombardo di Pavan et al. è stato condotto tra il 2000 e il 2006 utilizzando come fonti le notifiche di malattie infettive trasmesse al Ministero della salute dalle ASL e dalla Regione, le notifiche trasmesse al sistema di Sorveglianza sulla Meningite batterica e i dati derivanti dalle dimissioni ospedaliere. Sono stati analizzati tutti questi dati e per ciascun caso sono state raccolte le informazioni anagrafiche, la storia clinica e l’esito della malattia. Infine, i dati sono stati rielaborati per calcolare i tassi di incidenza annuali. Si può notare che nella fascia pediatrica e neonatale le forme da N. meningitidis e da S. pneumoniae quasi si equivalgono, con preponderanza, negli anni di studio considerati, delle forme da N. meningitidis. Intorno ai 20 anni prevalgono invece i casi dovuti a N. meningitidis, mentre dai 30-35 anni fino agli ultrasettantenni prevalgono le forme da S. pneumoniae. [67].
Invece, uno studio condotto nel Lazio (con una popolazione di circa 5 milioni di abitanti tra il 2001 e il 2005) ha segnalato, in questa regione, 944 casi di meningite, l’89% dei quali è stato eziologicamente correlato con S. pneumoniae; è interessante notare i picchi di incidenza nel primo anno di vita (48,60/100.000/anno) e nei bambini da 1 a 4 anni (11,29/100.000/anno). La popolazione maschile è risultata più colpita rispetto a quella femminile (4,27/100.000 vs 3,12/100.000). Quest’ultimo studio ha anche identificato nei sierotipi 14 (9,9% delle meningiti da pneumococco), 19 (9,9%), 23 (8,8%), 6 (8,8%) quelli più frequentemente associati alla meningite pneumococcica [68]. Analogamente, un altro studio sui sierotipi per questa patologia ma precedente rispetto a quelli sopra riportati (1997-1999) ha identificato nel sierotipo 14 quello maggiormente diffuso nei bambini al di sotto dei 5 anni (28%), seguito dal 6B (20%) e dal 23F (16%) [66].
Successivamente alla diffusione della vaccinazione antipneumococcica sul territorio italiano sono stati pubblicati diversi studi che hanno indagato l’impatto che i nuovi vaccini PCV7 e PCV13 hanno avuto sull’incidenza di MIP nella popolazione pediatrica e sulla prevalenza dei relativi sierotipi, quattro dei quali hanno elaborato dati provenienti dalla Sorveglianza Nazionale delle MaBI [69-72] mentre altri sei si sono basati sulla sorveglianza attiva [73-78].
Uno studio condotto in sette regioni italiane dal 2008 al 2014 mirava a verificare l’impatto del vaccino coniugato e a monitorare i sierotipi utilizzando i dati della Sorveglianza Nazionale delle MaBI. L’incidenza nazionale di MIP è stata di 1,2/100.000 (6,6/100.000 per i bambini < 1 anno di età, 3,5/100.000 per i bambini di 0-4 anni di età e 2,7/100.000 negli adulti > 64) nel 2008 e 1,4/100.000 nel 2014 (3,3/100.000 per bambini di età inferiore a 1 anno di età, 1,6/100.000 per bambini 0-4 anni e 3,6/100.000 negli adulti> 64) con un trend in discesa nel corso degli anni, in particolare nella fascia di età < 1 anno e nella fascia 0-4 anni. Nelle sette regioni selezionate si sono verificati l’87% (4.975/5.694) dei casi nazionali. Negli anni 2008-2014 per la fascia d’età 0-4 si è osservata una riduzione dell’incidenza delle malattie per tutti i sierotipi da 7,1 a 2,9 casi/100.000: l’incidenza delle forme da sierotipi vaccinali in particolare è scesa da 5,5 a 1,1/100.000, mentre l’incidenza delle forme da sierotipi non vaccinali è aumentata da 1,6 a 2,0/100.000 [69].
Un altro studio [70] portato avanti negli stessi anni conferma la diminuzione dell’incidenza delle MIP nel periodo 2008-2014. Sono stati analizzati i dati provenienti dal sistema di sorveglianza nazionale di cinque regioni italiane ed è stata confermata la diminuzione complessiva nel periodo considerato dei casi di MIP per i bambini di età inferiore a 5 anni da 7,8/100.000 del 2008 a 3,0/100.000 del 2014. Il calo maggiore (64%) è stato osservato nella fascia di età < 1 anno, dove l’incidenza di MIP è scesa da 12,9 a 4,6 casi/100.000 abitanti. Nei vaccinati, l’incidenza di MIP è diminuita da 2,92/100.000 del 2008 allo 0,13/100.000 del 2014. I sierotipi non vaccinali, nel periodo considerato, sono gradualmente aumentati (12F e 24F i più comuni, oltre al 19A, 20, 24, 33).
Nello studio di Monali et al. [71] è stato analizzato e approfondito l’impatto della vaccinazione in Italia sui casi di MIP nel periodo 2007-2017. Nel periodo oggetto dello studio, in Italia sono stati notificati 10.791 casi di MIP con tendenza in aumento. Nel 2007 in Italia sono stati segnalati al Ministero della Salute 524 casi di MIP con un tasso di notifica di 0,88/100.000 abitanti. Nel 2017 sono stati notificati 1.703 casi di MIP con un tasso di notifica di 2.,82/100.000 abitanti. In particolare, nel 2017 i tassi di MIP specifici per età erano: 5,7 per 100.000 bambini di età < 1 anno e 2,2 per 100.000 nei bambini di età compresa tra 1 e 4 anni [71].
I dati sulla sierotipizzazione nella popolazione italiana sono risultati disponibili per il 51% dei casi notificati. I sierotipi di S. pneumoniae isolati dai casi notificati sono risultati quelli vaccinali ricompresi nel PCV7 nel 31,0% dei casi nel 2007 e nel 6,3% nel 2017. Considerando il PCV10, i sierotipi vaccinali isolati dai casi notificati sono passati dal 13,2% nel 2007 al 2,6% nel 2017, mentre considerando il PCV13, dal 25,3% nel 2010 al 18,3% nel 2017 [71]. I sierotipi che hanno visto l’aumento maggiore nel periodo considerato sono stati il 3, l’8, il 12F e il 22F: nella popolazione di età compresa tra 0 e 4 anni sono risultati in aumento l’8 e il 12F, mentre il 19A e 3 sono diminuiti [71].
La riduzione dell’incidenza di MIP dopo l’introduzione della vaccinazione viene confermata anche da uno studio condotto in Veneto dal 2007 al 2014 con dati estrapolati dal Sistema di Sorveglianza regionale [72]. Il tasso di notifica delle MIP nei bambini < 5 anni è risultato di 3,75/100.000 con un più alto rischio di sviluppare la malattia (RR = 8,9, IC 95%: 5,1-15,9), rispetto alle altre fasce di età. Dall’analisi dei fattori di rischio per lo sviluppo delle MIP emerge inoltre che la malattia invasiva è stata causata principalmente dai sierotipi contenuti nel PCV13, rispetto agli altri sierotipi (RR = 2,9, IC 95%: 2,3-3,9). Tuttavia, una riduzione importante dell’incidenza complessiva di malattia è risultata evidente nel periodo successivo all’introduzione del vaccino PCV13 (RR = 0,4, IC 95%: 0,3-0,5), dimostrando l’efficacia del vaccino PCV13 nei bambini.
Per quanto riguarda gli studi basati sulla sorveglianza attiva nel periodo post vaccinale, Riva et al. [73], nel 2008, hanno portato avanti uno studio osservazionale multicentrico coinvolgendo una rete di 10 ospedali nel nord ovest della Lombardia arruolando bambini al di sotto dei 5 anni di età con sospetta MIP. Su 135 bambini reclutati, i casi confermati sono stati 15. L’incidenza annuale di MIP è stata di 50/100.000 (IC 95% 30,5-82,5/100.000). L’incidenza stratificata per età è risultata 58,3/100.000 (IC 95% 28,8-120,1/100.000) nei bambini < 2 anni e 44,4 (IC 95% 22,9-87,5/100.000) nei bambini fra 2 e 4 anni.
Singolare è uno studio prospettico di sorveglianza attiva eseguito in Sicilia sulla popolazione pediatrica da 0 a 59 mesi di età, condotto dal 1° gennaio 2010 al 31 dicembre 2011 [74]. Lo studio ha coinvolto 100 pediatri di famiglia, i bambini coinvolti sono stati 31.618 nel 2010 e 31.109 nel 2011. Di questi solo 40 risultavano casi sospetti ma nessuno è stato confermato come MIP, con un tasso di incidenza di 0,0/100.000 in entrambi gli anni oggetto di studio. Gli autori sottolineano che questo risultato può essere dovuto in parte all’elevata copertura vaccinale – maggiore del 90% – dei bambini siciliani, in parte alla limitata numerosità del campione.
Sempre Amodio et al. [75] ha condotto uno studio longitudinale di sorveglianza attiva delle MIP nella regione Sicilia (Pneumonet) dal 2009 al 2011. La sorveglianza è stata condotta dalle aziende ospedaliere provinciali e da 100 pediatri di libera scelta, nei bambini con un’età compresa fra 0 e 59 mesi interessando circa 30.000 bambini. Di questi gli eleggibili sono stati 136, nove dei quali sono risultati positivi, quattro sia a emocoltura che PCR e cinque solo a PCR. L’incidenza risultante è stata di circa 3/100.000, in linea con l’alto livello di copertura vaccinale della popolazione oggetto dello studio.
Diversi studi hanno più recentemente affrontato la distribuzione dei sierotipi coinvolti nelle MIP nei bambini e negli adolescenti. Nel Lavoro di Nieddu et al. [76] sono stati raccolti dati su adolescenti e adulti con diagnosi di MIP nel periodo 2005-2016, provenienti da tre regioni italiane (Friuli Venezia Giulia, Emilia Romagna e Toscana). I sierotipi più comunemente isolati sono stati il 3 (13,3%), l’8 (8,5%) e il 19A (7,5%). Complessivamente i sierotipi inclusi nel PCV13 hanno rappresentato il 47,6% degli isolati, ma il 62,3% nell’era pre-PCV13 e il 45,0% nell’era post PCV13. Il sierotipo 7F nell’era pre-PCV13 ha rappresentato il 15,6% degli isolati, mentre nel post-PCV13 solo il 2,8%.
Un ulteriore studio è quello di Azzari et al. [77] che ha valutato la potenziale copertura sierotipica dei tre vaccini pneumococcici coniugati (PCV7, PCV10, PCV13) contro l’infezione pneumococcica invasiva nei bambini. Lo studio, condotto nel periodo compreso tra aprile 2008 e marzo 2011, ha preso in considerazione bambini di 0-16 anni ricoverati in ospedale con diagnosi di MIP (sepsi-meningite pneumococcica, polmonite, batteriemia) provenienti da 83 centri pediatrici italiani. I 10 sierotipi più comuni individuati tramite PCR sono stati: 1 (29,9%), 3 (16,0%), 19A (13,2%), 7F (18,3%), 5 (4,2%), 14 (4,2%), 6A (3,5%), 6B (3,5%),18C (3,5%) e 19F (3,5%). In particolare, negli anni 2009-10-11, i sierotipi più frequenti nella fascia di età considerata sono stati l’1, il 3, e il 19A nei pazienti con polmonite e il 7F, il 3 e il 6A nei pazienti con meningite (nessuno di questi sierotipi è incluso nel PCV7 ma sono inclusi nel PCV13).
Infine, Nicolosi et al. [78] hanno effettuato una revisione delle cartelle cliniche dei bambini ricoverati all’Ospedale Bambin Gesù di Roma nel periodo 2008-2012 per valutare l’impatto dei vaccini PCV7 e PVC13 sulle MIP e identificarne i sierotipi coinvolti. I casi di MIP sono stati 46, l’età media dei bambini era 1,8 anni (range 1 giorno-16,4 anni). I sierotipi osservati sono stati il 19A (26,1%), l’1 (15,2%), il 3 e il 10 (entrambi 8,7%), il 14 (6,5%), mentre 7F, 11A, 15C, e 24F hanno fatto registrare due casi ognuno. I sierotipi del PCV7 sono stati l’8,9%, quelli del PCV13 il 66,7% e quelli non ricompresi nel PCV13 il 33,3%.
Al fine di delineare un quadro più completo sul burden clinico delle complicanze conseguenti alle infezioni da S. pneumoniae a livello internazionale, si è proceduto con la sistematizzazione e l’analisi dei dati emersi dalla revisione sistematica di letteratura.
Dalla ricerca bibliografica condotta, sono stati selezionati 135 records riportanti informazioni in linea con gli obiettivi della ricerca e riguardanti la popolazione pediatrica a livello internazionale. Dopo una prima fase di screening per titolo e abstract e la valutazione di 51 full text, sono state definite eleggibili 16 revisioni sistematiche. Dal processo di snowballing, inoltre, sono stati inclusi ulteriori due lavori, portando a un totale complessivo di 18 revisioni sistematiche ritenute eleggibili per la nostra ricerca. I dettagli sul processo di selezione degli studi sono schematizzati in Appendice 1, Figura 2.
Tra i lavori inclusi, quattro (22,3%) riportano dati raccolti in America Latina [80-83]; quattro (22,3%) prendono in esame la popolazione pediatrica della Cina [84-87]; altri tre (16,7%) riportano dati globali riguardanti più continenti [27, 88, 89]; due articoli (11,2%) si focalizzano sulla malattia pneumococcica pediatrica in Africa [90, 91]; un lavoro (5,5%) fa riferimento al Giappone [92]; uno (5,5%) alla Tailandia [93]; uno (5,5%) all’India [94]; uno (5,5%) prende in esame il burden clinico dell’infezione nel Sud dell’Asia [95]; infine, uno (5,5%) analizza la popolazione pediatrica in Europa occidentale [96].
Analizzando le caratteristiche della popolazione target, la metà dei lavori inclusi (n = 9, 50%) prende come riferimento specifico bambini < 5 anni di età e tre (17%) analizzano gruppi di adolescenti di età ≤ 14 anni [82, 86, 87]. Tra i rimanenti, invece, uno studio (5,5%) si focalizza sulla popolazione di età ≤ 2 anni [96]; uno (5,5%) su bambini < 6 anni [83]; uno (5,5%) sulla popolazione pediatrica < 16 anni [90]; uno (5,5%) sulla popolazione < 15 anni [92]; una revisione (5,5%) valuta una popolazione pediatrica con un ampio range di età compresa tra un mese e 12 anni [95]; infine, una revisione (5,5%) include ragazzi < 18 anni di età [84].
Si riporta, di seguito, una sintesi dei principali risultati emersi da questa revisione sistematica, articolata in specifici paragrafi riguardanti, rispettivamente, dati relativi alle principali complicanze correlate allo S. pneumoniae e alla sua distribuzione sierotipica, antibiotico-resistenza e, infine, ospedalizzazioni e mortalità correlate alle infezioni pneumococciche (Appendice 2, Tab. II).
Tra le malattie legate all’infezione da S. pneumoniae, la MIP risulta molto frequente nei bambini di età < 2 anni [80, 96].
Nel contesto europeo, la revisione sistematica condotta da Jefferson et al. [96] rileva un’elevata variabilità tra la popolazione pediatrica di diversi paesi considerati, con un tasso di incidenza oscillante tra 11,83 (IC 95% 10,06-11,25) casi/100.000 abitanti segnalati in Svizzera e 93,48 (IC 95% 76,55-110,42) casi/100.000 abitanti in Spagna.
Come suggerito dal lavoro di Valenzuela et al. [80], il tasso di incidenza media annua di MIP sembra diminuire con l’aumentare dell’età con valori fino a due volte più alti nei bambini di età < 2 anni rispetto a quelli di età < 5 anni.
Nell’ambito delle manifestazioni cliniche della MIP, la meningite e la polmonite batteriemica risultano le forme maggiormente riportate. Il tasso medio di incidenza della meningite, riportato a livello europeo, risulta pari a 8,71 casi per 100.000 nei bambini di età < 2 anni (IC 95% 7,06-10,76), con un valore più basso segnalato in Spagna, e maggiore, invece, nel Regno Unito [96]. Dal lavoro di O’Brien et al., a livello globale, si stimano al 2000 circa 103.000 casi di meningite pneumococcica nella popolazione di età < 5 anni [27]. Dagli studi inclusi nella revisione sistematica di Ramakrishnan et al. [91] si rileva un rischio di sequele post meningiti nel 16-38% dei bambini africani appartenenti alla fascia 1 mese-15 anni [media del 25%, Range interquartile (IQR) 21-32%], tra cui perdita dell’udito nel 5% dei casi e perdita dell’udito, perdita della vista, ritardo motorio e convulsioni nel 2-7% dei bambini.
Due studi inclusi nella revisione di Ishiwada et al. [92] hanno invece riportato dati riguardanti sequele in pazienti con MIP e polmonite pneumococcica, in particolare disabilità dello sviluppo (1,4%) e perdita bilaterale dell’udito (1,4%) in neonati con un’età media di 14 mesi, e un 21,4% di casi di paralisi tra neonati e bambini con MIP, con un range di età compreso tra 8 mesi-10 anni.
Tra le forme di malattie pneumococciche insorte in bambini < 5 anni di età, Valenzuela et al. [80] riportano un 12% (n = 1,3 milioni di episodi) di casi di OMA, un 40% (n = 270.000 episodi) di polmonite confermata all’imaging e un 6% (n = 59.000 episodi) di forme di consolidamento polmonare rilevate con radiodiagnostica e attribuibili allo S. pneumoniae.
Per quanto concerne la distribuzione sierotipica dello S. pneumoniae e la correlazione con forme severe di MIP, la revisione di Johnson et al. [88] riporta i sette sierotipi 1, 5, 6A, 6B, 14, 19F e 23F come i più comuni a livello globale, e più specificatamente in Africa e in Asia, dove contribuiscono all’insorgenza del 58-66% di casi di MIP nei bambini di età < 5 anni. Tra tutti, il sierotipo 14 è risultato responsabile del 12-29% di MIP in ciascuna regione di ambedue i continenti, mentre, insieme all’1 e al 5, tali sierotipi sono risultati responsabili del 28-43% dei casi totali di MIP [88].
Nel complesso, la distribuzione dei sierotipi e la loro correlazione con forme più o meno gravi di MIP varia a seconda del paese considerato. In India, ad esempio, i sierotipi 14, 1, 19F, 6B, 5, 6A, 9V e 23F sono risultati – in ordine decrescente di frequenza – la causa più frequente di MIP nei bambini di età < 5 anni [94]. Dall’analisi condotta nel setting americano e in alcuni paesi europei, nella revisione a cura di Belsells et al. [89], è emerso invece che i sierotipi 1, 7F e 12F rappresentano i principali responsabili di forme più gravi di MIP in bambini di età < 5 anni.
Dai dati di sorveglianza provenienti da America Latina e Caraibi, invece, i sierotipi maggiormente rilevati sono stati il 14, 1 e 6B [82]. Inoltre, sempre in America Latina, il sierotipo più frequentemente isolato nei bambini con meningite è risultato il 14, seguito dal sierotipo 5 e dal 6B nel 14,2% (IC 95%: 7,7-22,3) dei casi. Per quanto riguarda la batteriemia, il sierotipo maggiormente isolato è risultato invece il 14, seguito dal 6B e dal 19F [81].
In Cina, la revisione di Fu et al. ha stimato tra tutti gli isolati nei casi di MIP con un range di età 0-14 anni una prevalenza maggiore, in ordine decrescente, per i sierotipi 19F, 19A, 14, e 23F [85]. Nella fascia < 5 anni, invece, la prevalenza maggiore è stata attribuita al 19F, seguito dal 19A, dal 14, dal 23F e dal 6B [85].
Valori simili sono riportati nella revisione cinese di Men et al. [86] rilevando più frequentemente, tra i 942 campioni pediatrici di bambini < 14 anni di età, il sierotipo 19A, seguito dai sierotipi 19F, 14, 23F, e 6B. Allo stesso modo, in Tailandia, dagli studi inclusi nella revisione di Hocknell et al. [93] sono emersi, tra bambini < 5 anni di età, il 6B, il 23F e il 14 [93].
Il 50% (9/18) [83-88, 90, 94, 96] delle revisioni incluse in questo lavoro riporta dati riguardanti l’antibiotico-resistenza dello S. pneumoniae in generale o di suoi specifici sierotipi.
Johnson et al. [88] ha riportato che il sierotipo 19A risulta frequentemente associato alla resistenza agli antibiotici, soprattutto in Europa (6%) rispetto agli altri continenti (range: 3-4%).
Nella revisione di Jefferson et al. [96] gli autori hanno riportano un tasso variabile di antibiotico-resistenza a livello europeo, nello specifico alla penicillina, con valori del 49% registrati in Spagna (49%), a differenza di paesi con una politica più restrittiva circa l’uso di antibiotici, come la Danimarca (3,8%) e la Svezia (1,4%), in cui si segnala un’incidenza inferiore.
Nel continente Africano, nell’ambito dei beta-lattamici, Iroh Tam et al. [90] hanno riportato valori di prevalenza relativi alla suscettibilità alla penicillina del 78,1% (IC 95% 61,9, 89,2), mentre, in riferimento all’ampicillina/amoxicillina e alle cefalosporine di terza generazione, sono stati riscontrati valori, rispettivamente, del 94,7 (IC 95% 80,2-99,4) e del 98,5% (IC 95% 95,1-100,0).
Chen et al. [84], tra oltre 90 sierotipi, ne hanno identificati sette tra i più resistenti (6A, 6B, 9V, 14, 19A, 19F, 23F), riportando, nel complesso, una percentuale variabile dal 15 al 30% di S. pneumoniae multi-resistente (cioè resistenti a più di 3 classi di antibiotici) a livello globale.
In Cina, nella revisione di Lyu et al. [87], è stato riportato che i sierotipi 19F, 19A, 23F, 14 e 6B, responsabili sia di forme invasive sia non invasive tra la popolazione pediatrica, presentavano una elevata resistenza agli antibiotici, così come, sempre nella popolazione pediatrica cinese, il lavoro di Fu et al. [85] ha riportato alti tassi di resistenza agli antibiotici, in particolare a eritromicina, clindamicina, tetraciclina e sulfametossazolo, con tassi di resistenza rispettivamente del 94,4 (IC 95%: 90,7-98,1%), 92,3 (IC 95%: 87,4-97,3%), 83,7 (IC 95%: 75,1-92,2%) e 74,4% (IC 95%: 64,5-84,4%).
Allo stesso modo, nei sierotipi 19F, 19A, 14, 6B e 23F, rilevati nella revisione cinese di Men et al., è stata dimostrata un’alta frequenza di resistenza alla cefuroxima, al cefacloro e all’eritromicina [86].
Nel lavoro indiano di Singh et al. [94], invece, è stata descritta una resistenza pneumococcica al trimetoprim/sulfametossazolo, all’eritromicina, alla penicillina, al cloramfenicolo, alla levofloxacina e al cefotaxime, rispettivamente, nell’81, 37, 10, 8, 6 e 4% e riguardante i sierotipi più frequentemente isolati (14, 1, 19F, 6B, 5, 6A, 9V e 23F) nei bambini di età < 5 anni.
Infine, da una revisione condotta specificatamente su dati riguardanti isolati pneumococcici corrispondenti al sierotipo 19A, è stata riscontrata una elevata resistenza alla penicillina nel 53,7% (22/41) nei casi di meningite analizzati, mentre un 10,8% (17/158) e un 3,2% (5/158) di sierotipi 19A, provenienti da isolati di soggetti con manifestazioni cliniche diverse dalla meningite, sono stati classificati, rispettivamente, come sierotipi a intermedia e alta resistenza [83].
Solo due studi inclusi nella revisione (11,1%) [81, 82] riportano dati riguardanti ospedalizzazioni correlate alle infezioni da S. pneumoniae e alcuni dettagli anche sui costi sanitari a esse correlati che non saranno però riportati in questo paragrafo.
In America Latina, Ciapponi et al. [81] hanno descritto una degenza media per i casi di meningite pediatrica, nella fascia < 5 anni, di circa 15 giorni (IC 95% 12,6-17,5).
Sempre in America Latina, Bardach et al. [82] hanno stimato una durata media di degenza ospedaliera per casi di polmoniti da pneumococco di circa 10 giorni (IC 95% 7,7-12,3) e un numero medio di visite mediche di 2,8 per caso.
Per quanto riguarda la mortalità correlata alle infezioni da pneumococco, è stato invece possibile estrapolare dati utili da 8 (44%) [27, 80-82, 84, 88, 91, 92] revisioni sistematiche incluse.
Una revisione sistematica condotta a livello internazionale da O’ Brien et al. [27] ha attribuito alla malattia pneumococcica circa 826.000 decessi (582.000-926.000) nei bambini di età compresa tra 1 e 59 mesi, di cui 91.000 (63.000-102.000) in bambini HIV-positivi e 735.000 (519.000-825.000) in bambini HIV-negativi. Inoltre, tra i decessi in bambini HIV-negativi, oltre il 61% (449.000 [316.000-501.000]) si è verificato in dieci paesi africani e asiatici, identificando il più alto tasso di mortalità da pneumococco in Africa sub-Sahariana e in Asia del sud.
In America Latina, Valenzuela et al. [80] hanno descritto, ogni anno, un numero di decessi dovuti allo pneumococco in bambini < 5 anni che oscilla tra le 12.000 e le 28.000 morti, con un tasso di letalità del 37% per i casi di meningite e del 35% per le sepsi. Bardach et al. [82], nelle stesse regioni, hanno riportato una mortalità dovuta a polmonite variabile da 0,4 a 5,7/100.000 nei bambini tra 0-59 mesi, con una mortalità complessiva di 2,9/100.000 bambini (IC 95%, 0,3-8,2).
Sempre in America Latina e Caraibi, nell’arco temporale 2000-2010, è stata invece calcolata una mortalità da meningite e da sepsi pneumococcica, nei bambini tra 0-59 mesi, rispettivamente, dell’1,8-14,9 (IC 95% 0,0-21,0) e dello 0,5 (IC 95% 0,3-0,6) per 100.000 bambini [81].
In Africa, tra casi di polmonite batterica in pazienti pediatrici ospedalizzati, i più alti tassi di letalità sono stati osservati per gli episodi di meningite pneumococcica (mediana = 35%), rispetto ai casi dovuti a meningite da H. influenzae di tipo b (mediana = 25%), e a quelli dovuti a meningite meningococcica (mediana = 4%). Invece, dati sulla mortalità post-dimissione sono stati riportati in cinque studi, inclusi in questa revisione, e variavano dallo 0 al 18% (mediana 10%) [91].
In Cina, per quanto riguarda i decessi attribuibili ai sette specifici sierotipi maggiormente responsabili di forme invasive di malattia (sierotipi 1, 5, 6A, 6B, 14, 19F e 23F), questi sono stati calcolati intorno a 500.000 nei bambini di età < 5 anni [84].
In Giappone, invece, il tasso di mortalità variava a seconda della dimensione dello studio e della fascia di età considerata nei lavori inclusi nella revisione sistematica di Ishiwada et al. [92], la maggior parte dei quali si riferiva alla popolazione giovane-adulta. Gli autori riportano che su 19 bambini con MIP (età mediana: 2 anni), solo uno è andato incontro a decesso (5,3%).
Infine, nella revisione di Johnson et al. [88], condotta su dati globali, viene riportato che i sierotipi 1, 5, 6A, 6B, 14, 19F e 23F si correlano a circa 9 milioni di casi e 500.000 decessi dovuti alla malattia pneumococcica nei bambini < 5 anni di età.
Per il focus su questo aspetto, si è proceduto a una sistematizzazione delle evidenze scientifiche reperite tramite la revisione sistematica di letteratura. Da un totale di 1002 articoli, risultanti dalla ricerca di letteratura, dopo la rimozione dei duplicati e una prima selezione per titolo e abstract, sono stati valutati 91 full-text. Gli articoli sono stati inoltre sottoposti a un processo di snowballing, portando all’inclusione finale di 19 studi primari. Maggiori dettagli sul processo di selezione degli studi sono schematizzati in Appendice 1, Figura 3.
Tra questi studi, tre (15,7%) sono stati condotti nella Regione Toscana [50, 54, 64], uno (5,3%) in Campania [98], due (10,5%) in Lombardia [73, 98], uno (5,3%) in Veneto [104], uno (5,3%) in Friuli-Venezia Giulia [51], uno (5,3%) nelle Regioni Piemonte e Puglia [62], uno (5,3%) in Liguria [106] e, infine, nove (47,3%) in più centri dislocati a livello nazionale [55, 66, 70, 77, 99, 100-104] (Appendice 2, Tab. III).
Si riporta, di seguito, la descrizione di quanto emerso dalle evidenze scientifiche italiane disponibili. I risultati, come per quelli del setting internazionale, sono stati suddivisi in specifici paragrafi riguardanti, rispettivamente, il burden clinico delle principali complicanze correlate allo S. pneumoniae e la sua distribuzione sierotipica, l’insorgenza di antibiotico-resistenza e, infine, ospedalizzazioni e mortalità correlate alle infezioni pneumococciche.
Il 79% (15/19) [50, 54, 55, 62, 64, 66, 70, 73, 77, 97-101, 103] degli studi inclusi nella revisione di letteratura riporta dati riferiti al burden clinico delle complicanze causate da S. pneumoniae, correlando, nella quasi totalità dei lavori, specifici sierotipi pneumococcici con particolari manifestazioni cliniche di MIP (Appendice 2, Tab. IV).
Lo studio retrospettivo toscano di Montagnani et al. [50], analizzando dati raccolti in un arco temporale di 15 anni, dal 1992 al 2006, e riguardanti 640 pazienti di età compresa tra 0 mesi - 15 anni ricoverati in ospedale a Siena con una coltura positiva per S. pneumoniae, ha rilevato un 3,2% (n = 21) di casi di MIP. Nell’ambito delle manifestazioni cliniche delle forme invasive, gli autori hanno descritto 13 casi (62%) di polmoniti batteriemiche con o senza pleurite, cinque (24%) di sepsi e tre (14%) di meningiti. In riferimento alla distribuzione sierotipica, inoltre, tra i sierotipi maggiormente rilevati, gli autori hanno riportato l’1 (38%), sempre associato a condizioni di polmoniti, il sierotipo 4 (4,7%) e il sierotipo 7F (9,5%), in aggiunta ad altri sottotipi, tra cui 5, 6A, 12F, 14, 18C, 19A/F, 23F, 24F e 34 [50].
In modo simile al precedente, lo studio di Azzari et al., del 2008, [64] ha descritto, attraverso uno studio prospettico osservazionale condotto dal 2005 al 2006, su un campione di popolazione pediatrica di età compresa tra 0 mesi e 14 anni, la correlazione tra i principali sierotipi di S. pneumoniae e l’insorgenza di specifiche manifestazioni cliniche di MIP, rilevando un’associazione tra i sierotipi 4, 6A/B, 23F, 9V/A e casi di meningite e sepsi; una correlazione tra i sierotipi 1, 3, 4, 6A/B, 8, 12, 14, 18, 18C, 19F/A e lo sviluppo di polmonite; infine, il sierotipo 22F è stato correlato con l’insorgenza di artrite [64].
Sempre in Toscana, lo studio condotto da Bonsignori et al. [54] ha rilevato, tra il 1999 e il 2009, su un totale di 5450 bambini di età compresa tra 1 mese e 18 anni, affetti da una polmonite acquisita in comunità, un 39,48% di casi da S. pneumoniae.
L’unico studio condotto nella Regione Campania da Pagliano et al. [97], analizzando dati clinici, dal 1997 al 2005, di bambini di età 1 mese - 14 anni con diagnosi di meningite pneumococcica, ha invece correlato specifiche manifestazioni neurologiche, verificatesi nel 22% dei casi, a specifici sierotipi dello pneumococco. In particolare, gli autori hanno sottolineato la correlazione tra sierotipo 3 e idrocefalo; tra 6B e 19F e perdita di udito; tra 19A, 23A, 9N e 14 ed emiparesi, e, tra questi, 9N e14 e perdita di udito; tra 9V e decessi ed emiparesi; infine, tra 18C e 23 F e deterioramento cognitivo.
In Regione Lombardia, Riva et al. [73] hanno descritto 15 casi confermati di MIP su un totale di 135 bambini reclutati. Di questi 8 bambini (53,3%) presentavano polmonite, 4 (26,7%) batteriemia, 2 (13,3%) sepsi e uno (6,7%) meningite. Per quanto riguarda la distribuzione sierotipica nei casi confermati, il 19A è risultato il sierotipo più rilevato (23,1%). Nei neonati non sono stati riscontrati i sierotipi 1 e 19 F; questi sierotipi, invece, hanno rappresentato, nei bambini di età compresa tra 2-4 anni, in aggiunta al 19A e al 7F, gli agenti patogeni responsabili del 100% delle complicanze. In particolare, i sierotipi 1, 14, 7F e 19F si sono dimostrati causa di polmonite, i sierotipi 19A e 19F di batteriemia e i sierotipi 12B e 23F sono stati associati a quadri di sepsi. Per il sierotipo 15C, infine, è stata riscontrata un’associazione eziologica con casi di meningite.
Sempre in Lombardia (Milano), invece, nel 2002, Esposito et al. [98], su un campione di 196 bambini tra i 2-5 anni, hanno descritto le caratteristiche delle polmoniti acquisite in comunità associate all’infezione da S. pneumoniae confrontandole con quelle associate a infezione batterica atipica e con forme miste S. pneumoniae - infezione atipica. Le infezioni da S. pneumoniae sono state diagnosticate in 48 pazienti (24,5%) e sono risultate associate a evidenti segni radiologici di polmonite; le infezioni batteriche atipiche in 46 bambini (23,5%) e le infezioni miste in 16 (8,2%). Tra i sierotipi maggiormente rilevati, sono stati riscontrati l’1 (30,0%), il 14 (27,5%), il 9V (10,0%), il 4 e il 18C (7,5%), i 6B, 19F e 23F (5,0%) e il 5 (2,5%). Gli stessi sierotipi sono stati riscontrati anche nella popolazione pediatrica < 5 anni analizzata da Pantosti et al. (2000) [66], rilevando, tra i più frequenti, il 14 (28%), il 6B (20%) e il 23F (16%). Sempre Pantosti et. in un altro studio del 2003 [103] hanno riportato le percentuali dei sierotipi associati a casi di MIP confermate su un totale di 503 bambini di età compresa tra i 0 e i 15 anni di età. Nello specifico, gli autori hanno documentato i seguenti sierotipi: 14 (33,3%), 6A (3,9%), 6B (13,7%), 23F (13,7%), 19A (5,9%), 19F (3,9%), 1 (7,9%), 4 (5,9%), 7F (5,9%), 3 (2,0%), 5 (2,0%), 18C (2,0%).
Nello studio di Camilli et al. [70], invece, attraverso uno studio osservazionale condotto dal 2008 al 2014 in cinque regioni italiane (Emilia-Romagna, Lombardia, PA di Bolzano, Piemonte e PA di Trento), è stata analizzata l’evoluzione epidemiologica delle MIP e delle complicanze correlate alle infezioni anche alla luce dei diversi vaccini anti-pneumococcici disponibili. Lo studio ha dimostrato che il 28% dei casi di MIP si è manifestato con forme di meningiti pneumococciche, principalmente nel gruppo di età < 1 anno, sebbene esse si siano ridotte del 54% negli anni considerati. Per quanto concerne la sierotipizzazione, invece, in seguito all’introduzione del vaccino PCV13 nel 2010-2011, si è progressivamente assistito a un declino del sierotipo 19A e a un incremento dei sierotipi 3 e 7F. Infine, nel periodo 2012-2014 si è riscontrato un graduale declino dei sierotipi contenuti nel PCV13 a fronte di un aumento di 10A, 12F, 23B, 24F, 25A e 33F, che hanno rappresentato il 33% di tutti gli isolati [70] e sono stati responsabili del 69% dei casi di MIP nei bambini.
Nel 2010, Resti et al. [55], hanno esaminato i dati provenienti da 83 ospedali di 19 Regioni Italiane, dal 2007 al 2009, e riguardanti la popolazione pediatrica di età tra 0-16 anni con diagnosi di polmonite acquisita in comunità. Tra i 753 casi analizzati, il 21,5% (n = 162) è stato attribuito a S. pneumoniae e, tra questi, il 93,8% ha mostrato segni di versamento parapneumonico, il 31,5% versamento parapneumonico ed empiema, il 4,9% polmonite necrotizzante e, infine, il 4,9% atelettasie. Analizzando le associazioni con i sierotipi, il sierotipo 1, più frequentemente rilevato (42,6%), è stato riscontrato nel 50% dei casi di bambini di età > 2 anni. Più omogenea è stata invece la distribuzione sierotipica nei bambini < 2 anni, con una frequenza variabile dal 5,3% per i sierotipi 4, 5 e 18 al 15,8% per il 19A e 19F.
Risultati simili sono stati riportati anche da Esposito et al. [99], in uno studio del 2012, effettuato nel periodo 2008-2011 in diverse città italiane (Milano, Novara, Genova, Roma e Padova) su un campione di 510 bambini di età 1 mese-5 anni. Gli autori hanno riportato 73 casi (14,3%) di polmonite pneumococcica acquisita in comunità e complicata, con una percentuale simile tra i bambini di età inferiore o maggiore ai 2 anni. L’empiema è risultata la complicanza principale mentre, tra i sierotipi, il 19A è stato quello maggiormente rilevato (33,3%), seguito dal sierotipo 3 (11,1%) e dal 4, 1 e 7F (5,6%).
Il lavoro di Azzari et al. [77] sulla base dei dati provenienti da un programma di sorveglianza attiva su 19 Regioni Italiane, raccolti negli anni 2008-2011, si è invece proposto di rilevare i principali sierotipi responsabili dei casi segnalati di meningiti/sepsi (n = 49) e polmoniti batteriemiche (n = 10) in una popolazione pediatrica tra i 0-16 anni di età. L’analisi condotta ha evidenziato una correlazione significativa per alcuni sierotipi con specifiche manifestazioni cliniche. In particolare, il sierotipo 1 (29,9%) e il 19A (13,2%) sono stati correlati alla polmonite; il sierotipo 3 (16,0%) alla polmonite e alla meningite; il 7F (8,3%) e il 6A (3,5%) solo alla meningite.
Qualche anno dopo, nel 2015, un altro lavoro di Azzari et al. [100] ha riesaminato tale correlazione in uno studio prospettico multicentrico della durata di un anno (2008-2009), condotto in otto regioni italiane (Liguria, Puglia, Campania, Lazio, Toscana, Friuli-Venezia Giulia, Marche e Piemonte) su una popolazione pediatrica di età compresa tra 0 mesi e 4 anni. Dai risultati, in linea con quelli dello studio precedente, è emersa la correlazione dei sierotipi 1, 3, 14 e 18 con l’insorgenza di polmonite; l’associazione dei sierotipi 3 e 5 con la comparsa di polmonite con versamento pleurico; il 6A e il 19F sono stati associati a otite media; il 7F/A è stato correlato con versamento pleurico e meningite; il 19A, infine, così come il sierotipo 23F, oltre alla polmonite e al versamento pleurico, sono stati associati all’insorgenza di meningite [100].
In un altro studio di D’Ancona et al. [62], condotto sui dati microbiologici di 48 laboratori del Piemonte e 53 laboratori pugliesi, sono stati diagnosticati, tra il 2001 e il 2002, 17 casi confermati di MIP in bambini di età compresa tra i 0 e i 4 anni di età. Tra questi le principali forme cliniche erano rappresentate dalle meningiti (nel 58,8% dei casi), da polmoniti (11,8% dei casi) e da setticemie (11,8% dei casi). I sierotipi maggiormente riscontrati in questa fascia di età erano il 14, 3, 4, 6B, 7F, 18C, 19A e 31.
Infine, lo studio più recente di Lodi et al. [101] del 2019, basato sui dati del Registro Nazionale di Sorveglianza Molecolare, raccolti dal 2006 al 2018, ha correlato il sierotipo 3 con casi di MIP verificatisi in bambini di età tra 0-8 anni ricoverati negli ospedali italiani con una riduzione del 92% dei casi di sepsi e meningite da sierotipo 3 dalla fase pre-PCV13 a quella post-PCV13.
Il 42% (8/19) degli studi selezionati [50, 62, 66, 70, 73, 97, 102, 103] si è focalizzato sul fenomeno dell’antibiotico-resistenza.
Nello studio di D’Ancona et al. [62], che confronta i dati della Regione Puglia con quelli rilevati in Piemonte, gli autori hanno riportato una resistenza alla penicillina e all’eritromicina, rispettivamente, di circa il 5 e 31% in Piemonte e del 7 e del 20% in Puglia.
Percentuali diverse sono state presentate dal lavoro di Montagnani et al. [50], che in un arco temporale di 15 anni, ha rilevato un 10,2% di isolati resistenti alla penicillina, un 35,15% resistente all’eritromicina e la presenza di multiresistenza, invece, nell’8% dei campioni analizzati e appartenenti a una popolazione di età compresa tra 0-15 anni. Per le stesse molecole antimicrobiche, in particolare per penicillina, cefotaxime ed eritromicina, anche lo studio di Pagliano et al. ha rilevato livelli variabili di resistenza tra i ceppi analizzati [97].
I rimanenti cinque studi, invece, hanno riportato dati più specifici sulle resistenze riscontrate per i singoli sierotipi. Tra questi, quello di Marchese et al. [102] del 2000, mediante uno studio osservazionale condotto in 19 Regioni Italiane per quattro anni (1994-1998), su una popolazione pediatrica di età compresa tra 0-5 anni, ha riportato una resistenza specifica alla penicillina per i sierotipi 9V, 19F e 23F e all’eritromicina per i sierotipi 6B, 19A, 14, 19F, 15A/B e 23F.
Nello stesso anno, nello studio di Pantosti et al. [66], sono stati descritti risultati simili, evidenziando una resistenza alla penicillina per il sierotipo 9V, all’eritromicina per i sierotipi 14 e 6, e, solo per quest’ultimo, anche al cloramfenicolo e alla tetraciclina. Successivamente, sempre Pantosti et al. [103], nel 2003, hanno riscontrato una resistenza alla penicillina per il sierotipo 9 nel 30% dei casi, per il sierotipo 19 nel 31% dei casi e per i sierotipi non inclusi nei vaccini 24 e 35 nel 38 e nel 57% rispettivamente. Al contrario, la resistenza all’eritromicina è stata riscontrata nei sierotipi 14 (83%), 19 (63%) e 6 (44%), mentre 11 diversi sierogruppi sono stati classificati come ceppi multi-resistenti, rappresentati principalmente dal 6 (26,2%) e dal 19 (28,6%) [103].
Anche il lavoro di Riva et al. [73], in Lombardia, ha individuato, come gli autori precedenti, una resistenza all’eritromicina per i sierotipi 14, 19A e 19F e, per quest’ultimo, anche alla tetraciclina.
Infine, nel periodo 2008-2014, Camilli et al. [70], hanno evidenziato una resistenza generale alla penicillina del 21% nei casi di MIP e del 17% nei casi di meningite pneumococcica e, più nello specifico, del 57,1% per il sierotipo 14 e per i sierotipi 15A, 23B, 24F e 19A, appartenenti ai Non-Vaccine Serotype (NVS). Nel primo anno di studio, la resistenza all’eritromicina si è attestata intorno al 38% per i sierotipi contenuti nel vaccino PCV13, riducendosi al 27%, nel 2014, per i sierotipi 19A, 15A e 24F e per quelli NVS. Al contrario, nel periodo oggetto di studio, è stato registrato un aumento per la resistenza alla tetraciclina, passando dal 22 al 27% [70].
Il 42% (8/19) degli studi inclusi [50, 51, 54, 62, 97, 98, 104, 105] ha esaminato, invece, il tasso di ospedalizzazione o di mortalità conseguente all’infezione da S. pneumoniae.
Tra gli studi inclusi, due sono stati pubblicati da Baldo et al. [51, 104]. Nel primo, del 2014, basato su dati provenienti dal sistema di sorveglianza nazionale e condotto, per nove anni, in Veneto, è stato registrato un calo significativo di ospedalizzazioni tra i bambini di età compresa tra 0-4 anni con polmoniti complicate, passando da 617,3/100.000 nel 2004 a 451,8/100.000 nel 2012 (Average Annual Percent Changes, AAPC: -2,5%; [IC 95%: -4,5; -0,5]), con una durata di degenza ospedaliera di 4,7 ± 3,6 giorni nella fascia 0-4 anni e di 5,1 ± 3,7 giorni nel gruppo 5-14 anni [104].
Due anni dopo, invece, il secondo studio [51] ha analizzato 125.722 ricoveri per polmonite in pazienti di tutte le età, registrati, dal 2004 al 2013 in Veneto e nel Friuli-Venezia Giulia. Dei 125.722 ricoveri inclusi nell’analisi, il 6,8% (8.510 ricoveri) ha riguardato bambini sotto i cinque anni di età e il 75,3% (94.715 ricoveri) ha riguardato adulti over 65. Il tasso medio annuo di ospedalizzazione associato alla polmonite pneumococcica era, nei bambini da 0 a 4 anni, pari a 325,6 per 100.000 nei maschi e 288,9 per 100.000 nelle femmine. Su un totale di 8.510 ricoveri in bambini di 0-4 anni, 659 erano correlati a polmoniti da S. pneumoniae, mentre su 3.924 ricoveri in bambini di 5-14 anni, erano 371 i casi confermati di polmonite pneumococcica.
La degenza ospedaliera media era di 4,7 ± 3,9 giorni e di 4,9 ± 3,7 giorni per i bambini di età compresa tra i 0-4 anni e i 5-14 anni, rispettivamente.
Qualche anno prima, in riferimento alla polmonite pneumococcica complicata, lo studio condotto a Milano da Esposito et al. [98] nel 2002, ha indicato, su un campione di 196 bambini di età compresa tra i 2 e i 5 anni di età, una durata di degenza ospedaliera pari a 6,857 ± 3,523 giorni.
In Toscana, invece, Bonsignori et al. [54] hanno rilevato un diverso tasso annuo di ospedalizzazione, correlata alle polmoniti, nelle tre fasce di età considerate: del 28,04 (IC 95%: 26,42-31,23) per 100.000 bambini nel gruppo 0-5 anni; del 10,6 (IC 95%: 8.48-11.64) per 100.000 bambini nella fascia 6-12 anni e dello 0,98 per 100.000 bambini nella fascia di età 13-18 anni. Analizzando ancor più nello specifico le singole fasce d’età considerate, inoltre, è emerso che il numero di ospedalizzazioni per polmonite pneumococcica, tra tutti i casi di polmoniti comunitarie ricoverate, è aumentato dal 5,14% del 2001 al 23,5% nel 2006 nel gruppo < 5 anni di età; dall’1,7 al 4,72% tra il 2001 e il 2006 nel gruppo 6-12 anni e dallo 0,34% del 2001 all’1,32% nel 2008 nella fascia over 13 anni.
In un altro recente studio del 2022, Astengo et al. [105] hanno indagato l’incidenza delle ospedalizzazioni e degli accessi in pronto soccorso (PS) per polmoniti pneumococciche, tra il 2012 e il 2018, a seguito dell’introduzione, in Liguria, dei vaccini pneumococcici coniugati (PCV). Dall’analisi condotta è emerso che nei bambini di età < 15 anni, i ricoveri per polmonite da S. pneumoniae, sono diminuiti da 35 a 13 per 100.000 anni-persona durante il periodo di studio (p < 0,001); questa diminuzione è stata potenzialmente correlata all’uso di PCV nei bambini. I ricoveri per polmonite da tutte le cause sono rimasti stabili, sono diminuiti i ricoveri per OMA mentre sono aumentati i ricoveri per MIP. Nonostante la vaccinazione, dunque, in Liguria è risultato persistere un onere sostanziale per malattia pneumococcica nei bambini.
Per quanto riguarda la mortalità, i dati riscontrati in letteratura sono molto esigui. Montagnani et al. [50], in una popolazione di 640 bambini toscani, sottoposti a coltura per S. pneumoniae, hanno riportato 21 MIP, di cui 13 (62%) erano polmoniti batteriemiche con o senza pleurite, cinque (24%) erano sepsi e tre (14%) erano meningiti. Il tasso di mortalità per MIP è stato del 4,8%: un solo paziente (affetto da meningite) è morto.
Lo studio di Pagliano et al. [97], condotto in Campania, ha analizzato, invece, dati clinici, dal 1997 al 2005, di bambini di età compresa tra 1 mese e 14 anni con diagnosi di meningite pneumococcica, riportando due decessi associati al sierotipo 9V. D’Ancona et al. [62], infine, hanno riportato un tasso di letalità pediatrica pari all’8% nella popolazione < 2 anni, rilevando un solo caso di morte nel campione arruolato.
La ricerca di dati di letteratura internazionale ha portato alla selezione finale di una sola revisione sistematica [106] inerente all’impatto economico delle infezioni da S. pneumoniae (Appendice 1, Fig. 4).
Il lavoro di Shiri et al. del 2019 [106] ha incluso e selezionato 383 studi in totale e di questi sono stati analizzati solo quelli riguardanti i costi dovuti alle malattie infettive causate da S. pneumoniae nei bambini.
Le categorie di costi riportate in questa revisione sono relative a farmaci, ospedalizzazione, costi domestici e dei datori di lavoro. Sono state prese in considerazione diverse prospettive come quella della società, dell’assistenza sanitaria e del paziente/famiglia. La maggior parte degli studi faceva riferimento ai costi in paesi ad alto reddito come gli Stati Uniti e dell’Europa; solo alcuni studi provenivano da paesi dell’Africa sub-sahariana e da paesi asiatici. Di seguito si riportano i principali risultati riguardanti il burden economico per tipo di malattia pneumococcica individuati dagli studi selezionati da Shiri et al. con un focus particolare sullo scenario europeo.
I costi dell’OMA infantile sono stati riportati per diversi paesi. Un panorama del contesto europeo è stato fornito dallo studio di Wolleswinkel-van den Bosch et al. (2010) [107]. L’obiettivo dello studio è stato quello di stimare l’uso delle risorse mediche, dei costi diretti, delle perdite di produttività (costi indiretti) per episodi di OMA in bambini d’età inferiore ai 5 anni. I dati sono stati raccolti grazie a un questionario online somministrato ai genitori dei bambini dei seguenti Paesi: Belgio (Fiandre), Francia, Germania, Italia, Paesi Bassi, Spagna e Regno Unito. I costi medici diretti includevano le spese relative alle visite mediche (assistenza primaria, comprese consultazioni telefoniche, visite domiciliari e ambulatoriali), visite al pronto soccorso, ricoveri e pagamenti diretti per farmaci da prescrizione e da banco; i costi per esami diagnostici e chirurgici non sono stati invece inclusi. Le spese non mediche dirette includevano i costi di viaggio (basati sui chilometri percorsi) e i costi di parcheggio, tariffe per trasporti pubblici e taxi utilizzati per recarsi alle visite mediche o farmacie, dichiarati dai genitori. Per le spese mediche dirette, sono state consultate fonti nazionali ufficiali per ottenere costi unitari.
I costi per i farmaci sono stati ricavati direttamente dal questionario secondo una stima delle risposte. Il costo per le ospedalizzazioni per tutti i Paesi inclusi nel sondaggio si sono basati sul DRG o sul costo per giorno di ospedalizzazione per disturbi del tratto respiratorio superiore e OMA.
Tutte le spese mediche dirette sono state calcolate in Euro del 2007. Per i costi indiretti associati all’assenza dal lavoro retribuito, i costi medi della retribuzione oraria per l’anno 2006 sono stati ricavati dalle statistiche nazionali sul lavoro. I prezzi dei costi del Regno Unito (in sterline) sono stati convertiti in euro, utilizzando un tasso di cambio di £ 1 = € 1,48 (12 giugno 2007).
I costi sanitari diretti variavano da € 62,96 nei Paesi Bassi a € 214,91 in Spagna e comprendevano principalmente i costi di ospedalizzazione e le visite dal medico di famiglia o pediatra. Le spese per il Belgio (Fiandre) e i Paesi Bassi erano più basse rispetto alla maggior parte dei Paesi perché l’uso di farmaci con prescrizione non è stato registrato come altre informazioni sulle visite mediche.
Invece i costi sanitari diretti per Francia, Germania, Italia, Spagna e Regno Unito erano principalmente dovuti ai costi dell’ospedalizzazione e alle visite dal medico di medicina generale (costo per episodio: € 169,82 in Francia; € 107,88 in Germania; € 163,94 in Italia; € 214,91 in Spagna; € 157,35 nel Regno Unito).
I costi indiretti erano associati a una perdita della produttività e variavano da € 267,05 per i Paesi Bassi a € 588,92 in Germania. L’esatta composizione di questi costi variava per Paese, ma la perdita di produttività e l’assenza dal lavoro retribuito hanno contribuito maggiormente, a causa dell’elevata relativa retribuzione oraria. I costi indiretti costituivano il 61-83% dei costi totali relativi a un episodio di OMA.
Complessivamente, considerando gli anni in cui è stato svolto lo studio (2006/2007), il totale dei costi diretti e indiretti per episodio di OMA confermato dal medico, nei bambini di 0-4 anni, è stato per il Belgio di € 428,45, per la Francia di € 440,45, per la Germania di € 705,56, per l’Italia di € 526,46, per la Spagna di € 607,96 e infine per il Regno Unito di € 752,49.
Invece, lo studio di Strens et al. del 2010 [109] ha analizzato il burden economico delle sequele e complicazioni derivanti da episodi di OMA in bambini di età media di 13 anni in Belgio. Per tutto il periodo dello studio è stata calcolata la media (e deviazione standard) del costo annuale per paziente e per gruppo di pazienti. I costi sono stati calcolati sia dal punto di vista del sistema sanitario pubblico che del paziente. I bambini erano stati raggruppati a seconda delle sequele, che comprendevano: ipoacusia neurosensoriale e conduttiva, perforazione della membrana del timpano, otite media suppurativa cronica (CSOM) con colesteatoma, paralisi facciale e complicazioni neurologiche e post-chirurgiche.
Nel complesso, le complicazioni/sequele più comuni per OMA nella popolazione dello studio erano perdita dell’udito, otite media cronica e colesteatoma. Queste manifestazioni si erano verificate attorno al 5°-7° anno dopo il primo evento di OMA risultando in costi considerevoli per la sanità pubblica. In particolare, i costi annuali per paziente andavano da € 119 a € 7.957, con il costo medio più alto dovuto agli impianti cocleari nei pazienti con ipoacusia neurosensoriale. Nei pazienti trattati per perforazione della membrana timpanica e in quelli con complicazioni associate a intervento chirurgico, il costo maggiore era dovuto ai ricoveri; mentre nel gruppo di pazienti con ipoacusia conduttiva, le procedure ambulatoriali e gli apparecchi acustici costituivano la maggioranza dei costi per la sanità pubblica.
Inoltre, per quanto riguarda la prospettiva del paziente, le spese annuali più elevate sono state registrate per i bambini con ipoacusia conduttiva (€ 120) e per i bambini con complicazioni associate a interventi chirurgici per OMA complessa (€ 103) e comprendevano soprattutto i costi per i dispositivi medici, come apparecchi acustici, e quelli per visite mediche specialistiche.
Per quanto riguarda i costi della polmonite infantile, lo studio di Keitel et al. (2014) [109] ha analizzato una popolazione di bambini di età compresa tra 2 mesi e 16 anni in cerca di assistenza per la polmonite acquisita in comunità (CAP) presso l’ospedale universitario di Ginevra da gennaio 2008 a maggio 2010. I costi ospedalieri per gli episodi di polmonite sono stati calcolati secondo il sistema REKOLE® (algoritmo utilizzato dal sistema sanitario) mentre i costi non ospedalieri sono stati stimati tramite interviste ai genitori durante la prima visita e a quella di follow-up dopo 14 giorni. I costi medi per le cure ambulatoriali e ospedaliere erano rispettivamente 618 CHF e 23.481 CHF. Inoltre, i costi sostenuti erano significativamente più alti per i ricoveri ospedalieri che richiedevano interventi chirurgici (non specificati) e terapia intensiva. La maggior parte dei costi di ospedalizzazione era data dall’assistenza infermieristica seguita dalle spese per le cure mediche, spese generali e farmaci. I casi di polmonite severa hanno richiesto in media molte più risorse ospedaliere rispetto ai casi non gravi: 21.842 CHF contro 3.479 CHF (p < 0,0001). Prendendo in considerazione tutte le spese, la stima media complessiva per un episodio di CAP nella coorte di studio era di 11.258 CHF: in particolare 23.872 CHF per gli ospedalizzati e 1.009 CHF per gli ambulatoriali
Un altro studio, condotto retrospettivamente (2008-2011) in Belgio da Rozenbaum et al. (2015) [110] ha valutato i costi dell’ospedalizzazione per CAP stratificando per età e contesto di cura. Nei bambini della fascia d’età 0-9 anni il costo medio per episodio trattato in regime ambulatoriale ospedaliero era di € 482 e € 11.567 per caso trattato parzialmente in ICU (terapia intensiva) mentre il costo totale medio per episodio (comprendente tutti i casi di CAP) era di € 1.508. Invece nei pazienti del gruppo 0-17 anni il costo totale medio per episodio era più alto (€ 1.581), soprattutto per i casi trattati parzialmente in ICU (€ 15.860).
I costi della malattia pneumococcica invasiva infantile sono stati descritti nello studio di Brotons et al. (2013) [111] che mirava a stimare i costi diretti per i casi di MIP ospedalizzati in Spagna. Lo studio prospettico è stato realizzato sui bambini d’età inferiore ai 5 anni ai quali era stata diagnosticata una MIP in ospedale nel periodo 2007-2009 e durante gli anni 2012-2015. In totale sono stati raccolti 319 casi e 154. In totale, rispettivamente, la polmonite rappresentava il costo più alto (65,7 e 62,0%, rispettivamente), seguita dalla meningite (25,8 e 26,1%, rispettivamente).
I costi dei casi di MIP sono stati calcolati tenendo in conto l’uso delle seguenti risorse sanitarie: ospedalizzazione (a seconda se nel reparto per acuti o in ICU), trasferimento inter-ospedaliero, visite mediche di follow-up e trattamenti ambulatoriali con antibiotici. Il costo medio totale per MIP è aumentato nel secondo periodo di osservazione del 31,4% (€ 3.016,1 vs € 3.963,9).
Nel complesso il costo medio di ospedalizzazione per MIP si aggirava sui € 4.533. Nel dettaglio, si andava da € 4.919 con intervento chirurgico (riguardante parete toracica, pleura e polmoni) a € 1.435 senza intervento, con un costo di € 6.488 per i bambini (età media di 3 anni) che necessitavano di terapia intensiva contro € 3.862 per i pazienti curati in reparto per acuti.
Per quanto riguarda il quadro clinico della meningite, nella revisione internazionale di Shiri et al. [106] gli studi europei inerenti sono riferiti a una popolazione adulta (> 18 anni) e quindi non sono stati analizzati perché non rispettavano i criteri di inclusione di questo lavoro. Inoltre, la maggioranza degli articoli fa riferimento al contesto extraeuropeo soprattutto agli Stati Uniti, a Paesi africani e del Sud-est asiatico. Anche nel caso dei quadri clinici di infezioni da S. pneumonie associate a sepsi e batteriemia sono riportati pochi dati e non recenti per i Paesi europei.
La ricerca condotta sui tre database, dopo la rimozione dei duplicati, ha portato a un totale di 410 records. Dopo una prima selezione per titolo e abstract, sono stati analizzati 12 full-text. Sulla base dei criteri di inclusione/esclusione stabiliti, lo screening ha portato all’inclusione finale di cinque studi [104, 107, 112, 113, 114] (Appendice 1, Fig. 5; Appendice 2, Tab. V). I motivi che invece hanno condotto all’esclusione dei sette articoli, in seguito alla lettura del full-text, sono stati principalmente: la mancanza di dati economici di interesse, l’impossibilità di estrapolare i costi per la fascia d’età oggetto di studio e per lo pneumococco tra diverse infezioni.
Lo studio retrospettivo più recente tra i selezionati è stato quello Barbieri et al. del 2022 [112]. Questo studio ha valutato l’onere economico correlato alle infezioni da S. pneumoniae nei bambini di età inferiore ai 15 anni della regione Veneto dopo l’introduzione, nel 2010, del PCV13 nel programma di immunizzazione nazionale. Tra il 2010 e il 2017, le incidenze annuali di polmonite, OMA e MIP sono diminuiti, con conseguente riduzione delle spese regionali per polmonite (da 8,88 a 3,59 milioni di euro), OMA (da 3,78 a 2,76 milioni di euro) e MIP (da 1,40 a 1,00 milione di euro). Tuttavia, nonostante queste riduzioni della spesa regionale a seguito dell’introduzione del PCV13, continua a registrarsi, in Veneto, un onere economico importante associato alle infezioni pneumococciche.
Un altro studio retrospettivo recente è quello di Amicizia et al. del 2022 [113] che prende in esame una popolazione di bambini di età inferiore ai 15 anni, con MIP e OMA, visitati in pronto soccorso e/o ricoverati nel periodo di osservazione da ottobre 2012 a settembre 2018 in Liguria. Rispetto alla popolazione totale inclusa nello studio, sono stati registrati 287 episodi di polmonite pneumococcica, 17.040 episodi di OMA, 629 casi di batteremia causata da S. pneumoniae e 5 episodi di meningite pneumococcica.
Il costo annuo medio totale delle visite in pronto soccorso e dei ricoveri nel periodo di studio è stato di € 3.592.848, con visite in emergenza seguite da ricoveri che rappresentavano il 97% di questi costi; il resto comprendeva visite in pronto soccorso che non hanno portato al ricovero in ospedale. Il costo mediano per episodio era di € 891. Sia il totale annuo degli episodi che i relativi costi sono rimasti stabili tra il 2012 e il 2016, mostrando un calo tra il 2017 e il 2018, in accordo alla tendenza all’aumento delle coperture vaccinali regionali a 24, 36 e 48 mesi. La polmonite (dovuta a tutte le cause) ha rappresentato la maggior parte dei costi di ospedalizzazione (72,7%). Il costo medio annuo delle visite in pronto soccorso e dei ricoveri associati alla polmonite dovuta a tutte le cause è stato di 2,61 milioni di euro. I costi totali annui delle visite in emergenza e dei ricoveri per tutte le cause di polmonite sono variati nel tempo, con un burden però rimasto stabile nel 2018 di € 2.485.962. Invece i costi dovuti alla sola polmonite pneumococcica hanno mostrato un decremento da € 194.813 nel 2012 a € 73.111 nel 2018.
Il numero di casi e i costi di batteriemia pneumococcica hanno raggiunto il picco di 119 casi e € 580.673 nel 2015 per poi scendere rispettivamente a 60 casi e € 342.270 nel 2018. Durante tutto il periodo di studio, sono stati segnalati solo cinque ricoveri attribuibili a meningite pneumococcica verificatasi nel 2012 e nel 2013. La batteriemia e la meningite rappresentavano rispettivamente l’11,3 e lo 0,25% dei costi complessivi di ospedalizzazione. L’OMA rappresentava la maggior parte degli episodi di malattia pneumococcica in generale (61,6%); tuttavia, oltre il 90% degli episodi di OMA non sono stati seguiti da ricovero in ospedale con l’OMA a determinare solo il 9% dei costi ospedalieri. Il numero di episodi all’anno di OMA è stato fluttuante nel periodo analizzato con un numero minimo di 2.252 casi nel 2014 e un numero massimo di 2.593 casi nel 2018, mentre i costi hanno raggiunto il valore più basso pari a € 274.896 nel 2016 e il valore più alto di € 376.694 nel 2013. Il numero medio annuo di prescrizioni nel periodo di studio è stato di 3.469, con un costo medio annuale di € 199.810, che include € 42.320 di antibiotici. Il numero di prescrizioni, i giorni di terapia e i costi delle prescrizioni per gli agenti antimicrobici e antibatterici è rimasto pressoché costante durante lo studio. Analizzando i valori massimi e minimi registrati nel periodo di riferimento, il numero delle prescrizioni è variato da 3.228 nel 2016 a 3.730 nel 2014 e i giorni di terapia da 102.792 nel 2016 a 137.212 nel 2014. I costi per gli antibiotici sono variati da € 67.891 nel 2016 a € 103.372 nel 2015, e per gli agenti antibatterici da € 64.457 nel 2016 a € 92.906 nel 2014. Nel complesso, l’onere economico è rimasto notevole sia per le visite in pronto soccorso che per i ricoveri ospedalieri associati a malattie da pneumococco nei bambini di età inferiore ai 15 anni, nonostante un ben consolidato programma di vaccinazione infantile.
Il secondo lavoro incluso è lo studio di Baldo et al. del 2014 [104], che mirava a stimare i tassi di ricovero per malattia pneumococcica e i relativi costi. Lo studio retrospettivo ha previsto l’analisi delle cartelle cliniche (dal 1/01/2004 al 31/12/2012) dei pazienti dimessi da ospedali pubblici e privati del Veneto e appartenenti a diverse fasce d’età. In particolare, tra i pazienti ospedalizzati, 11.430 erano bambini dai 0 ai 4 anni e 4.765 dai 5 ai 14 anni. I costi trattati nell’articolo erano costi sanitari diretti a carico del SSN.
Della classe di età 0-4 anni (11.430 casi in tutto) il 98,6% dei bambini aveva polmonite, 0,7% setticemia, 0,3% meningite e 0,4% empiema. Il costo di ospedalizzazione per questa categoria, espresso come costo/anno, era di 4,5 milioni di euro. Dei pazienti di 5-14 anni (4.765) il 98,7% aveva polmonite, 0,4% setticemia, 0,2% meningite e 0,6% empiema. Il costo di ospedalizzazione per questa categoria, sempre espresso come costo/anno, era di 1,9 milioni di euro.
I seguenti due studi invece, riportano non solo i costi diretti sanitari ma anche quelli indiretti che riguardano la società. Il lavoro di Wolleswinkel-van den Boscha et al. del 2010 [107] fornisce una stima dell’uso delle risorse mediche, dei costi diretti, delle perdite di produttività e dei costi indiretti per casi di OMA in bambini d’età inferiore ai 5 anni. Lo studio è stato condotto in maniera retrospettiva (dati del 2006-2007) servendosi di un questionario online compilato dalle famiglie dei bambini con precedenti casi di OMA e diffuso in diversi Paesi europei. In Italia, sono stati registrati 2.145 casi e di questi 155 episodi di OMA confermati dal medico. Si riportano di seguito i dettagli dei costi diretti e indiretti per episodio registrati per l’Italia.
I costi medici diretti (€ 163,94 per caso) includevano costi relativi alle visite mediche (consulti telefonici, visite a domicilio e in ambulatorio), visite in pronto soccorso, ricoveri e costi out-of-pocket (a carico del paziente non coperti dal sistema sanitario) per le prescrizioni e i farmaci.
Le spese non mediche dirette (€ 10,87 per caso) includevano: spese per i viaggi (in km), per il parcheggio, per i mezzi pubblici e taxi utilizzati per recarsi alle visite mediche.
Per i costi indiretti (€ 351,65 per caso) associati sia all’assenza da un lavoro retribuito che a un lavoro non retribuito o domestico, sono stati ricavati per la maggior parte dalle statistiche nazionali del lavoro.
Complessivamente quindi, il costo totale per episodio di OMA riportato risultava di € 526,46.
Infine, l’ultimo studio incluso riporta i costi della meningite pneumococcica nella popolazione pediatrica. La ricerca di Lucioni et al. del 2005 [114], condotta in maniera retrospettiva, ha previsto la compilazione di un questionario diretto a tutte le famiglie di bambini per cui era giunta all’Ufficio Profilassi delle malattie infettive della Regione Lombardia la notifica di meningite da pneumococco negli anni 2000 e 2001 (quando quei bambini ricoverati avevano meno di 5 anni).
I casi di meningite erano 20 e di questi tre con sequele, che hanno implicato un ulteriore ospedalizzazione (la quale invece è stata richiesta solo per due casi tra i rimanenti 17).
I costi qui riportati si riferiscono quindi a casi di meningite in età pediatrica notificati nel 2000-2001 e riguardano l’arco di tempo che va dalla notifica al periodo di rilevazione dei questionari (prima metà del 2004). La durata media del follow-up (che a livello di ciascun paziente è stato misurato come tempo intercorrente tra la data della notifica e quella della rilevazione) è risultata pari a 3 anni e 4 mesi.
Includendo il ricovero iniziale, il costo complessivo di un caso di meningite senza sequele (€ 7.610; CI 95%: 6.636-8.585) si compone per il 78,3% di costi diretti a carico del SSN e per il rimanente di costi indiretti dovuti a perdite di produzione per assenze dal lavoro dei familiari impegnati ad assistere il paziente.
La proporzione dei costi diretti sanitari sul totale sale all’87,5% nella meningite con sequele, dove il costo complessivo di un caso con sequele (€ 42.888; CI 95%: 35.874-49.901) risulta essere più di cinque volte quello di un caso senza sequele. Nella media generale, il costo complessivo (sociale) di un caso di meningite (€ 12.903; CI 95%: 7.111-18.693) è costituito per l’82,9% di costi a carico del SSN. Tra questi, sono dominanti quelli per i ricoveri; seguono i costi per la riabilitazione e quelli per la diagnostica. Da notare che, sempre nell’ambito dei costi diretti sanitari, il costo dei ricoveri successivi (€ 3.207) a quello iniziale incide per circa un terzo (30%) sul totale di tali costi (€ 10.692). Complessivamente poca rilevanza sembravano avere gli altri costi diretti, soprattutto per quanto riguarda la voce “varie” (pasti durante l’assistenza, computer, passeggino, cavi, pile ecc.)
Questo studio è arrivato a fornire alcune preziose indicazioni quantitative sulla composizione e il livello del costo di un caso di meningite pneumococcica in soggetti di età inferiore a 5 anni (€ 10.692 per la parte a carico del SSN, € 12.903 come importo complessivo a carico della collettività).
Utilizzando il dato d’incidenza riportato nella premessa dello studio di Lucioni et al. (49 casi all’anno, pari a 1,8/100.000), si può infine, stimare che il costo annuo sostenuto dal SSN italiano per la meningite da pneumococco in età pediatrica sia pari a € 524.000 circa.
S. pneumoniae rappresenta l’agente eziologico più comune delle malattie batteriche invasive, con quadri clinici anche gravi, come meningite e sepsi, o meno gravi, come batteriemie o polmoniti batteriemiche. Tuttavia, più frequentemente, S. pneumoniae si rende responsabile di quadri localizzati, quali polmoniti, infezioni delle prime vie respiratorie e otiti.
La popolazione pediatrica, e più nello specifico la popolazione di età < 2 anni di vita, rappresenta il gruppo a maggior rischio di infezione e, insieme agli anziani, quello con maggiore “burden of disease”. L’introduzione della vaccinazione pediatrica anti-pneumococcica, disponibile a partire dagli anni 2000, ha nel tempo cambiato l’epidemiologia delle MIP, con un carico di malattia oggi attribuibile principalmente ai sierotipi non contenuti nei vaccini coniugati (sostituzione dei sierotipi o serotype replacement). I dati epidemiologici italiani dimostrano come l’incidenza delle MIP sia progressivamente diminuita con l’introduzione della vaccinazione. Prima dell’epoca vaccinale, l’incidenza ha mostrato, nella popolazione al di sotto dei 5 anni, valori variabili da 3,5 a 50 casi circa su 100.000 a seconda delle modalità di rilevazione e dal setting di studio passando poi a raggiungere valori più contenuti tra 1,6 e 3 circa su 100.000 dopo l’introduzione della vaccinazione. Nella fascia di età al di sotto di 1 anno si registrano tuttavia valori più elevati. Infatti, come si evince dal sistema di sorveglianza nazionale l’incidenza media nel periodo 2011-2021 è stata di 4,33 per 100.000 sotto l’anno di vita e di 1,7 su 100.000 tra 1 e 4 anni. Decisamente più bassi sono i valori nelle fasce di età 5-9 anni e 10-14 anni.
Anche i sierotipi responsabili di malattia si sono progressivamente modificati con un aumento delle forme dovute ai sierotipi 3, 8, 12F e 22F e una riduzione di quelle imputabili ai sierotipi 1, 19A e 6A. I sierotipi maggiormente riscontrati nel periodo 2011-2021 risultano, stando sempre al report del sistema di sorveglianza nazionale, l’1, il 3, il 14, il 19A, il 19F, il 22F e il 33F. La revisione di letteratura ha inoltre messo in evidenza come in Italia i sierotipi 1, 14, 9V, 3 e 19A siano maggiormente coinvolti nei casi di polmoniti complicate, mentre il 3, il 19 A, il 23F e il 6B siano più frequentemente associati a manifestazioni meningitiche.
Le MIP possono determinare lo sviluppo di una serie di complicanze tra le quali, le più temibili, sono quelle neurologiche successive all’interessamento del sistema nervoso centrale che possono riguardare fino a un quinto circa dei soggetti affetti. Tra le altre forme di sequele, la letteratura scientifica riporta anche paralisi (~ 21,4%), perdita dell’udito, talvolta bilaterale (1,4-5%) e disabilità dello sviluppo con ritardi motori (1,4-7%).
Non va, inoltre, dimenticata la letalità delle MIP che dagli studi italiani risulta variabile dal 3 all’8%.
Accanto alle forme invasive non vanno dimenticate le forme non invasive di malattia pneumococcica, in particolare le polmoniti e, in epoca pediatrica, le otiti. Di queste forme i dati di cui disponiamo provengono da studi primari che, per quanto riguarda le polmoniti, hanno rilasciato stime dei tassi di ospedalizzazione variabili a seconda del periodo e della popolazione in studio ma compresi tra 13 e 45 su 100.000 nella fascia di età 0-5 anni e più bassi nelle età successive. Gli studi sulle otiti si sono invece spesso concentrati sui casi non eziologicamente confermati e hanno rilasciato stime anch’esse variabili ma nell’ordine di grandezza di poco meno di 200 casi ogni 1.000 bambini al di sotto dei 5 anni.
Oltre ai dati descritti, il crescente problema della multiantibiotico-resistenza giustifica ulteriormente l’interesse nei confronti della prevenzione di tali infezioni. Nell’ambito degli studi presi in considerazione per redigere questo capitolo, i saggi di sensibilità effettuati sui ceppi isolati di pneumococco hanno rilevato una resistenza generale alla penicillina variabile dal 32,1 al 78,8%, con valori elevati soprattutto in Africa, e riguardanti maggiormente i 7 sierotipi responsabili, a livello globale, delle forme più gravi di malattia (6A, 6B, 9V, 14, 19A, 19F, 23F). Gli stessi sierotipi sono risultati resistenti anche ad altre molecole, quali eritromicina (37-94,4%) e, in percentuale minore ma variabile, cloramfenicolo, levofloxacina e cefotaxime, soprattutto nelle classi di età < 5 anni. Risultati simili sono stati riscontrati anche nel contesto italiano, riportando una resistenza alla penicillina compresa tra il 5-57,1%, soprattutto per i sierotipi 9V, 19F e 23F. Valori maggiori sono stati invece riscontrati in merito alla resistenza ai macrolidi, in particolare all’eritromicina, con un range variabile tra il 20-83%, soprattutto a carico dei sierotipi 6B, 19A, 14, 19F, 15A/B e 23F.
Oltre a determinare un rilevante burden clinico le malattie pneumococciche sono anche responsabili di un burden economico dovuto tanto all’assorbimento di risorse sanitarie che alla generazione di costi indiretti. I dati di letteratura indicano complessivamente una durata media di degenza ospedaliera di 5 giorni, sia per i casi di polmonite complicata sia per i casi di meningite pneumococcica, e un tasso di ospedalizzazione maggiore nella fascia 0-4 anni, principalmente dovuto a polmoniti complicate.
Il costo totale annuo per i ricoveri per malattia pneumococcica nella popolazione di 0-4 anni risulta da uno studio italiano di € 4,5 milioni. Va tuttavia ricordato che, specie nei casi complicati, si generano importanti costi indiretti. Un altro studio italiano ha infatti stimato che il costo di un caso di meningite pneumococcica è di € 10.692 per la parte a carico del SSN e di € 12.903 per la società. Anche le otiti medie acute generano un costo di circa € 500 a episodio.
Dalle evidenze scientifiche consultate e dai dati esaminati in questo capitolo emerge quindi un burden of disease considerevole. A oggi, l’infezione pneumococcica può essere prevenuta tramite la vaccinazione, già dai primi anni di vita. Il raggiungimento di elevate coperture vaccinali consente, infatti, il contenimento della circolazione del microrganismo, garantendo, contestualmente, una protezione indiretta anche ai non vaccinati e a tutta la comunità, in particolare agli anziani che, insieme ai bambini, risultano i più colpiti e interessati dal maggior burden.
Come raccomandato anche dall’OMS, risulta importante l’implementazione di attività di sorveglianza attiva e la successiva condivisione, a livello internazionale e nazionale, dei dati [115]. Tuttavia, la diversa partecipazione delle Regioni italiane alle attività di sorveglianza rende ancora difficile, al momento, definire con esattezza i ceppi batterici responsabili delle infezioni, l’esatta quota di casi prevenibili con le vaccinazioni e l’eventuale aumento di sierotipi non presenti nei vaccini attualmente disponibili.
A tal proposito, dunque, risulta cruciale il potenziamento di tali sistemi e l’attuazione di un monitoraggio routinario delle coperture vaccinali, favorendo l’armonizzazione e l’implementazione di efficaci strategie vaccinali da una parte e l’adozione di nuove e più efficaci misure preventive, comprese nuove tecnologie, per la riduzione del carico globale della malattia in tutta la popolazione.
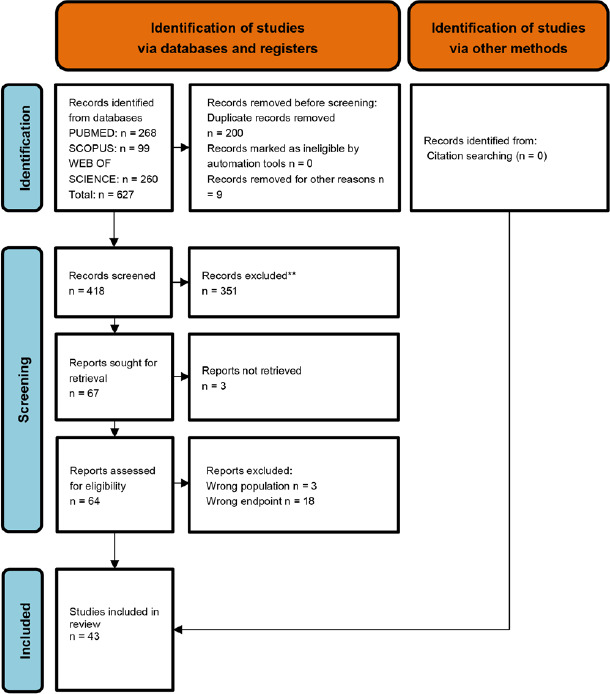
PRISMA statement flow diagram della revisione sistematica di letteratura relativa ai dati epidemiologici delle infezioni pneumococciche nel setting nazionale.
PRISMA statement flow diagram della revisione sistematica di letteratura relativa al burden clinico delle infezioni pneumococciche nel setting internazionale.
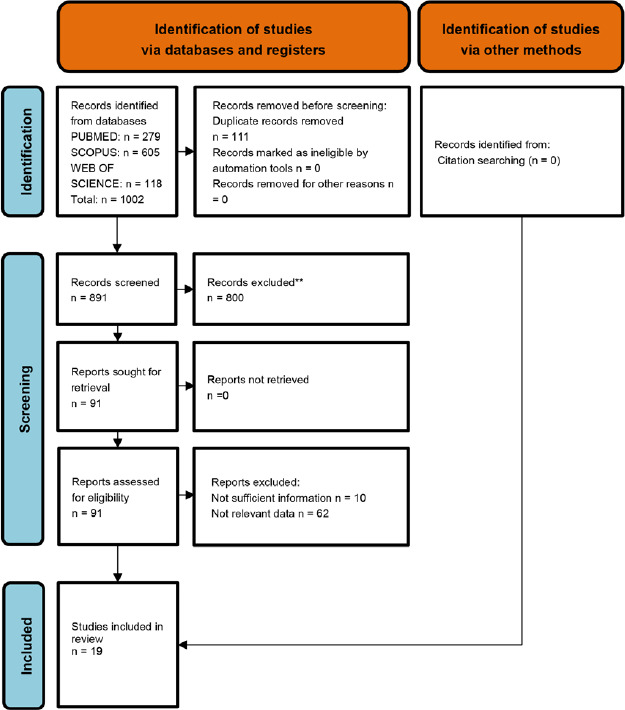
PRISMA statement flow diagram della revisione sistematica di letteratura relativa al burden clinico delle infezioni pneumococciche nel setting italiano.
PRISMA statement flow diagram della revisione sistematica di letteratura del burden economico delle infezioni pneumococciche nel setting internazionale.
PRISMA statement flow diagram della revisione sistematica di letteratura del burden economico delle infezioni pneumococciche nel setting nazionale.
Caratteristiche e principali risultati degli studi primari inclusi nella revisione sistematica relativa all’epidemiologia delle malattie pneumococciche.
| Primo autore, anno | Setting | Popolazione in studio (età) | Periodo in studio | Tipo di studio | Obiettivo | Risultati principali |
|---|---|---|---|---|---|---|
| Marchisio, 2001 | 17 città italiane | 1-7 anni | 1996-1997 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 3.8% in autunno e del 4.7% in primavera senza differenze significative tra i due periodi |
| Marchisio, 2002 | 13 città italiane | ≤ 7 anni | 2000 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata dell’8.6% senza differenze significative rispetto all’età. Il 63.2% dei sierotipi sono risultati coperti dal PCV7 con valori più alti nel gruppo < 2 anni (73.1%) e 2-5 anni (68.9%) rispetto a quello > 5 anni (51.2%). Il 77.3% dei sierotipi è risultato invasivo. Una sinusite nei precedenti 3 mesi è risultata un fattore di rischio |
| Petrosillo, 2002 | Lazio | < 6 anni | 1999 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata 14.9% e i sierotipi più comunemente identificati sono stati il 6A (20%), il 23F (25.8%), il 6B (11.7%), il 19F (7%), il 19A (4.7%), il 19C (2.3%). Vivere con più di 3 persone nella stessa casa è risultato un fattore di rischio |
| Schettini, 2003 | Bari | 1-7 anni | 2000 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 18.29% con i sierotipi 19A, 19F, 14, 6B, 23F a rappresentare il 60.3% degli isolati |
| Ansaldi, 2012 | Genova | < 5 anni | 2010 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza aggiustata per età è risultata del 50.1%. La prevalenza è risultata del 22% nel primo anno di vita, del 48.6% nel secondo e del 60% nel terzo-quarto. Per quanto riguarda i sierotipi i più comuni sono risultati, in ordine decrescente, il 10F, il 10A, il 5, il 18A e il 4. L’età, la presenza di fratelli/sorelle e la frequenza dell’asilo sono risultati fattori di rischio |
| Camilli, 2013 | Emilia Romagna-Lombardia | < 6 anni | 2011-2012 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 32.9% (7.1% nella fascia 0-5 mesi, 33.3% in quella 6-23 mesi, 33.06% tra 24-35 mesi e 35.19% tra 36-71 mesi). I sierotipi più comuni sono stati 6C, 24F e 19A |
| Zuccotti, 2014 | Italia | 3-59 mesi | 2011 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 27% (22% tra 3 e 12 mesi, 31% tra 13 e 24 mesi, 32% tra 25 e 59 mesi). I sierotipi più frequenti sono risultati, in ordine decrescente, il 6C, il 19A, e il 23A. La presenza di fratelli/sorelle, la frequenza dell’asilo e infezioni respiratorie nei precedenti 3 mesi sono risultati fattori di rischio |
| Pasinato, 2014 | Veneto | 6-59 mesi | 2010-2011 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 55,8%, ma pari al 61,3% nei bambini con infezioni respiratorie e al 50% in quelli sani. Non sono emerse invece differenze significative tra bambini con vaccinazione completa e bambini non vaccinati. I sierotipi più comunemente rilevati sono stati 35F, 5, 19F, 24 e 18. La prevalenza del carriage è risultata aumentare significativamente all’aumentare del tempo trascorso dalla vaccinazione |
| Esposito, 2015 | Milano | 6-17 anni | 2013 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata pari al 51,6%, significativamente maggiore tra 6 e 9 anni (70,8%) rispetto a 10-14 anni (42,7%) e 15-17 anni (29,4%) |
| Mameli, 2015 | Lombardia | 3-59 mesi | 2011-2012 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza aggiustata per età è risultata del 31% al tempo 0 e non si è modificata sostanzialmente al follow-up a 6 mesi (32%) e a 12 mesi (28%) ma contemporaneamente è aumentata la proporzione di soggetti vaccinati. Durante il follow-up è stata osservata una diminuzione dei sierotipi PCV13 e uno shift verso i sierotipi non-PCV13, in particolare il 15A |
| Principi, 2015 | Italia | 6-17 anni | 2013 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 57,9% (74,9% nei soggetti di età < 10 anni, 51,8% in quelli di età compresa tra 10 e 14 anni e 32,7% ≥ 15 anni). I sierotipi più comunemente isolati sono stati 19F, 5, 9V e 4 |
| Esposito, 2016 | Centri regionali Fibrosi cistica: Milano, Verona, Roma, Napoli | 6-17 anni con fibrosi cistica | 2014 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata di 19,8%, significativamente maggiore (28,6%) in bambini < 10 anni, e minore in quelli di 10-14 anni (17,6%) e ≥ 15 anni (12,7%). I sierotipi più comuni sono risultati il 19F, il 5, il 4, e il 9V |
| Principi, 2016 | Lombardia, Lazio | 6-17 anni con cancro | 2014 | Studio di sorveglianza attiva | Analisi della prevalenza del carriage nasofaringeo di S. pneumoniae | La prevalenza è risultata del 18,8% (20% nei pazienti ematologici e 11,9% in quelli con tumori solidi). La prevalenza è inoltre risultata significativamente maggiore (44,8%) < 10 anni rispetto alla fascia 10-14 anni (36,8%) e > 14 anni (18.4%). I sierotipi più comuni sono stati il 19F e il 4 |
| Montagnani, 2008 | Siena | 1 mese-15 anni | 1992-2006 | Studio di sorveglianza attiva | Analisi delle caratteristiche cliniche e microbiologiche delle malattie pneumococciche | Dei 640 bambini con coltura positiva per S. pneumoniae il 47,8% era carriers, il 49% aveva una malattia localizzata e il 3,2% una malattia invasiva. I sierotipi 1 e 7F sono stati i più comunemente isolati |
| Baldo, 2016 | Veneto e Friuli | Tutta la popolazione | 2004-2013 | Studio di sorveglianza attiva | Analisi delle ospedalizzazioni per polmonite | Il tasso medio annuo di ospedalizzazione è risultato più alto tra 0 e 4 anni (325,6 per 100.000 nei maschi, 288,9 per 100.000 nelle femmine) |
| Ansaldi, 2008 | Liguria | 0-2 anni | 2000-2005 | Studio di sorveglianza attiva | Analisi delle ospedalizzazioni per malattie pneumococciche | Il tasso di ospedalizzazione per polmonite è passato da 1,91/10.000 prima dell’introduzione del programma vaccinale a 0,56/10.000 dopo. Il tasso di ospedalizzazione per otite è variato da 45,22/10.000 prima dell’introduzione del programma di vaccinale a 28,77/10.000 dopo |
| Boccalini, 2017 | Toscana | Tutta la popolazione | 2002-2014 | Studio di sorveglianza attiva | Analisi delle ospedalizzazioni per malattie pneumococciche | Nella fascia di età 0-9 anni il tasso di ospedalizzazione complessivo è risultato 989,2/100.000 con un trend in declino dal 2002 (1, 415,3/100.000) al 2014 (628/100.000) |
| Bonsignori, 2013 | Toscana | 0-18 anni | 1999-2009 | Studio di sorveglianza attiva | Analisi delle ospedalizzazioni per polmonite | Il tasso di ospedalizzazione complessivo per polmonite pneumococcica stratificato per fascia di età è risultato: 28,04/100.000 tra 0-5 anni, 0,98/100.000 tra 6 e 12 anni; e 10,06/100.000 tra 13 e 18 anni. Tra i bambini di età < 5 anni i tassi di ricovero sono aumentati di 4.15 volte, da 12,84/100.000 nel 2001 a 53,27/100.000 nel 2006, per poi stabilizzarsi successivamente |
| Resti, 2010 | 83 ospedali italiani | 0-16 anni | 2007-2009 | Studio di sorveglianza attiva | Analisi dei sierotipi di S. pneumoniae responsabili di polmoniti ospedalizzate | Il sierotipo 1 è risultato il più frequente tra i bambini più grandi (12 anni) e quello più spesso associato a forme complicate. Il sierotipo 19A è stato il secondo isolato per frequenza, più comunemente nei bambini più piccoli |
| Marchese, 2011 | Italia | < 5 anni | 2009-2010 | Studio di sorveglianza attiva | Analisi della distribuzione di S. pneumoniae nei casi di polmonite | Il sierotipo 19A è risultato il più frequente |
| Liese, 2014 | Europa | < 6 anni | 2008-2009 | Studio di sorveglianza attiva | Analisi dell’incidenza delle otiti medie acute | L’incidenza in Italia è risultata di 195/1.000 anni-persona, più bassa rispetto agli altri paesi e una maggiore percentuale di bambini ha avuto un solo episodio di otite (86,1%) |
| Marchisio, 2012 | Italia | 0-6 anni | 2003-2007 | Studio di sorveglianza attiva | Analisi dell’incidenza delle otiti medie acute | Il tasso di incidenza totale nel periodo di studio è stato di 16,8 episodi per 100 anni-persona, inclusi episodi singoli (15,9 episodi per 100 anni-persona) e ricorrenti (0,9 episodi per 100 anni-persona) |
| Barbieri, 2021 | Veneto | < 15 anni | 2010-2017 | Studio di sorveglianza attiva | Analisi dell’incidenza delle otiti medie acute | Il tasso di incidenza nei bambini di 0-2 anni è passato da 126/1.000 anni-persona nel 2010 a 79/1.000 anni-persona nel 2017. Negli stessi anni, nei bambini di 2-4 anni, è passato da 213 a 178/1.000 anni-persona, mentre nella fascia di età 5-14 anni è passato da 60 a 38/1.000 anni-persona |
| Marchisio, 2017 | Lombardia | 6 mesi-7 anni | 2015-2016 | Studio di sorveglianza attiva | Analisi dell’eziologia delle otiti medie acute con rottura del timpano | S. pneumoniae è risultato responsabile del 27,1% dei casi ma solo nel 20,8% degli stessi è stato l’unico batterio isolato. S. pneumoniae è stato rilevato in maniera significativamente superiore nei bambini sotto i 2 anni |
| Balsamo, 2018 | Emilia Romagna | 1 mese-14 anni | 2002-2016 | Studio di sorveglianza attiva | Analisi delle caratteristiche dei pazienti con mastoidite | S. pneumoniae è stato rilevato nel 16,7% dei campioni che sono stati sottoposti a coltura e sono risultati positivi mentre la positività all’antigene pneumococcico è stata registrata nel 10% dei campioni urinari testati |
| Pantosti, 2000 | Italia | Tutta la popolazione | 1997-1999 | Studio di sorveglianza attiva | Analisi della prevalenza dei sierotipi di S. pneumoniae e del loro profilo di resistenza nei casi di meningite | Nei bambini sotto il 5 anni i più comuni sierotipi sono stati, in ordine di frequenza, 14, 6B e 23 Su tutti i campioni analizzati, indipendentemente dall’età, la resistenza alla penicillina è stata registrata nel 9,5% degli isolati con solo 2 ceppi completamente resistenti (appartenenti al sierotipo 9V). Il 30% dei ceppi appartenenti ai sierogruppi 14 o 6 erano resistenti all’eritromicina |
| D’Ancona, 2005 | Piemonte e Puglia | Tutta la popolazione | 2001 | Studio di sorveglianza attiva | Analisi dell’incidenza delle MIP | L’incidenza nei bambini tra 0 e 4 anni è risultata di 6,3 su 100.000 in Piemonte e 2,8 su 100.000 in Puglia (11,3 e 5,9 su 100.000 rispettivamente nei bambini < 2 anni). Circa il 79% dei ceppi isolati da pazienti di età inferiore a 5 anni è risultato incluso nel vaccino PCV7 |
| Zanchi, 2007 | Siena | 0-12 anni | 1992-2005 | Studio di sorveglianza attiva | Analisi dei sierotipi coinvolti nelle MIP | I sierotipi più comunemente rilevati, al di sotto dei 5 anni di età, sono stati l’1, il 6A e il 14 |
| Pavan, 2007 | Lombardia | Tutta la popolazione | 2000-2006 | Studio di sorveglianza attiva e Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’incidenza delle malattie batteriche invasive | 83 casi di MIP riportati nel periodo di studio nella fascia di età 0-4 anni, contro i 168 casi di malattie meningococciche invasive nella stessa età. Nel confronto tra i due batteri N. meningitidis è risultato prevalente fino ai 29 anni di età, mentre S. pneumoniae ha mostrato più casi a partire dai 30 anni, sebbene abbia un’incidenza significativa al di sotto dei 5 anni |
| Azzari, 2008 | Toscana e Italia | 0-14 | 2005-2006 | Studio di sorveglianza attiva | Analisi dell’incidenza delle MIP | Il tasso di incidenza ottenuto con metodi colturali è stato di 3,6/100.000 per i bambini sotto i 14 anni, 4,7/100.000 sotto i 5 anni, 11,5/100.000 sotto i 2 anni e 11,2/100.000 nel primo anno di vita. Utilizzando metodi molecolari, sono stati ottenuti invece i seguenti risultati: 19,9/100.000, 35,1/100.000, 51,8/100.000 e 55,8/100.000. Nei bambini di età < 14 anni l’incidenza è stata di 3,6/100.000 per meningite/sepsi, 1,8/100,00 per artrite e 14,4/100.000 per polmonite |
| Tardivo, 2009 | Nord-Est Italia | 0-36 mesi | 2003 | Studio di sorveglianza attiva | Analisi dell’incidenza delle MIP | L’incidenza annuale è risultata di 58,9 casi/100.000 |
| Giorgi Rossi, 2009 | Lazio | Tutta la popolazione | 2001-2005 | Studio di sorveglianza attiva e Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’incidenza delle meningiti batteriche | L’incidenza complessiva è risultata di 3,7/100.000 ma maggiore (48,6/100.000) sotto l’anno di vita rispetto alla classe 1-4 anni (11,3/100.000). S. pneumoniae è risultato l’agente eziologico più comune, in particolare con i sierotipi 14, 19, 23, e 6 |
| Riva, 2012 | Lombardia nord occidentale | < 5 anni | 2008 | Studio di sorveglianza attiva | Analisi dell’incidenza delle MIP | L’incidenza annuale è risultata di 50.0/100.000, maggiore < 2 anni (58,3/100.000) rispetto a 2-4 anni (44,4/100.000). Il sierotipo 19A è risultato il più comune seguito da 1, 7F, 19F, 14, 23F, 12B, 15C |
| Azzari, 2012 | Italia | 0-16 anni | 2008-2011 | Studio di sorveglianza attiva | Analisi dei sierotipi coinvolti nelle MIP e stima della copertura conferita dai vaccini pneumococcici | I 10 sierotipi più comunemente isolati nella popolazione arruolata nello studio sono stati, in ordine decrescente, 1, 3, 19A, 7F, 5, 14, 6A, 6B, 18C e 19F |
| Amodio, 2013 | Sicilia | 1-57 mesi | 2009-2011 | Studio di sorveglianza attiva | Analisi dell’incidenza delle MIP | Il 6.6% del totale dei pazienti inclusi nello studio sono risultati affetti da MIP. I sierotipi 19A e 15C sono risultati responsabili di 3 casi ciascuno con un ulteriore caso dovuto a 23F. Per gli altri due casi il sierotipo non è stato identificato |
| Amodio, 2014 | Sicilia | 1-59 mesi | 2010-2011 | Studio di sorveglianza attiva | Analisi dell’incidenza delle MIP | L’incidenza delle MIP è risultata pari a 0 dal momento che nessuno dei bambini eleggibili è risultato positivo per S. pneumoniae |
| D’Ancona, 2015 | 7 regioni (A.P. Bolzano, A.P. Trento, Emilia-Romagna, Friuli-Venezia Giulia, Lombardia, Piemonte, Veneto) | Tutta la popolazione | 2008-2014 | Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’incidenza delle MIP | Nella fascia 0-4 anni dal 2008 al 2014 c’è stato un calo dei casi del 56% (12.0/100.000 < 1 anno e 7,1/100.000 tra 0 e 4 anni nel 2008 a fronte di 5,9/100.000 e 3,1/100.000 nel 2014) |
| Baldovin, 2016 | Veneto | Tutta la popolazione | 2007-2014 | Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’incidenza delle MIP | Il tasso di incidenza nei bambini sotto i 5 anni di età è passato da 3,8/100.000 prima dell’introduzione del PCV13 a 0,8/100.000 dopo la stessa. In questa fascia di età, batteriemia e polmonite sono risultate le principali sindromi cliniche con un’incidenza di 2,2/100.000 e 1,8/100.000 prima dell’introduzione della vaccinazione e di 0,7/100.000 e 0,5/100.000 successivamente a essa |
| Camilli, 2017 | Emilia-Romagna, Lombardia, A.P. Bolzano, A.P. Trento, Piemonte | < 5 anni | 2008-2014 | Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’incidenza delle MIP | L’incidenza è risultata di 7,8/100.000 nel 2008 e di 3,0/100.000 nel 2014. Nei soggetti vaccinati i valori sono stati rispettivamente di 2,92/100.000 nel 2008 e 0,13/100.000 nel 2014. I casi da sierotipi non vaccinali sono aumentati (principalmente quelli da 12F e 24F) |
| Nieddu, 2017 | Friuli-Venezia Giulia, Emilia Romagna e Toscana | > 14 anni | 2005-2016 | Studio di sorveglianza attiva | Analisi della distribuzione dei sierotipi di S. pneumoniae nelle MIP | I sierotipi più comunemente isolati sono stati il 3 (13,3%), l’8 (8,5%), il 19A (7,5%), il 12 (6,5%), e il 22 (5,6%). Quelli che hanno mostrato una più alta crescita in percentuale nell’epoca post-PCV13 sono stati l’8 (+5,5%), il 23A (+4,4%) e il 33 (+3,5%). Quelli con una riduzione maggiore invece il 7F (-12,8%), il 15 (-4,0%) e il 12 (-3,0%) |
| Nicolosi, 2018 | Italia | 1-8 anni | 2008-2012 | Studio di sorveglianza attiva | Analisi della distribuzione dei sierotipi di S. pneumoniae nelle MIP | I sierotipi più comunemente isolati sono stati il 19A (26,1%), l’1 (15,2%), il 3 e il 10 (entrambi 8,7%), il 14 (6,5%), seguiti da 7F, 11A, 15C e 24F |
| Quattrone, 2020 | Toscana | Tutta la popolazione | 2016-2017 | Studio di sorveglianza attiva e Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’under-reporting del sistema di sorveglianza nazionale | Solo il 3,1% dei casi è stato contemporaneamente riscontrato nelle tre fonti considerate nello studio (ospedalizzazioni, sistema di sorveglianza, sistema di analisi microbiologiche) per un tasso di incidenza combinato di 12,1/100.000 e un under-reporting del 73,7% |
| Monali, 2020 | Italia | Tutta la popolazione | 2007-2017 | Sorveglianza Nazionale delle Malattie Batteriche Invasive | Analisi dell’incidenza delle MIP | L’incidenza delle MIP nella fascia di età sotto 1 anno e tra 1 e 4 anni è diminuita fino al 2013 ed è poi aumentata. Nel 2017, l’incidenza è risultata pari a 5.7 per 100.000 < 1 anno e 2,2 per 100.000 tra 1 e 4 anni. I sierotipi che hanno mostrato un aumento sono stati il 3, l’8, il 12F e il 22F, in particolare l’8 e il 12F nella fascia 0-4 anni, mentre sono diminuiti il 19A e il 3 |
| MIP: malattie invasive pneumococciche. | ||||||
Caratteristiche e principali risultati delle revisioni sistematiche relative al burden clinico delle malattie pneumococciche.
| Primo autore, anno | N. studi inclusi | Setting | Popolazione target (età) | Sierotipo | Principali risultati |
|---|---|---|---|---|---|
| Jefferson T. 2006 | 20 | Europa occidentale (Danimarca, Finlandia, Norvegia, Svezia, Spagna, Svizzera, Scozia, Austria, Germania, UK, Italia) | ≤ 2 anni | Il sierotipo 14 è risultato il più comune (19,47%), seguito dal sierotipo 6 (16,26%); 19 (15,14%); 23 (10,29%); 18 (6,12%); 1 (5,35%), 9 (5,21%); 7 (3,42%); 4 (2,9%); 3 (2,11%); 15 (0,87%); 8 (0,76%); 5 (0,61%); 11 (0,46%); 24 (0,41%); 12 (0,41%) | MIP
Meningiti L’incidenza di meningite pneumococcica è risultata variare da 8 a 9 casi/100.000 bambini < 2 anni
Antibiotico resistenza
|
| O’Brien K.L. 2007 | 156 | Prospettiva globale | < 5 anni HIV-positivi HIV-negativi |
- |
MIP
Meningite
PP
Mortalità
|
| Valenzuela M.T. 2009 | 24 | America Latina e Caraibi | < 5 anni | Il sierotipo 14 è risultato il più comune (fatta eccezione per la meningite nei bambini < 2 anni di età, per i quali il sierotipo 5 è risultato il più comune), costituendo il 28% e il 40% degli isolati da malattia pneumococcica invasiva, rispettivamente, nei bambini di età < 2 anni e < 6 anni di età | MIP
Complicanze
Mortalità
|
| Ramakrishnan M. 2009 | 37 | Africa | Range di età: 1 mese-15 anni con diagnosi di laboratorio confermata per meningite batterica (non solo da S. pneumoniae) | - | Meningite
Mortalità
|
| Johnson H.L. 2010 | 169 | Africa, Asia, Europa, America Latina e Caraibi, Nord America, Oceania | < 5 anni | Nel complesso, sette sono risultati i sierotipi più comuni (1, 5, 6A, 6B, 14, 19F, 23F). | MIP:
Mortalità:
Antibiotico resistenza:
|
| Chen Y. 2011 | 49 | Cina | < 5 anni | I sierotipi 19F, 19A e 14 sono risultati i più frequenti nei pazienti con polmoniti/meningiti | Meningite:
Mortalità:
Antibiotico resistenza:
|
| Castañeda E. 2012 | 63 | America Latina e Caraibi | < 6 anni | Tutti i dati hanno riguardato il sierotipo 19A | MIP:
Meningiti:
Otite media acuta:
Antibiotico resistenza:
|
| Ciapponi A. 2014 | 39 | America Latina e Caraibi | < 5 anni | La sorveglianza sulla distribuzione dei sierotipi ha mostrato che il 14, 5, 6B (per meningite) e 14, 6B, 19F (per batteriemia) sono risultati i più frequente | Meningite:
Batteriemia:
Mortalità:
Ospedalizzazione:
|
| Jaiswal N. 2014 | 22 | Asia del Sud | 1 mese-12 anni | - | MIP:
PP:
Meningite:
|
| Lyu S. 2017 | 40 | Cina | ≤ 14 anni | I sierotipi 19F, 19A, 23F, 14, e 6B sono risultati i più comuni sia nelle forme di malattia invasiva sia non invasiva in Cina | Antibiotico resistenza:
|
| Bardach A. E. 2017 | 35 | America Latina e Caraibi | ≤ 14 anni | I dati di sorveglianza hanno dimostrato i sierotipi 14, 1 e 6B come i più frequenti | PP:
Mortalità:
Ospedalizzazioni:
|
| Tam P. Y. I. 2017 | 38 | Africa | < 16 anni | I sierotipi 14 (16,7%), 6B (14,1%), 6A (12,6%), 23F (12,0%), 19F (10,7%), 19A (7,6%) sono stati individuati, nell’ordine, come i maggiori responsabili di malattia invasiva | MIP:
Meningite:
Batteriemia:
Antibiotico resistenza:
|
| Singh J. 2017 | 7 | India | ≤ 5 anni | I sierotipi 14 e 19A sono risultati presenti nella maggior parte delle aree geografiche studiate | MIP:
Antibiotico resistenza:
|
| Balsells E. 2018 | 13 | USA, Colombia, Francia, Israele, Francia, Italia, Paesi Bassi, Norvegia, Spagna, UK, Africa del Sud | < 5 anni | I sierotipi 1, 7F e 12F sono risultati essere i più pericolosi nei bambini < 5 anni di età | MIP:
|
| Fu J. 2019 | 16 | Cina | < 18 anni | I sierotipi predominanti sono risultati essere il 19F (27.7%), 19A (21,2%), 14 (16,5%), 6B (8,6%) e 23F (7,3%) | MIP:
Antibiotico resistenza:
|
| Hocknell R. E. 2019 | 10 | Tailandia | Range di età: ≤ 5 anni > 5 anni |
I sierotipi più comunemente responsabili di malattia sono risultati, nell’ordine, il 6B, 23F, 14, 19A e 19F | MIP:
|
| Men W. 2020 | 42 | Cina | < 14 anni | I sierotipi predominanti sono risultati il 19A (215, 22,8%), 19F (195, 20,7%), 14 (185, 19,6%), 23F (89, 9,4%) e 6B (79, 8,4%) | MIP:
Antibiotico resistenza:
|
| Ishiwada N. 2021 | 65 | Giappone | < 15 anni | I sierotipi più comuni sono risultati il 3, 6A, 19A (sierotipi del PCV13); 12F (sierotipi epidemici); 15A, 35B (sierotipi farmaco-resistenti) | MIP e PP:
Mortalità
|
| MIP: malattie invasive pneumococciche; PP: polmonite pneumococcica; NVT: non-vaccine-typePCV: Pneumococcal conjugate vaccine | |||||
Caratteristiche e principali risultati degli studi primari inclusi nella revisione sistematica relativa al burden clinico delle malattie pneumococciche.
| Primo autore, anno | Regione italiana/città/ Setting | Disegno di studio | Durata dello studio | Popolazione target (N, genere, età media) | Sierotipo (%) e/o correlazione con complicanze | Complicanze pneumococciche | Antibiotico resistenza | Ospedalizzazioni | Mortalità (%) |
|---|---|---|---|---|---|---|---|---|---|
| Marchese A. 2000 | Nord Italia: Bergamo, Genova, Milano, Novara, Sondrio, Torino e Vercelli. Centro Italia: Ancona, Bologna, Firenze, Parma, Roma, Perugia, e Pisa Sud Italia: Catania, Catanzaro, Messina, Napoli e Sassari |
Studio osservazionale | Gennaio 1994-settembre 1998 | Tot: 87 Range età: 0-5 anni |
19F (28,5%) 19A (3%) 6B (24,9%) 6A (0,45%) 23F (17%) 23A (1,21%) 9V (5,2%) 35 (1,31%) 15B (3,5%) 5A (15,2%) 14 (8,73%) 21 (0,45%) 24 (0,45%) |
- | Penicillina resistenza per sierotipi 23F-19F-9V Eritromicina resistenza per i sierotipi 6B-19A-14-19F-15A-15B-23F |
- | - |
| Pantosti A. 2000 | 47 Ospedali in diverse aree di Italia (Napoli, Pordenone, Palermo, Parma, Roma, Reggio Emilia, Arezzo, Bologna) | Studio osservazionale | Dicembre 1997-marzo 1999 | Tot: 25 Range età: 2 mesi-5 anni |
14 (28%) 23F (16%) 6B (20%) 1, 4, 18C, 19A, 6A, 7F |
Meningite | Penicillina resistenza per il sierotipo 9V Eritromicina resistenza per i sierotipi 14 e 6 Cloramfenicolo e tetraciclina resistenza per sierotipo 6 |
- | - |
| Esposito S. 2002 | Milano | Studio osservazionale | - | Tot: 196 M (50.5%) Range età: 2-5 anni |
1 (30,0%) 14 (27,5%) 9V (10,0%) 4 (7,5%) 18C (7,5%) 6B (5,0%) 19F (5,0%) 23F (5,0%) 5 (2,5%) |
Polmonite complicata con segni radiologici:
|
- | Giorni medi ± SD: 6,857 ± 3,523 |
- |
| Pantosti A. 2003 | 65 laboratori in diverse aree italiane | Studio trasversale | 1997-2000 | Tot: 503 isolati Range età: 0-15 anni |
14 (33,3%) 6A (3,9%) 6B (13,7%) 23F (13,7%) 19A (5,9%) 19F (3,9%) 1 (7,9%) 4 (5,9%) 7F (5,9%) 3 (2,0%) 5 (2,0%) 18C (2,0%) |
MIP | PNSSP:
ERSP:
|
- | - |
| D’Ancona F. 2005 | Piemonte e Puglia | Studio trasversale | Aprile 2001-marzo 2002 | Tot: 17 Range età: 0 mesi-4 anni |
14 (50,0%) 3 (7,1%) 4 (7,1%) 6B (7,1%) 7F (7,1%) 18C (7,1%) 19A (7,1%) 31 (7,1%) |
MIP Piemonte: 0-11 mesi = 5,6 per 100.000 0-23 mesi = 11,3 per 100.000 0-4 anni = 6,3 per 100.000 MIP Puglia: 0-11 mesi = 7,1 per 100.000 0-23 mesi = 5,9 per 100.000 0-4 anni = 2,8 per 100.000 Polmonite (11,8%) Meningite (58,8%) Setticemia (11,8%) Otite (5,9%) Altro (5,9%) |
Penicillina resistenza Mediamente sensibili al cefotaxime Eritromicina resistenza Resistenza a clindamcina e tetraciclina Resistenza a levofloxacina e cloramfenicolo |
- | 8% (1 decesso) in bambino < 2 anni di età |
| Pagliano P. | Campania | Studio longitudinale | Gennaio 1997-dicembre 2005 | Tot. 64 M: F = 1,9:1 Range età: 1 mese-14 anni Età media: 26 (7-89) mesi |
3 = Idrocefalo 4 6A 6B = Perdita dell’udito 8 9N = Perdita dell’udito, emiparesi 9V = Morte, emiparesi 11A 14 = Emiparesi, perdita dell’udito 15B 18A 18C = Deterioramento cognitivo 19A = Emiparesi 19F = Perdita dell’udito 23A = Emiparesi 23F = Deterioramento cognitivo 31 33 |
Meningiti Manifestazioni neurologiche (deficit motorio, perdita di udito, disturbi del comportamento o del linguaggio, igroma cerebrale e trombosi dei seni venosi): 22% |
2 ceppi totalmente resistenti alla penicillina e 8 con resistenza intermedia 2 ceppi con resistenza intermedia a cefotaxime ma entrambi penicillina resistenti 21 ceppi resistenti all’eritromicina 9 resistenti alla vancomicina o rifampicina |
- | 3% (2 decessi) |
| Azzari C. 2008 | Toscana | Studio longitudinale | Dicembre 2005-novembre 2006 | Tot: 92 M (57,6%) F (42,4%) Range età: 0 mesi-14 anni Età media: 63,1 ± 45,2 mesi |
4-6A/B-23F-9V/A = Meningite/sepsi 4-6A/B-19F/A-8-14-18-18C-12-3-1 = Polmonite 22F = Artrite |
Incidenza MIP: 3,6/100.000 per meningiti/sepsi 14,4/100.000 per polmoniti 1,8/100.000 per artrite |
- | - | - |
| Montagnani F. 2008 | Toscana | Studio osservazionale | 1992-2006 | Tot: 640 M 59% F 41% Range età: 0 mesi-15 anni |
1 (38,1%) = Polmonite batteriemica e sepsi 4 (4,7%) 7F (9,5%) 5 6A 12F 14 18C 19A 19F 23F 24F 34 |
Polmonite batteriemica con o senza pleurite 62% Meningite 25% Sepsi 16% |
Non suscettibile alla penicillina 10,2% Eritromicina resistenza 35,15%; Multiresistenza 8% |
- | Tra il 4,8% dei casi di MIP: decesso di un solo paziente (con meningite) |
| Resti M. 2010 | 83 Ospedali di 19 Regioni italiane | Studio osservazionale | Aprile 2007-giugno 2009 | Tot: 753 M 417 (55,4%) Range età: 0-16 anni < 2 anni: 177 (23,5%) Età media: 3,8 anni |
1 (50%) in bambini > 2 anni 19A (11,1%) bambini < anni 3 (13,9%) 6 (2,8%) 7F (2,8%) 9V (2,8%) 14 (5,6%) 18 (5,6%) 20 (2,8%) NT (2,8%) |
Polmonite complicata in 162 pazienti (21,5%): • versamento parapneumonico (93,8%) • versamento parapneumonico con empiema (31,5%) • polmonite necrotizzante (4,9%) • atelettasia (4,9%) |
- | - | - |
| Azzari C. 2012 | 19 Regioni italiane | Studio trasversale | Aprile 2008-marzo 2011 | Tot: 153 Range età: 0-16 anni Età media: 4,1 anni |
1 (29,9%) = Polmonite 3 (16,0%) = Polmonite e meningite 19A (13,2%) = Polmonite 7F (8,3%) = Meningite 5 (4,2%) 14 (4,2%) 6A (3,5%) = Meningite 6B (3,5%) 18C (3,5%) 19F (3,5%) |
MIP: Polmonite pneumococcica batteriemica Meningite/sepsi |
- | - | - |
| Esposito S. 2012 | Milano Novara Genova Roma Padova |
Studio osservazionale | Settembre 2008-marzo 2011 | Tot: 510 M 277 (54,3%) F 233 (45,7%) Range età: 1 mese-5 anni Età media: 2,3 anni |
19A (33,3%) 14 (5,6%) 4 (5,6%) 3 (11,1%) 7F (5,6%) 1 (5,6%) |
Polmonite complicata: • versamento pleurico • versamento pleurico con empiema • polmonite necrotizzante • atelettasia |
- | - | - |
| Riva E. 2012 | Lombardia | Studio osservazionale | 12 mesi | Tot: 135 M 75 F 60 Range età: 0-4 anni Età media: 2,5 ± 1,4 anni |
1-14-7F-19F = Polmonite 19A (23,1%)-19F 14 = Batteriemia 23F-12B = Sepsi 15C = Meningite |
MIP: Polmonite 53,3% Batteriemia 26,7% Sepsi 13,3% Meningite 6,7% |
Penicillina e Tetraciclina resistenza per sierotipo 15C Eritromicina resistenza per sierotipo 19A e 14 Eritromicina e tetracicilina resistenza per sierotipo 19F |
- | - |
| Bonsignori F. 2013 | Toscana | Studio longitudinale | Gennaio 1999-dicembre 2009 | Tot: 5450 M 54,9% F 45,1% Range età: 1 mese-18 anni Età media: 44 mesi |
- | PP: 39,48% | - | Ospedalizzazione (1999-2009) 0-5 anni: (28,04%) 6-12 anni: (10,6%) 13-18 anni: (0,98%) Durata media di degenza: 5 giorni |
|
| Baldo V. 2014 | Veneto | Studio osservazionale | Gennaio 2004-dicembre 2012 | Tot: 16,195 M 54,0% F 46,0% Range età: 0-14 anni |
- | Polmonite: 0-4 anni (98,6%) 5-14 anni (98,7%) Meningite: 0-4 anni (0,3%) 5-14 anni (0,2%) Setticemia: 0-4 anni (0,7%) 5-14 anni (0,4%) Empiema: 0-4 anni (0,4%) 5-14 anni (0,6%) |
- | 0-4 anni: 4,7 ± 3,6 giorni 5-14 anni: 5,1 ± 3,7 giorni Il tasso di ospedalizzazione correlato alla polmonite è diminuito significativamente nella fascia 0-4 anni da 617,3/100.000 nel 2004 a 451,8/100.000 nel 2012 |
- |
| Azzari C. 2015 | Liguria, Puglia, Campania, Lazio, Toscana, Friuli-Venezia Giulia, Marche e Piemonte | Studio osservazionale | Maggio 2008-giugno 2009 | Tot: 920 M 58% (529/920) Range età: 0-4 anni Età media: 23,1 mesi (range 0-59) |
1 = (5.9%) polmonite 3 = (8,8%) polmonite e versamento pleurico (2,9%) 5 = (2,9%) polmonite e versamento pleurico 6A = (2,9%) otite media 7F/A = (5,9%) versamento pleurico e meningite 14 = (8,8%) polmonite 18 = (2,9%) polmonite 19A = (11,8%) polmonite + versamento pleurico + meningite + altro 19F = (2,9%) cellulite e otite media 23F = (2,9%) meningite |
MIP: Polmonite Versamento pleurico Meningite Sepsi |
- | - | - |
| Baldo V. 2016 | Veneto e Friuli-Venezia Giulia | Studio osservazionale | Gennaio 2004-31 dicembre 2013 | Tot: 0-4 anni: 8510 M 54,3% F 45,7% 5-14 anni: 3924 M 55,2% F 44,8% |
- | Polmonite: 0-4 anni (97,8%) 5-14 anni (97,8%) Setticemia: 0-4 anni (1%) 5-14 anni (0,7%) Meningite: 0-4 anni (0,6%) 5-14 anni (0,4%) Empiema: 0-4 anni (0,6%) 5-14 anni (1,1%) |
- | Ospedalizzazioni: 6,8% nei bambini 0-4 anni (325,6 per 100.000 nei maschi, 288,9 per 100.000 nelle donne) Durata degenza media: 4,7 ± 3,9 giorni per bambini 0-4 anni e 4,9 ± 3,7 giorni per bambini 5-14 anni |
- |
| Camilli R. 2017 | Emilia-Romagna, Lombardia, PA di Bolzano, PA di Trento, Piemonte |
Studio osservazionale | Gennaio 2008-dicembre 2014 | Tot: 364 casi MIP Range età: 0-4 anni |
MIP 2008-2009: sierotipi PCV7 2010-2011 (introduzione PCV13): 3/7F in aumento 2012-2014: 10A/12F/23B/24F/25A/33F hanno rappresentato il 33% di tutti gli isolati PM 2008-2009: sierotipo 14 (17%); 2010-2011: sierotipo 1 e 7F (46%) 2012-2014: sierotipi 14/9N/10A/12F/15A/23B/33F MIP Sierotipi PCV7: 2,92 casi/100.000 abitanti nel 2008 e 0,13 casi/100.000 abitanti nel 2014 Sierotipi PCV13: 3,2 casi/100.000 abitanti nel 2008; 3,85 casi/100.000 abitanti nel 2010 e 0,89 casi/100.000 abitanti nel 2010 NSV: 1.12 casi/100.000 abitanti nel 2010; 3,15 casi/100.000 abitanti nel 2010 e 2,04 casi/100.000 abitanti nel 2014 Negli anni 2013-2014 NVS sono stati responsabili del 69% di tutti i casi di MIP nei bambini |
MIP (67,5%): Meningite (28%) |
Penicillina resistenza 21% MIP e 17% PM: 14% nel 2008 con sierotipi PCV13 33,3% nel 2012 22,7% nel 2014 con sierotipi PCV13 e NVS (15A/23B/24F/19A) 57,1% penicillina resistenza per sierotipo 14 Resistenza al ceftriaxone: 6% nel 2008; 22,2% nel 2012 e fino a 0 negli ultimi due anni analizzati Eritromicina resistenza con un picco del 40% nel 2009 e nel 2011, ha mostrato un trend generale in diminuzione: 38% nel 2008 con sierotipi PCV13; 27% nel 2014 con sierotipi 19A/15A/24F e sierotipi NVS Resistenza alla clindamicina con una percentuale costante, dal 26% nel 2008 al 27% nel 2014 Resistenza alla tetraciclina con una tendenza in aumento dal 22% nel 2008 al 27% nel 2014, e una resistenza al cloramfenicolo bassa nel periodo di studio (0-4%) |
- | - |
| Lodi L. 2019 | Ospedali italiani | Studio osservazionale | Gennaio 2006-agosto 2018 | Tot: 386 casi MIP M 34 (57,6%) Range età: 0-18 anni Età media: 3,30 ± 1,67 anni |
Sierotipo 3 (21,1%) (Tasso di incidenza per 1.000.000 anni-persona) Bambini nati prima del 2011: MIP: 0,99 Polmonite: 0,76 Sepsi/meningite: 0,24 Bambini nati dopo il 2011: MIP: 0,87 Polmonite da Ser3: 0,85 Sepsi/meningite: 0,02 Bambini nati dopo il 2011 e vaccinati: MIP: 0,62 Polmonite: 0,62 Sepsi/meningite: 0 |
Polmonite complicata (versamento, empiema, necrotizzazione) Sepsi Meningite |
- | - | - |
| Astengo M., 2022 | Liguria | Studio osservazionale | Ottobre 2012-dicembre 2018 | Popolazione pediatrica < 15 anni Tot: 287 episodi di PP M 150 (52,4%) 0-4 anni: 194 (67,7%) 5-14 anni: 93 (32,3%) Età media: 4,26 (2,9) anni MIP: Tot: 5 casi di PM M 3 (60,0%) 0-4 anni: 4 (80,0%) 5-14 anni: 1 (20,0%) Età media: 4,05 (1,4) anni Tot: 629 casi di batteriemia pneumococcica M 368 (58,5%) 0-4 anni: 518 (82,4%) 5-14 anni: 111 (17,7%) Età media: 2,70 (2,9) anni |
- | Polmonite MIP Meningite Batteriemia |
- | Anni 2012-2018 Incidenza ospedalizzazioni per PP 0-14 anni: diminuzione da 35 a 13/100.000 bambini 0-1 anno: diminuzione da 79 a 47/100.000 bambini 2-4 anni: diminuzione da 69 a 22/100.000 bambini 5-14 anni: diminuzione da 21 a 8/100.000 bambini Incidenza ospedalizzazioni per MIP 0-14 anni: aumento da 1,70 a 4,85/100.000 bambini 0-1 anno: aumento da 0,00 a 9,41/100.000 bambini 2-4 anni: aumento da 5,33 a 9,57/100.000 bambini 5-14 anni: aumento da 0,79 a 3,25/100.000 bambini |
- |
| MIP: malattie invasive pneumococciche; PP: polmonite pneumococcica; PCV: Pneumococcal conjugate vaccine; IPD-NSS: Invasive pneumococcal disease National Surveillance System; NVS: Non-Vaccine Serotype; PNSSP: Penicillin-nonsusceptible S. pneumoniae; PM: Pneumococcal meningitis | |||||||||
Caratteristiche e principali risultati degli studi primari inclusi nella revisione sistematica relativa al burden economico delle malattie pneumococciche.
| Primo autore (anno) | Titolo | Paese | Tipologia di studio | Fonte dati/setting | Popolazione target | Periodo di studio | Prospettiva analisi economica (costi sanitari diretti = SSN; costi indiretti = Società) | Risultati principali inerenti ai costi legati alle malattie infettive da S. pneumoniae |
|---|---|---|---|---|---|---|---|---|
| Barbieri (2022) | The Economic Burden of Pneumococcal Disease in Children: A Population-Based Investigation in the Veneto Region of Italy | Veneto | Retrospettivo | Database nazionali | Bambini < 15 anni | 2010-2017 | SSN | Il costo medio totale per episodio di polmonite pneumococcica ha registrato valori minimi nel 2014 (€ 494.21) e valori massimi nel 2012 (€ 1048.20). Per l’OMA, invece, sono stati stimati valori minimi nel 2010 (€ 48.47) e massimi nel 2013 (€ 50.12) L’utilizzo di risorse sanitarie per la polmonite pneumococcica è stato principalmente attribuito alle ospedalizzazioni, alle visite pediatriche e alle visite d’emergenza, con un costo medio, per episodio, tra il 2010-2017, rispettivamente, di € 714.63, € 29.00, e € 50.77; per l’OMA, invece, alle visite pediatriche e alle prescrizioni antibiotiche con un costo medio, per episodio, rispettivamente, di € 26.41 e € 8.71 Tra il 2010-2017, le spese regionali sono diminuite per la polmonite (da 8,88 a 3,59 milioni di €), per l’OMA (da 3,78 a 2,76 milioni di €) e per le MIP (da 1.35 a 1,02 milioni di €) |
| Amicizia (2022) | Economic burden of pneumococcal disease in children in Liguria, Italy | Liguria | Retrospettivo | Ospedaliero | Bambini < 15 anni con MIP e OMA visitati in pronto soccorso e/o ospedalizzati | 2012-2018 | SSN | I costi dovuti alla polmonite pneumococcica hanno mostrato un decremento passando da € 194.813 nel 2012 a € 73.111 nel 2018 rispetto al totale dei casi di polmonite comprendente anche ad altre cause L’OMA ha rappresentato la maggior parte degli episodi di malattia pneumococcica in generale (61,6%); Pochi invece i casi batteriemia e meningite che rappresentavano rispettivamente l’11,3% e lo 0,25% dei costi complessivi di ospedalizzazione. Inoltre, sono state registrate 3.469 prescrizioni attribuibili a polmonite per tutte le cause, MIP, malattia invasiva o OMA all’anno, con un costo annuo mediano di € 195.206 |
| Baldo (2014) | A population-based study on the impact of hospitalization for pneumonia in different age groups | Veneto | Retrospettivo | Ospedaliero | Bambini ricoverati per polmonite (0-14 anni) | 2004-2012 | SSN | Tra i pazienti della fascia d’età 0-4 anni (11,430) il 98,6% aveva polmonite, 0,7% setticemia, 0,3% meningite e 0,4% empiema. Il costo di ospedalizzazione per questa categoria espresso come costo/anno era di 4,5 milioni di €. Invece tra i pazienti della fascia d’età 5-14 anni (4.765) il 98,7% aveva polmonite, 0,4% setticemia, 0,2% meningite e 0,6% empiema. Il costo di ospedalizzazione per questa categoria espresso come costo/anno era di 1,9 milioni di € |
| Wolleswinkel-van den Bosch (2010) | The health care burden and societal impact of acute otitis media in seven European countries: Results of an Internet survey | Italia | Retrospettivo | Setting comunitario/ospedaliero | Bambini < 5 anni | 2010 | SSN e società |
* Costi medici diretti: 163,94 €, costi diretti non medici: 10,87 €, costi indiretti: 351,65 €, costi totali 526,46 * I costi riportati sono da intendere per singolo episodio |
| Lucioni (2005) | I costi della meningite pneumococcica in età pediatrica | Lombardia | Retrospettivo | Setting comunitario/ospedaliero | Bambini < 5 anni | 2000-2001 | SSN e società | Costo di un caso di meningite pneumococcica in soggetti di età inferiore a 5 anni: € 10.692 per la parte a carico del SSN. Tra questi, la maggior parte per i ricoveri; seguono i costi per la riabilitazione e quelli per la diagnostica. Invece € 12.903 come importo complessivo a carico della collettività. La proporzione dei costi diretti sanitari sul totale sale all’87,5% nella meningite con sequele, dove il costo complessivo di un caso (€ 42.888) risulta essere più di cinque volte il precedente |
| MIP: malattie invasive pneumococciche; OMA: otite media acuta; SSN: servizio sanitario nazionale. | ||||||||
S. pneumoniae (SP) (pneumococco) è un batterio largamente diffuso in grado di colonizzare il tratto respiratorio superiore di individui sani. La colonizzazione dell’oro-rinofaringe determina lo stato di portatore (carriage) che può persistere da poche settimane a periodi sensibilmente più lunghi. Si stima che il 30-50% dei bambini sotto i 6 anni di età sia portatore di SP, tale condizione li rende il principale reservoir del batterio [1]. Lo stato di carriage di per sé non rappresenta un rischio di malattia, tuttavia, è il primo passo nella via patogenetica del microrganismo fino alle forme invasive di malattia [2-5].
La comparsa di sintomi nei soggetti portatori di SP è principalmente legata a condizioni che alterano l’integrità della mucosa delle vie respiratorie, quali concomitanti infezioni virali e malattie che determinano immunodeficienza [6-9]. La malattia, in genere, si manifesta con sintomi a carico del tratto respiratorio superiore causando otite e sinusite. Tuttavia, quando SP si riproduce in distretti anatomici dove normalmente non è presente, come il sangue, il liquor o i polmoni, la malattia si manifesta in forma severa e invasiva, con quadri rispettivamente di meningite, sepsi e polmoniti batteriemiche [10]. La malattia invasiva pneumococcica (MIP) può colpire soggetti di qualsiasi età, tuttavia è più frequente nei bambini, negli anziani e nelle persone con immunodeficienza. Relativamente ai quadri clinici, le meningiti prevalgono nell’età pediatrica, mentre le sepsi e gli altri quadri sintomatologici sono più frequenti negli anziani [10, 11].
A livello mondiale, l’impatto maggiore si osserva nei Paesi con bassi livelli socio-economici dove SP è responsabile di un’elevata mortalità infantile circa 735.000 morti /anno e 14,5 milioni di casi di malattia/anno [12, 13]. Nei Paesi con alti livelli socio-economici e sistemi sanitari efficienti come l’Italia l’impatto risulta particolarmente rilevante in termini di malattia e di ospedalizzazioni determinando rilevanti costi diretti e indiretti [14-16].
La componente di struttura responsabile della virulenza e patogenicità dello pneumococco è la capsula polisaccaridica ed è in base alle caratteristiche di quest’ultima che sono stati identificati più di 90 diversi sierotipi [17]. Fortunatamente non tutti i sierotipi sono in grado di indurre malattia e, generalmente, le forme cliniche più gravi sono associate a un numero limitato di sierotipi [14].
Poiché lo pneumococco si trasmette per via aerea, l’unica arma preventiva efficace è la vaccinazione ed è stata proprio la scoperta della capsula polisaccaridica, nel secolo scorso, che ha reso possibile lo sviluppo di vaccini polisaccaridici (Pneumococcal Polysaccharide Vaccine, PPV) prima e vaccini coniugati (Pneumococcal Conjugate Vaccine, PCV) successivamente [18, 19].
I primi studi nell’ambito della prevenzione sono iniziati nel secolo scorso e, il primo vaccino a cellule intere inattivate fu sviluppato nel 1911 [18, 19].
In Tabella I sono riassunte le principali tappe della storia della vaccinazione anti-pneumococcica.
Principali tappe della storia della vaccinazione anti-pneumococcica.
| 1911 | Primo vaccino a cellule intere inattivato |
| Anni 30 del secolo scorso | Vaccini contenenti materiale capsulare parzialmente purificato |
| 1950 | Prima generazione di vaccini polisaccaridici |
| 1977 | Vaccino polisaccaridico 14-valente (sierotipi: 1, 2, 3, 4, 5, 6A, 7F, 8, 9N, 12F, 18C, 19F, 23F, 25F) autorizzato negli Stati Uniti |
| 1983 | Vaccino polisaccaridico 17-valente (sierotipi: 1, 2, 3, 4, 6A, 7F, 8, 9N, 11A, 12F, 14, 15F, 17F, 18C, 19F, 23F, 25) registrato in Europa |
| 1983 | Vaccino polisaccaridico 23-valente (sierotipi: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 11F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F) autorizzato in USA |
| 2000 | Vaccino polisaccaridico 23-valente (sierotipi: 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 11F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, 33F) autorizzato in Italia per i soggetti partire dai 2 anni di età |
| 2000 | Vaccino coniugato 7-valente (PV7) approvato in USA (sierotipi: 4, 6B, 9V, 14, 18C, 19F e 23F) |
| 2001 | Vaccino coniugato 7-valente approvato in Europa |
| 2005 | Introduzione della vaccinazione pediatrica con PCV7 in Italia |
| 2009-2010 | Autorizzati il vaccino 10-valente (sierotipi: 1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F e 23F) e il vaccino 13-valente (sierotipi: 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F e 23F). |
| Nuove opportunità di prevenzione: vaccini coniugati a spettro antigenico allargato | |
| Dicembre 2021 | Autorizzazione dell’European Agency Medicine (EMA) del vaccino 15-valente (sierotipi: 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F e 33F) in adulti ≥18 anni |
| Marzo 2022 | Autorizzazione dell’Agenzia Italiana del Farmaco (AIFA) del vaccino 15-valente in adulti ≥ 18 anni |
| Febbraio 2022 | Autorizzazione EMA del vaccino 20-valente (sierotipi: 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F e 33F) in adulti ≥18 anni |
| Maggio 2022 | Autorizzazione AIFA del vaccino 20-valente in adulti ≥18 anni |
| 15 settembre 2022 | Valutazione positiva da parte di EMA del vaccino 15-valente per l’immunizzazione di neonati, bambini e adolescenti da 6 settimane ai 18 anni di età |
Il primo vaccino anti-pneumococcico polisaccaridico non coniugato fu approvato negli USA nel 1977 ed esso conteneva gli antigeni capsulari di 14 sierotipi. Nel 1983, fu sostituito da un vaccino con le stesse caratteristiche ma contenente i polisaccaridi capsulari purificati di 23 sierotipi. Il vaccino polisaccaridico 23-valente (PPV23), indicato a partire dai 2 anni di età, è commercializzato in Italia dal 2000. Il PPV23, pur avendo un’ampia copertura sierotipica, induce una risposta immunitaria indipendente dai linfociti T, con conseguente assenza di produzione di cellule B della memoria [18-20] e, pertanto, non è in grado di indurre una memoria immunologica. I titoli anticorpali elicitati dalla vaccinazione diminuiscono nel tempo e non si osserva una risposta anamnestica positiva dopo la rivaccinazione. Inoltre, i vaccini polisaccaridici non sono in grado di conferire immunità in neonati e bambini piccoli (soggetti a più alto rischio di MIP) e, di conseguenza, PPV23 è indicato per soggetti con età > 24 mesi, età in cui il sistema immunitario raggiunge un grado di maturità tale da garantire un’efficace risposta T-indipendente.
Per cercare di superare le criticità associate alla scarsa capacità protettiva dei vaccini polisaccaridici nella fascia pediatrica, la ricerca si è concentrata sulla possibilità di sviluppare vaccini coniugati. In tale contesto, Schneerson et al. [21], nel 1980, dimostrarono che il legame chimico o la coniugazione a una proteina (CRM197, una variante ricombinante non tossica della tossina difterica) migliorava l’immunità conferita dal vaccino per Haemophilus infuenzae di tipo b. Infatti, in pochi anni, la vaccinazione di massa dei neonati con il preparato coniugato con CRM197 determinò un declino significativo dei casi di meningite da H. infuenzae di tipo b. Sulla base di questo successo fu predisposto un vaccino anti-pneumococco coniugato con CRM197 che conteneva sette sierotipi (4, 6B, 9V, 14, 18C, 19F e 23F). Il prodotto fu autorizzato nel 2000 in USA e nel 2001 in Europa. In Italia, la vaccinazione con PCV7 fu inserita nel Piano Nazionale Prevenzione Vaccinale (PNPV) nel 2005 [22].
Nei vaccini coniugati i polisaccaridi capsulari sono legati chimicamente a una proteina carrier altamente immunogena [23] e inducono una risposta T-dipendente e la produzione di cellule B della memoria, con conseguente sviluppo di memoria immunologica.
Gli studi epidemiologici condotti dopo l’introduzione della vaccinazione con PCV7 nella popolazione pediatrica hanno messo in evidenza un decremento significativo dei casi di malattia invasiva e non invasiva causati dai sierotipi inclusi nel vaccino ma hanno anche evidenziato un aumento relativo dei sierotipi non vaccinali (fenomeno del serotype replacement) [24-26]. Tali dati hanno sottolineato la necessità di sviluppare vaccini coniugati contenenti un numero maggiore di sierotipi per ampliare la protezione nei confronti della malattia. Lo sviluppo clinico ha portato all’autorizzazione nel 2009 di un vaccino 10-valente (PCV10) contenente 3 sierotipi aggiuntivi rispetto a PCV7 (1, 5 e 7F) e nel 2010 di un vaccino 13-valente (PCV13) contenente 6 sierotipi aggiuntivi (1, 3, 5, 6A, 7F e 19). Queste nuove opportunità di prevenzione hanno determinato la sostituzione di PCV7 con i nuovi vaccini (PCV10/PCV13) nel 2010.
Successivamente numerosi studi sono stati programmati e condotti con l’obiettivo di valutare l’efficacia dei programmi di vaccinazione anti-pneumococcica nella popolazione pediatrica. È stato osservato un significativo decremento dell’incidenza di malattia dimostrando un soddisfacente livello di efficacia [27-32]. Tuttavia, l’impatto epidemiologico dei diversi sierotipi patogeni si è modificato nel tempo con un aumento relativo dei sierotipi non contenuti nel PCV10 e nel PCV13 [33-35].
Ancora una volta si è evidenziata la necessità di attivare nuove linee di sviluppo clinico al fine di avere a disposizione vaccini a spettro antigenico allargato per cercare di arginare l’impatto dei sierotipi emergenti [33-35].
Nel 2021 è stato autorizzato dall’European Agency Medicine (EMA) un vaccino coniugato 15-valente (PCV15) (sierotipi: 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F e 33F) per l’immunizzazione attiva di soggetti adulti ≥ 18 anni e nel 2022 un vaccino 20-valente (PCV20) (sierotipi: 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F e 33F) anch’esso disponibile per la popolazione adulta ≥ 18 anni [36, 37].
Considerando che la popolazione pediatrica rientra nelle categorie a elevato rischio di sviluppo di malattia da pneumococco, la ricerca si è concentrata nella conduzione di studi clinici in questa categoria di soggetti e il 15 settembre 2022 EMA ha espresso una valutazione positiva sulla possibilità di immunizzare con PCV15 i neonati, bambini e adolescenti da 6 settimane ai 18 anni di età (vedi capitolo 3).
Alla luce di questi cambiamenti è prioritario definire strategie vaccinali che offrano il massimo beneficio per ogni fascia d’età al fine di massimizzare i risultati in termini di salute, di risparmio economico e garantire un’adeguata protezione per l’intera collettività.
Poiché, il presente report di HTA ha come obiettivo principale quello di valutare l’inserimento della vaccinazione con PCV15 in un programma di immunizzazione per la popolazione pediatrica in Italia analizzandone le implicazioni sanitarie, economiche, organizzative, etiche e sociali, in questo capitolo sono analizzati nel dettaglio solo i vaccini coniugati attualmente utilizzati per questa categoria di individui (PCV10 e PCV13). Occorre sottolineare che il vaccino PPV23 pur essendo autorizzato per l’immunizzazione attiva contro l’infezione pneumococcica in soggetti di età ≥ 2 anni non è utilizzato nella pratica vaccinale di routine per la popolazione pediatrica e, pertanto, non è stato analizzato nel presente capitolo [38].
L’obiettivo di questo capitolo è fornire al lettore una overview dei dati di immunogenicità, efficacia, effectiveness e sicurezza analizzando principalmente le revisioni sistematiche e/o meta-analisi poiché esse forniscono una panoramica sugli studi sperimentali e osservazionali pubblicati e offrono il livello più alto di affidabilità dell’evidenza.
Il vaccino PCV10 è indicato per l’immunizzazione attiva contro la patologia invasiva, la polmonite e l’otite media acuta (OMA) causata da SP in neonati e bambini da 6 settimane a 5 anni d’età.
Le principali caratteristiche sono riportate in Tabella II [39].
Caratteristiche del vaccino antipneumococcico 10-valente.
| Denominazione | Vaccino pneumococcico polisaccaridico coniugato (adsorbito) |
| Composizione antigenica | Polisaccaride pneumococcico del sierotipo 1 1,2 - 1 μg |
| Polisaccaride pneumococcico del sierotipo 4 1,2 - 3 μg | |
| Polisaccaride pneumococcico del sierotipo 5 1,2 - 1 μg | |
| Polisaccaride pneumococcico del sierotipo 6B 1,2 - 1 μg | |
| Polisaccaride pneumococcico del sierotipo 7F 1,2 - 1 μg | |
| Polisaccaride pneumococcico del sierotipo 9V 1,2 - 1 μg | |
| Polisaccaride pneumococcico del sierotipo 14 1,2 - 1 μg | |
| Polisaccaride pneumococcico del sierotipo 18C 1,3 - 3 μg | |
| Polisaccaride pneumococcico del sierotipo 19F 1,4 - 3 μg | |
| Polisaccaride pneumococcico del sierotipo 23F 1,2 - 1 μg | |
| 1 Adsorbito su alluminio fosfato 0,5 milligrammi Al3+ in totale; 2 Coniugato alla proteina D (derivata da Haemophilus influenzae non tipizzabile) proteina vettrice 9-16 μg; 3 Coniugato al tossoide tetanico, proteina vettrice 5-10 μg; 4Coniugato al tossoide difterico, proteina vettrice 3-6 μg | |
| Adiuvante | Idrossido di alluminio |
| Eccipienti | Contenitori da 1 e 2 dosi: sodio cloruro e acqua per preparazioni iniettabili |
| Contenitori da 4 dosi: sodio cloruro, acqua per preparazioni iniettabili e 2-fenossietanolo | |
| Forma farmaceutica | Sospensione iniettabile (sospensione bianca torbida) |
| Indicazioni (età) | 6 settimane 5 anni |
| Posologia e modo di somministrazione | Somministrazione tramite iniezione intramuscolare. I siti preferiti sono la superficie anterolaterale della coscia nei neonati o il muscolo deltoide della parte superiore del braccio nei bambini più grandi. |
| Le modalità di immunizzazione devono basarsi sulle raccomandazioni ufficiali. | |
| Schedula primaria a tre dosi | |
| La schedula di immunizzazione raccomandata per garantire una protezione ottimale è costituita da quattro dosi, ciascuna da 0,5 ml e consiste in tre dosi con la prima dose somministrata generalmente al secondo mese di età e con un intervallo di almeno 1 mese tra le dosi. La prima dose può essere somministrata a partire da 6 settimane di età. Si raccomanda una dose di richiamo (quarta) almeno 6 mesi dopo l’ultima dose del ciclo primario; essa può essere somministrata a partire dall’età di 9 mesi (preferibilmente tra 12 e 15 mesi di età). | |
| Schedula primaria a due dosi | |
| In alternativa, quando il vaccino è somministrato nel contesto di un programma di immunizzazione dell’infanzia di routine, può essere somministrata una schedula composta da tre dosi, ciascuna da 0,5 ml. La prima dose può essere somministrata a partire da 6 settimane di età, seguita da una seconda dose da somministrarsi due mesi dopo. Una dose di richiamo (terza) è raccomandata almeno 6 mesi dopo l’ultima dose del ciclo primario; essa può essere somministrata a partire dall’età di 9 mesi (preferibilmente fra i 12 e i 15 mesi di età). | |
| Neonati e bambini di età ≥ 7 mesi che non siano stati vaccinati prima | |
| Nei neonati di età compresa tra i 7 e gli 11 mesi il ciclo di vaccinazione consiste di due dosi da 0,5 ml con un intervallo di almeno 1 mese tra le dosi. Si raccomanda una dose di richiamo (terza) nel secondo anno di vita con un intervallo di almeno 2 mesi dopo l’ultima dose primaria. | |
| Nei bambini di età compresa tra 12 mesi e 5 anni: il ciclo di vaccinazione consiste di due dosi da 0,5 ml con un intervallo di almeno 2 mesi tra le dosi. | |
| Neonati prematuri nati tra la 27a a la 36a settimana di gestazione | |
| Nei neonati prematuri nati dopo almeno 27 settimane di gestazione, la serie di immunizzazione raccomandata consiste in quattro dosi, ciascuna da 0,5 ml. La serie primaria neonatale consiste in tre dosi, con la prima dose somministrata al secondo mese di vita e con un intervallo di almeno 1 mese tra le dosi. Una dose di richiamo (quarta) è raccomandata almeno 6 mesi dopo l’ultima dose del ciclo primario. | |
| Popolazioni speciali | |
| In soggetti con condizioni sottostanti che aumentano il rischio di malattia pneumococcica invasiva [infezione da Virus dell’Immunodeficienza Umana (HIV), l’anemia falciforme o la disfunzione splenica], il vaccino può essere somministrato secondo i cicli di vaccinazione sopra riportati a eccezione dei bambini che inizino il ciclo vaccinale tra le 6 settimane e i 6 mesi di età ai quali deve essere somministrato un ciclo primario a 3 dosi. | |
| Controindicazioni | Ipersensibilità ai principi attivi o a uno qualsiasi degli eccipienti o a una qualsiasi delle proteine vettrici. |
| Come per altri vaccini, la somministrazione del vaccino deve essere rimandata nei soggetti con malattie febbrili acute gravi. Tuttavia, la presenza di una infezione minore, come un raffreddore, non deve far rinviare la vaccinazione. | |
| Interazioni con altri medicinali | Il vaccino può essere somministrato in concomitanza con uno qualsiasi dei seguenti vaccini monovalenti o combinati [incluso DTPa-HBV-IPV/Hib e DTPw-HBV/Hib]: vaccino pertossico difterico-tetanico-acellulare (DTPa), vaccino per l’epatite B (HBV), vaccino polio inattivato (IPV), vaccino Haemophilus influenzae di tipo b (Hib), vaccino pertossico difterico-tetanico a cellula intera (DTPw), vaccino morbillo-parotite-rosolia (MMR), vaccino per la varicella (V), vaccino meningococcico sierogruppo C coniugato (CRM197 e coniugati TT), vaccino coniugato meningococcico gruppi A,C,W-135,Y (TT coniugato), vaccino polio orale (OPV) e vaccino rotavirus orale. |
| Vaccini iniettabili differenti devono essere sempre somministrati in siti di iniezione diversi. |
Il vaccino PCV13 è indicato per l’immunizzazione contro la patologia invasiva, la polmonite e l’OMA causate da SP in neonati, bambini e adolescenti di età compresa tra 6 settimane e 17 anni. Inoltre, è indicato per l’immunizzazione attiva per la prevenzione di patologia invasiva e di polmonite causata da SP in soggetti di età ≥ 18 anni e anziani.
Le principali caratteristiche sono riportate in Tabella III [40].
Caratteristiche del vaccino anti-pneumococco 13-valente.
| Denominazione | Vaccino pneumococcico polisaccaridico coniugato (13 valente adsorbito) |
| Composizione antigenica | Polisaccaride pneumococcico sierotipo1 1 |
| Polisaccaride pneumococcico sierotipo 3 1 | |
| Polisaccaride pneumococcico sierotipo 4 1 | |
| Polisaccaride pneumococcico sierotipo 5 1 | |
| Polisaccaride pneumococcico sierotipo 6A 1 | |
| Polisaccaride pneumococcico sierotipo 6B 1 | |
| Polisaccaride pneumococcico sierotipo 7F 1 | |
| Polisaccaride pneumococcico sierotipo 9V 1 | |
| Polisaccaride pneumococcico sierotipo 14 1 | |
| Polisaccaride pneumococcico sierotipo 18C 1 | |
| Polisaccaride pneumococcico sierotipo 19A 1 | |
| Polisaccaride pneumococcico sierotipo 19F 1 | |
| Polisaccaride pneumococcico sierotipo 23F 1 | |
| 1 Coniugato alla proteina vettrice CRM197, adsorbito su fosfato di alluminio. 1 dose (0,5 ml) contiene circa 32 μg di proteina vettrice CRM197 e 0,125 mg di alluminio. | |
| Adiuvante | Alluminio |
| Eccipienti | Sodio cloruro |
| Acido succinico | |
| Polisorbato 80 | |
| Acqua per preparazioni iniettabili. | |
| Forma farmaceutica | Sospensione iniettabile (sospensione bianca omogenea) |
| Indicazioni (età) | Neonati, bambini e adolescenti di età compresa tra 6 settimane e 17 anni. |
| Soggetti adulti di età ≥ 18 anni e anziani. | |
| Posologia e modo di somministrazione | Il vaccino deve essere somministrato per iniezione intramuscolare. I siti preferiti sono la superficie anterolaterale della coscia (muscolo vasto laterale) nei neonati, oppure il muscolo deltoide del braccio nei bambini e negli adulti. |
| Le modalità di immunizzazione devono basarsi sulle raccomandazioni ufficiali. | |
| Neonati di età compresa tra 6 settimane e 6 mesi | |
| Schedula primaria a 3 dosi | |
| La schedula di immunizzazione raccomandata consiste di quattro dosi, ciascuna da 0,5 ml. | |
| Il ciclo primario consiste di tre dosi, con la prima dose somministrata generalmente al 2° mese e con un intervallo di almeno 1 mese tra le dosi. La prima dose può essere somministrata anche a sei settimane di vita. La quarta dose (richiamo) è raccomandata tra gli 11 e i 15 mesi. | |
| Schedula primaria a 2 dosi | |
| Quando il vaccino è somministrato come parte di un programma di immunizzazione pediatrica di routine, può essere somministrato un ciclo primario a due dosi. La prima dose può essere somministrata a partire dai 2 mesi di vita, con una seconda dose due mesi dopo. La terza dose (richiamo) è raccomandata tra gli 11 e 15 mesi. | |
| Neonati pretermine (< 37 settimane di gestazione) | |
| Nei neonati pretermine, la schedula di immunizzazione raccomandata consiste di quattro dosi. Il ciclo primario consiste di tre dosi, con la prima dose somministrata a 2 mesi di età e con un intervallo di almeno 1 mese tra le dosi. La prima dose può essere somministrata già a sei settimane di età. La quarta dose (richiamo) è raccomandata tra gli 11 e i 15 mesi di età. | |
| Bambini e neonati non precedentemente vaccinati di età ≥ 7 mesi | |
| Due dosi con un intervallo di almeno 1 mese tra le dosi. Una terza dose è raccomandata durante il secondo anno di vita. | |
| Bambini di età compresa tra 12 e 23 mesi. | |
| Due dosi con un intervallo di almeno 2 mesi tra le dosi. | |
| Bambini e adolescenti di età compresa tra 2 e 17 anni | |
| Una dose singola. | |
| Adulti di età ≥ 18 anni e anziani | |
| Una singola dose. | |
| Popolazioni speciali | |
| Gli individui affetti da condizioni concomitanti che li predispongono a malattia pneumococcica (quali quelli affetti da anemia a cellule falciformi o infezione da HIV), compresi quelli precedentemente vaccinati con una o più dosi di vaccino PPV23-valente, possono ricevere almeno una dose di PCV13. Negli individui con trapianto di cellule staminali ematopoietiche (HSCT) la serie di immunizzazione raccomandata consiste di quattro dosi. Il ciclo primario consiste di tre dosi, la prima somministrata da 3 a 6 mesi dopo l’HSCT e con un intervallo di almeno 1 mese tra una dose e l’altra. A 6 mesi dalla terza dose si raccomanda la somministrazione di una quarta dose (richiamo). | |
| Controindicazioni | Ipersensibilità ai principi attivi o a uno qualsiasi degli eccipienti presente nel vaccino, o al tossoide difterico. Come con gli altri vaccini, nei soggetti che sono affetti da uno stato febbrile acuto grave la somministrazione del vaccino deve essere rimandata. Comunque, la presenza di una infezione minore, così come un raffreddore, non deve comportare il ritardo della vaccinazione. |
| Interazioni con altri medicinali | Neonati e bambini di età compresa tra 6 settimane e 5 anni. |
| PCV13 può essere somministrato contemporaneamente a uno qualsiasi dei seguenti vaccini sia come vaccini monovalenti o in combinazione: difterite, tetano, pertosse acellulare o a cellule intere, Haemophilus influenzae tipo b, antipolio inattivato, epatite B, meningococco sierogruppo C, morbillo, parotite, rosolia, varicella e vaccino rotavirus. Tra i 12 e i 23 mesi di vita, PCV13 può essere somministrato contemporaneamente al vaccino meningococcico polisaccaridico quadrivalente (ACWY) coniugato con il tossoide tetanico a bambini che abbiano ricevuto un’adeguata immunizzazione primaria con PCV13. | |
| Per i bambini e adolescenti di età compresa tra 6 e 17 anni al momento non sono disponibili dati relativi all’uso concomitante con altri vaccini. | |
| Per gli adulti di età compresa tra 18 e 49 anni non sono disponibili dati relativi all’uso concomitante con altri vaccini. | |
| Per i soggetti di età ≥ 50 anni il vaccino può essere co-somministrato con il vaccino influenzale stagionale. |
L'attuale PNPV 2017-19 [41] raccomanda la somministrazione del PCV13 a partire dal 61° giorno di vita con la schedula 2 + 1 con le dosi somministrate al 3°, 5° e 11°/13° mese di vita. L’immunizzazione con PCV13 può avvenire in co-somministrazione con il vaccino esavalente (DTaP-IPV-HepB-Hib, difterite, tetano, pertosse acellulare, poliomielite inattivato, epatite B, emofilo B). Nei bambini di età compresa tra 12 e 23 mesi mai vaccinati sono previste 2 dosi con intervallo ≥ 2 mesi, mentre per i bambini di età ≥ 2 anni la vaccinazione è eseguita in singola dose. Inoltre, 4 dosi di PCV13 (somministrati al 3°, 4°, 5° e 11°/13°) sono raccomandate nei neonati prematuri.
Sono state valutate criticamente le revisioni sistematiche e/o meta-analisi sui vaccini anti-pneumococco coniugati attualmente approvati e commercializzati in Italia per la popolazione pediatrica al fine di fornire una overview sulle evidenze disponibili. Tale metodo di lavoro è ampiamente usato nel campo dell’evidence-based medicine dato il numero sempre maggiore di revisioni sistematiche pubblicate e considerando che esse rappresentano il più alto livello di evidenza.
Al fine di reperire gli articoli di interesse è stata condotta una ricerca automatica sulla piattaforma OVID (https://ovidsp.ovid.com/) considerando le seguenti banche dati: Medline, Biological Abstracts e Global Health. Per la ricerca sono state costruite due stringhe di ricerca, descritte in Tabella IV, comprendenti una combinazione di termini MeSH (Medical Subject Headings) e parole chiave.
Stringhe utilizzate per la ricerca automatica nella piattaforma OVID per i vaccini PCV10 e PCV13.
| # | Script (PCV13) |
|---|---|
| 1 | (PCV13 or PCV-13 or Prevenar13 or Prevenar 13).mp. |
| 2 | (13 valent Pneumococcal Conjugate Vaccine or 13valent Pneumococcal Conjugate Vaccine).mp. |
| 3 | ((13 valent or 13valent) and (pneumococc* adj3 conjugate* adj3 vaccin*)).ab. |
| 4 | or/1-3 |
| 5 | Exp Child/ or exp infant/ or adolescent/ or exp pediatrics/ or child, abandoned/ or exp child, exceptional/ or child, orphaned/ or child, unwanted/ or minors/ or (pediatric* or paediatric* or child* or newborn* or congenital* or infan* or baby or babies or neonat* or pre-term or preterm* or premature birth* or NICU or preschool* or pre-school* or kindergarten* or kindergarden* or elementary school* or nursery school* or (day care* not adult*) or schoolchild* or toddler* or boy or boys or girl* or middle school* or pubescen* or juvenile* or teen* or youth* or high school* or adolesc* or pre-pubesc* or prepubesc*).mp. or (child* or adolesc* or pediat* or paediat*).jn. |
| 6 | 4 and 5 |
| 7 | (systematic review or meta analysis).mp. |
| 8 | 6 and 7 |
| 9 | remove duplicates from 8 |
| # | Script (PCV10) |
| 1 | (PCV10 or PCV-10 or Synflorix).mp. |
| 2 | (10 valent Pneumococcal Conjugate Vaccine or 10valent Pneumococcal Conjugate Vaccine).mp. |
| 3 | ((10 valent or 10valent) and (pneumococc* adj3 conjugate* adj3 vaccin*)).ab. or/1-3 |
| 4 | or/1-3 |
| 5 | Exp Child/ or exp infant/ or adolescent/ or exp pediatrics/ or child, abandoned/ or exp child, exceptional/ or child, orphaned/ or child, unwanted/ or minors/ or (pediatric* or paediatric* or child* or newborn* or congenital* or infan* or baby or babies or neonat* or pre-term or preterm* or premature birth* or NICU or preschool* or pre-school* or kindergarten* or kindergarden* or elementary school* or nursery school* or (day care* not adult*) or schoolchild* or toddler* or boy or boys or girl* or middle school* or pubescen* or juvenile* or teen* or youth* or high school* or adolesc* or pre-pubesc* or prepubesc*).mp. or (child* or adolesc* or pediat* or paediat*).jn. |
| 6 | 4 and 5 |
| 7 | (systematic review or meta analysis).mp. |
| 8 | 6 and 7 |
| 9 | or/1-3 |
Alla ricerca automatica è seguita una valutazione di idoneità dei prodotti individuati al fine di escludere i manoscritti duplicati e quelli identificati in entrambe le strategie di ricerca. In seguito, sono stati valutati i titoli e gli abstract e i manoscritti ritenuti potenzialmente eleggibili sono stati scaricati e valutati in extenso considerando i criteri di inclusione ed esclusione. Dopo la fase di screening i manoscritti ritenuti non conformi con l’obiettivo del presente capitolo e, non in linea, con il report globale di HTA sono stati esclusi. La ricerca automatica è stata completata con quella manuale, esaminando le bibliografie dei lavori inclusi.
Sono stati considerati i seguenti criteri di inclusione:
individui di età compresa tra ≥ 6 settimane - 18 anni;
immunizzazione con PCV10 o PCV13 autorizzati in Italia;
revisioni sistematiche e revisioni sistematiche con meta-analisi;
dati di immunogenicità, efficacia, efficacia sul campo (effectiveness), sicurezza e tollerabilità.
Se soddisfatti i criteri di inclusione il solo criterio di esclusione era una popolazione mista (bambini e adulti) senza stratificazione per fasce d’età.
Gli outcomes di interesse hanno incluso i domini di immunogenicità, efficacia, efficacia sul campo (effectiveness) e sicurezza.
La protezione contro le infezioni pneumococciche è mediata dall’azione concertata di anticorpi e componenti del complemento che opsonizzano i batteri per la fagocitosi. Di conseguenza, i vaccini anti-pneumococco coniugati sono autorizzati in seguito alla dimostrazione della loro capacità di indurre una risposta immunitaria ritenuta protettiva nei confronti della malattia (correlati di protezione) [42, 43].
Sono disponibili diversi metodi di laboratorio capaci di misure la quantità e l’attività funzionale degli anticorpi acquisiti dopo vaccinazione.
Come precedentemente descritto la protezione verso la malattia pneumococcica è correlata agli anticorpi anti-capsulari che possono essere misurati tramite diversi test di laboratorio. Dati di letteratura riportano che l’immuno-saggio di elettrochemiluminiscenza (ECL, ImmunoChemoLuminescence Assay) è il test maggiormente utilizzato per quantificare la concentrazione sierotipo specifica di IgG totali. La concentrazione di IgG totali ≥ 0,35 μg/ml è universalmente accettata come un correlato di protezione [42-44] e la quantificazione della percentuale degli individui immunizzati che raggiungono tale concentrazione è raccomandata dall’Organizzazione Mondiale della Sanità (OMS) e da altri Enti regolatori [45].
Inoltre, la risposta immune funzionale ovvero la capacità degli anticorpi di promuovere la fagocitosi può essere misurata tramite i saggi di opsonofagocitosi (OpsonoPhagocytosis Assay, OPA), capaci di misurare gli anticorpi in grado di opsonizzare i polisaccaridi capsulari, favorendo la fagocitosi. Il titolo anticorpale OPA è il reciproco della più elevata diluizione sierica in grado di ridurre la sopravvivenza del batterio di ≥ 50% [42, 44].
Poiché l’OMS raccomanda [45] che sia le IgG totali sia gli anticorpi opsonizzanti debbano essere misurati, per una valutazione critica dei dati estrapolati dai manoscritti considerati nella presente overview sono stati considerati i seguenti parametri: concentrazione media geometrica (Geometric Mean Concentration, GMC) o titolo medio geometrico (Geometric Mean Titer, GMT) di anticorpi sierotipo specifici; percentuale dei soggetti ritenuti sieroprotetti, ovvero quelli che raggiungono la concentrazione di IgG totali ≥ 0,35 μg/ml.
L’immunogenicità è stata suddivisa in assoluta e relativa.
L’immunogenicità assoluta è definita come la capacità del vaccino oggetto di studio di stimolare una risposta immunitaria rispetto alla non vaccinazione o a un trattamento non attivo (placebo o vaccini verso altri patogeni).
L’immunogenicità relativa è definita come la capacità del vaccino in studio di stimolare la risposta immunitaria rispetto a quella indotta da altri vaccini anti-pneumococco.
La protezione indotta dai vaccini può essere misurata, quantificando l’efficacia teorica definita come riduzione del rischio di eventi correlati all’infezione da pneumococco grazie alla vaccinazione in condizioni “ideali” come nel caso degli studi clinici controllati.
È stata considerata sia l’efficacia teorica assoluta che corrisponde alla riduzione degli eventi potenzialmente riconducibili all’infezione da pneumococco nei soggetti vaccinati rispetto a quelli non immunizzati sia quella relativa che valuta la riduzione degli eventi potenzialmente riconducibili all’infezione da pneumococco nei soggetti vaccinati con il vaccino di interesse rispetto ai soggetti immunizzati con un altro vaccino anti-pneumococco. Poiché la protezione indotta dai vaccini è sierotipica, l’efficacia è valutata verso i sierotipi contenuti nel vaccino oggetto di studio. Sono stati considerati diversi outcomes associati a malattia invasiva e non invasiva da pneumococco.
L’efficacia sul campo o effectiveness è definita come riduzione del rischio di eventi correlati all’infezione da pneumococco grazie alla vaccinazione in condizioni “del mondo reale” ovvero l’acquisizione di evidenza acquisita attraverso la conduzione di studi osservazionali (disegno caso-controllo e di coorte). Come per l’efficacia è stata considerata sia l’effectiveness assoluta che quella relativa. Sono stati considerati diversi esiti potenzialmente riconducibili all’infezione da pneumococco suddivisi in invasivi e non invasivi. Nel calcolo dell’effectiveness i bias riconducibili alle numerose variabili presenti nel mondo reale devono essere considerati.
Per il dominio di sicurezza e tollerabilità sono stati considerati i dati provenienti dagli studi clinici randomizzati e dagli studi osservazionali. Generalmente negli studi clinici sperimentali sono valutati sia gli eventi avversi (AE) sollecitati ovvero raccolti in modo “attivo”, tipicamente nelle due settimane successive alla vaccinazione) sia quelli non sollecitati (passivi) segnalati spontaneamente in un intervallo temporale più lungo e comprendono eventi avversi (AE) locali (arrossamento, gonfiore, indurimento, dolore/dolorabilità) e sistemici [febbre/febbricola, brividi, affaticamento/malessere generale, mal di testa, nausea, vomito, diarrea, inappetenza, insonnia/irritabilità/modifica del comportamento alimentare (per la popolazione pediatrica)]. Generalmente gli AE sono classificati in base alla gravità (da lieve a grave). Inoltre, nei clinical trial sono monitorati gli eventi avversi significativi e gli eventi avversi gravi (SAE) per l’intera durata dello studio.
Sono stati anche considerati i dati di sicurezza riferiti all’utilizzo dei vaccini anti-pneumococco coniugati nella pratica di immunizzazione di routine.
La ricerca automatica eseguita con il primo algoritmo di ricerca riferito al vaccino PCV13 ha individuato 86 manoscritti mentre la seconda ricerca ha restituito 53 articoli (vaccino PCV10). Come precedentemente descritto, inizialmente sono stati rimossi i manoscritti duplicati e quelli identificati in entrambe le strategie di ricerca. Successivamente 42 manoscritti sono stati considerati per la fase di screening e, pertanto, valutati i titoli e gli abstract. Di questi, 18 manoscritti sono risultati idonei poiché rispettavano i criteri di inclusione e, pertanto, considerati nella presente overview [30, 31, 46-61].
Gli articoli inclusi sono riportati in Tabella V dove sono descritte le principali caratteristiche.
Caratteristiche principali dei manoscritti inclusi nella presente overview.
| Autore | Outocome considerato | Studi inclusi revisione sistematica | Tipologia di studi considerati | Età dei soggetti | Paesi | Vaccini |
|---|---|---|---|---|---|---|
| Alicino C et al. 2017 [30] | Impatto sulla riduzione dei ricoveri per polmonite | 49 | Analisi di serie storiche e studi pre-post vaccinazione | < 2 anni | Europa, Nord e Sud America | PCV10 PCV13 |
| Marra LP et al. 2022 [31] | Effectiveness dei vaccini pneumococcici sulla prevenzione dell’otite media e dell’otite media acuta | 48 | Studi osservazionali | < 60 mesi | Africa, America, Europa, Asia | PCV7 PCV10 PCV13 PPV23 |
| Ruiz-Aragón J et al. 2013 [46] | Immunogenicità e sicurezza PCV13 | 9 | Studi clinici controllati | < 3 mesi | America, Europa, India | PCV13 |
| Ciapponi A et al. 2016 [47] | Risposta anticorpale, rapporto costo-efficacia ed efficacia dell’interscambiabilità dei PCV e programmi di vaccinazione nella popolazione pediatrica | 46 | Studi clinici controllati | < 6 mesi | Africa, America, Asia, Europa, Oceania | PCV7 PCV10 PCV13 |
| Choe YJ et al. 2020 [48] | Valutazione della differenza delle risposte anticorpali dopo serie primaria di PCV in relazione alle diverse regioni geografiche | 69 | Studi clinici controllati | < 6 mesi | Africa, America, Europa, Asia | PCV7 PCV10 PCV13 |
| Izurieta P et al. 2022 [49] | Efficacia, effectiveness e impatto di PCV10 e PCV13 nella prevenzione dell’otite media | 33 | Studi clinici controllati, studi di coorte | < 2 anni | Europa, Nord e Sud America | PCV10 PCV13 |
| de Sevaux JL et al [50] | Valutazione dell’effetto dei PCV nella prevenzione delle otiti medie | 15 | Studi clinici controllati | < 12 anni | Nord e Sud America | PCV7 PCV10 |
| Berman-Rosa M et al. 2020 [51] | Effectiveness di PCV13 e PCV10 sulla prevenzione delle MIP e dell’otite media acuta | 19 | Studi osservazionali (caso-controllo, di coorte) | ≤ 5 anni | Europa, Nord, Centro e Sud America, Asia | PCV10 PCV13 |
| Sings HL et al. 2019 [52] | Effectiveness nella prevenzione di MIP da sierotipo 3 | 8 | Studi di coorte, studi caso-controllo | < 5 anni | Europa, Nord e Sud America, Asia, Australia | PCV13 |
| Tin Tin Htar M et al. 2019 [53] | Impatto comparativo dei vaccini pneumococcici coniugati | 25 | Studi osservazionali, sorveglianze | Bambini e adulti | America, Europa | PCV10 PCV13 |
| de Oliveira LH et al. 2016 [54] | Impatto o effectiveness dei PCV su decessi o ricoveri per MIP, polmonite, meningite e sepsi | 22 | Studi caso controllo, coorte, studi pre-post vaccinazione | < 5 anni | Centro e Sud America | PCV10 PCV13 |
| Oligbu G et al. 2016 [55] | Valutazione della schedula vaccinale, dei fattori di rischio, della distribuzione del sierotipo, della presentazione clinica sugli gli esiti del fallimento vaccinale | 20 | Studi caso controllo, coorte, studi pre-post vaccinazione | ≤ 5 anni | Australia, Nord America, Europa | PCV7 PCV9 PCV10 PCV13 |
| Mungall BA et al. 2022 [56] | Fallimento e breakthrough vaccinale relativamente a MIP | 26 | Sorveglianze nazionali, studi osservazionali (caso-controllo, di coorte) | < 17 anni | Europa, Nord, Sud America, Asia | PCV7 PCV10 PCV13 |
| Onwuchekwa C et al. 2020 [57] | Impatto di PCV10 e PCV13 nella prevenzione delle polmoniti | 8 | Studi caso controllo, studi pre-post vaccinazione | < 60 mesi | Africa | PCV10 PCV13 |
| Thompson A et al. 2013 [58] | Sicurezza del PCV13 rispetto a PCV7 | 13 | Studi clinici controllati | < 15 mesi | Nord America, Europa, Asia | PCV7 PCV13 |
| Shiri T et al. 2017 [59] | Effetti indiretti dei PCV sulle MIP | 70 | Studi osservazionali e quasi sperimentali | < 5 anni | Europa, Nord e Sud America, Asia, Australia | PCV7 PCV13 |
| Boef AGC et al 2017 [60] | Valutazione delle differenze nelle risposte IgG per sesso dei PCV | 6 | Studi clinici controllati | 2, 3, 4 e 11 mesi | Europa | PCV7 PCV10 PCV13 |
| Koufoglou E et al [61] | Valutazione dell’effetto profilattico degli antipiretici sull’immunorisposta determinata dai PCV | 5 | Studi clinici controllati | < 4 anni | Europa | PCV7 PCV10 PCV13 |
Nel 2017 è stata pubblicata una meta-analisi da Ruiz-Aragón et al., eseguita in accordo con la linea guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses), finalizzata a valutare l’immunogenicità dei vaccini pneumococcici coniugati 13-valenti nei neonati [46]. Gli autori hanno interrogato banche dati elettroniche e riviste specializzate e hanno effettuato una ricerca manuale degli studi clinici controllati condotti in bambini immunizzati con PCV13 per comparare i risultati con i dati ottenuti in studi che hanno analizzato il vaccino coniugato 7-valente. In totale, i ricercatori hanno incluso nove studi clinici randomizzati classificati di qualità alta-moderata. I risultati hanno evidenziato un’elevata immunogenicità per entrambi i vaccini pneumococcici per tutti i sierotipi testati. Infatti, è stata riscontrata una concentrazione di anticorpi anti-polisaccaridi ≥ 0,35 μg/ml in almeno l’89% dei bambini. Nel dettaglio, per i sierotipi 4, 6B, 9V, 14, 18C, 19F, 23F la percentuale di neonati che hanno raggiunto una concentrazione anticorpale ≥ 0,35 μg/ml era > 94% nel gruppo vaccinato con PCV13, a eccezione di sierotipo 6B (89%). Nel gruppo immunizzato con PCV7, gli autori hanno riportato che più del 94% dei bambini aveva raggiunto una concentrazione anticorpale ≥ 0,35 μg/ml per i sierotipi 9V, 14, 18C e 19F. Da segnalare che non sono state riscontrate differenze statisticamente significative tra i gruppi per nessuno dei sierotipi comuni. Inoltre, per i sei sierotipi aggiuntivi esclusivi del PCV13, la percentuale dei responder era > 93% per tutti i sierotipi a eccezione del sierotipo 3 per il quale è stato osservato un valore inferiore (88%). Nel gruppo immunizzato con il vaccino PCV7, i risultati per i sierotipi 19A e 6A erano rispettivamente dell’82,4 e del 39%. Inoltre, per ciascuno dei sierotipi aggiuntivi le differenze nella sieropositività erano sempre statisticamente significative a favore del PCV13.
La revisione sistematica condotta da Ciapponi et al. [47] aveva l’obiettivo di valutare l’immunogenicità correlata all’interscambiabilità tra i vaccini pneumococcici coniugati nei programmi di vaccinazione della popolazione pediatrica nel periodo dicembre 2010 - aprile 2015. A tal fine i ricercatori hanno interrogato le banche dati Medline, Embase, Lilacs e Cochrane Central Register of Controlled Trials. Inoltre, sono stati ricercati report anche in siti web e database a cura di società scientifiche, associazioni ed esperti così come atti congressuali e tesi di dottorato. Non è stata applicata alcuna restrizione linguistica o temporale. In particolare, sono stati inclusi studi controllati randomizzati che hanno valutato la risposta anticorpale, e l’efficacia dell’intercambiabilità dei PCV. In totale, sono stati inclusi quarantasei studi dei 202 precedentemente identificati; nessuno studio riportava dati diretti sull’intercambiabilità tra i due vaccini considerati (PCV10 e PCV13). Relativamente all’immunogenicità comparata tra il PCV10 e il PCV7, gli autori hanno incluso 4 studi. In particolare, il ciclo vaccinale a tre dosi ha mostrato elicitare una forte risposta immunitaria per entrambi i vaccini PCV10 e PCV7 [62] ed escludendo i sierotipi 1, 5 e 7F (presente solo nel preparato PCV10), la percentuale di soggetti con una concentrazione anticorpale di ≥ 0,2 μg/ml e titoli anticorpali OPA ≥ 8 Dil [dilution of serum (opsonic titer)] per i sette sierotipi comuni, era simile in entrambi i gruppi di studio. Analogamente, in uno studio condotto in Polonia, sono stati osservati valori simili per 5 dei 7 sierotipi comuni, tuttavia, i soggetti immunizzati con PCV10 presentavano percentuali di anticorpi inferiori per i sierotipi 6B e 23F, maggiore positività di anticorpi OPA per il sierotipo 19F e positività OPA inferiore per il sierotipo 23F. Inoltre, Vesikari et al. [63] hanno osservato che più del 95,4% dei soggetti vaccinati con PCV10 aveva concentrazioni anticorpali di 0,2 μg/ml per 8 dei 10 sierotipi, mentre il 94,1% dei soggetti immunizzati con PCV7 aveva concentrazioni anticorpali di 0,2 μg/ml per 3 dei 7 sierotipi. Più del 90% dei soggetti vaccinati con PCV10 aveva titoli OPA ≥ 8 Dil per 8 sierotipi su 10 e oltre il 92,1% dei soggetti con PCV7 aveva titoli OPA ≥ 8 Dil per 4 sierotipi su 7. Inoltre, gli autori [47] hanno evidenziato un calo delle concentrazioni anticorpali e dei titoli OPA in entrambi i gruppi di studio nel periodo di tempo compreso tra il completamento del ciclo primario e la somministrazione della dose booster. Tuttavia, 1 mese dopo la dose di richiamo, gli anticorpi dei soggetti immunizzati con PCV10 aumentavano da 6,0 a 16,7 volte e gli anticorpi prodotti dal PCV7 incrementavano da 8,8 a 27,8 volte paragonati ai livelli misurati prima della dose booster. Più del 96% di tutti i soggetti presentava concentrazioni anticorpali di ≥ 0,2 μg/ml per i sette sierotipi comuni e oltre il 99% dei soggetti immunizzati con PCV10 presentava concentrazioni anticorpali ≥ 0,2 μg/ml contro i tre sierotipi aggiuntivi. Più del 94,9% dei soggetti vaccinati con PCV10 e 92,5% dei soggetti immunizzati con PCV7 avevano titoli OPA ≥ 8 Dil per i sierotipi condivisi. Wysocki et al. [64] hanno valutato nella loro ricerca per ogni singolo sierotipo la percentuale di soggetti con concentrazioni di anticorpi > 0,2 μg/ml e > 0,35 μg/ml (metodologia di laboratorio: test ELISA), i titoli GMC e la percentuale di soggetti con titoli OPA ≥ 8. Lo studio prevedeva la co-somministrazione con altre vaccinazioni pediatriche di routine. I ricercatori hanno osservato concentrazioni anticorpali ≥ 0,2 μg/ml e sieropositività OPA ≥ 8 per tutti i sierotipi (> 92%), evidenziando il buon profilo di immunogenicità del vaccino PCV10. In un altro lavoro è stato osservato che per i sierotipi 1, 5 e 7F, coperti dal PCV10, il 90% dei soggetti vaccinati con PCV10 presentava concentrazioni anticorpali di ≥ 0,2 μg/ml e titoli OPA ≥ 8 Dil e la vaccinazione booster induceva risposte immunitarie robuste in tutti i gruppi di studio [gruppo di studio nelle Filippine (schedula 6, 10, 14 settimane) e gruppo di studio in Polonia (2, 4, 6 mesi)] [65].
Un’altra revisione sistematica e meta-analisi [48] ha esaminato la differenza nella risposta anticorpale dopo cicli primari con vaccini anti-pneumococco coniugati in neonati, valutando eventuali variazioni a seconda dell’appartenenza a una specifica regione geografica. La ricerca bibliografica iniziale ha prodotto un totale di 549 manoscritti successivamente ridotti a 175 dopo la valutazione di titolo e abstract, 93 dei quali sono stati selezionati per la revisione del testo completo. Un totale di 69 studi è stato investigato; il maggior numero di studi proveniva dagli Stati Uniti, a seguire dalla Polonia e dal Regno Unito. Gli autori hanno evidenziato che gli studi condotti nella regione del Pacifico occidentale (WPR) riportavano valori di GMC anticorpali più elevati rispetto agli studi condotti in Europa. Il pool GMC per il sierotipo 4 dopo tre dosi di PCV7 era di 5,19 μg/ml (IC 95%: 4,85-5,53 μg/ml) nelle Regioni del Pacifico occidentale, mentre per gli studi condotti in Europa il valore si assestava a 2,01 μg/ml (IC 95%: 1,88-2,14 mg/ml). I rapporti GMC delle IgG variavano da 1,51 a 2,87 per PCV7, da 1,69 a 3,22 per PCV10 e da 1,49 a 3,08 per PCV13 rispettivamente negli studi condotti nelle regioni WPR rispetto a quelli svolti dei Paesi europei. In sintesi, è stato riscontrato che l’immunogenicità suscitata dal ciclo primario di PCV era generalmente più alta nei Paesi del WPR, SEA (Southeast Asia Countries) e Africa rispetto ai Paesi del continente americano e dell’Europa per la maggior parte dei sierotipi valutati. I dati hanno mostrato risultati simili a un precedente studio, che aveva valutato l’impatto dell’appartenenza a una determinata area geografica, in termini di GMC. Gli autori della revisione sistematica [48] hanno concluso che gli studi condotti nelle Regioni del Pacifico occidentale hanno generalmente osservato risposte anticorpali maggiori rispetto a quelli condotti in Europa. Le differenze tra le regioni geografiche sottolineano il fatto che è rilevante investigare i fattori biologici che contribuiscono a determinare la risposta immunitaria e che possono influenzare i calendari e i programmi vaccinali.
Boef AGC et al. [60] hanno analizzato sistematicamente gli studi condotti nei Paesi Bassi per valutare le differenze nelle risposte IgG per sesso a seguito della vaccinazione dell’infanzia. Oltre a stimare l’impatto di potenziali differenze nelle risposte anticorpali “IgG”, sono state esplorate le differenze di sesso nel fallimento/efficacia del vaccino e nella reattogenicità. Sono stati inclusi sei studi con misurazioni di IgG effettuate su 1577 bambini immunizzati con PCV7/ PCV10/PCV13 e/o DTaP-IPV-Hib(-HepB) o il richiamo in età prescolare DTaP-IPV. A tal riguardo è stata eseguita una meta-analisi relativa all’effetto del sesso sui livelli di IgG contro i diversi sierotipi di SP, il tossoide difterico, il tossoide tetanico, la pertactina pertussica (Ptx/FHA/Prn) e il polisaccaride capsulare purificato (poliribosilribitolo fosfato, PRP) di Haemophilus influenzae di tipo b (Hib-PRP) utilizzando modelli misti lineari. Per la vaccinazione pneumococcica, il rapporto di concentrazione della media geometrica dei livelli di IgG nei soggetti di sesso femminile rispetto a quelli di sesso maschile nei diversi sierotipi era 1,15 (IC 95%: 0,91-1,45) 1 mese dopo il ciclo primario, 1,16 (IC 95%: 1,02-1,32) all’età di 8 mesi, 1,12 (IC 95%: 1,02-1,23) prima del richiamo (11 mesi di età) e 0,99 (IC 95%: 0,89-1,10) dopo il richiamo (12 mesi di età). Non sono state trovate differenze per sesso nella reattogenicità all’età di 4 o 11 mesi o in caso di fallimento/efficacia del vaccino per MIP, malattia invasiva da Hib o pertosse. La proporzione di maschi e femmine che raggiungevano livelli di IgG ≥ 0,35 μg/ml generalmente non mostrava alcuna differenza tra i sessi, o talvolta era osservata una minima differenza a favore del sesso femminile. Da evidenziare che i livelli di IgG ≥ 0,35 μg/ml erano molto alti a un mese dal ciclo primario di vaccinazione e, in particolare, 1 mese dopo la vaccinazione di richiamo. Le differenze erano più marcate prima della vaccinazione di richiamo con valori compresi tra > 9,0% (IC 95%: 2,4-15,7) nelle femmine per il sierotipo 23F e 1,3% (IC 95%: 1,8-4,3) nei maschi per il sierotipo 7F. Inoltre, dei 20 casi di MIP di tipo vaccinale nei bambini con età pari o superiore a 4 mesi, 13 erano maschi (65%) e sette erano femmine (35%). La percentuale di fallimento del vaccino tra i casi era del 62% nei maschi (8/13 casi) e del 100% nelle femmine (7/7 casi) (p = 0,058). Pertanto, nonostante i livelli di IgG fossero più elevati nelle femmine rispetto ai maschi prima della dose booster a 11 mesi, la percentuale osservata di fallimento non era inferiore nelle femmine. In particolare, dei 392 casi di casi di MIP di tipo non vaccinale tra i bambini, idonei alla vaccinazione con età ≥ a 4 mesi, 246 erano maschi (62,8%) e 146 erano femmine (37,2%). In particolare, il 92,9% (224/241) dei maschi e il 96,5% (137/142) delle femmine erano stati vaccinati (p = 0,151). Utilizzando i casi di MIP di tipo non vaccinale come controlli, l’efficacia osservata era del 88% nei maschi (IC 95%: 47-97%), mentre non poteva essere calcolata nelle femmine. In conclusione, Boef et al. [60] hanno osservato livelli superiori di IgG anti-pneumococco nelle femmine rispetto ai maschi dopo il ciclo primario, tale trend è stato evidenziato anche dopo la dose booster (sebbene questa differenza fosse meno pronunciata e statisticamente significativa per solo uno dei 13 sierotipi).
È stata eseguita da un gruppo di ricerca greco [61] una revisione sistematica che ha incluso studi controllati randomizzati e studi osservazionali sulla risposta immunitaria conferita dai vaccini PCV7, PCV10 e PCV13 dopo la somministrazione di antipiretici. In tutti gli studi considerati, i vaccini pneumococcici sono stati co-somministrati con altri vaccini dell’età pediatrica: vaccino DTaP/HBV/IPV/Hib, Rotavirus e 4CMenB e i bambini hanno ricevuto l’immunizzazione a 2, 3, 4 mesi e la dose di richiamo a 12-15 mesi di età. La seconda dose di richiamo era somministrata a bambini di età compresa tra 31 e 44 mesi. Globalmente, sono stati inclusi nella revisione sistematica cinque studi. In particolare, sono stati valutati l’impatto dell’uso profilattico degli antipiretici (paracetamolo) sul sistema immunitario e la risposta ai PCV attraverso la misurazione delle concentrazioni di IgG anti-pneumococco nel siero e l’attività opsonofagocitica di ciascun sierotipo, prima e un mese dopo la vaccinazione primaria e un mese dopo la vaccinazione booster. La soglia GMC delle IgG sieroprotettive era definita come GMC ≥ 0,2 μg/ml (test inibizione ELISA 22F di GSK) o ≥ 0,35 μg/ml (test inibizione ELISA non-22F dell’OMS) così come il titolo OPA ≥ 8. Dei 3956 report individuati sono stati inclusi nella revisione 5 studi che includevano 2775 bambini: in 3 studi il vaccino considerato era il PCV10 mentre il PCV7 e il PCV13 sono stati studiati in uno studio ciascuno. Gli autori hanno riportato che la somministrazione profilattica del paracetamolo riduceva la risposta immunitaria per alcuni sierotipi. L’effetto era più evidente dopo il ciclo primario e quando la somministrazione di paracetamolo era immediata. Tuttavia, nonostante siano state osservate riduzioni nelle concentrazioni dei titoli anticorpali geometrici medi, era evidente una robusta risposta della memoria dopo la dose di richiamo. Inoltre, i titoli anticorpali erano superiori ai livelli protettivi nell’88-100% dei partecipanti. Pertanto, l’uso dell’antipiretico non sembrava influenzare l’immunogenicità dei PCV. Tuttavia, occorre segnalare che gli studi esaminati presentavano una significativa eterogeneità nel disegno e nella somministrazione del paracetamolo. Di conseguenza, questi risultati necessitano di ulteriori approfondimenti per meglio comprendere il significato clinico della ridotta immunogenicità, specialmente prima della dose di richiamo. Relativamente alla meta-analisi, non è stata eseguita per la notevole eterogeneità dei dati, per l’utilizzo di vaccini pneumococcici differenti e spesso co-somministrati con diverse combinazioni di vaccini di routine previsti nei calendari vaccinali.
Per quanto riguarda la stima di efficacia abbiamo incluso nel presente capitolo 2 studi.
La revisione sistematica di Izurieta et al. [49] aveva come obiettivo quello di valutare l’efficacia, l’effectiveness e l’impatto del PCV10 e del PCV13 sulla prevenzione dell’otite media. I ricercatori hanno inizialmente selezionato 33 articoli, tra i quali 4 hanno riportato stime di efficacia dei vaccini anti-pneumococco coniugati. Tutti gli studi erano riferiti alla vaccinazione con PCV10, nessuno studio era disponibile per PCV13. Specificatamente, i valori di efficacia del PCV10 nel prevenire le otiti medie provengono da due studi clinici controllati di fase III [66-69]. Gli studi hanno mostrato trend consistenti relativi alla riduzione delle otiti medie per tutte le cause diagnosticate clinicamente negli infanti sebbene i risultati non fossero sempre significativi e gli studi presentassero delle limitazioni come il rischio di bias e stime imprecise di effetto. Gli autori hanno riportato valori di efficacia pari al 13% (IC 95%: -2-26) nella prevenzione del posizionamento del tubo timpanostomico a seguito di otite e al 6,4% (IC 95%: -5,5-7,2) nella prevenzione di tutti gli episodi di otiti medie nello studio clinico randomizzato condotto in Finlandia [69]. Nello studio sud-americano l’efficacia del vaccino contro il primo episodio di otite media è risultata del 16,1% (IC 95%: -1,1-30,4; per-protocol analysis), e del 14,8% (IC 95%: -1,0-28,2; intent-to-treat analysis) nel prevenire tutte le otiti medie clinicamente confermate. I dati relativi alle otiti medie per tutte le cause permettono di ipotizzare un’efficacia maggiore nei bambini più piccoli (< 2 anni di età) rispetto ai gruppi di età più grandi [67].
Gli stessi studi clinici erano riportati nella revisione sistematica della Cochrane Review aggiornata dal gruppo di ricerca coordinato da de Sevaux che ha evidenziato che i vaccini PCV7 e PCV10, quando somministrati nell’infanzia, erano associati a un’elevata riduzione del rischio di otiti medie acute [50].
Berman-Rosa et al. [51] hanno effettuato una revisione sistematica sull’effectiveness dei vaccini PCV10 e PCV13 e hanno scelto come outcome primario la prevenzione della MIP nei bambini di età < 5 anni. Gli studi ammissibili in totale sono stati 19 e i risultati hanno evidenziato un’efficacia sul campo significativa contro le MIP causate da sierotipi vaccinali nei bambini immunizzati con PCV13 con la schedula 3 + 1 (86-96%) e 2 + 1 (67,2-86%) e per PCV-10 per i programmi 3 + 1 (72,8-100%) e 2 + 1 (92-97%). Nei bambini di età inferiore a 12 mesi, l’effectiveness del PCV13 verso il sierotipo 19A era significativa per la schedula 3 + 1, ma non per la schedula 2 + 1. Relativamente ai sottogruppi di bambini più grandi dove l’incidenza di MIP è maggiore (12 e 24 mesi di età), i dati di effectiveness erano disponibili solo per il PCV13. In particolare, i valori di efficacia sul campo dopo 2 o 3 dosi prima della dose booster nei bambini di 12 mesi di età si aggiravano intorno all’80% per entrambe le schedule [80% (IC 95%: 46-93) e 80% (IC 95%: 43-93) per le schedule 3 + 1 e 2 + 1, rispettivamente). Tra i bambini 12 e 24 mesi, l’effectiveness della schedula 2 + 1 nel prevenire le MIP causate da sierotipi vaccinali era inferiore rispetto alla stima corrispondente ottenuta con la schedula vaccinale 3 + 1. Il PCV13 non è risultato efficace contro il sierotipo 3. Il PCV13 è risultato efficace contro le otiti medie acute (86%; IC 95%: 61-94). Per il PCV10 sono stati osservati valori di efficacia sul campo contro le otiti medie acute clinicamente definite del 26,9% (IC 95%: 5,9-43,3) e del 43,3% (IC 95%: 1,7-67,3) se considerate le otiti medie acute batteriologicamente confermate. A causa della grande eterogeneità degli studi, non è stata effettuata la meta-analisi. In conclusione, secondo gli autori entrambi i PCV offrono protezione contro le infezioni pneumococciche.
de Oliveira et al. [54] hanno condotto una revisione sistematica sull’impatto/effectiveness dei PCV sui decessi e sui ricoveri dovuti a MIP, polmonite, meningite e sepsi interrogando le banche dati Medline (PubMed), WoS, Web of Science, Scopus, Lilacs, Cochrane e la letteratura grigia pubblicata in qualsiasi lingua dal 2009 al gennaio 2016. Sono stati inclusi studi riguardanti gli esiti di interesse nei bambini con età target per la vaccinazione e con i seguenti disegni di studio: randomizzato, coorte o caso-controllo, serie temporali interrotte con almeno tre punti dati prima e dopo l’intervento e studi prima e dopo vaccinazione. Specificatamente, gli autori hanno identificato 1085 citazioni, 892 da database e 193 da altre fonti. 33 ricerche sono risultate idonee per l’estrazione dei dati; esse comprendevano 18 report completi e 15 abstract e poster. Sono stati inclusi nella revisione sistematica anche gli studi caso-controllo di Domingues et al. [70] e quello di Verani et al. [71]. In particolare i 22 studi che soddisfacevano i criteri di inclusione sono stati condotti in Argentina, Brasile, Cile, Nicaragua, Perù e Uruguay. La maggior parte dei report è stata pubblicata/presentata nel periodo compreso tra il 2014 e il 2016 (91%). Il vaccino PCV10 è stato valutato nella maggior parte degli studi (68%) e le schedule vaccinali maggiormente utilizzate, indipendentemente dal tipo di vaccino, erano la 3 + 1 e 2 + 1 (95%). La polmonite era l’esito di interesse più frequente, il disegno dello studio pre e post vaccinazione è risultato il più comune e le sorveglianze epidemiologiche sono state la fonte di dati maggiormente rappresentata. In totale 6 studi hanno analizzato la mortalità: 2 hanno valutato l’impatto sui decessi per meningite pneumococcica [72, 73], 2 hanno valutato l’impatto sui decessi per tutte le cause [74, 75] e 3 hanno analizzato i decessi dovuti a polmonite. I risultati ottenuti hanno indicato un effectiveness che variava dall’8,8 ± 37,8% per le ospedalizzazioni per polmonite confermata radiologicamente, al 7,4 ± 20,6% per la polmonite clinica e al 13,3 ± 87,7% per i ricoveri dovuti a meningite e al 56 ± 83,3% per le ospedalizzazioni da MIP. Gli autori [54] hanno dichiarato che la loro revisione sistematica è stata la prima che ha fornito stime di impatto/efficacia sul campo dei vaccini pneumococcici coniugati in sud America, valutando outcome rilevanti come le ospedalizzazioni e la mortalità nei bambini sotto i 5 anni. I vaccini pneumococcici si sono dimostrati strumenti validi per la prevenzione della polmonite mostrando una buona effectiveness anche nei confronti dei singoli sierotipi studiati.
In letteratura sono disponibili anche i risultati ottenuti da Marra et al. [31] che hanno condotto una revisione sistematica sull’effectiveness dei vaccini pneumococcici coniugati (PCV7, PCV10 e PCV13) e dei vaccini polisaccaridici 23-valenti (PPSV23) nella prevenzione delle otiti nei bambini di età inferiore ai 5 anni. Dei 2112 studi selezionati, 48 studi osservazionali hanno rispettato i criteri di ammissibilità e, pertanto, sono stati inclusi nella revisione sistematica. Degli studi ammissibili, 30 (63%) erano studi pre-post vaccinazione, undici (23%) di coorte, sei (13%) di serie temporali e uno (2%) con disegno caso-controllo. L’efficacia sul campo del vaccino nella prevenzione di otiti medie o otiti medie acute variava a seconda del tipo di vaccino considerato. Nei bambini sotto i 24 mesi l’efficacia sul campo presentava un range compreso tra l’8 e il 42,7% (PCV7), tra il 5,6 e l’84% (PCV10) e tra il 2,2 e il 68% (PCV13). Nei bambini di età inferiore ai 60 mesi, l’effectiveness variava tra il 13,2 e il 39% per PCV7, tra l’11 e il 39% per PCV10 (solo bambini sotto i 48 mesi) e tra il 39 e il 41% per il PCV13. Relativamente agli outcome secondari, l’efficacia sul campo dei PCV nella riduzione della perforazione della membrana timpanica è stata valutata in 3 studi e i risultati variavano dal 2 al 49% nei bambini di 3 anni. Inoltre, l’effectiveness dei vaccini anti-pneumococco è stata valutata nel ridurre l’inserimento dei tubi di ventilazione. Quest’ultima analisi è stata condotta nei bambini di 4 anni, in 6 diversi studi che hanno ottenuto risultati divergenti poiché la riduzione variava dal 5 al 49%. Inoltre, alcuni studi hanno valutato gli effetti dei vaccini PCV sulla miringotomia, trovando una significativa riduzione dal 6 al 29% nei bambini di 5 anni di età. 2 studi hanno considerato come outcome di studio la mastoidite, entrambi i PCV hanno evidenziato una significativa riduzione dei tassi variabile tra il 10 e il 52%. Complessivamente i risultati indicano un effetto significativo della vaccinazione pneumococcica nel ridurre l’otite media o l’otite media acuta nei bambini sotto i cinque anni nei Paesi dove l’immunizzazione è inserita nei programmi di immunizzazione nazionale.
Izurieta et al. [49] hanno investigato sistematicamente i dati di effectiveness del PCV10 e del PCV13. Tali dati provenivano da uno studio [75] condotto in Finlandia su bambini ai quali è stato somministrato il PCV10 utilizzando come endpoint la prevenzione delle infezioni del tratto respiratorio e le otiti medie; un secondo studio condotto in USA [76] che ha valutato come esiti di effectiveness la prevenzione delle otiti medie (vaccini considerati: PCV7/PCV13), un terzo studio, effettuato in Corea, che ha utilizzato una banca dati nazionale a fini assicurativi per stimare l’efficacia combinata sul campo [77] del PCV10 e PCV13 e un quarto studio condotto in Spagna [78]. Lo studio finlandese sopra menzionato [75] ha seguito in modo prospettico una coorte di 424 bambini, osservati dalla nascita fino ai 2 anni di età. L’efficacia sul campo del PVC10 è risultata del 23% (IC 95%: 0-40) nella prevenzione delle infezioni del tratto respiratorio e le otiti medie. Lo studio di Pichichero et al. [76], di tipo prospettico ha valutato l’efficacia sul campo del PCV13 nella prevenzione dell’otite media causata dai 6 sierotipi contenuti nel vaccino 13-valente ma non inclusi nel 7-valente. Gli autori hanno arruolato 239 bambini con ciclo vaccinale completo fino a 30 mesi di età e i pazienti ambulatoriali di uno studio pediatrico privato negli Stati Uniti. Sono stati raccolti dagli autori i dati relativi agli episodi di otite media fino a 30-36 mesi di età e tutti i bambini sono stati sottoposti a timpanocentesi. I controlli erano bambini arruolati in uno studio precedente simile che prevedeva l’utilizzo del PCV7. L’efficacia sul campo stimata del PCV13 nella prevenzione dell’otite media dovuta ai 6 sierotipi aggiuntivi è risultata dell’86% (IC 95%: 61-94). Uno studio retrospettivo basato su analisi di database condotto a livello nazionale in Corea [77] per determinare l’efficacia sul campo del programma di vaccinazione con PCV10 e PCV13 ha riportato un’efficacia sul campo combinata nella prevenzione delle visite ambulatoriali per otite media del 19,13% (IC 95%:13,42-24,46). Uno studio basato sulla popolazione nel sud della Catalogna, in Spagna, ha identificato 78 casi di otite media causata da pneumococco confermato dalla coltura con otorrea spontanea. Il periodo temporale nel quale il programma vaccinale prevedeva l’immunizzazione con PCV7 (da gennaio 2007 a giugno 2010) è stato confrontato con il primo periodo dove il vaccino utilizzato era il PCV13. Non è stata osservata nessuna differenza significativa tra i tassi di incidenza complessivi degli episodi di otite da pneumococco nei due periodi di studio, sebbene la prevalenza di casi causati da sierotipi contenuti nel PCV13 seguisse un trend decrescente (65,5% vs 48,4%) [78].
Lo studio di Alicino et al. [30] ha investigato in modo sistematico l’impatto dei vaccini PCV10 e PCV13 nel ridurre le ospedalizzazioni per polmonite comunitaria (CAP) nei bambini di età inferiore ai 5 anni. I 12 articoli identificati dagli autori hanno riportato nei bambini di età < 24 mesi una riduzione del 17% (IC 95%: 11-22%, p-value < 0,001) e del 31% (IC 95%: 26-35%, p-value < 0,001) nei tassi di ospedalizzazione rispettivamente per polmonite confermata clinicamente e radiologicamente dopo l’introduzione dei nuovi PCV. Inoltre, nei bambini di età compresa tra 24 e 59 mesi, la meta-analisi ha mostrato una riduzione del 9% (IC 95%: 5-14%, p-value < 0,001) e del 24% (IC 95%: 12-33%, p-value < 0,001) nei tassi di ospedalizzazione per casi di polmonite e polmonite confermata radiologicamente, rispettivamente, dopo l’introduzione dei nuovi PCV. I risultati di questo studio hanno rivelato un impatto significativo dei vaccini PCV10 e PCV13 nella riduzione dei ricoveri per polmonite clinica, in particolare nei bambini di età < 24 mesi e per polmoniti confermate radiologicamente.
Una revisione sistematica e meta-analisi di studi osservazionali [52], finalizzata a valutare l’efficacia sul campo del vaccino PCV13 nella prevenzione delle MIP da sierotipo 3 nei bambini, ha interrogato sistematicamente le banche dati PubMed, Embase e Cochrane Library relativamente agli studi pubblicati prima del 14 agosto 2017. I ricercatori hanno identificato in totale 4 studi e 2 poster di conferenze che descrivevano le stime di efficacia sul campo del PCV13, stratificate per sierotipo. Specificatamente, l’effectiveness di PCV13 aggregata, causata da sierotipo 3 è risultata del 63,5% (IC 95%: 37,3-89,7%) con bassa eterogeneità (I2 = 15,7%, p = .313). L’analisi di sensibilità ha fornito una stima di effectiveness aggregata del 72,4% (IC 95%: 56,7-88,0%) con un I2 dello 0% (p = .891). Quando i risultati degli studi sono stati disaggregati, sono state osservate stime di effectiveness più alte nei Paesi con programmi di vaccinazione 3 + 1 vs 2 + 1. In conclusione, i dati raccolti supportano la protezione diretta del PCV13 nella prevenzione delle MIP da sierotipo 3 nei bambini.
Un altro aspetto importante da considerare è che la vaccinazione contro lo pneumococco permette di evitare l’assunzione di terapia antibiotica che spesso è associata a fenomeni di resistenza. Si stima, infatti, che nel 15-30% dei casi di infezione da pneumococco, si possa determinare resistenza a uno o più antibiotici, e questo può complicare la gestione clinico-terapeutica delle polmoniti e di altre forme severe di malattia. La diffusione della resistenza alla penicillina e ai beta-lattamici in generale, dei ceppi di pneumococco rappresenta un aspetto particolarmente temibile, con ripercussioni sulle terapie, soprattutto della meningite e delle forme invasive. In tale ambito. la revisione di Tin Tin Htar et al. [53] ha valutato la letteratura pubblicata tra il primo giugno 2008 e il primo giugno 2017 sull’effetto dell’implementazione dei programmi di immunizzazione infantile di routine con PCV10 o PCV13 sulla prevenzione della malattia pneumococcica invasiva resistente agli antimicrobici, otite media e carriage nasofaringeo nei bambini e negli adulti. Nei Paesi nei quali era osservata una resistenza antimicrobica elevata allo pneumococco, i programmi di vaccinazione infantile con PCV13 hanno ridotto la malattia pneumococcica invasiva resistente agli antibiotici, le otiti medie e lo stato di carriage nei bambini. Inoltre, si sono osservate diminuzioni dei casi di MIP negli adulti. L’efficacia sul campo del PCV13 contro il sierotipo 19A è stata probabilmente uno dei fattori più importanti che ha contribuito ai risultati osservati. Da segnalare che solo pochi studi hanno documentato l’impatto del PCV10 sulla resistenza antimicrobica. La revisione sistematica Tin Tin Htar et al. [53] sottolinea l’importanza di includere l’impatto sulla resistenza agli antibiotici quando si valutano i programmi di vaccinazione pneumococcica.
Un’altra revisione sistematica [55] ha investigato i report della letteratura inglese pubblicati da gennaio 2000 ad aprile 2016 per valutare gli esiti del fallimento vaccinale di PCV7, PCV10 e PCV13 nei bambini. Le fonti di dati includevano Medline, Embase, Cochrane Library e i riferimenti all’interno degli articoli individuati. In globale, sono stati identificati 1742 potenziali studi e sono stati incluse 20 pubblicazioni che hanno coinvolto 7584 bambini di età < 5 anni: 5202 hanno ricevuto 2 dosi seguite da un richiamo (68,6%), 64 (0,8%) hanno ricevuto 3 dosi senza richiamo (2 studi) e 2318 hanno ricevuto una schedula 3 + 1 (30,6%) (8 studi). La maggior parte degli studi inclusi riguardavano il PCV7 (70,0%; 14/20), uno il PCV10 (5,0%; 1/20) e uno studio sia il PCV7 sia il PCV10 (5,0; 1/20). Occorre sottolineare che solo uno studio ha riportato il fallimento del PCV13 (5,0%; 1/20). I ricercatori hanno concluso affermando che il fenomeno del fallimento dei vaccini PCV è raro e spesso correlato alla presenza di comorbilità nei soggetti immunizzati.
Un’altra revisione sistematica [56] condotta con l’obiettivo di valutare il fallimento vaccinale e il “breakthrough” nel prevenire le MIP in bambini di età ≤ 5 anni ha individuato ventisei manoscritti: 20 relativi a PCV13, 1 relativo a PCV10, 5 hanno valutato entrambi i vaccini. Gli autori hanno inizialmente identificato 1121 pubblicazioni e, dopo lo screening, hanno selezionato 104 pubblicazioni con la revisione dei “full-text”. Inoltre, sono stati identificati altri quattro articoli tra i riferimenti citati nelle pubblicazioni selezionate ed essi sono stati inclusi nella revisione del testo completo. Un totale di 26 pubblicazioni ha fornito dati rilevanti su 1058 casi di MIP in bambini che avevano ricevuto ≥ 1 dose di PCV13 e/o PCV10. Poiché la maggior parte degli studi si è svolta in contesti dove è stato utilizzato il PCV13, l’analisi complessiva si è focalizzata principalmente ai fallimenti del vaccino e i casi di “breakthrough” dopo PCV13. Di questi, 469 potevano essere classificati come fallimenti vaccinali (cioè erano completamente vaccinati secondo il programma del Paese) e 403 casi di “breakthrough” comprendenti soggetti che non avevano seguito la schedula completa. Nello specifico il fallimento del vaccino e il “breakthrough” nel prevenire le MIP sono risultati bassi: 8,4 e 9,3%, rispettivamente. Tale risultato risulta coerente con l’elevata efficacia dei vaccini pneumococcici. I principali sierotipi associati al fallimento/breakthrough del vaccino erano il 19A, il 3 e il 19F per PCV13 e il 14, il 6B, il 19A e il 6A correlati al vaccino PCV10. Nello specifico, i sierotipi 3 e 19A erano quelli più frequentemente riportati nei fallimenti vaccinali (185/463, 40,0% e 166/463, 35,9%, rispettivamente) seguiti dal sierotipo 19F (66/ 463, 14,3%). Nei 403 casi di MIP da ceppi vaccinali classificati come breaktrough il sierotipo più comunemente riportato era il 19A (180/403, 44,7%), seguito dal sierotipo 3 (80/403, 19,9%) e 19F (34/403, 8,4%). La stratificazione effettuata dagli autori sul numero di dosi ha indicato due modelli di casi di “fallimento” per sierotipo. Nei soggetti vaccinati con 1 dose i sierotipi più comunemente rilevati erano 1, 6A e 7F mentre in individui immunizzati con 2 dosi la maggiore frequenza era riferita ai sierotipi 3, 6B, 14, 19A e 19F, sebbene il numero assoluto di casi per molti sierotipi fosse piccolo. I risultati indicano che è fondamentale monitorare il fenomeno dei fallimenti da immunizzazione/ breaktrough considerando anche i diversi sierotipi.
Lo studio di Thompson et al. [58] si è basato sui dati di 13 studi clinici randomizzati multicentrici che hanno valutato la sicurezza del PCV13 nei neonati sani. Tutti gli studi erano di fase 3 a eccezione di uno studio di fase 1/2. La selezione effettuata dagli autori ha individuato studi di nove Paesi in Nord America, Europa e Asia. Tutti i 13 studi hanno valutato la sicurezza del PCV13 in co-somministrazione con altri vaccini. Dieci studi hanno utilizzato il PCV7, come comparatore attivo in somministrazione singola e 3 studi hanno confrontato diverse formulazioni o lotti di PCV13. Per l’analisi integrata, i dati dei 13 studi sono stati raggruppati e tutti i gruppi vaccinati con PCV13 sono stati considerati indipendentemente dalla formulazione o dal lotto. Complessivamente, i tassi di reazioni locali dopo qualsiasi dose del ciclo primario erano simili tra PCV13 e PCV7. Nel gruppo PCV13 qualsiasi tipo di dolorabilità variava dal 39,9% dopo la terza dose al 48,8% dopo la dose booster. Nel gruppo PCV7 la stanchezza variava dal 37,7% dopo la terza dose del ciclo primario al 54,4% dopo la dose booster. L’indurimento nel sito di inculo variava dal 21,8 al 35,3% dopo la prima dose e la dose booster nei bambini nel gruppo vaccinato con PCV13, mentre qualsiasi indurimento variava dal 20,2% dopo la prima dose a 37,1% dopo la dose booster nei bambini nel gruppo PCV7. Qualsiasi eritema variava dal 25,3% dopo la dose 1 al 46,6% dopo la dose booster nel gruppo PCV13 e dal 26,2% (1° dose) al 46,6% (dose booster) nel gruppo PCV7. L’incidenza di dolorabilità era significativamente più alta tra i soggetti immunizzati con PCV7 rispetto ai soggetti vaccinati con PCV13 (p = 0,047). Dopo la dose booster, l’incidenza della dolorabilità era significativamente più alta tra i soggetti immunizzati con PCV7 rispetto ai soggetti vaccinati con PCV13 (p = 0,005). Relativamente alle reazioni sistemiche le frequenze della febbre erano simili in entrambi i gruppi e la maggior parte era lieve (≤ 39°C). Nel gruppo vaccinato con PCV13 qualsiasi febbre variava da 23,9% dopo la dose 1 del ciclo primario al 36,9% dopo la dose booster. Nel gruppo immunizzato con PCV7, qualsiasi febbre variava dal 22,5% dopo la dose 1 del ciclo primario al 46,7% dopo la dose booster. La febbre elevata (> 40°C) è stata riportata in ≤ 0,3% dei soggetti dopo qualsiasi dose. Sono stati segnalati anche diminuzione dell’appetito, irritabilità e disturbi del sonno con valori simili in entrambi i gruppi durante il ciclo primario e la dose booster. Il profilo di sicurezza del PCV13 si è dimostrato ottimale e sovrapponibile al PCV7.
Anche la revisione sistematica di Ruiz-Aragón et al. [46] ha riportato un buon profilo di sicurezza dei vaccini anti-pneumococco. In particolare, è stato evidenziato che le reazioni locali erano lievi e moderate e variavano dal 26,71 al 53,25% nei gruppi PCV13, rispetto alla variazione compresa tra il 27,89 e il 58,20% osservata nel gruppo immunizzato con PCV7. Nessuna differenza statisticamente significativa per le reazioni locali è stata segnalata. Le reazioni locali più frequenti erano dolorabilità (47,36% nel gruppo vaccinato con PCV13 vs 47,07% nel gruppo immunizzato con PCV7), arrossamento (26,71% vs 29,08%) e gonfiore (25,29% vs 27,89%). L’indurimento è stato riportato meno frequentemente (21,85% vs 19,35%). Gli eventi sistemici variavano dal 29,31 all’89,24% nei bambini vaccinati con PCV13 rispetto al 26,40-88,12% nei soggetti immunizzati con PCV7, senza differenze statisticamente significative eccetto per l’irritabilità (70,59% nel gruppo PCV13 rispetto al 68,37% nel PCV7; p = 0,04). Gli eventi sistemici più comunemente riportati erano l’irritabilità e aumento del sonno (56,94% nei bambini vaccinati con PCV13 rispetto al 55,57% in quelli immunizzati con PCV7).
Le informazioni sulla sicurezza riportate nel sito del Centers for Disease Control and Prevention (CDC) evidenziano che i vaccini pneumococcici sono sicuri ed efficaci nel prevenire la malattia pneumococcica, tuttavia, come qualsiasi vaccino, possono avere effetti collaterali. Molto raramente, dopo la vaccinazione possono verificarsi gravi reazioni allergiche (anafilattiche) [79].
Lo studio “Post-marketing Safety Evaluation of Pneumococcal Vaccines Among Children and Elderly Adults” [80] ha raccolto i dati per valutare il rischio di eventi avversi a seguito della vaccinazione con PCV10 o PCV13 in neonati o bambini di età < 59 mesi, i risultati saranno disponibili a breve.
L’ultimo rapporto vaccini AIFA [81] riporta che nel 2017, le segnalazioni di sospette reazioni avverse al vaccino anti-pneumococco sono state 1.215 (di cui 22,1% gravi): 1.114 (22,7% gravi) erano riferite al PCV13 e 101 (15,8% gravi) al PPV23. La maggior parte delle reazioni avverse al PCV13, osservate nella popolazione di età compresa fra 0 e 16 anni, erano riferite alla co-somministrazione con preparato esavalente. La sospetta reazione avversa maggiormente segnalata, indipendentemente dal nesso di causalità, è stata la febbre (> 38°C). Inoltre, sono state segnalate con relativa frequenza le reazioni nel sito di somministrazione, l’agitazione/irritabilità, le reazioni cutanee generalizzate, l’iperpiressia (> 39,5°) e il pianto. Meno comunemente sono stati osservati: vomito, sonnolenza, dolore generalizzato e diarrea. Le segnalazioni di sospetta reazione avversa grave sono state in totale 110 di cui 79 sono risultate correlabili alla vaccinazione. L’87,3% di questi eventi avversi gravi si è completamente risolto e l’8,8% (n. 7) riportava nella scheda di segnalazione l’indicazione “in miglioramento” (per 3 schede l’esito non era disponibile). In base al numero complessivo di dosi somministrate, il tasso di segnalazione degli eventi avversi gravi correlabili ai vaccini anti-pneumococcico è stato di 6 casi ogni 100.000 dosi somministrate. La reazione avversa grave più frequentemente correlabile alla vaccinazione era iperpiressia, con un tasso di segnalazione di 3 casi ogni 100.000 dosi somministrate. In conclusione, non sono emerse particolari problematiche di sicurezza dall’analisi delle sospette reazioni avverse. Il tasso di segnalazione delle reazioni avverse correlabili alle vaccinazioni per dosi somministrate è risultata in linea con quanto riportato nel riassunto delle caratteristiche del prodotto.
La revisione sistematica di Onwuchekwa et al. [57] è stata condotta con l’obiettivo di riassumere i risultati sull’impatto della somministrazione di routine dei vaccini pneumococcici coniugati 10-valente e 13-valente sulla polmonite nei bambini sotto cinque anni di età nell’Africa sub-sahariana. Sono stati inclusi 8 studi di cui 6 erano studi pre-post vaccinazione o serie temporali, 1 studio caso-controllo e 1 studio che combinava ricerche pre-post vaccinazione e caso-controllo. È stato investigato l’impatto sulla polmonite con diagnosi clinica e gli studi analizzati hanno riportato risultati incoerenti. Silaba et al. [82] hanno osservato una diminuzione dei ricoveri per polmonite grave o molto grave secondo la definizione clinica fornita dall’OMS, mentre Mackenzie et al. [83] non hanno osservato cali significativi dell’incidenza di polmonite clinica tre anni dopo la vaccinazione con PCV13 in tutti gruppi di età ≥ 5 anni. Altri ricercatori hanno registrato un calo significativo di ricoveri per polmonite nei neonati e nei bambini tra 24-59 mesi. Questo effetto è stato osservato anche in bambini infetti da HIV [84]. È stato studiato anche l’impatto dei vaccini sulla polmonite confermata radiologicamente analizzando due studi di impatto giungendo a ottimi risultati. In particolare, Mackenzie et al. [83] hanno riportato un calo della polmonite confermata radiologicamente come definita dall’OMS in tutte le fasce d’età con un calo compreso tra il 22 e il 29%. Questo calo era più evidente nella fascia di età compresa tra 12 e 23 mesi. Analoghi risultati sono stati trovati da altri autori, come Silaba et al. [82] che hanno riportato un calo del 48% delle polmoniti confermate radiologicamente in tutta la popolazione di età sotto i cinque anni. In sintesi, gli autori hanno concluso che c’era evidenza dell’impatto positivo della vaccinazione pediatrica pneumococcica di routine sull’incidenza di polmonite in Africa.
Inoltre, alcuni studi si sono focalizzati sugli effetti indiretti della vaccinazione pneumococcica. Specificatamente, Shiri et al. [59] hanno ricercato su database studi quasi sperimentali o osservazionali non randomizzati recanti stime della malattia pneumococcica invasiva dopo l’introduzione della vaccinazione con PCV (studi pubblicati dal primo settembre 2010 al 6 gennaio 2016), aggiornando la precedente revisione sistematica sullo stesso argomento. I dati estratti da 70 studi provenienti da 27 Paesi ad alto reddito e sette Paesi a reddito medio, hanno evidenziato che i tempi medi previsti per raggiungere una riduzione del 90% di casi di malattia pneumococcica invasiva dovrebbero essere di circa 8-9 anni (IC 95%: 7,8-10,3) per i sierotipi contenuti nel PCV7 e 9,5 anni (IC 95%: 6,1-16,6) per i 6 sierotipi aggiuntivi contenuti nel PCV13. Secondo gli autori i programmi di vaccinazione con i vaccini coniugati nell’infanzia porteranno, in media, a una protezione sostanziale di tutta la popolazione in un decennio in termini di diminuzione di malattia invasiva.
Alla luce delle nuove opportunità in ambito di prevenzione delle malattie da pneumococco, capaci di offrire una più ampia copertura sierotipica, è prioritario definire strategie vaccinali che offrano il massimo beneficio per ogni fascia d’età al fine di massimizzare i risultati in termini di salute, di risparmio economico e garantire un’adeguata protezione per l’intera collettività.
Quando un nuovo vaccino si rende disponibile occorre valutare il suo inserimento nel PNPV, analizzando le alternative disponibili e, pertanto, il presente capitolo ha esaminato le evidenze relative ai vaccini anti-pneumococco coniugati attualmente utilizzati per la popolazione pediatrica (PCV10 e PCV13).
Il vigente PNPV raccomanda la somministrazione del vaccino coniugato a partire dal 61° giorno di vita con la schedula 2 + 1 con le dosi somministrate al 3°, 5° e 11°/13° mese di vita. Inoltre, il vaccino PPV23 pur essendo autorizzato per l’immunizzazione attiva contro l’infezione pneumococcica in soggetti di età ≥ 2 anni non è utilizzato nella pratica vaccinale di routine per la popolazione pediatrica e, pertanto, non è stato analizzato nel presente capitolo.
La ricerca di letteratura ha individuato 18 revisioni sistematiche e la valutazione critica delle evidenze ha permesso le seguenti considerazioni:
Il vaccino coniugato 10-valente (PCV10):
si è dimostrato altamente immunogeno capace di stimolare livelli anticorpali protettivi (sia anticorpi totali sia anticorpi opsonizzanti) per tutti i sierotipi vaccinali seppur con variazioni sierotipo specifiche. La dose booster, prevista nel secondo anno di vita, induce risposte immunitarie robuste per tutti i sierotipi contenuti nel vaccino;
è risultato non inferiore al PCV7 per i sierotipi comuni e ha dimostrato una superiorità nella risposta anticorpale verso i sierotipi aggiuntivi (1, 5 e 7F);
si è dimostrato efficace nel prevenire le MIP causate dai sierotipi vaccinali sebbene con differenze sierotipo specifiche. Inoltre, le evidenze disponibili hanno riportato dati di efficacia riferiti alla prevenzione sia delle otiti medie acute clinicamente definite sia di quelle batteriologicamente confermate supportando un effetto positivo della vaccinazione. Infine, i dati di letteratura restituiscono dati di impatto significativo anche sulla prevenzione delle ospedalizzazioni per polmonite comunitaria;
pochi dati sul fallimento vaccinale/breakthrough riferiti alla vaccinazione con PCV10 sono disponibili in letteratura. I principali sierotipi associati a tale fenomeno sono risultati il 14, il 6B e il 19A;
il profilo di sicurezza e tollerabilità è soddisfacente. La maggior parte degli eventi avversi osservati sia negli studi sperimentali controllati sia negli studi osservazionali sia nelle sorveglianze post-marketing erano associati a reazioni locali di natura transitoria e autorisolutiva. L’evento avverso sistematico maggiormente riportato è stato la febbre. Rari eventi avversi gravi correlati all’utilizzo del PCV10 sono stati osservati nelle sorveglianze post-marketing;
può essere co-somministrato con altri vaccini pediatrici di routine senza provocare interferenze significative in termini sia di risposta immunitaria sia di frequenza di eventi avversi.
Il vaccino coniugato 13-valente (PCV13):
si è dimostrato altamente immunogeno e capace di elicitare livelli anticorpali protettivi (sia anticorpi totali sia anticorpi opsonizzanti) per tutti i sierotipi vaccinali seppur con variazioni sierotipo specifiche. È stato osservato che la dose di richiamo nel secondo anno di vita è in grado di stimolare risposte immunitarie robuste per tutti i sierotipi;
è risultato non inferiore al PCV7 per i sierotipi comuni ed è stata osservata una superiorità nella risposta anticorpale verso i sierotipi aggiuntivi (1, 3, 5, 6A, 7F e 19);
si è dimostrato efficace nel prevenire i casi di MIP, nel ridurre le ospedalizzazioni per polmonite comunitaria e nel prevenire sia i casi di otite media clinicamente definiti sia quelli batteriologicamente confermati. Tale risultato determina un impatto significativo diretto sui soggetti vaccinati e indiretto sulla collettività;
i dati derivanti da studi specifici con l’obiettivo di valutare il fallimento/breakthrough della vaccinazione con PVC13 hanno evidenziato che il fenomeno è raro e spesso correlato alla presenza di comorbilità nei soggetti immunizzati. Nello specifico i sierotipi 3 e 19A sono risultati quelli più frequentemente riportati nei fallimenti vaccinali seguiti dal sierotipo 19F;
il profilo di reattogenicità è buono. La maggior parte degli eventi avversi riportati sia degli studi sperimentali controllati che negli studi osservazionali erano di moderata entità, di natura transitoria e generalmente comprendevano reazioni nel sito di inoculo (dolorabilità e indurimento). L’evento avverso più frequente è stato la febbre. Gli eventi avversi gravi sono stati rari. Le sorveglianze post-marketing hanno confermato il buon profilo di sicurezza osservato negli studi sperimentali controllati e gli eventi avversi gravi sono stati rari;
il PCV13 può essere co-somministrato con altri vaccini pediatrici di routine senza provocare alcuna interferenza significativa sia con la risposta immunitaria sia con la frequenza degli eventi avversi.
In generale, le evidenze raccolte con la presente revisione di letteratura hanno dimostrato anche un beneficio dei programmi di immunizzazione dell’infanzia con i PCV sull’antibiotico resistenza, poiché si stima che nel 15-30% dei casi di infezione da pneumococco, si possa avere resistenza a uno o più antibiotici. Nei Paesi nei quali è stata osservata una resistenza antimicrobica elevata allo pneumococco, i programmi di vaccinazione nell’infanzia con PCV13 hanno ridotto MIP resistenti agli antibiotici, le otiti medie e lo stato di carriage nei bambini. Inoltre, si è osservato un decremento dei casi di MIP negli adulti. La revisione sistematica Tin Htar et al. [53] sottolinea l’importanza di includere l’impatto sulla resistenza agli antibiotici quando si valutano i programmi di vaccinazione pneumococcica.
Infine, alcuni studi hanno osservato effetti indiretti positivi della vaccinazione pneumococcica. Specificatamente, una revisione sistematica [59] ha analizzato i dati estratti da 70 studi provenienti da 27 Paesi ad alto reddito e sette Paesi a reddito medio e ha evidenziato che i programmi di immunizzazione con i vaccini coniugati nell’infanzia porteranno nel medio termine (un decennio), a una protezione sostanziale di tutta la popolazione in termini di diminuzione di malattia invasiva e non invasiva.
I primi tentativi per l’immunoprofilassi attiva delle infezioni da Streptococcus pneumoniae (pneumococco) risalgono al 1911, quando un vaccino intero inattivato fu sviluppato [1]. Gli studi successivi, condotti nelle prime tre decadi del secolo scorso, portarono alla scoperta della capsula polisaccaridica dello pneumococco, quale principale fattore di virulenza, dimostrando il suo ruolo centrale nella patogenesi della malattia. Basandosi sulla struttura e sulle proprietà antigeniche della capsula polisaccaridica, furono scoperti diversi sierotipi dello pneumococco e fu inoltre dimostrato che la protezione vaccinale è altamente sierotipo specifica [2]. Queste importanti scoperte hanno portato allo sviluppo dei vaccini polisaccaridici (Pneumococcal Polysaccharide Vaccine, PPV), prima 14-valente (PPV14) e poi 23-valente (PPV23) [3].
Sebbene i vaccini polisaccaridici abbiano dimostrato una buona efficacia sul campo contro la malattia invasiva e la polmonite pneumococcica nell’anziano [4], tali formulazioni presentano alcuni importanti limiti intrinseci [5]. In primis, i vaccini polisaccaridici non sono immunogeni nei bambini piccoli né in grado di indurre la memoria immunologica, in quanto la risposta immunitaria è indipendente dai linfociti T e, di conseguenza, la produzione dei linfociti B di memoria risulta assente e non si osserva quindi la risposta anamnestica dopo un’eventuale dose di richiamo [5, 6].
Al fine di ovviare alle problematiche sopramenzionate, sono stati successivamente sviluppati i primi vaccini pneumococcici coniugati (Pneumococcal Conjugate Vaccine, PCV). La coniugazione dell’antigene polisaccaridico con proteine vettrici (carrier) permette di indurre una notevole risposta T dipendente con conseguente produzione delle cellule B di memoria. I PCV sono inoltre adiuvati con sali di alluminio al fine di indurre una risposta immunitaria più robusta [7, 8]. Il primo vaccino coniugato autorizzato fu il 7-valente (PCV7) e conteneva gli antigeni capsulari dei sierotipi 4, 6B, 9 V, 14, 18C, 19F e 23F [9]. Gli studi epidemiologici condotti successivamente hanno dimostrato un incremento relativo dei casi di malattia causati da sierotipi non inclusi nel PCV7 [10, 11], il fenomeno noto come “rimpiazzo” dei sierotipi (serotype replacement) [12]. Per tale motivo sono stati sviluppati i vaccini 10-valente (PCV10 che contiene sierotipi del PCV-7 più sierotipi 1, 5 e 7F) e 13-valente (PCV13 che contiene sierotipi del PCV7 più sierotipi 1, 3, 5, 6A, 7F e 19A) che hanno permesso di ampliare la copertura dei sierotipi degli pneumococchi circolanti [13]. Nelle diverse realtà geografiche (e.g., Danimarca [14], Francia [15], Cechia [16], Bangladesh [17], Inghilterra [18], Sudafrica [19], Stati Uniti [20]) che hanno introdotto i vaccini coniugati nelle schede vaccinali pediatriche, è stata dimostrata una drastica riduzione dell’incidenza della malattia invasiva da pneumococco (MIP in inglese Invasive Pneumococcal Disease, IPD). In Italia, i dati da quattro regioni (Lombardia, Emilia-Romagna, Trentino-Alto Adige e Piemonte) [21] suggeriscono che, grazie all’introduzione del PCV7/PCV13, l’incidenza della MIP è scesa da 7,8 casi per 100.000 abitanti nel 2008 a 3 casi per 100,000 nel 2014. Infatti, numerose revisioni sistematiche e/o meta-analisi [22-28] hanno dimostrato una notevole efficacia dei vaccini coniugati contro MIP [22-24], polmonite [25] e otite media [26] nei bambini piccoli. Inoltre, sono stati documentati alcuni effetti indiretti, come la riduzione della frequenza dei portatori sani e la diminuzione degli isolati resistenti agli antibiotici di prima linea [27, 28]. A tale riguardo, l’Organizzazione Mondiale della Sanità (OMS) raccomanda a tutti i Paesi del mondo di introdurre i PCV nei programmi di vaccinazione pediatrica [29].
Nonostante gli ovvi benefici dei PCV7/PCV10/PCV13, i dati più recenti dimostrano un progressivo aumento relativo dei sierotipi non inclusi in queste formulazioni vaccinali [30, 31]. Per esempio, dal 2011 al 2018 l’incidenza della MIP causata dai sierotipi non inclusi in PCV13 nei bambini europei di età < 5 anni è aumentata del 111% [30]. Una tendenza analoga è riportata nell’ultimo rapporto dell’Istituto Superiore di Sanità (ISS) sulla sorveglianza delle malattie batteriche invasive in Italia [32]. In particolare, nei bambini di età < 4 anni si evidenzia una netta predominanza (86.7%) dei sierotipi non inclusi nel PCV13 [32].
Recentemente, una nuova generazione di PCV è stata resa disponibile sia negli Stati Uniti [33, 34] sia in Europa [35, 36] ed è rappresentata dai vaccini coniugati 15-valente (PCV15 che contiene sierotipi del PCV13 più sierotipi 22F e 33F) e 20-valente (PCV20 che contiene sierotipi del PCV13 più sierotipi 8, 10A, 11A, 12F, 15B, 22F e 33F).
In Italia, il PCV7 è stato introdotto nel 2005 e in seguito, nel 2010, è stato sostituito dal PCV13 nella maggior parte delle Regioni [37]. Con l’introduzione del PCV15, l’oggetto di questo rapporto di Health Technology Assessment (HTA), nel piano nazionale/piani regionali di prevenzione, ci si aspetta un’ulteriore riduzione dei casi di MIP causata dai sierotipi 22F e 33F. Infatti, i dati recenti provenienti dalla Gran Bretagna [38], dal Canada [39] e dalla Spagna [40] suggeriscono un progressivo aumento dei casi di malattia dovuti a questi due sierotipi. È da notare che un’importante quota dei due sierotipi (specialmente 33F) è resistente alla claritromicina e al sulfametoxazolo/trimetoprim [39], riducendo quindi le opzioni terapeutiche disponibili. Negli Stati Uniti, laddove l’indicazione pediatrica di PCV15 è stata autorizzata qualche mese prima, l’Advisory Committee on Immunization Practices (ACIP) ha concluso che il PCV15 è una valida alternativa al PCV13 che può ridurre ulteriormente l’incidenza della MIP nei bambini e può essere utilizzato con lo stesso schema vaccinale del PCV13 ed è interscambiabile con quest’ultimo [41]. Pertanto, l’obiettivo di questo Capitolo HTA era di raccogliere e di analizzare in maniera sistematica gli studi sui principali aspetti clinici (immunogenicità, tollerabilità e sicurezza) del PCV15 nella popolazione pediatrica.
Come dall’attuale riassunto delle caratteristiche del prodotto [35], PCV15 (nome generico: vaccino pneumococcico polisaccaridico coniugato, 15-valente, adsorbito) è commercializzato da Merck Sharp & Dohme (MSD) ed è indicato per l’immunizzazione attiva dei bambini a partire da 6 settimane di età nella prevenzione della MIP e delle infezioni polmonari causate dai sierotipi 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F e 33F dello pneumococco. La vaccinazione avviene tramite iniezione intramuscolare (preferibilmente al livello del muscolo deltoide), seguendo lo schema stabilito dalle raccomandazioni ufficiali [35].
L’antigene è rappresentato dai polisaccaridi capsulari dei 15 sierotipi soprariportati in quantità pari a 2,0 μg per tutti eccetto il sierotipo 6B, laddove la quantità è di 4,0 μg. Tutti gli antigeni sono glico-coniugati alla proteina vettrice CRM197 (contenuto totale di circa 30 μg), un mutante non tossico della tossina difterica (Corynebacterium diphtheriae C7) espressa in forma ricombinante in Pseudomonas fluorescens [35]. CRM197 vanta un pluriennale safety record ed è attualmente utilizzata come proteina carrier sia in PCV13 che in alcuni vaccini meningococcici [42]. Inoltre, gli antigeni sono adsorbiti sul fosfato di alluminio (contenuto totale di 125 μg) [35], il quale è l’adiuvante vaccinale più utilizzato a partire dal 1920 [43].
Le controindicazioni sono circoscritte alla nota ipersensibilità ai principi attivi, a uno qualsiasi degli eccipienti (sodio cloruro, L-istidina, polisorbato 20, fosfato di alluminio) o a qualsiasi vaccino contenente il tossoide difterico [35].
Le linee guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) sono state utilizzate per il reporting del presente Capitolo [44].
I criteri di inclusione sono stati formulati, utilizzando il processo PICOS (Population, Intervention, Comparison, Outcome, Study design) [45]. Tali criteri sono stati determinati sulla base dell’analisi preliminare dei contesti nazionale [46-48] e internazionale [29, 41], saranno sostanziati nei paragrafi successivi e comprendono:
P: bambini di età ≥ 6 settimane < 18 anni;
I: PCV15;
C: PCV13 o altri vaccini coniugati a valenza minore (PCV7, PCV10);
O: Immunogenicità e frequenza degli eventi avversi (AE, Adverse Event);
S: Studi clinici randomizzati e controllati (RCT, Randomized Controlled Trial).
Per quel che concerne la popolazione pediatrica, le attuali raccomandazioni italiane [46, 47] prevedono la somministrazione del PCV13 a partire dal 61° giorno di vita (3° mese o 2 mesi compiuti) con un totale di 3 dosi (scheda 2 + 1) somministrati al 3°, 5° e 11°/13° mesi di vita. L’immunizzazione con PCV13 può avvenire in regime di co-somministrazione con il vaccino esavalente (DTaP-IPV-HepB-Hib, difterite, tetano, pertosse acellulare, poliomielite inattivato, epatite B, emofilo B). I bambini di età 12-23 mesi non vaccinati in precedenza possono ricevere 2 dosi con intervallo di ≥ 2 mesi, mentre il regime vaccinale per i bambini più grandi (≥ 2 anni) si limita a una singola dose Inoltre, 4 dosi di PCV13 (somministrati al 3°, 4°, 5° e 11°/13°) sono raccomandati ai neonati prematuri [48]. Pertanto, gli esiti di interesse valutati, utilizzando le schede vaccinali di cui sopra, sono stati ritenuti di interesse primario. Tuttavia, altri Paesi come, ad esempio gli Stati Uniti, hanno adottato uno schema base diverso: a tutti i nuovi nati di età ≥ 2 mesi può essere somministrato il ciclo primario di 3 dosi di PCV13 o di PCV15 (con intervallo di ≥ 2 mesi) seguito da una dose di richiamo somministrata a 12/15 mesi di vita (scheda 3 + 1) [41]. La scheda vaccinale 3 + 1 è stata ritenuta rilevante, in quanto il confronto diretto tra PCV15 e PCV13 in termini di immunogenicità e di sicurezza può fornire ulteriori dati utili.
L’intervento comprende PCV15 (vedi paragrafo “Descrizione della tecnologia”), mentre il comparatore attivo di interesse primario prevede il PCV13, essendo l’unico vaccino coniugato attualmente in uso in Italia. Tuttavia, i comparatori dei vaccini coniugati a valenza minore (PCV7 e PCV10 disponibili storicamente) sono stati eleggibili, in quanto la composizione qualitativa e quantitativa per gli antigeni in comune è sovrapponibile. Per motivi etici (disponibilità dei vaccini efficaci e sicuri inclusi nei piani vaccinali della maggior parte dei Paesi del mondo [29]), l’uso di placebo come comparatore non è stato previsto.
Gli esiti (outcomes) di interesse includono i domini di efficacia e di sicurezza. Per il primo, sono stati considerati gli studi di immunogenicità e, in particolar modo, gli studi di immunobridging, i quali confrontano la risposta immunitaria indotta dal nuovo vaccino con quella indotta dal vaccino autorizzato. La protezione diretta indotta dai vaccini può essere misurata, quantificando l’efficacy/efficacia teorica (e.g., riduzione dei casi di MIP o di otite media nei vaccinati con PCV rispetto ai non vaccinati e registrata nei RCT) o l’effectiveness/efficacia sul campo (e.g., riduzione dei casi di MIP o di otite media nei vaccinati con PCV rispetto ai non vaccinati e misurata dagli studi osservazionali di coorte o di caso-controllo). Nella discussione del progetto preliminare è emerso che, seppur un RCT sull’efficacia di PCV15 nel prevenire l’otite media nei bambini è in corso [49], non sono attualmente (novembre 2022) disponibili risultati di alcun RCT sull’efficacy. Analogamente, data la recente approvazione (nel 2022) del PCV15 nei bambini, la disponibilità degli studi osservazionali non è plausibile. Per tali motivi, abbiamo previsto l’inclusione dei soli studi sull’immunogenicità del PCV15. Per il dominio di sicurezza abbiamo considerato la frequenza degli AE “sollecitati” (raccolti attivamente) e “non sollecitati” (riportati spontaneamente). La descrizione completa degli esiti di immunogenicità e di sicurezza sarà fornita nei paragrafi successivi.
Infine, per quel che riguarda il disegno dello studio e tenendo conto degli esiti di cui sopra, solo i RCT sono stati ritenuti eleggibili.
Una volta soddisfatti i criteri di inclusione, sono stati applicati i seguenti criteri di esclusione: (i) manoscritti ritenuti ridondanti; (ii) popolazione dello studio mista (e.g., bambini e adulti) senza stratificazione per fasce di età; (iii) utilizzo delle formulazioni sperimentali del PCV15; (iv) utilizzo di altri vaccini coniugati 15-valenti non disponibili in Italia.
L’autorizzazione dei nuovi vaccini anti-pneumococcici è guidata dagli studi di immunogenicità, nei quali si dimostra la capacità dei vaccini di indurre una risposta immunitaria umorale ritenuta protettiva nei confronti della malattia (i.e., correlato di protezione) [50]. Analogamente ad altri batteri incapsulati, la protezione dall’infezione pneumococcica è correlata agli anticorpi anti-capsulari che possono essere misurati tramite diversi saggi ELISA (Enzyme-Linked ImmunoSorbent Assay) [51, 52]. Un’analisi preliminare della letteratura ha suggerito che l’immuno-saggio di elettrochemiluminiscenza (ImmunoChemoLuminescence Assay, ECL) è quello maggiormente utilizzato per quantificare la concentrazione sierotipo specifica di IgG totali. La concentrazione di IgG totali ≥ 0,35 μg/ml è universalmente accettata come un correlato di protezione [50-52] e la quantificazione della percentuale dei soggetti vaccinati che raggiungono tale concentrazione è raccomandata dall’OMS e da altri Enti regolatori [29]. Il cut-off di 0,35 μg/ml deriva da una meta-analisi di 3 RCT condotti nei bambini vaccinati con PCV7 [53].
Inoltre, la risposta immune funzionale (i.e., la capacità di anticorpi di promuovere la fagocitosi, uccidendo quindi gli pneumococchi) può essere misurata tramite i saggi di opsonofagocitosi (OpsonoPhagocytosis Assay, OPA). I saggi OPA misurano gli anticorpi in grado di opsonizzare i polisaccaridi capsulari degli pneumococchi, favorendo la fagocitosi e quindi la soppressione del batterio. Il titolo anticorpale OPA viene riportato come il reciproco della più elevata diluizione sierica che riduce la sopravvivenza degli pneumococchi di ≥ 50% [51, 52].
Dal momento che l’OMS raccomanda [29] che sia IgG totali sia anticorpi opsonizzanti debbano essere misurati, i seguenti parametri di immunogenicità sono stati eventualmente considerati:
concentrazione media geometrica (Geometric Mean Concentration, GMC) o titolo medio geometrico (Geometric Mean Titer, GMT) di anticorpi sierotipo specifici e misurati rispettivamente nei saggi ECL o OPA;
percentuale dei soggetti ritenuti sieroprotetti, i.e., quelli che raggiungono la concentrazione di IgG totali ≥ 0,35 μg/ml.
Inoltre, negli studi clinici controllati con un comparatore attivo (specialmente negli studi di immunobridging), possono essere applicati sia i criteri di non inferiorità sia i criteri di superiorità [54]. Tali criteri differiscono dai test statistici di verifica di ipotesi e vanno formulati ad hoc. Nel presente lavoro, i criteri di non inferiorità sono stati principalmente applicati ai 13 sierotipi in comune tra PCV15 e PCV13. I criteri di superiorità sono stati invece applicati ai sierotipi 22F e 33F che sono unici del PCV15. In particolare, il PCV15 è stato ritenuto non inferiore al PCV13 se il limite inferiore dell’intervallo di confidenza (IC) al 95% a due code del rapporto tra le GMC in seguito alla vaccinazione era > 0,5. L’analogo criterio di superiorità prevedeva che il limite inferiore dell’IC al 95% a due code del tale era > 2,0. Inoltre, il PCV15 è stato ritenuto non inferiore al PCV13 se il limite inferiore dell’IC al 95% a due code della differenza nella proporzione dei soggetti sieroprotetti (% PCV15-% PCV13) era > -15%.
Un AE è stato definito come qualsiasi episodio sfavorevole di natura medica che si verifichi in un soggetto vaccinato e che non deve avere necessariamente una relazione causale con la vaccinazione. Un evento avverso serio (Serious Adverse Event, SAE) è stato definito come un AE dosaggio sia fatale, metta in pericolo di vita, richieda il ricovero in ospedale oppure il suo prolungamento, porti a invalidità/incapacità persistente o significativa. [55]. Nel presente capitolo, sono stati valutati sia gli AE sollecitati (raccolta attivamente dallo sperimentatore e tipicamente durante le prime 2 settimane dalla vaccinazione) sia quelli riportati spontaneamente/non sollecitati (raccolti passivamente per tutto periodo dello studio). La prima tipologia di AE si riferisce quindi agli aspetti di reattogenicità/tollerabilità, mentre la seconda fa riferimento alla sicurezza in generale. I seguenti parametri sono stati considerati: (i) percentuale di soggetti vaccinati con PCV15 e PCV13 con ≥ 1 AE; (ii) percentuale di soggetti vaccinati con PCV15 e PCV13 con ≥ 1 AE locale (nel sito di iniezione); (iii) percentuale di soggetti vaccinati con PCV15 e PCV13 con ≥ 1 AE sistemico; (iv) percentuale di soggetti vaccinati con PCV15 e PCV13 con ≥ 1 SAE; (v) percentuale di soggetti vaccinati con PCV15 e PCV13 con ≥ 1 AE ritenuto correlato alla vaccinazione; (vi) percentuale di soggetti vaccinati con PCV15 e PCV13 con ≥ 1 SAE ritenuto correlato alla vaccinazione. La valutazione del nesso causale è tipicamente eseguita dallo sperimentatore qualificato.
Sono stati valutati a priori i seguenti AE locali: eritema, gonfiore, indurimento e dolore/dolorabilità nel sito di iniezione. Per gli AE sistemici nei bambini piccoli (laddove quindi la segnalazione proviene dai genitori/tutori legali) sono stati analizzati: febbre ≥ 38 °C/piressia, irritabilità, sonnolenza, inappetenza/modifica del comportamento alimentare. Per i bambini più grandi e adolescenti sono stati invece considerati febbre ≥ 38 °C/piressia, affaticamento/malessere generale, mal di testa, mialgia e artralgia.
La ricerca della letteratura è stata eseguita il 03/11/2022 da AD e comprendeva sia la ricerca automatica sia quella manuale. La ricerca automatica è stata compiuta in due passaggi. Innanzitutto, è stata utilizzata la piattaforma aggregatrice OVID (https://ovidsp.ovid.com/) che comprende le seguenti banche dati: (i) Medline, (ii) Biological Abstracts e (iii) Global Health. L’algoritmo della ricerca automatica via OVID è stato elaborato, utilizzando una combinazione dei termini MeSH (Medical Subject Headings) e delle parole chiave testuali ed è riportato nella Tabella I. Al fine di aumentare la sensibilità, durante la ricerca automatica non è stato applicato alcun filtro.
Algoritmo di ricerca automatica, utilizzato nella piattaforma OVID.
| # | Script |
|---|---|
| 1 | (PCV15 or PCV-15 or V114 or Vaxneuvance).mp. |
| 2 | (15 valent Pneumococcal Conjugate Vaccine or 15valent Pneumococcal Conjugate Vaccine).mp. |
| 3 | ((15 valent or 15valent) and (pneumococc* adj3 conjugate* adj3 vaccin*)).ab. |
| 4 | or/1-3 |
| 5 | Exp Child/ or exp infant/ or adolescent/ or exp pediatrics/ or child, abandoned/ or exp child, exceptional/ or child, orphaned/ or child, unwanted/ or minors/ or (pediatric* or paediatric* or child* or newborn* or congenital* or infan* or baby or babies or neonat* or pre-term or preterm* or premature birth* or NICU or preschool* or pre-school* or kindergarten* or kindergarden* or elementary school* or nursery school* or (day care* not adult*) or schoolchild* or toddler* or boy or boys or girl* or middle school* or pubescen* or juvenile* or teen* or youth* or high school* or adolesc* or pre-pubesc* or prepubesc*).mp. or (child* or adolesc* or pediat* or paediat*).jn. |
| 6 | 4 and 5 |
| 7 | Remove duplicates from 6 |
In secondo luogo, sono stati esplorati i principali registri degli studi clinici, i.e., quello statunitense disponibile su https://clinicaltrials.gov e quello europeo disponibile su https://www.clinicaltrialsregister.eu. In questi registri, è stato utilizzato il seguente script: “15 valent pneumococcal OR 15 valent conjugate OR 15valent pneumococcal OR 15valent conjugate OR PCV15 OR PCV 15 OR V114 OR Vaxneuvance”. È stato applicato un filtro relativo alla popolazione dello studio (Children and/or Adolescent).
La ricerca manuale è stata eseguita sia tramite modalità backward (i.e., revisionando la bibliografia dei manoscritti individuati durante la selezione automatica) sia tramite la ricerca forward (i.e., ricercando ulteriori riferimenti bibliografici che hanno citato i manoscritti individuati in precedenza). Per quest’ultima modalità di ricerca è stata utilizzata la banca dati Google Scholar (https://scholar.google.com/). Infine, sono stati esplorati gli abstract books dei congressi/conferenze delle principali società scientifiche (European Society of Clinical Microbiology and Infectious Diseases, ECCMID; European Society For Paediatric Infectious Diseases, ESPID; IDWeek).
I risultati prodotti dalla ricerca automatica sono stati scaricati dalle corrispettive banche dati e i record duplicati sono stati rimossi. I titoli e/o abstract dei record rimanenti sono stati quindi sottoposti allo screening e quei record chiaramente non idonei sono stati esclusi. In seguito, i manoscritti ritenuti potenzialmente eleggibili sono stati scaricati e valutati in extenso, applicando i criteri di inclusione e di esclusione riportati sopra. Considerando la quantità non elevata dei record disponibili, la selezione degli studi è stata condotta da un solo ricercatore (AD). Eventuali incertezze sono state risolte, coinvolgendo un altro ricercatore.
I dati di interesse sono stati estratti in un foglio di lavoro elettronico da AD. In particolare, sono state estrapolate le seguenti informazioni:
record bibliografico completo;
principali aspetti del disegno dello studio;
principali caratteristiche della popolazione dello studio (e.g., sottofasce di età, stato di esposizione precedente, fattori di rischio, condizioni di salute);
paese/i e periodo dello studio;
comparatore attivo;
scheda vaccinale utilizzata/numero di dosi;
dimensione campionaria per braccio e totale;
misure di effetto degli esiti di immunogenicità e di sicurezza (vedi sopra) con qualsiasi misura di dispersione statistica (e.g., IC, deviazione standard, errore standard);
altre informazioni ritenute rilevanti.
I dati di interesse mancanti, poco chiari o presenti solo in forma grafica sono stati reperiti, incrociando eventualmente i manoscritti pubblicati su riviste a revisione paritaria con i corrispettivi record disponibili nei registri di RCT. L’autore per corrispondenza o lo sponsor dello studio sono stati eventualmente contattati per chiarimenti o richieste dei dati.
Il rischio di confondimento (bias) dei RCT inclusi è stato valutato da AD tramite lo strumento Cochrane RoB 2 (Risk of Bias 2) [56] predisposto dalla Cochrane Collaboration.
Sulla base dei principali attributi del disegno e della popolazione, gli studi inclusi sono stati categorizzati e sintetizzati qualitativamente (sia in forma tabellare sia in forma grafica). Considerando un’ampia eterogeneità delle popolazioni pediatriche e delle schede vaccinali, è stato deciso di non eseguire alcuna analisi quantitativa (meta-analisi).
La ricerca automatica ha individuato un totale di 239 record (OVID: n = 71; registri di studi clinici: n = 168). In seguito alla rimozione manuale dei duplicati (n = 8), un totale di 231 record sono stati sottoposti allo screening dei titoli/riassunti. Un totale di 13 record è stato giudicato potenzialmente eleggibile e valutato in extenso. Di questi ultimi, 11 record [57-63, 66-69] hanno soddisfatto i criteri di idoneità e sono stati inclusi nella sintesi qualitativa. Undici record corrispondevano a 12 studi, in quanto un manoscritto [59] ha riportato i risultati di due RCT. La ricerca manuale ha individuato ulteriori due RCT [64, 65] sotto forma di abstract congressuale. Gli aspetti metodologici di questi ultimi due sono stati reperiti dal registro ClinicalTrials.gov. Due studi [70, 71] sono stati invece esclusi. Il primo studio [70] rappresentava un’analisi post-hoc del RCT di Rupp et al. [59] (incluso nella presente revisione sistematica), nella quale i titoli anticorpali dei bambini vaccinati sono stati correlati a diverse misure di immunogenicità ottenute da un modello animale. Il secondo RCT escluso [71] riguardava un vaccino pneumococcico coniugato 15-valente di LvZhu & Co Ltd. In sintesi, la presente analisi si basa su 13 record [57-69] che corrispondono a 14 diversi RCT. L’intero processo di selezione degli studi è riportato nella Figura 1.
Processo di selezione degli studi.
Nella Tabella II sono riportate le principali caratteristiche degli studi inclusi. Le seguenti caratteristiche erano comuni a tutti gli studi: (i) RCT multicentrici, in doppio cieco, con comparatore attivo, sponsorizzati da MSD; (ii) valutazione di immunogenicità sierotipo specifica in ECL e/o in OPA a distanza di 30 giorni da ciascuna vaccinazione (a seconda della scheda vaccinale adottata); (iii) valutazione degli AE sollecitati e non sollecitati rispettivamente nei primi 14 giorni post-vaccinazione e per l’intera durata dello studio. Il PCV13 è stato utilizzato come comparatore attivo in tutti tranne uno studio [57], laddove il PCV15 è stato confrontato con il PCV7. Quattro manoscritti [57-60] riportavano i risultati di 5 RCT di fase I e/o II, mentre i restanti nove [61-69] erano i RCT di fase III.
Caratteristiche principali degli studi inclusi (tutti gli studi sono multicentrici, randomizzati, controllati, in doppio cieco, e hanno valutato sia l’immunogenicità sia la tollerabilità/sicurezza).
| Studio/NCT [Rif.] | Fase | Paese (periodo) | Caratteristiche dei soggetti all’arruolamento | Scheda vaccinale | Numero dei partecipanti |
|---|---|---|---|---|---|
| Sobanjo-ter Meulen et al., NCT01215175 [57] | I | Finlandia, Stati Uniti (2009-2010) | Bambini di età 12-15 mesi vaccinati in precedenza con 3 dosi di PCV7 | 1 dose di richiamo | Coorte 1 (PCV15 formulazione adiuvata): 33; Coorte 2 (PCV15 formulazione non adiuvata): 29; Coorte 3 (PCV7): 28; Totale: 90 |
| Greenberg et al, NCT01215188 [58] | II | Finlandia, Spagna, Israele, Canada, Stati Uniti (2010-2012) | Bambini di età 6-12 settimane | 3+1 (2, 4, 6 e 12/15 mesi di età) | Coorte 1 (PCV15 formulazione adiuvata): 381; Coorte 2 (PCV15 formulazione non adiuvata): 386; Coorte 3 (PCV13): 381; Totale: 1.148 |
| Rupp et al., NCT02037984, NCT02531373 [59] | I/II | Stati Uniti (NCT02037984: 2014-2016; NCT02531373: 2015-2017) | Bambini di età 6-12 settimane | 3+1 (2, 4, 6 e 12/15 mesi di età) | Coorti PCV15 (lotti 1-6): 199 (studio 1, lotti 1-4), 102 (studio 2, lotti 5 e 6); a Coorti PCV13: 51 (studio 1), 52 (studio 2) Totale: 404 |
| Platt et al., NCT02987972 [60] | II | Finlandia, Spagna, Israele, Danimarca, Canada, Stati Uniti (2017-2019) | Bambini di età 6-12 settimane | 3+1 (2, 4, 6 e 12/15 mesi di età) | Coorte 1 (PCV15 lotto 1): 351; Coorte 2 (PCV15 lotto 2): 350; Coorte 3 (PCV13): 350; Totale: 1.051 |
| NCT03620162 [61] | III | Stati Uniti, Puerto Rico, Tailandia, Turchia (2019-2020) | Bambini di età 6-12 settimane | 3+1 (2, 4, 6 e 12/15 mesi di età) | Coorte 1 (PCV13 + PCV13 + PCV13 + PCV 13): 179; Coorte 2 (PCV13 + PCV13 + PCV13 + PCV 15): 181; Coorte 3 (PCV13 + PCV13 + PCV15 + PCV 15): 180; Coorte 4 (PCV13 + PCV15 + PCV15 + PCV 15): 180; Coorte 5 (PCV15 + PCV15 + PCV15 + PCV 15): 180; Totale: 900 |
| NCT03565900 [62] b | III | Stati Uniti, Australia, Belgio, Brasile, Canada, Colombia, Francia, Germania, Messico (2018-2021) | Bambini di età 3-17 anni sottoposti al trapianto allogenico di cellule staminali ematopoietiche | 3 dosi (ai tempi 0, 1 e 2 mesi 60-180 giorni dal trapianto) seguite da 1 dose di PPV23 a distanza di un anno dal trapianto | Coorte 1 (PCV15 + PPV23): 8; Coorte 2 (PCV13 + PPV23): 6; Totale: 14 |
| Banniettis et al., NCT03885934 [63] | III | Finlandia, Malesia, Polonia, Russia, Tailandia (2019-2020) | Coorte 1: Bambini di età 7-11 mesi naïve; Coorte 2: Bambini di età 12-23 mesi naïve; Coorte 3: Bambini di età 2-17 anni precedentemente vaccinati con ≥ 1 dose di PCV7, PCV10 o PCV13 |
Coorte 1: 3 dosi (ai tempi 0, 4/8 settimane e 8/12 settimane); Coorte 2: 2 dosi (ai tempi 0 e 4/8 settimane); Coorte 3: 1 dose |
Coorte 1: 128 (PCV15: 64; PCV13: 64); Coorte 2: 126 (PCV15: 62; PCV13: 64); Coorte 3 (PCV13): 352 (PCV15: 177; PCV13: 175); Totale: 606 |
| Martinón-Torres et al., NCT04031846 [64] | III | Australia, Belgio, Cechia, Estonia, Germania, Grecia, Polonia, Russia, Spagna (2019-2021) | Bambini di età 6-12 settimane | 3 dosi (ai tempi 0, 2 e 9/12 mesi) o 4 dosi per i bambini nati pre-termine (ai tempi 0, 12 e 9/12 mesi) | Coorte 1 (PCV15): 588; Coorte 2 (PCV13): 591; Totale: 1.179 |
| Benfield et al., NCT04016714 [65] | III | Danimarca, Finlandia, Italia, Norvegia, Svezia (2019-2021) | Bambini di età 10-15 settimane | 3 dosi (all’età di circa 3, 5 e 12 mesi) | Coorte 1 (PCV15): 595; Coorte 2 (PCV13): 596; Totale: 1.191 |
| NCT03731182 [66] | III | Stati Uniti, Brasile, Colombia, Repubblica Dominicana, Grecia, Italia, Panama (2019-2021) | Bambini di età 5-17 anni affetti da anemia falciforme | 1 dose | Coorte 1 (PCV15): 70; Coorte 2 (PCV13): 34; Totale: 104 |
| NCT03921424 [67] | III | Sudafrica, Tailandia, Ucraina (2019-2021) | Bambini di età 6-17 anni affetti da HIV | 1 dose seguita da PPV23 a distanza di 8 settimane | Coorte 1 (PCV15 + PPV23): 203; Coorte 2 (PCV13 + PPV23): 204; Totale: 407 |
| NCT03692871 [68] | III | Stati Uniti, Australia, Canada, Finlandia, Germania, Israele, Malaysia, Perù, Taiwan, Tailandia (2018-2021) | Bambini di età 6-12 settimane | 3+1 (2, 4, 6 e 12/15 mesi di età) | Coorte 1 (PCV15): 1.972; Coorte 2 (PCV13): 437; Totale: 2.409 |
| NCT03893448 [69] | III | Stati Uniti, Puerto Rico, Tailandia, Turchia (2019-2021) | Bambini di età 6-12 settimane | 3+1 (2, 4, 6 e 12/15 mesi di età) | Coorte 1 (PCV15): 860; Coorte 2 (PCV13): 860; Totale: 1.720 |
| a Coorti PCV15 (lotti 1-6) differivano per la quantità di antigene/adiuvante e per il processo di produzione della proteina vettrice; ciascuna coorte era composta da circa 50 soggetti. b La maggior parte (94,9%) dei soggetti arruolati erano adulti; solo i dati relativi alla sicurezza e specifici per la popolazione pediatrica sono disponibili pubblicamente. | |||||
Tutti i RCT inclusi [57-69] sono stati giudicati a basso rischio di bias in tutti i domini.
Il primo studio pediatrico di fase I [57] è stato condotto negli anni 2009 e 2010 e poneva come l’obiettivo la valutazione dell’immunogenicità e della sicurezza di una singola dose di PCV15 nei bambini al secondo anno di vita che avevano ricevuto la seria primaria di 3 dosi di PCV7. Un totale di 90 bambini di età 12-15 mesi è stato randomizzato (1:1:1) in 3 gruppi che comprendevano una formulazione di PCV15 adiuvata, una formulazione di PCV15 non adiuvata e il PCV7. La frequenza degli AE sollecitati è stata simile tra i tre gruppi: almeno un AE è stato riportato nel 93,9, nell’89,3 e nell’85,7% dei bambini ai quali sono stati somministrati rispettivamente il PCV15 adiuvato, il PCV15 non adiuvato e il PCV7. La maggior parte degli AE era di natura transitoria e di intensità da leggera a moderata. Non è stato registrato alcun SAE correlabile alla vaccinazione. Un quadro analogo è emerso dal confronto dei parametri di immunogenicità che è stata misurata sia in ECL sia in OPA. In particolare, la risposta immune per i 7 sierotipi in comune era generalmente simile tra i tre vaccini. Per quel che riguarda gli altri 8 sierotipi, entrambe le formulazioni di PCV15 sono risultate altamente immunogene e generalmente paragonabili tra loro. Va tuttavia notato che questo studio non è stato disegnato al fine di confrontare la formulazione adiuvata con quella non adiuvata [57].
Risultati di altri due RCT di fase I/II con un totale di otto bracci (5 in NCT02037984 e 3 in NCT02531373) sono stati riportati da Rupp et al. [59]. Entrambi gli studi seguivano lo schema statunitense 3 + 1 con il PCV13 che rappresentava il gruppo di controllo. Il primo RCT (NCT02037984) utilizzava lo stesso processo di coniugazione per tutti i 15 sierotipi (nel manoscritto originale riferito come il PCV15-A), mentre nel secondo (NCT02531373) è stato utilizzato un processo di coniugazione alternativo per 8 sierotipi (nel manoscritto originale riferito come il PCV15-B). Inoltre, il disegno di entrambi gli studi era dose-finding, poiché si variava sia la quantità di antigene [(i) dosaggio medio utilizzato nella formulazione autorizzata da 2,0 μg per tutti i sierotipi eccetto il sierotipo 6B con 4,0 μg; (ii) dosaggio dimezzato (1,0 μg per tutti i sierotipi eccetto il sierotipo 6B con 2,0 μg) o (iii) il dosaggio raddoppiato (4,0 μg per tutti i sierotipi eccetto il sierotipo 6B con 8,0 μg)] sia la quantità dell’adiuvante (attuali 125 μg o il dosaggio raddoppiato di 250 μg). I risultati di questi studi hanno quindi permesso di selezionare quella formulazione di PCV15 che rappresentava un trade-off ottimale tra la massimizzazione dell’immunogenicità e la minimizzazione della reattogenicità. In particolare, i profili di immunogenicità e di tollerabilità di tutte le formulazioni di PCV15-A e PCV15-B erano paragonabili con quelli di PCV13. Tuttavia, l’incremento della quantità del fosfato di alluminio non comportava dei vantaggi significativi in termini della risposta anticorpale. Rispetto alla formulazione con il dosaggio di antigene dimezzato, quella con il dosaggio medio dimostrava un significativo aumento della risposta verso alcuni sierotipi, mentre il raddoppiamento della quantità di antigene generalmente non comportava dei benefici sostanziali rispetto al dosaggio medio. D’altronde, la modifica del processo di coniugazione utilizzato nel processo produttivo di CRM197 (formulazione PCV15-B) migliorava significativamente il profilo generale di immunogenicità sia rispetto al PCV15-A sia rispetto al PCV13. Ad esempio, in seguito alla quarta dose, la proporzione dei soggetti con la concentrazione di IgG ≥ 0,35 μg/ml verso il sierotipo 3 era del 96,9% nei bambini vaccinati con il PCV15-B e dell’83,3% nei bambini vaccinati con il PCV13. Il PCV15-B è stato inoltre altamente immunogeno rispetto ai sierotipi unici 22F e 33F. Infatti, il 100% (IC 95%: 89,1-100%) dei bambini hanno raggiunto il livello di IgG protettivo. Per tutti questi motivi la formulazione PCV15-B, che corrisponde alla formulazione attualmente autorizzata, è stata selezionata per lo sviluppo clinico successivo [59].
Uno studio più grande (n = 1.148 bambini di età 6-12 settimane) di fase II ha confrontato gli aspetti di immunogenicità e di sicurezza del PCV15 nelle versioni adiuvata e non adiuvata con quelli di PCV13 [58]. La vaccinazione avveniva a seconda della scheda statunitense 3 + 1. La frequenza degli AE sistemici era paragonabile tra i tre gruppi, mentre la proporzione dei bambini con almeno un AE nel sito di iniezione (dolore in primis) era leggermente più alta nei soggetti vaccinati con la formulazione adiuvata di PCV15. Per quel che concerne la risposta immunitaria verso diversi sierotipi, lo studio ha confermato il vantaggio della formulazione adiuvata di PCV15 rispetto a quella non adiuvata. Dal confronto diretto con il PCV13 è emerso che un mese dopo la 3° dose, nel saggio ECL il vaccino PCV15 adiuvato ha soddisfatto il criterio di non inferiorità per 11 sierotipi in comune (1, 3, 4, 5, 6B, 7F, 9V, 14, 18C, 19F e 23F), mentre per i restanti sierotipi 6A [GMC 0,32 (IC 95%: 0,26-0,38)] e 19A [GMC 0,44 (IC 95%: 0,38-0,51)] tale criterio non è stato soddisfatto. Dall’altro lato, il PCV15 era più immunogeno del PCV13 nei confronti del sierotipo 3. Segnatamente, il 93,3% (IC 95%: 89,9-95,9%) e il 69,2% (IC 95%: 63,8-74,3%) dei bambini immunizzati rispettivamente con la formulazione adiuvata di PCV15 o con il PCV13 hanno raggiunto la concentrazione di IgG ≥ 0,35 μg/ml, risultando in un vantaggio del PCV15 pari al 24,1% (IC 95%: 18,3-30,0%). Analogamente, la magnitudine della risposta immunitaria è stata dell’89% [GMC PCV15/PCV13 1,89 (IC 95%: 1,69-2,18)] superiore nel braccio PCV15 adiuvato. Infine, il PCV15 è stato altamente immunogeno verso i sierotipi non inclusi nel PCV13: il 99,0% (IC 95%: 97,1-100%) e l’83,3% (IC 95%: 78,6-87,4%) dei bambini erano considerati sieroprotetti nei confronti dei sierotipi 22F e 33F rispettivamente. Il profilo di immunogenicità in seguito alla quarta dose era del tutto simile a quello osservato dopo la serie primaria di 3 dosi [58].
Infine, il RCT di fase II di Platt et al. [60] ha valutato la bioequivalenza tra lotti (lot-to-lot consistency) di PCV15. Nello specifico, 1.051 bambini di età 6-12 settimane sono stati randomizzati (1:1:1) in tre gruppi: i primi due sono stati vaccinati con due diversi lotti di PCV15, mentre il terzo gruppo di controllo ha ricevuto il PCV13. La scheda vaccinale era quella statunitense 3 + 1. La risposta immune verso i 13 sierotipi in comune e misurata in saggi ECL e OPA sia dopo la serie primaria sia dopo la dose booster era simile tra i tre gruppi di bambini. Il criterio di non inferiorità è stato ampiamente soddisfatto per entrambi i lotti di PCV15 (Fig. 2). Tuttavia, in seguito alla serie primaria di tre dosi, la protezione (concentrazione di IgG ≥ 0,35 μg/ml) verso il sierotipo 3 indotta dal PCV15 (lotti 1 e 2: 95,1%) era statisticamente superiore rispetto al PCV13 (71,7%). Per quel che concerne l’immunogenicità verso i sierotipi unici 22F e 33F, l’87,7-98,9% e il 99,6-100% dei bambini rispettivamente dopo la terza e dopo la quarta dose hanno raggiunto la concentrazione protettiva di IgG [60].
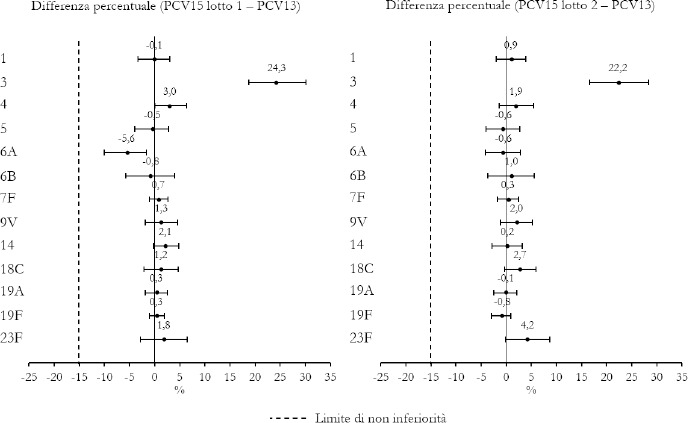
Differenza tra le proporzioni dei bambini vaccinati con la concentrazione di IgG ≥ 0,35 μg/ml misurati a un mese dopo la serie primaria della vaccinazione con la scheda statunitense 3 + 1, per sierotipo in comune (analisi di non inferiorità) e tipo del vaccino/lotto [60].
Lo studio PNEU-PED-EU-1 (NCT04031846) [64] rappresenta il fulcro del presente Capitolo, in quanto il suo disegno rispecchia le raccomandazioni italiane attualmente in vigore [46, 47]. Per tale motivo, i risultati di questo studio saranno descritti in maniera approfondita. In questo RCT di fase III, 1.180 bambini di età 6-12 settimane (~2 mesi) sono stati randomizzati in rapporto 1:1 in gruppi PCV15 e PCV13. La scheda vaccinale era identica per i 2 due gruppi e a seconda dell’età gestazionale alla nascita, prevedeva la somministrazione di 3 (scheda 2 + 1) o 4 (scheda 3 + 1) dosi di ciascun vaccino. In particolare, i bambini nati a termine (≥ 37 settimane di gravidanza) hanno ricevuto 3 dosi ai tempi 0, 2 e 9/12 mesi corrispondenti all’età anagrafica di circa 2, 4 e 11/15 mesi compiuti. I bambini nati pre-termine (< 37 settimane di gravidanza) hanno seguito un regime di 4 dosi somministrati all’età anagrafica di circa 2, 3, 4 e 11/15 mesi compiuti. Ciascuna seduta di vaccinazione con il PCV15 o il PCV13 avveniva in co-somministrazione con un vaccino esavalente DTaP-IPV-HepB-Hib. Inoltre, durante la seconda dose (o terza nei bambini nati pre-termine) è stato somministrato un vaccino vivo attenuato contro il rotavirus. In tutti i bambini vaccinati, l’immunogenicità misurata in ECL è stata valutata a distanza di 30 giorni sia al completamento della serie primaria (2° o 3° dose rispettivamente nei bambini nati a termine e nei bambini nati pre-termine) sia in seguito alla dose di richiamo. L’immunogenicità misurata in OPA è stata valutata in una parte dei vaccinati.
L’analisi di immunogenicità in ECL è stata eseguita su un totale di 1.179 bambini, dei quali 588 e 591 sono stati randomizzati rispettivamente nei gruppi PCV15 o PCV13. A distanza di un mese dal completamento della serie primaria di due dosi, la proporzione dei bambini che hanno raggiunto la concentrazione di IgG protettiva (≥ 0,35 μg/ml) era simile tra i due gruppi (Fig. 3), soddisfacendo il criterio di non inferiorità per tutti i sierotipi in comune. È interessante notare che la proporzione dei bambini protetti dal sierotipo 3 era del 25,7% (IC 95%: 21,1-30,3%) maggiore nel gruppo PCV15. Al completamento del ciclo vaccinale (i.e., 30 giorni dopo la dose di richiamo), il 92-100% dei bambini vaccinati con il PCV15 hanno raggiunto la sieroprotezione e la non inferiorità al PCV13 rispetto ai 13 sierotipi in comune è stata ampiamente dimostrata (Fig. 4). Sebbene la differenza sia ridotta, la percentuale dei bambini sieroprotetti nei confronti del sierotipo 3 era dell’8,2% (IC 95%: 4,4-12,2%) maggiore nel gruppo PCV15 [92,0% (IC 95%: 89,4-94,2%)] rispetto al gruppo PCV13 [83,8% (IC 95%: 80,4-86,8%)].
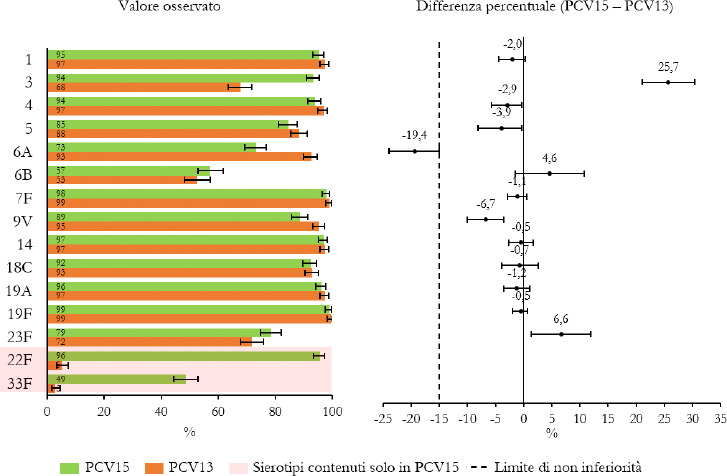
Confronto tra la proporzione dei bambini vaccinati con il PCV15 (n = 588) o il PCV13 (n = 591) che hanno raggiunto la concentrazione IgG ≥ 0,35 μg/ml misurati a un mese dopo il completamento della serie primaria di 2 dosi, per sierotipo [64].
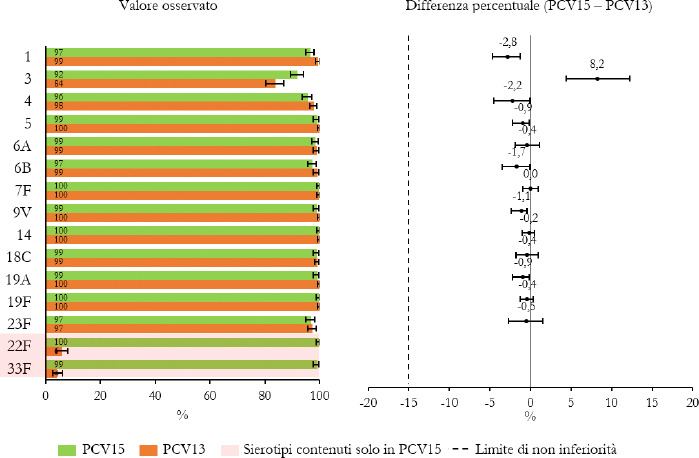
Confronto tra la proporzione dei bambini vaccinati con il PCV15 (n = 588) o il PCV13 (n = 591) che hanno raggiunto la concentrazione IgG ≥ 0,35 μg/ml misurati a un mese dopo la terza dose di richiamo, per sierotipo [64].
PCV15 si è dimostrato altamente immunogeno nei confronti dei due sierotipi aggiuntivi (Figg. 3, 4). In particolare, in seguito alla dose booster, il 99,6% (IC 95%: 98,7-100%) e il 99,1% (IC 95%: 97,8-99,7%) dei bambini hanno raggiunto la concentrazione di IgG ≥ 0,35 μg/ml nei confronti rispettivamente dei sierotipi 22F e 33F (Fig. 4).
L’analisi stratificata per l’età gestazionale alla nascita (Fig. 5) era conforme all’analisi dell’intera coorte e senza alcuna differenza notevole tra i bambini nati a termine e quelli nati pre-termine.
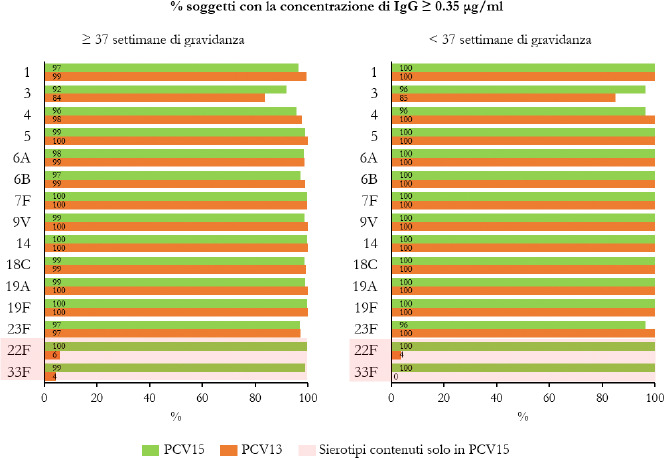
Confronto tra la proporzione dei bambini vaccinati con il PCV15 (n = 588) o il PCV13 (n = 591) che hanno raggiunto la concentrazione IgG ≥ 0,35 μg/ml misurati a un mese dopo la terza dose di richiamo, per sierotipo ed età gestazionale alla nascita [64].
Un subset (n = 238) dei bambini è stato incluso nella valutazione dei titoli opsonizzanti. I risultati ottenuti nel saggio OPA rispecchiavano quelli ottenuti in ECL con un’ampia sovrapposizione degli IC al 95% delle GMT per la maggior parte dei sierotipi in comune. Inoltre, il PCV15 ha indotto un alto livello di anticorpi opsonizzanti verso i sierotipi 22F e 33F, dimostrando una netta superiorità rispetto al PCV13 (Fig. 6).
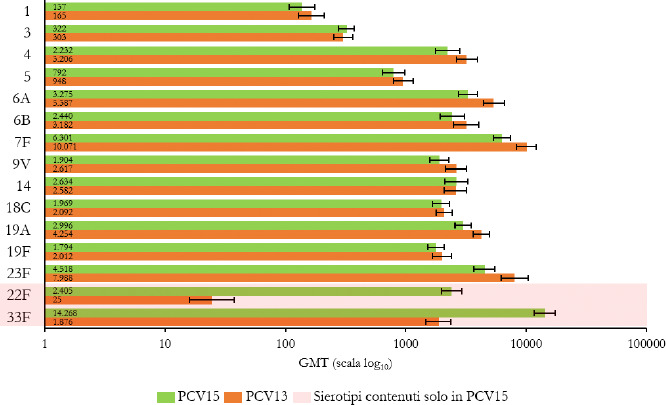
Confronto tra le medie geometriche dei titoli (GMT) di anticorpi opsonizzanti nei bambini vaccinati con il PCV15 (n = 116) o il PCV13 (n = 122) misurati a un mese dopo la terza dose di richiamo, per sierotipo [64].
Lo studio ha inoltre valutato una possibile interferenza immunologica di PCV15/PCV13 somministrati nella stessa seduta con i vaccini esavalente o anti-rotavirus vivo attenuato. Come riporta la Tabella III, il 98-100% dei bambini può essere considerato sieroprotetto nei confronti di ciascun antigene incluso nel vaccino DTaP-IPV-HepB-Hib. Le differenze nelle percentuali del tasso di sieroprotezione nei bambini immunizzati con il PCV15 o il PCV13 non differivano statisticamente (Tab. III). Analogamente, le GMT di IgA anti-rotavirus erano simili nei gruppi PCV15 (GMT = 45,39) e PCV13 (GMT = 47,07), con un rapporto GMT PCV15/PCV13 non statisticamente significativo (0,96; IC 95%: 0,80-1,16).
Proporzione dei bambini sieroprotetti rispetto ai singoli antigeni del vaccino esavalente DTaP-IPV-HepB-Hib a un mese dopo la terza dose di richiamo, per tipologia di vaccino [64].
| Antigene del vaccino esavalente | Criterio di sieroprotezione | PCV15, % (N) | PCV13, % (N) | Δ PCV15-PCV13, % (IC 95%) |
|---|---|---|---|---|
| Tossoide difterico | ≥ 0,1 IU/ml | 99,3(537) | 99,8(533) | -0,6 (-1,7-0,4) |
| Tossoide tetanico | 99,6(537) | 100(533) | -0,4 (-1,3-0,3) | |
| Tossoide pertossico | ≥ 5 EU/ml | 99,4(537) | 99,6(533) | -0,2 (-1,3-0,9) |
| Emoagglutinina filamentosa (pertosse) | 99,8(537) | 100(533) | -0,2 (-1,0-0,5) | |
| Pertactina (pertosse) | 99,6(537) | 100(533) | -0,4 (-1,3-0,3) | |
| Polisaccaride di H. influenzae tipo b | ≥ 0,15 μg/ml | 98,5(524) | 98,1(523) | 0,4 (-1,3-2,1) |
| HBsAg | ≥ 10 mIU/ml | 99,2(522) | 100(521) | -0,8 (-2,0-0,0) |
| Poliovirus 1 | Titolo degli anticorpi neutralizzanti ≥ 1:8 | 100(526) | 100(521) | 0,0 (-0,7-0,7) |
| Poliovirus 2 | 100(525) | 100(525) | 0,0 (-0,7-0,7) | |
| Poliovirus 3 | 100(531) | 99,8(523) | 0,2 (-0,5-1,1) |
Il quesito clinico se il PCV13 possa essere sostituito dal PCV15 in una qualsiasi seduta vaccinale consecutiva (seguendo lo schema statunitense 3 + 1) è stato posto nello studio di fase III PNEU-DIRECTION (NCT03620162) [61]. Un totale di 900 bambini di età ~2 mesi sono stati randomizzati (1:1:1:1:1) in 5 gruppi. Nel gruppo 1, tutti i bambini hanno ricevuto 4 dosi di PCV13, mentre nel gruppo 5 è stato utilizzato solo il PCV15. Nei gruppi 2, 3 e 4 il PCV13 è stato sostituito con il PCV15 a partire rispettivamente dalla 4°, 3° e 2° dose. Al completamento dello studio, le GMC in tutti i gruppi dei vaccinati erano simili (Fig. 7). Infatti, analizzando i rapporti tra le GMC di IgG nei gruppi misti (gruppi 2-4) un mese dopo la quarta dose (Fig. 8), non si evince alcuna differenza clinicamente significativa (sebbene la presenza di qualche differenza statisticamente significativa viene riscontrata a favore di uno o di altro gruppo). È di particolare interesse il fatto che la risposta IgG verso il sierotipo 3 era più alta nei gruppi riceventi un numero maggiore di dosi di PCV15. Infatti, mentre nel gruppo 1 che ha ricevuto esclusivamente il PCV13 la proporzione dei soggetti con IgG ≥ 0,35 μg/ml era del 65,7% (IC 95%: 55,6-74,8%), tale percentuale nel gruppo 5, laddove è stato utilizzato unicamente il PCV15, è stata pari al 91,8% (IC 95%: 84,5-96,4%). Nei gruppi misti 2 (una dose di PCV15), 3 (due dosi di PCV15) e 4 (tre dosi di PCV15) la proporzione dei bambini sieroprotetti era rispettivamente del 72,3% (IC 95%: 62,5-80,7%), del 71,8% (IC 95%: 61,0-81,0%) e del 77,7% (IC 95%: 67,9-85,6%).
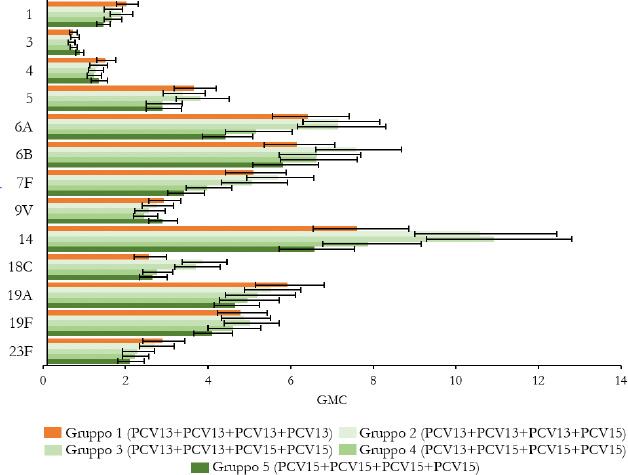
Medie geometriche delle concentrazioni (GMC) di IgG un mese dopo la quarta dose di richiamo, per sierotipo in comune e gruppo [61].
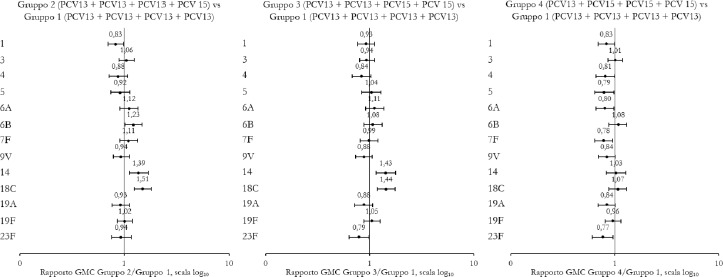
Rapporto tra le medie geometriche delle concentrazioni (GMC) di IgG un mese dopo la quarta dose di richiamo nei gruppi misti 2-4 rispetto al gruppo 1 del solo PCV13, per sierotipo in comune e gruppo [61].
L’immunogenicità del PCV15 verso i sierotipi 22F e 33F non condivisi è stata indotta in tutti i gruppi che hanno ricevuto almeno una dose di PCV15. Infatti, 30 giorni dopo la 3° dose, i gruppi 3-5 (i.e., i bambini che hanno ricevuto almeno una dose di PCV15) hanno riportato una notevole concentrazione di IgG, mentre tale parametro nei gruppi 1 e 2 era vicino allo 0% (Fig. 9). Questi dati supportano quindi la possibilità di sostituire il PCV13 con il PCV15 in qualsiasi momento del ciclo vaccinale [61].
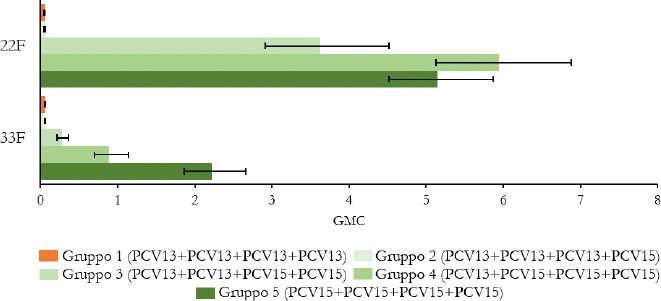
Medie geometriche delle concentrazioni (GMC) di IgG verso i sierotipi 22F e 33F un mese dopo la serie primaria di 3 dosi, per gruppo [61].
Banniettis et al. [63] hanno recentemente pubblicato risultati di un RCT che aveva tra gli obiettivi la valutazione di immunogenicità del PCV15 nei bambini e adolescenti di diverse età e stato di esposizione precedente ai vaccini anti-pneumococcici coniugati. In particolare, lo studio ha incluso tre coorti dei bambini: (i) 7-11 mesi naïve (n = 128), (ii) 12-23 mesi naïve (n = 126) e (iii) 2-17 anni precedentemente vaccinati con almeno una dose di PCV7, PCV10 o PCV13 (n = 352). Ciascuna coorte dei bambini è stata randomizzata in rapporto 1:1 a essere vaccinata con il PCV15 o il PCV13. La scheda vaccinale differiva a seconda dell’età dei soggetti: alla coorte 1 sono state somministrate 3 dosi (a distanza di 1-2 mesi l’una dall’altra), la coorte 2 ha ricevuto 2 dosi a distanza di 2-3 mesi, mentre la coorte 3 ha ricevuto un’unica dose di vaccino. Come dimostra la Figura 10, rispetto ai 13 sierotipi in comune, la percentuale dei soggetti sieroprotetti era ugualmente elevata per entrambi i vaccini e indipendentemente dalla fascia di età o stato di esposizione precedente. Come atteso, il PCV15 ha dimostrato una netta superiorità nei confronti dei sierotipi 22F e 33F. Infatti, la proporzione dei bambini vaccinati con il PCV15 che hanno raggiunto il livello di IgG ≥ 0,35 μg/ml nei confronti del sierotipo 22F era del 100% (IC 95%: 94,0-100%), del 100% (IC 95%: 94,0-100%) e del 100% (IC 95%: 97,7-100%) rispettivamente nelle tre coorti dello studio. Le analoghe proporzioni rispetto al sierotipo 33F erano del 100% (IC 95%: 94,0-100%), del 94,6% (IC 95%: 81,5-98,9%) e del 99,4% (IC 95%: 96,6-100%) (Fig. 10). Questi risultati comprovano l’utilizzo del PCV15 nei programmi di catch-up vaccinale, sia nei bambini mai vaccinati prima sia nei bambini con un ciclo vaccinale incompleto [63].
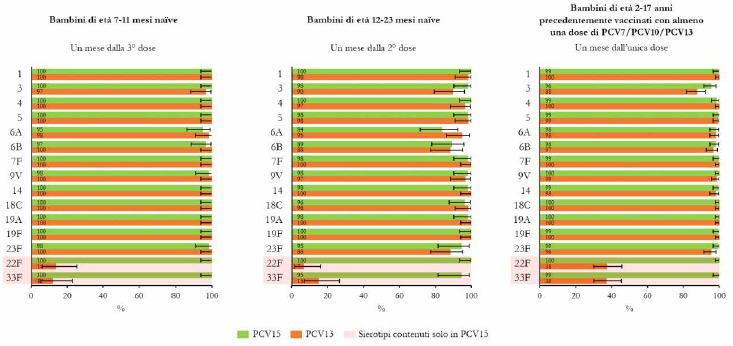
Confronto tra la proporzione dei bambini vaccinati con la concentrazione IgG ≥ 0,35 μg/ml misurati a distanza di un mese dopo l’ultima dose somministrata, per sierotipo e fascia di età [63].
Tre studi clinici hanno confrontato il PCV 15 e il PCV13 nelle popolazioni immunocompromesse e, in particolare, nei bambini affetti da anemia falciforme (drepanocitica) [66], positivi all’HIV [67] o sottoposti al trapianto allogenico di cellule staminali ematopoietiche [62].
Il primo studio PNEU-SICKLE (NCT03731182) [66] ha arruolato un totale di 104 bambini/adolescenti di età 5-17 anni affetti da anemia falciforme che sono stati randomizzati in rapporto 2:1 a ricevere una dose di PCV15 o di PCV13. Come dimostra un’ampia sovrapposizione degli IC al 95% (Fig. 11), la risposta immune verso i 13 sierotipi in comune e misurata sia nel saggio ECL sia nel saggio OPA era del tutto paragonabile tra i due vaccini. Il PCV15 era altamente immunogeno verso i sierotipi unici 22F e 33F [66].
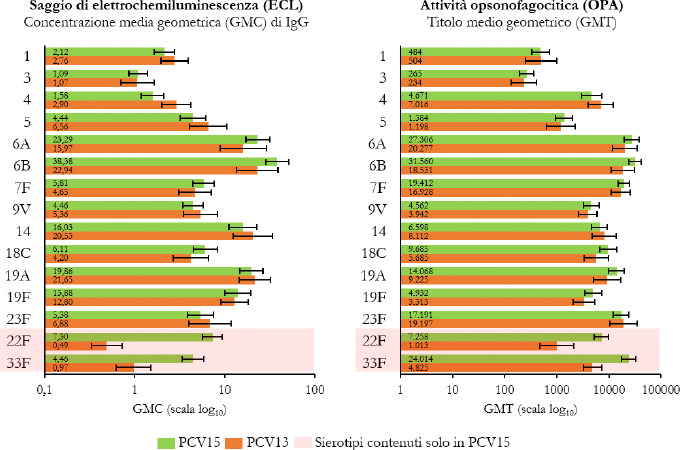
Confronto tra la risposta immunitaria indotta da PCV15 e PCV13 nei bambini e adolescenti affetti da anemia falciforme, per sierotipo e saggio [66].
Nel secondo RCT PNEU-WAY PED (NCT03921424) [67], 203 e 204 bambini di età 6-17 anni affetti da HIV hanno ricevuto una dose di PCV15 o di PCV13, entrambe seguite da una dose di PPV23 somministrata a distanza di 8 settimane. Come riporta la Figura 12, a distanza di 30 giorni dalla prima dose di PCV15 o di PCV13 non si è osservata alcuna differenza clinicamente significativa nella magnitudine della risposta anticorpale ECL o OPA, indipendentemente dal sierotipo in comune. Per quel che riguarda invece i sierotipi 22F e 33F, si evidenzia una netta superiorità del PCV15 (Fig. 12). Similmente, a distanza di 30 giorni da una dose di PPV23, i bambini precedentemente vaccinati con PCV15 o PCV13 hanno sviluppato una risposta immune del tutto paragonabile verso tutti i 15 sierotipi dello pneumococco (Fig. 13) [67].
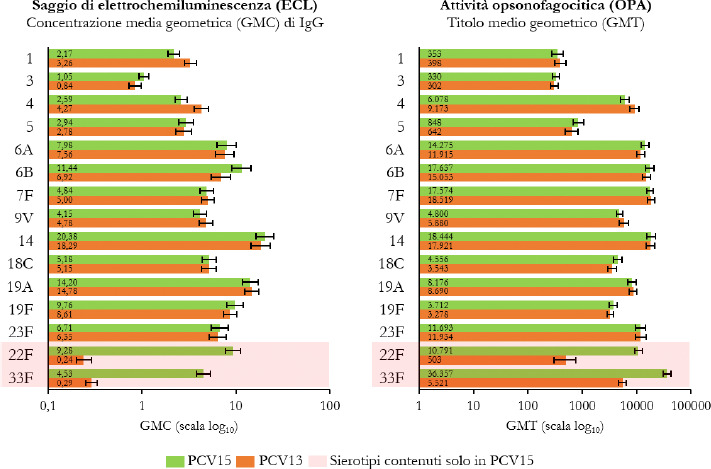
La risposta immunitaria nei bambini e adolescenti affetti da HIV a distanza di 30 giorni da una dose di PCV15 e PCV13, per sierotipo e saggio [67].
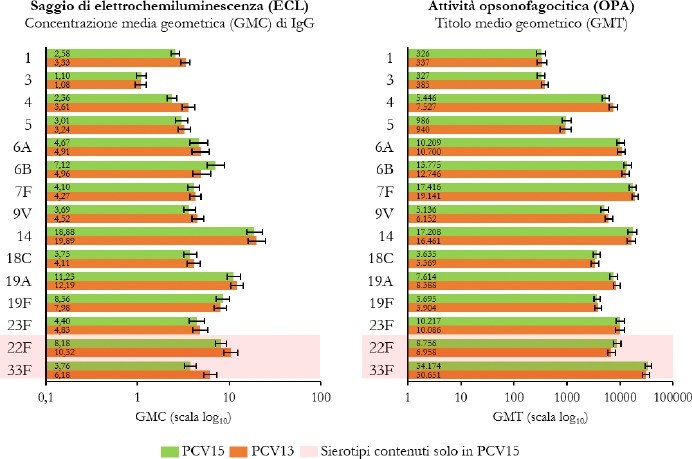
La risposta immunitaria nei bambini e adolescenti affetti da HIV e precedentemente vaccinati con una dose di PCV15 o PCV13, a distanza di 30 giorni da una dose di PPV23, per sierotipo e saggio [67].
Infine, lo studio PNEU-STEM (NCT03731182) ha valutato l’utilizzo del PCV15 nei soggetti sottoposti al trapianto allogenico di cellule staminali ematopoietiche 3-6 mesi prima della vaccinazione [62]. In particolare, i soggetti sono stati randomizzati 1:1 a ricevere 3 dosi di PCV15 o di PCV13 (a distanza di 1 mese l’una dall’altra) e seguite da una dose di PPV23 somministrata a un anno dal trapianto. Va tuttavia precisato che lo studio ha arruolato sia i soggetti adulti sia i bambini (3-17 anni) e il numero di questi ultimi era esiguo (il PCV15 e il PCV13 erano somministrati rispettivamente a 8 e 6 bambini). Sebbene lo studio non riporti i dati di immunogenicità specifici per la popolazione pediatrica, l’immunogenicità del PCV15 osservata nella popolazione totale appare paragonabile al PCV13 per i sierotipi condivisi, mentre per i sierotipi unici 22F e 33F il PCV15 è risultato altamente immunogeno [62].
Altri tre RCT [65, 68, 69] hanno valutato l’immunogenicità del PCV15, utilizzando le schede vaccinali diverse da quella italiana per il numero di dosi e/o per le tempistiche della somministrazione. Lo studio PNEU-PED (NCT03893448) [69] è considerato pivotale per la scheda vaccinale 3 + 1 (2, 4, 6 e 12/15 mesi di età) e i suoi risultati hanno portato all’autorizzazione per l’uso pediatrico del PCV15 negli Stati Uniti. I bambini (n = 1.720) di età di circa 2 mesi sono stati randomizzati 1:1 per ricevere 4 dosi di PCV15 o di PCV13. A un mese dopo la 3° dose e a seconda del sierotipo, l’84,8-98,7% dei bambini nel gruppo PCV15 ha raggiunto il livello protettivo di IgG. Il PCV15 ha indotto un alto livello di protezione verso i sierotipi unici 22F e 33F. Il PCV15 è stato non inferiore al PCV13 per tutti i 13 sierotipi in comune. D’altronde, il PCV15 è stato più immunogeno del PCV13 nei confronti del sierotipo 3 con una differenza nel tasso di sieroprotezione pari al 19,1% (IC 95%: 14,4-24,0%) (Fig. 14). Infatti, il rapporto tra le GMC PCV15/PCV13 verso questo sierotipo era nettamente superiore sia dopo la terza (1,70; IC 95%: 1,54-1,86) sia dopo la quarta (1,43; IC 95%: 1,30-1,57) dose. Lo studio ha inoltre dimostrato la non interferenza del PCV15 con altri vaccini pediatrici di routine (tetano, difterite, pertosse acellulare a 2 componenti, poliovirus inattivato a 3 componenti, H. influenzae tipo b, epatite B, rotavirus, morbillo, parotite, rosolia, varicella ed epatite A) [69].
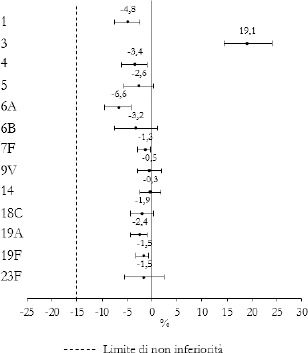
Differenza tra le proporzioni dei bambini vaccinati (PCV15 – PCV13) con la concentrazione di IgG ≥ 0,35 μg/ml misurati a un mese dopo la serie primaria della vaccinazione con la scheda statunitense 3 + 1, per sierotipo in comune (analisi di non inferiorità) [69].
Sebbene l’obiettivo primario del secondo studio PNEU-LINK (NCT 03692871) [68] era la sicurezza del PCV15, l’immunogenicità è stata valutata come l’obiettivo secondario. Il disegno dello studio (così come i suoi principali risultati) appaiono del tutto simili allo studio PNEU-PED [69]: la non inferiorità del PCV15 rispetto ai 13 sierotipi in comune e la superiorità nei confronti dei sierotipi 22F e 33F sono state dimostrate.
Infine, lo studio PNEU-PED-EU-2 (NCT04016714) [65] ha preso in esame l’immunogenicità relativa del PCV15, utilizzando la cosiddetta scheda vaccinale “scandinava”. Questa scheda 2 + 1 differisce dalla scheda utilizzata in Italia per il fatto che la vaccinazione avviene all’età di circa 3, 5 e 12 mesi. Parimenti alla scheda italiana, la vaccinazione anti-pneumococcica avviene in concomitanza con il vaccino esavalente DTaP-IPV-HepB-Hib. In questo RCT, l’obiettivo di non inferiorità è stato raggiunto per tutti i 13 sierotipi in condivisione. Il tasso di sieroprotezione (IgG ≥ 0,35 μg/ml) nei confronti del sierotipo 3 un mese dopo l’ultima dose è stato maggiore del 10,5% (IC 95%: 6,6-14,6%) nel gruppo PCV15 rispetto al gruppo PCV13. Più del 99% dei bambini vaccinati con il PCV15 ha raggiunto il livello di IgG ≥ 0,35 μg/ml (Fig. 15). Analogamente allo studio PNEU-PED-EU-1 che utilizzava la scheda italiana [64], lo studio PNEU-PED-EU-2 [65] ha dimostrato la non interferenza del PCV15 con la risposta immunitaria verso tutti gli antigeni inclusi nel vaccino esavalente pediatrico.
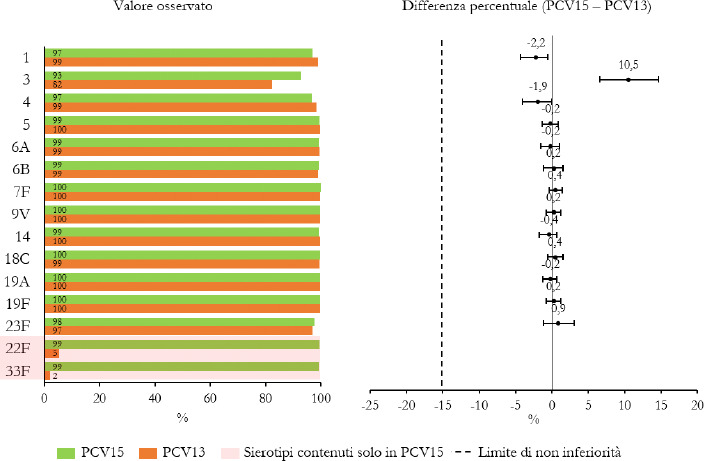
Confronto tra la proporzione dei bambini vaccinati con il PCV15 (n = 595) o il PCV13 (n = 596) che hanno raggiunto la concentrazione IgG ≥ 0,35 μg/ml misurati a un mese dopo il completamento del ciclo di 3 dosi, per sierotipo [65].
Tutti i RCT inclusi [57-69] hanno valutato la frequenza degli AE sollecitati (sia locali nel sito di iniezione sia sistemici) e riportati spontaneamente nei bambini immunizzati con il PCV15 o con il comparatore attivo, tipicamente il PCV13. La raccolta degli AE sollecitati avveniva tipicamente nei primi 14 giorni in seguito a una seduta vaccinale tramite un diario. La registrazione degli AE non sollecitati (inclusi gli SAE) è stata invece prevista per l’intera durata degli studi.
Le Tabelle IV-VII riassumono la frequenza delle diverse tipologie di AE riportate nei singoli studi in seguito a una qualsiasi seduta vaccinale. In breve, la maggior parte dei bambini ha riportato ≥ 1 AE sia nei gruppi PCV15 (74,6-99,3%) sia in quelli PCV13 (59,4-100%). In quasi tutti gli studi la comparsa di ≥ 1 AE era del tutto paragonabile tra il PCV15 e il PCV13. L’unico studio a riportare una maggiore frequenza degli AE sollecitati nel gruppo PCV15 è quello di Banniettis et al. [63]. In particolare, ≥ 1 AE locale o sistemico è stato riportato dal 79,0% dei bambini di età 12-23 mesi (ma non in quelli di età 7-11 mesi o 2-17 anni) vaccinati con il PCV15 contro il 59,4% riportato nel gruppo PCV13. L’incidenza di SAE potenzialmente correlabili alla vaccinazione è stata pari allo 0% nella maggior parte dei RCT [57, 59-64, 66, 77]. Platt et al. [60] ha riportato un SAE (incidenza pari allo 0,3%) giudicato potenzialmente correlabile all’utilizzo del PCV15 in un bambino che ha sviluppato convulsioni febbrili (Tab. IV). Tuttavia, la sorveglianza degli AE di interesse speciale (come per l’appunto le convulsioni febbrili o la sindrome di Guillain-Barré o disordini autoimmuni) condotta durante gli studi non ha rilevato alcun segnale di sicurezza (safety signal).
Frequenza degli eventi avversi sollecitati (primi 14 giorni dopo la vaccinazione) e riportati spontaneamente (tutta la durata dello studio) in seguito ad almeno una dose del vaccino, per tipologia di vaccino e studio.
| ≥ 1 AE | ≥ 1 AE correlato al vaccino | ≥ 1 SAE | ≥ 1 SAE correlato al vaccino | Totale soggetti | Rif. | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | |
| 93,3 | 85,7 a | 84,8 | 75,0 a | 0 | 0 a | 0 | 0 a | 33 | 28 a | [57] |
| 94,8 | 94,1 | NA | NA | 6,8 | 7,7 | NA | NA | 368 | 376 | [58] |
| 96,1 | 100 | NA | NA | 10,0 | 7,7 | 0 | 0 | 50 | 52 | [59] |
| 96,7 | 95,7 | 94,0 | 93,9 | 5,3 | 4,3 | 0,3 | 0 | 697 | 347 | [60] b |
| 91,1 | 93,9 | 85,5 | 83,8 | 11,7 | 11,7 | 0 | 0 | 179 c | 179 d | [61] |
| NA | NA | NA | NA | NA | NA | 0 | 0 | 8 | 6 | [62] |
| 76,6 | 78,1 | 64,1 | 64,1 | 10,9 | 7,8 | 0 | 0 | 64 | 64 | [63] e |
| 79,0 | 59,4 | 67,7 | 48,4 | 6,5 | 6,3 | 0 | 0 | 62 | 64 | [63] f |
| 74,6 | 76,6 | 70,6 | 71,4 | 2,3 | 2,3 | 0 | 0 | 177 | 175 | [63] g |
| 94,5 | 93,1 | 91,1 | 88,8 | 9,7 | 11,8 | 0 | 0,2 | 587 | 591 | [64] |
| 99,3 | 99,7 | 99,2 | 99,2 | 5,0 | 4,7 | 0,3 | 0,3 | 595 | 594 | [65] |
| NA | NA | NA | NA | 18,8 | 23,5 | 0 | 0 | 69 | 34 | [66] |
| NA | NA | NA | NA | 0,5 | 0,5 | 0 | 0 | 203 | 204 | [67] |
| NA | NA | NA | NA | 9,8 | 10,4 | NA | NA | 1,965 | 433 | [68] |
| 93,8 | 92,4 | 91,5 | 88,8 | 10,3 | 9,5 | NA | NA | 858 | 855 | [69] |
| a PCV7. b 2 lotti di PCV15 sono stati combinati. c Gruppo 5 che ha ricevuto 4 dosi di solo PCV15. d Gruppo 1 che ha ricevuto 4 dosi di solo PCV13. e Bambini di età 7-11 mesi naïve. f Bambini di età 12-23 mesi naïve. g Bambini di età 2-17 anni precedentemente vaccinati con almeno 1 dose di PCV7, PCV10 o PCV13. | ||||||||||
Frequenza degli eventi avversi locali sollecitati in seguito ad almeno una dose del vaccino, per tipologia di vaccino e studio. Le frequenze riportate non indicano necessariamente il nesso di causalità.
| ≥ 1 AE locale | Eritema | Dolore | Gonfiore | Indurimento | Totale soggetti | Rif. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | |
| 72,7 | 57,1 a | 45,5 | 25,0 a | 57,6 | 35,7 a | 33,3 | 21,4 a | 30,3 | 25,0 a | 33 | 28 a | [57] |
| 83,4 | 80,9 | 59,0 | 53,5 | 71,7 | 72,1 | 49,2 | 43,9 | 44,3 | 42,6 | 368 | 376 | [58] |
| 80,0 | 57,7 | 38,0 | 28,8 | 64,0 | 40,4 | 20,0 | 25,0 | 38,0 | 25,0 | 50 | 52 | [59] |
| 76,9 | 70,6 | 45,2 | 44,1 | 57,1 | 46,7 | 28,4 | 26,2 | 32,4 | 32,6 | 697 | 347 | [60] b |
| 70,9 | 71,5 | 44,1 | 47,5 | 47,5 | 44,1 | 22,9 | 22,9 | 26,3 | 34,6 | 179 c | 179 d | [61] |
| NA | NA | 0 | 33,3 | 75,0 | 83,3 | 25,0 | 50,0 | 12,5 | 33,3 | 8 | 6 | [62] |
| 39,1 | 42,2 | 28,1 | 34,4 | 18,8 | 7,8 | 18,8 | 15,6 | 17,2 | 14,1 | 64 | 64 | [63] e |
| 51,6 | 37,5 | 21,0 | 21,9 | 33,9 | 23,4 | 14,5 | 12,5 | 8,1 | 9,4 | 62 | 64 | [63] f |
| 66,7 | 68,0 | 19,2 | 21,1 | 54,8 | 56,6 | 20,9 | 24,0 | 6,8 | 14,9 | 177 | 175 | [63] g |
| 72,7 | 67,3 | 45,3 | 44,7 | 40,5 | 29,3 | 33,6 | 29,4 | 41,9 | 39,1 | 587 | 591 | [64] |
| 88,2 | 89,4 | 60,0 | 65,5 | 63,0 | 59,6 | 46,4 | 44,1 | 57,0 | 59,1 | 595 | 594 | [65] |
| 69,6 | 76,5 | 4,3 | 5,9 | 60,9 | 67,6 | 27,5 | 35,3 | 8,7 | 8,8 | 69 | 34 | [66] |
| 71,4 | 59,8 | 9,4 | 5,9 | 55,2 | 53,9 | 28,6 | 21,6 | 10,3 | 6,4 | 203 | 204 | [67] |
| 68,2 | 61,2 | 43,9 | 36,0 | 42,9 | 36,5 | 27,9 | 23,3 | 25,3 | 25,6 | 1,965 | 433 | [68] |
| 69,7 | 69,6 | 33,7 | 38,5 | 49,8 | 46,9 | 26,3 | 24,0 | 26,3 | 26,8 | 858 | 855 | [69] |
| a PCV7. b 2 lotti di PCV15 sono stati combinati. c Gruppo 5 che ha ricevuto 4 dosi di solo PCV15. d Gruppo 1 che ha ricevuto 4 dosi di solo PCV13. e Bambini di età 7-11 mesi naïve. f Bambini di età 12-23 mesi naïve. g Bambini di età 2-17 anni precedentemente vaccinati con almeno 1 dose di PCV7, PCV10 o PCV13. | ||||||||||||
Frequenza degli eventi avversi sistemici sollecitati (almeno uno, irritabilità, sonnolenza, inappetenza, febbre) in seguito ad almeno una dose del vaccino nei bambini < 2 anni, per tipologia di vaccino e studio. Le frequenze riportate non indicano necessariamente il nesso di causalità.
| ≥ 1 AE sistemico | Irritabilità | Sonnolenza | Inappetenza | Febbre ≥ 38 °C/piressia | Totale soggetti | Rif. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV13 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | |
| 93,9 | 82,1 a | 18,2 | 7,1 a | NA | NA | NA | NA | 40,6 | 39,3 a | 33 | 28 a | [57] |
| 92,9 | 92,3 | 85,6 | 81,4 | 71,5 | 70,5 | 57,6 | 52,1 | 33,4 | 29,3 | 368 | 376 | [58] |
| NA | NA | 82,0 | 84,6 | 60,0 | 75,0 | 32,0 | 46,2 | 70,0 | 65,4 | 50 | 52 | [59] |
| 90,1 | 91,1 | 85,5 | 84,7 | 66,3 | 67,2 | 47,8 | 44,4 | 67,0 | 68,6 | 697 | 347 | [60] b |
| 63,1 | 61,5 | 70,4 | 67,6 | 60,3 | 57,0 | 34,6 | 35,8 | 27,4 | 29,6 | 179 c | 179 d | [61] |
| 70,3 | 67,2 | 32,8 | 43,8 | 21,9 | 15,6 | 15,6 | 18,8 | 87,5 | 75,0 | 64 | 64 | [63] e |
| 64,5 | 45,3 | 35,5 | 21,9 | 24,2 | 17,2 | 22,6 | 18,8 | 56,5 | 51,6 | 62 | 64 | [63] f |
| 52,5 | 52,6 | NA | NA | NA | NA | NA | NA | 5,6 | 4,6 | 177 | 175 | [63] g |
| 82,3 | 78,0 | 71,7 | 66,3 | 46,2 | 41,8 | 33,9 | 33,5 | 77,9 | 76,3 | 587 | 591 | [64] |
| 98,8 | 98,8 | 96,3 | 94,1 | 77,3 | 77,9 | 54,8 | 58,2 | 53,8 | 55,7 | 595 | 594 | [65] |
| 83,8 | 80,1 | 74,9 | 69,3 | 55,4 | 55,0 | 41,6 | 36,0 | 39,4 | 40,7 | 1,965 | 433 | [68] |
| 91,5 | 89,6 | 76,5 | 75,4 | 59,0 | 62,0 | 34,3 | 36,0 | 30,9 | 31,6 | 858 | 855 | [69] |
| a PCV7. b 2 lotti di PCV15 sono stati combinati. c Gruppo 5 che ha ricevuto 4 dosi di solo PCV15. d Gruppo 1 che ha ricevuto 4 dosi di solo PCV13. e Bambini di età 7-11 mesi naïve. f Bambini di età 12-23 mesi naïve. g Bambini di età 2-17 anni precedentemente vaccinati con almeno 1 dose di PCV7, PCV10 o PCV13. | ||||||||||||
Frequenza degli eventi avversi sistemici sollecitati (febbre, mialgia, artralgia, mal di testa, affaticamento) in seguito ad almeno una dose del vaccino nei bambini > 2 anni, per tipologia di vaccino e studio. Le frequenze riportate non indicano necessariamente il nesso di causalità.
| Febbre ≥ 38 °C/piressia | Mialgia | Artralgia | Mal di testa | Affaticamento | Totale soggetti | Rif. | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | PCV15 | PCV13 | |
| 0 | 0 | 50,0 | 16,7 | 12,5 | 0 | 12,5 | 16,7 | 25,0 | 16,7 | 8 | 6 | [62] |
| 5,6 | 4,6 | 23,7 | 16,6 | 0 | 1,7 | 11,9 | 13,7 | 15,8 | 17,1 | 177 | 175 | [63] |
| 5,9 | 8,8 | 23,2 | 11,8 | 2,9 | 8,8 | 24,6 | 17,6 | 13,0 | 20,3 | 69 | 34 | [66] |
| NA | NA | 34,0 | 25,5 | 9,4 | 10,3 | 14,8 | 10,8 | 7,9 | 8,3 | 203 | 204 | [67] |
Per quel che concerne la frequenza dei singoli AE, il dolore nel sito di iniezione risulta il più frequente in assoluto e in tutte le fasce di età pediatriche (Tab. V). Tra gli AE sistemici, l’irritabilità e la sonnolenza nei bambini piccoli (Tab. VI) e la mialgia nei bambini più grandi (Tab. VII) sono i più frequenti. La frequenza di febbre è più elevata nei bambini < 1 anno di età, mentre nei bambini più grandi e negli adolescenti la sua frequenza è del 5,6-5,9% nei vaccinati con il PCV15 e del 4,6-8,8% nei vaccinati con il PCV13 (Tabb. VI, VII). La maggior parte degli AE riportati sono di intensità da leggera a moderata, di natura transitoria (< 3 giorni) e autolimitante [57-60, 63]. La frequenza e l’intensità degli AE, specialmente il dolore nel sito di iniezione, tendono a essere più frequenti in seguito alla prima seduta vaccinale [58].
Nello studio PNEU-PED-EU-1 [54], nel quale i bambini al 3° mese di vita venivano vaccinati a seconda della scheda italiana 2 + 1, non vi sono state differenze clinicamente significative tra l’incidenza totale degli AE nei bambini immunizzati con il PCV15 o il PCV13. Specificatamente, la comparsa di almeno un AE in seguito a una qualsiasi dose del vaccino è stata del 94,5% nel gruppo PCV15 e del 93,1% nel gruppo PCV15, risultando in una differenza non statisticamente significativa (1,5%; IC 95: -1,3-4,3%). Nel gruppo PCV15 nessun SAE (n = 57; 9,7%) è stato giudicato correlabile al vaccino. In entrambi i gruppi gli eventi avversi più frequenti erano irritabilità (PCV15: 71,7%; PCV13: 66,3%), sonnolenza (PCV15: 46,2%; PCV13: 41,8%), eritema nel sito di inoculo (PCV15: 45,3%; PCV13: 44,7%), piressia (PCV15: 44,5%; PCV13: 42,5%) e indurimento nel sito di iniezione (PCV15: 41,9%; PCV13: 39,1%). Tuttavia, il dolore nel sito di vaccinazione è stato più alto nel gruppo PCV15 (40,5% vs 29,3%).
In sintesi, il profilo di reattogenicità, tollerabilità e sicurezza del PCV15 è accettabile e appare clinicamente paragonabile a quello del PCV13 attualmente in uso.
La ricerca sistematica della letteratura disponibile condotta nell’ambito della presente valutazione HTA ha permesso di individuare 14 RCT [57-69] di fase I-III. Tutti gli studi inclusi sono stati giudicati a rischio di confondimento basso. Dall’analisi di queste evidenze di alta qualità è emerso quanto segue:
Il PCV15 è altamente immunogeno (dal punto di vista sia di anticorpi totali sia di anticorpi opsonizzanti) verso tutti i 15 sierotipi. Seppur con qualche variazione sierotipo specifica, la quasi totalità dei bambini vaccinati con il PCV15 ha raggiunto il livello anticorpale ≥ 0,35 μg/ml, ritenuto protettivo nei confronti della MIP.
Nei RCT di fase III, il PCV15 si è dimostrato non inferiore al PCV13 per tutti i 13 sierotipi in comune.
In tutti gli studi analizzati, il PCV15 ha dimostrato una netta superiorità nella risposta umorale verso i sierotipi unici 22F e 33F.
Gli aspetti di immunogenicità sono stati studiati in diverse popolazioni, tra cui: (i) le principali fasce di età pediatriche; (ii) le principali schede vaccinali utilizzate nel mondo; (iii) nei bambini sia naïve sia precedentemente vaccinati con almeno una dose di PCV7/PCV10/PCV13; (iv) nei bambini nati a termine di gravidanza sia pre-termine; (v) nei bambini sani e nelle popolazioni speciali, tra cui i bambini affetti da alcune condizioni di immunocompromissione, come HIV o anemia falciforme. I dati di immunogenicità ottenuti non dimostrano variazioni significative a seconda del gruppo di popolazione studiata, indicando quindi la coerenza e la solidità delle prove di efficacia disponibili.
Il PCV15 è interscambiabile con il PCV13, vale a dire che il PCV13 può essere sostituito con il PCV15 in qualsiasi momento del ciclo vaccinale. La dimostrata interscambiabilità può avere un ruolo importante in determinate situazioni come, ad esempio, problematiche relative all’approvvigionamento di un vaccino.
Il profilo di reattogenicità, tollerabilità e sicurezza di PCV15 è accettabile ed è simile a quello del PCV13. La maggior parte degli AE è transitoria, autorisolutiva e di natura da lieve a moderata. Gli SAE correlati all’utilizzo del PCV15 sono molto rari.
Il PCV15 può essere co-somministrato con altri vaccini pediatrici di routine senza provocare un’interferenza clinicamente significativa sia con la risposta immune umorale sia con la frequenza degli AE.
Diversi RCT hanno dimostrato una maggiore risposta anticorpale verso il sierotipo 3 nei bambini vaccinati con il PCV15 rispetto a quelli immunizzati con PCV13. Nel triennio 2008-2010, il sierotipo 3 è stato identificato nell’11% dei casi di MIP in Italia [32]. La MIP causata dal sierotipo 3 può essere più severa e alcune evidenze suggeriscono che esso può evadere la risposta anticorpale [72]. Inoltre, la popolazione attuale del sierotipo 3 è composta da diversi lignaggi, ciascuno dei quali presenta caratteristiche differenti [73]. Infatti, un’analisi dei casi di MIP tra i bambini di età 2-59 mesi in Catalogna [74] ha documentato che i due terzi (66,7%; 16/24) di tutti i fallimenti vaccinali con il PCV13 era dovuto al sierotipo 3. Sono quindi auspicabili ulteriori studi (sia di immunogenicità sia di efficacia) al fine di verificare se la maggiore immunogenicità del PCV15 nei confronti del sierotipo 3 possa portare all’ulteriore riduzione dell’incidenza della malattia pneumococcica dovuta a questo sierotipo, quale principale vaccine evader.
In sintesi, i dati di alta qualità sull’efficacia (approssimati tramite i parametri di immunogenicità) e sulla sicurezza analizzati nel presente Capitolo indicano un buon profilo rischio-beneficio del PCV15. Considerando il suo potenziale nel ridurre ulteriormente i casi di MIP e di altre forme delle infezioni dai sierotipi 22F e 33F, la sostituzione del PCV13 con il PCV15 nella scheda vaccinale pediatrica italiana risulta raccomandabile.
Lo Streptococcus pneumoniae (SP) è un batterio Gram-positivo responsabile di manifestazioni patologiche sia invasive come la Malattia Invasiva da Pneumococco (MIP) che non invasive come le otiti medie acute (Acute Otitis Media, OMA) e le Polmoniti Non Batteriemiche da pneumococco (non-Bacteriemic Pneumococcal Pneumonia, PNB). In Italia, le malattie da SP rappresentano un importante burden di sanità pubblica, pur con diversità inter-regionali nonostante l’incidenza della MIP, dopo il 2008, a seguito dell’introduzione della vaccinazione nei nuovi nati in tutta Italia, è andata diminuendo soprattutto nella fascia di età 0-5 anni [1].
In Italia secondo le raccomandazioni del Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 [2] il vaccino anti-pneumococco è raccomandato all’età di 3, 5 e 11 mesi nei neonati sani, negli anziani di età superiore ai 65 anni e nei soggetti tra i 2 e i 64 anni con patologie ad alto rischio (come impianto cocleare; liquido cerebrospinale; anemia falciforme o altre emoglobinopatie; asplenia congenita o acquisita; stato di immunocompromissione). Il vaccino pneumococcico polisaccaridico 23-valente (PPSV23) somministrato in sequenza al PCV13 è consigliato a tutti gli adulti di età ≥ 65 anni e raccomandato per le persone di età compresa tra i 2 e i 64 anni con patologie ad alto rischio.
Il vaccino coniugato pneumococcico 15-valente (PCV15) contiene tutti i sierotipi PCV13 (sierotipi 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F e 23F) e due sierotipi aggiuntivi, 22F e 33F. I sierotipi 22F e 33F sono due dei più comuni sierotipi non-PCV13 che causano MIP nei bambini secondo la sorveglianza MaBI, essendo stati riscontrati nel 10,8% delle forme invasive tipizzate nel 2019 [3]. I sierotipi unici 22F e 33F contenuti nel PCV15 sono stati associati a morbosità e costi aggiuntivi di entità paragonabile a quella del sierotipo di tipo 3 nel contesto europeo quando si tiene conto anche del replacement sierotipico atteso nel tempo [4]. La Commissione Europea ha recentemente approvato l’estensione di indicazione per il vaccino PCV15 che include l’immunizzazione attiva e la prevenzione da malattie invasive, infezione polmonare e OMA causate da SP nei neonati, bambini e adolescenti di età compresa tra 6 settimane e meno di 18 anni [5]. Il vaccino PCV15 è indicato in Italia anche per l’immunizzazione attiva per la prevenzione delle malattie invasive e dell’infezione polmonare causata da SP in soggetti di età pari o superiore a 18 anni.
Le valutazioni economiche dei nuovi vaccini sono una parte fondamentale delle valutazioni di Health Technology Assessment (HTA) in quanto rappresentano un’informazione cruciale per aiutare i decisori a valutare costi e benefici delle diverse strategie vaccinali nella popolazione generale così come in alcune particolari categorie [2, 6, 7].
Negli ultimi anni sono stati pubblicati in letteratura numerosi modelli di trasmissione dinamica dello SP che non includevano valutazioni di costo-efficacia dei diversi vaccini disponibili contro lo SP (Tab. I). Si va da modelli puramente deterministici a modelli stocastici o basati su agenti e che valutavano diverse strategie vaccinali per ridurre il carico di malattia, ma pochissimi sono i modelli dinamici inseriti in valutazioni di costo efficacia [8-17].
Modelli a trasmissione dinamica pubblicati per il pneumococco.
| Struttura del modello | Studio | Obiettivo/i | Risultati principali |
|---|---|---|---|
| SIR | Bottomley 2013 [8] | Prevedere la prevalenza dei sierotipi VT e NVT in seguito all’introduzione del PCV7 | La vaccinazione elimina i sierotipi a bassa e media prevalenza, ma la prevalenza complessiva del carriage si riduce leggermente a causa della sostituzione dei sierotipi |
| SIS | Melegaro 2010 [9] | Prevedere l’impatto del PCV7 sull’incidenza delle MIP | È importante includere la competizione VT-NVT in un modello |
| Choi 2019 [10] | Valutare l’impatto dello schema di dosaggio da 2 + 1 a 1 + 1 | L’abbandono di una dose di vaccino comporta una malattia da pneumococco estremamente lieve | |
| De Cao 2014 [11] | Valutare l’impatto del PCV13 sulle MIP | Il PCV13 riduce MIP a livelli superiori rispetto a quelli determinati in precedenza, se si considera l'immunità di gregge | |
| Cobey 2012 [13] | Studiare come una debole risposta immunitaria sierotipo-specifica possa supportare la coesistenza | L’interazione tra l’immunità acquisita specifica per il sierotipo e quella non specifica produce una coesistenza | |
| Colijn 2009 [14] | Indagare i meccanismi di coesistenza dei sierotipi sensibili agli antibiotici (AS) e resistenti agli antibiotici (AR) | La coesistenza è rara, tranne in caso di doppia trasmissione simultanea di ceppi AS e AR e autoimmunità più forte dell’immunità incrociata | |
| Lipsitch 1997 [16] | Analizzare la competizione in un trasporto a due sierotipi con co-colonizzazione. Prevedere i fattori e l’entità della sostituzione dei sierotipi |
La presenza di una NVT sinergizza con il vaccino per ridurre la trasmissione della VT | |
| Lipsitch 1999 [17] | Evidenziare i vantaggi del replacement. Suggerire i fattori da considerare nella scelta della composizione sierotipica dei vaccini | Il replacement dipende da molti fattori, tra cui la prevalenza della VT prima del vaccino e la copertura vaccinale | |
| SEIS | Sutton 2010 [10] | Studiare l’impatto a livello di popolazione delle strategie vaccinali sulla malattia pneumococcica | L’impatto maggiore è quello di colpire il carriage (rispetto all’infezione) |
| SIR: Model for Spread of Disease; SIS: Susceptible - Infected System; SEIS: susceptible, exposed, infectious, then susceptible. | |||
Però, come evidenziato da Løchen [18], le valutazioni economiche non sono tipicamente basate su modelli dinamici di trasmissione, non considerando così gli effetti positivi dell’immunità di gregge, sottolineando la necessità di utilizzare sia i modelli dinamici di trasmissione sia le valutazioni economiche per supportare gli stakeholders a prendere decisioni sulla progettazione dei programmi di vaccinazione.
Al fine di valutare l’impatto dell’introduzione del vaccino 15-valente in età pediatrica in Italia è stato sviluppato un modello di trasmissione dinamica in Mathematica® 13.1 [19], stratificato per età, che incorpora la vaccinazione per età e sierotipo nella popolazione pediatrica e adulta al fine di stimare e confrontare i risultati sanitari ed economici nell’arco della vita della vaccinazione pediatrica di routine con PCV15 (rispetto a PCV13) da una prospettiva sia del Servizio Sanitario Nazionale (SSN) che sociale.
L’obiettivo primario del modello è quello di valutare l’impatto clinico ed economico dell’introduzione del nuovo vaccino pneumococcico PCV15 in età pediatrica in Italia rispetto al vaccino PCV13, tenendo conto dell’epidemiologia dei tipi circolanti di S. pneumoniae in Italia. Inoltre, essendo PCV15 già indicato nell’adulto, il modello valuterà anche l’impatto dell’adozione di PCV15 in età adulta.
I risultati della valutazione economica saranno espressi come rapporto incrementale di costo-efficacia (Incremental Cost-Effectiveness Ratio, ICER) definito come €/QALY guadagnato, laddove € è Euro 2021 e QALY (Quality-Adjusted Life Years) sono gli anni di vita guadagnati e ponderati per la qualità.
Tenendo conto che fino a oggi non esiste un valore soglia della disponibilità a pagare (Willingness-To-Pay, WTP) definito da un’agenzia regolatoria in Italia, si assume un valore soglia di 40,000/QALY guadagnato d’accordo a una consensus italiana del 2013 [20]. I costi e gli effetti sono stati monitorati su un orizzonte temporale di 50 anni ed è stato adottato un tasso di sconto del 3% per costi e benefici.
Il presente modello si struttura in due parti: (i) un “modello epidemiologico” e (ii) un “modello del burden”.
Il modello epidemiologico è un modello matematico deterministico di tipo SEIR (Suscettibile, Esposto, Infetto, Rimosso) sviluppato al fine di stimare il numero di casi di infezione da pneumococco confermata in laboratorio, partendo da dati reali di sorveglianza disponibili nella letteratura scientifica internazionale e nell’ambito della Sorveglianza delle Malattie Batteriche Invasive (MaBI) dell’Istituto Superiore di Sanità (ISS). Il modello del burden è rappresentato da un albero decisionale e segue l’output del modello deterministico ed è volto a stimare le complicanze, le ospedalizzazioni, le morti, gli anni di vita ponderati per la qualità (QALY) e i costi associati alle diverse manifestazioni cliniche causate dallo S. pneumoniae.
Essendo la storia naturale della malattia da S. pneumoniae (SP) molto complessa, il modello di trasmissione dinamica sviluppato è stato costruito dividendo la popolazione in compartimenti specifici per età in base allo stato di portatore (carriage) di SP (che corrisponde allo stadio infettivo del modello), alla condizione di malattia e alla protezione indotta dalla vaccinazione, descrivendo le dinamiche di trasmissione del carriage e la progressione della malattia in presenza di vaccini pneumococcici specifici per classe di età e sierotipo. Il modello estende molti dei modelli già pubblicati e incorpora funzionalità e caratteristiche aggiuntive. Ad esempio, il modello di Gaivao [21] considerava il carriage e la co-colonizzazione, ma non incorporava la vaccinazione. Il modello sviluppato nel presente lavoro permette di: valutare la co-colonizzazione con sierotipi diversi e di considerare il declino dell’immunità indotta dal vaccino nel corso del tempo che non viene considerato nella maggior parte dei modelli di vaccinazione contro lo pneumococco, a eccezione di Choi (2012) [22], Iannelli [23] e Melegaro [9].
Oltre a incorporare queste proprietà in un unico modello, il modello include anche le seguenti caratteristiche:
il modello considera la struttura per età e i diversi sierotipi di pneumococco. Poiché tutte le fasce d’età della popolazione sono incluse simultaneamente, è possibile implementare una schedula vaccinale dipendente dall’età e valutarne l’impatto su qualsiasi classe di sierotipi di SP di interesse, permettendo così al modello di tenere conto dell’effetto dell'immunità di gregge attraverso la vaccinazione pediatrica. Inoltre, è possibile ottenere i risultati del modello per il carriage o per una manifestazione clinica della malattia per fascia di età, sierotipi e vaccini;
il modello consente di applicare vaccini diversi a gruppi di età diversi. Questo aiuta a calibrare il modello sui dati di copertura vaccinale disponibili nelle diverse fasce d’età per ogni vaccino o combinazione di vaccini, ma soprattutto per la vaccinazione sequenziale;
la trasmissione per carriage è modellata in modo esplicito, potenzialmente in grado di portare alla progressione della malattia. Lo stato di portatore di per sé non rappresenta un rischio di malattia ma, talvolta, può essere alla base delle infezioni [24]. Sebbene sia quasi sempre asintomatica, la colonizzazione pneumococcica rappresenta il primo passo nella via patogenetica del pneumococco fino alla malattia invasiva [25]. Con questa distinzione, abbiamo modellato un’efficacia vaccinale (VE) diversa per lo stato di portatore rispetto all’outcome malattia. Per tanto, la trasmissione dell’infezione è associata esclusivamente allo stato di portatore e non alla malattia;
la progressione dallo stato di portatore verso una malattia pneumococcica dipende dall’invasività di ciascun sierotipo, che varia in base all’età, e dalle condizioni di base dei singoli individui;
il modello tiene traccia della storia della vaccinazione con vaccini specifici. Questo permette anche di tenere conto del carriage e della malattia specifici per vaccino/i, classi di sierotipi e gruppi di età.
Il modello, quindi, presenta due componenti principali: una che considera gli aspetti demografici della popolazione e una rappresentata dal modello epidemiologico. La componente demografica ha lo scopo di simulare l’attuale struttura per età della popolazione italiana, come le nascite e i decessi, i contatti e l’invecchiamento nelle diverse fasce di età. Il modello epidemiologico descrive la trasmissione dello SP all’interno della popolazione sintetica, generata dal modello demografico. Come anticipato, il modello epidemiologico messo a punto ha tenuto conto di modelli simili, pubblicati in letteratura, relativamente alla valutazione di strategie vaccinali contro lo pneumococco [8-17], incorporando la modellazione del carriage recentemente pubblicata da Malik et al. [26].
La presente analisi ha considerato l’intera popolazione italiana potenzialmente eleggibile per la vaccinazione antipneumococcica a partire, quindi dai 2 mesi di vita. La popolazione totale, P (t), è stata suddivisa in nA gruppi di età nelle fasce considerate (A1: 0-1, A2: 1-5, A3: 5-15, A4: 15-65, A5: 65+), [(A2, A3), …, (An, ∞)]. Le ipotesi sulla crescita della popolazione in funzione dell’età sono tratte da Hethcote (1997) [27] e da Elbasha (2008) [28] e presuppongono che la distribuzione della popolazione abbia raggiunto uno stato stazionario con crescita o decadimento esponenziale della forma eqt, dove q è il tasso di crescita annuale della popolazione. Per tenere conto dei modelli di prevalenza del carriage dello pneumococco, delle diverse manifestazioni cliniche della malattia da pneumococco, delle raccomandazioni vaccinali e della disponibilità dei dati sulla malattia in Italia, il modello attuale divide la popolazione in cinque fasce di età < 1, 1-5, 5-15, 15-65, 65+. Le fasce d’età del modello sono state scelte in base alla disponibilità di dati del sistema di Sorveglianza delle MaBi che solo a partire dal 2017 distingue la popolazione infantile e quella anziana (64+). I parametri demografici utilizzati sono descritti in Tabella II.
Parametri demografici del modello.
| Parametri | Descrizione |
|---|---|
| Λ | Tasso di nascita (reclutamento nel modello) |
| μa | Rischio di morte nel gruppo a |
| ma | Tasso di invecchiamento dall’età del gruppo a ad a + 1 |
| cab | Numero medio di contatti di un individuo che è nel gruppo di età a con individui del gruppo di età b per anno |
| fa | Tasso di fertilità nel gruppo di età a |
| q | Tasso di crescita annuale della popolazione |
I dati relativi all’aspettativa di vita sono stati ottenuti consultando le Tavole di mortalità di ISTAT [29], attraverso i quali sono stati stimati i rischi di mortalità (μa) per ogni gruppo di età del modello.
Utilizzando una popolazione totale nell’anno 2020, sempre provenienti dalla banca dati ISTAT, “popolazione” [30], e i rischi di mortalità e i tassi di invecchiamento, abbiamo stimato le nascite annuali utilizzando la formula pubblicata in Elbasha (2021) [31]. Il modello non tiene conto di caratteristiche particolari della popolazione, come l’immigrazione.
Invece, si stratifica ulteriormente la popolazione in base alla classe di rischio di contrarre una malattia da SP, come definito dal PNPV. Le proporzioni di bambini, adulti sani, a rischio e ad alto rischio per fascia d’età si basano sui dati Multiscopo 2019 [32] (Tab. A; Materiale supplementare).
Nella calibrazione e nelle proiezioni del modello, sono state mantenute costanti sia la popolazione complessiva dell’Italia, sia le dimensioni delle fasce d’età. Questo per garantire che i risultati siano dovuti all’impatto dei vaccini e non alle variazioni della popolazione. Questa semplificazione ha molteplici impatti sull’Italia, un Paese in cui la popolazione è notoriamente in calo. Con un numero inferiore di neonati, qualsiasi impatto del vaccino (sia esso PCV13 o PCV15) sui gruppi di età più giovani (in particolare 0-1 e 1-5) sarebbe ridotto. Con un numero inferiore di neonati, si ridurrebbe anche la protezione indiretta degli adulti derivante dalla vaccinazione infantile con PCV. Questo porterebbe a un aumento di MIP e PNB negli adulti. Inoltre, con l’invecchiamento della popolazione, aumenterebbe la dimensione dei gruppi di età più avanzata. Poiché la MIP è più comune negli anziani, è probabile che l’invecchiamento della popolazione aumenti ulteriormente i casi complessivi di MIP.
Nel complesso, la diminuzione dei tassi di natalità porterebbe probabilmente a un minor numero di casi infantili di tutti gli esiti (MIP, PNB e OMA), a una riduzione della protezione di comunità negli adulti e a un aumento dei casi di esiti adulti (MIP e PNB) a causa della ridotta protezione di comunità e dell’aumento del pool di adulti suscettibili.
La classica soglia di protezione di comunità indotta dal vaccino, ipotizzando una popolazione omogenea, può essere più alta della soglia in presenza di eterogeneità nelle popolazioni. Poiché il modello incorpora la struttura per età, è importante tenere conto dell’eterogeneità dovuta ai diversi modelli di contatto tra i vari gruppi di età. Per questo una componente fondamentale del modello è rappresentata dalla matrice di contatto, che ha un impatto diretto sulle dinamiche di trasmissione di una malattia infettiva. Le matrici di contatto tra fasce di età di una popolazione sono per lo più basate su dati raccolti attraverso indagini specifiche e diari. La principale complicazione nell’adattamento di questi modelli è dovuta alla mancata corrispondenza tra le fasce d’età della popolazione dello studio di partenza e le fasce d’età del modello in uso. Per il modello attuale, le stime della matrice di contatto sono derivate da Prem [33], in cui le stime giornaliere corrispondono a modelli di contatto tra gruppi di età di 5 anni. La matrice di contatto ottenuta per il presente modello, raggruppando le fasce d’età prescelte, è mostrata nella Tabella B del materiale supplementare del presente capitolo. Le voci della matrice di contatto rappresentano una stima del numero di contatti che un individuo di un gruppo di età rappresentato da una riga ha in media in un anno con un individuo di un gruppo di età elencato in una colonna.
Il modello epidemiologico distingue tra stato di portatore e malattia da SP. La maggior parte dei bambini si presenta in uno stato di portatore, situazione in cui SP può risiedere in modo asintomatico nel rinofaringe per periodi di tempo prolungati. Lo stato di portatore non sempre si traduce in una malattia pneumococcica (OMA, MIP, ecc.). Quando si acquisisce un sierotipo ad alta invasività, un individuo può sviluppare una malattia pneumococcica. Secondo il Centro per il controllo e la prevenzione delle malattie statunitense (CDC), il periodo di incubazione della malattia pneumococcica va da 1 a 3 giorni [34]. Inoltre, i bambini di età inferiore ai 2 anni e gli adulti di 65 anni o più sono a maggior rischio di malattia pneumococcica.
Il modello incorpora la possibilità che, all’acquisizione dello pneumococco, un individuo entri nello stato di portatore oppure sviluppi una malattia da SP, tra cui la MIP, l'OMA e la polmonite pneumococcica non invasiva. Tuttavia, possono essere analizzate anche altre manifestazioni (ad esempio la batteriemia o un’ulteriore classificazione dell’OMA, semplice o ricorrente) utilizzando questo schema, adattando i parametri relativi alle malattie in esame.
Data la mancanza di dati per parametrizzare il modello per tutti i sierotipi rilevanti e per semplicità, i sierotipi sono stati raggruppati in 7 categorie ed è stato assunto che i valori dei parametri (competizione, probabilità di trasmissione, durata dello stato di portatore e invasività) non cambino all’interno di una classe di sierotipi.
La categoria 1 è costituita dai sierotipi del vaccino PCV7 (4, 6B, 9V, 14, 18C, 19F, 23F), la categoria 2 è costituita dai sierotipi del vaccino PCV13 aggiuntivi (1, 5, 6A, 7F, 19A), escluso il sierotipo 3 (ST3). La categoria 3 è rappresentata dal solo ST3, in quanto presenta delle peculiarità epidemiologiche in Italia, essendo il sierotipo più frequentemente isolato nell’ambito del sistema di sorveglianza MaBI dell’ISS dopo il sierotipo 8 e in seguito all’evidenza di una minore efficacia del PCV13 contro la malattia da ST3. La categoria 4 è rappresentata dai sierotipi aggiuntivi contenuti nel vaccino PCV15 (22F e 33F). La categoria 5 contiene i sierotipi aggiuntivi di PCV20 (8, 10A, 11A, 12F, 15B) e la categoria 6 contiene i sierotipi aggiuntivi di PPSV23, non inclusi in nessuno dei PCV precedenti (9N, 17F, 20). La categoria 7 include tutti i sierotipi rimanenti non inclusi in nessuna delle 6 classi di sierotipi di cui sopra (Tab. III). Va sottolineato che non è stato inserito il sottotipo 6A contenuto nei vaccini PCV13, 15 e 20, e che lo stesso non è un sottotipo bersaglio del PPSV23.
Aggregazioni di sierotipi (gruppi) considerati nel modello.
| Gruppi di sierotipi | Sierotipi contenuti | Descrizione |
|---|---|---|
| 1 | 4, 6B, 9V, 14, 18C, 19F, 23F | Sierotipi vaccinali unici di PCV7 |
| 2 | 1, 5, 6A, 7F, 19A | Sierotipi aggiuntivi contenuti in PCV13 (escluso il ST3) |
| 3 | 3 | Sierotipo 3 |
| 4 | 22F, 33F | Sierotipi aggiuntivi contenuti in PCV15 |
| 5 | 8, 10A, 11A, 12F, 15B | Sierotipi aggiuntivi contenuti in PCV20 |
| 6 | 9N, 17F, 20 | Sierotipi aggiuntivi contenuti in PCV23 |
| 7 | NVT backet | Sierotipi NON vaccinali |
La distribuzione percentuale di ciascun sierotipo è quella riportata nei Rapporti MaBI dei diversi anni: Rapporto MaBI 2007-2010 [35], Rapporto MaBI 2011-2017 [36], Rapporto MaBI 2004-2016 [37] e in particolare, il Rapporto MaBI consolidato per il triennio 2017-2019 [3]. Essendo noti solo i sierotipi responsabili di MIP, la medesima distribuzione sierotipica viene applicata anche alle OMA e alle PNB (assumption di uguale frequenza dei sierotipi).
Il modello di trasmissione deterministico per SP, strutturato per età e multi-sierotipo, è costruito dividendo la popolazione in compartimenti specifici per età in base allo stato di portatore sano di SP, allo stato di malattia e allo stato di protezione vaccinale, descrivendo le dinamiche di trasmissione del portatore e la progressione della malattia in presenza di vaccini pneumococcici specifici per età e sierotipo.
Gli indici, le variabili e i parametri epidemiologici del modello sono riassunti di seguito:
Gli indici considerano:
le categorie di sierotipi i,j vanno da 1 a 7, dove 7 è il numero totale di categorie dei sierotipi incluse nel modello;
il gruppo di età a va da 1 a 5, dove 5 è il numero totale di gruppi di età;
lo stato vaccinale viene indicato con σ = u: non vaccinato, σ = v: PCV-vaccinato, σ = vw: PCV-PPSV-vaccinato.
Le variabili considerano:
Nu,a individui non vaccinati non colonizzati nella fascia di età a;
Nv,a individui non colonizzati nella fascia di età a che hanno ricevuto PCV;
Nvw,a individui non colonizzati nella fascia di età a che hanno ricevuto PCV e PPSV;
Cu,a,i individui di età a che non sono stati vaccinati e sono colonizzati con sierotipo di classe i;
Cv,a,i individui di età a che hanno ricevuto PCV e sono colonizzati con sierotipo di classe i;
Cvw,a,i individui di età a che hanno ricevuto PCV e PPSV e sono colonizzati con sierotipo di classe i;
CCu,a,i,j individui non vaccinati di età a co-colonizzati con sierotipi di classe i e j;
CCv,a,i,j individui di età a, vaccinati con PCV, co-colonizzati con sierotipi di classe i e j;
CCvw,a,i,j individui di età a, vaccinati con PCV e PPSV, co-colonizzati con sierotipi di classe i e j;
Du,a,i individui non vaccinati di età a con malattia pneumococcica da gruppi di sierotipi i;
Dv,a,i individui di età a, vaccinati con PCV, con malattia pneumococcica da gruppi di sierotipi i;
Dvw,a,i individui di età a, vaccinati con PCV e PPSV, con malattia pneumococcica da gruppi di sierotipi i;
M_(v,a) individui non colonizzati di età a, precedentemente vaccinati ma con protezione vaccinale declinata;
Qu,a,i individui di età a, precedentemente vaccinati ma con protezione vaccinale declinata, colonizzati da sierotipi di classe i;
QQa,i,j individui di età a, precedentemente vaccinati ma con protezione vaccinale declinata, co-colonizzati con le classi di sierotipo i e j;
P_a popolazione totale nella fascia di età a.
I parametri epidemiologici considerano:
βa,i probabilità per un carrier di età a di trasmettere l’infezione da gruppi di sierotipi i per contatto;
γσ,a,i tasso di clearance del gruppo di sierotipi i di individui di età a con classe di vaccino σ;
θi,j probabilità di essere co-colonizzati dal gruppo di sierotipi j se attualmente colonizzato col gruppo di sierotipi i (riduzione del rischio della seconda colonizzazione con j);
ρa,i probabilità di sviluppare una malattia pneumococcica in seguito all’acquisizione di un sierotipo del gruppo i nella fascia di età a;
eσ,a,i efficacia del vaccino σ contro l’acquisizione del gruppo di sierotipi i nella fascia di età a;
eD,σ,a,i efficacia del vaccino σ contro lo sviluppo di malattia pneumococcica se infettati col gruppo di sierotipi i nella fascia di età a;
ωσ,a tasso di riduzione dell’efficacia del vaccino σ nella fascia di età a;
copertura vaccinale della coorte;
ψσ,a Tasso di vaccinazione con σ degli individui non vaccinati nella fascia di età a.
La Figura 1 descrive i compartimenti degli individui non vaccinati stratificati per fasce d’età e stato di portatore sano. Invece, le dinamiche di trasmissione dello stato portatore e di progressione della malattia negli individui vaccinati sono rappresentate rispettivamente nella Figura 2 e nella Figura 3.
Modello di diagramma di flusso che descrive le transizioni tra i compartimenti degli individui non vaccinati.
Modello di diagramma di flusso che descrive le transizioni tra i compartimenti dei soggetti vaccinati con carriage nasofaringeo.
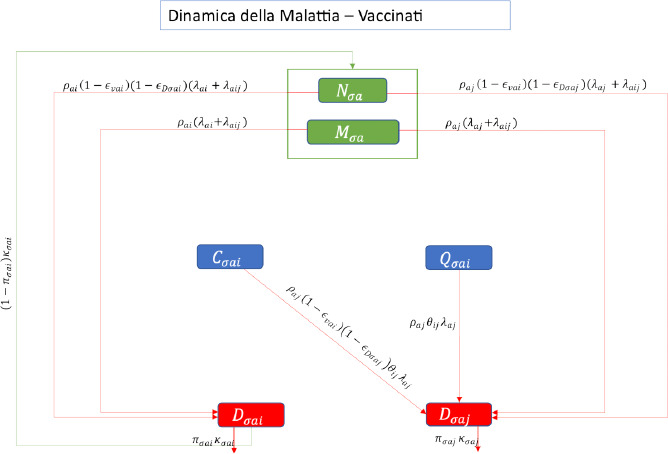
Diagramma di flusso del modello che descrive la frazione di individui vaccinati che progrediscono verso una malattia da pneumococco al momento dell’acquisizione del carriage e della guarigione dalla malattia.
Il modello incorpora la trasmissione del carriage e la progressione della malattia dopo il carriage come fenomeni separati, anche se non indipendenti. L’acquisizione del carriage dello pneumococco è un precursore della malattia, mentre la malattia non partecipa alla trasmissione. Si presume che la trasmissione sia associata solo al carriage nasofaringeo e, una volta che un individuo progredisce verso la malattia, si presume che non la trasmetta. Di conseguenza, il modello distingue tra l’efficacia di un vaccino contro il carriage e l’efficacia contro lo sviluppo della malattia data l’acquisizione del carriage.
L’efficacia del vaccino dipende dall’età, varia da una classe di sierotipi all’altra e l’efficacia contro una specifica manifestazione clinica è rappresentata dall’efficacia residua dopo l’acquisizione dello stato di portatore (cioè l’efficacia contro la malattia dato il carriage).
I dati di efficacia vaccinale (VE) sul campo dei vaccini disponibili contro la malattia pneumococcica nei bambini sono riportati nella Tabella IV e sono tratte dalla letteratura scientifica internazionale [38-41]. La VE di PCV15 è stimata a partire dal rapporto fra i valori delle concentrazioni medie geometriche (GMC) di IgG sierotipo-specifiche dei bracci degli studi clinici di PCV15 vs il comparator PCV13, d’accordo con quanto proposto da Ryman et al. [42, 43]. Gli stessi rapporti GMT sono utilizzati per modulare la VE verso l’acquisizione del carriage (Tab. V).
Valori di efficacia di campo dei vaccini pediatrici per gruppi di sierotipi.
| Vaccino | Malattia pneumococcica | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| MIP | PNB | OMA | |||||||
| PCV7 ST | Sierotipi PCV13 nonPCV7 | PCV15 non PCV13 (22F/33F) | Tutti sierotipi | PCV7 ST | Sierotipi PCV13 nonPCV7 | PCV15 non PCV13 (22F/33F) | |||
| ST1, 5, 6A, 7F, 19A | ST3 (1a) | ST1, 5, 6A, 7F, 19A | ST3 | ||||||
| PCV7 | 93% | na | na | na | 87,2% | 57% | na | na | na |
| PCV13 | 93% | 86,3% | 44% | na | 87,2% | 57% | 87% | 15% | na |
| PCV15 | 91% | 78,4% | 81% | 93% | 87,2% | 57% | 87% | 15% | 78% |
Dati di efficacia contro lo stato di portatore per tipo di vaccino ed età.
| VE Against Carriage Acquisition | ||
|---|---|---|
| Pediatrico | Adulto | |
| PCV7 | 7,16% | 6,74% |
| PCV13 (1,5,7A,6F,19A) | 5,72% | 2,68% |
| PCV13 (ST3) | 1,39% | 0,87% |
| Non risultato di calibrazione, ma utilizzati nella proiezione (media valori PCV7 e PCV13, non ST3) | ||
| PCV15 (22F/33F) | 6,44% | 4,71% |
Per la stima della VE sul campo negli adulti sono state utilizzate le stime della letteratura scientifica internazionale (Tab. VI) [44-46]. In particolare, per il vaccino PPSV23 è stata considerata l’efficacia sul campo nei confronti della malattia pneumococcica, ma non per lo stato di portatore. Inoltre, la durata media della protezione di PCV o PPSV23, nello scenario base, è stata stimata in linea con la letteratura scientifica e prevede una durata media di 10 anni di protezione a livello di popolazione per il vaccino coniugato [45, 47]. Si è ipotizzato che la protezione del PPSV23 abbia, invece, una durata media della protezione di 7,5 anni a livello di popolazione [48].
Efficacia sul campo dei vaccini contro lo pneumococco negli adulti.
| VE against MIP | VE against PNB | |
|---|---|---|
| PCV13 | 75% (41,4-90,8) | 45% (14,2-65,3) |
| PPSV23 | 73% (10-92) | 33,5% (5,6-53,1) |
Il carriage segue due parametri principali: la probabilità di acquisirlo in base all’età e al gruppo di sierotipi e la VE contro l’acquisizione. Le VE dei vaccini PCV7 e PCV13 sono state ottenute tramite calibrazione del modello rispetto ai dati disponibili e riportate nella Tabella V in cui è descritto il caso base: PCV15 avrà la stessa VE di PCV13 (pari a -5,72% nei 5 ST aggiuntivi non PCV7 e pari a 1,39% verso il ST 3) e una VE contro l’acquisizione dei due sierotipi aggiuntivi (ST 22F e 33F) pari alla media fra le VE di PCV7 e PCV13 contro i sierotipi diversi da ST3.
La probabilità di divenire portatore e la durata media in giorni dello stato di portatore sono presentate nelle Tabelle C e D del materiale supplementare del presente capitolo.
Il modello del burden simula la storia naturale della malattia ed è schematicamente rappresentato nella Figura 4. In breve, ogni soggetto dallo stato di portatore (carriage) può sviluppare una malattia con una certa probabilità più o meno severa: dall’OMA alla PNB, fino alla MIP. Il paziente con MIP (IPD in inglese) può andare incontro con una certa probabilità verso una forma di meningite o sepsi batteriemica che può dare luogo a sequele post-meningite (PMS); il soggetto con PNB, invece, può necessitare di ospedalizzazione, qualora non gestibile a domicilio. In seguito a una MIP o una PNB complicata, indipendentemente dal ricorso alle cure, il paziente potrebbe andare incontro ad exitus. Le OMA considerate sono solo quelle in età pediatrica (< 15 anni) e solo una frazione di OMA va incontro a ospedalizzazione.
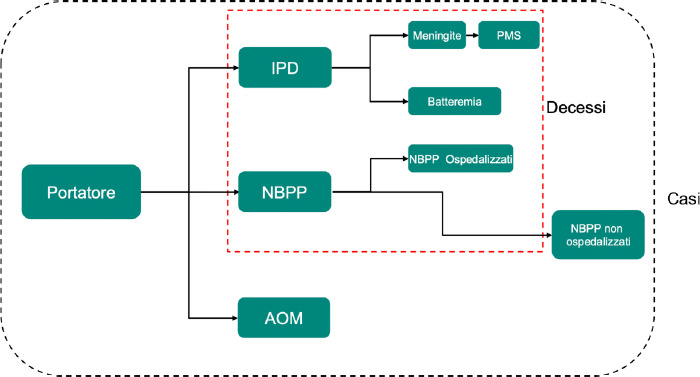
Rappresentazione semplificata del modello di burden.
I dati di copertura vaccinale nei bambini con PCV sono disponibili sul sito del Ministero della Salute a partire dall’anno 2013 e per gli anni precedenti sono stati tratti da una pubblicazione dell’ISS del 2013 [49, 50]. I dati sulla copertura vaccinale con PCV e con PPSV23 non sono disponibili in Italia, gli unici dati sono accessibili attraverso stime locali e regionali pubblicate sui siti istituzionali [50] o a partire da stime sulle DDD di vaccino polisaccaridico e coniugato rilevate da parte di AIFA nell’ambito del Rapporto sull’Uso dei Farmaci, OSMED [51]. In Tabella VII sono descritti i dati utlizzati per il nostro modello. Le coperture vaccinali nei soggetti a rischio sono state stimate sulla base di assumption di maggior compliance a questa vaccinazione.
Dati e stime di copertura vaccinale in Italia, 2007-2020 (valori %).
| Coperture a 36 mesi nei bambini sani [49, 50] | Coperture PCV nei bambini a rischio± (assumption) | Coperture PCV negli adulti sani (65+) [50] | Coperture PCV + PPSV23 nei soggetti a rischio 5± (assumption) | |||
|---|---|---|---|---|---|---|
| Anno | PCV7 | PCV13 | PPSV23 Pre PCV13 | PCV13 + PPSV23 Passaggio a sequenziale | PCV13 + PPSV23 | |
| 2007 | 50,80% | 6% | ||||
| 2008 | 61,10% | 8% | ||||
| 2009 | 72,60% | 10% | ||||
| 2010 | 44,60% | 12% | ||||
| 2011 | 81,10% | 14% | ||||
| 2012 | 82% | 16% | ||||
| 2013 | 82,90% | 18% | ||||
| 2014 | 88,10% | 20% | ||||
| 2015 | 88,30% | 22% | ||||
| 2016 | 88,70% | 24% | ||||
| 2017* | 90,40% | 95% | 26% | 40% | ||
| 2018 | 91,70% | 95% | 28% | 50% | ||
| 2019 | 92,40% | 95% | 30% | 50% | ||
| 2020 | 91,70% | 95% | 32% | 50% | ||
| * Introduzione del PNPV 2017-2019. ± Assunzione di maggior adesione nelle popolazioni a rischio, pediatriche a adulto. | ||||||
L’incidenza della patologia invasiva (meningite e batteriemia) per la popolazione italiana è stata estrapolata dai Report di sorveglianza MaBI, nei vari anni. A partire dai report più recenti (Rapporto consolidato 2017-2019) [3], si è stimato anche la preponderanza dei quadri clinici di meningite (70% delle MIP). L’incidenza della MIP per gli anni antecedenti al 2017 (anno in cui la Sorveglianza MaBI introduce l’analisi dei dati per fasce d’età), sono stati estrapolati da D’Ancona et al. 2015 [52]. L’incidenza delle polmoniti non batteriemiche è stata stimata per l’infanzia a partire da un recente studio di Barbieri et al. 2022 [53] che riporta le ospedalizzazioni per polmoniti per tutte le cause, mentre per l’adulto è stato utilizzato lo studio di Astengo et al. 2021 [54] che ha riportato i tassi di ospedalizzazione per fasce d’età puntuali per le polmoniti per tutte le cause. A entrambe le fonti è stato applicato un 27.3% di frazione attribuibile a S. pneumoniae, ottenuto dalla metanalisi di Said et al. 2013 [55] e, successivamente, una proporzione di ospedalizzazione distinta per età per stimare l’incidenza complessiva anche delle forme che non hanno necessitato di ricovero. In assenza di dati per gli anni successivi al 2017, si è assunto un trend stabile. Sia i dati delle MPI che delle PNB riflettono un trend ben documentato anche in Italia, ovvero la diminuzione del burden in età pediatrica e l’aumento dell’incidenza in età adulta (Tab. VIII).
Incidenza delle malattie pneumococciche considerate (tutti i sierotipi).
| Incidenza MIP * 100.000 | |||||||
| Fasce d'età | |||||||
| < 1 | 1-4 | 5-9 | 10-14 | 15-24 | 25-64 | > 64 | |
| 2020 | 6,39 | 1,76 | 0,48 | 0,31 | 0,42 | 1,71 | 7,26 |
| 2019 | 6,39 | 1,76 | 0,48 | 0,31 | 0,42 | 1,71 | 7,26 |
| 2018 | 5,04 | 2,23 | 0,61 | 0,31 | 0,29 | 1,6 | 6,67 |
| 2017 | 5,77 | 2,21 | 0,46 | 0,49 | 0,42 | 1,82 | 7,37 |
| 2016 | 5 | 2,2 | 0,81 | 0,56 | 0,3 | 1,43 | 6,43 |
| 2015 | 5,03 | 1,72 | 0,7 | 0,42 | 0,35 | 1,25 | 5,43 |
| 2014 | 5,9 | 2,5 | 1,2 | 0,7 | 0,3 | 1,7 | 7,5 |
| 2013 | 5,2 | 3,3 | 2,5 | 0,6 | 0,4 | 2,1 | 8,5 |
| 2012 | 7,7 | 3,4 | 1,6 | 0,4 | 0,2 | 1,5 | 7,9 |
| 2011 | 8,6 | 5,1 | 1,5 | 0,1 | 0,2 | 1,3 | 6,5 |
| 2010 | 9,3 | 5,1 | 1,4 | 0,5 | 0,3 | 1,8 | 7 |
| 2009 | 10,5 | 4,7 | 1,2 | 0,5 | 0,4 | 1,7 | 6,1 |
| 2008 | 12 | 5,9 | 1,4 | 0,6 | 0,4 | 1,2 | 5,3 |
| Incidenza polmoniti pneumococciche non batteriemiche (PNB) * 100.000 | |||||||
| Fasce d'età | |||||||
| < 1 | 1-4 | 5-9 | 10-14 | 15-24 | 25-64 | > 64 | |
| 2020 | 189 | 310,5 | 81 | 81 | 78 | 140 | 1311 |
| 2019 | 189 | 310,5 | 81 | 81 | 78 | 140 | 1311 |
| 2018 | 189 | 310,5 | 81 | 81 | 78 | 140 | 1311 |
| 2017 | 189 | 310,5 | 81 | 81 | 66 | 121 | 1216 |
| 2016 | 216 | 378 | 135 | 135 | 60 | 113 | 1089 |
| 2015 | 216 | 398,25 | 108 | 108 | 58 | 120 | 1119 |
| 2014 | 243 | 567 | 324 | 324 | 82 | 124 | 963 |
| 2013 | 189 | 432 | 216 | 216 | 73 | 113 | 947 |
| 2012 | 216 | 378 | 108 | 108 | 68 | 112 | 918 |
| 2011 | 243 | 465,75 | 216 | 216 | |||
| 2010 | 243 | 526,5 | 297 | 297 | |||
| Incidenza otiti medie acute (OMA) * 100.000 | |||||||
| Fasce d'età | |||||||
| < 1 | 1-4 | 5-9 | 10-14 | 15-24 | 25-64 | > 64 | |
| 2020 | 186 | 180 | 38 | 38 | Non incluse nel modello | Non incluse nel modello | Non incluse nel modello |
| 2019 | 186 | 180 | 38 | 38 | |||
| 2018 | 186 | 180 | 38 | 38 | |||
| 2017 | 186 | 180 | 38 | 38 | |||
| 2016 | 184 | 193 | 42 | 42 | |||
| 2015 | 183 | 185 | 43 | 43 | |||
| 2014 | 187 | 189 | 44 | 44 | |||
| 2013 | 178 | 192 | 54 | 54 | |||
| 2012 | 175 | 203 | 55 | 55 | |||
| 2011 | 173 | 211 | 58 | 58 | |||
| 2010 | 179 | 205 | 60 | 60 | |||
| 2009 | 195 | 195 | |||||
| 2008 | 195 | 195 | |||||
| 2007 | 176 | 176 | |||||
La casistica così definita è stata suddivisa nei 7 sierogruppi vaccinali, fra loro complementari, al fine di effettuare la calibrazione del modello e prevedere l’andamento della malattia pneumococcica nell’orizzonte della simulazione.
Per ciascuna delle malattie da pneumococco incluse nel modello si descrivono di seguito le probabilità di transizione che ne definiscono l’utilizzo di risorse sanitarie. Per quanto riguarda le MIP, essendo rilevate dalla sorveglianza MaBI è implicito che il 100% vada incontro a ospedalizzazione. L’occorrenza di sequele post-meningite (PMS) è pari al 99% dei casi di meningite ed è caratterizzata dall’accesso a 2 visite specialistiche post-dimissione (una otorinolaringoiatra e l’altra neurologica) per ogni anno di vita residuo del paziente che non va incontro a decesso. Le polmoniti pneumococciche non batteriemiche (PNB) vanno incontro a ospedalizzazione nel 21-45% dei casi a seconda della fascia d’età [56, 57]. In età pediatrica, i pazienti con PNB accedono al Pediatra di Libera Scelta (PLS) 1,14 volte per episodio, mentre fra gli adulti è stimato un solo accesso al Medico di Medicina Generale (MMG) per episodio. Nel setting ambulatoriale, a ogni PNB corrisponde una prescrizione medica per terapia antibiotica, e il 30% di esse richiede esami diagnostici di approfondimento, per i quali una radiografia del torace è assunta come proxy. I dati di utilizzo di risorse sanitarie associati a OMA e PNB nei bambini sono tratti dalle pubblicazioni recenti di Amicizia et al. 2022 [58] e Barbieri et al. 2022 [59], quest’ultima basata sui dati registrati dalla pediatria di famiglia nel Database Pedianet, un software gestionale che consente di valorizzare l’attività outpatient. I dati di consumo di risorse sanitarie da parte degli adulti provengono anch’esse da diverse fonti di letteratura specifiche per il contesto italiano, in particolare da Astengo et al. 2022 [60]. La Tabella IX riporta i principali parametri epidemiologici per ciascuna malattia pneumococcica considerata.
Principali parametri epidemiologici per ciascuna malattia pneumococcica considerata.
| < 1 | 1-4 | 5-9 | 10-14 | 15-24 | 25-64 | > 64 | Fonte± | |
|---|---|---|---|---|---|---|---|---|
| MIP | ||||||||
| % Sepsi batteriemica | 70% | 70% | 70% | 70% | 70% | 70% | 70% | [3] |
| % Meningiti | 30% | 30% | 30% | 30% | 30% | 30% | 30% | [3] |
| Mortalità per MIP | 1,49% | 2,75% | 1,37% | 5,45% | 5,25% | 8,84% | 12,02% | [61] |
| MIP ospedalizzate | 100% | 100% | 100% | 100% | 100% | 100% | 100% | ± |
| MIP che accedono a DEA | 100% | 100% | 100% | 100% | 100% | 100% | 100% | ± |
| Visita PLS/MMG post-osp | 100% | 100% | 100% | 100% | 100% | 100% | 100% | ± |
| % Follow-up spec. meningiti (1 neurologo + 1 otorino) post-osp | 99% | 99% | 99% | 99% | 99% | 99% | 99% | [62] |
| Polmoniti pneumococciche non batteriemiche (PNB) | ||||||||
| Eziologia da S. pneumoniae | 27,3% | 27,3% | 27,3% | 27,3% | 27,3% | 27,3% | 27,3% | [55] |
| % PNB ospedalizzate | 21% | 21% | 21% | 21% | 21% | 24% | 45% | [56, 57, 59] |
| % PNB outpatient | 79% | 79% | 79% | 79% | 79% | 76% | 55% | [56, 57, 59 |
| Mortalità per PNB | 0,26% | 0,26% | 0,21% | 0,83% | 1,78% | 5,07% | 12,10% | [56] |
| % PNB che accedono a DEA (1,38 di quelle che saranno ricoverate) | 29% | 29% | 29% | 29% | 29% | 33% | 62% | [59] |
| Visita PLS/MMG (qualsiasi PNB) | 114% | 114% | 114% | 114% | 100% | 100% | 100% | [59] |
| % Prescrizione farmacologica da PLS o MMG | 100% | 100% | 100% | 100% | 100% | 100% | 100% | ± |
| % esami diagnostici (X-ray come proxy) | 30% | 30% | 30% | 30% | 30% | 30% | 30% | [62] |
| Otiti medie acute (OMA) | ||||||||
| % OMA ospedalizzate | 0,1% | 0,1% | 0,1% | 0,1% | nd | nd | nd | [58] |
| % OMA che accedono a DEA (1,3 di quelle ospedalizzate) | 1,3% | 1,3% | 1,3% | 1,3% | nd | nd | nd | [58] |
| % OMA che accedono al PLS | 104% | 104% | 104% | 104% | nd | nd | nd | [59] |
| ± Assunzione di maggior adesione nelle popolazioni a rischio, pediatriche ad adulto. | ||||||||
Per il modello epidemiologico per lo S. pneumoniae (SP) abbiamo considerato come punto di partenza i dati epidemiologici della Sorveglienza MaBI coordinato dall’ISS, in Italia, dal 2007 al 2019 [3], aggiustando, attraverso specifiche analisi di sensibilità, alcuni parametri del modello che non erano facilmente reperibili in letteratura. Inoltre, il modello è stato anche calibrato sui dati di copertura vaccinale per garantire la rappresentazione dell’implementazione delle strategie vaccinali nel periodo di calibrazione, assicurando a sua volta la corretta considerazione del loro impatto sui trend di incidenza della MIP in ogni gruppo di età e in ogni categoria di sierotipi. In questo modo si garantisce che il modello sia calibrato con l’incidenza complessiva delle MIP in presenza di vaccini specifici per sierotipo e per età, insieme alle variazioni delle raccomandazioni durante il periodo di calibrazione.
Abbiamo adattato il tasso di incidenza di MIP, in ciascuna delle cinque fasce di età considerate con ciascuna delle sette categorie di sierotipi ottenute dal modello, all’incidenza di MIP per 100.000 abitanti in Italia secondo i dati del Sistema di Sorveglianza MaBI. A causa della presenza di un dato outlier per il 2017 è stato applicato ai dati un modello di smoothing per permettere di calibrare il modello in maniera adeguata.
Questi valori di incidenza di MIP sono stati utilizzati come valori iniziali per il modello, che successivamente è stato calibrato nel tempo nel primo periodo di vaccinazione (T1) a partire dal 2007. Qui i parametri del vaccino, in particolare l’efficacia contro la MIP dovuta alla prima classe di sierotipi e il tasso di riduzione dell’efficacia sul campo, sono stati aggiustati per riflettere l’implementazione del PCV7 nella fascia di età pediatrica. Oltre ai parametri non vaccinali sopra citati, anche l’efficacia del vaccino contro il carriage per ogni classe di sierotipi è stata aggiustata in modo che l’incidenza di MIP nel periodo 2007-2010 (periodo di utilizzo di PCV7) fosse strettamente corrispondente. Questi parametri vengono nuovamente aggiustati nel 2010 per riflettere il passaggio dal PCV7 al PCV13. In questo secondo periodo di calibrazione (T2), viene attuata anche la vaccinazione sequenziale PCV13 + PPSV23 secondo l’andamento delle coperture vaccinali sopra descritto.
Per la calibrazione del modello è stato utilizzato il metodo dei minimi quadrati implementato in Mathematica® 13.1 (Wolfram Research). Regolando la probabilità di trasmissione del carriage per contatto (βa,i), la competizione (θi,j) e la probabilità di sviluppare la malattia pneumococcica al momento dell’acquisizione dell’infezione (ρa,i) è stato possibile stimare la probabilità di acquisire la condizione di carriage per contatto e la conseguente probabilità di sviluppare la malattia (Tabb. E-G; materiale supplementare).
In Figura 5 è rappresentata la calibrazione del modello riferita alle MIP dal 2012 al 2019 per i diversi sierogruppi considerati nel presente studio, per fasce di età.
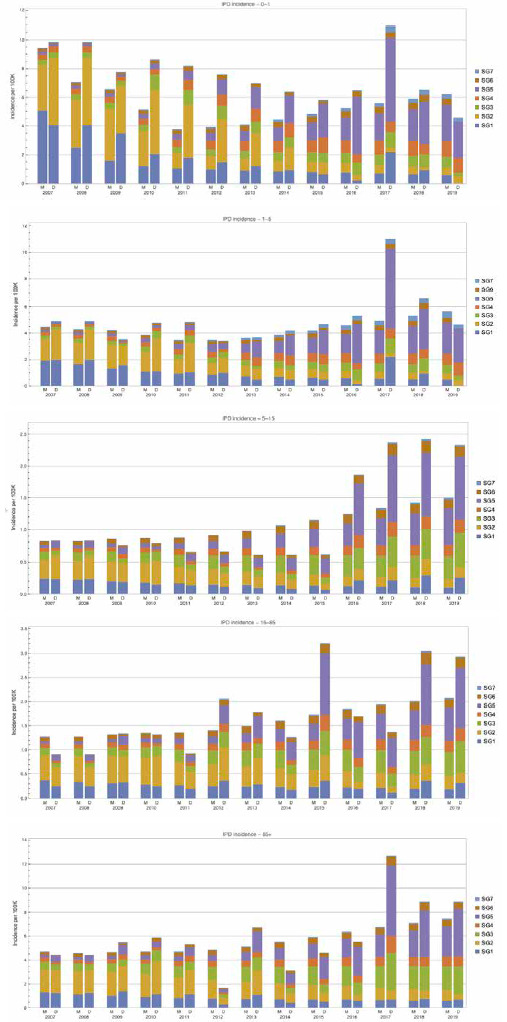
Calibrazione del modello riferita alle malattie invasive da Pneumococco: anni 2012-2019 per gruppi di sierotipi e fasce d’età.
I risultati completi della calibrazione del modello e il fitting dei dati per le PNB e OMA sono presentati nel materiale supplementare del presente capitolo (Figg. I, II, materiale supplementare).
I costi inclusi nel modello sono prevalentemente diretti sanitari e provengono, nella maggior parte dei casi, dalle stesse pubblicazioni utilizzate per definire l’utilizzo di risorse [58-60] e sono riportati nella Tabella X.
Parametri di costo.
| Parametri di costo | Età pediatrica | Età adulta | Fonte |
|---|---|---|---|
| Costo delle alternative vaccinali | |||
| PVC13 | 43,90 | 43,90 | [51] |
| PCV15 | 43,90 | 43,90 | Aggiudiche regionali |
| PPSV23 | 19,13 | 19,13 | [51] |
| Costo di somministrazione (per dose) | 6,80 | 6,80 | [63] |
| Costi diretti per la gestione delle malattie da S. pneumoniae | |||
| MIP - Meningiti | |||
| Costo ospedalizzazione | 12.903 | 9.927 | [60, 64] |
| Costo accesso al Pronto Soccorso | 61,89 | 110,31 | [59,60] |
| Costo farmaci prescritti post-dimmissione ospedaliera | 14,70 | 36,74 | [59,62] |
| Costo visita al MMG o PLS | 28,33 | 20,00 | [59,63] |
| Costo di sequele post-meningiti: 2 visite specialistiche (neurologa + otorinolaringoiatrica)*anno | 32,40 | 32,40 | [63] |
| MIP - Batteriemia | |||
| Costo ospedalizzazione | 5.705 | 8.395 | [58,60] |
| Costo accesso al Pronto Soccorso | 61,89 | 110,31 | [58,60] |
| Costo farmaci prescritti post-dimmissione ospedaliera | 14,70 | 36,74 | [58,62] |
| Costo visita al MMG o PLS | 28,33 | 20,00 | [58,63] |
| PNB ospedalizzate | |||
| Costo ospedalizzazione | 3.323 | 4.463 | [58,60] |
| Costo visita al Pronto Soccorso | 61,89 | 110,31 | [58,60] |
| Costo farmaci prescritti post-dimmissione ospedaliera | 14,70 | 36,74 | [58,62] |
| Costo visita al MMG o PLS | 28,33 | 20,00 | [58,63] |
| PNB non-ospedalizzate | |||
| Costo visita al Pronto Soccorso | 61,89 | 110,31 | [58,60] |
| Costo farmaci prescritti da MMG o PLS | 14,70 | 36,74 | [58,62] |
| Cost visita al MMG o PLS | 28,33 | 20,00 | [58,63] |
| Costo radiografia del torace | 15,49 | 15,49 | [63] |
| OMA - Otite media acuta | |||
| Costo singola ospedalizzazione | 662 | - | [65] |
| Costo accesso al Pronto Soccorso | 61,89 | - | [58] |
| Costo farmaci prescritti da MMG o PLS | 12,48 | - | [58] |
| Costo visita al MMG o PLS | 26,88 | - | [58] |
| Costi indiretti associati a perdita di produttività per singolo episodio (caregiver o adulto affetto da PD) | |||
| Meningite | 971 | 971 | [4] |
| Batteriemia | 571 | 571 | [4] |
| OMA | 351,65 | 351,65 | [66] |
I costi indiretti considerati si riferiscono solo alla perdita di produttività del caregiver (per soggetti con età inferiore a 15 anni) e agli adulti in età lavorativa (< 65 anni). I valori reperiti in letteratura si applicano a ciascun episodio di MIP e OMA, mentre non è stato rinvenuto un dato per le PNB [4, 66]. I costi indiretti così stimati sono estremamente conservativi ma consentiranno di apprezzare la prospettiva sociale oltreché quella del SSN.
All’interno del modello, gli individui vanno incontro a una perdita di QALY in funzione dell’età e dello sviluppo delle malattie pneumococciche considerate. La perdita di QALY è definita come disutility (tratte da Szende (2014) [67]) applicata per una certa durata alle utilities base raggruppate per età. In caso di malattia pneumococcica, si applicano invece valori di disutility specifici per la malattia pneumococcica come definiti in un recente studio del Centre for Health Economics Research and Modelling Infectious Diseases belga [68]. Nelle Tabelle H e I del materiale supplementare del presente capitolo sono presentati i valori di utilities e le dusitilities applicate a seconda della fascia d’età e classe di rischio. Tali disutilities si applicano a ciascun evento per una durata di tempo che varia da 8,5 giorni per le PNB outpatient sino a vita per le sequele da post meningite. Alle OMA non si associa perdita di qualità della vita.
Il modello parte dalla raccomandazione presente nel PNPV 2017-19 [2] e definisce come “intervento” la sostituzione di PCV15 al PCV13, tanto nell’età pediatrica (oggetto del presente report di HTA) quanto in età adulta valutando quindi due distinti scenari:
scenario base: PCV13 nel pediatrico e PCV13 + PPSV negli adulti e nei soggetti a rischio;
scenario 1: PCV15 nel pediatrico e PCV13 + PPSV negli adulti e nei soggetti a rischio;
scenario 2: PCV15 nel pediatrico e PCV15 + PPSV negli adulti e nei soggetti a rischio.
In base al modello epidemiologico e di burden precedentemente descritti, i risultati restituiranno il numero di casi di MIP, PNB e OMA evitati con l’intervento vs il caso base e il rapporto di costo-efficacia incrementale associato all’introduzione di PCV15 in un orizzonte temporale di 50 anni.
Utilizzando le assunzioni e i parametri sinora descritti si ottengono stime puntuali, per fascia d’età e gruppi di sierotipi, per le tre malattie da pneumococco considerate: MIP, PNB e OMA. A seguito del periodo di calibrazione, nel 2020 il modello proietta l’impatto dell’introduzione di PCV15.
Come si evince dai grafici di Figura 6, le MIP attese per anno vedono una crescita in parte contenuta dall’introduzione di PCV15 che, grazie alla sua efficacia sul campo ipotizzata verso i 2 sierotipi (22F e 33F) e altri sierogruppi, in particolare il ST3, eviterebbe sino a 200 casi anno di MIP.
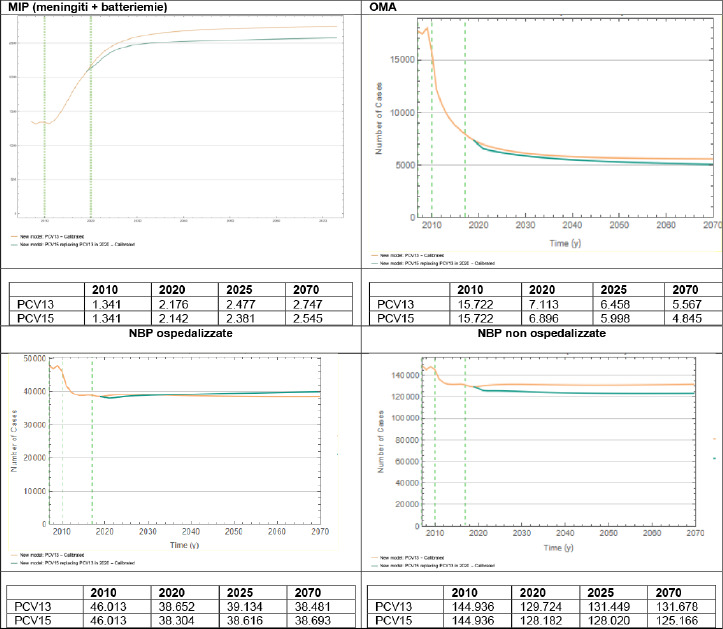
Incidenza casi anno predette dal modello, scenario 1.
Le PNB prevenute sono stimate in 6.300 casi anno, mentre le OMA in 800 episodi per anno evitati rispetto allo scenario che mantiene il PCV13 in età pediatrica. I grafici della Figura 6 illustrano i casi incidenti per anno proiettati dal modello, tenendo conto del periodo di calibrazione, antecedente al 2020, e dell’orizzonte temporale prescelto di 50 anni (sino al 2070).
In base a queste proiezioni, il modello restituisce i risultati epidemiologici ed economici mostrati nelle Tabelle XI e XII. I casi di malattia diminuiscono in maniera consistente e così i costi associati. Considerando tutte le età, l’introduzione di PCV15 preverrebbe sino a 5.745 morti e si assocerebbe a 15.811 QALY guadagnati e 301 milioni di euro risparmiati a valori scontati, mostrandosi una strategia dominante. Il dettaglio per fascia d’età è riportato nel materiale supplementare del presente capitolo [Fig. III; Tabb. L (1-6), Materiale supplementare].
Risultati epidemiologici per tutte le età.
| PCV13 nei bambini | Risultati epidemiologici caso base | Δ vs Caso base | |||
|---|---|---|---|---|---|
| PCV15 vs PCV13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | PCV15 vs PCV13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | ||
| MIP | 140.591 | 128.118 | 127.070 | -12.549 | -13.351 |
| Batteriemia | 98.413 | 89.682 | 88.949 | -8.784 | -9.346 |
| Meningiti | 42.177 | 38.435 | 38.121 | -3.765 | -4.005 |
| PMS | 41.755 | 38.051 | 37.740 | -3.727 | -3.965 |
| PNB | 8.770.953 | 8.275.355 | 8.232.048 | -457.778 | -490.937 |
| OMA | 333.586 | 306.798 | 306.799 | -24.283 | -24.282 |
| Decesso | 102.285 | 96.633 | 96.083 | -5.328 | -5.745 |
Risultati economici in Euro per tutte le età.
| PCV13 nei bambini | Risultati caso base | Δ vs Caso base | |||
|---|---|---|---|---|---|
| PCV15 vs PCv13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | ||
| Costo vaccino | 3.231.865.231 | 3.231.867.771 | 3.231.867.788 | 2.540 | 2.557 |
| Costo MIP | 694.872.618 | 640.611.235 | 636.082.259 | -54.261.384 | -58.790.359 |
| Costo Batteriemia | 441.426.402 | 408.411.208 | 405.430.297 | -33.015.195 | -35.996.105 |
| Costo Meningiti | 253.446.216 | 232.200.027 | 230.651.961 | -21.246.189 | -22.794.254 |
| Costo PMS | 27.754.718 | 25.217.519 | 25.041.010 | -2.537.199 | -2.713.707 |
| Costo PNB | 4.464.473.612 | 4.249.424.570 | 4.230.046.289 | -215.049.042 | -234.427.323 |
| Costo OMA | 69.599.185 | 64.286.778 | 64.286.874 | -5.312.407 | -5.312.311 |
| LYs (Disc.) | 1.548.755.540 | 1.548.758.084 | 1.548.758.328 | 2.544 | 2.788 |
| LYs (Undisc.) | 2.990.356.088 | 2.990.361.735 | 2.990.362.283 | 5.647 | 6.195 |
| Costo totale | 8.488.565.364 | 8.211.407.872 | 8.187.324.220 | -277.157.492 | -301.241.143 |
| QALYs guadagnati | 1.375.560.594 | 1.375.575.302 | 1.375.576.405 | 14.708 | 15.811 |
| ICERs per PCV15 Dominante | |||||
Dalle Tabelle XI e XII si osserva che lo scenario che prevede l’introduzione di PCV15 anche negli adulti, migliora sensibilmente i risultati del modello associandosi a più casi di malattia pneumococcica prevenuti e a 19,3 milioni di euro di saving ulteriore nella prospettiva della società.
I risultati del modello dinamico sono apprezzabili osservando la distribuzione dei casi per fascia d’età [Tabb. L (1-6)], da cui si osserva come l’introduzione di PCV15 in età pediatrica, potrebbe prevenire 5.286 morti per malattie pneumococciche negli over 65enni, 332 mila casi di PNB e 4.664 MIP.
Considerata l’incertezza di alcuni parametri, si è deciso di ripetere la simulazione secondo due scenari alternativi:
scenario VE contro il carriage adattato ai rapporti GMT: in questo scenario i valori di Tabella VI sono aggiustati, al pari della VE di campo, applicando i valori di immunogenicità da studio registrativo, d’accordo all’approccio proposto da Ryman et al. (2022) [42];
scenario 75% di coperture vaccinali nell’adulto: nel secondo scenario si è ipotizzato che le coperture vaccinali nell’adulto raggiungano il target del 75% previsto dal PNPV. Il secondo scenario è particolarmente rilevante per il contesto italiano considerando che il burden delle malattie pneumococciche si concentra in età adulta per via del contesto demografico proprio dell’Italia ma anche per merito delle elevate coperture vaccinali in età pediatrica. Con questo secondo scenario si è quindi inteso valutare anche l’impatto della vaccinazione sequenziale con PCV15 + PPSV23 a coperture target.
I risultati per i due scenari esplorativi sono mostrati nel Materiale supplementare del presente capitolo e confermano i risultati del caso base, a eccezione dello scenario in cui l’efficacia verso l’acquisizione del carriage varia e si osserva un lieve aumento dei casi di malattia non invasiva (PNB e OMA) a fronte però di una riduzione molto più marcata rispetto al caso base delle forme invasive (23.064 casi di MIP vs scenario base).
Dal punto di vista della costo-efficacia, tutte le strategie che prevedono l’inclusione di PCV15 risultano dominanti; solo nel caso appena descritto in cui diminuisce la protezione verso i sierogruppi coperti da PCV7 e PCV13, l’impatto di PCV15 nei sierotipi aggiuntivi e nel sierotipo 3 non compenserebbe del tutto l’aumento di incidenza della malattia non invasiva stimato. Dal punto di vista economico, questo scenario è comunque altamente costo-efficace per il SSN e la società avendo un ICER di 716 euro nello scenario dell’introduzione di PCV15 in età pediatrica.
Il modello epidemiologico utilizzato è particolarmente specifico per la realtà italiana in quanto ha utilizzato i dati di sorveglianza delle MIP in Italia, nonché dati di PNB e OMA recenti.
I risultati suggeriscono che la vaccinazione con PCV15 sia una strategia dominante o costo-efficace rispetto al PCV13, offrendo inoltre migliori esiti clinici e QALYs.
Pur non esistendo in Italia un valore soglia di WTP standardizzato, in base alla letteratura i valori soglia di 30.000 €/QALY e di 50.000 €/QALY sono quelli più frequentemente utilizzati. Una consensus italiana del 2013 [20], inoltre, ha proposto un valore soglia di 40,000/QALY guadagnato. Le linee guida dell’OMS, invece, definiscono il valore soglia di WTP sulla base del prodotto interno lordo (PIL) pro capite [69]. Nel 2021 il PIL in Italia era di circa € 30.000 per abitante. Secondo l’OMS, un intervento è definito altamente costo-efficace quando l’ICER è inferiore al PIL pro capite, mentre è costo-efficace quando è inferiore a tre valori PIL (90.000 €/QALY per l’Italia). I nostri risultati dimostrano che l’introduzione di PCV15 in Italia è altamente costo efficace indipendentemente dal valore soglia WTP considerato.
Fino a oggi in letteratura le analisi di HTA sono state implementate tramite modelli statici, che non tengono in considerazione negli scenari analizzati dell’effetto indiretto dell’immunità di gregge conferita dalla vaccinazione, sottostimando i benefici economici di quest’ultima. Il modello dinamico implementato, invece, in questa analisi ha predetto correttamente, oltre all’herd immunity, anche le differenze di incidenza sierotipo-specifiche a seconda della fascia d’età. Secondo il modello, grazie all’introduzione del vaccino PCV15 in Italia, i casi di malattia diminuirebbero in maniera consistente e con essi i costi associati. Considerando tutte le età, l’introduzione di PCV15 preverrebbe sino a 5.745 morti e si assocerebbe a 15.811 QALY guadagnati e 301 milioni di euro risparmiati, mostrandosi una strategia dominante.
Nello specifico si assisterebbe a una diminuzione di casi di MIP in tutte le fasce d’età, con un significativo decremento nei casi di MIP infantili correlati ai sierotipi 3 e 22F/33F, sierotipi aggiuntivi del PCV15 rispetto al PCV13. Interessante notare, inoltre, come lo stato di portatore si riduca per i sierotipi 22F/33F e per gli anziani anche per il ST3. Risultati speculari si apprezzano anche per le PNB che evidenziano una riduzione per i STs 3, 22F e 33F, soprattutto nei ricoverati in età pediatrica e in tutte le fasce d’età tra i non ricoverati.
Benché per le OMA la riduzione dei casi è evidente sia con il vaccino PCV13 che PCV15, la riduzione dei casi con il PCV15 è più evidente, con particolare riferimento ai ST 3, 22F e 33F.
Nell’orizzonte del modello, l’introduzione del PCV15 in Italia si configura come un investimento prevenendo fra i 12.251 e i 23.064 casi di MIP, di cui 8.576-16.145 casi di batteriemia e 3.675-6.919 casi di meningiti, circa mezzo milione di PNB e 24.280 casi di OMA a seconda dello scenario considerato. Le morti prevenute si stimano nel range di 4.788 e 5.745.
I risultati del nostro modello dinamico sono l’esito non solo del replacement sierotipico che viene simulato nell’orizzonte temporale del modello, ma anche dell’efficacia sul campo ipotizzata per il nuovo vaccino PCV15 sia verso l’acquisizione dello stato di portatore che contro la malattia pnuemococcica. A oggi solo PCV13 e PPSV23 dispongono di dati efficacia sul campo, ma ai fini della presente valutazione si è reso necessario ipotizzare valori specifici di efficacia vaccinale di PCV15 in ciascun gruppo di sierotipi e popolazione. In accordo con un approccio metodologico che si va sempre più affermando nelle valutazioni farmaco-economiche per questa classe di vaccini, la vaccine efficacy per PCV15 nel nostro studio è stata calcolata sulla base dei valori di immunogenicità presenti negli studi clinici (rapporto fra GMC, concentrazione media geometrica) [42, 43, 68]. Seguendo tale approccio, la VE del PCV15 contro le MIP nella popolazione pediatrica è stata stimata lievemente inferiore a quella di PCV13 nei sierotipi PCV13, ma quasi doppia per il sierotipo ST3 e massima nei sierotipi aggiuntivi (Tab. II dell’RCP) [5].
Il modello presenta alcuni limiti, che sono intrinseci ai parametri stimati, in particolare piccole variazioni dell’efficacia del vaccino nei confronti dello stato di carrier (VEc) potrebbero avere un impatto diverso sui vari esiti della malattia. Infatti, moltiplicando per i valori di immunogenicità ottenuti dalla letteratura [42, 43, 70] la VEc per i sierotipi PCV7 (SG1) è scesa dal 7,16 al 7,00% e quella dei sierotipi PCV13-non ST3 dal 5,72 al 5,19%; mentre per i sierotipi ST3 (SG3) è aumentata dall’1,39 al 2,56%. L’analisi di questo scenario alternativo mostra che si otterrebbe una diminuzione dei casi di MIP ma un aumento dei casi di OMA e PNB. L’aumento dei casi di OMA e PNB è dovuto principalmente alla diminuzione della VEc contro i sierotipi appartenenti ai gruppi SG 1 e 2, che ha portato a un aumento dell’acquisizione di questi due sierotipi, con conseguenti casi aggiuntivi di OMA e PNB da questi sierotipi. Tuttavia, l’aumento della VEc per il SG3 è stato più rilevante della diminuzione della VEc per i SG 1 e 2, portando a una diminuzione dei casi di MIP. È importante notare che la VEc protegge da tutti gli esiti, mentre l’efficacia del vaccino contro la malattia (VEd) protegge solo dalle forme di MIP. Nonostante una diminuzione dei casi di MIP a causa dell’aumento del VEc per SG3, l’impatto su OMA o PNB è stato molto limitato, poiché i valori di VEd che proteggono gli individui con carriage dallo sviluppo di malattie invasive erano ancora piuttosto alti. L’impatto rilevante dei cambiamenti della VEc sull’output del modello emerge anche da altri modelli dinamici pubblicati in letteratura che hanno dimostrato come piccole variazioni sulla VEc hanno un impatto maggiore per qualsiasi strategia vaccinale considerata da Sutton et al. (2010) [10]. Un altro modello stima come un vaccino che sia in grado di ridurre il rischio di colonizzazione per un sierotipo anche solo del 10% (riducendo al contempo del 45% il rischio di MIP in caso di colonizzazione), si prevede che possa ridurre il rischio di malattia invasiva di circa il 40% in meno di 10 anni [71]. Ulteriore limite della presente analisi è legato alla disponibilità di dati consistenti sulla sorveglianza delle malattie batteriche invasive in Italia. Questo fenomeno risulta dalla sottonotifica dei casi, evidente soprattutto per i casi di MIP. La presente analisi ha, però, considerato l’intera popolazione italiana potenzialmente eleggibile per la vaccinazione antipneumococcica a partire, quindi, dai 2 mesi di vita, ipotizzando la crescita della popolazione in funzione dell’età come da letteratura.
Va da sé che questo approccio è utile ai fini della modellazione dell’impatto del nuovo intervento sanitario, ma andrebbe rivalutato non appena esisteranno sufficienti evidenze di real world sull’efficacia sul campo delle nuove vaccinazioni anti-pneumococciche sia nel prevenire le forme cliniche che nel prevenire lo stato di portatore.
Il modello dinamico nelle proiezioni a 50 anni dell’incidenza e dello stato di carriage slatentizza un effetto paradosso per i STs non 3 e non 22F/33F dovuto in parte ai limiti del modello stesso ma soprattutto al fenomeno di replacement dovuto all’introduzione di una nuova vaccinazione.
Si presume, infatti, che la trasmissione sia associata solo al carriage nasofaringeo e che, una volta che un individuo progredisce verso la malattia, non la trasmetta. Di conseguenza, il modello distingue tra l’efficacia di un vaccino contro il carriage e l’efficacia contro lo sviluppo della malattia data l’acquisizione del carriage.
Il modello a trasmissione dinamica qui presentato permette di stimare che l’introduzione di PCV15 rappresenta una strategia dominante e quindi cost-saving per il SSN e la società. Negli scenari analizzati, l’introduzione di PCV15 si associa, su un orizzonte temporale di 50 anni, a un risparmio di circa 282,5 milioni di euro, nonostante il costo aggiuntivo derivante dall’introduzione di PCV15. Tale fenomeno è la risultante del numero di anni di vita guadagnati e della diminuzione di 62 milioni di euro sui costi delle MIP – di cui 38 milioni di euro sui costi delle batteriemie e 24 milioni sui costi delle meningiti – 2,6 milioni sui costi delle PMS, 209 milioni sui costi delle PNB e 9 milioni di euro sui costi della gestione delle OMA.
L’introduzione del nuovo PCV15 nel PNPV, d’accordo alla posologia corrente (2 + 1 dosi entro gli 11 mesi di vita) risulterebbe in un miglioramento significativo della qualità di vita della popolazione di ogni età con un guadagno di 15.811 QALY, 2.788 anni di vita scontati e 6.195 anni di vita a valori non scontati.
Questo modello, grazie alle sue assunzioni effettuate e agli scenari valutati, consente di apprezzare le importanti ricadute di una nuova strategia vaccinale rispetto alle raccomandazioni attuali, tenendo conto del potenziale impatto di PCV15 rispetto al PCV13 nel contesto epidemiologico e demografico italiano.
Grazie anche all’inclusione della strategia vaccinale sequenziale PCV15 + PPSV23 nell’adulto, il modello conferma l’importanza di disporre di nuovi vaccini ma allo stesso tempo di mantenere lo schema sequenziale per garantire una copertura sempre maggiore per le popolazioni a rischio e adulte nel contesto italiano.
La prossima generazione di vaccini pediatrici contro lo pneumococco dovrebbe continuare a mantenere i sierotipi altamente prevalenti e invasivi prima dell’introduzione dei vaccini coniugati della precedente generazione, estendendo al contempo la copertura ai sierotipi non contenuti in nessuno dei vaccini disponibili e che attualmente sono responsabili di malattia.
Stratificazione della popolazione in classi di rischio da Multiscopo 2019.
| Input demografici | Valore | Fonte |
|---|---|---|
| Bambini eleggibili a vaccinazione nell’anno base (2019) | 431.007 | Pop. 0 anni, ISTAT, Dataset: Popolazione residente al 1° gennaio |
| % Bambini a rischio (immunocompromessi) 0-14 anni | 1,90% | ISTAT Multiscopo 2019 |
| % Adulti con condizioni di rischio | ||
| 15-24 | 6,18% | ISTAT Multiscopo 2019, (% pesate per fascia d’età estesa) |
| 25-64 | 16,86% | ISTAT Multiscopo 2019, (% pesate per fascia d’età estesa) |
| 64+ | 58,60% | ISTAT Multiscopo 2019, (% pesate per fascia d’età estesa) |
| Tasso di fecondità (*100.000) | 3,5 (17 anni) - 91,5 (32 anni) | Tassi di fecondità a partire dai 17 anni, ISTAT |
| Tassi di mortalità | valori età specifici | ISTAT, Tavole di mortalità 2019 |
Matrice di contatto utilizzata nel modello: media del numero di contatti per diverse fasce di età per anno, adattato da Prem 2017.
| 0-2 | 2-5 | 5-15 | 15-65 | 65+ | |
|---|---|---|---|---|---|
| 0-2 | 534.8867 | 854.8603 | 554.5810 | 1889.4456 | 98.5123 |
| 2-5 | 534.8867 | 854.8603 | 554.5810 | 1889.4456 | 98.5123 |
| 5-15 | 91.3465 | 145.9904 | 2660.8609 | 1722.1355 | 82.2857 |
| 15-65 | 58.9221 | 94.1695 | 470.5333 | 4237.2653 | 106.6241 |
| 65+ | 27.8431 | 44.4991 | 245.1839 | 1302.1783 | 553.1419 |
Numero giorni sino a clearance del carriage nasofaringeo da letteratura per aggregazione di sierotipi.
| Fascia d'età | ||||||
|---|---|---|---|---|---|---|
| SG | < 1 | 1-4 | 5-14 | 15-65 | 65+ | |
| 4, 6B, 9V, 14, 18C, 19F, 23F | SG1 | 70.24127852 | 46.33247 | 24.81455 | 25.99959 | 26.82687 |
| 1, 5, 6A, 7F, 19A | SG2 | 54.17242757 | 43.88487 | 21.98629 | 16.3721 | 16.3721 |
| 3 | SG3 | 24.6 | 49.80647 | 22.95287 | 45.5 | 45.5 |
| 22F, 33F | SG4 | 87.5625 | 45.08496 | 59.65959 | 43.09969 | 43.09969 |
| 8, 10A, 11A, 12F, 15B | SG5 | 41.2366495 | 40.39964 | 26.48797 | 22.19854 | 25.85273 |
| 9N, 17F, 20 | SG6 | 34.73258232 | 35.42394 | 23.80358 | 16.58422 | 16.58422 |
| Altri | SG7 | 36.4831746 | 32.32393 | 31.79151 | 31.79151 | 31.79151 |
Numero giorni (anno) sino a clearance del carriage nasofaringeo da letteratura per aggregazione di sierotipi.
| Fascia d'età | ||||||
|---|---|---|---|---|---|---|
| Sierotipi in ciascun gruppo | SG | < 1 | 1-4 | 5-14 | 15-65 | 65+ |
| 4, 6B, 9V, 14, 18C, 19F, 23F | SG1 | 5.199933824 | 7.883241 | 14.71919 | 14.0483 | 13.61508 |
| 1, 5, 6A, 7F, 19A | SG2 | 6.742359838 | 8.322914 | 16.61263 | 22.3093 | 22.3093 |
| 3 | SG3 | 14.84756098 | 7.333385 | 15.91304 | 8.027473 | 8.027473 |
| 22F, 33F | SG4 | 4.17130621 | 8.101371 | 6.122234 | 8.47454 | 8.47454 |
| 8, 10A, 11A, 12F, 15B | SG5 | 8.857412142 | 9.040923 | 13.78928 | 16.45379 | 14.1281 |
| 9N, 17F, 20 | SG6 | 10.51606231 | 10.31082 | 15.34433 | 22.02395 | 22.02395 |
| Altri | SG7 | 10.0114643 | 11.29968 | 11.48892 | 11.48892 | 11.48892 |
Carriage Acquisition per contact (Beta).
| Sierogruppo | ||||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Fascia d'età | 1 | 0.013751858 | 0.014309343 | 0.021538738 | 0.011834197 | 0.017678164 | 0.026776901 | 0.01756162 |
| 2 | 0.000981401 | 0.001591962 | 0.002250783 | 0.000927062 | 0.00208901 | 0.00087131 | 0.002719342 | |
| 3 | 2.65293E-05 | 0.000129116 | 5.93836E-05 | 5.72711E-05 | 4.81948E-05 | 0.000118194 | 6.33196E-05 | |
| 4 | 8.29104E-05 | 0.000146681 | 0.000641833 | 0.000171825 | 0.000198696 | 0.000189858 | 0.000196055 | |
| 5 | 0.001300654 | 0.00046565 | 0.003428752 | 0.001414268 | 0.001446921 | 0.001217138 | 0.005821394 | |
Probability of disease upon carriage acquisition (Rho).
| Sierogruppo | ||||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Fascia d'età | 1 | 5.742E-05 | 0.000103955 | 2.52844E-05 | 2.73341E-05 | 7.08675E-05 | 1.01677E-05 | 9.553997312686399*^-6 |
| 2 | 2.1348E-05 | 5.06617E-05 | 1.76131E-05 | 2.10707E-05 | 6.48842E-05 | 8.42207742314559*^-6 | 1.3627E-05 | |
| 3 | 2.14272E-05 | 7.26301E-05 | 5.25093E-05 | 3.33253E-05 | 0.00012719 | 2.5029E-05 | 4.374576814393649*^-6 | |
| 4 | 5.11504E-05 | 0.000202812 | 7.4973E-05 | 6.84899E-05 | 0.000237561 | 5.04085E-05 | 7.357113800975357*^-6 | |
| 5 | 0.000682076 | 0.003101595 | 0.000702026 | 0.000911594 | 0.003563592 | 0.000660269 | 4.81083E-05 | |
Serotype competition (Theta).
| Sierogruppo | ||||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
| Sierogruppo | 1 | 0 | 0.439811297 | 0.190821883 | 0.211919635 | 0.119131783 | 0.393784789 | 0.315526774 |
| 2 | 1 | 0 | 0.540341504 | 0.448752974 | 0.205788626 | 0.403206133 | 0.66614812 | |
| 3 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | |
| 4 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | |
| 5 | 1 | 1 | 1 | 1 | 0 | 1 | 1 | |
| 6 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | |
| 7 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | |
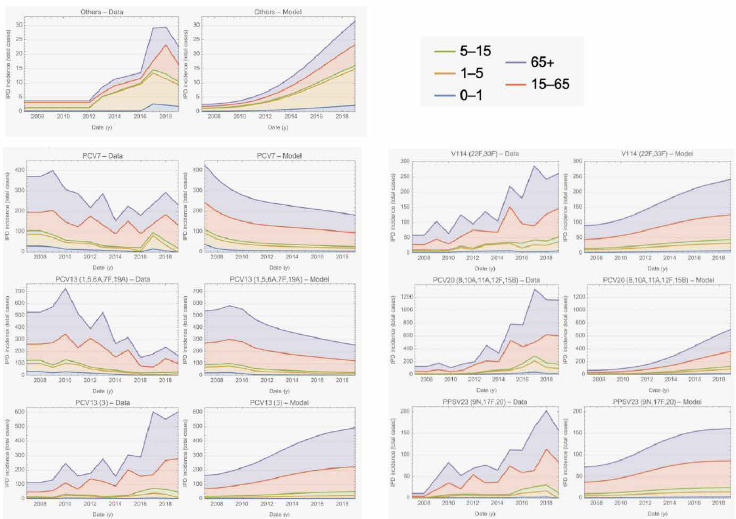
Calibrazione del modello epidemiologico effettuata sulle MIP, anni 2008-2018, per sierogruppo e fascia d’età (casi anno). Confronto dati provenienti dalla Sorveglianza e dati del modello.
Data fitting ai fini della calibrazione del modello, anni 2012-2019.
NB: il fitting dei dati è stato effettuato solo per le MIP, la condizione per la quale è stata fatta la calibrazione del modello. Per PNB e OMA, noto il trend temporale di incidenza, si comparerà questo con il modello.
a) Fitting dell’incidenza delle MIP per fasce d’età e sierogruppo, 2012-2019
b) Fitting dei dati di incidenza delle PNB INPATIENT per fasce d’età e sierogruppo, 2012-2019
c) Fitting dei dati di incidenza delle PNB OUTPATIENT per fasce d’età e sierogruppo, 2012-2019
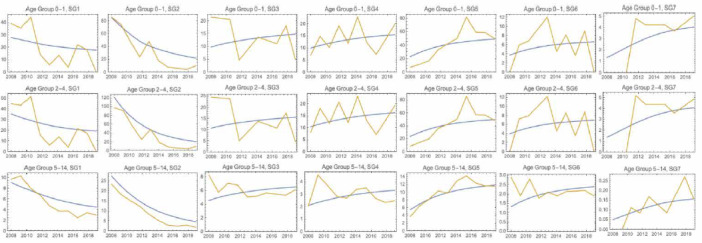
d) Fitting dei dati di incidenza delle OMA per fasce d’età (solo pediatriche) e sierogruppo, 2012-2019
Utilities al baseline da Szende et al. 2014.
| Fascia d’età | Baseline utility (mean) |
|---|---|
| 0-1 | 0.948 |
| 1-5 | 0.948 |
| 5-15 | 0.9486 |
| 15-65 | 0.9163 |
| 65+ | 0.773922 |
Disutilities applicate in base all’età e alla malattia pneumococcica (da Beutels et al. 2017).
| Evento | Sottopopolazione | Età | Valore disutilità | Durata |
|---|---|---|---|---|
| MIP (meningite o batteriemia) | Bambini + adulti a basso rischio | 0-65 a | 0,0203 | Valore medio applicato per 1 a |
| > 65 a | 0,1741 | |||
| Adulti a rischio | 18-65 a | 0,0310 | ||
| > 65 a | 0,0988 | |||
| Sequela-post meningiti PMS (any risk) | Qualsiasi | 0,477 | Sino a morte | |
| PNB ospedalizzate | Bambini + adulti a basso rischio | 0-65 a | 0,0491 | Valore medio applicato per 1 a |
| > 65 a | 0,0679 | |||
| Adulti a rischio | 18-65 a | 0,0708 | ||
| > 65 a | 0,0985 | |||
| PNB outpatient | Tutte | Tutte | 0,196 | 8,5 gg |
| OMA | Bambini | 0-14 a | 0 | N/A |
| a: anno; gg: giorni. | ||||
Proiezioni del Modello 2020-2070. Incidenza MIP per fascia d’età e sierogruppo (SG1-SG7), si noti come le assumptions di VE e di carriage si traducono in un impatto di PCV15 prevalentemente nei SG3 (sierotipo 3) e nel SG4 (sierotipi aggiuntivi di PCV15: 22F e 33F). Le scale denotano la diversa incidenza di ciascun sierogruppo e delle MIP per fasce d’età.
Linea arancio: incidenza della MIP predetta dal modello (calibrata) con PCV13; Linea verde: incidenza della MIP predetta dal modello (calibrata) con l’introduzione di PCV15 a partire dal 2020.
Risultati del modello a seconda dello scenario considerato. A 50 anni il modello restituisce i risultati epidemiologici ed economici mostrati nelle tabelle seguenti. I casi di malattia diminuiscono in maniera consistente e così i costi associati. Considerando tutte le fasce d’età, l’introduzione di PCV15 in età pediatrica e in età adulta preverrebbe 5.745 morti e si assocerebbe a 14.817 QALY guadagnati e a -282.547.545 € risparmiati a valori scontati, mostrandosi una strategia dominante.
1) Risultati epidemiologici del caso base a 50 anni (2070), tutte le età, prospettiva della società
| Risultati epidemiologici caso base | Δ vs Caso base | ||||
|---|---|---|---|---|---|
| PCV13 nei bambini | PCV15 vs PCV13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | PCV15 vs PCV13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | |
| MIP | 140.591 | 128.118 | 127.070 | -12.549 | -13.351 |
| Batteriemia | 98.413 | 89.682 | 88.949 | -8.784 | -9.346 |
| Meningiti | 42.177 | 38.435 | 38.121 | -3.765 | -4.005 |
| PMS | 41.755 | 38.051 | 37.740 | -3.727 | -3.965 |
| PNB | 8.770.953 | 8.275.355 | 8.232.048 | -457.778 | -490.937 |
| OMA | 333.586 | 306.798 | 306.799 | -24.283 | -24.282 |
| Decesso | 102.285 | 96.633 | 96.083 | -5.328 | -5.745 |
2) Risultati economici del caso base a 50 anni (2070), tutte le età, prospettiva della società
| Risultati caso base | Δ vs Caso base | ||||
|---|---|---|---|---|---|
| PCV13 nei bambini | PCV15 vs PCv13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | |
| Costo vaccino | 3.231.865.231 € | 3.231.867.771 € | 3.231.867.788 € | 2.540 € | 2.557 € |
| Costo MIP | 694.872.618 € | 640.611.235 € | 636.082.259 € | -54.261.384 € | -58.790.359 € |
| Costo batteriemie | 441.426.402 € | 408.411.208 € | 405.430.297 € | -33.015.195 € | -35.996.105 € |
| Costo meningiti | 253.446.216 € | 232.200.027 € | 230.651.961 € | -21.246.189 € | -22.794.254 € |
| Costo PMS | 27.754.718 € | 25.217.519 € | 25.041.010 € | -2.537.199 € | -2.713.707 € |
| Costo PNB | 4.464.473.612 € | 4.249.424.570 € | 4.230.046.289 € | -215.049.042 € | -234.427.323 € |
| Costo OMA | 69.599.185 € | 64.286.778 € | 64.286.874 € | -5.312.407 € | -5.312.311 € |
| LYs (discounted) | 1.548.755.540 | 1.548.758.084 | 1.548.758.328 | 2.544 | 2.788 |
| LYs (undiscounted) | 2.990.356.088 | 2.990.361.735 | 2.990.362.283 | 5.647 | 6.195 |
| Costo totale | 8.488.565.364 € | 8.211.407.872 € | 8.187.324.220 € | -277.157.492 € | -301.241.143 € |
| QALYs guadagnati | 1.375.560.594 | 1.375.575.302 | 1.375.576.405 | 14.708 | 15.811 |
3) Risultati epidemiologici ed economici a 50 anni (2070), per fascia d’età e per tutti gli scenari considerati, prospettiva della società
| Risultati caso base | Delta Caso base | Delta Scenario 1 (VE St 3) | Delta Scenario 2 (VCRs = 75% negli adulti) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| PCV13 nei bambini | PCV15 vs PCv13 nei bambini | PCV15 anche negli adulti (PCV15 +PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | Casi attesi scenario PCV13 VCR 75% | Casi attesi scenario PCV15 VCR 75% | PCV15 negli adulti (PCV15 + PPSV23) | |
| Fascia d'età 0-1 | ||||||||||
| MIP | 3.704 | 2.997 | 2.997 | -698 | -698 | -920 | -920 | 3.705 | 2.997 | -708 |
| Batteriemia | 2.593 | 2.098 | 2.098 | -489 | -489 | -644 | -644 | 2.593 | 2.098 | -495 |
| Meningiti | 1.111 | 899 | 899 | -209 | -209 | -276 | -276 | 1.111 | 899 | -212 |
| PMS | 1.100 | 890 | 890 | -207 | -207 | -273 | -273 | 1.100 | 890 | -210 |
| PNB | 47.846 | 42.666 | 42.667 | -4.859 | -4.858 | 1.740 | 1.741 | 47.846 | 42.667 | -5.179 |
| OMA | 43.686 | 40.241 | 40.241 | -3.087 | -3.087 | 5.912 | 5.913 | 43.686 | 40.241 | -3.445 |
| Decesso | 55 | 45 | 45 | -11 | -11 | -14 | -14 | 55 | 45 | -11 |
| Fascia d'età 1-4 | ||||||||||
| MIP | 13.051 | 10.828 | 10.828 | -2.202 | -2.202 | -3.152 | -3.152 | 13.051 | 10.829 | -2.222 |
| Batteriemia | 9.135 | 7.580 | 7.580 | -1.541 | -1.541 | -2.207 | -2.207 | 9.136 | 7.580 | -1.556 |
| Meningiti | 3.915 | 3.248 | 3.248 | -660 | -660 | -946 | -946 | 3.915 | 3.249 | -667 |
| PMS | 3.876 | 3.216 | 3.216 | -654 | -654 | -936 | -936 | 3.876 | 3.216 | -660 |
| PNB | 341.114 | 300.376 | 300.378 | -38.375 | -38.373 | 4.390 | 4.397 | 341.119 | 300.383 | -40.736 |
| OMA | 178.644 | 163.668 | 163.668 | -13.622 | -13.621 | 17.385 | 17.389 | 178.644 | 163.669 | -14.975 |
| Decesso | 359 | 298 | 298 | -61 | -61 | -85 | -85 | 359 | 298 | -61 |
| Fascia d'età 5-14 | ||||||||||
| MIP | 8.404 | 6.906 | 6.906 | -1.446 | -1.447 | -2.140 | -2.140 | 8.404 | 6.906 | -1.498 |
| Batteriemia | 5.883 | 4.834 | 4.834 | -1.013 | -1.013 | -1.498 | -1.498 | 5.883 | 4.834 | -1.049 |
| Meningiti | 2.521 | 2.072 | 2.072 | -434 | -434 | -642 | -642 | 2.521 | 2.072 | -449 |
| PMS | 2.496 | 2.051 | 2.051 | -430 | -430 | -635 | -635 | 2.496 | 2.051 | -445 |
| PNB | 287.016 | 255.269 | 255.268 | -28.819 | -28.819 | -9.915 | -9.913 | 287.013 | 255.264 | -31.749 |
| OMA | 111.256 | 102.890 | 102.890 | -7.573 | -7.574 | -1.894 | -1.894 | 111.250 | 102.884 | -8.366 |
| Decesso | 115 | 95 | 95 | -21 | -21 | -29 | -29 | 115 | 95 | -21 |
| Fascia d'età 15-64 | ||||||||||
| MIP | 48.526 | 45.076 | 44.517 | -3.539 | -3.980 | -6.787 | -7.263 | 48.525 | 44.515 | -4.010 |
| Batteriemia | 33.968 | 31.553 | 31.162 | -2.477 | -2.786 | -4.751 | -5.084 | 33.967 | 31.161 | -2.807 |
| Meningiti | 14.558 | 13.523 | 13.355 | -1.062 | -1.194 | -2.036 | -2.179 | 14.558 | 13.355 | -1.203 |
| PMS | 14.412 | 13.387 | 13.222 | -1.051 | -1.182 | -2.016 | -2.157 | 14.412 | 13.221 | -1.191 |
| PNB | 1.353.045 | 1.291.978 | 1.282.395 | -53.771 | -61.355 | 107.021 | 98.868 | 1.352.974 | 1.282.318 | -70.656 |
| OMA | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Decesso | 4.281 | 4.008 | 3.964 | -274 | -308 | -348 | -396 | 4.281 | 3.963 | -318 |
| Fascia d'età 65+ | ||||||||||
| MIP | 66.905 | 62.311 | 61.822 | -4.664 | -5.025 | -9.202 | -9.588 | 45.655 | 41.841 | -3.813 |
| Batteriemia | 46.834 | 43.618 | 43.275 | -3.265 | -3.517 | -6.442 | -6.712 | 31.958 | 29.289 | -2.669 |
| Meningiti | 20.072 | 18.693 | 18.547 | -1.399 | -1.507 | -2.761 | -2.876 | 13.696 | 12.552 | -1.144 |
| PMS | 19.871 | 18.506 | 18.361 | -1.385 | -1.492 | -2.733 | -2.848 | 13.559 | 12.427 | -1.133 |
| PNB | 6.741.932 | 6.385.066 | 6.351.341 | -331.954 | -357.532 | 132.218 | 104.827 | 5.811.195 | 5.440.245 | -370.950 |
| OMA | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Decesso | 97.474 | 92.188 | 91.682 | -5.286 | -5.347 | -642 | -1.191 | 82.574 | 77.195 | -5.379 |
| Tutte le età | ||||||||||
| MIP | 140.591 | 128.118 | 127.070 | -12.549 | -13.351 | -22.202 | -23.064 | 119.339 | 107.088 | -12.251 |
| Batteriemia | 98.413 | 89.682 | 88.949 | -8.784 | -9.346 | -15.541 | -16.145 | 83.537 | 74.962 | -8.576 |
| Meningiti | 42.177 | 38.435 | 38.121 | -3.765 | -4.005 | -6.660 | -6.919 | 35.802 | 32.126 | -3.675 |
| PMS | 41.755 | 38.051 | 37.740 | -3.727 | -3.965 | -6.594 | -6.850 | 35.444 | 31.805 | -3.639 |
| PNB | 8.770.953 | 8.275.355 | 8.232.048 | -457.778 | -490.937 | 235.454 | 199.920 | 7.840.147 | 7.320.877 | -519.270 |
| OMA | 333.586 | 306.798 | 306.799 | -24.283 | -24.282 | 21.402 | 21.408 | 333.580 | 306.794 | -26.786 |
| Decesso | 102.285 | 96.633 | 96.083 | -5.328 | -5.745 | -1.118 | -269 | 87.384 | 81.595 | -5.789 |
4) Impatto scenario 1: carriage acquisition % distinte per PCV13 e PCV15
| VE Against Carriage Acquisition | ||
|---|---|---|
| PCV13 | PCV15 | |
| PCV7 | 7,16% | 7,01% |
| PCV13 (1, 5, 7A, 6F, 19A) | 5,72% | 5,20% |
| PCV13 (ST3) | 1,39% | 2,56% |
| 22F, 33F | 0% | 6,1% |
D’accordo a Ryman et al. 2022, applicando le GMT ratio ai valori iniziali di VE verso l’acquisizione del carriage, la VE di PCV7 passa a 7%, quella di PCV13 verso sierotipi non ST3 anch’essa diminuisce, mentre la protezione verso il ST3 aumenta passando da 1,39 a 2,56% per PCV15. Nuovamente, la VE di PCV15 verso i due sierotipi aggiuntivi è il risultato della media dei valori di PCV7 e PCV13.
Rispetto al caso base, lo scenario 1 ipotizza una distinta protezione di PCV15 rispetto a PCV13 verso il carriage.
Applicando questi valori di carriage acquisition, il modello proietta meno casi di malattia invasiva in età pediatrica rispetto al caso base, in quanto la maggiore VE nella prevenzione delle MIP da sierotipo 3 compensa l’aumento relativo dei casi attesi associati ai sierogruppi 1 e 2.
In questo scenario, tuttavia, il maggior beneficio della protezione indiretta della vaccinazione pediatrica non riesce a contrastare l’aumento dei casi di PNB associati ai sierogruppi vaccinali 1 e 2 che hanno una prevalenza distinta nell’adulto. L’aumento della mortalità è dovuto ai casi di PNB con esito fatale in età 65+.
5) Impatto scenario 2: vaccinazione dell’adulto a coperture target (75%) in tutte le categorie di rischio
Il modello ha correttamente incorporato nella calibrazione l’aumento delle coperture vaccinali in età pediatrica a cui si è assistito fra il 2013 e il 2020 e, nel corso della proiezione, prevede che le coperture in età pediatrica continuino ad aumentare. Poiché il modello nel caso base prevede un elevato burden di malattia nella popolazione adulta (15+) per via dell’aumento dell’incidenza delle patologie pneumococciche e dell’elevata proporzione di persone adulte e anziane nella popolazione italiana, un secondo scenario ha inteso valutare l’impatto dell’aumento della protezione diretta dell’adulto ipotizzando coperture al 75%.
Come si osserva dai risultati epidemiologici, l’aumento delle coperture impatta la popolazione anziana e non quella pediatrica e prevede meno casi di PNB.
I risultati economici per fascia d’età e scanerio considerato confermano che l’introduzione di PCV15 è una strategia dominante in ciascuna fascia d’età nel caso base in quanto si associa a minori costi per la gestione delle patologie pneumococciche non prevenute e a migliori esiti sanitari misurati in QALY e anni di vita guadagnati.
6) Risultati economici a 50 anni (2070), per fascia d’età e per tutti gli scenari considerati, prospettiva della società
| Risultati caso base | Delta Caso base | ICERs | Delta Scenario 1 (scaled VE vs St 3) | ICERs | Delta Scenario 2 (VCRs = 75% negli adulti) | ICERs | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PCV15 vs PCv13 nei bambini | PCV15 anche negli adulti (PCV15 + PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | PCV15 vs PCv13 nei bambini | PCV15 negli adulti (PCV15 + PPSV23) | |||||
| Fascia d'età 0-1 | ||||||||||||
| Costo vaccino | 2.733.622.990 € | 2.733.622.990 € | 2.733.622.990 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | |||
| Costo MIP | 16.470.553 € | 13.407.577 € | 13.407.517 € | -3.062.977 € | -3.063.036 € | -3.815.469 € | -3.815.614 € | -3.062.845 € | -3.062.932 € | |||
| Costo batteriemie | 8.495.178 € | 6.915.357 € | 6.915.326 € | -1.579.821 € | -1.579.852 € | -1.967.941 € | -1.968.016 € | -1.579.754 € | -1.579.798 € | |||
| Costo meningiti | 7.975.375 € | 6.492.220 € | 6.492.191 € | -1.483.155 € | -1.483.184 € | -1.847.527 € | -1.847.598 € | -1.483.091 € | -1.483.133 € | |||
| Costo PMS | 1.136.308 € | 924.992 € | 924.988 € | -211.316 € | -211.320 € | -263.230 € | -263.240 € | -211.307 € | -211.313 € | |||
| Costo PNB | 18.615.002 € | 16.659.096 € | 16.659.229 € | -1.955.906 € | -1.955.773 € | -44.419 € | -44.031 € | -1.955.920 € | -1.955.733 € | |||
| Costo OMA | 9.118.018 € | 8.424.383 € | 8.424.432 € | -693.635 € | -693.586 € | 703.119 € | 703.351 € | -693.608 € | -693.537 € | |||
| LYs (discounted) | 18.893.597 | 18.893.602 | 18.893.602 | 5.252 | 5.252 | 7 | 7 | 5 | 5 | |||
| LYs (undiscounted) | 36.480.236 | 36.480.246 | 36.480.246 | 10.532 | 10.532 | 13 | 13 | 10 | 10 | |||
| Costo totale | 2.778.962.871 € | 2.773.039.038 € | 2.773.039.157 € | -5.923.833 € | -5.923.714 € | PCV15 dominante | -3.419.999 € | -3.419.534 € | PCV15 dominante | -5.923.679 € | -5.923.513 € | |
| QALYs guadagnati | 17.906.696 | 17.907.486 | 17.907.486 | 790 | 790 | 921 | 921 | 790 | 790 | PCV15 dominante | ||
| Fascia d'età 1-4 | ||||||||||||
| Costo vaccino | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | |||
| Costo MIP | 58.010.373 € | 48.442.030 € | 48.441.760 € | -9.568.342 € | -9.568.613 € | -12.768.160 € | -12.768.812 € | -9.568.152 € | -9.568.541 € | |||
| Costo batteriemie | 29.920.578 € | 24.985.420 € | 24.985.280 € | -4.935.158 € | -4.935.297 € | -6.585.559 € | -6.585.896 € | -4.935.059 € | -4.935.259 € | |||
| Costo meningiti | 28.089.795 € | 23.456.610 € | 23.456.479 € | -4.633.185 € | -4.633.316 € | -6.182.601 € | -6.182.917 € | -4.633.093 € | -4.633.281 € | |||
| Costo PMS | 4.047.385 € | 3.379.802 € | 3.379.783 € | -667.583 € | -667.602 € | -890.835 € | -890.880 € | -667.570 € | -667.597 € | |||
| Costo PNB | 132.956.376 € | 117.627.941 € | 117.628.632 € | -15.328.435 € | -15.327.744 € | -2.952.420 € | -2.950.130 € | -15.328.690 € | -15.327.717 € | |||
| Costo OMA | 37.281.283 € | 34.269.863 € | 34.270.002 € | -3.011.420 € | -3.011.280 € | 1.778.812 € | 1.779.567 € | -3.011.362 € | -3.011.159 € | |||
| LYs (discounted) | 75.445.865 | 75.445.895 | 75.445.895 | 30.365 | 30.366 | 40 | 40 | 30 | 30 | |||
| LYs (undiscounted) | 145.672.762 | 145.672.823 | 145.672.823 | 61.197 | 61.200 | 86 | 86 | 61 | 61 | |||
| Costo totale | 232.295.416 € | 203.719.636 € | 203.720.177 € | -28.575.780 € | -28.575.239 € | -14.832.601 € | -14.830.255 € | -28.575.775 € | -28.575.015 € | |||
| QALYs guadagnati | 71.505.455 | 71.508.151 | 71.508.151 | 2.697 | 2.697 | PCV15 dominante | 3.138 | 3.138 | PCV15 dominante | 2.697 | 2.697 | PCV15 dominante |
| Fascia d'età 5-14 | ||||||||||||
| Costo vaccino | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | |||
| Costo MIP | 37.453.752 € | 31.128.303 € | 31.128.020 € | -6.325.449 € | -6.325.731 € | -8.688.617 € | -8.689.167 € | -6.324.767 € | -6.325.170 € | |||
| Costo batteriemie | 19.317.888 € | 16.055.349 € | 16.055.204 € | -3.262.539 € | -3.262.684 € | -4.481.413 € | -4.481.696 € | -3.262.187 € | -3.262.394 € | |||
| Costo meningiti | 18.135.864 € | 15.072.953 € | 15.072.817 € | -3.062.910 € | -3.063.047 € | -4.207.204 € | -4.207.471 € | -3.062.580 € | -3.062.775 € | |||
| Costo PMS | 2.585.206 € | 2.148.598 € | 2.148.579 € | -436.608 € | -436.627 € | -599.723 € | -599.761 € | -436.561 € | -436.589 € | |||
| Costo PNB | 113.601.810 € | 102.127.713 € | 102.127.561 € | -11.474.097 € | -11.474.249 € | -6.895.542 € | -6.895.064 € | -11.474.397 € | -11.474.609 € | |||
| Costo OMA | 23.199.884 € | 21.592.532 € | 21.592.439 € | -1.607.353 € | -1.607.445 € | -952.623 € | -952.601 € | -1.607.369 € | -1.607.494 € | |||
| LYs (discounted) | 188.412.617 | 188.412.627 | 188.412.627 | 10.566 | 10.581 | 13 | 15 | 10 | 10 | |||
| LYs (undiscounted) | 363.791.659 | 363.791.679 | 363.791.679 | 20.594 | 20.595 | 29 | 29 | 20 | 20 | |||
| Costo totale | 176.840.652 € | 156.997.146 € | 156.996.599 € | -19.843.506 € | -19.844.053 € | -17.136.504 € | -17.136.593 € | -19.843.093 € | -19.843.860 € | |||
| QALYs guadagnati | 178.603.762 | 178.605.494 | 178.605.494 | 1.732 | 1.732 | PCV15 dominante | 2.147 | 2.147 | PCV15 dominante | 1.732 | 1.732 | PCV15 dominante |
| Fascia d'età 15-64 | ||||||||||||
| Costo vaccino | 243.675.053 € | 243.675.484 € | 243.675.497 € | 430 € | 443 € | 737 € | 751 € | 431 € | 444 € | |||
| Costo MIP | 246.230.674 € | 230.989.183 € | 228.458.120 € | -15.241.491 € | -17.772.554 € | -27.731.991 € | -30.527.107 € | -15.242.132 € | -17.775.932 € | |||
| Costo batteriemie | 162.070.299 € | 152.038.274 € | 150.372.314 € | -10.032.025 € | -11.697.985 € | -18.253.339 € | -20.093.098 € | -10.032.448 € | -11.700.211 € | |||
| Costo meningiti | 84.160.375 € | 78.950.910 € | 78.085.806 € | -5.209.466 € | -6.074.569 € | -9.478.652 € | -10.434.008 € | -5.209.684 € | -6.075.721 € | |||
| Costo PMS | 13.321.380 € | 12.496.797 € | 12.359.863 € | -824.583 € | -961.517 € | -1.500.334 € | -1.651.554 € | -824.618 € | -961.700 € | |||
| Costo PNB | 706.177.908 € | 679.085.872 € | 674.589.331 € | -27.092.036 € | -31.588.577 € | 31.765.484 € | 26.809.410 € | -27.090.386 € | -31.592.613 € | |||
| Costo OMA | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | |||
| LYs (discounted) | 902.619.264 | 902.619.389 | 902.619.410 | 125 | 146 | 155 | 178 | 125 | 146 | |||
| LYs (undiscounted) | 1.742.792.424 | 1.742.792.695 | 1.742.792.738 | 271 | 314 | 347 | 395 | 271 | 314 | |||
| Costo totale | 1.209.405.016 € | 1.166.247.336 € | 1.159.082.811 € | -43.157.679 € | -50.322.204 € | 2.533.895 € | -5.368.500 € | -43.156.705 € | -50.329.801 € | |||
| QALYs guadagnati | 826.748.865 | 826.751.757 | 826.752.238 | 2.892 | 3.373 | PCV15 dominante | 3.540 | 4.070 | PCV15 costo-efficace a 716 | 2.892 | 3.373 | PCV15 dominante |
| Fascia d'età 65+ | ||||||||||||
| Costo vaccino | 254.567.187 € | 254.569.297 € | 254.569.301 € | 2.110 € | 2.114 € | 3.904 € | 3.909 € | 368 € | 369 € | |||
| Costo MIP | 336.707.266 € | 316.644.141 € | 314.646.841 € | -20.063.124 € | -22.060.425 € | -37.790.398 € | -39.985.829 € | -14.028.289 € | -16.098.757 € | |||
| Costo batteriemie | 221.622.459 € | 208.416.807 € | 207.102.173 € | -13.205.652 € | -14.520.286 € | -24.873.835 € | -26.318.879 € | -9.233.494 € | -10.596.286 € | |||
| Costo meningiti | 115.084.807 € | 108.227.334 € | 107.544.668 € | -6.857.473 € | -7.540.139 € | -12.916.564 € | -13.666.950 € | -4.794.796 € | -5.502.471 € | |||
| Costo PMS | 6.664.439 € | 6.267.330 € | 6.227.798 € | -397.109 € | -436.641 € | -747.985 € | -791.439 € | -277.661 € | -318.642 € | |||
| Costo PNB | 3.493.122.516 € | 3.333.923.947 € | 3.319.041.536 € | -159.198.569 € | -174.080.980 € | 6.674.754 € | -9.679.973 € | -145.403.776 € | -166.177.634 € | |||
| Costo OMA | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | 0 € | |||
| LYs (discounted) | 363.384.198 | 363.386.570 | 363.386.794 | 2.372 | 2.596 | 378 | 622 | 2116 | 2418 | |||
| LYs (undiscounted) | 701.619.008 | 701.624.291 | 701.624.796 | 5.284 | 5.789 | 636 | 1.186 | 4731 | 5373 | |||
| Costo totale | 4.091.061.408 € | 3.911.404.716 € | 3.894.485.476 € | -179.656.692 € | -196.575.933 € | -31.859.725 € | -50.453.332 € | -159.709.359 € | -182.594.665 € | |||
| QALYs guadagnati | 280.795.816 | 280.802.413 | 280.803.036 | 6.597 | 7.220 | PCV15 dominante | 1.703 | 2.388 | PCV15 dominante | 5.805 | 6.638 | PCV15 dominante |
| Tutte le età | ||||||||||||
| Costo vaccino | 3.231.865.231 € | 3.231.867.771 € | 3.231.867.788 € | 2.540 € | 2.557 € | 4.640 € | 4.659 € | 799 € | 813 € | |||
| Costo MIP | 694.872.618 € | 640.611.235 € | 636.082.259 € | -54.261.384 € | -58.790.359 € | -90.794.635 € | -95.786.529 € | -48.226.185 € | -52.831.330 € | |||
| Costo batteriemie | 441.426.402 € | 408.411.208 € | 405.430.297 € | -33.015.195 € | -35.996.105 € | -56.162.087 € | -59.447.586 € | -29.042.942 € | -32.073.948 € | |||
| Costo meningiti | 253.446.216 € | 232.200.027 € | 230.651.961 € | -21.246.189 € | -22.794.254 € | -34.632.548 € | -36.338.944 € | -19.183.244 € | -20.757.382 € | |||
| Costo PMS | 27.754.718 € | 25.217.519 € | 25.041.010 € | -2.537.199 € | -2.713.707 € | -4.002.107 € | -4.196.874 € | -2.417.717 € | -2.595.840 € | |||
| Costo PNB | 4.464.473.612 € | 4.249.424.570 € | 4.230.046.289 € | -215.049.042 € | -234.427.323 € | 28.547.856 € | 7.240.212 € | -201.253.168 € | -226.528.306 € | |||
| Costo OMA | 69.599.185 € | 64.286.778 € | 64.286.874 € | -5.312.407 € | -5.312.311 € | 1.529.309 € | 1.530.317 € | -5.312.339 € | -5.312.190 € | |||
| LYs (discounted) | 1.548.755.540 | 1.548.758.084 | 1.548.758.328 | 2.544 | 2.788 | 594 | 863 | 2287 | 2610 | |||
| LYs (undiscounted) | 2.990.356.088 | 2.990.361.735 | 2.990.362.283 | 5.647 | 6.195 | 1112 | 1.710 | 5095 | 5780 | |||
| Costo totale | 8.488.565.364 € | 8.211.407.872 € | 8.187.324.220 € | -277.157.492 € | -301.241.143 € | -64.714.936 € | -91.208.216 € | -257.208.611 € | -287.266.854 € | |||
| QALYs guadagnati | 1.375.560.594 | 1.375.575.302 | 1.375.576.405 | 14.708 | 15.811 | PCV15 dominante | 11.449 | 12.664 | PCV15 dominante | 13.916 | 15.230 | PCV15 dominante |
I vaccini antipneumococcici rappresentano attualmente la migliore forma di prevenzione nei confronti delle infezioni da Streptococcus pneumoniae.
S. pneumoniae è un agente patogeno responsabile sia di malattie non invasive (polmonite, otite media, rinosinusite) sia di malattie invasive pneumococciche (MIP) (meningite, sepsi, polmonite batterica) che possono avere importanti ricadute in ambito sanitario, sociale ed economico. Inoltre, la prevenzione primaria delle MIP riveste oggi particolare importanza alla luce dell’incremento di inappropriatezza nell’uso di antibiotici che, nella seconda metà del XX secolo, ha contribuito all’aumento, anno dopo anno, di fenomeni di antibiotico resistenza [1].
In cento anni di ricerca su vaccini antipneumococcici si sono avvicendati diversi tipi di formulati: prima i vaccini a cellule intere, poi i vaccini polisaccaridici, infine i vaccini polisaccaridici coniugati.
Il primo vaccino registrato è stato lo ‘Pneumo-Bacterin’ autorizzato negli USA nel 1909, prodotto sotto forma di iniezioni e compresse che combinavano pneumococchi e altri batteri inattivati [2].
Nel 1911, il batteriologo britannico Wright, al fine di controllare le frequenti epidemie di polmonite, condusse degli studi che dimostrarono che l’inoculazione di due dosi di vaccino inattivato riduceva l’incidenza di malattia del 25-50% e il rischio di morte del 40-50% [3].
Quando, nel 1918-19 a causa della pandemia da influenza spagnola aumentarono i casi di polmonite e di quadri respiratori severi quali complicanza dell’infezione da virus influenzale, team di ricercatori crearono diversi vaccini (etichettati “erroneamente” come vaccini antinfluenzali) a base di batteri a cellule intere inattivati a caldo che spesso includevano componenti di S. pneumonia [2].
Nel 1916-17 Dochez e Avery isolarono i nostri moderni polisaccaridi capsulari che chiamarono “sostanze specifiche solubili di pneumococco o SSS”. Successivamente, tra il 1923 e il 1929, Avery e Heidelberger, a New York, condussero una serie di studi che stabilirono che gli antigeni capsulari erano responsabili della diversità sierotipica dello pneumococco. Nel 1931 Dubos e Avery confermarono l’importante ruolo delle capsule pneumococciche come fattore di virulenza [4, 5].
Nel 1941 Felton comparò direttamente i vaccini antipneumococcici a cellula intera sierotipo-specifico con i vaccini polisaccaridici. Non furono trovate differenze significative sui titoli anticorpali indotti [6]. Dal 1942 al 1945, Colin MacLeod, ricercatore della New York University Medical School approfittò dei precedenti sviluppi nella tecnologia vaccinale basata sui polisaccaridi capsulari per sviluppare e testare un vaccino antipneumococcico polisaccaridico multivalente. In questo primo studio randomizzato con l’uso di vaccino versus placebo furono dimostrati sicurezza, efficacia e assenza di importanti effetti collaterali del vaccino testato [7].
Nel 1946, tuttavia, la messa in commercio della penicillina oscurò la ricerca sulla vaccinazione antipneumococcica e la comunità scientifica internazionale vide in questo proto-antibiotico una sorta di panacea per la polmonite, vista la sua facilità di somministrazione, l’alta efficacia e la rara incidenza di effetti avversi [8].
Sporadiche ricerche e sviluppi sui vaccini polisaccaridici antipneumococcici (PPV) furono condotti fino al 1968 quando la Eli Lilly & Co.® recuperò interesse verso i vaccini antipneumococcici per rispondere all’alto tasso di mortalità (17%) rilevato per infezioni da S. pneumoniae nonostante le cure antibiotiche [9, 10].
Nel 1970 Merck Sharp & Dohme (MSD®) iniziò nuovi programmi di ricerca sulla vaccinazione antipneumococcica che dimostrarono una riduzione del 76% del rischio di polmonite da pneumococco nel caso del vaccino esavalente e del 92% nel caso del vaccino 12-valente, con buoni profili di sicurezza [9].
Questi risultati offrirono una migliore compliance ai vaccini antipneumococchi rispetto al passato e portarono la MSD a richiedere e a ottenere nel 1977 la licenza, da parte dell’FDA, alla produzione di un vaccino polisaccaridico 14-valente [8].
Nel 1978 la US Advisory Committee on Immunization Practices (ACIP) raccomandò il vaccino per la popolazione di età superiore ai 2 anni con specifici fattori di rischio o come misura di controllo contro outbreak epidemici [11, 12].
Nel 1983 fu introdotto un vaccino polisaccaridico 23 valente (PPV23), il vaccino non coniugato attualmente in uso che copriva la maggior parte dei sierotipi responsabili di malattie da pneumococco. Tale vaccino si è dimostrato efficace nel ridurre le infezioni complicate nell’adulto immunocompetente, ma presentava delle criticità ascrivibili a limiti intrinseci dei vaccini polisaccaridici non coniugati soprattutto in termini di memoria immunologica [13].
Studi successivi hanno infatti dimostrato che i polisaccaridi capsulari contenuti in PPV23 stimolano, attraverso un meccanismo T-indipendente, la differenziazione di popolazioni di plasmacellule a breve emivita responsabili della produzione di anticorpi diretti contro gli antigeni capsulari. Tuttavia, trattandosi di un processo immunologico T-indipendente, tale risposta non riesce a sviluppare né un’appropriato coinvolgimento immunitario cellulo-mediato né una duratura memoria immunologica [12].
In particolare, la scarsa capacità di risposta T-mediata dei bambini d’età inferiore ai due anni agli antigeni polisaccaridici ha importanti implicazioni perché rende i vaccini polisaccaridici non indicati per tale fascia di età [12].
La risposta immunitaria T-indipendente limita, inoltre, anche l’utilità della somministrazione di dosi booster ravvicinate che possono indurre fenomeni di iporesponsività agli antigeni capsulari, con titoli anticorpali in alcuni casi inferiori a quelli ottenuti con la vaccinazione primaria [12]. Per migliorare la risposta immunitaria antipneumococcica, è stata successivamente sviluppata e testata una terza generazione di vaccini in cui i polisaccaridi capsulari sono stati coniugati a una o più proteine carrier altamente immunogene che, tramite l’induzione di una risposta T-dipendente e la produzione di cellule B della memoria, inducono lo sviluppo di una robusta memoria immunologica [1].
Nel 2001, il primo vaccino coniugato contro lo pneumococco disponibile sul mercato fu il PCV7, attivo contro 7 sierotipi di pneumococco coniugati con un mutante non tossico della tossina difterica (CRM197). L’inclusione, nelle linee guida di immunizzazione di neonati e infanti, soprattutto nei paesi a medio e alto reddito, portò tra i nuovi nati a una significativa riduzione delle infezioni pneumococciche correlate [1]. Il PCV7 è stato autorizzato in Italia l’11 ottobre 2001 [1].
Successivamente, dal 2009, sono stati autorizzati al commercio il vaccino 10-valente e il vaccino 13-valente. Il PCV13valente che include anche i sierotipi 3, 6A e 19A, oltre quelli contenuti nel PVC10 risulta indicato per l’immunizzazione attiva per la prevenzione di patologia invasiva, polmonite e otite media acuta, causate da S. pneumoniae in neonati, bambini e adolescenti di età compresa tra 6 settimane e 17 anni e immunizzazione attiva per la prevenzione di patologia invasiva e di polmonite, causata da S. pneumoniae, in adulti di età ≥ 18 anni e anziani [1].
In Italia, il PVC10 e il PVC13 sono quelli attualmente inseriti nel Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 e offerti gratuitamente a tutti i neonati nel primo anno di vita [14].
MSD® ha sviluppato di recente un PVC 15-valente che nel dicembre 2021 ha ricevuto l’approvazione dalla Commissione Europea e l’8 marzo 2022 (G.U. n. 56), su Determina AIFA, l’indicazione per l’immunizzazione attiva nella prevenzione della malattia invasiva pneumococcica e dell’infezione polmonare da S. pneumoniae nei soggetti di età pari o superiore a 18 anni.
L’ACIP, tra febbraio-giugno 2022, dopo aver esaminato l’epidemiologia della malattia da pneumococco e gli studi randomizzati effettuati, ha rilevato un’immunogenicità e sicurezza sovrapponibile tra PCV15 e PCV13 e, di conseguenza, raccomanda un utilizzo di entrambi i vaccini in modo intercambiabile per tutti i bambini di età compresa tra 2 e 59 mesi. Inoltre, si raccomanda l’uso del PCV15 per i bambini di età compresa tra 60 e 71 mesi con condizioni di rischio e per le persone di età compresa tra 6 e 18 anni immunocompromesse, con perdita di liquido cerebrospinale o impianto cocleare [15]. A febbraio 2022 l’agenzia europea per il farmaco (EMA), seguita dall’AIFA a maggio dello stesso anno, ha autorizzato l’immissione in commercio del primo vaccino pneumococcico coniugato 20-valente, sviluppato da Pfizer® per l’immunizzazione attiva per la prevenzione della malattia invasiva e della polmonite causate dallo S. pneumoniae nei soggetti di età pari o superiore ai 18 anni.
Infine, il 21 ottobre 2022 la Commissione Europea ha approvato l’estensione dell’indicazione del PCV15 nella prevenzione della malattia invasiva e dell’infezione polmonare causate da Streptococcus pneumoniae nei soggetti di età compresa tra 6 settimane e meno di 18 anni.
In atto non esistono, da parte dell’AIFA, precise indicazioni che orientino la scelta di un determinato PCV tra quelli disponibili. L’AIFA si limita, quindi, a “seguire le raccomandazioni ufficiali, tenendo in considerazione l’impatto sulle patologie pneumococciche in differenti gruppi d’età, così come la variabilità dell’epidemiologia nelle diverse aree geografiche”. Tuttavia, bisogna notare che il Calendario Vaccinale per la Vita 4a Edizione (2019) [16] evidenzia l’importanza di avvalersi dell’innovazione vaccinale in ambito pediatrico prestando particolare attenzione a garantire, nella scelta di nuovi vaccini, una immonogenicità comparabile con i precedenti vaccini al fine di evitare la ri-emergenza di sierotipi già controllati dalla vaccinazione. Appare altresì fondamentale che nuovi vaccini antipenumococcici assicurino ampia protezione già dopo la seconda dose, in modo da essere già efficaci contro le MIP in un’età a maggiore incidenza, e determinino miglior immunogenicità verso sierotipi associati epidemiologicamente a malattia invasiva severa (come ad esempio il sierotipo 3).
Il Ministero della Salute, nella nota protocollo n. 0019468 del 23 giugno 2017 indirizzata al Coordinamento Interregionale dell’Area Prevenzione e Sanità Pubblica, parlando di PCV10 e PCV13 afferma che “entrambi i vaccini sono compatibili con il calendario attualmente in uso in Italia” e che “come documentato dalla copiosa letteratura disponibile sull’argomento, entrambi i vaccini si sono dimostrati sicuri ed efficaci nei confronti dei sierotipi riportati nelle specifiche schede tecniche”.
Sebbene nel PNPV 2017-2019 vi sia un implicito suggerimento a garantire la più ampia protezione possibile, poiché l’organizzazione dell’offerta vaccinale è di competenza regionale, la scelta di un determinato vaccino è delegata alle Regioni e alle Province Autonome in base ai sierotipi circolanti a livello locale, oltre che al costo [14].
Il calendario vaccinale attualmente in vigore (Fig. 1) si poneva l’obiettivo iniziale di raggiungere coperture per la vaccinazione antipneumococcica ≥ 95% nei nuovi nati oltre che un progressivo incremento della medesima copertura vaccinale nei sessantacinquenni secondo lo schema: 40% nel 2017; 55% nel 2018; 75% nel 2019.
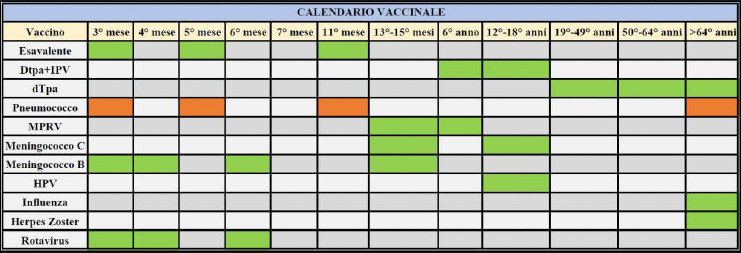
Calendario vaccinale PNPV 2017-2019 (da [14], mod.).
Secondo quanto disposto dalla Legge 119/2017 [17], la vaccinazione antipneumococcica è inclusa tra quelle non obbligatorie ma a offerta attiva e gratuita da parte di Regioni e Province autonome.
Inoltre, la vaccinazione antipneumococcica è consigliata, a prescindere dall’età, a tutti coloro che presentino determinate patologie o condizioni predisponenti (Tab. I) in quanto queste aumentano il rischio di infezione pneumococcica severa e delle sue complicanze [18].
Patologie e condizioni predisponenti a contrarre forme severe di MIP.
| Patologie e condizioni predisponenti a contrarre forme severe di MIP | |
|---|---|
| Cardiopatie croniche | Immunodeficienze congenite o acquisite |
| Malattie polmonari croniche | Infezione da HIV |
| Patologie richiedenti un trattamento immunosoppressivo a lungo termine | Condizioni di asplenia anatomica o funzionale e pazienti candidati alla splenectomia |
| Epatopatie croniche, inclusa la cirrosi epatica e le epatopatie croniche evolutive da alcool | Patologie onco-ematologiche (leucemie, linfomi e mieloma multiplo) |
| Alcoolismo cronico | Neoplasie diffuse |
| Soggetti con perdite liquorali da traumi o intervento | Trapianto d’organo o di midollo |
| Presenza di impianto cocleare | Diabete mellito |
| Emoglobinopatie quali anemia falciforme e talassemia | Insufficienza renale/surrenalica cronica |
Il PNPV 2017-2019, in età pediatrica, nell’ottica di un’ottimizzazione dell’offerta vaccinale, prevede la somministrazione del vaccino coniugato antipneumococco in concomitanza a quella del vaccino esavalente ma in sede anatomica diversa (quadricipite femorale della coscia contro-laterale). Sono, quindi, previste tre dosi rispettivamente al terzo, quinto e undicesimo mese [14].
Per quanto riguarda la popolazione anziana, la coorte cui la vaccinazione deve essere offerta attivamente è rappresentata dai soggetti di 65 anni di età e può essere offerta, sempre con l’obiettivo di aumentare la copertura, simultaneamente alla vaccinazione antinfluenzale o con diverse altre vaccinazioni inclusa la anti-COVID-19, facendo però presente che il vaccino antipneumococcico può essere somministrato in qualsiasi stagione dell’anno [19].
Nell’anziano, secondo quanto riportato nel PNPV 2017-2019, è prevista l’offerta attiva gratuita della vaccinazione con vaccino pneumococcico coniugato, seguita, ad almeno due mesi di distanza, da una dose di vaccino polisaccaridico. Da sottolineare l’importanza di non invertire l’ordine di somministrazione dei due vaccini, dal momento che ciò comporterebbe una più bassa risposta immunitaria con conseguente riduzione dell’efficacia vaccinale [20].
Le coperture vaccinali sono un indicatore fondamentale dell’efficienza del sistema vaccinale nonché dell’efficacia dei relativi programmi di immunizzazione volti a garantire un determinato grado di protezione nella popolazione aderente. Secondo l’intesa sancita in Conferenza Stato-Regioni nella seduta del 7 settembre 2016 sullo “Schema di decreto del Presidente del Consiglio dei ministri di aggiornamento dei livelli essenziali di assistenza (LEA)” il raggiungimento e il mantenimento delle coperture vaccinali per la vaccinazione antipneumococcica nei nuovi nati deve essere ≥ 95% [14].
Dai dati provenienti dal sito del Ministero della Salute riguardo la copertura del vaccino antipneumococcico nell’età pediatrica (dato a 24 mesi) si evince che, a livello nazionale, vi sia stato un incremento quasi continuo della copertura vaccinale dal 2013 al 2019 [21].
In particolare, si rileva che l’entità dell’incremento della copertura vaccinale a 24 mesi (Fig. 2) nel corso degli anni diminuisce passando da un +2,55% tra il 2016 e il 2017 a un +0,99% tra 2017 e il 2018 e infine +0,11% tra il 2018 e il 2019. Tra il 2019 e il 2021 si assiste, invece, a un decremento della copertura vaccinale.
Copertura vaccinale antipneumococcica in Italia a 24 mesi - rilevazioni dal 2013 al 2021.
Nel complesso, dal 2017 al 2019 si ha un incremento della copertura a 24 mesi dal 90,90% nel 2017 al 92% nel 2019, tendente a quanto proposto dal PNPV (obiettivo 95%) e frutto probabilmente anche della introduzione della legge sull’obbligo vaccinale che impattando sull’esavalente ha prodotto un effetto traino sul vaccino PCV, co-somministrato con lo stesso.
I più recenti dati delle ultime due annate (2020 e 2021), molto probabilmente a causa dell’impatto della pandemia da COVID-19, mostrano tuttavia una riduzione della copertura vaccinale anti-PCV a 24 mesi (90,58% nel 2020 e 91,25% nel 2021; -1,42% e -0,75% rispetto al 2019, rispettivamente) [22].
Andando ad analizzare i medesimi dati e focalizzando l’attenzione sulle singole coorti di nascita (Fig. 3) si rileva come le coperture a 36 mesi mostrino, come prevedibile, un incremento, sebbene in alcuni casi minimo, rispetto a quelle rilevate per la medesima coorte di nascita a 24 mesi. Tale fenomeno deve essere considerato ascrivibile a un recupero vaccinale che avviene nel corso del terzo anno di vita. Relativamente ai dati del 2013 e del 2017 si osserva una seppur lieve riduzione nelle coperture a 36 mesi rispetto a quelle a 24 mesi, che potrebbe essere spiegata con l’uso di un denominatore differente, un sistema diverso di calcolo oppure legata a fenomeni di migrazione (arrivo di soggetti non vaccinati da altre aree, ecc.).
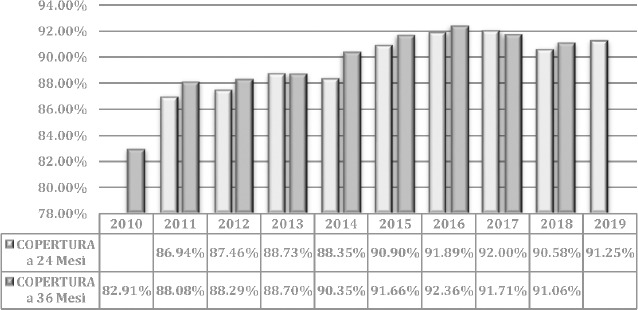
Copertura vaccinale antipneumococcica in Italia a 24 e 36 mesi per coorte di nascita.
Entrando nel dettaglio delle singole regioni, nel 2021, come mostrato nella sottostante Figura 4, si riscontra una copertura vaccinale antipneumococcica a 24 mesi alquanto eterogenea.
Copertura vaccinazione anti-pneumococcica per regione a 24 mesi, anno di rilevazione 2021.
Le regioni con la maggior copertura risultano essere Umbria e Molise che, con una copertura del 94,5%, si avvicinano all’obiettivo proposto dal PNPV di una copertura minima del 95%.
Il Trentino-Alto Adige con una copertura dell’81,9% presenta al suo interno profonde differenze tra le due province che lo compongono. Infatti, la Provincia di Trento rileva una copertura del 91,1% mentre la Provincia di Bolzano con il 71,7% rappresenta la minore copertura a 24 mesi registrata nel 2021 a livello nazionale.
L’analisi della copertura vaccinale relativa ai nati nel 2018, tramite i dati a 24 mesi rilevati nel 2020 (Fig. 5) e i dati a 36 mesi rilevati nel 2021 (Fig. 6) evidenzia che in diverse regioni si assiste, sebbene in misura variabile da regione a regione, a un recupero vaccinale.
Copertura vaccinazione anti-pneumococcica per regione a 24 mesi; anno 2020 (coorte di nascita 2018).
Copertura vaccinazione anti-pneumococcica per regione a 36 mesi; anno 2021 (coorte di nascita 2018).
Nel 2020, a causa dello scoppio della pandemia da COVID-19, in Italia e nel resto del mondo, specialmente per quanto concerne le vaccinazioni in adolescenza, si è osservato un significativo decremento nelle coperture vaccinali. Anche i vaccini pediatrici, incluso quello antipneumococcico, hanno mostrato un calo a cui possono aver contribuito le misure messe in atto dal Governo nel tentativo di arginare i contagi specialmente nella prima metà del 2020, come la chiusura delle scuole e dei centri vaccinali e il lockdown [22].
Si deve, inoltre, sottolineare la differenza tra le coperture registrate a 36 mesi e quelle a 24 mesi le cui motivazioni potrebbero essere in parte riconducibili sia alla difficoltà nell’offerta attiva della vaccinazione nelle diverse regioni che al ritardo vaccinale legato a una iscrizione scolastica posticipata (specialmente nelle Regioni del Sud Italia). Si tratta di fattori che purtroppo comportano allo stesso tempo un’esposizione ingiustificata di questi bambini a quelle che sono le più frequenti e gravi complicanze di un’infezione pneumococcica [21, 23].
Non si può tuttavia escludere che il mancato raggiungimento degli obiettivi di copertura del PNPV sia, almeno in parte, riconducibile a un ruolo attivo della vaccine hesitancy, ulteriormente amplificatosi negli ultimi anni anche per un improprio utilizzo di Internet. L’importanza della vaccine hesitancy è diventato tale che per contrastarlo lo Strategic Advisory Group of Experts (SAGE) on Immunization dell’Organizzazione Mondiale della Sanità (OMS) nel 2012 ha creato un gruppo di lavoro apposito [24].
Per arginare tali problematiche in accordo con quanto proposto nel Piano di comunicazione dello European Vaccine Action Plan (EVAP), bisognerebbe dare priorità a far crescere la fiducia nei confronti delle vaccinazioni, dei servizi vaccinali e delle autorità sanitarie e anche informare le persone circa i rischi delle complicanze delle malattie prevenibili con vaccini e il reale rapporto rischi/benefici della vaccinazione [14].
Recentemente, anche il Comitato Nazionale per la Bioetica (CNB), organo consultivo della Presidenza del Consiglio dei Ministri Italiana, ha sottolineato come i vaccini abbiano un rapporto rischi/benefici positivo e con un significativo valore etico oltre che sanitario. Tale organo ha inoltre invitato, similmente alle raccomandazioni dell’EVAP, ad attuare efficaci campagne d’informazione, comunicazione ed educazione finalizzate a mettere in evidenza l’importante ruolo delle vaccinazioni a livello individuale e collettivo e a richiamare i cittadini a scelte consapevoli e corrette nel proprio stesso interesse e a quello dei propri figli [14].
Dunque, le possibili proposte per promuovere le corrette pratiche vaccinali e il massimo rispetto delle tempistiche vaccinali previste all’interno dei Piani Nazionali di Prevenzione Vaccinale, in particolare nel caso delle vaccinazioni pediatriche, sarebbero raggruppabili sinteticamente in tre sottogruppi (Tab. II): incrementare l’accessibilità ai servizi vaccinali, aumentare le conoscenze da parte della Comunità sull’importanza degli interventi vaccinali e infine ottimizzare conoscenze e strumenti degli operatori sanitari.
Strategie di promozione delle pratiche vaccinali.
| Proposte per promuovere le corrette pratiche vaccinali | ||
|---|---|---|
| Accessibilità più immediata ai servizi vaccinali | Maggiore conoscenza da parte della Comunità dell’importanza degli interventi vaccinali | Ottimizzazione delle conoscenze e degli strumenti degli operatori |
|
|
|
Al fine di superare le differenze strutturali e organizzative attualmente presenti nei diversi contesti regionali italiani nel rispetto dei principi costituzionali, sarebbe opportuno rendere disponibili, in base alle caratteristiche socio-demografiche della popolazione e alle caratteristiche geografiche del territorio, un numero idoneo di punti vaccinali che possa soddisfare le necessità dei cittadini.
Aperture pomeridiane prolungate o di sabato mattina, in determinate realtà, faciliterebbero l’accesso puntuale da parte dei genitori “lavoratori” evitando di accumulare ritardi legati alle richieste di permesso sul luogo di lavoro che spesso richiedono lunghi e farraginosi percorsi autorizzativi da parte del datore di lavoro. Inoltre, sarebbe opportuno creare percorsi dedicati presso gli Ambulatori Vaccinali Territoriali per le varie fasce di popolazione afferenti o delle sale dedicate alla popolazione pediatrica all’interno dei Centri Vaccinali stessi.
Nel caso di aree in cui si rilevi una bassa copertura, il progetto vaccinale, soprattutto nella gestione di situazioni particolari (utenti impossibilitati a raggiungere i centri vaccinali per motivi di salute, economici o infrastrutturali) dovrebbe, altresì, essere condiviso con i pediatri di libera scelta che, conoscendo bene la storia clinica dei propri pazienti, svolgono un ruolo fondamentale soprattutto nel raggiungere quella fetta di popolazione che per vari motivi risulta poco compliante (attraverso somministrazione presso lo studio o al domicilio del paziente).
In tal senso, lo stesso “Calendario Vaccinale per la Vita 2019” raccomanda: “Il coinvolgimento di pediatri di famiglia e medici di medicina generale, oltre che nelle attività di promozione vaccinale e condivisione degli obiettivi, dovrebbe attivarsi anche in quelle di effettuazione delle vaccinazioni nei propri studi, in rete e corresponsabilità con il Dipartimento di Prevenzione, in quanto doveroso per fare fronte alle molteplici sfide e in considerazione dei positivi risultati delle esperienze già attuate in tal senso. Appare opportuno che la somministrazione dei vaccini sia effettuata anche nell’ambito del rapporto fiduciario con gli assistiti e le loro le famiglie, per il raggiungimento degli obiettivi del Piano Nazionale Prevenzione Vaccinale” [16].
Da non sottovalutare, infine, la notevole importanza che potrebbero rivestire le strutture ospedaliere nel gestire l’offerta vaccinale nei confronti dei soggetti fragili, a rischio di infezione o di forme gravi di patologie infettive evitabili tramite la stessa vaccinazione, in un ambiente protetto e adeguato. I tempi di erogazione del servizio potrebbero essere ottimizzati vaccinando tutti i pazienti in follow-up ambulatoriale o ricoverati in ambito ospedaliero, con particolare riferimento a reparti di pediatria, di malattie infettive e chirurgie pediatriche.
Un ulteriore facilitazione nell’accesso ai servizi vaccinali, in particolare nelle aree metropolitane e nelle zone meno servite dai servizi sanitari, sarebbe ottenibile con l’organizzazione di campagne mirate attraverso l’utilizzo di postazioni mobili, case di comunità, farmacie o, nel caso delle vaccinazioni dell’infanzia e dell’adolescenza, attraverso il coinvolgimento degli istituti scolastici. Proprio quest’ultimi, offrendo l’occasione di far precedere la sessione vaccinale da momenti formativi e informativi rivolti a studenti e docenti, si presterebbero particolarmente allo scopo nonostante le possibili criticità e difficoltà organizzative dovute sia all’interazione con gli uffici scolastici che al proporre un’attività sanitaria in ambienti a questa non predisposti con conseguenti possibili maggiori difficoltà nella gestione di reazioni avverse gravi [25].
Una maggiore conoscenza da parte della Comunità dell’importanza degli interventi vaccinali si ottiene tramite campagne educative che sensibilizzino i cittadini a considerare la vaccinazione non solo un diritto ma anche un dovere verso i minori e verso l’intera società e che rendano, di conseguenza, il cittadino empowered cioè in grado di comprendere e scegliere. Il processo di empowerment del cittadino, termine introdotto per la prima volta nel Piano Sanitario Nazionale 2006-2008 in cui si mira a erogare “cure efficaci e appropriate sotto il profilo clinico ed etico e, nel contempo, garantire il massimo livello possibile di equità nell’uso delle risorse” [26], dovrebbe realizzarsi sia attraverso un dialogo con la popolazione basato su una consolidata documentazione scientifica, avvalendosi anche dell’ausilio delle nuove tecnologie, dei media e dei social media, sia rendendo più fruibili e user-friendly i servizi sanitari territoriali, al fine di facilitarne l’accesso.
Lo stesso PNPV 2017-2019 sottolinea come le strategie di prevenzione possono raggiungere appieno i propri obiettivi solo promuovendo lo sviluppo di una vera e propria “cultura vaccinale” volta a rendere il cittadino consapevole circa le potenzialità delle vaccinazioni e a contrastare il diffondersi di falsità e pregiudizi. Rilevando nell’empowerment del cittadino lo strumento chiave per sviluppare tale “cultura vaccinale”, elenca, quindi, dei suggerimenti atti a realizzarlo e rafforzarlo (Box 1) [14].
L’ottimizzazione delle conoscenze degli operatori, anch’essa fondamentale per il processo di empowerment del cittadino, si ottiene tramite interventi di formazione periodica strutturata su temi di comunicazione sanitaria e vaccinologia, volti, quindi, non solo a soddisfare il bisogno di relazioni attente alle esigenze e preoccupazioni dei singoli ma anche per essere preparati sull’organizzazione stessa dei servizi vaccinali e sui loro obiettivi. Tali interventi formativi a favore di tutti gli operatori coinvolti nel processo vaccinale, come suggerito dal PNPV 2017-2019 dovrebbero garantire:
una formazione tecnica e scientifica focalizzata sulle vaccinazioni e sulla capacità di comunicazione e interazione con l’utenza;
una formazione degli operatori sanitari sulla comunicazione del rischio al pubblico, gestendo le esitazioni nell’aderire alle vaccinazioni, sottolineandone i vantaggi e il valore;
una risposta tempestiva, trasparente e affidabile in caso di eventi avversi a vaccino accertati o sospetti e a timori relative alla sicurezza dei vaccini;
azioni di deterrenza e disciplina etica e professionale nei confronti dei medici e degli operatori infedeli che non raccomandano o sconsigliano la vaccinazione.
Monitoraggio delle percezioni, delle conoscenze, degli atteggiamenti e delle opinioni del pubblico, perché la comunicazione si basi su evidenze di bisogni informativi, su cui calibrare i messaggi
Dialogo con la popolazione, attraverso canali di comunicazione multipli; con particolare attenzione all’uso delle nuove tecnologie dei media e dei social media
Attività di sostegno per la comunicazione sulle vaccinazioni per trasmettere informazioni che anticipino e rispondano ai timori dei genitori e degli anziani, soprattutto
Monitoraggio costante del “sentimento anti-vaccinazione”, così da garantire tempestivamente risposte corrette alle informazioni inesatte o false
Con lo scopo di individuare specifici target d’azione, le attività formative dovrebbero essere pensate e sviluppate sulla base delle esigenze di ogni singolo territorio. L’organizzazione di queste potrebbe essere delegata alle scuole di medicina, alle autorità sanitarie e alle associazioni professionali e scientifiche che potrebbero avvalersi per effettuarle, oltre che di lezioni frontali, anche della distribuzione di materiale informativo per mezzo postale o di posta elettronica (ad es. brochure informative, poster, ecc.) o, per facilitare gli operatori coinvolti, di accessi da remoto (ad es. webinar, video informativi, ecc.).
Dal punto di vista strumentale, negli ultimi anni vi sono state notevoli evidenze circa il fatto che le diverse tecnologie digitali hanno reso maggiormente efficienti i servizi vaccinali; sarebbe necessario, quindi, che le autorità sanitarie locali, regionali e nazionali valutassero come potenziare, nel più breve tempo possibile, l’implementazione dei sistemi di digitalizzazione come già suggerito nel PNPV 2017-2019.
Infatti, così come accaduto per la vaccinazione anti-COVID-19, i nuovi strumenti digitali possono favorire l’uso del Fascicolo Sanitario elettronico per l’accesso al calendario vaccinale personale e anche prenotazione e gestione delle sedute vaccinali, nonché un’anagrafe vaccinale a livello regionale e nazionale.
Di fondamentale importanza risulta essere il ricorso a un sistema di Anagrafe Vaccinale Informatizzata su scala Regionale e Nazionale che permetta operazioni di rilevamento dati (ritardatari, inadempienti) ma anche di progettare interventi di chiamata attiva, promemoria per gli appuntamenti, dematerializzazione dell’anamnesi completa del processo di conservazione sostitutiva secondo norma vigente ecc. [14].
Il processo di informatizzazione attraverso sia la progettazione e l’attivazione di software che consentano di migliorare gli aspetti gestionali e organizzativi (anagrafe vaccinale), sia la formazione e il supporto agli operatori per diffondere tra le aziende le “best practices”, permetterebbe, di conseguenza, il superamento dei numerosi sistemi informatici aziendali con un riallineamento di tutti i dati beneficiando, in tempo reale, di informazioni omogenee e conformi alle linee guida regionali e nazionali, oltre che una migliore distribuzione delle risorse e una riduzione dei costi di manutenzione. L’integrazione di tali dati, di concerto con i sistemi di sorveglianza delle malattie prevenibili da vaccino (sistema PREMAL incardinato all’interno del Nuovo Sistema Informativo Sanitario) [27], consentirebbe sia di avere un quadro dettagliato della situazione italiana in ambito di vaccinazione antipneumococcica, sia di poter attuare strategie efficaci volte a ridurre i rischi provenienti dalla mancata vaccinazione e migliorare il livello di copertura vaccinale.
Nonostante il PNPV 2017-2019 si sia posto come obiettivo il raggiungimento del 95% di copertura vaccinale antipneumococcica tra i nuovi nati, purtroppo tale obiettivo risulta non essere stato raggiunto a livello nazionale, ma soltanto a livello locale in alcune regioni più virtuose.
Valutando tuttavia il trend di coperture registrato a 24 mesi in Italia si può evidenziare come un impulso importante di crescita si sia avuto a partire dal 2017, anno in cui la legge n. 119 ha reso obbligatoria la vaccinazione fino ai 16 anni di età contro poliomielite, difterite, tetano, epatite B, pertosse, Haemophilus influenzae tipo b, varicella, morbillo, parotite e rosolia. Nello specifico, come mostrato in Figura 7, tra il 2014 e il 2016 le coperture vaccinali antipneumococciche a 24 mesi in Italia sono cresciute al ritmo dello 0,47% per anno mentre tra 2016 e 2017 (anno di implementazione della legge 119/2017) l’incremento è stato pari al 2,55%. Negli anni successivi si è registrato un ulteriore incremento annuale di circa lo 0,55% per anno fino al 2019. Tra il 2020 e il 2021 invece si è osservata una riduzione per anno pari al -0,41% per anno rispetto al 2019.
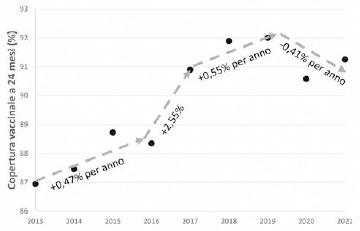
Trend di copertura vaccinale antipneumococcica a 24 mesi in Italia dal 2013 al 2021.
È chiaro che, benché il vaccino antipneumocicco non rientri tra quelli obbligatori, a seguito dell’introduzione della obbligatorietà vaccinale di cui alla legge 119/2017, si è avuto un incremento percentuale della copertura vaccinale anche di questo vaccino che viene abitualmente proposto in cosomministrazione con il vaccino esavalente.
L’importante effetto “traino” fornito dall’obbligatorietà del vaccino esavalente è confermato dai trend di altre vaccinazioni non obbligatorie (contro meningococco B e rotavirus ad esempio) somministrate nel primo anno di vita, che hanno visto significativamente aumentare le coperture vaccinali dopo l’estensione dell’obbligatorietà vaccinale.
Le motivazioni legate a questi incrementi potrebbero essere molteplici e in parte legate all’ampio dibattito e discussione pubblica che si è creato con i mandati vaccinali, alle campagne di comunicazione e di promozione alla vaccinazione fatte dal Ministero della Salute e divulgate da medici e pediatri, all’aumentata e migliorata attività di divulgazione e di comunicazione messa in atto sia dalle aziende farmaceutiche private sia dal Ministero della Salute [28], oltre che all’aumentata attenzione mediatica conseguente all’ondata epidemica di morbillo di quegli anni [29, 20].
Sicuramente, l’importanza di raccomandare, in accordo ai dettami del PNPV, la cosomministrazione dei tre vaccini (esavalente, pneumococco e rotavirus) supporta notevolmente tale effetto trainante del vaccino esavalente.
Diversamente, la separazione in due sedute delle due vaccinazioni iniettive del neonato da effettuare dal 61esimo giorno di vita (esavalente e antipneumococcica) non solo non ha alcuna base scientifica, ma porterebbe a un notevole ritardo nel completamento del ciclo vaccinale, aggiungendo notevoli complicazioni per i genitori del bambino che saranno costretti a raddoppiare gli accessi ai centri vaccinali nel primo e secondo anno di vita, e alla lunga a un calo delle coperture vaccinali.
Lo S. pneumoniae, responsabile sia di malattie non invasive che di malattie invasive, rappresenta un’importante causa di morbosità e mortalità, soprattutto nei bambini e negli anziani con ricadute in ambito sanitario, sociale ed economico.
In atto i vaccini antipneumococcici si sono dimostrati la forma di prevenzione più efficace nei confronti delle infezioni da S. pneumoniae tanto che la stessa OMS ha dichiarato come la prevenzione vaccinale delle malattie pneumococciche, di concerto con un adeguato sistema di sorveglianza delle malattie invasive, sia un obiettivo prioritario di salute, tanto per i paesi industrializzati quanto per quelli in via di sviluppo.
Per la Sanità Pubblica, di conseguenza, risulta necessario riuscire a raggiungere e mantenere nel tempo a livello nazionale una copertura vaccinale del 95%, valore minimo ritenuto necessario per potere considerare significativamente protetta la popolazione, in particolare i soggetti maggiormente a rischio.
Per farlo è necessario puntare a una riorganizzazione dell’offerta vaccinale con il coinvolgimento dei pediatri di famiglia, con un ampliamento dell’offerta vaccinale territoriale (ampliamento orari e giorni di apertura e locali dedicati per vaccinazioni del neonato), con la promozione della cosomministrazione, sempre e comunque, dei vaccini iniettivi nel primo anno di vita in accordo ai dettami del PNPV.
Fondamentale per il raggiungimento di queste coperture è tentare di recuperare tutti quei soggetti che per vari motivi (esitazione vaccinale, problemi logistici, mancata informazione ecc.) non aderiscono alla vaccinazione attuando molteplici iniziative mirate ad aumentare la richiesta di vaccinazione da parte della popolazione. Tale recupero vaccinale si potrebbe ottenere tramite un miglioramento dell’offerta vaccinale sia rafforzando numerosità e distribuzione nel territorio dei punti vaccinali che coinvolgendo altri attori quali gli ospedali e la medicina territoriale (MMG, PLS, case di comunità).
Infine, la partecipazione attiva delle scuole attraverso apposite campagne vaccinali rivolte ai genitori, potrebbe renderle importanti luoghi di promozione attiva delle vaccinazioni, in particolare quelle dell’infanzia e dell’adolescenza.
Un’adeguata ed efficace formazione continua e costante degli operatori sanitari coinvolti a tutti i livelli nel processo vaccinale nonché un’adeguata ed efficace informazione della popolazione, tramite anche l’utilizzo delle nuove tecnologie, permetterebbe d’intraprendere interventi sia correttivi che innovativi con il risultato collaterale, oltre quello di una corretta informazione, di rassicurare riguardo tutte quelle preoccupazioni immotivate insite nei cittadini.
L’obbligatorietà vaccinale, che inevitabilmente porta i cittadini a interfacciarsi con i centri di prevenzione, si è dimostrata essere un’ottima occasione di educazione sanitaria volta ad aumentare l’adesione anche nei confronti delle vaccinazioni raccomandate sebbene non obbligatorie.
Ulteriore strumento che potrebbe risultare basilare nell’ottimizzare gestione e implementazione dei servizi vaccinali sarebbe il completamento della realizzazione di un’anagrafe vaccinale che consenta di avere un flusso di dati, sia a livello regionale che a livello nazionale, completo e in tempo reale.
Pertanto, sarebbe fondamentale sostenere lo sviluppo di una vera e propria “cultura vaccinale”, atta a trasmettere una maggiore coscienza che metta in evidenza come i vaccini siano una delle misure preventive più valide contro le malattie infettive, con un rapporto rischio/beneficio positivo e con un valore non solo sanitario ma anche etico.
Lo Streptococcus pneumoniae (S. pneumoniae), comunemente chiamato “pneumococco”, è un batterio patogeno per l’uomo. Diplococco, gram-positivo, è classificato in 90 sierotipi, divisi in 48 sierogruppi [1]. Le infezioni sintomatiche da S. pneumoniae sono distinte in una forma non-invasiva e in una forma invasiva. Tra le infezioni pneumococciche non-invasive più comuni rientrano: otiti medie acute, sinusiti, congiuntiviti, bronchiti e polmoniti pneumococciche non batteriemiche [2].
La forma più severa è l’infezione o malattia pneumococcica invasiva (MIP, in inglese Invasive Pneumococcal Disease, IPD), caratterizzata dalla presenza dello S. pneumoniae in siti normalmente sterili (sangue circolante, liquido cefalorachidiano, midollo osseo, ecc). Nelle MIP rientrano le batteriemie senza focolaio, le sepsi, le polmoniti batteriemiche, le meningiti e le osteomieliti [3]. Altre infezioni meno frequenti causate da S. pneumoniae includono la cellulite periorbitale, l’endocardite, la pericardite, la peritonite, l’artrite piogenica, le infezioni dei tessuti molli e la setticemia neonatale [1]. La trasmissione avviene per via aerea, attraverso aerosol e droplet emessi da soggetti infetti o da portatori sani.
Le infezioni pneumococciche e le MIP sono causa di incremento della morbosità e mortalità da malattie trasmissibili, a livello sia europeo sia globale. Secondo l’Organizzazione Mondiale della Sanità (OMS), le infezioni da pneumococco sono responsabili dell’11% delle morti nei bambini al di sotto dei 5 anni di età (Cfr. Capitolo 1). Stime del 2016 indicano che la polmonite pneumococcica causi ogni anno circa 45 milioni di episodi di infezioni respiratorie delle vie inferiori e 350.000 decessi in bambini di età < 5 anni [4].
La prevalenza e la distribuzione dei sierotipi invasivi di S. pneumoniae differiscono tra le popolazioni e le aree geografiche. Le infezioni da pneumococco colpiscono persone di tutte le età. Nel 2017, negli Stati Uniti, l’incidenza annuale di MIP è stata pari a 7 casi/100.000 bambini di età < 5 anni [3]. In Europa, l’incidenza riportata di MIP varia da 0.4 casi/100.000 abitanti a 20 casi/100.000 abitanti [1]. Nell’ultimo report dell’ECDC, del 2020, si stima un tasso medio di MIP nell’intervallo temporale 2014-2018 pari a 6,4 casi/100.000 abitanti, con valori di 14,4 casi/100.000 tra i bambini di età < 1 anno e di 5 casi/100.000 tra i bambini di età 1-5 anni, rispetto ai 18,7 casi/100.000 tra gli adulti di età ≥ 65 anni. Nel complesso, in tutte le fasce di età considerate, il sesso più colpito è il maschile, con un rapporto tra maschi e femmine di 1,2:1 (Cfr. Capitolo 1). Per quanto riguarda la situazione italiana, nel periodo di osservazione 2011-2020, l’8% dei casi totali di MIP, registrati dalla sorveglianza nazionale delle malattie batteriche invasive (MaBI), ha colpito la popolazione giovane di età 0-14 anni, in particolare neonati e bambini di età < 4 anni; nel 58% dei casi, invece, è stata colpita la popolazione anziana d’età > 64 anni. Il tasso di mortalità da infezioni dovute a S. pneumoniae, in Italia, è pari a 3-8%, coinvolgendo soprattutto bambini di età < 2 anni (Cfr. Capitolo 1).
La colonizzazione nasofaringea asintomatica da S. pneumoniae è una condizione comune, che interessa il 20-40% dei bambini e il 5-10% degli adulti. Solitamente la colonizzazione da S. pneumoniae avviene a circa sei mesi di età; l’esito della stessa dipende dalla virulenza del sierotipo specifico e dalla risposta immunitaria dell’ospite [1]. I bambini piccoli (di età < 2 anni) e gli anziani (di età superiore di 65 anni) sono più a rischio: si stima che ogni anno circa un milione di bambini muoia – nel mondo – a causa dello pneumococco. I neonati sono soggetti alla MIP quando gli anticorpi materni diminuiscono. In questa fascia di età, la manifestazione più comune è la batteriemia senza focolaio [5].
L’incidenza delle MIP raggiunge il picco nei mesi invernali, nei climi temperati. La stagionalità è attribuita a molteplici fattori, tra cui la minore umidità, l’affollamento negli ambienti chiusi, le infezioni virali associate, il freddo e l’inquinamento atmosferico [1]. Oltre all’età, altri fattori predisponenti alle infezioni pneumococciche e alla MIP sono: influenza, malattie croniche cardiache, polmonari (inclusi BPCO e asma) o renali, perdita di liquor cefalorachidiano, impianto cocleare, diabete, infezione da HIV e altre immunodeficienze, cancro (leucemia, mieloma multiplo), trapianto di organi solidi, assunzione di farmaci immunosoppressori, sindrome nefrosica, anemia falciforme, asplenia funzionale. Negli adulti di tutte le età, ulteriori fattori predisponenti sono: alcolismo, tabagismo e malattie croniche epatiche [2]. I bambini sono spesso la via di ingresso del batterio nelle famiglie e il rischio di trasmissione all’interno di un nucleo familiare è associato alle dimensioni della famiglia stessa [1, 2, 6].
Lo S. pneumoniae è, inoltre, il patogeno batterico più comunemente isolato nell’otite media acuta (OMA), sia nei bambini sia negli adulti; è la causa principale di meningite batterica e sepsi nei bambini di età < 5 anni; è la causa più comune di polmonite batterica acquisita in comunità (Community-Acquired Pneumonia, CAP), accompagnata da batteriemia nel 15-30% dei casi, che fa raggiungere una mortalità ospedaliera pari al 15%; è la causa più frequente di mastoidite, che ha come complicanze meningiti e ascessi cerebrali; è la causa più comune di meningite batterica negli adulti, con un tasso di letalità pari al 10-30% [5].
A livello globale si è assistito a un rapido aumento della resistenza dello S. pneumoniae agli antimicrobici. Come riportato nel Capitolo 1 del presente report, è emerso, da alcuni studi, che ceppi isolati di pneumococco hanno dimostrato una resistenza generale alla penicillina variabile dal 32,1 al 78,8%, con valori elevati soprattutto in Africa; per quanto riguarda il panorama europeo, nello studio di Jefferson et al. si riporta un tasso variabile di antibiotico-resistenza alla penicillina, con valori del 49% registrati in Spagna, a differenza di Paesi con una politica più restrittiva circa l’uso di antibiotici, come la Danimarca (3,8%) e la Svezia (1,4%); in Italia, invece, i valori oscillavano tra 5 e 57,1%. Altra importante resistenza è – a livello mondiale – quella nei confronti dei macrolidi, in particolare dell’eritromicina (37-94,4%), che in Italia si aggira tra il 20 e l’83%. Altre resistenze segnalate nel mondo sono contro cloramfenicolo, levofloxacina e cefotaxime. I vaccini, che consentono di prevenire la maggior parte delle MIP, rivestono pertanto la massima importanza.
Nei Paesi industrializzati, 23 sierotipi causano circa il 90% delle infezioni invasive da pneumococco, in particolare meningiti e batteriemie. I polisaccaridi dello S. pneumoniae sono antigeni che evocano una risposta immunitaria T-indipendente; pertanto, essi sono scarsamente immunogenici nei soggetti di età < 2 anni. Inoltre, non inducono la memoria immunitaria: di conseguenza, un’avvenuta infezione da pneumococco non protegge da una futura infezione.
Attualmente sono disponibili due classi di vaccini contro lo pneumococco: una classe basata su polisaccaridi coniugati a una proteina carrier per migliorarne immunogenicità ed efficacia vaccinale soprattutto nei bambini con età < 2 anni (Pneumococcal Conjugate Vaccine, PCV); l’altra su polisaccaridi (Pneumococcal Polysaccharide Vaccine, PPV). Il limite dei vaccini polisaccaridici (non coniugati) è di stimolare solo la risposta dei linfociti B senza il coinvolgimento della risposta T dipendente [7]. Per stimolare la risposta dei linfociti T helper è necessario coniugare i vaccini con il tossoide difterico CRM197. Il CRM197 induce l’attivazione delle cellule T helper di tipo 2, che attivano lo switching e la formazione di anticorpi non IgM e la produzione di cellule B di memoria [7]. La coniugazione permette la risposta immunitaria anche in soggetti neonati, oltre che garantire una copertura di lungo periodo.
Il primo vaccino coniugato pneumococcico, il PCV7, autorizzato negli Stati Uniti dalla Food and Drug Administration (FDA) nel 2000 e in Europa nel 2001, contiene i polisaccaridi di 7 sierotipi (4, 6B, 9V, 14, 18C, 19F e 23F), che coprono il 65-80% dei sierotipi associati alla MIP tra i bambini nei Paesi industrializzati occidentali [4].
La vaccinazione contro lo pneumococco protegge dall’infezione sistemica e riduce la colonizzazione rinofaringea dei sierotipi del vaccino. Di conseguenza si assiste a un fatto molto importante, ovvero l’immunità di gregge (herd immunity) contro i sierotipi vaccinali. Infatti, la trasmissione dei ceppi vaccinali da individui colonizzati a individui suscettibili diminuisce. Già a seguito di vaccinazione di routine con PCV7, si sono evidenziate riduzioni sostanziali dell’incidenza di MIP e polmonite anche nei bambini e negli adulti non immunizzati. In particolare, nei bambini vaccinati con PCV7, rispetto ai non vaccinati, si è riscontrata una diminuzione pari al 20% di episodi di polmonite confermata dalla radiografia del torace, pari al 7% di episodi di OMA e pari al 20% di posizionamenti di tubi per timpanostomia, oltre a un importante calo, negli Stati Uniti, dei casi di MIP e OMA.
Nonostante una sostanziale riduzione del numero di casi di MIP in seguito all’introduzione del PCV7, è stato osservato un successivo aumento dell’incidenza della malattia causata da sierotipi non vaccinali, quali 6A, 7F e 19A [8, 9]. Ad esempio, la percentuale di MIP causata dal sierotipo 19A nei bambini statunitensi è passata, dopo l’introduzione del PCV7, da circa il 3 a circa il 47%. Un aumento simile è stato osservato in altri Paesi, quali Australia, Canada, Francia, Israele, Nuova Zelanda e Regno Unito, dove il sierotipo 19A rappresentava il 4-10% di MIP, ma è aumentato fino al 15-45% dopo l’introduzione del PCV7 [5].
L’aumento dei casi da sierotipi non vaccinali (serotype replacement) si verifica perché S. pneumoniae è un batterio commensale che risiede nel rinofaringe dei bambini sani e i PCV offrono protezione contro il trasporto nasofaringeo dei sierotipi pneumococcici coperti dal vaccino. Mentre il carriage nasofaringeo complessivo è rimasto costante, i sierotipi non vaccinali che hanno sostituito i sierotipi vaccinali sono generalmente meno patogeni, pertanto i tassi complessivi di MIP rimangono sostanzialmente inferiori rispetto ai livelli pre-vaccinali. Il serotype replacement ha reso necessario, quindi, lo sviluppo di nuovi vaccini contenenti sierotipi aggiuntivi, in modo da mantenere la riduzione della malattia [9]. Per rispondere a questa esigenza, sono stati sviluppati PCV10 e PCV13, introdotti in Europa nel 2009 [8]. La FDA ha autorizzato PCV13 nel 2010, sulla base di studi che hanno dimostrato la sua capacità di indurre livelli di anticorpi paragonabili a quelli indotti dal PCV7 e di proteggere contro la MIP. Il PCV10 contiene tutti i sierotipi del PCV7, più i sierotipi 1, 5 e 7F; il PCV13 contiene 3 sierotipi in più (3, 6A e 19A) rispetto al PCV10 [9].
L’implementazione del PCV13 è stata associata alla diminuzione significativa dei casi di MIP causati dai sierotipi aggiunti, eccetto il sierotipo 3, che continua a persistere. In seguito all’introduzione del PCV13, l’incidenza dei sierotipi 3, 6A e 19A si è ridotta rispetto ai Paesi che somministrano PCV10, ma si è osservato un parallelo aumento dell’incidenza di molteplici sierotipi non-PCV13, tra cui 6C, 8, 9N, 10A, 11A, 12F, 15A, 15B, 15C, 22F, 23B, 24F, 33F, 35B, e 38 [4].
In particolare, è stato osservato serotype replacement nella MIP causata dai sierotipi 22F e 33F [5]. Il sierotipo 33F ha un elevato potenziale di malattia invasiva rispetto ad altri sierotipi non-PCV13 ed è associato ad antibiotico-resistenza [3]. Sebbene nel 1998-1999 rappresentassero solo l’1,2% di tutti i casi di MIP nei bambini statunitensi di età inferiore ai 5 anni, la MIP causata da questi due sierotipi è aumentata nel 2017 fino a circa l’8 e il 9% per il 22F e il 33F, rispettivamente [5]; nel 2013, negli adulti di età maggiore di 18 anni i sierotipi 22F e 33F hanno causato, rispettivamente, il 13 e il 5% delle MIP [9]. Nel 2020, il PCV10 e il PCV13 erano stati introdotti in 160 programmi di immunizzazione nazionale in tutto il mondo, in particolare PCV13 è presente in circa l’80% dei suddetti programmi. Studi modellistici globali stimano che 175 milioni di casi di malattia pneumococcica e 625.000 decessi siano stati prevenuti dal PCV13 nei bambini sotto i 5 anni di età in tutto il mondo tra il 2010 e il 2019.
Per rispondere al nuovo serotype replacement, dal momento che i nuovi vaccini devono continuare a mantenere i sierotipi PCV originali per mantenere la riduzione della malattia, estendendo al contempo la copertura ai sierotipi emergenti che causano la malattia, sono stati sviluppati il PCV15 e il PCV20. Il primo contiene i sierotipi 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F e 33F, mentre il secondo contiene i sierotipi 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F e 33F. Entrambi includono, quindi, i 2 sierotipi 22F e 33F, tra le principali cause di MIP dopo l’implementazione dei PCV [9].
Come riportato nel Capitolo 3 del presente report, le attuali raccomandazioni italiane per la popolazione pediatrica prevedono la somministrazione del PCV13 a partire dal 61° giorno di vita (3° mese o 2 mesi compiuti), con un totale di 3 dosi (scheda 2 + 1) somministrate al 3°, 5° e 11°/13° mese di vita. L’immunizzazione con PCV13 può avvenire in regime di co-somministrazione con il vaccino esavalente (DTaP-IPV-HepB-Hib, difterite, tetano, pertosse acellulare, poliomielite inattivato, epatite B, emofilo B). Tra il 2021 e il 2022 l’FDA, l’EMA e l’AIFA hanno autorizzato l’uso negli adulti di PCV15 e PCV20; nel 2022, ha fatto seguito l’autorizzazione per l’uso del PCV15 – oggetto di questa analisi etica in HTA – in soggetti di età compresa tra 6 settimane e 18 anni.
L’obiettivo dei programmi di HTA è valutare l’opportunità dell’introduzione di una nuova tecnologia nel sistema sanitario o la rivalutazione di tecnologie sanitarie già esistenti qualora siano disponibili nuovi dati o entrino nel mercato nuove alternative. Ai fini di questa valutazione è necessario analizzare oltre i dati di efficacia, sicurezza, impatto economico e organizzativo, anche le eventuali ricadute su salute, qualità di vita, esercizio dell’autonomia del paziente ed equità nell’accesso ai trattamenti [10, 11].
La possibilità di avere a disposizione vaccini immunogenici, efficaci, sicuri e in grado di coprire il più ampio spettro di sierotipi offre – già di per sé – importanti vantaggi per la vita, la salute e la qualità della vita, oltre a ridurre i costi diretti sanitari (assistenza sanitaria, trattamenti farmacologici, eventuale ricovero ospedaliero) e indiretti (perdita di giornate lavorative o di scuola) nel caso di insorgenza della patologia. A livello sociale, è inoltre possibile ottenere la cosiddetta “immunità di gregge” (herd immunity) che consente di proteggere anche la popolazione non vaccinata e di ridurre la circolazione dell’agente patogeno. L’analisi etica nell’ambito di questo HTA assume così una duplice rilevanza: da una parte consente di valutare la tecnologia in esame, PCV15; dall’altra, di porre l’attenzione sull’importanza della prevenzione vaccinale come esercizio di una duplice responsabilità: verso sé stessi e verso gli altri [12].
A differenza di altri ambiti di indagine che usano procedure abbastanza standardizzate, l’analisi etica in HTA può fare riferimento a diversi modelli e metodologie di analisi [13-15]. La metodologia di analisi etica - utilizzata in questo processo HTA - fa riferimento al personalismo ontologicamente fondato o sostanzialista. Questo modello, detto “metodo triangolare”, si articola in quattro principi di riferimento: 1) la difesa della vita fisica e della sua integrità; 2) il rispetto della libertà nelle scelte e il richiamo alla responsabilità del proprio agire; 3) il principio terapeutico o della totalità; 4) i principi di socialità e sussidiarietà, secondo cui l’autorità pubblica o privata è chiamata ad aiutare la persona senza discriminazioni e in base ai suoi bisogni [16].
Il metodo triangolare prevede tre momenti:
raccolta e analisi dei dati di efficacia (immunogenicità, efficacy e effectiveness nel caso di un vaccino), di sicurezza e tollerabilità della tecnologia sanitaria in studio (fase conoscitiva);
valutazione di come la tecnologia sanitaria in studio si rapporti al bene integrale della persona (tutela della vita e della salute; qualità della vita; rispetto dell’autonomia; ricerca del bene comune);
elaborazione del parere etico conclusivo, facendo emergere anche le eventuali problematicità di tipo etico di cui i decision-makers devono tenere conto qualora venissero chiamati a valutare l’opportunità di impiegare la tecnologia in studio (fase prescrittiva) [17].
Il PCV15 è una sospensione sterile di polisaccaridi capsulari purificati di 15 sierotipi di S. pneumoniae (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F e 33F) coniugati singolarmente con la variante non tossica della tossina difterica CRM197. Una dose da 0,5 ml di PCV15 contiene 2,0 μg di polisaccaride di ciascuno dei 14 sierotipi e 4,0 μg di polisaccaride del sierotipo 6B, 30 μg di proteina carrier CRM197, 1,55 mg di L-istidina, 1 mg di polisorbato 20, 4,50 mg di cloruro di sodio e 125 μg di alluminio come adiuvante fosfato di alluminio. Il vaccino non contiene conservanti.
I vantaggi ricercati sono riassumibili nella disponibilità di un vaccino che:
sia immunogenico, efficace e sicuro;
copra un ampio spettro di sierotipi di S. pneumoniae;
stimoli la risposta immunitaria anche in soggetti pediatrici, garantendo una copertura di lungo periodo;
favorisca l’immunità di gregge (herd immunity) contro i sierotipi vaccinali.
Nella fase valutativa, verranno analizzati: il rapporto rischi/benefici del ricorso a PCV15; i vantaggi in termini di miglioramento della qualità della vita; il rispetto dell’esercizio dell’autonomia da parte del soggetto interessato alla vaccinazione; la possibilità di assicurare l’accesso alla vaccinazione a tutta la popolazione target.
L’analisi etica di una tecnologia sanitaria comporta, innanzitutto, la valutazione della sua utilità clinica e della proporzionalità tra i benefici ricercati (efficacia) e i rischi prevedibili (sicurezza). La vita fisica è, come già detto, il valore “fondamentale” e in quanto tale esige il massimo rispetto.
La protezione offerta da un determinato vaccino viene valutata in base all’immunogenicità, l’efficacia teorica (efficacy) e l’efficacia sul campo o “reale” (effectiveness). L’immunogenicità è la capacità dei vaccini di stimolare la risposta immune, mentre efficacy ed effectiveness fanno riferimento alla riduzione proporzionale dei casi di malattia rispettivamente nelle condizioni ideali (i.e., trial clinico) e quelle della “vita reale”. Inoltre, ciascuno di questi parametri può essere quantificato su scala assoluta (i.e. confronto con la non vaccinazione o con il placebo) o relativa (i.e. confronto con un altro vaccino).
Come si evince dal Capitolo 2 del presente report, i vaccini finora utilizzati per la vaccinazione antipneumococcica in età pediatrica, PCV7, PCV10 e PCV13, si sono dimostrati efficaci e sicuri. Nello specifico, i vaccini antipneumococcici coniugati si sono dimostrati:
efficaci nella riduzione delle infezioni pneumococciche [18];
efficaci nella riduzione delle complicanze quali le otiti medie [19];
efficaci nella riduzione di forme invasive della malattia pneumococcica (MIP) da sierotipo 3 nei bambini [20];
sicuri, con presenza esclusivamente di eventi avversi lievi o moderati e l’assenza di eventi avversi gravi o decessi dovuti ai vaccini [21].
L’efficacia e la sicurezza di PCV15, contenente i sierotipi 22F e 33F in aggiunta ai sierotipi inclusi in PCV13, sono state valutate sui neonati nel trial clinico NCT01215188 [9]. Si tratta di uno studio multicentrico, randomizzato, in doppio cieco, di fase 2, condotto in 58 centri clinici (Stati Uniti, Canada, Finlandia, Israele e Spagna), che ha confrontato la sicurezza e l’immunogenicità di due formulazioni (non adiuvato o adiuvato con alluminio) di PCV15 rispetto a PCV13 nei neonati a cui è stato somministrato un regime di 4 dosi a 2, 4, 6 e 12-15 mesi di età. Un totale di 1148 neonati è stato randomizzato in uno dei 3 gruppi di vaccinazione: PCV15 con coadiuvante in alluminio, PCV15 senza coadiuvante o PCV13. I soggetti sono stati seguiti per gli eventi avversi per 14 giorni dopo ogni vaccinazione utilizzando una scheda di segnalazione vaccinale validata.
Dopo la somministrazione della terza dose, le formulazioni di PCV15 adiuvata e non adiuvata (con alluminio) hanno mostrato non inferiorità rispetto al PCV13 per 10 dei 13 sierotipi condivisi, ma non sono risultati non inferiori per 3 sierotipi (6A, 6B e 19A) in rapporto alla proporzione di soggetti che hanno raggiunto livelli anticorpali superiori al valore soglia (IgG GMC > 0,35 μg/ml). Il PCV15 ha indotto anticorpi più elevati contro i sierotipi 3, 22F e 33F rispetto a PCV13.
La percentuale di soggetti che hanno riportato eventi avversi locali è stata più alta tra i riceventi di PCV15 adiuvato rispetto a PCV13 o PCV15 non adiuvato. Sebbene le proporzioni di eritema, indurimento e gonfiore non siano cambiate con le dosi successive, è stata osservata una certa diminuzione del dolore locale. La frequenza degli effetti indesiderati sistemici è stata generalmente paragonabile in tutti i gruppi dopo qualsiasi vaccinazione. Gli effetti collaterali sistemici più comunemente riportati sono stati irritabilità, diminuzione dell’appetito e sonnolenza. Una proporzione numericamente più alta di destinatari di PCV15 adiuvato ha riportato un AE (Adverse Event) sistemico rispetto ai destinatari di PCV13 e PCV15 non adiuvato.
Più di recente è stato pubblicato lo studio di Platt et al. [5]. Si tratta di uno studio di fase 2, randomizzato, multicentrico [Finlandia (8), Spagna (2]) Israele (3) Danimarca (2]) Canada (3) e Stati Uniti (29)], in doppio cieco, che ha confrontato i profili di sicurezza, tollerabilità e immunogenicità di 2 diversi lotti di PCV-V114 rispetto al PCV13 in neonati sani di 6-12 settimane di età.
Lo studio ha dimostrato che le risposte immunitarie di V114 Lotto 1 e V114 Lotto 2 non sono state inferiori a quelle di PCV13 per tutti i 13 sierotipi condivisi. È stata osservata una maggiore immunogenicità per il sierotipo 3 per entrambi i lotti del V114 rispetto al PCV13. Questo dato è degno di nota se si considerano le evidenze contrastanti sull’efficacia del PCV13 contro la MIP dovuta al sierotipo 3. È importante notare gli alti tassi di risposta e le IgG GMC per i 2 sierotipi esclusivi del V114 (22F e 33F), poiché questi sierotipi sono responsabili di una maggiore percentuale di casi di MIP nei bambini e negli adulti nei Paesi in cui i PCV sono inclusi nel programma di vaccinazione infantile. L’inclusione di questi due sierotipi aggiuntivi 22F e 33F in un vaccino pneumococcico coniugato è un approccio importante per affrontare l’onere globale della malattia da pneumococco.
La maggior parte degli effetti indesiderati sistemici e nel sito di iniezione riportati in tutti e 3 i gruppi di vaccinazione sono stati transitori e di intensità lieve o moderata. Nel complesso, la vaccinazione con V114 è stata generalmente ben tollerata, con un profilo di sicurezza generalmente paragonabile a quello del PCV13.
L’analisi della letteratura effettuata nel Capitolo 3 del presente report, in cui sono stati analizzati 14 RCT di fase I-III, conferma quanto già riportato: il PCV15 è emerso essere altamente immunogeno, dal punto di vista sia degli anticorpi totali sia degli opsonizzanti, verso tutti i 15 sierotipi che contiene. Quasi la totalità dei bambini vaccinati con il PCV15 raggiunge il livello anticorpale ≥ 0,35 μg/ml, ritenuto protettivo nei confronti della MIP. Nella maggior parte degli studi analizzati, il PCV15 è stato non inferiore al PCV13 per tutti i 13 sierotipi in comune; in tutti gli studi analizzati, d’altra parte, il PCV15 ha dimostrato una netta superiorità nella risposta umorale verso i sierotipi 22F e 33F, non contenuti in PCV13.
Relativamente agli AE, la maggior parte dei bambini ha riportato ≥ 1 AE sia nei gruppi PCV15 (74,6-99,3%) sia in quelli PCV13 (59,4-100%); in quasi tutti gli studi la comparsa di ≥ 1 AE era del tutto paragonabile tra il PCV15 e il PCV13. La maggior parte degli AE riportati sono di intensità da leggera a moderata, di natura transitoria (< 3 giorni) e autolimitante. Il dolore nel sito di iniezione è risultato il più frequente in assoluto e in tutte le fasce di età pediatriche; tra gli AE sistemici, l’irritabilità e la sonnolenza nei bambini piccoli e la mialgia nei bambini più grandi sono stati i più frequenti. Gli AE severi correlati all’utilizzo del PCV15 sono risultati rari, pari allo 0% nella maggior parte dei RCT.
Come si evince dal Capitolo 3, inoltre, il PCV15 può essere co-somministrato con altri vaccini pediatrici di routine senza provocare un’interferenza clinicamente significativa, sia con la risposta immune umorale, sia con la frequenza degli AE.
Premesso che PCV15 presenta un rapporto benefici attesi (immunogenicità, efficacy ed effectiveness /rischi prevedibili) e di tollerabilità/sicurezza favorevole, è necessario valutare anche l’impatto sulla qualità di vita dei soggetti vaccinati in termini di riduzione del carico di malattia e sofferenza, della non autosufficienza, della sospensione/perdita di vita di relazione e di attività lavorativa o scolastica. La riduzione dei casi di MIP nella popolazione, che avrebbero richiesto interventi ambulatoriali o di ospedalizzazione, depone senza dubbio per un miglioramento della qualità della vita
Con riferimento specifico alla popolazione pediatrica, è stata documentata – dopo la vaccinazione – una riduzione del 94-97% dell’incidenza di MIP causata dai sierotipi del vaccino e una riduzione complessiva del 75% dell’incidenza di MIP nei bambini di età < 5 anni [1, 6]. Per quanto riguarda la situazione italiana, lo studio osservazionale condotto da Camilli et al. tra il 2008 e il 2014 in 5 regioni italiane ha evidenziato che nella fascia di età 0-4 anni, si è assistito a una progressiva diminuzione, pari al 61%, dell’incidenza di MIP, passando da 7,8 casi/100.000 abitanti nel 2008 a 3 casi/100.000 nel 2014. La riduzione maggiore si è osservata nel gruppo di età < 1 anno, in cui l’incidenza di MIP è scesa da 12,9 a 4,6 casi/100.000 abitanti (Cfr. Capitolo 1).
Globalmente, la mortalità nei bambini di età < 5 anni è diminuita da oltre 1 milione di decessi nel 2000 a circa 300.000 decessi nel 2015, con l’onere maggiore nei Paesi in via di sviluppo. L’uso diffuso dei PCV è stato associato a una significativa riduzione delle ospedalizzazioni per polmonite, del carriage nasofaringeo e della MIP causata dai sierotipi inclusi in questi vaccini, sia nei bambini vaccinati che negli individui non vaccinati di altre fasce d’età [5].
L’impiego preventivo, diagnostico o terapeutico di una tecnologia sanitaria va sempre subordinato all’adesione libera e responsabile del soggetto interessato. Dopo un’informazione completa e comprensibile, va, infatti, rilevato il consenso o l’assenso nel caso in cui il destinatario sia un minore in grado di esprimere la propria adesione al trattamento. È quanto previsto anche dalla Legge 219/2017, che all’articolo 3, comma 1, recita quanto segue: “La persona minore di età […] deve ricevere informazioni sulle scelte relative alla propria salute in modo consono alle sue capacità per essere messa nelle condizioni di esprimere la sua volontà” [22]. Nel caso del piccolo minore, la scelta è a carico dei genitori che dovranno agire avendo “come scopo la tutela della salute psicofisica e della vita del minore nel pieno rispetto della sua dignità” (art. 3, comma 2) e come criterio di riferimento lo standard del miglior interesse del bambino [23]. Per essere legalmente valido e moralmente accettabile, il consenso dovrà essere specifico, libero e consapevole. Il soggetto interessato deve conoscere il trattamento, i benefici ricercati, i rischi prevedibili e le eventuali alternative.
Nel caso delle vaccinazioni, le questioni sul consenso informato sono riconducibili a quelle generali di altri trattamenti sanitari, anche se vanno tenuti presenti alcuni elementi specifici. Ad esempio, la dimensione di massa, che accompagna la somministrazione dei vaccini, non deve indurre i medici ad acquisire il consenso o l’assenso in modo approssimativo, né a somministrare i vaccini in modo poco attento senza valutare le condizioni fisiche e mentali del soggetto da vaccinare. Per i minori, va tenuta presente anche la possibilità di un loro dissenso alla vaccinazione, che potrebbe anche non coincidere con la volontà espressa dai genitori.
La somministrazione di PVC15 va, quindi, sempre preceduta da un colloquio personalizzato con il soggetto da vaccinare o, nel caso di un minore, con/anche con i genitori. I medici dovranno spiegare i benefici della vaccinazione rispetto alla possibilità di contrarre la patologia e la responsabilità morale di accedere alla vaccinazione per proteggere sé stessi e i soggetti più vulnerabili [24].
La possibilità di disporre di un vaccino con un profilo di efficacia/tollerabilità/sicurezza favorevole e in grado di assicurare una buona qualità di vita a fronte delle infezioni pneumococciche e delle MIP dovrebbe comportare come logica conseguenza la possibilità di fornirlo a tutti coloro che rispondono ai criteri stabiliti negli studi clinici. La limitatezza delle risorse disponibili in sanità potrebbe, però, porre il problema se sia possibile garantire questo trattamento a tutti.
Assicurare giustizia significa sia rispettare l’uguaglianza tra tutti gli esseri umani (principio di equità), sia rispondere alle necessità specifiche di ciascuno in relazione al proprio stato di salute/malattia (principio della differenza). In tal modo, il paziente diviene l’unità di misura nella prassi clinica, la protezione della salute e della vita il valore fondamentale, la giustizia lo strumento di tutela di questo valore. La valutazione del rapporto rischi/benefici deve, allora, precedere sempre quella del rapporto costi/benefici nella scelta di un trattamento. Nella valutazione dell’impatto economico di PCV, vanno presi in considerazione non solo i costi diretti (ospedalizzazione, procedure diagnostiche, trattamenti terapeutici, ecc.) e indiretti (perdita di giorni di lavoro per i pazienti e per i caregivers), ma anche i costi intangibili (dolore e sofferenza, generati dalla condizione di malattia), che già di per sé potrebbero giustificare il ricorso tra vaccinazione e non vaccinazione, ma anche tra vaccinazione e malattia prevenuta.
Per quanto riguarda il rapporto costo/efficacia di PCV nella popolazione pediatrica, sono da segnalare i due studi di Hu et al. e lo studio di Wasserman et al. [4].
Lo studio di Hu et al, pubblicato nel 2020, aveva come obiettivo la stima dei casi di MIP e OMA causate da V114 tipi, tra i bambini negli Stati Uniti e la loro possibile riduzione con il ricorso ai PCV [3]. È stata fatta una stima del numero di casi di MIP e OMA di tipo V114 e dei costi in un’ipotetica coorte di nati non vaccinati negli Stati Uniti in 20 anni. Sono stati analizzati tre periodi di tempo, utilizzando dati epidemiologici specifici per determinare il numero di casi di MIP e OMA associati a tutti i 15 sierotipi in V114. I periodi sono stati: (1) pre-PCV7 (1999); (2) pre-PCV13 (2009); (3) post-PCV13 (2017). I costi sono stati stimati da una prospettiva sociale (dollari USA 2018) e scontati al 3%. Il modello di analisi utilizzato ha stimato 18.983 casi di MIP e 5,4 milioni di casi di OMA associati a sierotipi V114 pre-PCV7, 4.697 casi di MIP e 3,0 milioni di casi di OMA pre-PCV13 e 948 casi di MIP e 0,2 milioni di casi di OMA post-PCV13. I costi totali associati ai sierotipi V114 erano 1,7 miliardi di dollari pre-PCV7, 730 milioni di dollari pre-PCV13 e 75 milioni di dollari post-PCV13.
Uno studio simile ha riguardato otto Paesi europei (Danimarca, Francia, Germania, Italia, Norvegia, Spagna, Svizzera e Regno Unito), in cui è stata fatta una stima dei casi di MIP di tipo V114 e i costi in ipotetiche coorti di nati non vaccinati per oltre 20 anni. I casi e i costi di MIP sono stati calcolati per tre periodi utilizzando dati epidemiologici specifici: (a) pre-PCV7; (b) pre-PCV13; e (c) post-PCV13. I costi sono stati stimati da una prospettiva sociale (2018 euro) e scontati al 3% [8]. Il modello ha stimato che 4.649 casi di MIP nel periodo pre-PCV7, 3.248 casi nel periodo pre-PCV13 e 958 casi nel periodo post-PCV13 sono attribuibili ai sierotipi V114. I costi totali attualizzati associati ai sierotipi V114 sono stati di 109,1 milioni di euro (periodo pre-PCV7), 65,7 milioni di euro (periodo pre-PCV13) e 18,7 milioni di euro (periodo post-PCV13). Ne consegue che i nuovi vaccini pneumococcici pediatrici dovranno continuare a mantenere, oltre ai nuovi aggiunti, anche i sierotipi nei vaccini autorizzati al fine di mantenere la riduzione della malattia e di estendere la copertura ai sierotipi non vaccinali.
Lo studio di Wasserman et al. [4] aveva come obiettivo la stima dell’onere clinico ed economico annuale della malattia pneumococcica attribuibile ai vaccini autorizzati (PCV10 e PCV13) e ai PCV in fase sperimentale, in particolare ai vaccini 15-valente (PCV15) e 20-valente (PCV20), in 13 Paesi nei bambini di età inferiore ai 5 anni [4]. A tale scopo è stato creato un modello analitico decisionale per aggregare i casi totali (comprensivi di MIP, polmonite e OMA), decessi e costi diretti in ciascun Paese incluso nello studio (stratificati a seconda dei programmi nazionali di immunizzazione) per 1 anno, utilizzando i dati di copertura del sierotipo disponibili fino ai tre anni più recenti. I risultati di questa analisi dimostrano che esiste un sostanziale bisogno insoddisfatto dovuto ai sierotipi non coperti dai PCV attualmente autorizzati nei Paesi considerati in questo studio (PCV10 e PCV13). In particolare, tra il 46 e il 77% delle patologie pneumococciche rimanenti è dovuto ai sierotipi che sarebbero coperti dal PCV20 nei 13 Paesi inclusi in questa analisi. Ciò corrisponde a circa 1,23 milioni di casi, 160 decessi e 214 milioni di dollari di costi medici diretti all’anno nei Paesi inclusi. È importante che i vaccini sperimentali continuino a proteggere contro i sierotipi contenuti nei vaccini attualmente autorizzati, dal momento che i sierotipi rimasti eventualmente scoperti potrebbero causare, comunque, malattie significative.
Lo studio di Amicizia et al. del 2022 effettuato in Liguria, che considera nel periodo 2012-2018 una popolazione di bambini di età < 15 anni con MIP e OMA, visitati in pronto soccorso e/o ricoverati, evidenzia che i costi dovuti alla sola polmonite pneumococcica hanno mostrato un decremento da € 194.813 nel 2012 a € 73.111 nel 2018 (Cfr. Capitolo 1).
La valutazione economica dell’introduzione del PCV15 in Italia, riportata nel Capitolo 4 del presente report, è basata su un modello di trasmissione dinamica, adottando la metodologia più appropriata per la valutazione economica dei vaccini [25]. Il modello, stratificato per fasce d’età e sierotipi di S. pneumoniae circolanti, tiene conto dei dati di sorveglianza italiani della MIP, delle polmoniti non batteriemiche e delle otiti medie acute; i costi e gli effetti sono stati monitorati su un orizzonte temporale di 50 anni (2070) ed è stato adottato un tasso di sconto del 3% per costi e benefici. Secondo il modello, la sostituzione del PCV13 con il PCV15 nella fascia pediatrica porterebbe a una riduzione di 5.328 morti, un guadagno di 14.708 QALY e un risparmio di 277.157.492 €. Questi numeri risultano anche maggiori nello scenario che considera l’utilizzo di PCV15 anche negli adulti, arrivando a una riduzione di 5.745 morti, un guadagno di 15.811 QALY e un risparmio di 301 milioni di euro a valori scontati. Il beneficio evidenziato dal modello dipenderebbe dalla diminuzione, soprattutto, della malattia pneumococcica invasiva in tutte le fasce d’età e, in particolare, dei casi in età pediatrica dovuti ai sierotipi 3, 22F e 33F.
Secondo la valutazione economica, pertanto, l’introduzione del PCV15 sarebbe una strategia altamente costo-efficace, che permetterebbe un importante risparmio economico per il Servizio Sanitario Nazionale.
Dalla valutazione fin qui svolta emerge che PCV15 è immunogeno ed efficace nella protezione contro l’infezione e le malattie da S. pneumoniae nella popolazione pediatrica. I vantaggi in termini di guadagno di salute, miglioramento della qualità di vita e riduzione dei livelli di morbosità/mortalità in caso di MIP dovrebbero spingere i decisori a considerare questa opportunità. Inoltre, è di fondamentale rilevanza investire in interventi di educazione alla salute per promuovere la vaccinazione con PCV15 a tutta la popolazione pediatrica italiana. Secondo il Piano Nazionale Prevenzione Vaccinale 2017-2019, il vaccino pneumococcico coniugato è raccomandato per i nuovi nati e viene somministrato simultaneamente alla vaccinazione con esavalente. Al fine di raggiungere l’obiettivo di copertura vaccinale individuato dal Piano del 95%, sono necessarie molteplici azioni, tra cui il coinvolgimento dei pediatri di famiglia e delle scuole, la vaccinazione in co-somministrazione e l’utilizzo delle nuove tecnologie sia per la comunicazione sia per la gestione delle vaccinazioni (Cfr. Capitolo 5) [26].
Sulla base dei dati a disposizione, il giudizio etico è –quindi – complessivamente positivo. I decision-makers dovranno, comunque, porre particolare attenzione ai seguenti aspetti:
la necessità di predisporre colloqui personalizzati in fase di somministrazione del vaccino, che prendano in esame tutte le variabili legate alla condizione clinica del soggetto interessato;
la verifica di un uguale accesso al vaccino da parte della popolazione pediatrica;
un’adeguata attenzione alla vaccino-vigilanza;
l’organizzazione di campagne di educazione vaccinale anche a partire dall’epoca della gravidanza in modo da sensibilizzare le mamme alla vaccinazione anti-pneumococcica che, seppur solo raccomandata, è molto utile per tutti i bambini;
una capillare informazione della popolazione su: la possibilità di contrarre la malattia pneumococcica più di una volta, con la raccomandazione di vaccinarsi contro lo pneumococco anche se si è avuta la malattia in passato; l’aumento della probabilità di contrarre la malattia pneumococcica in caso di influenza.
Questo capitolo sintetizza gli aspetti più rilevanti emersi dalla valutazione HTA del vaccino coniugato antipneumococcico 15-valente (PCV15) per la prevenzione delle infezioni da S. pneumoniae in età pediatrica.
S. pneumoniae rappresenta l’agente eziologico più comune delle malattie batteriche invasive, con quadri clinici severi, come meningite e sepsi, o meno gravi, come batteriemie o polmoniti batteriemiche. Più frequentemente, S. pneumoniae è responsabile di quadri localizzati, quali infezioni delle prime vie respiratorie, otiti e polmoniti.
La popolazione pediatrica, e nello specifico quella di età inferiore ai 2 anni di vita, rappresenta il gruppo a maggior rischio di infezione e, insieme agli anziani, quello con maggiore “burden of disease”.
L’introduzione della vaccinazione pediatrica anti-pneumococcica, disponibile a partire dagli anni 2000, ha nel tempo cambiato l’epidemiologia delle malattie invasive pneumococciche (MIP), con un carico di malattia oggi attribuibile principalmente ai sierotipi non contenuti nei vaccini coniugati (sostituzione dei sierotipi o serotype replacement).
I dati epidemiologici italiani dimostrano come l’incidenza delle MIP sia progressivamente diminuita con l’introduzione della vaccinazione. In epoca pre-vaccinale, l’incidenza nella popolazione al di sotto dei 5 anni, mostrava valori variabili da 3,5 a 50 casi su 100.000 a seconda delle modalità di rilevazione e dal setting di studio. Con l’introduzione della vaccinazione l’incidenza è diminuita raggiungendo valori compresi tra 1,6 e 3 su 100.000. Occorre sottolineare che i valori più elevati si registrano nella fascia di età al di sotto di 1 anno. Infatti, come si evince dal sistema di sorveglianza nazionale, l’incidenza media nel periodo 2011-2021 è stata di 4,33 per 100.000 e di 1,7 su 100.000 nei bambini tra 1 e 4 anni. Decisamente più bassi sono i valori osservati nelle fasce di età 5-9 e 10-14 anni.
I sierotipi responsabili di malattia si sono progressivamente modificati con un aumento delle forme dovute ai sierotipi 3, 8, 12F e 22F e una riduzione di quelle imputabili ai sierotipi 1, 19A e 6A. Secondo i dati provenienti dalla sorveglianza nazionale italiana i sierotipi maggiormente riscontrati nel periodo 2011-2021 sono stati l’1, il 3, l’8, il 14, il 19A, il 19F, il 22F e il 33F. Una revisione di letteratura ha messo in evidenza come in Italia i sierotipi 1, 14, 9V, 3 e 19A siano maggiormente coinvolti nei casi di polmonite complicata, mentre il 3, il 19A, il 23F e il 6B siano più frequentemente associati a meningite.
Le MIP possono determinare lo sviluppo di una serie di complicanze tra le quali, le più temibili, sono quelle neurologiche successive all’interessamento del sistema nervoso centrale che possono riguardare fino a circa un quinto dei soggetti colpiti. Tra le altre sequele, la letteratura scientifica riporta anche paralisi (~ 21,4%), perdita dell’udito, talvolta bilaterale (1,4-5%) e disabilità dello sviluppo con ritardi motori (1,4-7%).
La letalità delle MIP, in età pediatrica, è trascurabile e dagli studi italiani risulta variabile dal 3 all’8%.
Accanto alle MIP non vanno dimenticate le forme non invasive di malattia pneumococcica, in particolare le polmoniti e, in età pediatrica, le otiti. Di queste forme i dati di cui disponiamo provengono da studi primari che, per quanto riguarda le polmoniti, hanno riportato tassi di ospedalizzazione variabili a seconda del periodo e della popolazione in studio compresi tra 13 e 45 su 100.000 nella fascia di età 0-5 anni e inferiori nelle età successive. Gli studi sulle otiti si sono spesso concentrati sui casi non eziologicamente confermati e hanno registrato stime variabili, di circa 200 casi ogni 1.000 bambini al di sotto dei 5 anni.
Occorre evidenziare che, la diversa partecipazione delle Regioni italiane alle attività di sorveglianza rende ancora difficile, al momento, definire con esattezza i ceppi batterici responsabili delle infezioni, l’esatta quota di casi prevenibili con le vaccinazioni e l’eventuale aumento di sierotipi non presenti nei vaccini attualmente disponibili. Risulta, quindi, importante, come anche raccomandato dall’OMS, l’ulteriore implementazione di attività di sorveglianza attiva e la successiva condivisione, a livello internazionale e nazionale, dei dati.
Oltre al dato epidemiologico, il crescente problema dell’antibiotico-resistenza giustifica l’interesse nei confronti della prevenzione di tali infezioni. Nell’ambito degli studi analizzati nel presente report, i saggi di sensibilità effettuati sui ceppi isolati di pneumococco hanno rilevato, in Italia, una resistenza alla penicillina del 5-57,1%, soprattutto per i sierotipi 9V, 19F e 23F. Valori maggiori sono stati riscontrati in merito alla resistenza ai macrolidi, in particolare all’eritromicina, con un range variabile tra il 20 e l’83%, soprattutto a carico dei sierotipi 6B, 19A, 14, 19F, 15A/B e 23F.
Oltre a determinare un rilevante burden clinico, le malattie pneumococciche sono anche responsabili di un burden economico dovuto sia all’assorbimento di risorse sanitarie che alla generazione di costi indiretti.
Uno studio italiano riporta un costo totale annuo di € 4,5 milioni per i ricoveri causati da malattia pneumococcica nella popolazione di 0-4 anni. Va tuttavia ricordato che, specie nei casi complicati, si generano importanti costi indiretti. Un altro studio italiano ha, infatti, stimato un costo a carico del SSN di un caso di meningite pneumococcica pari a € 10.692 e di € 12.903 per la società. Le otiti medie acute generano un costo di circa € 500 a episodio.
Il Piano Nazionale di Prevenzione Vaccinale (PNPV) 2017-2019 e il nuovo PNPV 2023-2025, in fase di approvazione, raccomandano la somministrazione del vaccino coniugato a partire dal 61° giorno di vita con la schedula 2 + 1 con le dosi somministrate al 3°, 5° e 11°/13° mese di vita. I vaccini disponibili, oltre a quello 15-valente oggetto di valutazione di questo report, sono:
vaccino coniugato 10-valente (PCV10). Si è dimostrato altamente immunogeno capace di stimolare livelli anticorpali protettivi (sia anticorpi totali sia anticorpi opsonizzanti) per tutti i sierotipi vaccinali seppur con variazioni sierotipo specifiche. La dose booster, prevista nel secondo anno di vita, induce risposte immunitarie robuste per tutti i sierotipi contenuti nel vaccino. È risultato non inferiore al vaccino 7-valente (PCV7) per i sierotipi comuni e ha dimostrato una superiorità nella risposta anticorpale verso i sierotipi aggiuntivi (1, 5 e 7F). Si è dimostrato efficace nel prevenire le MIP da sierotipi vaccinali sebbene con differenze sierotipo specifiche. Inoltre, le evidenze disponibili hanno riportato dati di efficacia riferiti alla prevenzione sia delle otiti medie acute clinicamente definite sia di quelle batteriologicamente confermate, supportando un effetto positivo della vaccinazione. Infine, i dati di letteratura restituiscono dati di impatto significativo anche sulla prevenzione delle ospedalizzazioni per polmonite comunitaria. Pochi dati sul fallimento vaccinale/breakthrough riferiti alla vaccinazione con PCV10 sono disponibili in letteratura. I principali sierotipi associati a tale fenomeno sono risultati il 14, il 6B e il 19A. Il profilo di sicurezza e tollerabilità è soddisfacente. La maggior parte degli eventi avversi osservati, sia negli studi sperimentali controllati sia negli studi osservazionali sia nelle sorveglianze post-marketing, erano associati a reazioni locali di natura transitoria e autorisolutiva. L’evento avverso sistematico maggiormente riportato è stato la febbre. Rari eventi avversi gravi correlati all’utilizzo del PCV10 sono stati osservati nelle sorveglianze post-marketing. Questo vaccino può essere co-somministrato con altri vaccini pediatrici di routine senza provocare interferenze significative in termini sia di risposta immunitaria sia di frequenza di eventi avversi;
vaccino coniugato 13-valente (PCV13). Si è dimostrato altamente immunogeno e capace di elicitare livelli anticorpali protettivi (sia anticorpi totali sia anticorpi opsonizzanti) per tutti i sierotipi vaccinali seppur con variazioni sierotipo specifiche. È stato osservato che la dose di richiamo nel secondo anno di vita è in grado di stimolare risposte immunitarie robuste per tutti i sierotipi. È risultato non inferiore al PCV7 per i sierotipi comuni ed è stata osservata una superiorità nella risposta anticorpale verso i sierotipi aggiuntivi (1, 3, 5, 6A, 7F e 19). Inoltre, il vaccino si è dimostrato efficace nel prevenire i casi di MIP, nel ridurre le ospedalizzazioni per polmonite comunitaria e nel prevenire sia i casi di otite media clinicamente definiti sia quelli batteriologicamente confermati. Tale risultato determina un impatto significativo diretto sui soggetti vaccinati e indiretto sulla collettività. I dati derivanti da studi specifici con l’obiettivo di valutare il fallimento/breakthrough della vaccinazione con PVC13 hanno evidenziato che il fenomeno è raro e spesso correlato alla presenza di comorbilità nei soggetti immunizzati. Nello specifico i sierotipi 3 e 19A sono risultati quelli più frequentemente riportati nei fallimenti vaccinali seguiti dal sierotipo 19F. Il profilo di reattogenicità è buono. La maggior parte degli eventi avversi riportati sia dagli studi sperimentali controllati che negli studi osservazionali erano di moderata entità, di natura transitoria e generalmente comprendevano reazioni nel sito di inoculo (dolorabilità e indurimento). L’evento avverso più frequente è stato la febbre. Gli eventi avversi gravi sono stati rari. Le sorveglianze post-marketing hanno confermato il buon profilo di sicurezza osservato negli studi sperimentali controllati e gli eventi avversi gravi sono stati rari. Il PCV13 può essere co-somministrato con altri vaccini pediatrici di routine senza provocare alcuna interferenza significativa sia con la risposta immunitaria sia con la frequenza degli eventi avversi.
In generale, le evidenze raccolte nel presente report, mediante revisione di letteratura, hanno dimostrato anche un beneficio dei programmi di immunizzazione dell’infanzia con i PCV sull’antibiotico resistenza poiché si stima che nel 15-30% dei casi di infezione da pneumococco si possa avere resistenza a uno o più antibiotici. Nei Paesi nei quali è stata osservata una resistenza antimicrobica elevata allo pneumococco, i programmi di vaccinazione nell’infanzia con PCV13 hanno ridotto le MIP resistenti agli antibiotici, le otiti medie e lo stato di carriage nei bambini. Inoltre, si è osservato un decremento dei casi di MIP negli adulti. Infine, alcuni studi hanno osservato effetti indiretti positivi della vaccinazione pneumococcica, evidenziando che i programmi di immunizzazione con i vaccini coniugati nell’infanzia porteranno nel medio termine (un decennio) a una protezione sostanziale di tutta la popolazione in termini di diminuzione di malattia invasiva e non invasiva.
In aggiunta, occorre sottolineare che, sebbene il vaccino polisaccaridico 23-valente (PPV23) sia autorizzato per l’immunizzazione attiva contro l’infezione pneumococcica in soggetti di età ≥ 2 anni, non è di fatto utilizzato nella pratica vaccinale di routine per la popolazione pediatrica. Quest’ultimo vaccino è raccomandato con la schedula sequenziale PCV/PPV23 (una prima dose di PCV seguita ad almeno 8 settimane di distanza da una dose di PPV23) nei bambini ad alto rischio di malattia grave come da indicazioni del vigente PNPV.
La ricerca sistematica della letteratura disponibile condotta nell’ambito della presente valutazione HTA ha permesso di individuare 14 randomized controlled trial (RCT) di fase I-III. Tutti gli studi inclusi sono stati giudicati a basso rischio di bias. Dall’analisi di queste evidenze di alta qualità è emerso quanto segue:
il PCV15 è altamente immunogeno (dal punto di vista sia di anticorpi totali sia di anticorpi opsonizzanti) verso tutti i 15 sierotipi. Seppur con qualche variazione sierotipo specifica, la quasi totalità dei bambini vaccinati con il PCV15 ha raggiunto il livello anticorpale ≥ 0,35 μg/ml, ritenuto protettivo nei confronti delle MIP;
nei RCT di fase III, il PCV15 si è dimostrato non inferiore al PCV13 per tutti i 13 sierotipi in comune.
in tutti gli studi analizzati, il PCV15 ha dimostrato una netta superiorità nella risposta umorale verso i sierotipi unici 22F e 33F;
gli aspetti di immunogenicità sono stati studiati in diverse popolazioni, tra cui: (i) le principali fasce di età pediatriche; (ii) le principali schedule vaccinali utilizzate nel mondo; (iii) nei bambini sia naïve sia precedentemente vaccinati con almeno una dose di PCV7/PCV10/PCV13; (iv) nei bambini nati a termine di gravidanza o pre-termine; (v) nei bambini sani e nelle popolazioni speciali, tra cui i bambini affetti da alcune condizioni di immunocompromissione, come HIV o anemia falciforme. I dati di immunogenicità ottenuti non dimostrano variazioni significative a seconda del gruppo di popolazione studiata, indicando quindi la coerenza e la solidità delle prove di efficacia disponibili;
il PCV15 è interscambiabile con il PCV13, vale a dire che il PCV13 può essere sostituito con il PCV15 in qualsiasi momento del ciclo vaccinale. La dimostrata interscambiabilità può avere un ruolo importante in determinate situazioni come, ad esempio, problematiche relative all’approvvigionamento di un vaccino;
il profilo di reattogenicità, tollerabilità e sicurezza di PCV15 è accettabile ed è simile a quello del PCV13. La maggior parte degli eventi avversi è transitoria, autorisolutiva e di natura da lieve a moderata. Gli eventi avversi seri correlati all’utilizzo del PCV15 sono molto rari;
il PCV15 può essere co-somministrato con altri vaccini pediatrici di routine senza provocare un’interferenza clinicamente significativa sia con la risposta immune umorale sia con la frequenza degli eventi avversi;
diversi RCT hanno dimostrato una maggiore risposta anticorpale verso il sierotipo 3 nei bambini vaccinati con il PCV15 rispetto a quelli immunizzati con PCV13. Nel triennio 2008-2010, il sierotipo 3 è stato identificato nell’11% dei casi di MIP in Italia. La MIP causata dal sierotipo 3 può essere più severa e alcune evidenze suggeriscono che esso può evadere la risposta anticorpale. Inoltre, la popolazione attuale del sierotipo 3 è composta da diversi lignaggi, ciascuno dei quali presenta caratteristiche differenti. Infatti, un’analisi dei casi di MIP tra i bambini di età 2-59 mesi in Catalogna ha documentato che i due terzi (66,7%; 16/24) di tutti i fallimenti vaccinali con il PCV13 era dovuto al sierotipo 3. Sono quindi auspicabili ulteriori studi (sia di immunogenicità sia di efficacia) al fine di verificare se la maggiore immunogenicità del PCV15 nei confronti del sierotipo 3 possa portare all’ulteriore riduzione dell’incidenza di MIP dovuta a questo sierotipo, quale principale vaccine evader.
In sintesi, i dati di alta qualità sull’efficacia (approssimati tramite i parametri di immunogenicità) e sulla sicurezza indicano un buon profilo rischio-beneficio del PCV15.
Le valutazioni economiche dei nuovi vaccini sono una parte fondamentale delle valutazioni di HTA in quanto rappresentano un’informazione cruciale per aiutare i decisori a valutare costi e benefici delle diverse strategie vaccinali. Negli ultimi anni sono stati pubblicati in letteratura numerosi modelli di trasmissione dinamica dello S. pneumoniae che non includevano valutazioni di costo-efficacia dei diversi vaccini disponibili. Tuttavia, è importante sottolineare come le valutazioni economiche non sono tipicamente basate su modelli dinamici di trasmissione, non considerando così gli effetti positivi dell’immunità di gregge, che è invece cruciale per aiutare gli stakeholders a prendere decisioni di valore sulla progettazione delle strategie vaccinali.
Pertanto, al fine di valutare l’impatto dell’introduzione di PCV15 in età pediatrica in Italia è stato sviluppato un modello di trasmissione dinamica in Mathematica® 13.1, stratificato per età e che incorpora la vaccinazione per età e sierotipo nella popolazione pediatrica e adulta al fine di stimare e confrontare i risultati sanitari ed economici della vaccinazione pediatrica di routine con PCV15 (rispetto a PCV13), dalla prospettiva sia del SSN sia sociale.
Il modello a trasmissione dinamica sviluppato per il presente report HTA permette di stimare che l’introduzione della vaccinazione con PCV15 rappresenta una strategia dominante e quindi cost-saving per il SSN e per la società, rispetto alla strategia vaccinale con PCV13. Negli scenari analizzati, l’introduzione di PCV15 si associa, su un orizzonte temporale di 50 anni, a un risparmio di circa 282,5 milioni di euro, nonostante il costo aggiuntivo derivante all’introduzione di PCV15. Nel dettaglio, questo vantaggio è associato a un risparmio di 62 milioni di euro relativo ai costi delle MIP (di cui 38 milioni di euro di costi evitati per la cura delle batteriemie e 24 milioni per le meningiti), di 2,6 milioni di euro per la gestione delle sequele post-meningite (PMS), di 209 milioni di euro correlati ai costi delle polmoniti pneumococciche non batteriemiche (NBPP) e 9 milioni di euro di costi per la gestione delle otiti medie acute (OMA).
L’introduzione del nuovo PCV15, in accordo alla posologia corrente (2 + 1 dosi entro gli 11 mesi di vita) porterebbe a un miglioramento significativo della qualità di vita della popolazione di ogni età con un guadagno di 15.811 QALY.
Per rendere la valutazione più robusta, a causa dell’incertezza di alcuni parametri, la simulazione è stata ripetuta considerando due scenari alternativi: uno in cui sono state modificate le stime di Vaccine Efficacy (VE) contro il carriage (VEc), ipotizzando una maggiore VEc verso il sierotipo 3, e uno in cui le coperture vaccinali nell’adulto sono state ipotizzate al 75%, come previsto dal PNPV. I risultati di queste analisi aggiuntive hanno confermano i risultati del caso base, a eccezione dello scenario in cui l’efficacia verso il carriage varia e, in tal caso, si osserva un lieve aumento dei casi di malattia non invasiva a fronte di una riduzione marcata, rispetto al caso base, delle forme invasive (-23.064 casi di MIP vs scenario base). Dal punto di vista della costo-efficacia, tutte le strategie che prevedono l’inclusione di PCV15 risultano dominanti; solo nel caso delle analisi aggiuntive il beneficio della vaccinazione con PCV15 sui sierotipi aggiuntivi e sul sierotipo 3 non compenserebbe del tutto l’aumento di incidenza della malattia non invasiva. Dal punto di vista economico, questo scenario è comunque altamente costo-efficace per il SSN e la Società avendo un ICER di 716 euro, in quanto si associa a minori costi per la gestione delle patologie pneumococciche e a migliori esiti sanitari misurati in QALY e anni di vita guadagnati.
Questo modello, grazie alle sue assunzioni e agli scenari valutati, consente di apprezzare lo spettro delle ricadute cliniche di una nuova strategia vaccinale rispetto all’attuale raccomandazione, tenendo conto del potenziale impatto favorevole della vaccinazione con PCV15 rispetto a quella con PCV13 nel contesto epidemiologico e demografico italiano.
I vaccini antipneumococcici si sono dimostrati lo strumento di prevenzione più efficace nei confronti delle infezioni da S. pneumoniae tanto che la stessa OMS ha dichiarato come la prevenzione vaccinale delle malattie pneumococciche, di concerto con un adeguato sistema di sorveglianza delle malattie invasive, sia un obiettivo prioritario di salute, tanto per i Paesi industrializzati quanto per quelli in via di sviluppo.
In un’ottica di Sanità Pubblica risulta, pertanto, necessario riuscire a raggiungere e mantenere nel tempo a livello nazionale una copertura vaccinale del 95%, valore minimo ritenuto necessario per potere considerare significativamente protetta la popolazione, in particolare i soggetti a maggior rischio. Tuttavia, in accordo con le coperture rese note dal Ministero, in Italia nel 2021 la copertura antipneumococcica a 24 mesi è stata pari al 91,25% (range 71,7% Prov. Autonoma Bolzano - 94,5% Umbria e Molise).
Per incrementare tali coperture è necessario puntare a una riorganizzazione dell’offerta vaccinale che preveda il coinvolgimento attivo dei pediatri di famiglia, un ampliamento dell’offerta vaccinale territoriale (ampliamento orari e giorni di apertura e locali dedicati per le vaccinazioni del neonato), la promozione della co-somministrazione dei vaccini iniettivi nel primo anno di vita, in accordo con le indicazioni del PNPV.
Fondamentale per il raggiungimento di alte coperture vaccinali è tentare di recuperare, attraverso iniziative mirate, tutti quei soggetti che per vari motivi (esitazione vaccinale, problemi logistici, mancata informazione ecc.) non hanno aderito alla vaccinazione. Tale recupero vaccinale si potrebbe ottenere tramite un miglioramento dell’offerta vaccinale sia rafforzando numerosità e distribuzione nel territorio dei punti vaccinali sia coinvolgendo altri attori quali gli ospedali e la medicina territoriale (MMG, PLS, case di comunità).
Infine, la partecipazione attiva delle scuole potrebbe rendere le stesse, importanti luoghi di promozione attiva delle vaccinazioni, in particolare quelle dell’infanzia e dell’adolescenza.
Un’adeguata ed efficace formazione continua e costante degli operatori sanitari coinvolti a tutti i livelli nel processo vaccinale nonché un’adeguata ed efficace informazione della popolazione, tramite anche l’utilizzo delle nuove tecnologie, permetterebbe d’intraprendere interventi sia correttivi che innovativi con il risultato di trasferire corrette informazioni e di rassicurare riguardo tutte quelle preoccupazioni immotivate insite nei cittadini.
L’obbligatorietà vaccinale, che inevitabilmente porta i cittadini a interfacciarsi con i centri di prevenzione, si è dimostrata un’ottima occasione per informare la popolazione sulle vaccinazioni raccomandate e migliorare le coperture vaccinali.
Ulteriore strumento che potrebbe risultare basilare nell’ottimizzare la gestione e l’implementazione dei servizi vaccinali sarebbe il completamento della realizzazione dell’anagrafe nazionale vaccini che consentirebbe di avere un flusso di dati, sia a livello regionale che nazionale, completo e in tempo reale.
Infine, sarebbe fondamentale sostenere lo sviluppo di una vera e propria “cultura vaccinale”, atta a trasmettere una maggiore consapevolezza sul valore delle vaccinazioni.
Dalla valutazione condotta emerge che PCV15 è immunogeno ed efficace nella protezione contro le malattie da S. pneumoniae nella popolazione pediatrica. I vantaggi in termini di guadagno di salute, miglioramento della qualità di vita e riduzione dei livelli di morbosità/mortalità in caso di MIP dovrebbero spingere i decisori a considerare questa opportunità. Inoltre, è di fondamentale rilevanza investire in interventi di educazione alla salute per promuovere la vaccinazione con PCV a tutta la popolazione pediatrica italiana.
Sulla base dei dati a disposizione, il giudizio etico è complessivamente positivo. I decision-makers dovranno, comunque, porre particolare attenzione ai seguenti aspetti:
la necessità di predisporre colloqui personalizzati in fase di somministrazione del vaccino, che prendano in esame tutte le variabili legate alla condizione clinica del soggetto interessato;
la verifica di un uguale accesso al vaccino da parte della popolazione pediatrica;
un’adeguata attenzione alla vaccino-vigilanza;
l’organizzazione di campagne di educazione vaccinale anche a partire dall’epoca della gravidanza in modo da sensibilizzare le mamme alla vaccinazione anti-pneumococcica che, seppur solo raccomandata, è molto utile per tutti i bambini;
una capillare informazione della popolazione su: la possibilità di contrarre la malattia pneumococcica più di una volta, con la raccomandazione di vaccinarsi contro lo pneumococco anche se si è avuta la malattia in passato; l’aumento della probabilità di contrarre la malattia pneumococcica in caso di influenza.
Alla luce delle nuove opportunità in ambito di prevenzione delle malattie da pneumococco, capaci di offrire una più ampia copertura sierotipica, è prioritario definire strategie vaccinali che offrano il massimo beneficio per ogni fascia d’età al fine di massimizzare i risultati in termini di salute e di risparmio economico e garantire un’adeguata protezione per l’intera collettività.
Dalla valutazione condotta nell’ambito del presente report di HTA e riassunta nei paragrafi precedenti, emerge che la sostituzione del PCV13 con il PCV15 nella scheda vaccinale pediatrica italiana risulta una scelta raccomandabile alla luce del potenziale di PCV15 nel ridurre ulteriormente i casi di MIP e di altre forme di malattie pneumococciche dovute ai sierotipi 22F e 33F, nonché a una potenziale maggiore risposta anticorpale verso il sierotipo 3 – associato a forme cliniche più severe di MIP – e, quindi, alla luce del risparmio che deriverebbe dal suo utilizzo.