Abstract
目的
探讨胎盘间充质干细胞(placental-derived mesenchymal stem cells, P-MSCs)移植对脓毒症小鼠肠道损伤的保护作用与机制。
方法
将24只小鼠随机均分为3组:假手术(Sham)组、脓毒症(CLP)组与胎盘间充质干细胞治疗(CLP+P-MSCs)组。假手术组小鼠仅开腹游离盲肠后还纳,其余2组采用盲肠结扎穿孔法(CLP)构建脓毒症模型。Sham组和CLP组均于术后1 h经尾静脉注射0.9%NaCl 0.1 mL,CLP+P-MSCs组于术后1 h输注P-MSCs 2×105个。P-MSCs移植24 h后收集各组小鼠肠道和血液样本。肠道组织经HE染色后进行病理评估,酶联免疫吸附法对血清D-乳酸、二胺氧化酶(DAO)、内毒素、IL-1β、TNF-α、IL-6、IL-10、TGF-β浓度进行检测,实时荧光聚合酶链式反应法对小肠组织中相关炎性因子基因表达水平进行测定。蛋白免疫印迹法测定肠道中ZO-1与occludin蛋白的表达情况,免疫组化法对小肠巨噬细胞的浸润程度进行检测,免疫荧光法对巨噬细胞的极化情况进行检测。
结果
外源性移植的P-MSCs可在脓毒症小鼠损伤肠道中定植。相比CLP组,CLP+P-MSCs组肠道损伤明显减轻;血清D-乳酸、DAO、内毒素、IL-1β、IL-6、TNF-α浓度降低(P<0.05),IL-10、TGF-β升高(P<0.05);肠道组织中IL-1β、TNF-α、IL-6基因表达水平降低(P<0.05),IL-10、TGF-β升高(P<0.05);肠道中ZO-1与occludin蛋白表达量也升高(P<0.05)。同时,CLP+P-MSCs组肠道组织中巨噬细胞分布显著减少,巨噬细胞有向M2型极化的趋势。
结论
外源性P-MSCs移植可显著减轻脓毒症肠损伤小鼠的炎性损伤、改善肠屏障功能。减少巨噬细胞的浸润、促使巨噬细胞由M1型向M2型极化可能是其减轻炎症反应的机制之一。
Keywords: 脓毒症, 间充质干细胞, 肠损伤, 免疫失衡, 巨噬细胞极化
Abstract
Objective
To explore the protective effect of placenta-derived mesenchymal stem cells (P-MSCs) transplantation on intestinal injury in septic mice and its mechanism.
Methods
A total of 24 mice were randomly assigned to 3 groups, a sham operation group, a sepsis group that underwent cecal ligation and puncture (CLP) procedure, and a group that received CLP and P-MSCs treatment. Hereinafter, the three groups are referred to as the Sham group, the CLP group, and the CLP+P-MSCs group. For the mice in the Sham group, the abdomen was cut open and the cecum was exposed and then placed back in the abdomen. CLP was performed in the other two groups to establish the sepsis model. Mice in the Sham and the CLP groups received 0.1 mL of 0.9% NaCl injection in the tail vein 1 hour after operation, while mice in the CLP+P-MSCs group received 2×105 P-MSCs infusion 1 hour after operation. Intestinal and blood specimens were collected from the mice in each group 24 hours after P-MSCs transplantation. Hematoxylin and eosin (HE) staining of the intestinal tissue was performed for pathological evaluation. The serum concentrations of D-lactic acid, diamine oxidase (DAO), endotoxin, interleukin (IL)-1β, tumor necrosis factor (TNF)-α, IL-6, IL-10, and transforming growth factor (TGF)-β were determined by enzyme linked immunosorbent assay (ELISA). The gene expression of the relevant inflammatory factors in the small intestinal tissue was determined by real-time fluorescence polymerase chain reaction. The expression of zonula occludens protein-1 (ZO-1) and occludin protein in the intestine was determined by Western blot, the infiltration of intestinal macrophages was determined by immunohistochemical method, and the polarization of macrophages was determined by immunofluorescence.
Results
The exogenous transplantation of P-MSCs could form colonies in the injured intestines of septic mice. Compared with those of the CLP group, the intestinal injury of the CLP+P-MSCs group was significantly alleviated, the serum concentrations of D-lactic acid, DAO, endotoxin, IL-1β, IL-6, and TNF-α were significantly decreased (P<0.05), while the serum concentrations of IL-10 and TGF-β were significantly increased (P<0.05), the expression levels of IL-1β, TNF-α and IL-6 genes in the intestinal tissue were significantly decreased (P<0.05), while the expression levels of IL-10 and TGF-β genes were significantly increased (P<0.05), and the expression of ZO-1 and occludin proteins in the intestine was also significantly increased (P<0.05). In addition, the distribution of macrophages in the intestinal tissue of the CLP+P-MSCs group decreased significantly and the macrophages showed a tendency for M2 polarization.
Conclusion
Exogenous transplantation of P-MSCs can significantly reduce inflammatory injury and improve the intestinal barrier function in septic mice with intestinal injury. Reduction in the infiltration of macrophages and promotion of the polarization of macrophages from M1 to M2 may be the mechanisms underlying the reduction of inflammation.
Keywords: Sepsis, Mesenchymal stem cells, Intestinal injury, Immune imbalance, Macrophage polarization
脓毒症是机体因感染所致的全身炎症反应综合征,常继发多器官功能障碍及患者死亡,其发病率高且呈逐年上升趋势,病死率可达30%~70%[1]。脓毒症的过度炎症反应常累及肠道,而损伤的肠道又会促使细菌与毒素移位,加重炎症反应,推动其他器官损伤的进展。可见,肠道既是脓毒症的损伤器官又是导致病情进展的重要中间环节,故寻找有效的脓毒症肠损伤的保护策略至关重要。
巨噬细胞作为免疫系统的关键参与者,在脓毒症的炎症反应中扮演着重要的角色[2]。已有研究表明,巨噬细胞在脓毒症肠道损伤的发生、发展中发挥着重要作用,免疫失衡导致的过度炎症反应会诱导局部更多的巨噬细胞浸润,这又将进一步加重肠组织损伤[3]。而有趣的是,巨噬细胞具有很强的可塑性,一些研究证实,巨噬细胞从M1表型向M2表型的转化可减少各种炎症性疾病中的组织损伤[4-6]。近年来,有研究发现胎盘间来源的间充质干细胞(placental-derived mesenchymal stem cells, P-MSCs)相比其他种类的间充质干细胞具有更强的免疫调节与增殖能力,然而,P-MSCs在脓毒症肠道损伤中的治疗作用鲜有报道。因此,本研究旨在观察P-MSCs对脓毒症小鼠肠道损伤的保护作用,并探讨P-MSCs能否有效减少肠道组织中巨噬细胞的浸润并促使巨噬细胞由M1型向M2型极化。
1. 材料和方法
1.1. 材料
1.1.1. 动物
健康成年雄性C57BL/6小鼠,鼠龄6~8周,体质量18~22 g,购自成都达硕实验动物有限公司。所有实验动物均在合适的环境中饲养,25 ℃,12 h暗/光循环,可自由饮水和进食。实验程序由西部战区总医院医学伦理委员会批准(伦理批件编号:2021EC2-20)。
1.1.2. 主要试剂
间充质干细胞无血清培养基购自友康恒业生物科技( 北京) 有限公司;流式抗体CD105、CD90、CD73、CD19、CD45、CD34、CD14和人类白细胞DR抗原(human leukocyte antigen DR, HLA-DR)购自美国Biolgend公司。白介素(interleukin, IL)-1β、IL-6、IL-10、肿瘤坏死因子(tumor necrosis factor, TNF)-α、血清D-乳酸、二胺氧化酶(diamine oxidase, DAO)、内毒素(endotoxin, ET)检测试剂盒均购自上海江莱生物科技有限公司;兔抗小鼠闭锁连接蛋白1(zonula occludens protein 1, ZO-1)与occludin抗体,CD86、CD206、CD163、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)抗体购自英国Abcam公司;CD68抗体购自美国CST公司;反转录聚合酶链反应(RT-PCR)检测试剂盒 one step SYBR PrimeScript RT-PCR KitⅡ购自日本TaKaRa公司;引物由上海生工生物工程有限公司设计并合成;RNA提取试剂与全蛋白提取试剂盒购自北京索莱宝科技有限公司;麻醉药异氟烷购自深圳市瑞沃德生命科技有限公司。
1.1.3. 主要设备与仪器
IVIS Spectrum(美国Caliper公司);CFX96荧光定量聚合酶链反应(PCR)仪(美国Bio-Rad公司);细胞培养箱(美国Thermofisher);FACSCantoⅡ型流式细胞分析仪(美国BD公司)。
1.2. 实验方法
1.2.1. P-MSCs的培养与鉴定
参照HUANG等[7]研究,将课题组前期保存的P-MSCs(第3代)采用间充质干细胞无血清培养基培养,选取生长良好的第4代细胞。制备P-MSCs单细胞悬液,离心、洗涤、再离心,然后重悬细胞,加入直标一抗孵育。孵育完成后洗涤、离心、重悬细胞,采用流式细胞仪检测P-MSCs的表面标志物(CD105、CD73、CD90、CD34、CD19、CD45、CD14和HLA-DR)。此外,分别对P-MSCs进行成骨诱导分化(茜素红染色)和成脂诱导分化(油红O染液染色),最后再根据国际细胞治疗协会(ISCT)组织鉴定标准进行鉴定。
1.2.2. 模型构造与给药方法
将24只健康成年雄性C57BL/6小鼠随机均分为Sham组、CLP组与CLP+P-MSCs组,术前12 h禁食但不禁饮。CLP组与CLP+P-MSCs组采用盲肠结扎穿孔法(CLP)建立脓毒症肠损伤模型[8]:用异氟烷麻醉小鼠后,开腹分离肠系膜和盲肠,在盲肠的上1/3处用3号线结扎,用22G针头横穿下半部盲肠,在穿孔处挤出少许肠内容物,随后还纳入腹腔并逐层关腹。Sham组用异氟烷麻醉小鼠后游离盲肠再回纳关腹,如相比Sham组,CLP组血清炎症因子及HE染色出现明显变化表示造模成功。
Sham组与CLP组均于术后1 h经尾静脉注射1 mL 37 ℃ 0.9%NaCl。CLP+P-MSCs组于术后1 h经尾静脉输注2×105个P-MSCs。在P-MSCs移植24 h后取材,异氟烷麻醉后处死所有小鼠,经眶静脉取血,约1 mL/只,静置后离心取血清,再收集小肠组织(空肠),将血清与组织保存于−80 ℃冰箱。实验过程符合国家有关实验动物福利伦理原则。
1.2.3. 小肠组织HE染色与组织病理学观察
用体积分数4%多聚甲醛溶液将小肠组织固定24 h后,进行梯度脱水、二甲苯透明、石蜡包埋、切片(厚度4 μm),再行HE染色。组织切片由两位高年资病理医生在显微镜下观察病理学变化,并采用双盲法进行病理评分。小肠组织病理评分参照CHIU等[9]的方法。
1.2.4. 血清D-乳酸、DAO、ET及炎性因子的检测
血清中D-乳酸、DAO、ET、IL-1β、TNF-α、IL-6、IL-10、TGF-β的分泌水平均使用ELISA法检测。将小鼠血清在4 ℃下离心20 min(3000 r/min)后取上清液。将不同浓度的标准品50 μL加入标准品孔中,将稀释的待测样本50 μL加入样本孔中,空白孔不加样。再将辣根过氧化物酶(HRP)标记的抗体100 μL分别加入样本孔与标准品孔中,孵育60 min。最后采用全自动酶标仪测定450 nm处的吸光度(OD)值。
1.2.5. 肠道组织中炎症因子基因表达水平检测
采用qRT-PCR法测定各组肠道中炎症因子基因的表达水平。将适量相同质量的小肠组织研磨,其总mRNA经Trizol法提取测定浓度后,用one step SYBR PrimeScript RT-PCR KitⅡ在CFX96荧光定量聚合酶链反应仪进行RNA逆转录和PCR扩增。用2−△△Ct法对数据进行分析,炎症基因引物均由上海生工生物工程有限公司合成,引物序列见表1。
表 1. qRT-PCR primer sequence.
qRT-PCR引物序列
| Gene | Upstream primer sequence | Downstream primer sequence |
| TNF-α | 5′-AGAAGTTCCCAAATGGCCTC-3′ | 5′-CCACTTGGTGGTTTGCTACG-3′ |
| IL-1β | 5′-GCAACTGTTCCTGAACTCAACT-3′ | 5′-ATCTTTTGGGGTCCGTCAACT-3′ |
| IL-6 | 5′-TAGTCCTTCCTACCCCAATTTCC-3′ | 5′-TTGGTCCTTAGCCACTCCTTC-3′ |
| IL-10 | 5′-GTTACTTGGGTTGCCAAG-3′ | 5′-TTGATCATCATGTATGCTTC-3′ |
| TGF-β | 5′-AGAGCCCTGGATACCAACTATTG-3′ | 5′-TGCGACCCACGTAGTAGACG-3′ |
| β-actin | 5′-ACGGTCAGGTCATCACTATCG-3′ | 5′-GGCATAGAGGTCTTTACGGATG-3′ |
1.2.6. 小肠组织中ZO-1与occludin蛋白表达水平测定
采用Western blot法检测肠道组织中ZO-1与occludin蛋白表达水平。将适量等质量的小肠组织(空肠)磨碎后提取总蛋白。通过常规的电泳、转膜、封闭后,加入抗ZO-1与occludin抗体(1∶1000),在4 ℃下共孵育过夜。用TBST洗涤3次后,加入二抗(1∶5000)孵育1 h,再次用TBST洗涤3次,最后经化学发光凝胶成像仪曝光并用天能GIS机箱控制软件V2.0对条带进行曝光扫描,分析目的条带光密度值。
1.2.7. P-MSCs在脓毒症小鼠体内示踪
取10只健康成年雄性C57BL/6小鼠随机分为Sham+P-MSCs组与CLP+P-MSCs组(每组5只),两组处理方法同1.2.2。假手术与CLP术后1 h分别经尾静脉注射CM-Dil标记的P-MSCs 2×105个,P-MSCs移植后24 h进行取材,麻醉后处死所有小鼠并采集空肠组织制备冰冻切片,使用DAPI将冰冻切片复染核后在荧光显微镜下观察P-MSCs的分布并拍照。采用IPP Image-Pro Plus 6.0软件测量两组P-MSCs的定植量。
1.2.8. 小肠组织中的巨噬细胞浸润
采用免疫组化法检测小肠组织中巨噬细胞的浸润情况。将小肠组织石蜡切片进行脱蜡处理后,进行抗原修复与封闭,先加入一抗(抗小鼠CD68抗体)1∶500,室温孵育60 min,再于4 ℃孵育过夜。次日加入生物素标记的二抗孵育30 min后再滴加DAB溶液,复染、脱水、透明、封片后显微镜下观察并拍照。采用IPP Image-Pro Plus 6.0软件测量CD68蛋白表达量。
1.2.9. 小肠组织中巨噬细胞极化表型的免疫荧光染色
采用免疫荧光法检测小肠组织中巨噬细胞的极化表型分布情况。将小肠石蜡切片进行脱蜡处理后,进行抗原修复、通透与封闭,分别加入一抗(抗小鼠CD68、CD86、CD206、CD163、iNOS抗体)1∶500,4 ℃孵育过夜,次日加入荧光标记的二抗孵育1 h,复染、封片后置于荧光显微镜下观察并拍照。采用IPP Image-Pro Plus 6.0软件分别测量各组iNOS、CD86、CD163、CD206蛋白表达量。
1.3. 统计学方法
用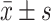 表示计量资料,单因素方差分析(Tukey法)用于多组间比较,LSD-t检验用于进一步两两比较,P<0.05为差异有统计学意义。
表示计量资料,单因素方差分析(Tukey法)用于多组间比较,LSD-t检验用于进一步两两比较,P<0.05为差异有统计学意义。
2. 结果
2.1. P-MSCs生物学特性鉴定
P-MSCs在培养状态下呈长梭形,经流式细胞仪检测:MSCs阳性标志物(CD90、CD73、CD105)≥95%;阴性标志物(CD14、CD34、CD19、CD45和HLA-DR)≤2%(图1);多向分化潜能鉴定:P-MSCs可成功向骨细胞、脂肪细胞分化(图2)。表明本实验培养获得的P-MSCs满足间充质干细胞标准。
图 1.

P-MSCs flow cytometry results
P-MSCs流式细胞仪检测结果
A: CD90; B: CD73; C: CD14; D: CD34; E: CD19; F: CD45; G: CD105; H: HLA-DR.
图 2.
P-MSCs differentiation identification
P-MSCs分化鉴定
A: before P-MSCs osteoblast differentiation and staining; B: P-MSCs osteoblast differentiation staining; C: before P-MSCs adipoblast differentiation and staining; D: P-MSCs adipoblast differentiation staining.
2.2. 小肠组织HE染色与病理损伤评估
小肠组织HE染色结果显示,Sham组小鼠小肠组织结构清晰,柱状上皮排列整齐,形态未见明显异常;与Sham组相比,CLP组小肠组织结构紊乱,绒毛顶端剥落,黏膜、黏膜下层和肌层水肿、充血伴炎性细胞浸润明显,该组病理评分明显升高(P<0.001);对比CLP组,CLP+P-MSCs组结构破坏明显减少,黏膜、黏膜下层和肌层水肿与充血减轻,炎性细胞浸润减少 (P<0.05)(图3)。
图 3.

Pathological injury of the small intestine of the mice in each group
各组小鼠小肠组织病理损伤
* P<0.05, *** P<0.001; n=5.
2.3. P-MSCs对脓毒症小鼠血清炎症因子的影响
ELISA检测结果表明,与Sham组相比,CLP组血清中炎症因子IL-1β、TNF-α、IL-6质量浓度升高,抗炎因子IL-10、TGF-β质量浓度降低;与CLP组相比,CLP+P-MSCs组血清炎症因子IL-1β、TNF-α、IL-6质量浓度降低,抗炎因子IL-10、TGF-β质量浓度升高(P<0.05,图4)。
图 4.

Findings for the serum inflammatory indices of the mice
小鼠血清炎性指标
* P<0.05, ** P<0.01; n=5.
2.4. 脓毒症小鼠肠道炎症因子基因表达水平
qRT-PCR法检测表明,相比Sham组,CLP组的促炎因子IL-1β、TNF-α、IL-6 mRNA表达升高,抗炎因子IL-10、TGF-β mRNA的表达降低;相比CLP组,CLP+P-MSCs组促炎因子IL-1β、TNF-α、IL-6 mRNA的表达降低,抗炎因子IL-10、TGF-β mRNA的表达升高(P<0.05,图5)。
图 5.
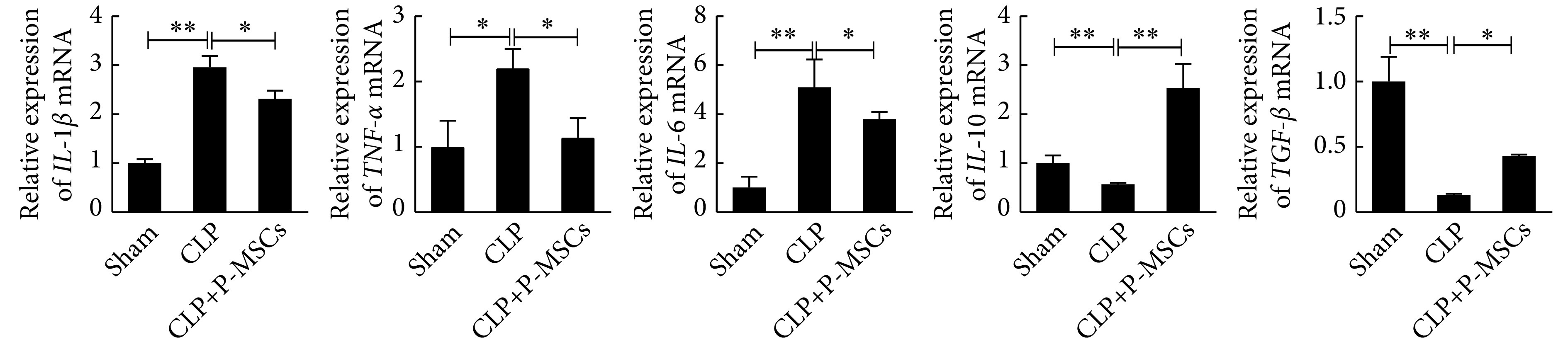
Gene expression of inflammatory factors in the small intestine of the mice
小鼠小肠组织炎性因子基因表达
* P<0.05, ** P<0.01; n=5.
2.5. 脓毒症小鼠肠道屏障功能
本研究发现,CLP组比Sham组血清D-乳酸、DAO、ET水平升高;给予P-MSCs治疗后,血清D-乳酸、DAO、ET水平降低(P<0.05,图6)。通过Western blot检测脓毒症小鼠肠道紧密连接蛋白,CLP组ZO-1与occludin的表达量比Sham组下降;经P-MSCs治疗后,CLP+P-MSCs组ZO-1与occludin的表达量比CLP组增加(P<0.05,图7)。综上表明,P-MSCs能有效改善脓毒症小鼠肠屏障功能。
图 6.

Determination of serum D-lactic acid, DAO, and ET in mice
小鼠血清D-乳酸、DAO和ET检测
* P<0.05, ** P<0.01; n=5.
图 7.

Examination of ZO-1 and occludin proteins in small intestine by Western blot
小肠组织 ZO-1与occludin蛋白的Western blot检测
* P<0.05, ** P<0.01, *** P<0.001; n=5.
2.6. P-MSCs在损伤部位的定植
如图8所示,相比Sham+P-MSCs组,CLP+P-MSCs组肠道组织中有更多的P-MSCs定植。以上结果表明,体外输注的P-MSCs有向损伤的肠道组织中定植的趋势。
图 8.

Colonization of P-MSCs in the small intestinal tissue
P-MSCs在小肠组织的定植
A:distribution of CM-Dil labeled P-MSCs in small intestine (×400); B: statistical analysis of colonization (*** P<0.001; n=4).
2.7. 脓毒症小鼠小肠组织中巨噬细胞的浸润情况
结果发现,Sham组存在少量巨噬细胞(CD68+),且散在分布于小肠固有层和肌层中;与Sham组相比,CLP组小肠巨噬细胞(CD68+)浸润明显增多;相比CLP组,CLP+P-MSCs组小肠巨噬细胞明显减少(图9)。因此,说明P-MSCs在治疗脓毒症小鼠肠道损伤中,可有效减少小肠组织巨噬细胞的浸润。
图 9.

Determination of infiltration of macrophages in the small intestinal tissues by immunohistochemical staining
免疫组化检测小肠组织巨噬细胞浸润情况
*** P<0.001; n=5.
2.8. 脓毒症小鼠小肠组织中巨噬细胞的极化情况
采用免疫荧光染色发现,Sham组小肠组织中仅散在分布有少量巨噬细胞(CD68+),相比Sham组,CLP组小肠组织中巨噬细胞浸润明显增多,并且高表达iNOS与CD86(M1极化),而低表达CD163与CD206(M2极化),由此,说明在脓毒症肠道损伤的发生过程中小肠组织中的巨噬细胞发生了M1极化。相比CLP组,CLP+P-MSCs组小肠组织中巨噬细胞数量明显减少,并且iNOS、CD86表达降低,而CD163、CD206表达升高(图10),由此,说明在P-MSCs治疗脓毒症小鼠肠道损伤中,可诱导小肠组织巨噬细胞向M2型极化。
图 10.

Polarization of macrophages in the small intestinal tissues
小肠组织中巨噬细胞的极化情况
* P<0.05, ** P<0.01, *** P<0.001; n=5.
3. 讨论
MSCs是一种具有自我更新、多向分化潜能、低免疫原性以及免疫调节功能的成体多能干细胞,其组织来源丰富,如骨髓基质、脂肪、围产期组织(胎盘、脐带、脐带血)、骨骼、肌肉、肝脏等[10]。研究表明MSCs通过调节免疫状态、平衡炎症反应,在脓毒症疾病的治疗中具有明显优势[11-12]。骨髓、脂肪等来源的间充质干细胞已被多项研究证实可有效减轻脓毒症模型的炎症反应,缓解器官损伤[13-14]。而当前有多项研究表明P-MSCs相比其他来源的MSCs表现出更强的免疫调节与增殖能力[7,15],且无创获取方便 、伦理限制少。因此,本研究通过探讨外源性植入P-MSCs治疗脓毒症肠损伤的有效性,并观察P-MSCs对巨噬细胞的调节作用,为临床治疗脓毒症肠损伤提供新策略。
本研究中,建模后24 h即检测发现CLP组小鼠血清促炎因子IL-1β、TNF-α、IL-6质量浓度显著升高,抗炎因子IL-10、TGF-β质量浓度明显降低,同时肠道组织中促炎因子IL-1β、TNF-α、IL-6 mRNA 表达水平显著升高,抗炎因子IL-10、TGF-β mRNA 表达水平明显降低,表明CLP小鼠模型肠道与全身炎症反应严重。移植P-MSCs 24 h后,本研究发现肠道组织中促炎因子IL-1β、TNF-α、IL-6 mRNA表达水平显著降低,而抗炎因子IL-10、TGF-β mRNA表达水平明显升高。反映全身炎症反应的促炎因子IL-1β、TNF-α、IL-6血清指标明显降低,抑炎因子IL-10、TGF-β血清指标显著升高。因此,以上实验结果表明P-MSCs能有效减轻脓毒症小鼠肠道及全身炎症反应。
DAO是肠上皮细胞内酶,只有当肠上皮细胞发生损伤时,其血清活性才会显著增加。肠道作为外界与机体内环境之间的天然屏障,当肠道屏障功能正常时,D-乳酸、内毒素几乎不能进入到血液循环中,而当肠道屏障功能发生障碍时,大量的D-乳酸、内毒素才可进入到血液循环中。此外,肠道屏障功能完整性与肠道上皮细胞间的紧密连接密切相关,研究表明,ZO-1与occludin蛋白是评价肠上皮细胞间紧密连接的重要指标[16]。本研究中,建模后24 h即观察到CLP组小鼠小肠黏膜绒毛形态出现明显异常,同时DAO、D-乳酸和内毒素等反映肠黏膜完整性和肠屏障功能的血清指标均显著升高,小肠组织ZO-1与occludin蛋白表达明显降低,表明脓毒症小鼠模型伴有明显的肠道损伤且肠屏障功能破坏。而经外源性植入P-MSCs 24 h后即观察到脓毒症小鼠肠道结构破坏明显减少,组织水肿、红细胞渗出、炎性细胞浸润明显减轻,血清D-乳酸、DAO与内毒素浓度显著降低,肠道组织中ZO-1与occludin蛋白表达显著升高。综上说明P-MSCs能有效减轻脓毒症小鼠肠道损伤并改善肠道屏障功能。
组织细胞发生损伤时,会分泌释放多种细胞因子或趋化因子,诱导MSCs向损伤部位迁移与定植。MSCs向脓毒症损伤肠道迁移与定植则更有利于通过细胞间接触和旁分泌机制发挥免疫调节作用,促进局部经典活化的M1巨噬细胞向M2型极化,而M2巨噬细胞可通过分泌鸟氨酸促进细胞增殖和组织修复[17-18]。而关于外源性MSCs是否在脓毒症损伤肠道中定植尚未见报道,因此本研究探讨了体外移植的P-MSCs在脓毒症小鼠损伤肠道内的定植情况。植入P-MSCs 24 h后,假手术组小肠组织中仅观察到少量P-MSCs,而脓毒症组小肠组织内P-MSCs分布显著增多。表明外源性P-MSCs具有向脓毒症损伤肠道中迁移和定植的特性,这更有利于发挥脓毒症肠道损伤的治疗作用。
炎症反应是机体为自我保护而作出的防御反应,在炎症反应中,巨噬细胞作为关键的炎性细胞通常可表现出M1(促炎)和M2(抗炎)表型。M1巨噬细胞通过促炎反应增强免疫应答以消除感染,对机体提供保护作用。但在脓毒症中,因免疫失衡所致的炎症反应异常亢进,M1巨噬细胞促炎产生的大量炎性因子严重破坏正常细胞代谢,诱导细胞凋亡,加剧组织缺血,最终加重组织损伤,继发多器官功能障碍和患者死亡。M2巨噬细胞可通过抑制炎症反应,清除细胞碎片和促进细胞增殖来补充细胞凋亡以帮助组织修复。因此,旨在减弱M1巨噬细胞活性或诱导M1巨噬细胞向M2型极化已被普遍认为是成功的脓毒症治疗方法[19-21]。MSCs可根据环境信号不同的刺激表现出治疗潜力的差异,其暴露在炎性环境中反应出更强的免疫调节能力,诱导巨噬细胞由M1型向M2型极化,有效降低炎性因子的表达,而增强巨噬细胞的吞噬活性和细菌杀伤力[22]。因此,本研究考察P-MSCs对脓毒症小鼠巨噬细胞极化的调节对揭示其潜在的治疗作用机制提供有力的证据。本研究通过免疫组化观察到,与Sham组相比,CLP组肠道巨噬细胞数量显著增多,而相比CLP组,CLP+P-MSCs组巨噬细胞浸润明显减少。为进一步探讨P-MSCs对巨噬细胞的调节作用,通过免疫荧光分析发现CLP组肠道巨噬细胞主要表现为M1型,而CLP+P-MSCs组M2型分布明显增多。由此,本研究证明了外源性P-MSCs移植可有效减少脓毒症小鼠小肠巨噬细胞浸润,并促使肠道巨噬细胞由M1型向M2型极化。
综上,本研究表明P-MSCs可有效减轻脓毒症小鼠肠道损伤及全身炎症反应,改善肠屏障功能,P-MSCs减轻肠道损伤与炎症反应可能与减少肠道组织巨噬细胞浸润并促巨噬细胞向M2抗炎型极化有关。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金面上项目(No. 81772001)和西部战区总医院军事医学联合攻关项目(No. 2019LH04)资助
Contributor Information
捷 邓 (Jie DENG), Email: dj229425372@163.com.
红玉 孙 (Hong-yu SUN), Email: shongyu2008@163.com.
References
- 1.BAGHDADI J D, BROOK R H, USLAN D Z, et al Association of a care bundle for early sepsis management with mortalitym among patients with hospital-onset or community-onset sepsis. JAMA Intern Med. 2020;180:707–716. doi: 10.1001/jamainternmed.2020.0183. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.KARAKIKE E, GIAMARELLOS-BOURBOULIS E J Macrophage activation-like syndrome: a distinct entity leading to early death in sepsis. Front Immunol. 2019;10:55. doi: 10.3389/fimmu.2019.00055. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.GINHOUX F, SCHULTZE J L, MURRAY P J, et al New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nat Immunol. 2016;17:34–40. doi: 10.1038/ni.3324. [DOI] [PubMed] [Google Scholar]
- 4.JUNG M, MA Y, IYER R P, et al IL-10 improves cardiac remodeling after myocardial infarction by stimulating M2 macrophage polarization and fibroblast activation. Basic Res Cardiol. 2017;112(3):33. doi: 10.1007/s00395-017-0622-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.RAHMAN N, PERVIN M, KURAMOCHI M, et al M1/M2-macrophage polarizationbased hepatotoxicity in d-galactosamine-induced acute liver injury in rats. Toxicol Pathol. 2018;46(7):764–776. doi: 10.1177/0192623318801574. [DOI] [PubMed] [Google Scholar]
- 6.DAYAN V, YANNARELLI G, BILLIA F, et al Mesenchymal stromal cells mediate a switch to alternatively activated monocytes/macrophages after acute myocardial infarction. Basic Res Cardiol. 2011;106(6):1299–1310. doi: 10.1007/s00395-011-0221-9. [DOI] [PubMed] [Google Scholar]
- 7.HUANG Q, YANG Y, LUO C, et al An efficient protocol to generate placental chorionic plate-derived mesenchymal stem cells with superior proliferative and immunomodulatory properties. Stem Cell Res Ther. 2019;10(1):301. doi: 10.1186/s13287-019-1405-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.RITTIRSCH D, HUBER-LANG M S, FLIERL M A, et al Immunodesign of experimental sepsis by cecal ligation and puncture. Nat Protoc. 2009;4(1):31–36. doi: 10.1038/nprot.2008.214. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.CHIU C J, SCOTT H J, GURD F N Intestinal mucosal lesion in lowflow states. Ⅱ. The protective effect of intraluminal glucose as energy substrate. Arch Surg. 1970;101(4):484–488. doi: 10.1001/archsurg.1970.01340280036010. [DOI] [PubMed] [Google Scholar]
- 10.BORZOU B, MEHRABANI D, ZARE S, et al The effect of age and type of media on growth kinetics of human amniotic fluid stem cells. Biopreserv Biobank. 2020;18(5):389–394. doi: 10.1089/bio.2019.0103. [DOI] [PubMed] [Google Scholar]
- 11.Le BLANCK, MOUGIAKAKOS D Multipotent mesenchymal stromal cells and the innate immune system. Nat Rev Immunol. 2012;12(5):383–396. doi: 10.1038/nri3209. [DOI] [PubMed] [Google Scholar]
- 12.FONTAINE M J, SHIH H, SCHÄFER R, et al Unraveling the mesenchymal stromal cells' paracrine immunomodulatory effects. Transfus Med Rev. 2016;30(1):37–43. doi: 10.1016/j.tmrv.2015.11.004. [DOI] [PubMed] [Google Scholar]
- 13.SUN J, DING X, LIU S, et al Adipose-derived mesenchymal stem cells attenuate acute lung injury and improve the gut microbiota in septic rats. Stem Cell Res Ther. 2020;11:384. doi: 10.1186/s13287-020-01902-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.CÓNDOR J M, RODRIGUES C E, SOUSA MOREIRA R D, et al Treatment with human Wharton's Jelly-derived mesenchymal stem cells attenuates sepsis-induced kidney injury, liver injury, and endothelial dysfunction. Stem Cells Transl Med. 2016;5:1048–1057. doi: 10.5966/sctm.2015-0138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.TALWADEKAR M D, KALE V P, LIMAYE L S Placenta-derived mesenchymal stem cells possess better immunoregulatory properties compared to their cord derived counterparts--a paired sample study. Sci Rep. 2015;5(1):15784. doi: 10.1038/srep15784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.SUZUKI T Regulation of intestinal epithelial permeability by tight junctions. Cell Mol Life Sci. 2013;70(4):631–659. doi: 10.1007/s00018-012-1070-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.邓捷, 黄启林, 黄尚卿, 等 间充质干细胞治疗脓毒症的研究进展. 生命科学. 2022;34(4):420–426. doi: 10.13376/j.cbls/2022049. [DOI] [Google Scholar]
- 18.HU Q, LYON C J, FLETCHER J K, et al Extracellular vesicle activities regulating macrophage- and tissue-mediated injury and repair responses. Acta Pharm Sin B. 2021;11(6):1493–1512. doi: 10.1016/j.apsb.2020.12.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.CHENG Y, MARION T N, CAO X, et al Park 7: a novel therapeutic target for macrophages in sepsis-induced immunosuppression. Front Immunol. 2018;9:2632. doi: 10.3389/fimmu.2018.02632. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.SHU B, FENG Y, GUI Y, et al Blockade of CD38 diminishes lipopolysaccharide-induced macrophage classical activation and acute kidney injury involving NF-κB signaling suppression. Cell Signal. 2018;42:249–258. doi: 10.1016/j.cellsig.2017.10.014. [DOI] [PubMed] [Google Scholar]
- 21.LIU R H, WEN Y, SUN H Y, et al Abdominal paracentesis drainage ameliorates severe acute pancreatitis in rats by regulating the polarization of peritoneal macrophages. World J Gastroenterol. 2018;24(45):5131–5143. doi: 10.3748/wjg.v24.i45.5131. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.LIU G Y, LIU Y, LU Y, et al Short-term memory of danger signals or environmental stimuli in mesenchymal stem cells: implications for therapeutic potential. Cell Mol Immunol. 2016;13:369–378. doi: 10.1038/cmi.2015.11. [DOI] [PMC free article] [PubMed] [Google Scholar]



