Abstract
目的
分析体检人群患代谢相关脂肪性肝病(metabolic dysfunction-associated fatty liver disease, MAFLD)的危险因素,建立MAFLD的发生风险预测模型,为疾病的预防与发生提供管理策略。
方法
选取2018年1月–2021年12月于四川大学华西医院体检中心进行体检的14664例人员作为研究对象,按是否患有MAFLD分为MAFLD组(n=4013)与非MAFLD组(n=10651),分别比较糖脂代谢水平等生化指标差异,运用logistic回归分析MAFLD发生的危险因素并建立列线图预测模型。通过一致性指数(C指数)和校准曲线对模型的预测效果进行验证及评价。
结果
14664例体检者中,MAFLD患者4013例,总患病率为27.37%,男性患病率高于女性(38.99% vs. 10.06%,P<0.001)。与非MAFLD组相比,MAFLD组血糖、总胆固醇、三酰甘油、低密度脂蛋白胆固醇、天门冬氨酸氨基转移酶、丙氨酸氨基转移酶、γ-谷氨酰基转肽酶及血清尿酸水平均升高(P<0.05),高密度脂蛋白胆固醇水平降低(P<0.05)。logistic回归分析结果显示男性、年龄、体质量指数、血糖、三酰甘油及高血压均是MAFLD的独立危险因素,高密度脂蛋白胆固醇是保护因素。运用危险因素建立列线图预测风险模型,一致性指数(C指数)和校准曲线显示列线图模型预测性能良好,ROC曲线显示列线图模型对预测MAFLD发生的风险具有较好价值。
结论
体检人群中MAFLD患病率较高,通过常规体检筛查建立的列线图模型可提示临床筛选和分析高风险患者,对高风险人群具有预警作用。
Keywords: 代谢相关脂肪性肝病, 体检, 血糖, 血脂, 列线图模型
Abstract
Objective
To analyze the risk factors of metabolic dysfunction-associated fatty liver disease (MAFLD) in the physical examination population, to establish a risk prediction model for the occurrence of MAFLD, and to provide management strategies for the prevention and occurrence of the disease.
Methods
A total of 14664 people who underwent physical examination at the Physical Examination Center, West China Hospital, Sichuan University between January 2018 and December 2021 were selected as research subjects. The subjects were divided into a MAFLD group (n=4013) and a non-MAFLD group (n=10651) according to whether they had MAFLD. The differences in biochemical indices, for example, glycolipid metabolism levels, were compared and logistic regression was conducted to analyze the risk factors for MAFLD, thereby establishing a nomogram prediction model. The prediction effect of the model was validated and evaluated with the consistency index (C-index) and the calibration curve.
Results
Among the 14664 subjects who underwent physical examination, 4013 were MAFLD patients, presenting an overall prevalence of 27.37%, with significantly higher prevalence in men than that in women (38.99% vs. 10.06%, P<0.001). Compared with those of the non-MAFLD group, the levels of glucose (GLU), total cholesterol (TC), triglyceride (TG), low density lipoprotein cholesterol (LDL-C), aspartate transaminase (AST), alanine transaminase (ALT), gamma-glutamyl transpeptidase (GGT) and uric acid (UA) were increased (P<0.05), while the high density lipoprotein cholesterol (HDL-C) level was decreased (P<0.05) in the MAFLD group. The results of logistic regression analysis showed that male sex, age, body mass index, GLU, TG and hypertension were all independent risk factors of MAFLD, while HDL-C was a protective factor of MAFLD. The risk factors were used to establish a nomogram risk prediction model and the C-index and calibration curve showed that the nomogram model produced good predictive performance. The receiver operating characteristic (ROC) curve showed that the nomogram model had good predictive value for the risk of MAFLD.
Conclusion
We found a relatively high prevalence of MAFLD in the physical examination population, and the nomogram model established with routine physical examination screening can provide indications for the clinical screening and analysis of high-risk patients, which has an early warning effect on the high-risk population.
Keywords: Metabolic dysfunction-associated fatty liver disease, Physical examination, Glucose, Lipids, Nomogram model
随着人民物质生活水平的提高,代谢综合征(包括肥胖、2型糖尿病等)发病率逐年上升,非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)于2020年更名为代谢相关脂肪性肝病(metabolic dysfunction-associated fatty liver disease, MAFLD),其患病率也呈持续上升趋势,造成巨大的社会经济负担[1]。MAFLD的危害在于极易引发心脑血管疾病、造成肝纤维化及肝癌等,且易引发慢性肾脏疾病、胰岛素抵抗相关恶性肿瘤等肝外并发症,对人体健康造成巨大危害,不容忽视[2]。虽然目前广泛推荐超声为诊断肝脂肪变的首要手段,但肝脂肪变<20%时诊断性降低,且肥胖者超声检测性能不佳[1]。MAFLD与肥胖密切相关,但在非肥胖人群中也非少见,因此对MAFLD高危人群的早期识别及预防十分必要。近年来,列线图模型因为简洁直观且能分析多变量,在临床应用较广,但目前尚无采用列线图模型预测MAFLD发生的相关研究。本研究通过回顾性分析研究建立基于常规体检指标的MAFLD发生列线图预测模型,提示临床筛选高风险患者,为疾病的治疗与干预提供依据,对高风险人群具有预警作用。
1. 对象与方法
1.1. 研究对象
本研究资料来源于四川大学华西医院体检中心数据库,纳入2018年1月–2021年12月体检数据。纳入标准:进行腹部影像学检查、实验室检测及人体学检查且数据资料齐全的体检者。排除标准:妊娠或哺乳期妇女,患有恶性肿瘤、自身免疫性肝炎、急慢性感染、药物性和病毒性肝炎者。最终纳入体检者14664名,其中男性8771名,女性5893名。本研究通过四川大学华西医院伦理委员会审批(2015年审202号)。
1.2. 方法
查阅数据库中研究对象的基本数据信息(包括性别、年龄、病史)。由专业医生负责人体学检查,包括测量体质量、身高、舒张压(diastolic pressure, DBP)、收缩压(systolic pressure, SBP),计算体质量指数(body mass index, BMI)。研究对象空腹8 h,专业超声医生负责开展肝、脾、胆、胰超声测定。采集研究对象空腹静脉血4 mL,3500 r/min,离心8 min,保留血清,使用全自动生化分析仪(c702, Roche, Germany)检测葡萄糖(glucose, GLU)、血脂、肝功能等指标。
1.3. 诊断标准
MAFLD诊断依据2020年代谢相关脂肪性肝病国际专家共识[1]:影像学检查提示存在脂肪肝,且同时满足以下三项条件之一:①超重或肥胖;②2型糖尿病;③存在两项以上代谢异常风险。影像学超声诊断以中华医学会肝病学分会脂肪肝和酒精性肝病学组《非酒精性脂肪性肝病防治指南(2018年更新版)》为参照[3]:具备以下任意两项即诊断为脂肪肝:①肝脏近场回声弥漫性增强,回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。BMI分级参考《肥胖症基层诊疗指南(2019年)》[4]:体质量过低,BMI<18.5 kg/m2;体质量正常,18.5 kg/m2≤BMI<24.0 kg/m2;超重,24.0 kg/m2≤BMI<28.0 kg/m2;肥胖,BMI≥28.0 kg/m2。高血压诊断标准参考《中国高血压防治指南(2018年修订版)》[5]:收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg。
1.4. 统计学方法
计量资料按照是否为正态分布分别采用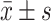 、中位数(四分位数)表示,用t检验或Mann-Whitney U检验进行组间比较。用χ2检验进行率或比的比较。运用二分类logistic对MAFLD发生的影响因素进行分析,α=0.05。将logistic回归分析结果引入R软件,采用R语言软件中"rms package"的lrm函数进行列线图模型的绘制,构建基于体检指标的MAFLD发生风险预测模型。将研究对象分为建模组和验证组,采用一致性指数(C 指数)和ROC校正曲线对建立的列线图预测模型进行验证以评估模型的准确性,C指数越接近1表明模型的准确性越高。
、中位数(四分位数)表示,用t检验或Mann-Whitney U检验进行组间比较。用χ2检验进行率或比的比较。运用二分类logistic对MAFLD发生的影响因素进行分析,α=0.05。将logistic回归分析结果引入R软件,采用R语言软件中"rms package"的lrm函数进行列线图模型的绘制,构建基于体检指标的MAFLD发生风险预测模型。将研究对象分为建模组和验证组,采用一致性指数(C 指数)和ROC校正曲线对建立的列线图预测模型进行验证以评估模型的准确性,C指数越接近1表明模型的准确性越高。
2. 结果
2.1. MAFLD患病率
14664例体检者中MAFLD患者4013例,总患病率为27.37%,男性患病率(38.99%,3420/8771)高于女性(10.06%,593/5893),差异有统计学意义(P<0.001)。
2.2. MAFLD组与非MAFLD组一般资料比较
将14664例体检者按照检测结果是否存在MAFLD疾病分为MAFLD组(n=4013)及非MAFLD组(n=10651)。两组对象基础资料差异有统计学意义(P<0.001),与非MAFLD组相比,MAFLD组中男性、合并高血压人员、高龄人员占比更高,MAFLD组BMI平均水平更高,见表1。
表 1. Comparison of general data of the two groups of subjects.
两组研究对象一般资料比较
| Variable | Non-MAFLD group (n=10651) |
MAFLD group (n=4013) |
P |
| Sex/case (%) | <0.001 | ||
| Male | 5351 (50.24) | 3420 (85.22) | |
| Female | 5300 (49.76) | 593 (14.78) | |
| Age/case (%) | <0.001 | ||
| <30 yr. | 1750 (16.43) | 292 (7.28) | |
| 30-40 yr. | 3756 (35.26) | 1177 (29.33) | |
| 41-50 yr. | 2544 (23.89) | 1133 (28.23) | |
| 51-60 yr. | 2008 (18.85) | 1119 (27.88) | |
| >60 yr. | 593 (5.57) | 292 (7.28) | |
BMI/(kg/m2), 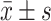
|
23.24±3.38 | 27.33±2.84 | <0.001 |
| Hypertension/case (%) | 1668 (15.66) | 1487 (37.05) | <0.001 |
2.3. MAFLD组与非MAFLD组实验室检测指标比较
与非MAFLD组相比,MAFLD组患者GLU、胆固醇(total cholesterol, TC)、三酰甘油(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、天门冬氨酸氨基转移酶(aspartate transaminase, AST)、丙氨酸氨基转移酶(alanine transaminase, ALT)、γ-谷氨酰基转肽酶(gamma-glutamyltranspeptidase, GGT)及血清尿酸(uric acid, UA)水平均升高,高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)水平下降,且差异均有统计学意义(P<0.05)。见表2。
表 2. Comparison of laboratory testing results of the two groups of subjects.
两组研究对象实验室检测指标比较
| Variable | Non-MAFLD group (n=10651) |
MAFLD group (n=4013) |
P |
| * Median (P25, P75). GLU: glucose; TC: total cholesterol; TG: triglyceride; LDL-C: low density lipoprotein cholesterol; HDL-C: high density lipoprotein cholesterol; AST: aspartate transaminase; ALT: alanine transaminase; GGT: gamma-glutamyl transpeptidase; UA: uric acid. | |||
| GLU/(mmol/L) | 4.98±0.72 | 5.61±1.52 | <0.001 |
| TC/(mmol/L) | 4.75±0.87 | 5.04±0.98 | <0.001 |
| TG/(mmol/L) | 1.27±0.86 | 2.44±1.79 | <0.001 |
| LDL-C/(mmol/L) | 2.85±0.78 | 3.07±0.81 | <0.001 |
| HDL-C/(mmol/L) | 1.47±0.33 | 1.13±0.29 | <0.001 |
| AST/(U/L) | 21.18±7.23 | 26.47±11.14 | <0.001 |
| ALT/(U/L) | 20.09±12.67 | 36.92±25.03 | <0.001 |
| GGT/(U/L)* | 24 (12, 31) | 53 (28, 68) | <0.001 |
| UA/(μmol/L) | 328.87±80.63 | 410.26±90.16 | <0.001 |
2.4. MAFLD的多因素回归分析
以是否患有MAFLD(是=1,否=0)为因变量,性别(男=1,女=2)、年龄、BMI、是否合并高血压(是=1,否=0)、AST、ALT、GLU、UA、TG、TC、LDL-C、HDL-C和GGT为自变量,进行二分类logistic回归分析。最终纳入回归方程的有性别、年龄、BMI、GLU、TG、HDL-C及高血压,结果提示:男性、年龄、BMI、GLU、TG及合并高血压均是MAFLD的独立危险因素,HDL-C是保护因素。见表3。
表 3. Multivariate logistic regression analysis of MAFLD.
MAFLD的多因素logistic回归分析
| Factor | β | SE | Wald | P | OR | 95% CI | ||
| β: partial regression coefficient; SE: standard error; OR: odds ratio; CI: confidence interval. | ||||||||
| Sex | −0.246 | 0.063 | 15.433 | <0.001 | 0.782 | 0.691-0.884 | ||
| Age | 0.016 | 0.002 | 56.710 | <0.001 | 1.016 | 1.012-1.021 | ||
| BMI | 0.401 | 0.011 | 1449.596 | <0.001 | 1.493 | 1.462-1.524 | ||
| GLU | 0.232 | 0.023 | 100.022 | <0.001 | 1.261 | 1.205-1.320 | ||
| TG | 0.360 | 0.025 | 199.979 | <0.001 | 1.433 | 1.363-1.506 | ||
| HDL-C | −1.052 | 0.093 | 126.917 | <0.001 | 0.349 | 0.291-0.419 | ||
| Hypertension | 0.208 | 0.055 | 14.165 | <0.001 | 1.231 | 1.105-1.372 | ||
2.5. 建立MAFLD发生的风险预测列线图模型
将二分类logistic分析得到的影响因素(性别、年龄、BMI、GLU、TG、HDL-C、是否合并高血压)引入R软件,构建列线图预测模型。该模型给出各指标具体值所对应的小标尺分数,介于0~100分之间。利用体检数据中7个指标所得的各分数相加即获得总分,每个个体的总分在0~220分之间,个体总分垂直对应的发病率即为该个体MAFLD患病的概率。以男性、40岁、GLU 8 mmol/L、血压150/100 mmHg、HDL-C 1.5 mmol/L、TG 5.0 mmol/L、BMI值26 kg/m2为例,则该体检者对应得分为2+2+12+2+19+17+50=104分,列线图预测MAFLD患病风险为85%(图1)。
图 1.
Column chart model for predicting MAFLD
预测MAFLD的列线图模型
BMI: body mass index; GLU: glucose; TG: triglyceride; HDL-C: high density lipoprotein cholesterol.
2.6. MAFLD发生的风险预测模型的验证与预测评价
用内部验证对预测模型进行验证,运用随机数字法将全部研究对象按照7∶3比例随机分为训练集(n=10264)和验证集(n=4400)。运用ROC曲线、C指数、校准曲线和Brier Score对模型进行评价。训练集曲线下面积(area under the curve, AUC)=0.886〔95%置信区间(confidence interval, CI):0.8789~0.8921〕,验证集AUC=0.877(95%CI: 0.8665~0.8872),表明模型预测准确度良好(图2)。训练集C指数=0.886,Brier Score=0.120;验证集C指数=0.878,Brier Score=0.126;表明模型在区分度和校准度上表现均较好,预测值与真实值差异较小。校准曲线用于评价预测模型的预测能力,ideal表示理想的结果,bias-corrected表示经过重新抽样校正的曲线,apparent表示当前的结果,三线几乎重合,表明构建的预测模型预测能力良好(图3)。模型在训练集与验证集中表现相近,证明模型拟合良好。
图 2.
ROC curve of the validation set
验证集的ROC曲线
The best cut-off value (sensitivity and specificity) is 0.232 (0.744,0.861), indicating that the sensitivity and specificity of the model reach the best at this point.
图 3.
Calibration curve for the validation group
验证组的Calibration校正曲线
3. 讨论
随着经济水平提高、生活习惯变化,MAFLD发病率逐年上升,已成为我国最常见的慢性肝脏疾病,且存在年轻化发展趋势。目前我国MAFLD的发病率为16%~38%,且经济发达地区发病较高 [6-7]。本研究通过回顾性分析2018年1月–2021年12月在四川大学华西医院进行健康体检的14664例研究对象的体检结果,发现体检人群MAFLD总患病率为27.37%(4013/14664),与经济发达地区患病率相近。其中男性患病率(38.99%)明显高于女性(10.06%),有研究显示患病率差异可能与男女饮食、久坐少动等生活方式相关,也可能与雌激素对肝脏脂肪具有保护作用有关[8]。二分类logistic回归结果显示,MAFLD的危险因素有年龄、性别、TG、BMI、GLU、是否合并高血压,保护因素为HDL-C。MAFLD的发病与饮食结构、生活习惯密切相关,和高血压、肥胖、胰岛素抵抗及糖脂代谢紊乱等联系紧密[9]。年龄增加可导致代谢系统减慢,增加MAFLD患病的风险。肥胖与MAFLD发病息息相关,BMI升高提示体脂可能升高,TG利用率下降可增加脂肪代谢风险[10]。本研究显示MAFLD组中BMI超重和肥胖者占72.65%,与既往报道一致[11-12]。MAFLD患者多合并血压升高,可加快机体胰岛素抵抗,导致血糖上升;脂肪过度堆积及异常分布可进一步诱发脂肪代谢紊乱,从而降低胰岛素敏感性,导致糖脂代谢紊乱,增加MAFLD发生风险[13-14]。本研究显示,与非MAFLD组相比,MAFLD组GLU、TC、TG、LDL-C均升高,HDL-C水平下降,可见MAFLD患者存在糖脂代谢紊乱。当机体脂肪合成及利用环节异常时血脂指标TC、TG、LDL-C及HDL-C水平异常。HDL-C是保护血管的脂蛋白,其水平升高对高脂血症及肝脏疾病具有改善作用[15]。GGT、AST与ALT作为诊断肝脏病变的关键指标,可有效反映肝脏病变的严重状况[16]。MAFLD组的肝功能指标(AST、ALT和GGT)水平高于非MAFLD组,说明MAFLD患者的肝损程度高于非MAFLD人群。MAFLD患者脂肪大量蓄积引发肝细胞脂肪变性,且合并不同程度的肝纤维化改变,肝酶含量升高,导致肝脏功能受损。
将MAFLD的危险因素建立列线图预测模型,结果显示男性,年龄越大,高血压,BMI、GLU、TG升高的患者,其列线图模型对应评分随之提升,其对应出现MAFLD的概率随之增大,而HDL-C升高的患者,其列线图模型对应评分降低,其对应发生MAFLD的风险也下降。此外,训练集和测试集的C指数分别为0.886和0.877,校准曲线结果显示,根据模型预测的MAFLD发生概率与MAFLD实际发生概率吻合良好,表明该模型具有较好的临床实用性。运用Calibration校准曲线和ROC曲线结果显示,预测模型预测能力良好。但模型仅进行了内部验证,缺少样本量更大、多个实验中心数据的外部验证,需要更多前瞻性研究及数据来优化列线图预测模型,更有利于临床应用的推广。
* * *
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
四川省科技厅项目(No. 2021YFH0167)资助
Contributor Information
蓓 夏 (Bei XIA), Email: 10177791@qq.com.
振梅 安 (Zhen-mei AN), Email: azmhxnfm@163.com.
References
- 1.ESLAM M, NEWSOME P N, SARIN S K, et al A new definition for metabolic dysfunction-associated fatty liver disease: an international expert consensus statement. J Hepatol. 2020;73(1):202–209. doi: 10.1016/j.jhep.2020.03.039. [DOI] [PubMed] [Google Scholar]
- 2.PELUSI S, CESPIATI A, RAMETTA R, et al Prevalence and risk factors if significant fibrosis in patients with nonalcoholic fatty liver without steatohepatitis. Clin Gastroenterol Hepatol. 2019;17(11):2310–2319.e6. doi: 10.1016/j.cgh.2019.01.027. [DOI] [PubMed] [Google Scholar]
- 3.中华医学会肝病学分会脂肪肝和酒精性肝病学组 非酒精性脂肪性肝病防治指南(2018年更新版). 实用肝脏病杂志. 2018;21(2):177–186. doi: 10.3969/j.issn.1672-5069.2018.02.007. [DOI] [Google Scholar]
- 4.中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 等 肥胖症基层诊疗指南(2019年). 中华全科医师杂志. 2020;19(2):95–101. doi: 10.3760/cma.j.issn.1671-7368.2020.02.002. [DOI] [Google Scholar]
- 5.中国高血压防治指南修订委员会, 高血压联盟(中国), 中华医学会心血管病学分会, 等 中国高血压防治指南(2018年修订版). 中国心血管杂志. 2019;24(1):24–56. doi: 10.3969/j.issn.1007-5410.2019.01.002. [DOI] [Google Scholar]
- 6.ARSHAD T, GOLABI P, PAIK J, et al Prevalence of nonalcoholic fatty liver disease in the female population. Hepatol Commun. 2018;3(1):74–83. doi: 10.1002/hep4.1285. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.GUAN L, ZHANG X H, TIAN H Y, et al Prevalence and risk factors of metabolic-associated fatty liver disease during 2014-2018 from three cities of Liaoning Province: an epidemiological survey. BMJ Open. 2022;12(2):e047588. doi: 10.1136/bmjopen-2020-047588. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.KIM D K, KIM Y H, LEE J H, et al Estrogen-related receptor γ controls sterolregulatory element-binding protein-1c expression and alcoholic fatty liver. Biochimica Biophys Acta Mol Cell Biol Lipids. 2019;1864(12):158521. doi: 10.1016/j.bbalip.2019.158521. [DOI] [PubMed] [Google Scholar]
- 9.梁珊珊, 王霞, 秦垦 亚临床功能甲状腺减低与非酒精性脂肪肝的相关性分析. 四川大学学报(医学版). 2018;49(3):504–506. doi: 10.13464/j.scuxbyxb.2018.03.043. [DOI] [Google Scholar]
- 10.ROSATO V, MASARONE M, DALLIO M, et al NAFLD and extra-hepatic comorbidities: current evidence on a multi-organ metabolic syndrome. Int J Environ Res Public Health. 2019;16(18):3415. doi: 10.3390/ijerph16183415. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.ESLAM M, SARIN S K, WONG V W, et al The Asian Pacific Association for the Study of the Liver clinical practice guidelines for the diagnosis and management of metabolic associated fatty liver disease. Hepatol Int. 2020;14(6):889–919. doi: 10.1007/s12072-020-10094-2. [DOI] [PubMed] [Google Scholar]
- 12.HUANG J F, TSAI P C, YEH M L, et al Risk stratification of non-alcoholic fatty liver disease across body mass index in a community basis. J Formos Med Assoc. 2020;119(1):89–96. doi: 10.1016/j.jfma.2019.03.014. [DOI] [PubMed] [Google Scholar]
- 13.CHO I Y, CHANG Y, KANG J H, et al Long or irregular menstrual cycles and risk of prevalent and incident nonalcoholic fatty liver disease. J Clin Endocrinol Metab. 2022;107(6):e2309–e2317. doi: 10.1210/clinem/dgac068. [DOI] [PubMed] [Google Scholar]
- 14.ZHANG X, LI R, CHEN Y, et al The role of thyroid hormones and autoantibodies in metabolic dysfunction associated fatty liver disease: TgAb may be a potential protective factor. Front Endocrinol (Lsusanne) 2020;11:598836. doi: 10.3389/fendo.2020.598836. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.CATANZARO R, SELNAGGIO F, SCIUTO M, et al Triglycerides to high-density lipoprotein cholesterol ratio for diagnosing nonalcoholic fatty liver disease. Minerva Gsatroenterol (Torino) 2022;68(3):261–268. doi: 10.23736/S2724-5985.21.02818-X. [DOI] [PubMed] [Google Scholar]
- 16.FAN N G, PENG L, XIA Z H, et al Triglycerides to high-density lipoprotein cholesterol ratio as a surrogate for nonalcoholic fatty liver disease: a cross sectional study. Lipids Health Dis. 2019;18(1):39. doi: 10.1186/s12944-019-0986-7. [DOI] [PMC free article] [PubMed] [Google Scholar]





