Abstract
海藻酸钠(SA)是从褐藻类海带中提取的一种天然高分子材料,具备出色的生物相容性、无毒性、生物降解性以及丰富的储存量。海藻酸钠凝胶形成的条件温和,可有效避免活性物质的失活。经过多种制备方法,海藻酸钠微球被广泛用于生物材料和组织工程等领域。本文综述了制备海藻酸钠微球的常见方法,包括挤出法、乳化法、静电喷射法、喷雾干燥法和同轴气流法,并探讨了它在骨修复、止血以及药物递送等生物医学领域的应用。
Keywords: 海藻酸钠微球, 骨修复, 止血, 药物递送, 生物相容性
Abstract
Sodium alginate (SA) is a kind of natural polymer material extracted from kelp, which has excellent biocompatibility, non-toxicity, biodegradability and abundant storage capacity. The formation condition of sodium alginate gel is mild, effectively avoiding the inactivation of active substances. After a variety of preparation methods, sodium alginate microspheres are widely used in the fields of biomaterials and tissue engineering. This paper reviewed the common methods of preparing alginate microspheres, including extrusion, emulsification, electrostatic spraying, spray drying and coaxial airflow, and discussed their applications in biomedical fields such as bone repair, hemostasis and drug delivery.
Keywords: Sodium alginate microsphere, Bone repair, Hemostasis, Drug delivery, Biocompatibility
0. 引言
海藻酸钠(sodium alginate,SA)是一种常用的生物材料,是天然多糖碳水化合物中的一种。这种化合物可以从褐藻类的海带中提取,属于藻类衍生物,具有优异的生物相容性、无毒性、稳定性且储存量丰富,已经被广泛应用于诸如骨组织治疗、受损组织的止血以及疾病治疗等生物医学领域。
1. 海藻酸钠的理化性质
海藻酸钠是存在于褐藻类海洋生物中的线性阴离子天然多糖,由β-D-甘露糖醛酸(M)和α-L-古罗糖醛酸(G)键聚合而成[1-2]。海藻酸钠是一种白色或者淡黄色不定形的粉末,无毒,溶于水,不溶于有机溶剂且无臭无味[3-4]。溶于水后形成粘稠的胶状物,当含水量超过95%时,容易从溶胶状变成凝胶状[5]。当pH值为6~9时黏性稳定,加热至80 ℃以上时,黏性降低[6]。随着pH的降低,海藻酸钠溶液的黏度不断增强。
2. 海藻酸钠微球的制备方法
海藻酸钠含有大量的-COO-,在水溶液中可表现出聚阴离子行为,可以和二价阳离子交联形成凝胶[7](见图1、表1)。海藻酸钠的结构与活组织的细胞外基质相似,可广泛应用于伤口愈合、小分子药物和蛋白质等生物活性剂的输送和细胞移植[8-9]。目前,海藻酸钠微球的制备方法主要有挤出法、乳化交联法、静电喷射法、同轴气流法以及喷雾干燥法等。
图 1.
Schematic diagram of SA and Ca2+ cross-linkage
SA和Ca2+交联示意图
表 1. Advantages, disadvantages and applications of sodium alginate microsphere preparation methods.
海藻酸钠微球制备方法优缺点及应用
| 方法 | 优点 | 缺点 | 应用 |
| 挤出法 | 操作简单 | 粒径较大,大小不均 | 临床应用,注射给药,工业生产 |
| 静电喷射法 | 尺寸均匀且粒径小,表面光滑,分散性高 | 仪器要求高,有一定的危险性 | 喷涂,微胶囊化,生产细粉,用溶液制备微纳米薄膜 |
| 同轴气流法 | 不需要外部电场,粒径小 | 微球大小不均,具有机械稳定性 | 药物缓释,包封生物活性物质,生物材料固定 |
| 乳化法 | 制备工艺简单,可包封药物,粒径小 | 微球清洗方式麻烦,包封效果差 | 在生物、食品、医药等行业中用于包埋生物活性物质 |
| 喷雾干燥法 | 操作简单,成本低,大规模生产 | 加工精度低,机器清理难度高 | 制备载体颗粒,呼吸道治疗,制备可吸入粉末 |
2.1. 挤出法
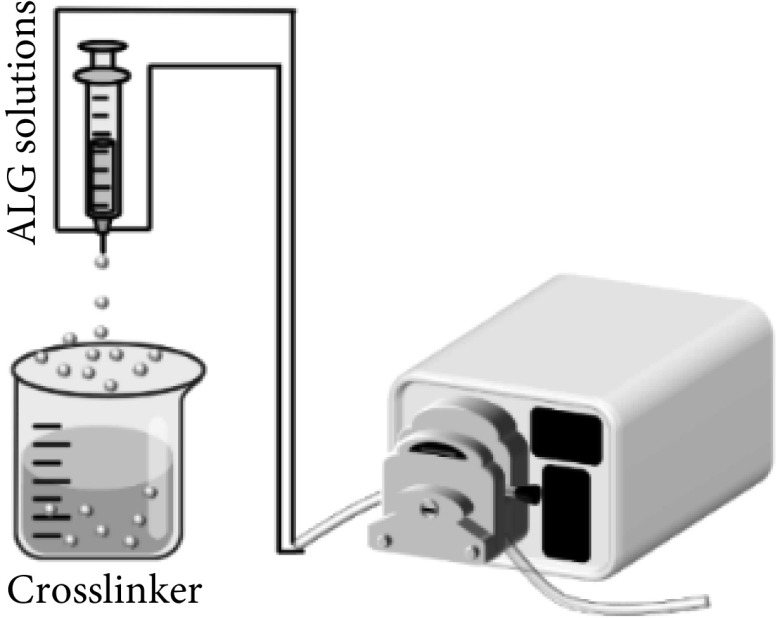
挤出法(见图2)是操作最简单、应用最普遍的微球制备技术。这种制备方法通常是将含有海藻酸钠溶液的滴管或者带有针头的注射器借助外力相互挤压,使之滴落在含有金属阳离子的交联剂中以此产生海藻酸钠微球。其粒径通常会受到液滴下落的距离、针头尺寸、溶液浓度以及交联剂浓度等因素的影响[10-11],通常情况下微球粒径的范围在500~1 000 µm。运用挤出法所制备微球的也有明显的缺点,比如粒径较大、表面粗糙且大小不均。为此,现有研究对挤出法做出了进一步的改善,即利用静电喷射法或同轴气流技术来控制藻酸盐微球的形状和尺寸[12-13]。该方法可以用于工业、食品和生物医学工程等方面。Liao等[14]用溶液挤压法在工业上生产出连续纤维电池,功能部件之间的层流保证了它们在挤压过程中的无缝界面。
图 2.
Schematic diagram of extrusion method
挤出法示意图
2.2. 乳化交联法
目前,运用乳化交联法(见图3)制备海藻酸钠微球是应用最广泛的技术。该方法由至少两种不混溶的液相组成,其中一种以球形液滴的形式分散在另一种液相中,并通过乳化剂或表面活性剂稳定存在[12]。关于海藻酸钠微球的制备,将海藻酸钠水溶液作为分散相加入至含有表面活性剂的油相溶液中,制得油包水(W/O)溶液,再加入金属阳离子(常为Ca2+)进行交联[15-16]。该方法制备的粒径通常在10~1 000 µm。乳化法的主要缺点是包封在微球内部的活性物质或细胞会暴露于有毒性的连续相中,并且在微球形成后需要使用有机溶剂洗涤残留的油相[17]。Ali等[18]利用乳化法制备了地塞米松纳米颗粒,该纳米颗粒可以实现零级释放动力学。
图 3.
Schematic diagram of emulsion cross-linking method
乳化交联法示意图
2.3. 静电喷射法
通常来说尺寸较小以及尺寸分布比较窄的微球通过传统的制备方法是比较难以获得的。因此,静电喷射技术(见图4)在制备微球方面取得了广泛的关注。Hayati等[19]在1987年研究了外加电场对流动液滴的影响,随着电场的增加,可以观察到水滴形状的变化和滴速的增加,这就是所谓的滴水模式。在持续性电压的作用下,液体以临界体积从针头处滴落,这取决于液体的表面张力[20]。当电场力的强度足以克服海藻酸钠溶液的表面张力时,针头处的液滴形成喷射状从而产生微液滴,这些微液滴可以与钙离子交联,继而产生微球[21]。与此同时,所得微球的粒径和形状与电压、推进速度以及海藻酸钠浓度等因素有关[22],通常情况下微球的粒径在50~500 µm。与乳化交联方法相比,不会降低生物活性是静电喷射技术的主要优点。Castrovilli等[23]应用电喷的方法作为酶固定化技术,制造了一种新的、无金属的漆酶基生物传感器,具有前所未有的可重复使用和存储能力。
图 4.
Schematic diagram of electrostatic spraying method
静电喷射法示意图
2.4. 同轴气流喷射法
挤出法的衍生就是同轴气流技术(见图5),高速气流的引入有利于将挤出的液体裂解成更小的液滴,从而形成不同的喷射模式,例如滴落或喷射状态[24- 25]。同轴气流促使液滴从针尖中喷射至交联剂中,与交联剂固化形成微球。气体流速、溶液浓度以及针头尺寸等因素会影响微球粒径的大小[26]。与静电喷射技术类似,该技术所制备出的微球粒径也小于500 µm。同轴气流压力对液滴位移和体积的影响与电压幅值、脉冲宽度和脉冲频率有关[27]。相对于静电喷射技术而言,同轴气流技术的微球生产率有一定优势,但是该方法可能会形成非球形的微球并且对黏度较高的海藻酸钠并不敏感[28],因此该技术依旧未能用于大批量生产。
图 5.
Schematic diagram of the coaxial airflow method
同轴气流喷射法示意图
2.5. 喷雾干燥法
喷雾干燥法(见图6)是通过雾化器把海藻酸钠溶液喷散成雾滴,并在高温气流中使雾滴干燥而形成的粉状制品[5]。采用该方法所制备的微球粒径及其形貌会受到进风温度、前驱体溶液浓度、进料速度以及前驱体溶液组成的影响[29]。通常情况下,所制备微球粒径在10~100 µm。Grenha等[30]通过喷雾法制备出了载蛋白纳米颗粒,可系统地将治疗性大分子输送到肺部。
图 6.
Schematic diagram of spray drying method
喷雾干燥法示意图
3. 海藻酸钠微球的应用
3.1. 在骨修复中的应用
近年来与骨缺损治疗相关的医疗技术的快速发展为临床管理提供了多种选择,自体骨移植或异体骨移植被广泛用于治疗严重骨缺损,但移植骨来源有限,迫切需要有应用价值的骨组织工程支架作为骨替代材料。间充质干细胞(mesenchymal stem cells,MSCs)对组织修复的生物学作用主要是通过细胞外囊泡的分泌作用介导的,而不是直接分化成实质细胞来修复或替换受损组织。笔者所在的课题组[22]受骨基质囊泡(matrix vesicles,MVs)初始矿化过程的启发(见图7),研究发现了基于静电喷雾法制备的藻酸盐微球(alginate microspheres,ALG)以及矿化的藻酸盐微球(mineralised alginate microspheres,M-ALG)具有良好的生物相容性和成骨性能。矿化后产生的羟基磷灰石(hydroxy-apatite,HA)涂层也有利于成骨细胞向M-ALG微球表面的主动迁移。这是由于HA晶体首先形成并锚定在微球膜上,就像HA晶体最初沉积在MVs内部一样。随着矿物晶体的不断生长和积累,最终在ALG微球上形成HA涂层。HA涂层也有利于成骨细胞向M-ALG微球表面的主动迁移。总之,ALG微球上的骨样HA具有促进骨缺损修复的良好前景。Yashaswini Devi等[31]研究制备了钙离子交联的海藻酸盐复合微球作为骨移植的替代物。采用模拟体液溶液进行体外生物矿化研究,在微球表面观察到磷灰石形成。研究制备的微球与人骨肉瘤细胞(MG-63)共同培养,体外研究表明使用成骨细胞具有良好的生物相容性以及促成骨生成作用。Thomas等[32]研究并制备了一种基于海藻酸钠的微球,将MSCs包封在一个隔室中,在不同时间点对微球的力学完整性进行了测试。结果表明,海藻酸盐微球在较长时间内具有机械稳定性。通过磁操纵测试加载IONP/MSCs的微球,使用电磁操纵设备进行靶向MSCs递送以进行软骨修复。Zhao等[33]研究制备了海藻酸盐水凝胶,研究了和水凝胶培养的兔骨髓基质细胞的活性、增殖、初始黏附和成骨分化情况,结果表明该凝胶具有良好的生物相容性,包埋的兔骨髓基质细胞具有成骨分化能力。笔者所在的课题组Miao等[34]以海藻酸钠为原料研究制备了三维杂化水凝胶,可以模拟天然细胞外基质的结构和生物功能。支架内相互连接且均匀的孔隙有利于骨再生过程中营养物质的运输。结果表明,HA颗粒均匀分布在水凝胶表面,与MC3T3-E1细胞共培养实验表明,矿化后的杂化水凝胶具有良好的生物相容性,有利于骨组织的生长。
图 7.
MVs as the initial site of mineralization participate in the formation of bone tissue and the biomimetic mineralization mechanism inspired by MVs with ALG microspheres as the matrix
MVs作为矿化的初始位置参与骨组织的形成以及受MVs启发以ALG微球为基质的仿生矿化机制[22]
reprinted with permission from ref. [22] (Xu et al. 2022) Copyright © 2022 Published by Elsevier Ltd
3.2. 在止血中的应用
在伤口愈合过程中,促进止血和细胞黏附是必不可少的。及时的止血治疗对于减少失血和提高生存率至关重要。当血液接触异物时,表面吸附的纤维蛋白原诱导血小板的黏附和激活,从而触发凝血。Huang等[35]为提高凝血速度设计并制备了不同表面粗糙度的海藻酸钠止血微球。采用扫描电子显微镜、红外光谱和凝血实验分析表面形貌和止血性能,结果表明,这些微球可以聚集大量的血小板,具有最快的凝血速度和最强的凝血强度。微球不仅无细胞毒性,而且还促进细胞生长。体外和体内凝血实验表明,微球可以减少出血时间和出血量,提高止血效率,这表明微球是具有优异生物安全性的潜在止血剂。Jin等[36]设计并制备了一种新型海藻酸盐复合微球并对其理化性质、体内外止血能力、生物相容性、伤口愈合以及生物降解性等进行了研究。结果表明,该微球既能止血,又能通过加快凝血和伤口愈合速度来提高愈合效率。此外,微球无明显的皮内刺激反应,无明显的溶血反应。更重要的是,它可以在体内降解,对生理、生物化学和组织没有显著影响。该研究将为进一步研究体内止血实验提供重要信息。Wang等[37]研究制备了海藻酸钠复合止血微球(见图8),具有良好的生物相容性、吸水性和黏度。测定了微球使用过程中止血压力与止血时间的关系并通过构建肝、脾、股动脉出血模型分析了止血效果。复合微球具有良好的体内耐受性,在动物实验中表现出较微孔多糖粉末化合物更好的止血效果。研究结果表明,该微球是一种止血效果好且安全性高的材料,具有很大的临床应用潜力。Xie等[38]研究开发了一种基于海藻酸钠的多功能水凝胶。该水凝胶可以通过快速凝胶,牢固地附着在创面皮肤上,实现快速止血。体外全血凝血实验表明,水凝胶能黏附红细胞,对大鼠肝损伤和断尾模型具有良好的止血作用。该水凝胶具有生物相容性,在止血和创面愈合方面具有广阔的应用前景。
图 8.
Schematic of SA/γ-PGA treatment for hemorrhage
SA/γ-PGA治疗出血示意图
该图像是在BioRender(biorender.com)中制作的[37]
the image was made in BioRender (biorender.com). Reprinted with permission from ref. [37] (Wang et al. 2021) Copyright © 2021 American Chemical Society

3.3. 在药物递送中的应用
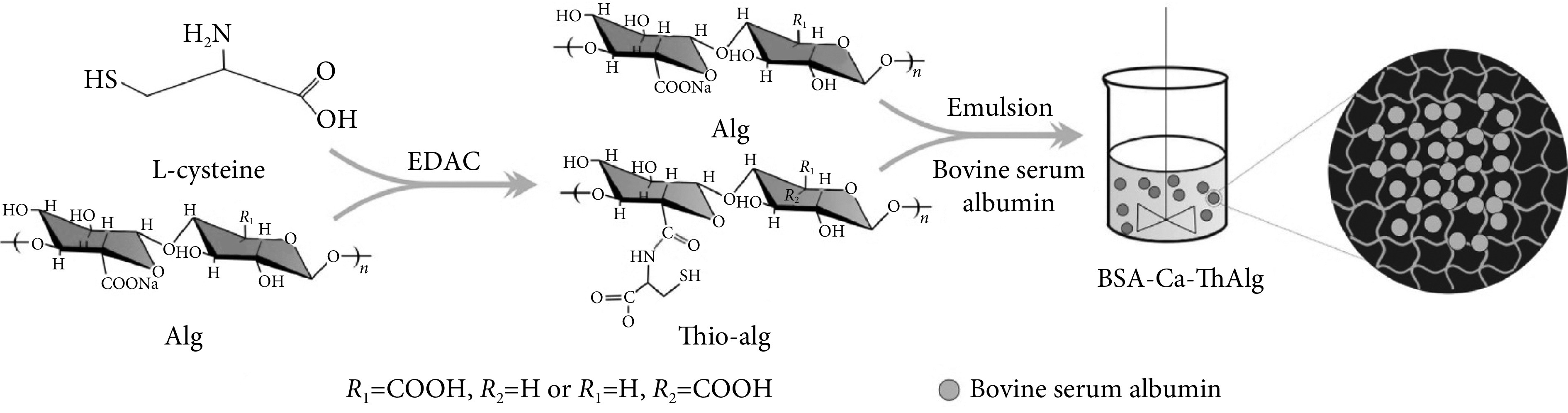
海藻酸微球作为一种新型给药系统,由于价格低廉、无毒、生物相容性和生物降解性等优点而受到广泛关注。在新型给药系统中,药物载体是一种底物,它使药物能够被运输到靶部位,以可控的速率释放药物,从而提高药物的生物利用度。Chang等[39]以海藻酸钠为原料制备了pH和温度敏感的纳米凝胶。细胞毒性试验表明,纳米颗粒具有较低的细胞毒性和较高的生物相容性。pH敏感和温度敏感实验表明,在pH=5.5和31 ℃以上,该水凝胶的颗粒尺寸减小。体外载药和药物释放实验也证实了这一发现,表明新合成的水凝胶可以根据环境的变化释放药物。Mao等[40]将海藻酸钠进行乳化,得到了一种肠道靶向的多肽口服给药微球(见图9)。以胎牛血清蛋白模拟药物,考察微球作为肠道给药载体的可行性。结果表明,该微球粒径分布较窄。此外,微球可以保持结构的完整性,并在胃的强酸性环境中保存药物。而且,微球表现出持续的肠道靶向药物释放能力。
图 9.
Schematic illustration for the preparation of BSA-Ca-ThAlg microspheres
BSA-Ca-ThAlg微球的制备原理图
以胎牛血清蛋白为模拟药物,考察微球作为肠道给药载体的可行性[40]
bovine serum albumin was used as the simulating drug to assess the feasibility of microspheres as intestinal delivery carriers. Reprinted with permission from ref. [40] (Mao et al. 2019) Copyright © 2019 American Chemical Society
4. 结论及展望
在天然聚合物中,海藻酸盐通常可以从棕色海藻中获得,已经被广泛应用于生物医学领域。海藻酸微球伤口敷料可以维持生理湿润的微环境,减少伤口部位的细菌感染,进而促进伤口愈合。海藻酸钠微球可以用来延长药物作用的时间以此增强药效。开发新型的细胞和组织相互作用的海藻酸盐凝胶,可以促进组织工程的未来发展。
壳聚糖是天然多糖甲壳素脱除部分乙酰基的产物,是一种常用的生物材料,亲水性高,无毒,具有良好的生物降解性、生物相容性以及抑菌性质。壳聚糖在伤口管理领域以其止血特性而闻名。此外,它还具有其他生物活性,并可影响巨噬细胞功能,有助于加快伤口愈合。目前,提高壳聚糖应用价值的最有效途径之一是对壳聚糖进行化学修饰,形成壳聚糖衍生物。如果将海藻酸钠和壳聚糖结合形成复合微球,可以用于药物缓释、癌症治疗以及伤口敷料中,以此来降低药物的毒副作用,减少服药次数,增强药物的稳定性和利用率。同时,它还可以应用于抗菌,可有效抑制细菌的增长。另外可以利用壳聚糖胺基和海藻酸钠羧基之间的强离子键,制备一种相比壳聚糖来说力学性能更好、结构更稳定的天然聚合物基复合支架,具有较好的应用前景。另外,根据修复组织或器官损伤的实际情况,结合三维打印技术以及海藻酸钠微球的优势,可制备出包埋微球的组织类器官芯片,进行智能修复。总之,因海藻酸钠优良的理化及生物相容性,制备的微球应用前景广阔,但是因制备方法以及材料本身性质的限制,微球的尺寸仍然难以达到纳米级,在诊断以及治疗领域的应用还有限制,因此制备方法还需要加大探索。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:刘轩妤完成文章的撰写;王玉辉进行文献收集工作;魏延、梁紫薇、黄棣、连小洁、胡银春进行文章指导工作。
Funding Statement
国家自然科学基金项目(12272253,82103147,12202302);山西省应用基础研究计划项目(202203021221047,20210302124007,20210302124405);山西省回国留学人员科研资助项目(HGKY2019037)
Contributor Information
棣 黄 (Di HUANG), Email: huangjw2067@163.com.
延 魏 (Yan WEI), Email: weiyan@tyut.edu.cn.
References
- 1.刘袖洞, 于炜婷, 王为, 等 海藻酸钠和壳聚糖聚电解质微胶囊及其生物医学应用. 化学进展. 2008;20(1):14. [Google Scholar]
- 2.Yang J, Yao J, Wang, S Electromechanical response performance of a reinforced biomass gel artificial muscle based on natural polysaccharide of sodium alginate doped with an ionic liquid for micro-nano regulation. Carbohydr Polym. 2022;275:118717. doi: 10.1016/j.carbpol.2021.118717. [DOI] [PubMed] [Google Scholar]
- 3.Wang L, Zhang H J, Liu X, et al A physically cross-linked sodium alginate–gelatin hydrogel with high mechanical strength. ACS Applied Polymer Materials. 2021;3(6):3197–3205. doi: 10.1021/acsapm.1c00404. [DOI] [Google Scholar]
- 4.Liu J, Shang S, Jiang Z, et al Facile fabrication of chemically modified sodium alginate fibers with enhanced mechanical performance. AATCC J Res. 2022;(1):9. [Google Scholar]
- 5.周烨, 雷世婵, 罗勉, 等 海藻酸钠微球制备方法进展. 生物化工. 2021;7(1):3. [Google Scholar]
- 6.严丽华, 郭圣荣 海藻酸钠微球的制备及其应用进展. 绿色科技. 2017;(24):4. doi: 10.16663/j.cnki.lskj.2017.24.053. [DOI] [Google Scholar]
- 7.Mørch Ýrr A, Donati I, Strand B L, et al Effect of Ca2+, Ba2+, and Sr2+ on alginate microbeads. Biomacromolecules. 2006;7(5):1471. doi: 10.1021/bm060010d. [DOI] [PubMed] [Google Scholar]
- 8.Lee K Y, Mooney D J Alginate: properties and biomedical applications. Prog Polym Sci. 2012;37(1):106–126. doi: 10.1016/j.progpolymsci.2011.06.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tiraton T, Suwantong O, Chuysinuan P, et al Biodegradable microneedle fabricated from sodium alginate-gelatin for transdermal delivery of clindamycin. Mater Today Commun. 2022;32:104158. doi: 10.1016/j.mtcomm.2022.104158. [DOI] [Google Scholar]
- 10.Uyen N T T, Hamid Z A A, Tram N X T, et al Fabrication of alginate microspheres for drug delivery: A review. Int J Biol Macromol. 2020;153:1035–1046. doi: 10.1016/j.ijbiomac.2019.10.233. [DOI] [PubMed] [Google Scholar]
- 11.Brun-Graeppi A K, Richard C, Bessodes M, et al Cell microcarriers and microcapsules of stimuli-responsive polymers. J Control Release. 2011;149(3):209–224. doi: 10.1016/j.jconrel.2010.09.023. [DOI] [PubMed] [Google Scholar]
- 12.Guarino V, Altobelli R, Sala F D, et al. Alginate processing routes to fabricate bioinspired platforms for tissue engineering and drug delivery// Rehm B H A, Moradali M F. Alginates and their biomedical applications. Singapore: Springer Singapore, 2018: 101-120.
- 13.Wang X, Zhu J, Shao T, et al Production of highly monodisperse millimeter‐sized double‐emulsion droplets in a coaxial capillary device. Chem Eng Technol. 2019;42(6):1330–1340. doi: 10.1002/ceat.201800040. [DOI] [Google Scholar]
- 14.Liao M, Wang C, Hong Y, et al Industrial scale production of fibre batteries by a solution-extrusion method. Nat Nanotechnol. 2022;17(4):372–377. doi: 10.1038/s41565-021-01062-4. [DOI] [PubMed] [Google Scholar]
- 15.Ching S H, Bansal N, Bhandari B Alginate gel particles-A review of production techniques and physical properties. Crit Rev Food Sci Nutr. 2017;57(6):1133–1152. doi: 10.1080/10408398.2014.965773. [DOI] [PubMed] [Google Scholar]
- 16.Liew S N, Utra U, Alias A K, et al Physical, morphological and antibacterial properties of lime essential oil nanoemulsions prepared via spontaneous emulsification method. LWT. 2020;128(2):109388. [Google Scholar]
- 17.Chong D, Liu X, Ma H, et al Advances in fabricating double-emulsion droplets and their biomedical applications. Microfluid Nanofluid. 2015;19(5):1071–1090. doi: 10.1007/s10404-015-1635-8. [DOI] [Google Scholar]
- 18.Ali R Preparation and characterization of dexamethasone polymeric nanoparticle by membrane emulsification method. J Nanopart Res. 2020;22(11):314. doi: 10.1007/s11051-020-05031-1. [DOI] [Google Scholar]
- 19.Hayati I, Bailey A I, Tadros T F Investigations into the mechanisms of electrohydrodynamic spraying of liquids. Pt.I. Effect of electric field and the environment on pendant drop and factors affecting the formation of stable jets and atomization. J Colloid Interface Sci. 1987;117(1):205–221. [Google Scholar]
- 20.Hayati I, Bailey A, Tadros T F Investigations into the mechanism of electrohydrodynamic spraying of liquids: II. Mechanism of stable jet formation and electrical forces acting on a liquid cone. J Colloid Interface Sci. 1986;117(1):222–230. [Google Scholar]
- 21.Jaworek A Micro- and nanoparticle production by electrospraying. Powder Technol. 2007;176(1):18–35. doi: 10.1016/j.powtec.2007.01.035. [DOI] [Google Scholar]
- 22.Xu M, Liu T, Qin M, et al Bone-like hydroxyapatite anchored on alginate microspheres for bone regeneration. Carbohydr Polym. 2022;287:119330. doi: 10.1016/j.carbpol.2022.119330. [DOI] [PubMed] [Google Scholar]
- 23.Castrovilli M C, Tempesta E, Cartoni A, et al Fabrication of a new, low-cost, and environment-friendly laccase-based biosensor by electrospray immobilization with unprecedented reuse and storage performances. ACS Sustain Chem Eng. 2022;10(5):1888–1898. doi: 10.1021/acssuschemeng.1c07604. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Rehg T, Dorger C, Chau P C Application of an atomizer in producing small alginate gel beads for cell immobilization. Biotechnol Lett. 1986;8(2):111–114. doi: 10.1007/BF01048467. [DOI] [Google Scholar]
- 25.Salem D R. 1 - Electrospinning of nanofibers and the charge injection method// Brown P J, Stevens K. Nanofibers and nanotechnology in textiles. Sawston: Woodhead Publishing, 2007: 3-21.
- 26.Workamp M, Alaie S, Dijksman J A Coaxial air flow device for the production of millimeter-sized spherical hydrogel particles. Rev Sci Instrum. 2016;87(12):125113. doi: 10.1063/1.4972587. [DOI] [PubMed] [Google Scholar]
- 27.Zhou J, Pei Z Experimental study of the piezoelectric drop-on-demand drop formation in a coaxial airflow. Chem Eng Process. 2020;147:107778. doi: 10.1016/j.cep.2019.107778. [DOI] [Google Scholar]
- 28.Koch S, Schwinger C, Kressler J, et al Alginate encapsulation of genetically engineered mammalian cells: Comparison of production devices, methods and microcapsule characteristics. J Microencapsul. 2003;20(3):303–316. doi: 10.3109/02652040309178071. [DOI] [PubMed] [Google Scholar]
- 29.储茂泉, 刘国杰 喷雾干燥法制备载药微球时的形貌与粒度控制. 化工学报. 2004;55(11):1903–1907. doi: 10.3321/j.issn:0438-1157.2004.11.022. [DOI] [Google Scholar]
- 30.Grenha A, Seijo B, Remunan-Lopez C Microencapsulated chitosan nanoparticles for lung protein delivery. Eur J Pharm Sci. 2005;25(4-5):427–437. doi: 10.1016/j.ejps.2005.04.009. [DOI] [PubMed] [Google Scholar]
- 31.Yashaswini Devi G V, Prabhu A, Anil S, et al Preparation and characterization of dexamethasone loaded sodium alginate-graphene oxide microspheres for bone tissue engineering. J Drug Deliv Sci Technol. 2021;64:102624. doi: 10.1016/j.jddst.2021.102624. [DOI] [Google Scholar]
- 32.Thomas R G, Unnithan A R, Moon M J, et al Electromagnetic manipulation enabled calcium alginate Janus microsphere for targeted delivery of mesenchymal stem cells. Int J Biol Macromol. 2018;110:465–471. doi: 10.1016/j.ijbiomac.2018.01.003. [DOI] [PubMed] [Google Scholar]
- 33.Zhao D, Wang X, Cheng B, et al Degradation-kinetics-controllable and tissue-regeneration-matchable photocross-linked alginate hydrogels for bone repair. ACS Appl Mater Interfaces. 2022;14(19):21886–21905. doi: 10.1021/acsami.2c01739. [DOI] [PubMed] [Google Scholar]
- 34.Miao F, Liu T, Zhang X, et al Engineered bone tissues using biomineralized gelatin methacryloyl/sodium alginate hydrogels. J Biomater Sci Polym Ed. 2022;33(2):137–154. doi: 10.1080/09205063.2021.1980360. [DOI] [PubMed] [Google Scholar]
- 35.Huang X, Fu Q, Deng Y, et al Surface roughness of silk fibroin/alginate microspheres for rapid hemostasis in vitro and in vivo. Carbohydr Polym. 2021;253(1):117256. doi: 10.1016/j.carbpol.2020.117256. [DOI] [PubMed] [Google Scholar]
- 36.Jin J, Ji Z, Xu M, et al Microspheres of carboxymethyl chitosan, sodium alginate, and collagen as a hemostatic agent in vivo. ACS Biomater Sci Eng. 2018;4(7):2541–2551. doi: 10.1021/acsbiomaterials.8b00453. [DOI] [PubMed] [Google Scholar]
- 37.Wang Y, Wang P, Ji H, et al Analysis of safety and effectiveness of sodium alginate/poly (gamma-glutamic acid) microspheres for rapid hemostasis. ACS Appl Bio Mater. 2021;4(8):6539–6548. doi: 10.1021/acsabm.1c00671. [DOI] [PubMed] [Google Scholar]
- 38.Xie M, Zeng Y, Wu H, et al Multifunctional carboxymethyl chitosan/oxidized dextran/sodium alginate hydrogels as dressing for hemostasis and closure of infected wounds. Int J Biol Macromol. 2022;219:1337–1350. doi: 10.1016/j.ijbiomac.2022.08.166. [DOI] [PubMed] [Google Scholar]
- 39.Chang S, Qin D, Yan R, et al Temperature and pH dual responsive nanogels of modified sodium alginate and NIPAM for berberine loading and release. ACS Omega. 2021;6(2):1119–1128. doi: 10.1021/acsomega.0c03965. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Mao X, Li X, Zhang W, et al Development of microspheres based on thiol-modified sodium alginate for intestinal-targeted drug delivery. ACS Appl Bio Mater. 2019;2(12):5810–5818. doi: 10.1021/acsabm.9b00813. [DOI] [PubMed] [Google Scholar]