Abstract
Introducción.
El Registro Andaluz de Embarazos en pacientes con esclerosis múltiple (EM) es el mayor registro español sobre EM y planificación familiar. Por primera vez se incluye información sobre la fertilidad de hombres con EM. También se analizan la influencia del uso de un tratamiento modificador de la enfermedad (TME) en la salud del feto o recién nacido y el impacto de la lactancia materna en la EM.
Sujetos y métodos.
Es un estudio observacional, prospectivo y multicéntrico. El reclutamiento de pacientes se hizo entre diciembre de 2018 y diciembre de 2020. El seguimiento de las mujeres tras el parto fue de un año. Se incluyó a 100 mujeres y 16 hombres, con un total de 103 recién nacidos.
Resultados.
La tasa anualizada de brotes de las mujeres con EM descendió durante el embarazo de forma significativa (de 0,23 a 0,065). Un 11,2% de los pacientes recurrieron a técnicas de reproducción asistida para conseguir la gestación. No se encontró relación entre el uso de un TME en la concepción y/o embarazo y el riesgo de aborto, prematuridad o bajo peso al nacer. El 54,2% de las mujeres con EM optaron por dar lactancia (el 26,7% de ellas usando un TME).
Conclusiones.
La EM no afecta a la fertilidad de los hombres. Tampoco influye en ésta, ni en la salud de sus hijos, el uso de un TME en el momento de la concepción. Las técnicas de reproducción asistida no impactaron negativamente en la evolución de la EM. La lactancia se impone como una práctica habitual entre las mujeres con EM y no se evidencian efectos positivos o negativos sobre la evolución de la enfermedad.
Palabras clave: Embarazo, Esclerosis múltiple (EM), Hombres con esclerosis múltiple, Lactancia, Registro andaluz, Tratamiento modificador de la enfermedad (TME)
Abstract
Introduction.
The Andalusian Registry of Pregnancies in patients with multiple sclerosis is the largest Spanish registry on multiple sclerosis (MS) and family planning. For the first time, it includes information on the fertility of men with MS. The influence of the use of a disease-modifying treatment (DMT) on the health of the foetus/newborn and the impact of breastfeeding on MS are also analysed.
Subjects and methods.
This is a multicentre, prospective and observational study. Recruitment of patients took place between December 2018 and December 2020. Women were followed up for one year after delivery. Altogether 100 women and 16 men were included, with a total of 103 newborn infants.
Results.
The annualised relapse rate of the women with MS decreased significantly during pregnancy (from 0.23 to 0.065). A total of 11.2% of patients resorted to assisted reproductive techniques in order to conceive a child. No association was found between the use of a DMT at conception and/or pregnancy and the risk of miscarriage, prematurity or low birth weight. Over half the women with MS (54.2%) chose to breastfeed (26.7% of them while on a DMT).
Conclusions.
MS does not affect the fertility of men. Neither does the use of a DMT at the time of conception affect their fertility or their children’s health. Assisted reproductive techniques did not have a negative impact on the course of MS. Breastfeeding is a common practice among women with MS and there is no evidence of positive or negative effects on disease progression.
Key words: Andalusian registry, Breastfeeding, Disease-modifying therapy (DMT), Men with multiple sclerosis, Multiple sclerosis (MS), Pregnancy
Introducción
La esclerosis múltiple (EM) es una enfermedad neurológica, de base autoinmune, con una etiopatogenia multifactorial, que conlleva una afectación del sistema nervioso central del individuo que la padece [1,2], y está considerada como la segunda causa más frecuente de discapacidad en personas jóvenes [3]. En España se cuantifica un número de casos cercano a los 55.000 [3-5], con una tendencia creciente en las cifras de prevalencia e incidencia [4], que se establece entre los 80 y 180 casos/100.000 habitantes [5], y los 4,2 casos/100.000 habitantes/año, respectivamente. La ratio entre mujeres y hombres con EM se aproxima a 3:1 [6], y es frecuente que se diagnostique en lo que se considera como el período fértil de una persona (de los 18 a los 45 años); de hecho, se estima que entre un 20 y un 30% de las mujeres con EM tendrán un embarazo en los primeros años tras el diagnóstico [7].
A pesar de la ausencia de un consenso español de expertos sobre planificación familiar en la EM, está bien establecido que la gestación debe ser planificada y ha de tener lugar tras, al menos, un año de estabilidad clínica y radiológica [8-11]. Como consecuencia, es frecuente que las pacientes tengan que posponer su deseo gestacional, y es habitual que haya un retraso en la edad a la que consiguen ser madres con respecto a la media en mujeres sanas [10]. Esto puede dar lugar a un incremento en el número de pacientes que tienen que recurrir a una técnica de reproducción asistida [12]. Habitualmente, la evolución de la enfermedad, en el caso de mujeres con EM que deciden quedarse embarazadas, es favorable, ya que la tasa anualizada de brotes disminuye significativamente durante este período para incrementarse ligeramente tras el parto y volver a estabilizarse con el tiempo hasta alcanzar niveles previos a la gestación [9,13-15]. En cuanto a los resultados obstétricos, se han hallado tasas de aborto similares a las de mujeres sanas sin EM, y no se comunican mayores tasas de prematuridad ni de bajo peso al nacer, y no existe contraindicación para aplicar la analgesia epidural [9,16].
Tampoco se contraindica el uso de tratamientos modificadores de la enfermedad (TME), como interferón beta o acetato de glatiramer, en el momento en que se lleva la concepción [17], y estos u otros TME pueden mantenerse temporalmente durante la gestación si el balance beneficio-riesgo es favorable. De igual manera, ya hay estudios que aportan conocimiento sobre la lactancia materna en mujeres con EM, e incluso algunos abordan la posibilidad de usar un TME sin que ello genere problemas en el lactante [18-21].
A diferencia del Registro Andaluz de Embarazos en pacientes con Esclerosis Múltiple (RAEEM), otros estudios previos en España sobre EM y embarazo no han recogido datos sobre hombres con EM, analizando las consecuencias de la enfermedad y/o el uso de los TME en su fertilidad o la salud del feto. Si se desea conocer datos específicos sobre la planificación familiar en un hombre con EM, la bibliografía científica publicada al respecto es más bien escasa [21-23]. No fue objeto de evaluación en esos estudios la repercusión de la lactancia en la evolución de la EM, y los datos que conocemos se obtienen de los metaanálisis y artículos publicados en los últimos años [24,25]. Por estos motivos, los objetivos de este trabajo son: a) examinar la evolución de la EM en mujeres embarazadas; b) incluir a hombres en el análisis y evaluar el efecto de la EM en la fertilidad masculina; c) analizar la repercusión del uso de un TME en la salud del feto o recién nacido; y d) examinar el efecto de la lactancia materna en la evolución de la EM.
Sujetos y métodos
Diseño del estudio y selección de pacientes
El RAEEM es un registro observacional descriptivo, multicéntrico, longitudinal prospectivo, desarrollado en Andalucía. Incluye a todos los hombres y mujeres mayores de 18 años, con diagnóstico de EM o síndrome clínico aislado, que comunican en consulta un embarazo. Todos los pacientes firmaron un consentimiento informado para hacer constar por escrito su participación voluntaria (incluidas las parejas de varones con EM, que autorizaban así la consulta y el uso de los datos de salud del bebé tras el nacimiento). En todos los hospitales participantes se obtuvo la aprobación del comité de ética de investigación.
El período de inclusión de pacientes fue de diciembre de 2018 hasta diciembre de 2020, y se involucraron en el registro 11 hospitales. En el caso de las mujeres, se recogían datos en el momento de comunicar la gestación y en las consultas posteriores de seguimiento (una en cada trimestre gestacional, tras el parto, y a los seis y 12 meses tras haber dado a luz). En el caso de los hombres, se llevaba a cabo una recogida de datos inicial cuando comunicaban que su pareja estaba embarazada. Por último, cuando tenía lugar el nacimiento del bebé, se recogían datos sobre su salud y las posibles incidencias clínicas que hubieran tenido lugar. En total participaron 100 mujeres y 16 hombres, y hay datos de 103 recién nacidos.
Registro de variables
Se recogieron las variables siguientes:
– En mujeres con EM: edad en el momento del embarazo; tiempo de evolución de la EM (desde el diagnóstico hasta el embarazo); criterios de McDonald seguidos para el diagnóstico; fenotipo clínico; escala de discapacidad de Kurtzke (escala expandida del estado de discapacidad) previa al embarazo y al año del parto; tasa anualizada de brotes previa al embarazo, intraembarazo y al año del parto; concepción bajo la influencia de un TME; uso de TME en el embarazo; gestación simple o múltiple; gestación alcanzada usando técnicas de reproducción asistida; gestación planificada o imprevista; incidencias durante la gestación de cualquier tipo; brotes durante la gestación; neuroimagen durante la gestación; tratamiento para prevenir brotes posparto; tipo de parto; uso de analgesia epidural; aborto o recién nacido a término; número de hijos en la gestación actual; tipo de lactancia; y uso de TME en la lactancia.
– En hombres con EM: edad en el momento de la concepción; tiempo de evolución de la EM (desde el diagnóstico hasta la concepción); criterios de McDonald seguidos para el diagnóstico; fenotipo clínico; escala expandida del estado de discapacidad y tasa anualizada de brotes previas a la concepción; concepción bajo la influencia de un TME; gestación planificada o imprevista; gestación simple o múltiple; gestación alcanzada mediante técnicas de reproducción asistida; y recién nacido sano o aborto.
– En recién nacidos: semana de gestación en el momento del nacimiento (de la que se deduce si hay prematuridad o no); género; peso al nacimiento; Apgar al nacer; malformaciones; e incidencias en el nacimiento.
Análisis estadístico
Las variables cuantitativas se representan a través de la media y la desviación estándar, y las cualitativas se representan a través de la frecuencia y el porcentaje. Para estudiar las diferencias en las características de los pacientes, se aplicaron el test de la χ2 y/o el test exacto de Fisher. Además, se calcularon diferentes tasas con sus correspondientes intervalos de confianza. En todos los casos se considera como significativo un valor de p < 0,05. Los análisis estadísticos se llevaron a cabo con los programas IBM SPSS v.21, y R v.4.0.3.
Resultados
Las principales características de la población de estudio se recogen en la tabla.
Tabla.
Características generales de la cohorte del Registro Andaluz de Embarazos en pacientes con esclerosis múltiple.
| Total (116) | Mujeres (100) | Hombres (16) | |
|---|---|---|---|
| Edad (años), media, DE | 34,08 ± 4,32 | 34,22 ± 4,21 | 33,19 ± 5,03 |
|
| |||
| Tiempo evolución de la EM (meses), media, DE | 81,82 ± 60,57 | 84,55 ± 62,88 | 63,66 ± 39,55 |
|
| |||
| Fenotipo, n (%) | |||
|
| |||
| EMRR | 103 (88,8) | 89 (89) | 14 (87,5) |
|
| |||
| EMSP | 7 (6,03) | 6 (6) | 1 (6,25) |
|
| |||
| SCA | 6 (5,17) | 5 (5) | 1 (6,25) |
|
| |||
| EMPP | 0 (0) | 0 (0) | 0 (0) |
|
| |||
| Criterio de McDonald, n (%) | |||
|
| |||
| 2010 | 88 (75,9) | 74 (74) | 14 (87,5) |
|
| |||
| 2017 | 28 (24,1) | 26 (26) | 2 (12,5) |
|
| |||
| Método anticonceptivo, n (%) | |||
|
| |||
| No usa | 32 (27,6) | 26 (26) | 6 (37,5) |
|
| |||
| Preservativo | 48 (41,4) | 41 (41) | 7 (43,75) |
|
| |||
| Píldora | 30 (25,9) | 29 (29) | 1 (6,25) |
|
| |||
| Otros | 5 (4,3) | 4 (4) | 1 (6,25) |
|
| |||
| Se desconoce el dato | 1 (0,9) | 0 (0) | 1 (6,25) |
|
| |||
| N.o de hijos previos, n (%) | |||
|
| |||
| 0 | 70 (60,3) | 60 (60) | 10 (62,5) |
|
| |||
| 1 | 31 (26,7) | 28 (28) | 3 (18,8) |
|
| |||
| 2 | 11 (9,5) | 11 (11) | 0 (0) |
|
| |||
| 3 | 1 (0,9) | 1 (1) | 0 (0) |
|
| |||
| Se desconoce el dato | 3 (2,6) | 0 (0) | 3 (18,8) |
|
| |||
| N.o de abortos previos, n (%) | |||
|
| |||
| 0 | 81 (69,8) | 68 (68) | 13 (81,3) |
|
| |||
| 1 | 26 (22,4) | 26 (26) | 0 (0) |
|
| |||
| 2 | 5 (4,3) | 5 (5) | 0 (0) |
|
| |||
| 3 | 1 (0,9) | 1 (1) | 0 (0) |
|
| |||
| Se desconoce el dato | 3 (2,6) | 0 (0) | 3 (18,8) |
|
| |||
| N.o de hijos por gestación actual, n (%) | |||
|
| |||
| 1 | 108 (93,1) | 95 (95) | 13 (81,25) |
|
| |||
| 2 | 6 (5,2) | 4 (4) | 2 (12,5) |
|
| |||
| 3 | 1 (0,9) | 1 (1) | 0 (0) |
|
| |||
| Se desconoce el dato | 1 (0,9) | 0 (0) | 1 (6,25) |
|
| |||
| Gestación planificada, n (%) | |||
|
| |||
| Sí | 96 (82,8) | 82 (82) | 14 (87,5) |
|
| |||
| No | 20 (17,2) | 18 (18) | 2 (12,5) |
|
| |||
| Período de lavado del TME, n (%) | |||
|
| |||
| Sí | 19 (16,4) | 18 (18) | 1 (6,25) |
|
| |||
| No | 73 (62,9) | 60 (60) | 13 (81,25) |
|
| |||
| No se necesita | 24 (20,7) | 22 (22) | 2 (12,5) |
|
| |||
| Tipo de parto, n (%) | |||
|
| |||
| Vaginal sin instrumental | 45 (54,25) | NP | |
|
|
|
||
| Vaginal con instrumental | 21 (25,5) | ||
|
|
|
||
| Cesárea | 17 (20,25) | ||
|
|
|
||
| Con epidural | 66 (79,5) | ||
|
|
|
||
| Sin epidural | 17 (20,5) | ||
|
| |||
| Lactancia, n (%) | |||
|
| |||
| No | 38 (45,8) | NP | |
|
|
|
||
| Por decisión propia | 25 (65,8) | ||
|
|
|
||
| Por recomendación del neurólogo | 13 (34,2) | ||
|
|
|
||
| Sí | 45 (54,2) | ||
|
|
|
||
| Exclusiva | 35 (77,8) | ||
| Combinada | 10 (22,2) | ||
| ≤6 meses | 28 (66,7) | ||
| >6 meses | 14 (33,33) | ||
| Con TME | 12 (26,7) | ||
| Sin TME | 33 (73,33) | ||
DE: desviación estándar; EM: esclerosis múltiple; EMPP: esclerosis múltiple primaria progresiva; EMRR: esclerosis múltiple remitente-recurrente; EMSP: esclerosis múltiple secundaria progresiva; NP: no procede; SCA: síndrome clínico aislado; TME: tratamiento modificador de la enfermedad.
En la evolución de la EM en las mujeres participantes, observamos cómo la tasa anualizada de brotes descendió durante el embarazo (de 0,23 a 0,065) y se incrementó ligeramente al año del parto (0,185). Sólo seis pacientes sufrieron un brote de la enfermedad en el embarazo, no se hizo estudio de neuroimagen a ninguna de ellas y se administró tratamiento sintomático únicamente a una de ellas.
Las técnicas de reproducción asistida para conseguir la gestación se emplearon en un 11,2% de los pacientes del registro (tres hombres y 10 mujeres). La técnica más usada fue la fecundación in vitro, y fruto de estos tratamientos nacieron 16 bebés (ocho gestaciones simples y cuatro gemelares). La edad de las mujeres con EM sometidas a técnicas de reproducción asistida fue algo mayor que la media de la cohorte (35,6 ± 5,89 años) y en ningún caso se produjeron brotes durante el embarazo ni en el año de seguimiento.
En el transcurso del embarazo apenas se comunicaron incidencias (Fig. 1). Las más comunes fueron el aborto espontáneo (el 13,89% de los casos, todos ellos en el grupo de mujeres con EM), seguido de la diabetes gestacional (el 6,04% de los casos).
Figura 1.
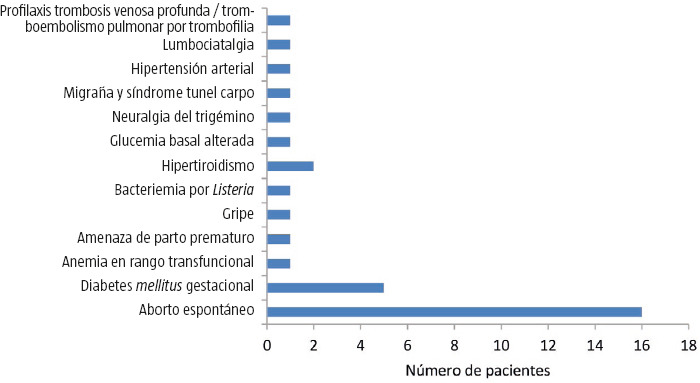
Complicaciones e incidencias durante la gestación en mujeres con esclerosis múltiple.
El número total de recién nacidos sanos fue de 103 (86 en el grupo de las mujeres con EM y 17 en el grupo de los hombres con EM), con unas tasas de prematuridad y bajo peso al nacer del 8,73 y el 16,5%, respectivamente.
Un 54,2% de las mujeres con EM optó por dar lactancia, que fue mayoritariamente exclusiva y por un período de tiempo igual o inferior a los seis meses. Hasta en 12 casos, la lactancia se llevó a cabo mientras se usaba un TME (acetato de glatiramer, ocho; e interferón beta, cuatro) (Tabla). No se encontraron diferencias estadísticamente significativas en la evolución de la EM al año del parto, medida por la tasa anualizada de brotes (p = 0,094) o por la escala expandida del estado de discapacidad (p = 0,457), entre el grupo que daba lactancia y el que no. Tampoco se hallaron diferencias entre los grupos según el tipo de lactancia (exclusiva o combinada), el tiempo de ésta (más o menos de seis meses) o si se hacía usando un TME.
El 37,06% de los pacientes no estaba usando un TME antes de que se produjera la gestación. De este grupo, el 12,5% de los hombres y el 18% de las mujeres habían llevado a cabo un período de lavado del TME, mientras que en un 6% de los casos se relacionó con que el TME (alemtuzumab o cladribina) usado no se podía considerar que influyera en la concepción, y hay hasta un 16% de mujeres en las que no se recoge el motivo específico que da lugar a esta circunstancia. Por el contrario, el 60% de las mujeres y el 86,7% de los hombres estaban usando un TME en el momento en que tuvo lugar la concepción. Hasta un 45% de las mujeres lo mantuvo en el embarazo durante una media de 141,11 ± 100,37 días (Figs. 2 y 3), y, tras el parto, un 25,3% no reinició el TME, sin un motivo específico que lo justifique hasta en dos tercios de los casos.
Figura 2.
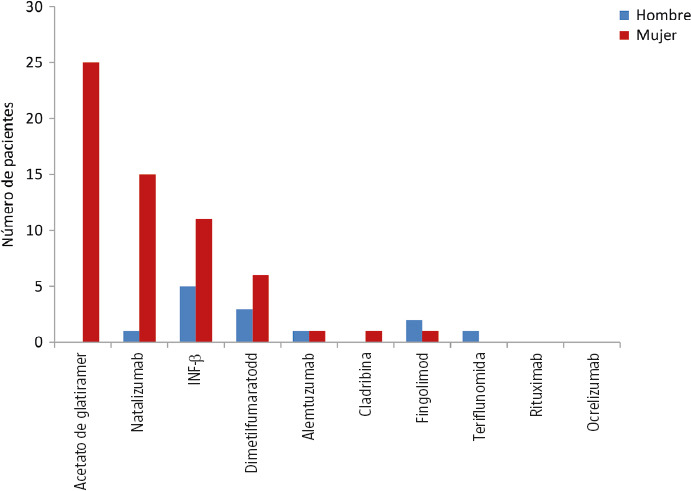
Tratamientos modificadores de la enfermedad que influyen en la concepción.
Figura 3.
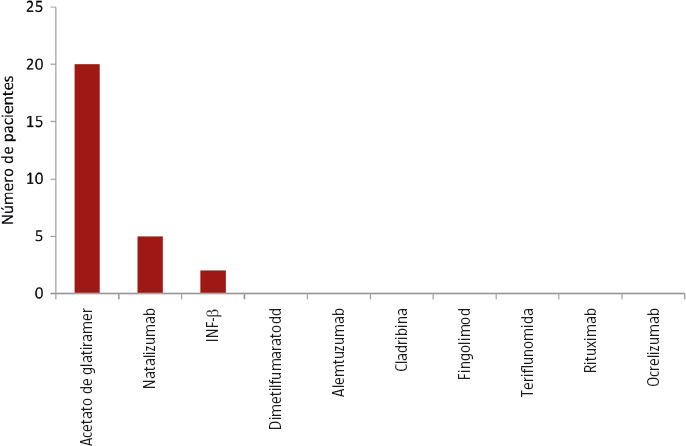
Tratamientos modificadores de la enfermedad que las mujeres con esclerosis múltiple mantienen durante el embarazo.
Tanto en hombres como en mujeres con EM no se establece una relación entre el uso de un TME en el momento de la concepción y aborto espontáneo (p = 0,788), parto prematuro (p = 0,732) o bajo peso al nacer (p = 0,284). Tampoco existe correspondencia entre estos parámetros y el empleo temporal de un TME durante el embarazo en mujeres con EM (p = 0,76, p = 0,67 o p = 0,336, para aborto espontáneo, parto prematuro y bajo peso al nacer, respectivamente).
Discusión
El trabajo que presentamos respalda la evolución habitual de la EM en una mujer que lleva a cabo un embarazo, ya que apreciamos una marcada disminución de la tasa anualizada de brotes durante este período y en el seguimiento anual tras el parto, datos que están en la misma línea de análisis previos [9,14]. En cuanto a los resultados obstétricos, la tasa de abortos espontáneos en el RAEEM es concordante con lo que se conoce en mujeres sanas sin EM [26,27], al igual que ocurre con la tasa de prematuridad [28] y la tasa de complicaciones en la gestación, como, por ejemplo, la diabetes [29]. Hallazgos similares se han comunicado en otros estudios españoles sobre EM y embarazo [30-32]. Sin embargo, en el presente análisis, hay un porcentaje de casos de bajo peso al nacer mayor de lo que se ha publicado en mujeres españolas sanas [33], lo que puede deberse a la mayor edad a la que las mujeres con EM alcanzan la gestación, a que la EM es una enfermedad crónica o a que algunos casos han tenido lugar en el contexto de un embarazo múltiple. Estas y otras circunstancias están reconocidas como factores predisponentes del bajo peso al nacer en mujeres sanas [33,34].
El porcentaje de pacientes que recurrió a una técnica de reproducción asistida para conseguir una gestación fue ligeramente mayor que lo comunicado por la Sociedad Española de Fertilidad en 2019 (9,5% frente a 11,2%, respectivamente) [35]. Este incremento puede estar relacionado con el hecho de que Andalucía es la región donde más técnicas de reproducción asistida se practican (14,6%) [35] o puede ser consecuencia de la mayor edad de las personas que recurren a estos tratamientos. En las pacientes con EM monitorizadas en nuestro registro, las técnicas de reproducción asistida se mostraron como tratamientos seguros que no alteraron el curso de su enfermedad, al no apreciarse reactivación de ésta en forma de brotes en ningún momento del embarazo o durante el año de seguimiento tras el parto.
Los resultados que hemos obtenido relativos al uso de determinados TME en el momento de la concepción o durante el embarazo avalan su seguridad, al no poder relacionarlos con mayores tasas de abortos espontáneos, prematuridad o bajo peso al nacer. Estos datos coinciden con los obtenidos en otros grupos de pacientes con EM, como, por ejemplo, los que se han dado a conocer de la cohorte danesa [36,37].
Al ser el RAEEM el primer registro en España donde se recogen datos de hombres con EM, recalcamos la importancia de considerar la planificación familiar como un tema que se debe tratar de forma rutinaria en consulta con ellos, como se hace en el caso de las mujeres con EM. En el caso de los hombres, la elección de un TME también va a influir directamente en una posible concepción, y debemos tenerlo en cuenta para escoger el mejor perfil farmacológico. De acuerdo con los resultados derivados del análisis, es posible afirmar que ni la EM ni el uso de los TME incluidos en este estudio repercuten en la fertilidad de los hombres ni en la salud de sus bebés.
Finalmente, la evaluación del efecto de la lactancia materna en la evolución de la EM en el elevado porcentaje de mujeres que optaron por ella, algunas bajo el uso activo de un TME, no nos permite emitir una recomendación específica al no haber encontrado diferencias estadísticamente significativas entre los grupos.
Conclusiones
El RAEEM representa el mayor registro publicado sobre EM y planificación familiar en nuestro país, y el único que incluye también información sobre hombres con EM. En estos pacientes, ni su fertilidad ni la salud de sus bebés se alteran por la enfermedad ni por el uso de un TME. La evolución favorable de la EM en las mujeres que afrontan un embarazo es la norma. Las técnicas de reproducción asistida son seguras y no impactan negativamente en la EM. La opción de la lactancia materna se impone entre las mujeres con EM, incluso bajo el uso de un TME.
Agradecimientos:
A todos los pacientes que han prestado su colaboración al estudio, a FIBAO por el soporte técnico y humano y a todos los neurólogos participantes, sin los cuales no habría sido posible la elaboración del registro.
Bibliografía
- 1.Compston A, Coles A. Multiple sclerosis. Lancet. 2008;372:1502–17. doi: 10.1016/S0140-6736(08)61620-7. [DOI] [PubMed] [Google Scholar]
- 2.Buzzard K, Chan WH, Kilpatrick T, Murray S. Multiple sclerosis:basic and clinical. Adv Neurobiol. 2017;15:211–52. doi: 10.1007/978-3-319-57193-5_8. [DOI] [PubMed] [Google Scholar]
- 3.Aguilar-Zambalamberri B, Arnal-García MC, Brieva-Ruiz L, Caballero-Martínez F, Calles-Hernández MC, Campos-Lucas FJ, et al. Libro blanco esclerosis múltiple en España 2020. Madrid: Universidad Francisco de Vitoria; 2020. [Google Scholar]
- 4.García-López FJ, García-Merino A, Alcalde-Cabero E, Pedro-Cuesta J. Incidence and prevalence of multiple sclerosis in Spain:a systematic review, Neurologia (Engl Ed) 2022 doi: 10.1016/j.nrleng.2022.02.004. [Online ahead of print] [DOI] [PubMed] [Google Scholar]
- 5.Pérez-Carmona N, Fernández-Jover E, Sempere AP. Epidemiología de la esclerosis múltiple en España. Rev Neurol. 2019;69:32–8. doi: 10.33588/rn.6901.2018477. [DOI] [PubMed] [Google Scholar]
- 6.Houtchens M, Edwards N, Schneider G, Stern K, Phillips A. Pregnancy rates and outcomes in women with and without MS in the United States. Neurology. 2018;91:e1559–69. doi: 10.1212/WNL.0000000000006384. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Weinshenker BG, Hader W, Carriere W, Baskerville J, Ebers GC. The influence of pregnancy on disability from multiple sclerosis:a population-based study in Middlesex County, Ontario. Neurology. 1989;39:1438–44. doi: 10.1212/wnl.39.11.1438. [DOI] [PubMed] [Google Scholar]
- 8.Coyle PK. Managment of women with multiple sclerosis through pregnancy and after childbirth. Ther Adv Neurol Disord. 2016;9:198–210. doi: 10.1177/1756285616631897. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Mendibe-Bilbao M, Boyero-Durán S, Bárcena-Llona J, Rodriguez-Antigüedad A. Esclerosis múltiple, maternidad y cuestiones relacionadas con el género. Neurologia. 2019;34:259–69. doi: 10.1016/j.nrl.2016.06.005. [DOI] [PubMed] [Google Scholar]
- 10.Kristen MK, Dobson R, Alroughani R, Amato MP, Bove R, Ciplea A. Family planning considerations in people with multiple sclerosis. Lancet Neurol. 2023;22:350–66. doi: 10.1016/S1474-4422(22)00426-4. [DOI] [PubMed] [Google Scholar]
- 11.Vukusic S, Carra-Dalliere C, Ciron J, Maillart E, Michel L, Leray E, et al. Pregnancy and multiple sclerosis:2022 recommendations from the French multiple sclerosis society. Mult Scler. 2023;29:11–36. doi: 10.1177/13524585221129472. [DOI] [PubMed] [Google Scholar]
- 12.Oreja-Guevara C, Rabanal A, Hernández-Rodríguez C, Aladro-Benito Y, Mendibe-Bilbao M, González-Suarez I, et al. Assisted reproductive techniques in multiple sclerosis:recommendations from an expert panel. Neurol Ther. 2023;12:427–39. doi: 10.1007/s40120-023-00439-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.McDonald SC, McElrath TF, Hernández-Díaz S. Pregnancy outcomes in women with multiple sclerosis. Am J Epidemiol. 2019;188:57–66. doi: 10.1093/aje/kwy197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Confavreux C, Hutchinson M, Hours M, Cortinovis P, Moreau T, et al. Rate of pregnancy related relapse in multiple sclerosis. N Engl J Med. 1998;339:285–91. doi: 10.1056/NEJM199807303390501. [DOI] [PubMed] [Google Scholar]
- 15.Dobson R, Jokubaitis V, Giovannoni G. Change in pregnancy-associated multiple sclerosis relapse rate over time:a meta-analysis. Mult Scler Relat Disord. 2020;44:102241. doi: 10.1016/j.msard.2020.102241. [DOI] [PubMed] [Google Scholar]
- 16.Mahlanza TD, Manieri MC, Klawiter EC, Solomon AJ, Lathi E, Ionete C, et al. Prospective growth and developmental outcomes in infants born to mothers with multiple sclerosis. Mult Scler. 2021;27:79–89. doi: 10.1177/1352458520904545. [DOI] [PubMed] [Google Scholar]
- 17.Dobson R, Dassan P, Roberts M, Giovannoni G, Nelson-Piercy C, Brex PA. UK consensus on pregnancy in multiple sclerosis:'Association of British Neurologists'guidelines. Pract Neurol. 2019;19:106–14. doi: 10.1136/practneurol-2018-002060. [DOI] [PubMed] [Google Scholar]
- 18.Ciplea AI, Kurzeja A, Thiel S, Haben S, Alexander J, Adamus E, et al. Eighteen-month safety analysis of offspring breastfed by mothers receiving glatiramer acetate therapy for relapsing multiple sclerosis –COBRA study. Mult Scler. 2022;28:1641–50. doi: 10.1177/13524585221083982. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Ciplea AI, Langer-Gould A, Stahl A, Thiel S, Queisser-Wahrendorf A, Gold R, et al. Safety of potential breast milk exposure to IFN-βor glatiramer acetate:one-year infant outcomes. Neurol Neuroimmunol Neuroinflamm. 2020;7:e757. doi: 10.1212/NXI.0000000000000757. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Sánchez-Velasco S, Midaglia L, Vidal Jordana À, Castillo F, Horno R, Carreras E, et al. Fármacos modificadores de la enfermedad en la esclerosis múltiple durante la lactancia:revisión de la evidencia actual. Rev Neurol. 2023;76:21–30. doi: 10.33588/rn.7601.2022404. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lu E, Zhu F, Zhao Y, Van der Kop M, Synnes A, Dahlgren L, et al. Birth outcomes in newborns fathered by men with multiple sclerosis exposed to disease-modifying drugs. CNS Drugs. 2014;28:475–82. doi: 10.1007/s40263-014-0154-6. [DOI] [PubMed] [Google Scholar]
- 22.Pecori C, Giannini M, Portaccio E, Ghezzi A, Hakiki B, Pastó L, et al. Paternal therapy with disease modifying drugs in multiple sclerosis and pregnancy outcomes:a prospective observational multicentric study. BMC Neurol. 2014;14:114. doi: 10.1186/1471-2377-14-114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Massarotti C, Sbragia E, Gazzo I, Stigliani S, Inglese M, Anserini P. Effect of multiple sclerosis and its treatments on male fertility:cues for future research. J Clin Med. 2021;10:5401. doi: 10.3390/jcm10225401. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Ghiasian M, Nouri M, Moghadasi AN, Ghaffari M. Effect of pregnancy and exclusive breastfeeding on multiple sclerosis relapse rate and degree of disability within two years after delivery. Clin Neurol Neurosurg. 2020;194:105829. doi: 10.1016/j.clineuro.2020.105829. [DOI] [PubMed] [Google Scholar]
- 25.Krysko KM, Rutatangwa A, Graves J, Lazar A, Waubant E. Association between breastfeeding and postpartum multiple sclerosis relapses:a sistematyc review and meta-analysis. JAMA Neurol. 2020;77:327–38. doi: 10.1001/jamaneurol.2019.4173. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Quenby S, Gallos ID, Dhillon-Smith RK, Podesek M, Stephenson MD, Fisher J, et al. Miscarriage matters:the epidemiological, physical, psychological, and economic costs of early pregnancy loss. Lancet. 2021;397:1658–67. doi: 10.1016/S0140-6736(21)00682-6. [DOI] [PubMed] [Google Scholar]
- 27.Magnus MC, Wilcox AJ, Morken NH, Weinberg CR, Haberg SE. Role of maternal age and pregnancy history in risk of miscarriage:prospective register based study. BMJ. 2019;364:1869. doi: 10.1136/bmj.l869. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Rellán-Rodríguez S, García-de Ribera C, Aragón-García MP. El recién nacido prematuro. Protocolos diagnóstico-terapéuticos de la Asociación Española de Pediatría (AEP):Neonatología. Actualización año. 2008. URL: https://www.aeped.es/sites/default/files/documentos/8_1.pdf . Fecha última consulta:03.06.2023.
- 29.Ricart W, Lopez J, Mozas J, Pericot A, Sancho MA, Gonzalez N, et al. Potential impact of American Diabetes Association (2000) criteria for diagnosis of gestational diabetes mellitus in Spain. Diabetología. 2005;48:1135–41. doi: 10.1007/s00125-005-1756-9. [DOI] [PubMed] [Google Scholar]
- 30.De las Heras V, De Andrés C, Téllez N, Tintoré M. Pregnancy in multiple sclerosis patients treated with immunomodulators prior to or during part of the pregnancy:a descriptive study in the Spanish population. Mult Scler. 2007;13:981–4. doi: 10.1177/1352458507077896. [DOI] [PubMed] [Google Scholar]
- 31.Cuello JP, Martínez Ginés ML, Martin Barriga ML, de Andrés C. Multiple sclerosis and pregnancy:a single-centre prospective comparative study. Neurología (Engl Ed) 2017;32:92–8. doi: 10.1016/j.nrl.2014.12.015. [DOI] [PubMed] [Google Scholar]
- 32.Cuello JP, Salgado-Cámara P, García-Domínguez JM, Lozano-Ros A, Mas-Serrano M, Martínez-Ginés ML. Exposición a fármacos modificadores de la enfermedad durante el embarazo en esclerosis múltiple:estudio prospectivo. Med Clin. 2020;154:214–7. doi: 10.1016/j.medcli.2019.05.026. [DOI] [PubMed] [Google Scholar]
- 33.Instituto Nacional de Estadística (INE) Cifras oficiales de Nacimientos por tipo de parto, peso del nacido y grupo de edad de la madre, año. 2019. URL: https://www.ine.es/jaxi/Tabla.htm?path=/t20/e301/nacim/a2019/l0/&file=01012.px&L=0 . Fecha última consulta:03.06.2023.
- 34.García-Reymundo M, Demestre X, Calvo MJ, Ginovart G, Jiménez A, Hurtado JA. Late preterm infants in Spain:experience of the 34-36 neonatal group. An Pediatr (Engl Ed) 2018;88:246–52. doi: 10.1016/j.anpedi.2017.05.006. [DOI] [PubMed] [Google Scholar]
- 35.Sociedad Española de Fertilidad. Registro Nacional de Actividad 2019-Registro SEF. URL: https://cnrha.sanidad.gob.es/registros/pdf/Informe_estadistico-SEF_2019.pdf . Fecha de última consulta:03.06.2023.
- 36.Andersen JB, Sellebjerg F, Magyari M. Pregnancy outcomes after early fetal exposure injectable first-line treatments, dimethyl fumarate, or natalizumab in Danish women with multiple sclerosis. Eur J Neurol. 2023;30:162–71. doi: 10.1111/ene.15559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Andersen J, Mober JY, Spelman T, Magyari M. Pregnancy outcomes in men and women treated with teruflunomide. A population-based nationwide Danish register study. Front Immunol. 2018;9:2706. doi: 10.3389/fimmu.2018.02706. [DOI] [PMC free article] [PubMed] [Google Scholar]


