Abstract
目的
探讨肠道菌群对坏死性小肠结肠炎(necrotizing enterocolitis,NEC)新生大鼠模型造血系统的影响。
方法
Sprague-Dawley新生大鼠随机分为对照组和模型组(NEC组),每组6只。采用配方奶结合缺氧和冷刺激构建NEC新生大鼠模型。苏木精-伊红染色观察肠组织及造血相关器官病理变化;检测各组血常规;免疫组化法检测造血相关器官中特定细胞的改变;流式细胞术检测骨髓中特定细胞的变化;采用16S rDNA测序技术检测分析各组肠道菌群的组成及丰度。
结果
与对照组比较,NEC组肠组织充血坏死,肠绒毛破损、萎缩脱落,NEC病理评分显著增加;NEC组外周血白细胞及淋巴细胞计数显著低于对照组(P<0.05);NEC组脾脏、胸腺、骨髓的有核细胞及肝脏的嗜碱性细胞核的小细胞聚集体数量均明显少于对照组;NEC组肝脏中CD71+红系祖细胞显著减少,脾脏、骨髓中的CD45+白细胞及胸腺中的CD3+ T淋巴细胞显著降低,骨髓中CD45+CD3-CD43+SSChi的中性粒细胞比例明显下降(P<0.05);NEC组肠道菌群组成与对照组比较差异明显,NEC组利乳杆菌属的相对丰度降低,而埃希菌-志贺菌属的相对丰度显著升高(P<0.05),取代利乳杆菌属成为优势菌属。
结论
NEC新生大鼠模型存在多谱系造血异常,可能与肠道微生物稳态失衡及致病菌属埃希菌-志贺菌属的异常扩增有关。
Keywords: 坏死性小肠结肠炎, 造血异常, 肠道菌群, 新生大鼠
Abstract
Objective
To study the effect of gut microbiota on hematopoiesis in a neonatal rat model of necrotizing enterocolitis (NEC).
Methods
Neonatal Sprague-Dawley rats were randomly divided into a control group and a model group (NEC group), with 6 rats in each group. Formula milk combined with hypoxia and cold stimulation was used to establish a neonatal rat model of NEC. Hematoxylin and eosin staining was used to observe the pathological changes of intestinal tissue and hematopoiesis-related organs. Routine blood tests were conducted for each group. Immunohistochemistry was used to observe the changes in specific cells in hematopoiesis-related organs. Flow cytometry was used to measure the changes in specific cells in bone marrow. 16S rDNA sequencing was used to observe the composition and abundance of gut microbiota.
Results
Compared with the control group, the NEC group had intestinal congestion and necrosis, damage, atrophy, and shedding of intestinal villi, and a significant increase in NEC histological score. Compared with the control group, the NEC group had significantly lower numbers of peripheral blood leukocytes and lymphocytes (P<0.05), nucleated cells in the spleen, thymus, and bone marrow, and small cell aggregates with basophilic nuclei in the liver (P<0.05). The NEC group had significant reductions in CD71+ erythroid progenitor cells in the liver, CD45+ lymphocytes in the spleen and bone marrow, CD3+ T lymphocytes in thymus, and the proportion of CD45+CD3-CD43+SSChi neutrophils in bone marrow (P<0.05). There was a significant difference in the composition of gut microbiota between the NEC and control groups, and the NEC group had a significant reduction in the abundance of Ligilactobacillus and a significant increase in the abundance of Escherichia-Shigella (P<0.05), which replaced Ligilactobacillus and became the dominant flora.
Conclusions
Multi-lineage hematopoietic disorder may be observed in a neonatal rat model of NEC, which may be associated with gut microbiota dysbiosis and abnormal multiplication of the pathogenic bacteria Escherichia-Shigella.
Keywords: Necrotizing enterocolitis, Hematopoietic disorder, Gut microbiota, Neonatal rat
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是早产儿(胎龄<32周或出生体重<1 500 g)最为常见的致死性肠道疾病[1],幸存者也存在短肠综合征、神经发育迟缓等远期并发症[2]。在过去的几十年里,NEC的预防和治疗方面进展甚微,目前NEC仍然以支持性治疗为主[3]。NEC的发病因素极为复杂,涉及不成熟的胃肠道屏障、微生物定植异常、感染、炎症和肠道缺血缺氧等[4]。正常的肠道屏障需要对抗病原体和毒素等有害抗原的侵害,同时又能容纳和耐受有益的共生细菌。肠道细菌病原体和共生细菌之间稳态的失衡会进一步破坏早产儿原本不成熟的肠道屏障,引发不受控制的炎症反应,造成肠组织损伤从而导致NEC[5]。肠道微生物群衍生的内毒素或有害代谢产物还会渗漏到血液中,相关内毒素血症引起的全身炎症反应及多系统衰竭是NEC死亡的重要原因[6]。
1976年,Hutter等[7]首次报道了患有严重NEC的婴儿存在血小板减少症、粒细胞计数降低、溶血性贫血等与NEC相关的血液学异常。尽管并不是所有的NEC病例死亡都归因于血液学并发症,但研究发现血液学异常对NEC的病死率有显著影响,且与预后较差密切相关[8]。研究发现,NEC死亡患儿中,血小板减少症和中性粒细胞减少症的发生率比幸存者更高[9]。目前认为导致NEC相关血液学异常的可能机制包括造血生长因子水平过低、炎症因子水平过高等[8],其机制迄今仍未完全阐明。最近的研究表明,肠道菌群在正常造血中也发挥重要作用。与肠道菌群改变相关的人类疾病(如炎症性肠病)或长期使用抗生素,均与不良血液学影响有关,包括贫血和中性粒细胞减少[10]。然而,NEC中肠道微生物稳态与造血之间的关联仍是未知。本研究通过构建NEC新生大鼠模型,对其造血系统进行分析,并采用16S rDNA测序技术分析动物模型肠道微生态变化情况以探究其与造血系统之间的关联。从肠道微生物稳态角度探讨NEC相关血液学异常的可能机制,为寻找更有效的NEC防治手段提供新思路。
1. 材料与方法
1.1. 动物及主要试剂
SPF级成年健康雌、雄Sprague-Dawley大鼠各6只,体重约220 g,购于武汉云克隆动物有限公司,许可证号:SCXK(鄂)2018-0021。将雌、雄大鼠按1∶1比例合笼,饲养于屏障环境中,产仔后取新生大鼠进行实验。
宠物专用奶粉购自美国Pet-Ag公司,婴儿配方奶粉购自中国雅培公司;苏木精-伊红(hematoxylin-eosin,HE)染液、CD45兔源多克隆抗体、CD3兔源多克隆抗体购自武汉赛维尔生物科技有限公司;CD71小鼠单克隆抗体购自美国Santa Cruz公司;抗大鼠CD45-PE/Cy7和抗大鼠CD43-PE流式抗体购自美国BioLegend公司;抗大鼠CD3-APC流式抗体购自美国eBioscience公司;柠檬酸抗原修复缓冲液、牛血清白蛋白、磷酸盐缓冲溶液、辣根过氧化物酶标记的二抗、DAB显色液均购自武汉赛维尔生物科技有限公司。
1.2. NEC新生大鼠模型的建立
NEC动物模型的建立方法参照参考文献[11],将出生24 h内体重6~8.5 g的新生大鼠随机分为两组:对照组和模型组(NEC组)。因NEC造模有一定死亡率,为保证有足够新生大鼠用于后续实验,对照组入组6只,NEC组入组15只。对照组新生大鼠由母鼠喂养。NEC组新生大鼠与母鼠分离,每隔6~8 h给予40 μL/g的配方奶粉(15 g婴儿配方奶粉/75 mL宠物奶粉)灌胃。NEC组进行缺氧处理(95% N2和5% O2 2 min,3次/d),并予以4℃冷刺激(5 min/次,2次/d,连续4 d)。最终NEC组存活新生大鼠6只用于后续实验。
1.3. 血常规检测
取各组新生大鼠外周血(乙二胺四乙酸盐抗凝),采用兽用全自动血液细胞分析仪进行血常规检测。
1.4. HE染色
各组新生大鼠造模4 d后经颈椎脱臼法处死,取胃肠道组织进行拍照后,剪取回肠末端组织放入4%多聚甲醛固定;另外剪取肝、脾、胸腺、股骨等组织放入4%多聚甲醛固定至少24 h后经梯度乙醇脱水、浸蜡、包埋,制作石蜡切片,厚度4 μm。石蜡切片经脱蜡至水后,进行HE染色,脱水、封片后采用正置光学显微镜观察并拍照。依照文献[12]的NEC病理评分标准:评分为0分(正常)、1分(轻度NEC:绒毛核心分离,无其他异常)、2分(中度NEC:绒毛核心分离、黏膜下水肿和上皮脱落)和3分(重度NEC:上皮剥落伴绒毛缺失、全层坏死)。每组随机选6张玻片进行病理评分。
1.5. 免疫组化染色
将石蜡切片脱蜡至水后置于柠檬酸抗原修复缓冲液中进行微波抗原修复,采用3%双氧水阻断内源性过氧化物酶及3% BSA封闭后,加一抗(CD71、CD45、CD3)4℃孵育过夜,一抗稀释比分别为1∶100、1∶2 000、1∶150,PBS洗涤3次后,加与一抗对应种属的HRP标记的二抗(1∶200稀释),室温孵育50 min。PBS洗涤3次,DAB显色,自来水冲洗终止显色。苏木精复染,乙醇脱水后二甲苯透明,封片后采用正置光学显微镜观察拍照,并用Image J软件进行定量分析。
1.6. 骨髓细胞流式细胞分析
用眼科剪取新生大鼠的两条后肢,剥离肌肉,分别剪下股骨和胫骨,剪去两端软骨露出骨髓腔,用吸有PBS的1 mL注射器,插入并重复冲洗骨髓腔并经70 μm细胞筛网过滤以获得骨髓单细胞悬液。加入CD45-PE/Cy7、CD43-PE、CD3-APC流式抗体,4℃孵育30 min,PBS洗涤后,依照已有的大鼠骨髓细胞流式分析方法[13],采用流式细胞仪检测各细胞比例。
1.7. 16S rDNA测序
分别收集对照组和NEC组大鼠肠道内容物进行16S rDNA测序分析。微生物组总DNA提取后经琼脂糖凝胶电泳质检及紫外分光光度计定量。采用相应引物对V3-V4片段进行PCR扩增,引物序列为341 F:5'-CCTACGGGNGGCWGCAG-3';805 R:5'-GACTACHVGGGTATCTAATCC-3'。PCR产物经2%琼脂糖凝胶电泳确证,由AMPure XT beads(美国贝克曼库尔特有限公司)纯化、回收,Qubit(英潍捷基上海贸易有限公司)定量。采用美国Illumina文库定量试剂盒建库后使用NovaSeq 6000测序仪进行2×250 bp的双端测序。测序获得数据经拆分、拼接、过滤、去噪后获得ASV(Amplicon Sequence Variant)特征序列和丰度信息,以进行多样性及物种差异分析。样本处理、测序及结果分析等服务由上海百趣生物医学科技有限公司提供。
1.8. 统计学分析
采用GraphPad Prism 7.0软件进行统计学分析,计量资料以均数±标准差( )表示,两组间比较采用两样本t检验;16S数据分析采用R软件,非正态分布的计量资料以中位数(四分位数间距)[M(P 25,P 75)]表示,组间比较采用Mann-Whitney U秩和检验,Alpha多样性分析采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2. 结果
2.1. NEC新生大鼠模型的建立
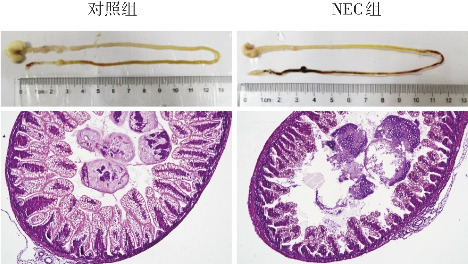
观察对照组和NEC组新生大鼠胃肠道组织外观发现,与对照组比较,NEC组大鼠肠组织明显充血,呈黑色坏死样;HE染色结果显示,与对照组比较,NEC组大鼠肠组织肠绒毛破损、萎缩脱落,为NEC肠组织的典型病理表现(图1);NEC组病理评分显著高于对照组[(2.33±0.21)分vs(0.33±0.21)分;t=6.708,P<0.05)]。
图1. 两组新生大鼠肠组织外观和末端回肠的HE染色比较(×100) NEC组新生大鼠肠组织明显充血,呈黑色坏死样;NEC组新生大鼠肠组织肠绒毛破损、萎缩脱落。.
2.2. 两组血常规指标比较
血常规检测结果显示,NEC组外周血白细胞计数、淋巴细胞计数、中性粒细胞百分比均显著低于对照组(P<0.05),见表1。
表1.
两组新生大鼠血常规指标比较 ( )
| 项目 | 对照组 (n=5) | NEC组 (n=5) | t值 | P值 |
|---|---|---|---|---|
| 白细胞计数 (×109/L) | 13.9±2.3 | 7.8±0.8 | 2.491 | 0.037 |
| 淋巴细胞计数 (×109/L) | 11.4±1.8 | 5.6±0.7 | 2.998 | 0.017 |
| 单核细胞计数 (×109/L) | 0.42±0.10 | 0.36±0.68 | 0.490 | 0.637 |
| 中性粒细胞绝对值 (×109/L) | 2.08±0.46 | 1.88±0.25 | 0.384 | 0.711 |
| 淋巴细胞百分比 (%) | 82.2±1.3 | 71.1±4.3 | 2.482 | 0.038 |
| 单核细胞百分比 (%) | 3.0±0.3 | 4.7±0.8 | 1.825 | 0.106 |
| 中性粒细胞百分比 (%) | 14.7±1.0 | 24.2±3.5 | 2.616 | 0.031 |
| 红细胞计数 (×1012/L) | 1.36±0.11 | 1.42±0.16 | 0.343 | 0.741 |
| 血红蛋白 (g/L) | 59±5 | 60±6 | 0.081 | 0.938 |
| 红细胞积压 (%) | 15.9±1.4 | 16.4±1.7 | 0.240 | 0.816 |
| 平均红细胞体积 (fL) | 117.5±2.0 | 116.3±1.5 | 0.467 | 0.653 |
| 平均红细胞血红蛋白含量 (pg) | 43.5±1.5 | 42.2±0.9 | 0.740 | 0.480 |
| 平均红细胞血红蛋白浓度 (g/L) | 371±7 | 363±5 | 0.911 | 0.389 |
| 红细胞分布宽度变异系数 (%) | 29±6 | 29±6 | 0.002 | 0.998 |
| 血小板计数 (×109/L) | 355±58 | 327±51 | 0.370 | 0.721 |
| 平均血小板体积 (fL) | 6.44±0.16 | 6.46±0.17 | 0.086 | 0.934 |
| 血小板分布宽度 (%) | 17.96±0.20 | 17.84±0.19 | 0.438 | 0.673 |
| 血小板压积 (%) | 0.227±0.036 | 0.208±0.029 | 0.412 | 0.691 |
2.3. 两组新生大鼠造血相关器官的病理变化
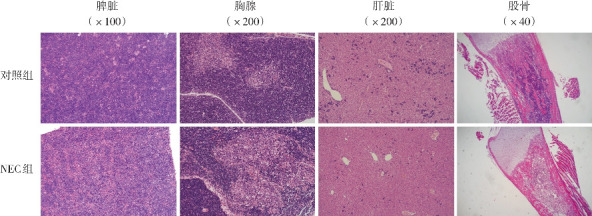
HE染色结果显示,与对照组相比,NEC组新生大鼠脾脏实质及胸腺皮质区有核细胞数量、肝脏组织中嗜碱性细胞核的小细胞聚集体数量及骨髓中有核细胞数量明显减少。见图2。
图2. 两组新生大鼠造血相关器官HE染色变化 NEC组新生大鼠脾脏实质及胸腺皮质区有核细胞数量、肝脏组织中嗜碱性细胞核的小细胞聚集体数量及骨髓中有核细胞数量较对照组明显减少。.
2.4. 两组新生大鼠造血相关器官中特定细胞的变化
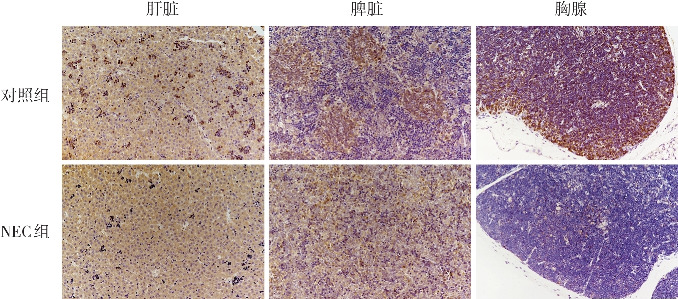
免疫组化结果显示,与对照组相比,NEC组新生大鼠肝脏中CD71阳性的红系祖细胞聚集体数量、脾脏中CD45阳性的白细胞数量、胸腺中CD3阳性的T淋巴细胞数量减少(P<0.05)。见表2、图3。
表2.
两组造血相关器官中特定细胞数量比较
| 指标 | 对照组 | NEC组 | t值 | P值 |
|---|---|---|---|---|
| CD71+细胞 | 0.012±0.004 | 0.008±0.003 | 4.694 | <0.001 |
| CD45+细胞 | 0.036±0.017 | 0.025±0.007 | 2.116 | 0.044 |
| CD3+细胞 | 0.052 ±0.040 | 0.014 ±0.016 | 5.276 | <0.001 |
n=3,
图3. 两组新生大鼠造血相关器官中特定细胞的免疫组化染色(×200) NEC组新生大鼠肝脏中CD71阳性的红系祖细胞聚集体数量、脾脏中CD45阳性的白细胞数量及胸腺中CD3阳性的T淋巴细胞数量较对照组减少。阳性表达呈棕色。.
2.5. 两组新生大鼠骨髓中特定细胞的变化
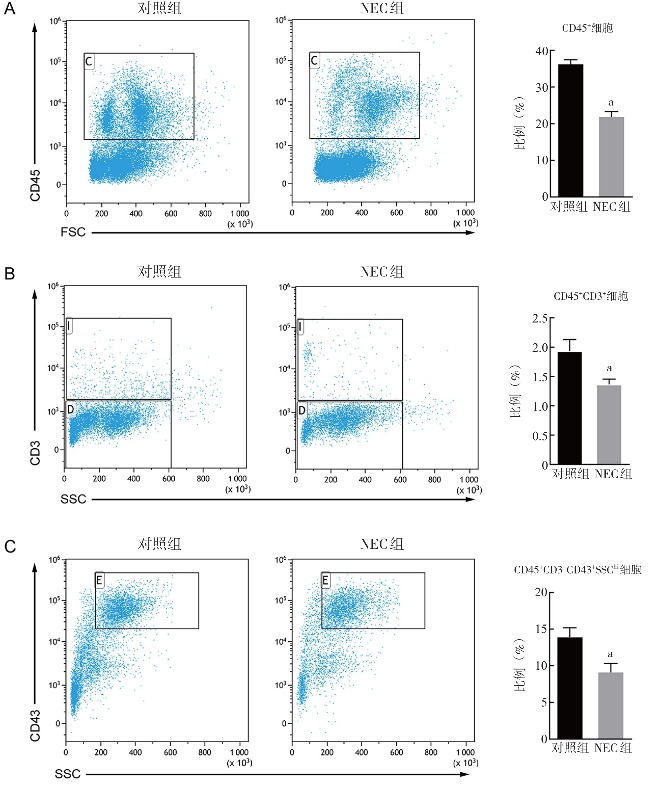
流式细胞术检测发现,与对照组相比,NEC组CD45+白细胞比例、CD45+CD3+T淋巴细胞比例及CD45+CD3-CD43+SSChi中性粒细胞比例降低(P<0.05)。见图4。
图4. 两组新生大鼠骨髓中特定细胞的流式分析结果(n=3) A:CD45+细胞比例。NEC组骨髓中CD45+白细胞比例较对照组降低;B:CD45+CD3+细胞比例。NEC组骨髓中CD45+CD3+T淋巴细胞比例较对照组降低;C:CD45+CD3-CD43+SSChi细胞比例。NEC组骨髓中CD45+CD3-CD43+SSChi中性粒细胞比例较对照组降低。a示与对照组比较,P<0.05。.
2.6. 两组新生大鼠肠道菌群的组成及丰度变化
Alpha多样性分析结果显示,NEC组Chao1指数和observed otus指数与对照组比较差异无统计学意义(P>0.05),但NEC组Shannon指数和Simpson指数高于对照组(P<0.05)(表3)。Beta多样性分析结果表明,对照组及NEC组肠道菌群具有差异(图5)。与对照组相比,门水平上NEC组肠道菌群中变形菌门、放线菌门相对丰度明显增加,而厚壁菌门相对丰度明显减少;属水平上NEC组肠道菌群中利乳杆菌属相对丰度明显减少,而埃希菌-志贺菌属、葡萄球菌属相对丰度明显增加。NEC组中埃希菌-志贺菌属取代利乳杆菌属成为优势菌属(图6~7)。进一步对两组肠道优势菌群分析结果显示,门水平上NEC组厚壁菌门的丰度低于对照组,而变形菌门的丰度高于对照组(P<0.05);属水平上NEC组利乳杆菌属的丰度低于对照组,而埃希菌-志贺菌属和葡萄球菌属的丰度高于对照组(P<0.05)。见表4。
表3.
两组新生大鼠肠道菌群Alpha多样性比较
| 项目 | 对照组 (n=6) | NEC组 (n=6) | Z值 | P值 |
|---|---|---|---|---|
| observed otus指数 | 162±26 | 188±29 | -0.642 | 0.574 |
| Shannon指数 | 2.41±0.32 | 3.23±0.20 | -2.082 | 0.041 |
| Simpson指数 | 0.64±0.06 | 0.79±0.03 | -2.005 | 0.041 |
| Chao1指数 | 163±25 | 188±29 | -0.641 | 0.589 |
图5. 两组肠道菌群Beta多样性分析 采用基于weighted uniFrac的距离矩阵进行主坐标分析。一个圆点表示一个样品,每组6个点代表6个样品。.
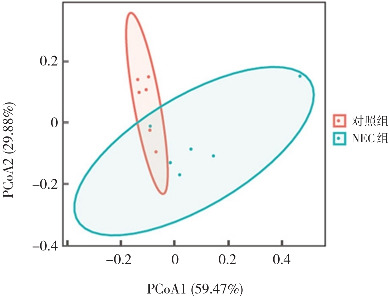
图6. 门水平及属水平上两组肠道菌群相对丰度 左图:门水平上菌群相对丰度。NEC组肠道菌群中变形菌门、放线菌门的相对丰度明显增加,而厚壁菌门相对丰度明显减少。右图:属水平上菌群相对丰度。NEC组肠道菌群中利乳杆菌属相对丰度明显减少,而埃希菌-志贺菌属、葡萄球菌属相对丰度明显增加。.
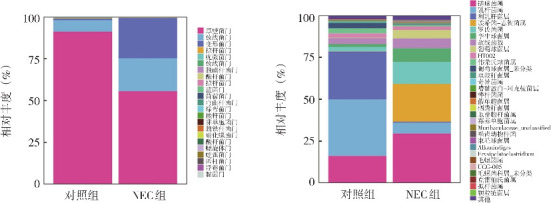
图7. 两组相对丰度排序前5的菌群分布情况 NEC组中埃希菌-志贺菌属取代利乳杆菌属成为优势菌属。.
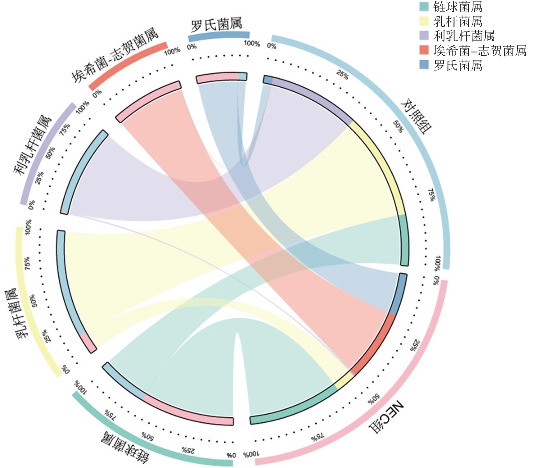
表4.
门水平及属水平上两组肠道优势菌群的相对丰度比较
| 项目 | 对照组 | NEC组 | Z值 | P值 |
|---|---|---|---|---|
| 厚壁菌门 | 93.92(81.42, 98.49) | 61.08(41.68, 72.68) | -2.562 | 0.010 |
| 变形菌门 | 0.98(0.54, 1.31) | 11.74(1.82, 43.61) | -2.562 | 0.010 |
| 利乳杆菌属 | 21.08(1.04, 53.23) | 0.41(0.14, 0.94) | -2.082 | 0.037 |
| 埃希菌-志贺菌属 | 0.16(0.08, 0.24) | 10.48(0.53, 42.02) | -2.562 | 0.010 |
| 葡萄球菌属 | 0.06(0.03, 0.61) | 0.96(0.17, 11.28) | -2.096 | 0.037 |
[M(P 25,P 75)]
3. 讨论
胸腺、脾脏是T、B淋巴细胞分化成熟、驻留的重要场所,正常脾脏中T细胞约占40%,B细胞约占60%;而胸腺中胸腺细胞(T细胞的前身)约占90%。在胎儿出生的前3 d,淋巴细胞生成的部位会由胎肝向骨髓过渡,在此期间,淋巴细胞的生成主要发生在脾脏,随后淋巴活化的多能祖细胞会从新生儿脾脏和成年骨髓向胸腺迁移定居并发育成熟为T淋巴细胞[14],因此,胸腺、脾脏和骨髓在生命早期造血中都发挥着重要的作用。部分造血祖细胞在胸腺中分化成熟的T细胞会返回骨髓腔,并作为“基质细胞”参与旁分泌和邻分泌信号转导以促进造血[15]。本研究发现NEC新生大鼠模型,血常规、脾、胸腺及骨髓中白细胞、T淋巴细胞数量均显著下降,提示存在淋系分化障碍,并可能进一步从“基质细胞”层面影响整个造血系统。
本研究发现NEC组新生大鼠模型还存在肝脏CD71阳性红系祖细胞数量明显减少。肝脏是胎儿在宫内时期的一个主要的造血器官,主要支持红骨髓造血和造血干细胞扩增。胎鼠肝脏的造血功能会在出生后1~2周内消失,正常生理条件下,成年鼠肝脏不会造血[16]。最近的一项病例对照研究发现,严重贫血与极低出生体重儿NEC的发病风险增加密切相关[17]。早产儿患严重贫血的风险因素包括内源性因素,即促红细胞生成素(erythropoietin,EPO)生产减少或分解增加,以及外源性因素即营养缺乏、医源性失血、感染等。贫血导致氧传递减少和组织缺氧可造成肠道损伤,被认为是NEC发展的基础。EPO主要作用于红系祖细胞,可促进其增殖分化为成熟的红细胞,增加循环中的红细胞数量,给予早产儿EPO不仅能够减少红细胞输注的数量,还能够降低NEC的发生率[18],可见预防严重贫血的重要性。此外,本研究发现NEC组骨髓中性粒细胞比例显著降低。中性粒细胞是先天性免疫的重要组成部分,是对细菌、病毒和真菌感染第一个作出反应和防御的循环免疫细胞[19]。研究表明,NEC死亡病例的中性粒细胞计数显著低于NEC幸存病例,表明中性粒细胞减少症与预后较差密切相关[8]。造血干祖细胞向粒细胞分化主要依赖于粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF),而G-CSF在临床已被用于中性粒细胞减少症相关败血症的治疗。一项包含7例早发性败血症和7例NEC患儿的研究发现,G-CSF治疗与相对较高的白细胞计数及生存率相关[8]。以上提示NEC新生大鼠模型造血相关器官中存在红系及粒系的多谱系分化障碍。
除上述EPO、G-CSF等常见的细胞因子外,近年来发现肠道菌群是造血功能的一个关键的调节因子,肠道微生物稳态对于正常造血的维持至关重要[20]。肠道微生态失衡与NEC肠组织损伤相关,但对于其在NEC相关造血异常中的作用却鲜有关注。本研究发现,NEC组肠道菌群中益生菌利乳杆菌属的丰度显著降低,而致病菌埃希菌-志贺菌属异常扩增取代利乳杆菌属成为优势菌属,表明NEC新生大鼠模型肠道微生物稳态严重失衡。一项针对非洲儿童的随机对照研究发现,肠道乳酸杆菌显著减少,大肠杆菌和沙门氏菌等致病肠杆菌属水平增加可能与铁过载相关血液学异常有关[21]。埃希菌-志贺菌属是革兰阴性致病菌。大多数革兰阴性菌的主要损害作用源于其外膜的主要成分脂多糖(lipopolysaccharide,LPS)。在NEC肠道微生态失衡背景下,肠道屏障被破坏,通透性增加,异常扩增的埃希菌-志贺菌相关的LPS更易扩散进入血液循环到达全身各组织器官。
血液系统的所有细胞都是由造血干/祖细胞分化产生[22],故我们在NEC新生大鼠模型造血相关器官中发现的多谱系异常可能源于上游的造血干/祖细胞。研究表明,LPS等能够通过识别Toll样受体4、7、9介导持续炎症信号刺激造血干/祖细胞使之耗竭,从而导致正常造血被抑制[23]。例如,LPS或者革兰阴性菌感染,可通过造血干/祖细胞的TLR4-TRIF-ROS-p38信号轴诱导具有持续遗传毒性的增殖应激,并能够破坏其自我更新与造血重建能力[24]。因此,NEC新生大鼠模型的血液学异常可能与其肠道微生物稳态严重失衡,致病菌埃希菌-志贺菌属异常扩增有关,NEC状态下肠道屏障破坏进一步导致体内内毒素水平升高从而对造血产生不利影响。
本研究虽初步揭示了NEC新生大鼠血液学异常与肠道微生物稳态失衡之间的关系,但仍有不足之处。后续研究还可采用LPS诱导的NEC动物模型进一步验证LPS而非造模方式本身对造血的影响,采用粪菌移植或补充益生菌等实验进一步确认肠道微生物稳态在NEC造血异常中的作用及机制。
(版权所有©2023中国当代儿科杂志)
基金资助
江苏省重点研发计划(社会发展)项目(BE2021614);南京市卫生科技发展专项资金杰出青年基金项目(JQX22009);南京医科大学大型科学仪器开放共享研究课题(ZC2021DY11);江苏省中医药科技发展计划面上项目(MS2021039)。
参 考 文 献
- 1. Moschino L, Duci M, Fascetti Leon F, et al. Optimizing nutritional strategies to prevent necrotizing enterocolitis and growth failure after bowel resection[J]. Nutrients, 2021, 13(2): 340. DOI: 10.3390/nu13020340. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Bazacliu C, Neu J. Necrotizing enterocolitis: long term complications[J]. Curr Pediatr Rev, 2019, 15(2): 115-124. DOI: 10.2174/1573396315666190312093119. [DOI] [PubMed] [Google Scholar]
- 3. Neu J. Necrotizing enterocolitis: the future[J]. Neonatology, 2020, 117(2): 240-244. DOI: 10.1159/000506866. [DOI] [PubMed] [Google Scholar]
- 4. Wu H, Guo K, Zhuo Z, et al. Current therapy option for necrotizing enterocolitis: practicalities and challenge[J]. Front Pediatr, 2022, 10: 954735. DOI: 10.3389/fped.2022.954735. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. 杨佳慧, 石永言. Paneth细胞参与新生儿坏死性小肠结肠炎发病机制的研究进展[J]. 中华新生儿科杂志, 2023, 38(2): 121-124. DOI: 10.3760/cma.j.issn.2096-2932.2023.02.014. [DOI] [Google Scholar]
- 6. Chelakkot C, Ghim J, Ryu SH. Mechanisms regulating intestinal barrier integrity and its pathological implications[J]. Exp Mol Med, 2018, 50(8): 1-9. DOI: 10.1038/s12276-018-0126-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Hutter JJ, Hathaway WE, Wayne ER. Hematologic abnormalities in severe neonatal necrotizing enterocolitis[J]. J Pediatr, 1976, 88(6): 1026-1031. DOI: 10.1016/s0022-3476(76)81069-4. [DOI] [PubMed] [Google Scholar]
- 8. Kling PJ, Hutter JJ. Hematologic abnormalities in severe neonatal necrotizing enterocolitis: 25 years later[J]. J Perinatol, 2003, 23(7): 523-530. DOI: 10.1038/sj.jp.7210983. [DOI] [PubMed] [Google Scholar]
- 9. Ragazzi S, Pierro A, Peters M, et al. Early full blood count and severity of disease in neonates with necrotizing enterocolitis[J]. Pediatr Surg Int, 2003, 19(5): 376-379. DOI: 10.1007/s00383-003-1014-5. [DOI] [PubMed] [Google Scholar]
- 10. Yan H, Baldridge MT, King KY. Hematopoiesis and the bacterial microbiome[J]. Blood, 2018, 132(6): 559-564. DOI: 10.1182/blood-2018-02-832519. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Huang K, Mukherjee S, Desmarais V, et al. Targeting the PXR-TLR4 signaling pathway to reduce intestinal inflammation in an experimental model of necrotizing enterocolitis[J]. Pediatr Res, 2018, 83(5): 1031-1040. DOI: 10.1038/pr.2018.14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Yan X, Cao Y, Chen W, et al. Peptide (tat(48-60)) YVEEL protects against necrotizing enterocolitis through inhibition of Toll-like receptor 4-mediated signaling in a phosphatidylinositol 3-kinase/AKT dependent manner[J]. Front Nutr, 2022, 9: 992145. DOI: 10.3389/fnut.2022.992145. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Barnett-Vanes A, Sharrock A, Birrell MA, et al. A single 9-colour flow cytometric method to characterise major leukocyte populations in the rat: validation in a model of LPS-induced pulmonary inflammation[J]. PLoS One, 2016, 11(1): e0142520. DOI: 10.1371/journal.pone.0142520. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Kumar BV, Connors TJ, Farber DL. Human T cell development, localization, and function throughout life[J]. Immunity, 2018, 48(2): 202-213. DOI: 10.1016/j.immuni.2018.01.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Ratajczak MZ, Kucia M. Hematopoiesis and innate immunity: an inseparable couple for good and bad times, bound together by an hormetic relationship[J]. Leukemia, 2022, 36(1): 23-32. DOI: 10.1038/s41375-021-01482-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Lewis K, Yoshimoto M, Takebe T. Fetal liver hematopoiesis: from development to delivery[J]. Stem Cell Res Ther, 2021, 12(1): 139. DOI: 10.1186/s13287-021-02189-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Song J, Dong H, Xu F, et al. The association of severe anemia, red blood cell transfusion and necrotizing enterocolitis in neonates[J]. PLoS One, 2021, 16(7): e0254810. DOI: 10.1371/journal.pone.0254810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Wang Y, Song J, Sun H, et al. Erythropoietin prevents necrotizing enterocolitis in very preterm infants: a randomized controlled trial[J]. J Transl Med, 2020, 18(1): 308. DOI: 10.1186/s12967-020-02459-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Hidalgo A, Libby P, Soehnlein O, et al. Neutrophil extracellular traps: from physiology to pathology[J]. Cardiovasc Res, 2022, 118(13): 2737-2753. DOI: 10.1093/cvr/cvab329. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. 魏同, 席亚明, 毛夏丽, 等. 肠道微生态与造血关系的研究进展[J]. 临床血液学杂志, 2020, 33(3): 229-232. DOI: 10.13201/j.issn.1004-2806.2020.03.019. [DOI] [Google Scholar]
- 21. Manzo VE, Bhatt AS. The human microbiome in hematopoiesis and hematologic disorders[J]. Blood, 2015, 126(3): 311-318. DOI: 10.1182/blood-2015-04-574392. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Haas S, Trumpp A, Milsom MD. Causes and consequences of hematopoietic stem cell heterogeneity[J]. Cell Stem Cell, 2018, 22(5): 627-638. DOI: 10.1016/j.stem.2018.04.003. [DOI] [PubMed] [Google Scholar]
- 23. Espinoza JL, Kotecha R, Nakao S. Microbe-induced inflammatory signals triggering acquired bone marrow failure syndromes[J]. Front Immunol, 2017, 8: 186. DOI: 10.3389/fimmu.2017.00186. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Takizawa H, Fritsch K, Kovtonyuk LV, et al. Pathogen-induced TLR4-TRIF innate immune signaling in hematopoietic stem cells promotes proliferation but reduces competitive fitness[J]. Cell Stem Cell, 2017, 21(2): 225-240.e5. DOI: 10.1016/j.stem.2017.06.013. [DOI] [PubMed] [Google Scholar]


