Resumen
Introducción:
en la actualidad, el cáncer de ovario epitelial se diagnostica en etapas avanzadas (EC IIIC) en 75-80% de los casos a nivel mundial. En este grupo de pacientes se inicia el tratamiento con quimioterapia neoadyuvante, seguida de citorreducción de intervalo de la enfermedad residual e incluso requieren de peritonectomía con aplicación de quimioterapia intraperitoneal hipertérmica (HIPEC).
Objetivo:
identificar la sobrevida global y sobrevida libre de progresión asociada a la realización de peritonectomía, en pacientes con carcinomatosis peritoneal secundario a cáncer de ovario tratadas en el servicio de Ginecología Oncológica de enero de 2009 a enero de 2019 en el Hospital de Oncología Centro Médico Nacional Siglo XXI (CMN SXXI).
Material y métodos:
estudio observacional, descriptivo, transversal, retrospectivo, se obtuvo información del expediente clínico de pacientes tratados con peritonectomía con uso de quimioterapia intraperitoneal hipertérmica en el servicio de Ginecología Oncológica de enero de 2009 a enero de 2019 en el Hospital de Oncología CMN SXXI.
Resultados:
se obtuvo información de un total de 36 pacientes (n = 100%), el 36.1% recibió quimioterapia intraperitoneal y al 63.8% se les realizó citorreducción sin la aplicación de quimioterapia intraoperatoria. El fármaco utilizado con mayor frecuencia fue el cisplatino seguido por mitomicina. No hubo significancia estadística al comparar ambos grupos, sin embargo hubo una tendencia a favor del uso de quimioterapia intraoperatoria al obtener un mayor número de meses en cuanto a sobrevida global.
Conclusiones:
la peritonectomía con quimioterapia intraperitoneal hipertérmica es una opción en pacientes seleccionados de cáncer de ovario en etapa avanzada en cirugía primaria y recurrente, así mismo en paciente con cáncer de ovario platino-resistentes.
Palabras clave: Procedimientos Quirúrgicos de Citorreducción, Neoplasias, Quimioterapia, Hipertermia, Ovario
Abstract
Background:
Currently, epithelial ovarian cancer is diagnosed in advanced stages (EC IIIC) in 75-80% of cases worldwide. In this group of patients treatment with neoadjuvant chemotherapy is started, followed by interval cytoreduction of residual disease and even require peritonectomy with application of hyperthermic intraperitoneal chemotherapy (HIPEC).
Objective:
To identify the overall survival and progression-free survival associated with peritonectomy, in patients with peritoneal carcinomatosis secondary to ovarian cancer treated in the oncology gynecology service from January 2009 to January 2019 at the UMAE Hospital de Oncología Centro Médico Nacional Siglo XXI.
Material and methods:
Observational, descriptive, cross-sectional, retrospective study, information was obtained from the clinical file of patients treated with peritonectomy with the use of hyperthermic intraperitoneal chemotherapy in the gynecological oncology service from January 2009 to January 2019 at the UMAE Hospital de Oncología Centro Médico Nacional Siglo XXI.
Results:
Information was obtained from a total of 36 patients (n=100%), 36.1% received intraperitoneal chemotherapy and 63.8% underwent cytoreduction without the application of intraoperative chemotherapy. The most frequently used drug was cisplatin followed by mitomycin. There was no statistical significance when comparing both groups, however there was a trend in favor of the use of intraoperative chemotherapy by obtaining a greater number of months in terms of overall survival.
Conclusions:
Peritonectomy with hyperthermic intraperitoneal chemotherapy is an option in selected patients with advanced stage ovarian cancer in primary and recurrent surgery, as well as in patients with platinum-resistant ovarian cancer.
Keywords: Cytoreduction Surgical Procedures, Neoplasms, Drug therapy, Hyperthermia, Ovary
Introducción
El cáncer de ovario es la segunda causa más común de cáncer ginecológico, y reporta los índices de mortalidad más altos.1 Debido a que no existe un método de cribado de cáncer efectivo para detectar los síntomas tempranos del cáncer ovárico, la mayoría de los pacientes (> 70%) son diagnosticados en etapas avanzadas (III o IV), con metástasis tumorales en la cavidad abdominal u otros órganos distantes (pulmón e hígado) siendo la sobrevida en estos pacientes menor al 30%.2,3
Anualmente, se estiman a nivel mundial 239,000 nuevos casos diagnosticados de cáncer de ovario y 152,000 muertes relacionadas a la enfermedad. Las tasas de incidencia más altas se presentan en Europa central y oriental (11.4 por 100,000 y 6.0 por 100,000 habitantes, respectivamente).4
En México, el cáncer de ovario constituye el 4% de todas las neoplasias, lo que representa el tercer lugar en frecuencia en la mujer, después del cáncer de cérvix y de mama, siendo la segunda causa de mortalidad.5,6 En el Hospital de Oncología del Centro Médico Nacional Siglo XXI (CMN SXXI), durante el periodo 2005 a 2012, ocupó el octavo lugar en frecuencia en mujeres, representando el 2.6%, con 1193 casos nuevos en el periodo.7
Las pautas actuales para el tratamiento primario de la enfermedad avanzada recomiendan la cirugía citorreductora y etapificadora, seguida de quimioterapia adyuvante basada en platino y taxano en los casos de enfermedad citorreducible de forma primaria.8 Estudios subsecuentes han demostrado el mismo beneficio de supervivencia al realizar una reducción óptima, lo cual se logra con la resección completa de todas las enfermedades macroscópicas, con la finalidad de conseguir una citorreducción completa (R0) de la enfermedad, ya sea que se realice como tratamiento primario o después de quimioterapia neoadyuvante.9 Existe una población de pacientes para quienes la cirugía primaria no es factible, o que serían sometidos a morbilidad significativa para alcanzar una cirugía óptima. En estos pacientes se recomienda la quimioterapia neoadyuvante ya que se ha determinado que, seguida de la cirugía de citorreducción de intervalo, no es inferior a la cirugía de citorreducción primaria seguida por quimioterapia adyuvante como opción del tratamiento para los pacientes con enfermedad avanzada.10,11,12
Uno de los factores pronóstico más importantes para la sobrevida y periodo libre de enfermedad es el papel de la cirugía óptima en carcinomatosis y que se define como una cirugía sin residual tumoral macroscópico.13 El tamaño de los implantes residuales se considera un importante factor pronóstico en resultados oncológicos, sin embargo, sigue siendo un aspecto controvertido si la cirugía por sí sola se asocia a resultados más alentadores en pacientes con carcinomatosis.14
La vía de diseminación más importante en el cáncer de ovario epitelial es la intraperitoneal y generalmente se encuentra con extensión de la enfermedad, conocido con el término de carcinomatosis peritoneal, al momento de su diagnóstico. El tratamiento con quimioterapia intraperitoneal se justifica al exponer el tejido tumoral directamente a altas concentraciones de quimioterapia intracavitaria;15,16 se ha demostrado que mejora la sobrevida global y aumenta el periodo libre de enfermedad.17 El fármaco de mayor respuesta en este ámbito es el cisplatino, sin embargo, la toxicidad y morbilidad perioperatoria no están del todo establecidas, por lo que no se considera un manejo estándar para todas las pacientes en etapas avanzadas.18 Reportes sobre toxicidad con la administración de cisplatino intraperitoneal, con o sin hipertermia al momento de la cirugía primaria, seguida de quimioterapia intravenosa es aceptable, con el beneficio de no requerir colocación de catéter para repetir la quimioterapia intraperitoneal, evitando complicaciones de acceso peritoneal prolongado.19 Sugarbaker et al. sustentan que la persistencia de las células tumorales en la cavidad abdominal o en la pelvis es la causa de muerte del 30-50% de las pacientes.20,21 La supervivencia media en los casos de enfermedad localizada es de alrededor de nueve meses, y de cuatro meses cuando la enfermedad está generalizada.22 En los pacientes con indicación para la intervención quirúrgica, la extensión de la carcinomatosis parece ser el único indicador de supervivencia.23 La administración de quimioterapia intraperitoneal tiene el beneficio de proporcionar concentraciones más altas de cistostáticos en el lugar donde se encuentra el tumor, a la vez que se minimizan los efectos tóxicos sistémicos en comparación con los producidos por la administración intravenosa sistémica.24 La morbilidad y mortalidad asociadas a esta terapia combinada de citorreducción oncológica radical y quimioterapia abdominal son altas.25 Las complicaciones pueden derivarse directamente de la cirugía, de la quimioterapia o de ambas. Se han publicado tasas de morbilidad y mortalidad muy diversas, con cifras entre 0-43% de morbilidad y 0-20% de mortalidad.26,27
Existen escasos estudios sobre la morbilidad y mortalidad perioperatoria relacionadas con este procedimiento en pacientes con cáncer ginecológico con periodos breves de seguimiento; sin embargo, se está viviendo un auge de protocolos de investigación que sustentan la peritonectomía más quimioterapia intraperitoneal hipertérmica (HIPEC, por sus siglas en inglés) como opción terapéutica. El Hospital de Oncología del CMN SXXI es un centro de referencia regional y nacional para el manejo de pacientes con carcinomatosis, de entre los servicios de la institución destaca el área de Ginecología Oncológica, donde se maneja pacientes con dicho diagnóstico cuyo primario es, principalmente, el cáncer de ovario epitelial. Del universo de pacientes manejadas en Ginecología Oncológica, hasta el 75% presenta una etapa clínica avanzada (EC IIIC) de la enfermedad al momento del diagnóstico, por lo que la realización de este estudio permitió obtener información estadística sobre la efectividad y seguridad del procedimiento en nuestra institución.
Las pacientes candidatas a dicho tratamiento, ya fuera por recurrencia, estadios avanzados o pacientes con tratamiento neoadyuvante, se han venido manejando en nuestra unidad con peritonectomía más quimioterapia intraperitoneal desde enero de 2009. Nuestro objetivo fue determinar el riesgo - beneficio que aporta la realización de peritonectomía con o sin aplicación de quimioterapia intraperitoneal en las pacientes con carcinomatosis por cáncer ginecológico tratadas en el servicio de Ginecología Oncológica del Hospital de Oncología del CMN SXXI de enero 2009 a enero de 2019.
Material y Métodos
Se realizó un estudio de tipo observacional, retrospectivo, no experimental, de pacientes con diagnóstico de cáncer ginecológico atendidas en el servicio de Ginecología Oncológica del Hospital de Oncología del CMN SXXI, tratadas con peritonectomía pélvica o total y cirugía citorreductora con o sin aplicación de quimioterapia intraperitoneal, de enero 2009 a junio 2021. El análisis estadístico se realizó con el programa informático SPSS v.23 para Mac, y para el análisis de datos se realizó estadística descriptiva (frecuencias y proporciones) para variables categóricas, mientras que para variables numéricas se usaron medidas de dispersión. Para establecer la asociación de variables se utilizó la prueba de Chi cuadrada. y un Long Rank Test con curvas de sobrevida libre de recurrencia (Kaplan-Meier), con una significancia ≤ 0.05.
Resultados
Se obtuvo información mediante el expediente electrónico y el expediente físico de un total de 36 pacientes (n = 100%), el 95.2% tenía cáncer de ovario avanzado (n = 34). La edad media al momento de la cirugía fue de 55.25 años (cuadro I). En cuanto a las comorbilidades 8 pacientes presentaban hipertensión arterial sistémica, 5 diabetes mellitus tipo 2, 1 hipotiroidismo y 1 paciente insuficiencia cardiaca compensada.
Cuadro I. Características generales de las 36 pacientes a quienes se les realizó citorreducción con o sin aplicación de quimioterapia intraoperatoria.
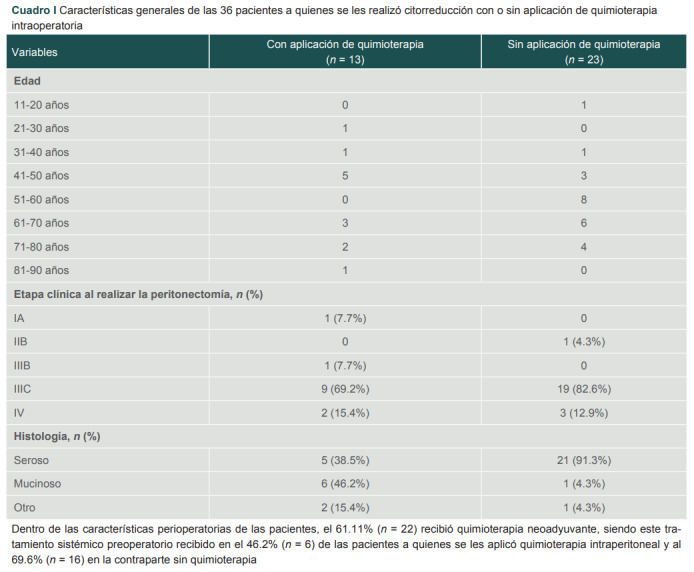
Dentro de las características perioperatorias de las pacientes, el 61.11% (n = 22) recibió quimioterapia neoadyuvante, siendo este tratamiento sistémico preoperatorio recibido en el 46.2% (n = 6) de las pacientes a quienes se les aplicó quimioterapia intraperitoneal y al 69.6% (n = 16) en la contraparte sin quimioterapia
Del total de 36 pacientes el 36.11% (n = 13) recibió quimioterapia intraperitoneal y al 63.88% (n = 23) se le realizó citorreducción, sin la aplicación de quimioterapia intraoperatoria. La técnica utilizada en la totalidad de las pacientes con quimioterapia intraoperatoria fue cerrada o técnica de coliseo. Asimismo, el fármaco utilizado con mayor frecuencia fue el cisplatino (38.4%), seguido por la mitomicina (30.76%). No hubo mortalidad asociada a la aplicación de quimioterapia intraoperatoria, únicamente se documentaron dos complicaciones postquirúrgicas inmediatas: íleo posquirúrgico y anemia grado III, las cuales se resolvieron sin eventualidades durante la estancia en piso.
En cuanto a la histología, la más frecuentemente documentada fue la estirpe mucinosa 46.2% (n = 6) en el grupo con aplicación de quimioterapia, y la estirpe serosa 91.3% (n = 21) en la contraparte sin quimioterapia.
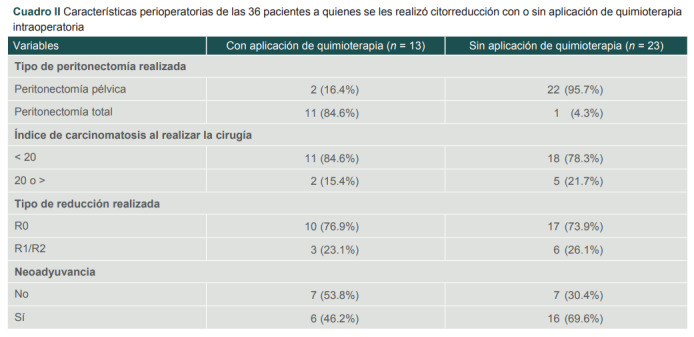
Asimismo, de las 13 pacientes que recibieron quimioterapia intraperitoneal al 76.9% (n= 10) se le realizó una citorreducción óptima, debutando con un índice de carcinomatosis menor a 20 puntos en el 84.6% (n = 11) y realizándose una peritonectomía total en el 84.6% (n = 11) (cuadro II). En la contraparte sin quimioterapia intraoperatoria, se realizó una peritonectomía pélvica en el 95.7% (n = 22), se debutó con un índice de carcinomatosis menor a 20 en el 78.3% (n = 18) y se obtuvo una citorreducción óptima en el 73.9% (n = 17).
Cuadro II. Características perioperatorias de las 36 pacientes a quienes se les realizó citorreducción con o sin aplicación de quimioterapia intraoperatoria.
La sobrevida global se determinó como la fecha de fallecimiento de la paciente o la fecha de última consulta en expediente durante el seguimiento posquirúrgico. La media global de seguimiento fue de 53.2 meses, en el grupo al cual se aplicó quimioterapia intraperitoneal fue de 53.2 meses y en la contraparte, sin quimioterapia intraperitoneal, de 51 meses (figura 1). No hubo significancia estadística al comparar ambos grupos, sin embargo hubo una tendencia a favor del uso de quimioterapia intraoperatoria al obtener un mayor número de meses en cuanto a sobrevida global como se observa en la gráfica de Kaplan-Meier.
Figura 1. Sobrevida global. Log Rank.

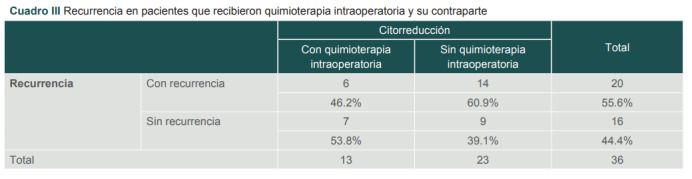
La sobrevida libre de progresión se determinó como; los meses transcurridos desde la realización de la citorreducción con o sin quimioterapia intraperitoneal hasta la recurrencia. De la totalidad de las 36 pacientes evaluadas, el 55.6% presentó recurrencia (n=20). Se documentó en las 20 pacientes que presentaron recurrencia una tasa del 60.9% de recurrencia en aquellas pacientes en quienes no se aplicó quimioterapia intraoperatoria y un 46.2% de recurrencia en la contraparte que recibió quimioterapia intraoperatoria. La media de meses en el grupo sin quimioterapia fue de 14.1 meses a la aparición de recurrencias y 16.6 meses en el grupo con quimioterapia (cuadro III).
Cuadro III. Recurrencia en pacientes que recibieron quimioterapia intraoperatoria y su contraparte.
El lugar de recurrencia con mayor tasa de presentación en el grupo con quimioterapia fue la afección locorregional, con un 61.5% (n = 8); seguido de la afección hepática en un 15.4% (n = 2). En la contraparte, las pacientes a quienes no se les aplicó quimioterapia presentaron mayor afección locorregional en un 60.9% (n = 14), seguida de la afección hepática en un 21.7% (n = 5) y retroperitoneal 17.4% (n = 4).
Al evaluar la sobrevida libre de progresión se observó una tendencia a favor del uso de la quimioterapia intraperitoneal, tras documentarse una media medida en meses hasta la aparición de recurrencia de 16.6 meses en este grupo, en comparación con los 14.1 meses en la contraparte que no recibió quimioterapia intraoperatoria. No hubo significancia estadística, como se observa en la correspondiente grafica de Kaplan-Meier (figura 2).
Figura 2. Sobrevida libre de progresión.

Discusión
La frecuencia del cáncer de ovario en nuestra institución se sitúa en primer lugar entre los canceres ginecológicos, esto debido a que se trata de un hospital de referencia a nivel nacional, en el cual también se atiende a pacientes en etapas clínicas avanzadas.
Si bien el tratamiento estandarizado para este tipo de cáncer es la cirugía de citorreducción primaria óptima con posterior quimioterapia adyuvante a base de platinos, la gran mayoría de las pacientes se diagnostican en etapas avanzadas, como se documentó en la presente revisión, es entonces cuando el manejo con quimioterapia intraperitoneal ocupa un papel importante. En la actualidad se acepta de manera general, que solo los pacientes con enfermedad residual mínima después de la cirugía pueden beneficiarse de la quimioterapia intraperitoneal, tal como se documentó en la presente revisión, al aplicar quimioterapia intraoperatoria en el 84.6% de las pacientes con un índice de carcinomatosis menor a 20 puntos.12
La quimioterapia intraoperatoria expone el tejido tumoral a altas concentraciones dentro de la cavidad peritoneal, y ha logrado demostrar una mejoría en la sobrevida global, así como del periodo libre de enfermedad. De la misma manera, se correlaciona con la directriz de realizar el máximo esfuerzo quirúrgico con la intención de lograr una citorreducción óptima (R0) en aquellos pacientes donde sea posible efectuarla sin aumentar la morbilidad de manera significativa; en nuestra evaluación el 76.9% de las pacientes con R0 recibieron quimioterapia intraoperatoria, en contraste con el 23.1% de las pacientes con quimioterapia intraoperatoria, quienes quedaron con enfermedad residual R1/R2.
Existen datos firmes apoyados por el beneficio de mejoría en la supervivencia para realizar una citorreducción primaria, sin embargo también se encuentra una población no menos frecuente de pacientes para quienes la cirugía primaria no es factible, o que de ser sometidas a dicho procedimiento tendrían un aumento en la morbilidad de manera significativa, y es en estas pacientes donde se recomienda la quimioterapia neoadyuvante para posteriormente continuar con una citorreducción de intervalo. Todo esto debido a que se ha determinado que, de optar por la cirugía de citorreducción de intervalo, los resultados no son inferiores a los de la cirugía de citorreducción primaria seguida por quimioterapia adyuvante como opción del tratamiento para las pacientes con enfermedad avanzada.5 Tal como se documentó en nuestra revisión, en la que el 61.1% de la totalidad de las pacientes recibió quimioterapia neoadyuvante.
Tras evaluar los resultados oncológicos (sobrevida global y sobrevida libre de recurrencia) en la presente revisión, identificamos que no hubo significancia estadística, y sí se mantuvo la tendencia a favor del uso de quimioterapia intraoperatoria, una probable explicación sería la poca homogeneidad de ambos grupos en cuanto a la cantidad de pacientes (el 36% recibió quimioterapia intraperitoneal y el 64% no). Esto puede ser debido a que el intervalo de años evaluado en la presente cohorte inició en el año 2009, y fue bien hasta el 2018 cuando Van Driel et al. publicaron las pautas para el uso de la quimioterapia intraoperatoria en cáncer de ovario, siendo este nuevo intervalo de tiempo (año 2018 a la actualidad) cuando se llevó a cabo en nuestra institución la gran mayoría de las citorreducciones con quimioterapia intraoperatoria.
Conforme a la literatura internacional, en nuestro estudio no hubo mayor toxicidad, morbilidad e, incluso, mortalidad perioperatoria con la aplicación de quimioterapia intraoperatoria.
Conclusiones
La peritonectomía con quimioterapia intraperitoneal hipertérmica es una opción en pacientes seleccionados de cáncer de ovario en etapa avanzada en cirugía primaria y recurrente, así como en pacientes con cáncer de ovario platino-resistentes.
Notas
los autores han completado y enviado la forma traducida al español de la declaración de conflictos potenciales de interés del Comité Internacional de Editores de Revistas Médicas, y no fue reportado alguno que tuviera relación con este artículo.
Referencias
- 1.Qiu Y, Tan M, McMeekin S. Early prediction of clinical benefit of treating ovarian cancer using quantitative CT image feature analysis. Acta Radiol Online. 2015 doi: 10.1177/0284185115620947. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Gallardo-Rincón D, Espinosa-Romero R, Muñoz WR. Epidemiological overview, advances in diagnosis, prevention, treatment and management of epithelial ovarian cancer in Mexico. Salud Pública de México. 2016;58(2) doi: 10.21149/spm.v58i2.7801. [DOI] [PubMed] [Google Scholar]
- 3.Martínez-Sánchez YL, Escudero-de los Ríos PM. Epidemiología del cáncer en pacientes adultos del Hospital de Oncología del Centro Médico Siglo XXI, Instituto Mexicano del Seguro Social. Cir Cir. 2013;81:508–516. [Google Scholar]
- 4.Mikkelsen MS, Christiansen T, Petersen LK, et al. Morbidity after cytoreductive surgery and hyperthermic intraperitoneal chemotherapy with carboplatin used for ovarian, tubal, and primary peritoneal cancer. J Surg Oncol. 2019;120(3):550–557. doi: 10.1002/jso.25603. [DOI] [PubMed] [Google Scholar]
- 5.Moldovan B, Makkai-Popa S-T, Rad C, et al. In: Ovarian Cancer - Updates in Tumour Biology and Therapeutics. Ho G-Y, Webber K, editors. Londres, Inglaterra: IntechOpen; 2021. Cytoreductive procedures and HIPEC in the treatment of advanced ovarian cancer. [Google Scholar]
- 6.Vergote I, Tropé CG, Kristensen GB. Neoadjuvant Chemotherapy or Primary Surgery in Stage IIIC or IV Ovarian Cancer. N Engl J Med. 2010;363:943–953. doi: 10.1056/NEJMoa0908806. [DOI] [PubMed] [Google Scholar]
- 7.Tsip NP, Kopetskiy VI, Polentsov YO, et al. Experience with the use of HIPEC in advanced serous ovarian cancer after complete and optimal cytoreduction. Exp Oncol. 2021;43(1):67–72. doi: 10.32471/exp-oncology.2312-8852.vol-43-no-1.15984. [DOI] [PubMed] [Google Scholar]
- 8.Chen W-C, Huang H-J, Yang L-Y, et al. Hyperthermic intraperitoneal chemotherapy for recurrent epithelial ovarian cancer. Biomed J. 2021 doi: 10.1016/j.bj.2021.10.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tkachenko OI, Chetverikov SH, Bondar OV, et al. Implementation of the enhanced recovery after surgery protocol for patients with peritoneal carcinomatosis undergoing cytoreductive surgery and hyperthermic intraperitoneal chemoperfusion. Contemp Oncol. 2021;25(2):133–9. doi: 10.5114/wo.2021.107441. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bristow RE, Tomacruz RS, Armstrong DK, et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J Clin Oncol. 2002;20(5):1248–1259. doi: 10.1200/JCO.2002.20.5.1248. [DOI] [PubMed] [Google Scholar]
- 11.Mishra S, Sinukumar S, Jumale N, et al. Pathology of Peritoneal Metastases. Singapore: Springer Singapore; 2020. Rare peritoneal tumours: Histopathological diagnosis and patterns of peritoneal dissemination. [Google Scholar]
- 12.Rawahi Al, et al. Surgical citorreduction for recurrent ephitelial ovarian cancer. Cochrane Database Syst Rev. 2013 Feb 28;2 [Google Scholar]
- 13.Hung H-C, Hsu P-J, Chang T-C, et al. The impact of multidisciplinary team approach on cytoreductive surgery with hyperthermic intraperitoneal chemotherapy for peritoneal carcinomatosis. J Pers Med. 2021;11(12):1313. doi: 10.3390/jpm11121313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhang G, Zhu Y, Liu C, et al. The prognosis impact of hyperthermic intraperitoneal chemotherapy (HIPEC) plus cytoreductive surgery (CRS) in advanced ovarian cancer: the meta-analysis. J Ovarian Res. 2019;12(1):33. doi: 10.1186/s13048-019-0509-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Huo YR, Richards A, Liauw W. Hyperthermic intraperitoneal chemotherapy (HIPEC) and cytoreductive surgery (CRS) in ovarian cancer: A systematic review and meta-analysis. Eur J Surg Oncol. 2015;41(12):1578–1589. doi: 10.1016/j.ejso.2015.08.172. [DOI] [PubMed] [Google Scholar]
- 16.Halkia E, Chrelias G, Chrelias C, et al. 2017 update on ovarian cancer peritoneal carcinomatosis multimodal-treatment considerations. Gastroenterol Res Pract. 2018;2018:1–6. doi: 10.1155/2018/5284814. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Boerner T, Zivanovic O, Chi DS. Narrative review of cytoreductive surgery and intraperitoneal chemotherapy for peritoneal metastases in ovarian cancer. J Gastrointest Oncol. 2021;12(Suppl 1):S137–S143. doi: 10.21037/jgo-20-274. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.National Cancer Institute. Bethesda, MD: National Cancer Institute; 2006. Disponible en: http://ctep.cancer.gov/highlights/docs/clin_annc_010506.pdf . [Google Scholar]
- 19.Armstrong DK. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. N Engl J Med. 2006;354:34–43. doi: 10.1056/NEJMoa052985. [DOI] [PubMed] [Google Scholar]
- 20.Riggs MJ, Pandalai PK, Kim J. Hyperthermic intraperitoneal chemotherapy in ovarian cancer. Diagnostics (Basel) 2020;10(1):43. doi: 10.3390/diagnostics10010043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Lim MC. Hyperthermic intraperitoneal chemotherapy after extensive cytoreductive surgery in patients with primary advanced epithelial ovarian cancer: interim analysis of a phase II study. Ann Surg Oncol. 2009;16(4):993–1000. doi: 10.1245/s10434-008-0299-y. [DOI] [PubMed] [Google Scholar]
- 22.Elias DM. Pharmacokinetics of heated intraoperative intraperitoneal oxaliplatin after complete resection of peritoneal carcinomatosis. Surg Oncol Clin N Am. 2003;12:755–769. doi: 10.1016/s1055-3207(03)00051-6. [DOI] [PubMed] [Google Scholar]
- 23.Cowan RA, O’Cearbhaill RE, Zivanovic O. Current status and future prospects of hyperthermic intraoperative intraperitoneal chemotherapy (HIPEC) clinical trials in ovarian cancer. Int J Hyperthermia. 2017;33(5):548–553. doi: 10.1080/02656736.2017.1283066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Koole S, van Stein R, Sikorska K. Primary cytoreductive surgery with or without hyperthermic intraperitoneal chemotherapy (HIPEC) for FIGO stage III epithelial ovarian cancer: OVHIPEC-2, a phase III randomized clinical trial. Int J Gynecol Cancer. 2020;30(6):888–892. doi: 10.1136/ijgc-2020-001231. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Antonio CCP, Alida GG, Elena GG. Cytoreductive surgery with or without HIPEC after neoadjuvant chemotherapy in ovarian cancer: A phase 3 clinical trial. Ann Surg Oncol. 2022;29(4):2617–2625. doi: 10.1245/s10434-021-11087-7. [DOI] [PubMed] [Google Scholar]
- 26.Kusamura S. Multidimensional análisis of the learning curve for cyreductive surgery and hypertermic intraperitoneal chemotherapy in peritoneal Surface malignancies. Annals of Surgery. 2012;255(2):348–356. doi: 10.1097/SLA.0b013e3182436c28. [DOI] [PubMed] [Google Scholar]
- 27.Witkamp AJ. Antitumor reatment. Rationale and techniques of intra-operative hypertermic intraperitoneal chemotherapy. Cancer Treat Rev. 2001;27:365–374. doi: 10.1053/ctrv.2001.0232. [DOI] [PubMed] [Google Scholar]


