Abstract
核酸类药物是在基因水平上发挥作用的RNA或DNA。目前应用较多的有核酸适配体、反义寡核苷酸、信使RNA、微RNA、小干扰RNA、小激活RNA等。核酸类药物临床应用面临稳定性差、靶向性弱、难以跨越体内屏障等难题。通过核酸化学结构修饰可以提高部分核酸药物在体内的稳定性、靶向性,提高递送效率,同时降低药物的免疫原性;应用核酸类药物载体可以帮助药物到达病灶,有助于核酸类药物实现更高效的内体逃逸,促进药物在体内发挥作用。目前应用较多的递送载体有病毒载体、脂质纳米粒、聚合物纳米载体、无机纳米载体、蛋白载体、外泌体等。目前,单独的修饰或递送载体尚不足以克服众多障碍,将核酸化学结构修饰与药物递送系统相结合有望实现更好的治疗效果,但后者技术难度和临床转化成本也随之增加。针对更加简单实用、低毒高效、精准递送核酸药物载体和核酸化学结构修饰的研发将成为核酸药物研发的热点方向。本文综述了核酸类药物的修饰和递送研究进展,讨论了提高核酸类药物递送效率的对策,以期为核酸类药物的转化应用提供参考。
Keywords: 核酸类药物, 基因治疗, 化学修饰, 药物递送系统, 综述
Abstract
Nucleic acid-based drugs, such as RNA and DNA drugs, exert their effects at the genetic level. Currently, widely utilized nucleic acid-based drugs include nucleic acid aptamers, antisense oligonucleotides, mRNA, miRNA, siRNA and saRNA. However, these drugs frequently encounter challenges during clinical application, such as poor stability, weak targeting specificity, and difficulties in traversing physiological barriers. By employing chemical modifications of nucleic acid structures, it is possible to enhance the stability and targeting specificity of certain nucleic acid drugs within the body, thereby improving delivery efficiency and reducing immunogenicity. Moreover, utilizing nucleic acid drug carriers can facilitate the transportation of drugs to lesion sites, thereby aiding efficient intracellular escape and promoting drug efficacy within the body. Currently, commonly employed delivery carriers include virus vectors, lipid nanoparticles, polymer nanoparticles, inorganic nanoparticles, protein carriers and extracellular vesicles. Nevertheless, individual modifications or delivery carriers alone are insufficient to overcome numerous obstacles. The integration of nucleic acid chemical modifications with drug delivery systems holds promise for achieving enhanced therapeutic effects. However, this approach also presents increased technical complexity and clinical translation costs. Therefore, the development of nucleic acid drug carriers and nucleic acid chemical modifications that are both practical and simple, while maintaining high efficacy, low toxicity, and precise nucleic acid delivery, has become a prominent research focus in the field of nucleic acid drug development. This review comprehensively summarizes the advancements in nucleic acid-based drug modifica-tions and delivery systems. Additionally, strategies to enhance nucleic acid drug delivery efficiency are discussed, with the aim of providing valuable insights for the translational application of nucleic acid drugs.
Keywords: Nucleic acid drugs, Gene therapy, Chemical modification, Drug delivery system, Review
核酸类药物在遗传疾病、癌症、肝炎病毒、2019冠状病毒病等疾病的治疗上应用广泛,是当今生物医药研发中较具发展潜力的药物类型之一。核酸类药物通过调控基因的转录和表达过程而发挥作用,主要包括RNA和DNA,目前应用较多的为反义寡核苷酸、mRNA、miRNA、siRNA、saRNA等。与小分子药物、蛋白药物等传统药物疗法比较,核酸类药物具有设计简单、研发周期短、成功率高、特异性强、能够在根本上调控致病基因等优势,为众多难治疾病治疗提供了解决方案。目前,核酸类药物存在的主要问题(附表1)是体内稳定性差,容易被体内的核酸酶降解或被肾脏清除;其次,核酸类药物携带负电荷,难以跨越屏障或跨膜到达胞内来发挥作用;最后,核酸类药物在体内的靶向性弱,不能精准靶向目标细胞或组织,可能会在实际应用中产生脱靶效应,导致副作用从而损伤机体,进入细胞内的药物还会面临被溶酶体水解的风险,以及在循环过程中非特异性吸附蛋白而无法发挥作用。将核酸类药物基本单位核苷酸中的碱基、磷酸基团、核糖进行化学修饰能够改变核酸类药物的理化性质,使其更加稳定,增强其抵抗内源性内切酶和外切酶降解能力,从而提高递送效率。同时,靶向分子修饰的应用,改变其组织分布、并降低药物的免疫原性,初步解决核酸药物应用中面临的稳定性、靶向性、免疫原性等问题。递送载体能够包裹核酸药物,阻隔其与体内核酸酶的接触,提高核酸类药物在体内的稳定性,同时载体能够帮助核酸类药物跨过体内屏障,到达病灶处,有助于精准治疗。载体的应用还能够防止其非特异性地结合体内蛋白,并有助于实现在细胞内的溶酶体逃逸,提高核酸药物治疗的有效性。因此,核酸类药物化学修饰与递送载体相结合,共同发挥作用,才能较好地满足临床治疗要求。
本文首先阐述了通过化学修饰和载体递送系统克服核酸类药物的短板,然后针对影响核酸类药物递送效率的关键问题提出了一些对策,旨在为核酸类药物的转化应用提供思路。
1. 核酸化学修饰
在早期核酸类药物研究中,许多核酸类药物未经修饰直接进行动物体内研究,导致无法达到预期的沉默效果,或是产生脱靶效应。目前,核酸化学修饰广泛用于ASO、siRNA、miRNA、mRNA等核酸类药物,有助于核酸类药物在疾病治疗中发挥作用。对核酸类药物进行修饰能够提高其抗酶解能力,保持序列的稳定性并延长半衰期,可以增加药物的脂溶性,降低免疫原性。同时,化学修饰可以提高靶向性,如在核酸序列的末端引入细胞表面特异性识别的配体或适配体,提高核酸类药物的沉默效率和催化反应效率等。
1.1. 磷酸基团修饰
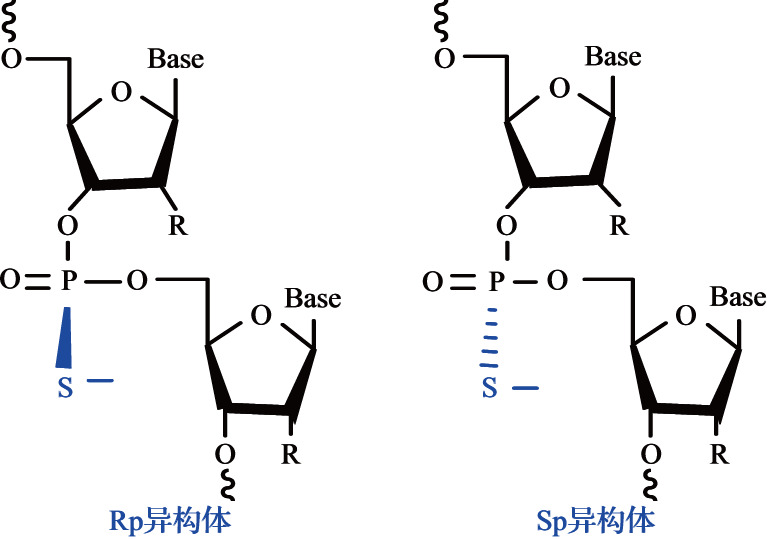
磷酸基团的修饰常在非桥连氧原子上进行,应用较为广泛的是硫原子取代磷酸基团的一个非桥连氧原子,从而形成硫代磷酸酯键。硫代磷酸酯键有利于提高核酸的抗酶解能力、与血浆蛋白的结合能力[1],从而延长其在体内的循环时间。然而,硫代修饰的不足之处在于其与靶序列的结合力较弱,且高含量的硫代磷酸酯键可能会带来细胞毒性和免疫刺激等副作用。因此,硫代磷酸酯键的位置和数量对于递送效率也很重要。如Alnylam公司在siRNA反义链5 端和3 端的前两个核苷酸处分别引入两个硫代磷酸酯键,在有义链5 端的前两个核苷酸处引入两个硫代磷酸酯键,可以得到较好的沉默效果[2]。改造后的硫代磷酸酯键存在Sp、Rp两种构型,见图1。Iwamoto等[3]证明了硫代磷酸酯的立体异构会对ASO的治疗效果产生影响,Sp构型比Rp构型更稳定,且ASO可以在体内保持更长时间的抑制效果。此外,磷酸基团上的氧原子还可被各种胺基、硼烷基取代,或整个磷酸基被酰胺基、胺氧基、烷氧基、三氮唑基等取代,但这些应用均不如硫代修饰普遍。
图1. 硫代磷酸酯的Rp、Sp结构示意图.
1.2. 碱基修饰
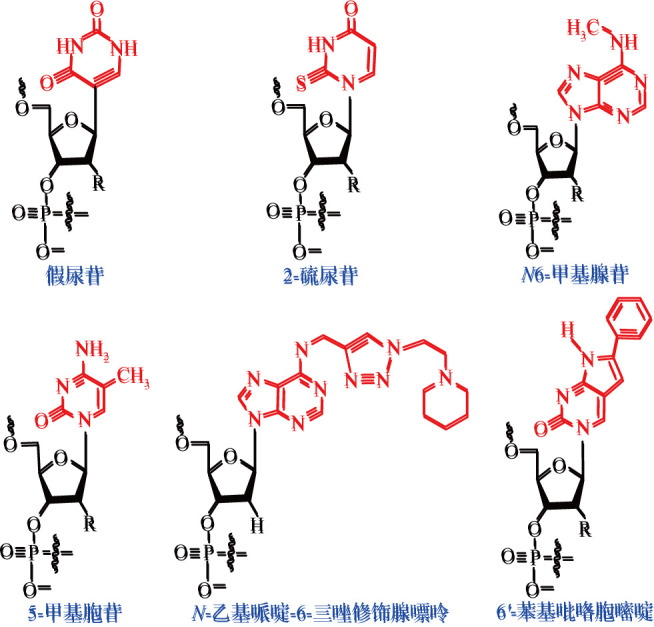
对碱基的修饰主要为碱基的取代基修饰或碱基的替换,嘧啶的5-位和嘌呤的8-位是常用的取代位点。常用的碱基修饰类型有假尿苷、2-硫尿苷、N1-甲基假尿苷、5-甲基尿苷、5-甲氧基尿苷、N6-甲基腺苷、5-甲基胞苷等,见图2 [4]。其中用假尿苷代替尿嘧啶是常见的碱基修饰之一。Vaidyanathan等[5]证明,替换成假尿苷可改善编码Cas9的mRNA的翻译并降低其免疫原性。此外,N-乙基哌啶-6-三唑修饰的腺苷类似物可以阻碍siRNA与Toll样受体8的相互作用,降低了免疫原性[6]。6 -苯基吡咯胞嘧啶是一种胞嘧啶类似物,具有良好的碱基配对效应、热稳定性和强荧光性[7]。siRNA经6 -苯基吡咯胞嘧啶修饰后其基因沉默效果不受影响,且其荧光特性可用于检测细胞内siRNA的摄取和运输。
图2. 几种碱基修饰的结构示意图.
1.3. 核糖修饰
核糖修饰主要有两种类型,一种是在其2 位引入不同大小和极性的基团,常见的有2 -甲氧基、2 -甲氧基乙氧基和2 -脱氧-2 -氟等[8];另一种是在2 位及其他核糖位点同时进行修饰,如锁核酸、PMO等,见图3。
图3. 几种核糖修饰的结构示意图.
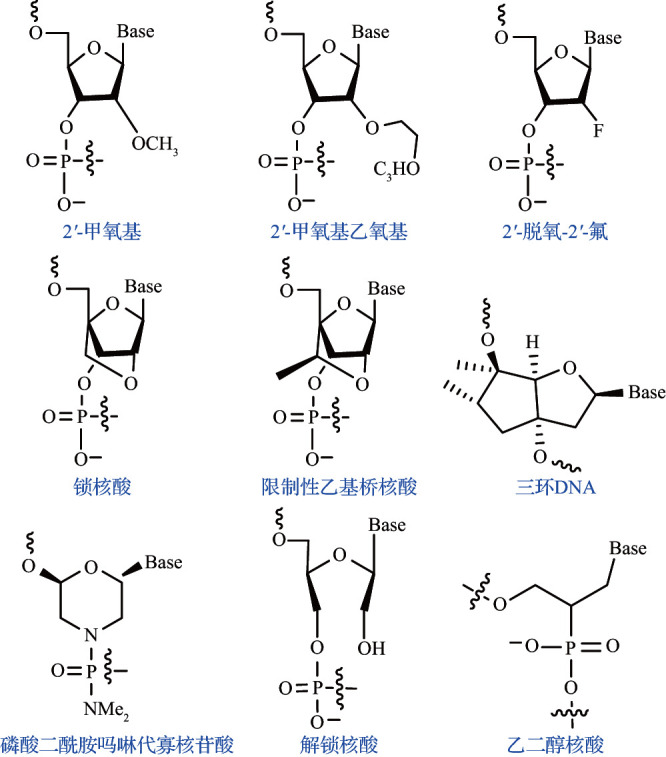
2'位修饰对于抑制核酸酶的水解很重要。2 -甲氧基修饰是目前应用较广泛的核糖修饰手段,可以增强药物与靶mRNA的结合性、抑制核酸酶的水解、减弱体内免疫原性,并赋予核酸结构一定的脂溶性。2 -甲氧基乙氧基是2 -甲氧基的类似物,具有相似的性质,但对靶mRNA的亲和力和抗酶解能力更强[9]。2 -脱氧-2 -氟修饰可以提高siRNA的亲和力和稳定性。
在核糖的2'、4'位甚至整个糖环进行修饰也会产生较好的效果。锁核酸是一种核酸构象的限制性修饰,采用C3'-内切构象,其可以仅用较短的序列来保持较高的靶亲和力和抗酶解能力。但短序列的锁核酸的脱靶效应和毒性问题较为严重,因此实际应用中常采用解锁核酸、限制性乙基桥核酸、三环DNA、乙二醇核酸来替代,并且将这四种核糖修饰与硫代磷酸酯修饰组合运用可以获得更好的治疗效果。PMO和肽核酸修饰带来的电中性结构可以提高核酸类药物的稳定性和亲和力。PMO的水溶性较好,应用较为广泛,目前一些PMO修饰的siRNA和miRNA已进入临床试验阶段[10]。PMO还可以进一步修饰,如引入穿膜肽和带正电性的胺基,以提高其跨膜能力[11]。
2. 核酸类药物载体
化学修饰可以在一定程度上提高核酸类药物的稳定性、亲和力和递送效率,但核酸类药物的大尺寸性、负电荷性和亲水性导致其细胞通透性很差,难以跨膜进入细胞,从而难以在体内发挥作用。因此,选择合适的递送载体以及开发高效的递送技术对核酸类药物治疗具有重要意义。理想的药物递送系统应具有以下几个特性:①良好的生物相容性,不引起机体的免疫反应;②能够长时间在血液中循环,免于核酸酶的降解;③较强的靶向性和特异性,能够在病灶处富集;④高细胞通透性,便于细胞摄取;⑤能高效地从内体中逃逸,便于在细胞内发挥作用。上世纪80年代,人们最早使用病毒载体将外源基因递送到体内特定细胞,但由于免疫反应和安全性等原因导致效果并不理想。上世纪90年代,学者采用脂质体、聚合物、金属纳米粒等作为载体来递送核酸类药物,提高了药物的稳定性和生物相容性,见附表2。
2.1. 病毒载体
随着基因工程技术进展,慢病毒、腺病毒、腺相关病毒逐渐成为较为有效的核酸类药物递送方法。慢病毒通过逆转录将目的片段整合到宿主基因组中,目前常用三质粒体系构建病毒载体,将表达外壳的质粒和插入目的片段的表达质粒完全分开,从而提高递送的安全性。如CAR-T细胞疗法常采用慢病毒为递送体系来实现体外T淋巴细胞中CAR的表达,以提高T淋巴细胞对癌细胞的识别和攻击能力[12]。腺病毒载体递送的基因没有整合能力,降低了随机插入的风险,其包容量是几类病毒载体中最大的,最高可以插入7.5 kb的外源基因片段,感染效率较高,感染后表达速度较快[13]。因此,腺病毒载体递送在疫苗研制领域得到较广泛的应用,如康希诺生物公司、AstraZeneca公司和Johnson & Johnson公司都选择了腺病毒载体递送SARS-CoV-2疫苗。但腺病毒载体递送的安全性仍需要不断优化[14]。腺相关病毒的免疫原性较低,实际应用中去除了其整合到宿主基因组的能力,提高了腺相关病毒载体的安全性。但腺相关病毒的载体容量比较小,且从感染到表达的时间比较长[15]。目前已有几款使用腺相关病毒载体的药物,如Glybera、Luxturna和Zolgensma[16],这些药物的价格较高,尚未广泛应用。
虽然病毒载体作为最早研究的核酸递送系统存在一些缺点,但随着这些缺点不断获得弥补,其在当今临床治疗中仍占据着重要的地位。
2.2. LNP
LNP是一种直径约为100 nm的球形载体,由中性辅助脂质、可电离的阳离子脂质、胆固醇和PEG-脂质组成。LNP目前已被广泛用于核酸药物递送,国际上首个siRNA药物Onpattro(用于治疗hATTR)即采用LNP进行药物递送[17]。LNP递送的mRNA疫苗可以有效克服体内运输障碍,如稳定性差、靶向性弱等。研究表明,使用LNP递送mRNA疫苗的效率是病毒载体的50~100倍。非人灵长动物通过肌内注射10 μg未经修饰的mRNA LNP疫苗,即可使其获得狂犬病和H1N1-HA的抗性,且免疫力持续长达一年,甚至优于常规疫苗的效果[18]。同时,针对2019冠状病毒病,采用LNP递送mRNA疫苗也表现出优良的递送效果。研究者设计了靶向SARS-CoV-2病毒高度保守区域的siRNA-LNP系统,最终病毒抑制率达90%以上[19]。因此,siRNA-LNP递送有望作为当前疫苗策略的辅助疗法,共同对抗2019冠状病毒病。
在治疗病毒感染性疾病方面,Geisbert等[20]在扎伊尔型埃博拉病毒Kikwit株哺乳动物模型中,证明了siRNA-LNP系统的抗病毒潜力。研究人员向病毒感染的兔子连续7 d静脉注射2 mg/kg siRNA-LNP,最终实验兔子100%存活。该研究团队还开发了一种抗MARV的siRNA-LNP系统,并在感染了致死剂量的MARV-Angola、MARV-Ci67或MARV-Ravn病毒的豚鼠中测试其效力[21]。他们为感染毒性最强的MARV-Angola1病毒的豚鼠连续7 d静脉注射0.5 mg/kg siRNA-LNP,结果实验豚鼠100%存活[22],即使在感染后3 d开始治疗(可以在血液中检测到病毒RNA的最早时间点),实验豚鼠也可以100%存活[21]。尽管siRNA-LNP系统在治疗致死性病毒性疾病哺乳动物模型中表现出较好的效果,但对于人类临床还有待进一步深入研究。
2.3. 聚合物纳米载体
聚合物纳米载体递送是天然高分子或合成高分子通过吸附、共价结合、交联和包埋等方式结合药物,运输到体内病变部位的一种递送方式。聚合物纳米载体的主要优点源于其多种多样的化学和物理特性,其化学组成、分子量、多分散系数等物理化学性质可以根据递送核酸类药物的种类而设计。大多数聚合物纳米载体的共同特点是结合了阳离子基团,其有助于聚合物包裹负电荷的核酸类药物,也有利于结合细胞膜上负电荷的糖蛋白[23]。但聚合物纳米载体递送核酸类药物时需要克服两个障碍:内体逃逸障碍和载体递送后的去向。目前,质子海绵效应可以解释内体逃逸机制;应用可降解聚合物材料可以避免聚合物长时间聚集在体内而产生潜在的毒性,从而提高生物相容性[24]。
PAMAM由于其多价结构,含有数百个伯胺末端的偶联位点,便于在酸性环境中质子化并通过质子海绵效应实现内体逃逸,因此成为目前广泛研究的药物和基因载体[25]。通过PAMAM的胺基部分与细胞特异性配体连接,可以提高递送靶标的特异性。因此,以PAMAM为递送载体的肿瘤细胞基因治疗也成为治疗肿瘤的一个手段[26]。
另一种质子海绵效应显著的化合物是PEI,其广泛应用于体内核酸类药物递送如miRNA和siRNA等[27]。除此之外,PEI分子的电荷密度较高,与内膜直接相互作用后会增加其通透性。但高电荷密度会对细胞膜造成损伤,可能导致细胞凋亡、坏死或抑制ATP的合成。并且PEI不能被降解,长时间在体内富集会产生细胞毒性,也会刺激机体免疫反应。为了解决上述问题,研究人员将PEI与其他生物相容性强的聚合物结合,如将PEI与PLGA混合或接枝可产生相对稳定的阳离子载体,与质粒DNA和多肽同时络合,相比单独PEI转染率更高[28]。
可降解聚合物材料生物相容性更强,在核酸类药物递送中相对更安全。其可分为天然聚合物和合成聚合物,天然聚合物包括结构蛋白和多糖等,如阳离子胶原蛋白和壳聚糖,已成为核酸载体的研究对象。合成的可降解聚合物是通过硫键或酯键等生物可逆键将低分子单体组装而成,包括聚乳酸、聚乙醇酸和PLGA等。这些材料可以经过水解过程而缓慢降解,既有利于核酸类药物的持续释放,也避免聚合物在体内富集的潜在毒性。基于PLGA的递送系统目前已应用于多种核酸类药物,包括siRNA、miRNA和肽核酸等[29]。聚β-氨基酸酯是一类可降解的阳离子合成聚合物,合成相对容易,且可根据递送对象进行修饰,从而产生大量聚合物文库,这些文库在不同应用对象中可以进行筛选和优化[30]。研究表明,对聚合物结构的修饰可以优化核酸类药物在儿童脑癌细胞[31]、肝细胞癌和视网膜色素上皮细胞中的递送。
2.4. 无机纳米载体
无机纳米载体是以无机物为主体的递送系统, 常用的无机纳米材料有金、银、磷酸钙、氧化石墨烯、量子点和磁性纳米材料如氧化铁等。无机纳米材料因其独特的电学、光学性质和生物相容性以及低细胞毒性的特点而备受关注[32]。金纳米材料具有柔性表面,这使得核酸可以直接与金纳米粒结合。Son等[33]利用i-motif二级结构创造一种pH敏感的siRNA-金纳米粒递送系统,可通过siRNA沉默PLK1(编码稳定染色体和有丝分裂所必需的酶),进而诱导靶细胞凋亡。pH梯度变化可引起核酸构象改变,诱导siRNA-金纳米粒聚集,促进内体逃逸,从而释放siRNA。另一项研究发现HIV-TAT是一种关键的细胞穿透肽[34]。HIV-TAT可以促进细胞对多种分子吸收,因此可以对无机纳米载体进行相应功能化修饰。由于干细胞难以摄取外来物质,很难使用传统的非病毒载体进行药物递送[35]。Peng等[36]用HIV-TAT肽对金纳米粒和银纳米粒进行功能化修饰,载体可以有效穿透表皮干细胞,且毒性较低。
量子点是一种基于半导体的单分散纳米晶体。碳量子点是其中最典型的应用之一,其尺寸通常小于10 nm。碳量子点具有低毒性、高量子产率、低光漂白、良好的水溶性、易于表面修饰和化学性能稳定的特点。PEI、乙二胺、精胺和精氨酸等表面修饰已广泛应用于碳量子点,且携带阳离子化合物的碳量子点可以有效地将治疗性质粒转染到细胞中[37]。碳量子点可用于癌症靶向治疗,Zhang等[37]利用叶酸修饰掺杂了氮的碳量子点,进一步与自噬抑制剂组合,并在多达26种肿瘤细胞系中进行实验,最终实现快速(24 h内)抑制肿瘤细胞生长且杀伤效果显著。另外,碳量子点还可以作为一种高效的荧光探针,实现核酸标记和体内动态分布的实时跟踪[38]。例如用脂质体包裹碳量子点可用于血管中肿瘤扩增的成像[39]。Wu等[40]运用碳量子点来递送siRNA进行“可视化”的肺癌治疗。碳量子点的吸收光波长为360 nm,发射光波长为460 nm,这是蓝光的波长范围。由于其独特的发光特性和抗光漂白性,碳量子点在未来活细胞和体内生物成像中潜力巨大。
石墨烯是碳的同素异形体,由于其独特的光学、热学和电学特性,成为一种新型纳米材料。氧化石墨烯存在π-π堆叠非共价相互作用,可以提高药物装载能力并实现受控释放[41]。Kim等[42]设计了一种刺激响应型核酸递送载体,由PEG、PEI和氧化石墨烯组成。氧化石墨烯纳米粒吸收近红外辐射时,局部温度升高,导致内体破裂,实现受控释放。同时,氧化石墨烯具有较高负载力,可以将氧化石墨烯、PEI和聚4-苯乙烯磺酸钠组装成纳米复合物来同时递送miRNA药物和抗癌药物阿霉素[43]。
2.5. 蛋白载体
蛋白质具有良好的生物相容性、生物可降解性,通常毒性较小[44];且蛋白质具有两亲性,可以与溶剂和特定药物如DNA、RNA等发生相互作用,因此可以作为优良的核酸递送载体。有多种蛋白质可用于核酸递送,如明胶、白蛋白、丝蛋白、弹性蛋白、玉米醇溶蛋白等。
白蛋白是血液中的一种天然转运蛋白。白蛋白的内部结合位点和表面活性基团使其能够同时携带多种分子进行多功能治疗,且容易被修饰。Han等[45]用乙二胺对牛血清白蛋白表面进行修饰,生成阳离子牛血清白蛋白,并与siRNA混合,通过静电相互作用产生阳离子牛血清白蛋白/siRNA纳米粒。阳离子牛血清白蛋白既能保护siRNA不被降解,还能够将siRNA有效传递到B16肺转移细胞中。
玉米醇溶蛋白是存在于玉米种子中的一种贮藏蛋白,Regier等[46]证明其具有疏水性可以实现核酸的持续递送。因其安全性目前已可用于临床。Karthikeyan等[47]扩展了Regier等的工作,制造了玉米醇溶蛋白纳米纤维用于持续递送siRNA到皮肤成纤维细胞中以进行基因沉默。
2.6. 外泌体
外泌体是由多泡体与质膜融合以后释放到细胞外,直径40~160 nm的膜性囊泡状小体。外泌体作为天然的纳米载体可以装载多种类型的药物,如小分子、核酸类药物、重组蛋白、CRISPR/Cas9等。外泌体的膜上具有特异性配体或黏附分子,通过与受体细胞的膜相互作用,或被细胞摄取等方式进行药物释放[48]。因此,外泌体可以作为细胞内良好的核酸类药物递送系统。与脂质体或其他聚合物纳米载体比较,外泌体含有跨膜和膜锚定蛋白,可增强内吞作用,从而促进有效药物递送[49];肿瘤来源的外泌体的表面具有CD47分子,其能与巨噬细胞表面调节蛋白α结合,逃避吞噬,提高药物在内环境中的稳定性。外泌体为内源性的纳米粒,免疫原性较低,生物相容性较高,安全性较高,跨越生物屏障(包括血脑屏障和胃肠道屏障)的能力较强。不同来源的外泌体具有不同的功能,如来源于人胚肾HEK293细胞的外泌体具有免疫惰性,不会在体内引发炎症反应[50];癌细胞中过表达的Rab27a和Rab27b蛋白参与了外泌体的释放[51],这些外泌体由于与其亲本癌细胞相似可用于靶向递送;单核细胞和巨噬细胞等免疫细胞分泌的外泌体可以逃避免疫吞噬作用[52]。
目前已有许多利用外泌体进行核酸递送的研究,随着CRISPR基因编辑技术的兴起,人们也尝试利用外泌体递送CRISPR/Cas9,通过基因编辑手段治疗癌症。例如,Kim等[53]采用卵巢癌来源的外泌体在SKOV3异种移植小鼠体内递送CRISPR/Cas9质粒,能够抑制多聚(ADP-核糖)聚合酶1的表达,且在瘤内注射治疗20 d期间肿瘤体积几乎没有变化,而对照组肿瘤则持续增长。除此之外也有多项研究表明,利用外泌体递送ASO、siRNA、miRNA、mRNA等核酸类药物也具有良好的抗肿瘤治疗效果[54]。
外泌体药物递送研究也面临一系列挑战。首先,如何大规模生产用于临床试验的外泌体?Yang等[55]报道了一种细胞纳米穿孔法来产生大量外泌体,比传统方法产量高出50倍。其次,如何开发将药物装载到外泌体的新方法?传统的装载策略效率较低,即使是应用最广泛的电穿孔也容易引起核酸的聚集和降解以及改变外泌体性质[56]。Hu等[57]利用热稳定、可电离类LNP将siRNA装载到外泌体内,其具有良好的物理和化学性质、热稳定性和高效的siRNA转运效率,最后有助于实现癌症的精准化治疗。复杂的内环境以及外泌体的异质性可能会影响外泌体的递送效果。可以利用肿瘤患者自身肿瘤细胞产生的外泌体作为递送载体,其对体内癌细胞具有较高的靶向能力[58]。
3. 提高核酸类药物递送效率的解决方案
体外构建完成的核酸类药物要想在体内顺利发挥作用,需要克服重重阻碍。有许多关键性的因素影响着核酸递送效率,如核酸类药物在体内的稳定性、核酸类药物跨屏障到达病灶的能力。同时,如何促进溶酶体逃逸、改善核酸类药物的蛋白吸附、提高核酸类药物递送的靶向性对提高核酸类药物的递送效率具有重要作用。根据核酸类药物的作用机制,设置综合解决方案,如选用恰当的核酸结构修饰以及药物递送载体,辅以超声、激光脉冲等先进的技术手段,有助于实现良好的治疗效果。
3.1. 增强核酸类药物的稳定性、延长半衰期
大部分核酸类药物为RNA单链结构,结构并不稳定,在通过血液循环系统到达药物作用部位时极易被内环境中存在的大量核酸酶所降解,半衰期只有十几分钟,难以发挥治疗作用。另外,网状内皮系统介导的免疫清除也是导致核酸类药物半衰期短的重要因素。
对核酸类药物的糖基、碱基、磷酸基团进行多种化学修饰,有助于维持其自身结构的稳定[59],同时提高了抗酶解能力。将siRNA碱基的腺苷替换成用N-乙基哌啶-6-三唑修饰的腺苷类似物[60],也可以降低其免疫原性,从而增加在体内的循环时间。构建核酸类药物-LNP纳米载体,将核酸类药物包裹在脂质体的内部,有效地保护了核酸类药物的结构。LNP中性脂质DOPE以及胆固醇可以增强脂质体的稳定性[61],PEG-脂质结构可以阻止调理素与核酸-LNP结合,防止其被网状内皮系统迅速清除,从而延长半衰期。构建核酸-蛋白载体,利用蛋白质的两亲性与核酸相互作用进行药物递送可以使核酸长时间在体内运输,且毒性低,不易引发免疫反应。
3.2. 提高核酸类药物进入特定细胞的能力
大多数核酸类药物都是跟随血液流经全身,因此需要跨过血管内皮屏障才能到达靶器官、靶细胞。治疗神经系统疾病时,还要跨过血脑屏障。通过在核酸序列末端或载体表面修饰特异性靶向分子如瘦素、转铁蛋白受体的抗体等可以帮助核酸类药物跨越血脑屏障[62]。此外,外加磁场可以将超顺磁性氧化铁纳米粒加载的核酸类药物靶向到特定位置[63],并且暂时破坏血管内皮屏障,激活细胞旁运输途径[64],从而增加血管内皮的通透性。移除磁场后,粒子间磁性相互作用消失,防止超顺磁性氧化铁纳米粒在体内长时间聚集。核酸类药物在肿瘤组织中由于高通透性和滞留效应可以进行被动富集,但由于纳米载体尺寸通常在100~200 nm,不利于深入扩散到肿瘤内部。因此,可以利用近红外光构建尺寸动态改变的LNP,使后者从162 nm变为8.6 nm左右,有利于药物向肿瘤深部扩散[65]。
核酸类药物的细胞通透性是核酸类药物进入细胞的关键。核酸类药物-载体复合物大多数通过吸附性内吞作用、受体介导的内吞作用、巨胞饮作用和吞噬作用进入细胞。因此,可以在核糖2'位引入烷基,增加核酸类药物的脂溶性[9];核酸类药物-LNP中的胆固醇具有较强的膜融合特点,可以促进内吞作用;使载体携带阳离子,可以与膜上硫酸肝素蛋白多糖结合促进内吞作用[66];用HIV-TAT肽对金纳米粒进行修饰,可以使核酸类药物-载体复合物有效地穿透表皮干细胞[36]。上述化学修饰的方法可以提高核酸类药物的细胞通透性,使药物能够成功进入细胞。除此之外,超声、激光脉冲、电穿孔等物理辅助技术也可以促进核酸向细胞内运输[67],但尚未广泛应用。
3.3. 促进溶酶体逃逸
核酸类药物经过血液循环并跨膜进入细胞后,会被运送到溶酶体,溶酶体中的酸性环境以及多种水解酶会迅速使核酸类药物失活。因此,对载体进行改造来促进内体逃逸是提高核酸类药物治疗效果的关键手段之一。例如,核酸类药物-LNP中的阳离子脂质具有胺基头部,其可以根据pH变化改变电性,在与溶酶体融合时可以促进内体逃逸;聚合物纳米载体中也含有许多胺基类基团,可以在酸性条件下质子化,导致氯离子和水流入内体,渗透压升高,膨胀破裂,实现内体逃逸。两者都是根据质子海绵机制实现内体逃逸,阳离子聚合物还可能介导内体的物理破坏实现逃逸[68]。在无机纳米载体中,可以根据材料的特性来实现内体逃逸。例如,Son等[33]利用i-motif二级结构驱动构建pH敏感的siRNA-金纳米粒,通过pH梯度变化引起核酸构象改变,诱导siRNA-金纳米粒聚集,促进内体逃逸;Kim等[42]利用氧化石墨烯构建光热转染的受控释放载体,氧化石墨烯纳米粒在吸收近红外辐射时,局部温度升高,导致内体破裂。
3.4. 改善蛋白质吸附
阳离子型载体虽然能够通过静电相互作用包裹核酸类药物,提高核酸类药物的稳定性,进而提高转染效率,但其可与多种细胞进行非特异性结合,且在循环过程中会吸附大量蛋白,导致复合体不稳定,掩盖靶向分子等[69]。使用其他非阳离子型载体,如白蛋白载体、玉米醇溶蛋白载体等,可以有助于减少运输过程中血清成分的变化[70]。
3.5. 提高核酸类药物递送的靶向性
提高核酸类药物的靶向性是提高药物递送准确性和治疗效果的关键手段之一,并且能减少药物对非靶细胞的副作用。近年来,GalNAc共轭连接递送技术的开发大大改善了核酸类药物肝脏靶向的递送效果。去唾液酸糖蛋白受体是在肝细胞膜表面上高度特异性表达的一种内吞性受体,可以介导GalNAc的内吞作用,GalNAc是其配体[71]。基于GalNAc共轭连接递送技术,目前全球已上市的核酸类药物有三种:Alnylam公司的Onpattro和Givlaari,以及Ionis Pharmaceuticals公司的Tegsedi。其中,Onpattro和Tegsedi通过靶向干细胞来治疗hATTR,Givlaari用于治疗急性间歇性卟啉症。
但针对肝外组织和细胞的靶向转运是核酸类药物递送面临的挑战,目前的临床核酸类药物尚未有肝外靶向的案例。很多细胞表面都缺乏核酸类药物的靶向受体,这也限制了核酸类药物的肝外靶向。因此,开发肝外靶向的核酸类药物仍然需要更多的研究和发展。目前,Cheng等[72]开发了一种SORT策略,可以准确地将核酸类药物递送到小鼠的肺、脾和肝脏静脉等部位。通过添加补充分子(如正电荷脂质、负电荷脂质、两性离子脂质等)调整递送载体内部的电荷来调整组织趋向性[73]。实验结果表明,阳离子SORT脂质可以使转染从肝转移到脾,然后转移到肺;而阴离子SORT脂质能够促进脾脏转染。造成这种SORT-LNP的器官靶向特性的机制因素为器官水平生物分布、酸解离常数和血清蛋白吸附。首先LNP表面PEG脂质解离暴露出内部SORT类分子,暴露的SORT分子识别吸附不同的血清蛋白,然后表面吸附蛋白与靶器官中细胞表达同源受体相互作用,促进核酸类药物选择性传递到这些组织。核酸适配体通过核酸的三维结构与靶分子结合,提高核酸递送载体的靶向性[74]。由Valeant公司开发的第一款临床核酸适配体药物Pegaptanib,用于治疗湿性年龄相关性黄斑变性,为临床诊断和精准药物治疗提供新工具。
4. 结语
目前,核酸类药物已被广泛用于癌症、2019冠状病毒病等疾病的治疗研究中,许多以前难以治疗的疾病在核酸类药物递送手段下,也逐渐找到了可行的思路。针对核酸类药物在体内稳定性低,以及在治疗过程中靶向性弱、难以跨越体内屏障等难题,对核酸类药物的结构进行化学修饰、构建有效的纳米载体等手段显著改善了核酸类药物的递送效率和治疗效果。
进一步提高核酸类药物在体内的稳定性、增强递送效率,降低免疫原性,促进核酸药物特定组织细胞精准递送,是未来提高核酸类药物递送主攻方向。目前,病毒载体应用较为广泛,LNP、聚合物纳米载体、无机纳米载体和外泌体的研究也逐渐扩大与深入,在实验研究和临床应用都已取得较大突破,成为未来递送载体研究的重要内容。一系列核酸结构的修饰以及药物递送系统的研发可以有效地帮助核酸类药物顺利到达靶点,调节基因的转录和翻译。单独的修饰或递送载体尚不足以克服众多障碍,将核酸化学修饰与药物递送系统相结合有望实现更好的治疗效果,但其技术难度和临床应用转化成本也随之增加,针对更加简单实用、高效低毒、精准靶向核酸药物载体和核酸化学修饰的研发将成为核酸药物研发的热点方向。核酸类药物递送是一个广阔的、富有前景的研究领域,但也充满了挑战,需要不断探索。
Supplementary information
本文附表见电子版。
Acknowledgments
研究得到国家重点研发计划(2021YFC2700903)、国家杰出青年科学基金(32225014)、浙江省“领雁”研发攻关计划(2023C03023)支持
Acknowledgments
This study was funded by the National Key R&D Program of China (2021YFC2700903), National Science Fund for Distinguished Young Scholars (32225014), “Lingyan” Research and Development Project (2023C03023).
[缩略语]
信使RNA(messenger RNA,mRNA);微RNA(microRNA,miRNA);小干扰RNA(small interfering RNA,siRNA);小激活RNA(small activating RNA,saRNA);反义寡核苷酸(antisense oligonucleotide,ASO);成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR);CRISPR关联(CRISPR associated,Cas);磷酸二酰胺吗啉代寡核苷酸(phosphorodiamidate morpholino oligomer,PMO);嵌合抗原受体(chimeric antigen receptor,CAR);严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2);脂质纳米粒(lipid nanoparticle,LNP);聚乙二醇[poly (ethylene glycol),PEG];遗传性甲状腺素转运蛋白淀粉样变性(hereditary transthyretin-mediated amyloidosis,hATTR);马尔堡病毒(Marberg virus,MARV);聚酰胺-胺(polyamidoamine,PAMAM);聚乙烯亚胺(polyethylenimine,PEI);聚乳酸-羟基乙酸共聚物[poly (lactic-co-glycolic acid),PLGA];人类免疫缺陷病毒(human immunodeficiency virus,HIV);反式激活蛋白(trans-activator,TAT);1,2-二油酰-SN-甘油-3-磷酰乙醇胺(1,2-dioleoyl-SN-glycero-3-phosphoethanola-mine,DOPE);N-乙酰化的半乳糖胺(N-acetylgalatosa-mine,GalNAc);选择性器官靶向(selective organ targeting,SORT)
利益冲突声明
所有作者均声明不存在利益冲突
Conflict of Interests
The authors declare that there is no conflict of interests
参考文献(References)
- 1.YU R Z, LEMONIDIS K M, GRAHAM M J, et al. Cross-species comparison of in vivo PK/PD relationships for second-generation antisense oligonucleotides targeting apolipoprotein B-100[J]. Biochem Pharmacol, 2009, 77(5): 910-919. 10.1016/j.bcp.2008.11.005 [DOI] [PubMed] [Google Scholar]
- 2.HU B, ZHONG L, WENG Y, et al. Therapeutic siRNA: state of the art[J]. Signal Transduct Target Ther, 2020, 5(1): 101. 10.1038/s41392-020-0207-x [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.IWAMOTO N, BUTLER D, SVRZIKAPA N, et al. Control of phosphorothioate stereochemistry substantially increases the efficacy of antisense oligonucleotides[J]. Nat Biotechnol, 2017, 35(9): 845-851. 10.1038/nbt.3948 [DOI] [PubMed] [Google Scholar]
- 4.NELSON J, SORENSEN E W, MINTRI S, et al. Impact of mRNA chemistry and manufacturing process on innate immune activation[J]. Sci Adv, 2020, 6(26): eaaz6893. 10.1126/sciadv.aaz6893 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.VAIDYANATHAN S, AZIZIAN K T, HAQUE A, et al. Uridine depletion and chemical modification increase Cas9 mRNA activity and reduce immunogenicity without HPLC purification[J]. Mol Ther Nucleic Acids, 2018, 12: 530-542. 10.1016/j.omtn.2018.06.010 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.VALENZUELA R A P, SUTER S R, BALL-JONES A A, et al. Base modification strategies to modulate immune stimulation by an siRNA[J]. Chembiochem, 2015, 16(2): 262-267. 10.1002/cbic.201402551 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.WAHBA A S, AZIZI F, DELEAVEY G F, et al. Phenylpyrrolocytosine as an unobtrusive base modifi-cation for monitoring activity and cellular trafficking of siRNA[J]. ACS Chem Biol, 2011, 6(9): 912-919. 10.1021/cb200070k [DOI] [PubMed] [Google Scholar]
- 8.SHEN W, LIANG X H, SUN H, et al. 2'-Fluoro-modified phosphorothioate oligonucleotide can cause rapid degradation of P54nrb and PSF[J]. Nucleic Acids Res, 2015, 43(9): 4569-4578. 10.1093/nar/gkv298 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.KHVOROVA A, WATTS J K. The chemical evolution of oligonucleotide therapies of clinical utility[J]. Nat Biotechnol, 2017, 35(3): 238-248. 10.1038/nbt.3765 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.LIAO T, LI X, TONG Q, et al. Ultrasensitive detection of microRNAs with morpholino-functionalized nano-channel biosensor[J]. Anal Chem, 2017, 89(10): 5511-5518. 10.1021/acs.analchem.7b00487 [DOI] [PubMed] [Google Scholar]
- 11.WARREN T K, SHURTLEFF A C, BAVARI S. Advanced morpholino oligomers: a novel approach to antiviral therapy[J]. Antiviral Res, 2012, 94(1): 80-88. 10.1016/j.antiviral.2012.02.004 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.MAUDE S L, FREY N, SHAW P A, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med, 2014, 371(16): 1507-1517. 10.1056/nejmoa1407222 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.RUSSELL W C. Update on adenovirus and its vectors[J]. J Gen Virol, 2000, 81(Pt 11): 2573-2604. 10.1099/0022-1317-81-11-2573 [DOI] [PubMed] [Google Scholar]
- 14.LOGUNOV D Y, DOLZHIKOVA I V, SHCHEBLY-AKOV D V, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia[J]. Lancet, 2021, 397(10275): 671-681. 10.1016/s0140-6736(21)00234-8 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.FLOTTE T R. Gene therapy progress and prospects: recombinant adeno-associated virus (rAAV) vectors[J]. Gene Ther, 2004, 11(10): 805-810. 10.1038/sj.gt.3302233 [DOI] [PubMed] [Google Scholar]
- 16.MENDELL J R, AL-ZAIDY S A, RODINO-KLAPAC L R, et al. Current clinical applications of in vivo gene therapy with AAVs[J]. Mol Ther, 2021, 29(2): 464-488. 10.1016/j.ymthe.2020.12.007 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.AKINC A, MAIER M A, MANOHARAN M, et al. The Onpattro story and the clinical translation of nano-medicines containing nucleic acid-based drugs[J]. Nat Nanotechnol, 2019, 14(12): 1084-1087. 10.1038/s41565-019-0591-y [DOI] [PubMed] [Google Scholar]
- 18.LUTZ J, LAZZARO S, HABBEDDINE M, et al. Unmodified mRNA in LNPs constitutes a competitive technology for prophylactic vaccines[J]. NPJ Vaccines, 2017, 2: 29. 10.1038/s41541-017-0032-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.IDRIS A, DAVIS A, SUPRAMANIAM A, et al. A SARS-CoV-2 targeted siRNA-nanoparticle therapy for COVID-19[J]. Mol Ther, 2021, 29(7): 2219-2226. 10.1016/j.ymthe.2021.05.004 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.GEISBERT T W, LEE A C, ROBBINS M, et al. Pos-texposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference: a proof-of-concept study[J]. Lancet, 2010, 375(9729): 1896-1905. 10.1016/s0140-6736(10)60357-1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.URSIC-BEDOYA R, MIRE C E, ROBBINS M, et al. Protection against lethal Marburg virus infection mediated by lipid encapsulated small interfering RNA[J]. J Infect Dis, 2014, 209(4): 562-570. 10.1093/infdis/jit465 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.THI E P, MIRE C E, LEE A C, et al. siRNA rescues nonhuman primates from advanced Marburg and Ravn virus disease[J]. J Clin Invest, 2017, 127(12): 4437-4448. 10.1172/jci96185 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.NI R, FENG R, CHAU Y. Synthetic approaches for nucleic acid delivery: choosing the right carriers[J]. Life (Basel), 2019, 9(3): 59. 10.3390/life9030059 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.PIOTROWSKI-DASPIT A S, KAUFFMAN A C, BRACAGLIA L G, et al. Polymeric vehicles for nucleic acid delivery[J]. Adv Drug Deliv Rev, 2020, 156: 119-132. 10.1016/j.addr.2020.06.014 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.ARAÚJO R V, SANTOS S, IGNE FERREIRA E, et al. New advances in general biomedical applications of PAMAM dendrimers[J]. Molecules, 2018, 23(11): 2849. 10.3390/molecules23112849 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.SHARMA A, PORTERFIELD J E, SMITH E, et al. Effect of mannose targeting of hydroxyl PAMAM dendrimers on cellular and organ biodistribution in a neonatal brain injury model[J]. J Control Release, 2018, 283: 175-189. 10.1016/j.jconrel.2018.06.003 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.SCHLOSSER K, TAHA M, DENG Y, et al. Systemic delivery of microRNA mimics with polyethylenimine elevates pulmonary microRNA levels, but lacks pulmonary selectivity[J]. Pulm Circ, 2018, 8(1): 2045893217750613. 10.1177/2045893217750613 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.HALMAN J R, KIM K T, GWAK S J, et al. A cationic amphiphilic co-polymer as a carrier of nucleic acid nanoparticles (Nanps) for controlled gene silencing, immunostimulation, and biodistribution[J]. Nanomedi-cine, 2020, 23: 102094. 10.1016/j.nano.2019.102094 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.KAPOOR D N, BHATIA A, KAUR R, et al. PLGA: a unique polymer for drug delivery[J]. Ther Deliv, 2015, 6(1): 41-58. 10.4155/tde.14.91 [DOI] [PubMed] [Google Scholar]
- 30.KACZMAREK J C, KAUFFMAN K J, FENTON O S, et al. Optimization of a degradable polymer-lipid nano-particle for potent systemic delivery of mRNA to the lung endothelium and immune cells[J]. Nano Lett, 2018, 18(10): 6449-6454. 10.1021/acs.nanolett.8b02917 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.CHOI J, RUI Y, KIM J, et al. Nonviral polymeric nanoparticles for gene therapy in pediatric CNS malig-nancies[J]. Nanomedicine, 2020, 23: 102115. 10.1016/j.nano.2019.102115 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.ERATHODIYIL N, YING J Y. Functionalization of inorganic nanoparticles for bioimaging applications[J]. Acc Chem Res, 2011, 44(10): 925-935. 10.1021/ar2000327 [DOI] [PubMed] [Google Scholar]
- 33.SON S, NAM J, KIM J, et al. I-motif-driven Au nanomachines in programmed siRNA delivery for gene-silencing and photothermal ablation[J]. ACS Nano, 2014, 8(6): 5574-5584. 10.1021/nn5022567 [DOI] [PubMed] [Google Scholar]
- 34.WAGSTAFF K M, JANS D A. Protein transduction: cell penetrating peptides and their therapeutic applica-tions[J]. Curr Med Chem, 2006, 13(12): 1371-1387. 10.2174/092986706776872871 [DOI] [PubMed] [Google Scholar]
- 35.LAKSHMIPATHY U, PELACHO B, SUDO K, et al. Efficient transfection of embryonic and adult stem cells[J]. Stem Cells, 2004, 22(4): 531-543. 10.1634/stemcells.22-4-531 [DOI] [PubMed] [Google Scholar]
- 36.PENG L H, NIU J, ZHANG C Z, et al. TAT conjugated cationic noble metal nanoparticles for gene delivery to epidermal stem cells[J]. Biomaterials, 2014, 35(21): 5605-5618. 10.1016/j.biomaterials.2014.03.062 [DOI] [PubMed] [Google Scholar]
- 37.ZHANG P, AN K, DUAN X, et al. Recent advances in siRNA delivery for cancer therapy using smart nano-carriers[J]. Drug Discov Today, 2018, 23(4): 900-911. 10.1016/j.drudis.2018.01.042 [DOI] [PubMed] [Google Scholar]
- 38.MOHAMMADINEJAD R, DADASHZADEH A, MOGHASSEMI S, et al. Shedding light on gene therapy: carbon dots for the minimally invasive image-guided delivery of plasmids and noncoding RNAs—a review[J]. J Adv Res, 2019, 18: 81-93. 10.1016/j.jare.2019.01.004 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.HASSAN M, GOMES V G, DEHGHANI A, et al. Engineering carbon quantum dots for photomediated theranostics[J]. Nano Res, 2018, 11(1): 1-41. 10.1007/s12274-017-1616-1 [DOI] [Google Scholar]
- 40.WU Y F, WU H C, KUAN C H, et al. Multi-functionalized carbon dots as theranostic nanoagent for gene delivery in lung cancer therapy[J]. Sci Rep, 2016, 6: 21170. 10.1038/srep21170 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.YANG X, ZHANG X, LIU Z, et al. High-efficiency loading and controlled release of doxorubicin hydro-chloride on graphene oxide[J]. J Phys Chem C, 2008, 112(45): 17554-17558. 10.1021/jp806751k [DOI] [Google Scholar]
- 42.KIM H, KIM W J. Photothermally controlled gene delivery by reduced graphene oxide-polyethylenimine nanocomposite[J]. Small, 2014, 10(1): 117-126. 10.1002/smll.201202636 [DOI] [PubMed] [Google Scholar]
- 43.ZHI F, DONG H, JIA X, et al. Functionalized graphene oxide mediated adriamycin delivery and miR-21 gene silencing to overcome tumor multidrug resistance in vitro [J/OL]. PLoS One, 2013, 8(3): e60034. 10.1371/journal.pone.0060034 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.LOHCHAROENKAL W, WANG L, CHEN Y C, et al. Protein nanoparticles as drug delivery carriers for cancer therapy[J]. Biomed Res Int, 2014, 2014: 180549. 10.1155/2014/180549 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.HAN J, WANG Q, ZHANG Z, et al. Cationic bovine serum albumin based self-assembled nanoparticles as siRNA delivery vector for treating lung metastatic cancer[J]. Small, 2014, 10(3): 524-535. 10.1002/smll.201301992 [DOI] [PubMed] [Google Scholar]
- 46.REGIER M C, TAYLOR J D, BORCYK T, et al. Fabrication and characterization of DNA-loaded zein nanospheres[J]. J Nanobiotechnology, 2012, 10: 44. 10.1186/1477-3155-10-44 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.KARTHIKEYAN K, KRISHNASWAMY V R, LAKRA R, et al. Fabrication of electrospun zein nanofibers for the sustained delivery of siRNA[J]. J Mater Sci Mater Med, 2015, 26(2): 101. 10.1007/s10856-015-5439-x [DOI] [PubMed] [Google Scholar]
- 48.FAROOQI A A, DESAI N N, QURESHI M Z, et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds[J]. Biotechnol Adv, 2018, 36(1): 328-334. 10.1016/j.biotechadv.2017.12.010 [DOI] [PubMed] [Google Scholar]
- 49.LU M, ZHAO X, XING H, et al. Comparison of exosome-mimicking liposomes with conventional liposomes for intracellular delivery of siRNA[J]. Int J Pharm, 2018, 550(1-2): 100-113. 10.1016/j.ijpharm.2018.08.040 [DOI] [PubMed] [Google Scholar]
- 50.ZHU X, BADAWI M, POMEROY S, et al. Compre-hensive toxicity and immunogenicity studies reveal minimal effects in mice following sustained dosing of extracellular vesicles derived from HEK293T cells[J]. J Extracell Vesicles, 2017, 6(1): 1324730. 10.1080/20013078.2017.1324730 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.OSTROWSKI M, CARMO N B, KRUMEICH S, et al. Rab27a and Rab27b control different steps of the exosome secretion pathway[J]. Nat Cell Biol, 2010, 12(1): 19-30, sup 1-13. 10.1038/ncb2000 [DOI] [PubMed] [Google Scholar]
- 52.SHENODA B B, AJIT S K. Modulation of immune responses by exosomes derived from antigen-presenting cells[J]. Clin Med Insights Pathol, 2016, 9(Suppl 1): 1-8. 10.4137/cpath.s39925 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.KIM S M, YANG Y, OH S J, et al. Cancer-derived exosomes as a delivery platform of CRISPR/Cas9 confer cancer cell tropism-dependent targeting[J]. J Control Release, 2017, 266: 8-16. 10.1016/j.jconrel.2017.09.013 [DOI] [PubMed] [Google Scholar]
- 54.ZHANG Y, LIU Q, ZHANG X, et al. Recent advances in exosome-mediated nucleic acid delivery for cancer therapy[J]. J Nanobiotechnology, 2022, 20(1): 279. 10.1186/s12951-022-01472-z [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.YANG Z, SHI J, XIE J, et al. Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation[J]. Nat Biomed Eng, 2020, 4(1): 69-83. 10.1038/s41551-019-0485-1 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.JOHNSEN K B, GUDBERGSSON J M, SKOV M N, et al. Evaluation of electroporation-induced adverse effects on adipose-derived stem cell exosomes[J]. Cytote-chnology, 2016, 68(5): 2125-2138. 10.1007/s10616-016-9952-7 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.HU B, LI B, LI K, et al. Thermostable ionizable lipid-like nanoparticle (iLAND) for RNAi treatment of hyperlipidemia[J]. Sci Adv, 2022, 8(7): eabm1418. 10.1126/sciadv.abm1418 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.GONG C, ZHANG X, SHI M, et al. Tumor exosomes reprogrammed by low pH are efficient targeting vehicles for smart drug delivery and personalized therapy against their homologous tumor[J]. Adv Sci (Weinh), 2021, 8(10): 2002787. 10.1002/advs.202002787 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.NAIR J K, ATTARWALA H, SEHGAL A, et al. Impact of enhanced metabolic stability on pharmacokinetics and pharmacodynamics of GalNAc-siRNA conjugates[J]. Nucleic Acids Res, 2017, 45(19): 10969-10977. 10.1093/nar/gkx818 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.HARINGSMA H J, LI J J, SORIANO F, et al. mRNA knockdown by single strand RNA is improved by chemical modifications[J]. Nucleic Acids Res, 2012, 40(9): 4125-4136. 10.1093/nar/gkr1301 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.ZHANG S, XU Y, WANG B, et al. Cationic compounds used in lipoplexes and polyplexes for gene delivery[J]. J Control Release, 2004, 100(2): 165-180. 10.1016/j.jconrel.2004.08.019 [DOI] [PubMed] [Google Scholar]
- 62.LEE Y, LEE J, KIM M, et al. Brain gene delivery using histidine and arginine-modified dendrimers for ischemic stroke therapy[J]. J Control Release, 2021, 330: 907-919. 10.1016/j.jconrel.2020.10.064 [DOI] [PubMed] [Google Scholar]
- 63.MAHMOUDI M, SANT S, WANG B, et al. Superpara-magnetic iron oxide nanoparticles (SPIONs): develop-ment, surface modification and applications in chemo-therapy[J]. Adv Drug Deliv Rev, 2011, 63(1-2): 24-46. 10.1016/j.addr.2010.05.006 [DOI] [PubMed] [Google Scholar]
- 64.QIU Y, TONG S, ZHANG L, et al. Magnetic forces enable controlled drug delivery by disrupting endothelial cell-cell junctions[J]. Nat Commun, 2017, 8: 15594. 10.1038/ncomms15594 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.XIONG X, XU Z, HUANG H, et al. A NIR light triggered disintegratable nanoplatform for enhanced penetration and chemotherapy in deep tumor tissues[J]. Biomaterials, 2020, 245: 119840. 10.1016/j.biomaterials.2020.119840 [DOI] [PubMed] [Google Scholar]
- 66.FINN J D, SMITH A R, PATEL M C, et al. A single administration of CRISPR/Cas9 lipid nanoparticles achieves robust and persistent in vivo genome editing[J]. Cell Rep, 2018, 22(9): 2227-2235. 10.1016/j.celrep.2018.02.014 [DOI] [PubMed] [Google Scholar]
- 67.DU X, WANG J, ZHOU Q, et al. Advanced physical techniques for gene delivery based on membrane perforation[J]. Drug Deliv, 2018, 25(1): 1516-1525. 10.1080/10717544.2018.1480674 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 68.WOJNILOWICZ M, GLAB A, BERTUCCI A, et al. Super-resolution imaging of proton sponge-triggered rupture of endosomes and cytosolic release of small interfering RNA[J]. ACS Nano, 2019, 13(1): 187-202. 10.1021/acsnano.8b05151 [DOI] [PubMed] [Google Scholar]
- 69.PALCHETTI S, DIGIACOMO L, GIULIMONDI F, et al. A mechanistic explanation of the inhibitory role of the protein corona on liposomal gene expression[J]. Biochim Biophys Acta Biomembr, 2020, 1862(3): 183159. 10.1016/j.bbamem.2019.183159 [DOI] [PubMed] [Google Scholar]
- 70.CAGLIANI R, GATTO F, BARDI G. Protein adsorption: a feasible method for nanoparticle functionalization?[J]. Materials (Basel), 2019, 12(12): 1991. 10.3390/ma12121991 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 71.HUANG Y. Preclinical and clinical advances of GalNAc-decorated nucleic acid therapeutics[J]. Mol Ther Nucleic Acids, 2017, 6: 116-132. 10.1016/j.omtn.2016.12.003 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.CHENG Q, WEI T, FARBIAK L, et al. Selective organ targeting (SORT) nanoparticles for tissue-specific mRNA delivery and CRISPR-Cas gene editing[J]. Nat Nanotechnol, 2020, 15(4): 313-320. 10.1038/s41565-020-0669-6 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 73.YAN Y, XIONG H, ZHANG X, et al. Systemic mRNA delivery to the lungs by functional polyester-based carriers[J]. Biomacromolecules, 2017, 18(12): 4307-4315. 10.1021/acs.biomac.7b01356 [DOI] [PubMed] [Google Scholar]
- 74.HE F, WEN N, XIAO D, et al. Aptamer-based targeted drug delivery systems: current potential and challenges[J]. Curr Med Chem, 2020, 27(13): 2189-2219. 10.2174/0929867325666181008142831 [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
本文附表见电子版。


