Abstract
目的
探究脂质运载蛋白2(Lcn2)在骨发育和老年性骨质疏松的作用。
方法
C3H10T1/2 MSC细胞用成骨诱导液诱导3 d或不作处理(control),收集细胞核提取染色质,以H3K27A和H3K9Me3抗体进行免疫沉淀;ChIP-seq分析了诱导成骨分化前后C3H10T1/2间充质干细胞Lcn2基因座位的修饰组蛋白结合情况;ROSE软件(利用H3K27AC信号计算)显示成骨诱导后出现超级增强子;RNA-seq结果证实Lcn2在C3H10T1/2成骨诱导后上调的倍数在所有基因中位列第4;逆转录-实时定量PCR结果用于证实Lcn2的mRNA水平在C3H10T1/2成骨诱导后上调;蛋白质组学分析了16月龄C57BL/6J雄鼠相对于3月龄雄鼠股骨远端总蛋白表达谱的差异。iTRAQ-MS/MS用于分析,16月龄的老年雄鼠的松质骨中Lcn2蛋白表达相对于3月龄雄鼠的差异;ELISA检测3月龄和16月龄老年雄鼠血清中Lcn2含量;用50、100、200、500 ng/mL浓度的Lcn2重组蛋白处理C3H10T1/2后以ALP检测成骨分化能力,以Westem blot检测早期成骨转录因子OSX和晚期成骨指标OCN。
结果
iTRAQ-MS/MS结果显示,16月龄的老年雄鼠的松质骨中Lcn2蛋白表达相对于3月龄雄鼠明显上调(P < 0.01)。与此对应,ELISA结果示16月龄老年雄鼠血清中Lcn2含量比3月龄对照(control)雄鼠明显升高(P < 0.01)。ALP染色结果和定量结果显示加入100、200、500 ng/mL浓度Lcn2 RP后ALP表达减弱(P < 0.05,P < 0.01,P < 0.01)。Westem blot定量结果显示OSX在100、200、500 ng/mL浓度的Lcn2 RP组中的表达减低,呈剂量依赖性(P < 0.05)。Westem blot定量结果显示OCN在100、200、500 ng/mL浓度的Lcn2 RP组中的表达减低,呈剂量依赖性(P < 0.05,P < 0.01,P < 0.001)。ROSE软件(利用H3K27AC信号计算)显示成骨诱导后Lcn2基因区域出现超级增强子。RNA-seq结果证实Lcn2在C3H10T1/2成骨诱导后上调的倍数在所有基因中位列第4。C3H10T1/2成骨诱导后上调倍数最高的Zbtb16基因区域也在成骨诱导后出现超级增强子。逆转录-实时定量PCR进一步证实了Lcn2的mRNA水平在成骨诱导后急剧升高(P < 0.001)。
结论
Lcn2是间充质干细胞(MSCs)正常成骨分化所必须的,但在衰老时过度表达和分泌以自限性抑制MSCs的成骨分化。
Keywords: 脂质运载蛋白2, 老年性骨质疏松, 间充质干细胞, 成骨分化
Abstract
Objective
To explore the role of lipocalin 2 (Lcn2) in bone development and senile osteoporosis.
Methods
Chromatin immunoprecipitation with H3K27AC and H3K9Me3 antibodies coupled with massively parallel sequencing (ChIP-Seq) was performed to analyze the changes in binding of modified histones at the Lcn2 gene locus in C3H10T1/2 mesenchymal stem cells (MSCs) induced with osteogenic induction medium for 3 days. ITRAQ-MS/MS and ELISA were used to compare Lcn2 protein expressions in the cancellous bone and the serum between 16- and 3-month-old male mice. The effect of treatment with recombinant Lcn2 protein on osteogenic differentiation of C3H10T1/2 cells was evaluated by detecting changes in ALP expression, and Western blotting was performed to examine the changes in OSX and OCN expression.
Results
The expression of Lcn2 protein in the cancellous bone and its serum levels were significantly higher in 16-month-old than in 3-month-old male mice (P < 0.01). In C3H10T1/2 cells, ALP expression level decreased significantly after treatment with recombinant Lcn2 protein (P < 0.05) accompanied by lowered protein expressions of OSX and OCN (P < 0.05). Analysis with ROSE software revealed a super enhancer in the Lcn2 gene region of C3H10T1/2 cells after osteogenesis induction. RNA-seq results confirmed that Lcn2 was among the top 4 up-regulated genes in C3H10T1/2 cells following osteogenic induction, and a super enhancer was also detected in Zbtb16 gene, which showed the highest up- regulation after osteogenic induction. Real- time quantitative PCR further confirmed that the mRNA level of Lcn2 increased sharply in C3H10T1/2 cells after osteogenic induction (P < 0.001).
Conclusion
Lcn2 is essential for normal osteogenic differentiation of MSCs, but its overexpression and excessive secretion in aging induce self-limited inhibition of osteogenic differentiation of MSCs.
Keywords: lipocalin 2, senile osteoporosis, mesenchymal stem cells, osteogenic differentiation
老年性骨质疏松(SOP)主要原因在于骨髓间充质干细胞(BMSC)成骨分化减少,导致成骨细胞介导的骨形成(骨合成代谢)严重减少,而目前临床药物主要作用于成骨细胞靶点的药物很少[1]。甲状旁腺激素激动剂- 特立帕太主要通过增强成骨细胞形成以及抑制成骨细胞凋亡来起到抗骨质疏松的作用[2],但该药是高钙血症患者禁用[3],价格昂贵,长期使用会增加患骨肉瘤的风险并且会损害皮质骨结构,进而导致骨折风险的进一步增加[4]。雷诺昔芬属于选择性雌激素受体调节剂,通过促进骨形成和抑制骨吸收来起到抗骨质疏松作用,但雷诺昔芬有增加中风和静脉血栓栓塞的风险[5]。所以研究可以促进BMSC成骨分化的靶点对于改善骨质疏松的药物研发起着重要意义。
脂质运载蛋白2(Lcn2)也称为中性粒细胞明胶酶相关脂质运载蛋白,是一种25 000的分泌蛋白,可结合并转运小的疏水物质[6]。Lcn2在成骨细胞和白色脂肪细胞有较高表达[7],并在免疫细胞,肝细胞和肾小管细胞表达,其表达在病理状态下上调[8]。Lipocalin-2是急性和慢性肾脏疾病、心力衰竭和肥胖相关医学并发症的功能性生物标志物[9]。成骨细胞中过表达Lcn2的转基因小鼠存在骨量减少[10],且小鼠颅骨成骨细胞在模拟微重力条件下成骨分化减弱,而此时在多种基因中Lcn2的上调最明显[11],表明微重力条件下Lcn2可能参与成骨分化的抑制。在模拟微重力条件下,小鼠成骨细胞中出现Lcn2基因的上调,而小鼠原代成骨细胞中过表达Lcn2则导致骨形成减低[12]。以上数据提示Lcn2在微重力条件下可能反过来抑制成骨分化,但在骨发育和老年性骨质疏松的作用尚不清楚。Lcn2分泌蛋白对MSC成骨分化能力的作用值得研究,可为靶向Lcn2治疗老年骨质疏松提供理论基础。
1. 材料和方法
1.1. 材料
C3H/10T1 /2(ATCC),MEM培养基(Biological Industries),血清(Biological Industries),ALP试剂盒(碧云天),Lcn2 RP(R&D),OSX抗体、OCN(abcam),β- actin、二抗抗兔、二抗抗鼠(北京锐抗),Lcn2 RP ELISA试剂盒(elabscience),Trizol(Takara),反转录试剂盒(Takara),qPCR试剂盒(诺唯赞)。3月龄和16月龄雄性C57BL/6J小鼠购自广东斯嘉景达生物科技有限公司,饲养于SPF级动物房。本研究动物实验已通过论理委审核(L2018179)。
1.2. 方法
1.2.1. 细胞培养
C3H/10T1/2细胞系使用MEM培养基培养,添加10%胎牛血清、1%非必需氨基酸、1%谷氨酰胺、1%丙酮酸钠以及1%双抗,在37 ℃、CO2浓度为5% 的细胞培养箱内培养,2 d/次更换培养基。当细胞百分百融合以后,加入成骨诱导液:终浓度50 μmol/L的维生素C,终浓度10 mmol/L的β-磷酸甘油和0.1 μmol/L终浓度地塞米松,成骨诱导7 d。对照组(control)为不加入Lcn2 RP;实验组(Lcn2 RP)为在成骨诱导液中额外加入50、100、200、500 ng/mL的Lcn2 RP培养7 d。
1.2.2. 碱性磷酸酶(ALP)染色
将C3H/10T1/2细胞接种于24孔板,细胞完全融合后进行成骨诱导7 d后按ALP显色试剂盒操作说明对细胞进行固定、清洗、染色、扫描并记录。每组实验重复3次。
1.2.3. 实时定量荧光PCR
用Trizol法按说明书操作提取细胞RNA,测定浓度后并反转录合成cDNA。PCR扩增反应参照诺唯赞试剂盒的说明书进行。Lcn2和内参基因β-actin引物序列如下:
Lcn2: Forward Primer: TGGCCCTGAGTGTCATGTG
Reverse Primer: CTCTTGTAGCTCATAGATGGTGC
β- actin: Forward Primer: GGCTGTATTCCCCTCCAT CG
Reverse Primer: CCAGTTGGTAACAATGCCATGT
1.2.4. 免疫印迹实验(Westem blot)
将C3H/10T1/2细胞接种于24孔板,细胞完全融合后进行成骨诱导7 d后提取细胞总蛋白后进行Westem blot实验。蛋白上样,10% SDS-PAGE电泳分离后,转膜,5% BSA封闭液封闭1 h,一抗置于4 ℃孵育过夜,洗膜3次,37 ℃孵育二抗1 h,洗膜3次,化学发光显影。Image J软件分析电泳条带灰度值,以β-actin作为内参,得出蛋白相对表达水平。
1.2.5. 酶联免疫吸附试验(ELISA)
小鼠麻醉后心脏取血,离心机3000 r/min离心10 min,获取上清液即为小鼠血清。稀释小鼠血清在Lcn2的ELISA试剂盒浓度范围内。将Lcn2的ELISA试剂盒从4℃冰箱取出,平衡至室温。按说明书操作。酶标仪检测A值算出相应血清的Lcn2浓度。
1.2.6. RNA测序
1.2.7. 染色质免疫沉淀(ChIP)测序及数据分析
将C3H10T1/2 MSC细胞以前述成骨诱导液诱导3 d(OB 3 d)或不作处理(control),参照Cell Signaling Technology(CST)试剂盒裂解细胞,收集细胞核提取染色质,以H3K27AC和H3K9Me3抗体进行免疫沉淀。纯化的DNA委托诺禾致源公司进行建库和双末端测序。简要步骤:首先利用Bowtie2将所有reads匹配到小鼠基因组(mm10),而后以MACS2.0检测peak并以Diffbind比较差异。以Deeptools将bam文件转换成bw格式,而后以IGV进行可视化展示。超级增强子通过ROSE [14]进行定义和比较。
1.2.8. 统计学分析
实验数据采用Graphpad prism7统计软件进行统计学分析。结果以均数±标准差表示,组间比较采用两独立样本t检验。当P < 0.05时认为差异有统计学意义。
2. 结果
2.1. 老年骨质疏松小鼠的松质骨和血清中Lcn2的蛋白表达和分泌显著升高
老年性骨质疏松与氧化应激密切相关,本研究筛选了在16月龄雄鼠股骨远端中上调的氧化应激相关蛋白(图 1A)。iTRAQ-MS/MS结果显示,16月龄的老年雄鼠的松质骨中Lcn2蛋白表达相对于3月龄雄鼠明显上调(P < 0.01,图 1B)。与此对应,ELISA结果显示16月龄老年雄鼠血清中Lcn2含量比3月龄对照(control)雄鼠明显升高(P < 0.01,图 1C)。
图 1.
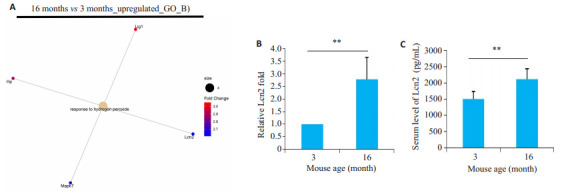
老年鼠股骨远端松质骨中Lcn2蛋白表达增强致血清中分泌增多
Increased expression of lipocalin 2 (Lcn2) in the distal femoral cancellous bone of aged mice causes an increased serum level of Lcn2. A: Up-regulated proteins in 16-month-old male mice analyzed with GO_BP functional annotation with Clusterprofiler, which identified 4 oxidative stress-related proteins, including Lcn2. B: Specific fold upregulation of Lcn2. C: Serum level of Lcn2 in aged mice detected by ELISA(Mean±SD). **P < 0.01.
2.2. Lcn2剂量依赖地抑制C3H/10T1/2的成骨分化
与未加Lcn2重组蛋白的对照组相比,ALP染色结果和定量结果显示加入50 ng/mL的Lcn2 RP未见明显差异,加入100、200、500 ng/mL浓度Lcn2 RP后ALP表达减弱且有统计学差异(P < 0.05,图 2)。
图 2.
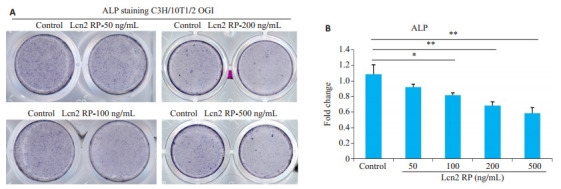
Lcn2 RP对C3H/10T1/2细胞系成骨分化7d后ALP染色和定量结果
ALP staining of C3H/10T1/2 cells treated with recombinant lipocalin 2 protein (Lcn2 RP) at 7 days of osteogenic induction and quantitative analysis of the results (Mean±SD). *P < 0.05, **P < 0.01.
2.3. Lcn2剂量依赖地抑制早期和晚期关键成骨分化基因的表达
与ALP染色结果一致,Westem blot定量结果显示成骨分化早期转录因子osterix(OSX)和成骨分化晚期标志骨钙素(OCN)在100、200、500ng/mL浓度的Lcn2 RP组中的表达减低,呈剂量依赖性且具有统计学差异(P < 0.05,图 3)。
图 3.
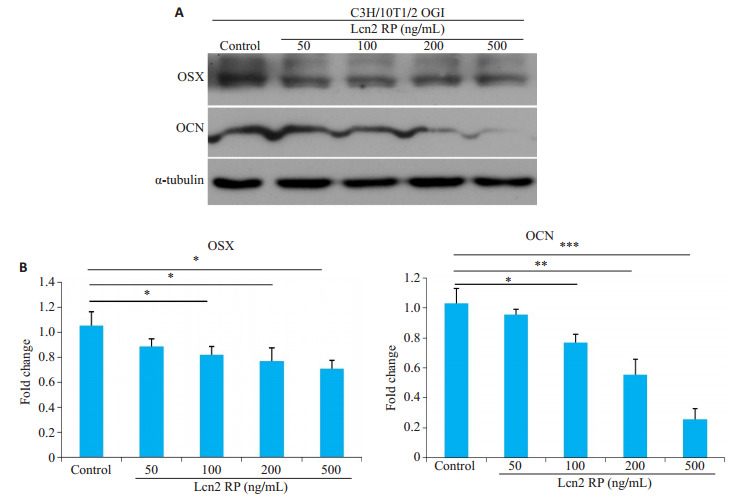
Lcn2 RP对C3H/10T1/2细胞系成骨分化7d后OSX和OCN蛋白表达的影响
Effect of Lcn2 RP treatment on protein expressions of OSX and OCN in C3H/10T1/2 cells induced for osteogenesis for 7 days. A: Western blots of OSX and OCN proteins. B: Quantitative results of the results (Mean±SD). *P < 0.05, **P < 0.01, ***P < 0.001.
2.4. MSC成骨分化中Lcn2的编码基因出现超级增强子,mRNA表达随之上调
在诱导成骨分化3 d(OB)后,Lcn2基因全域结合的H3K27AC信号明显增强,而H3K9Me3信号则维持极低水平(图 4A),提示Lcn2全域处于转录激活状态。ROSE软件(利用H3K27AC信号计算)显示成骨诱导后Lcn2基因区域出现超级增强子(图 4A上图,底部)。RNA-seq结果证实Lcn2在C3H10T1/2成骨诱导后上调的倍数在所有基因中位列第4(图 4B、C)。与此一致,图 1B中C3H10T1/2成骨诱导后上调倍数最高的Zbtb16基因区域也在成骨诱导后出现超级增强子(图 4A下图,底部)。结果数据描述Lcn2的mRNA水平在成骨诱导后急剧升高(P < 0.001,图 4D)。
图 4.
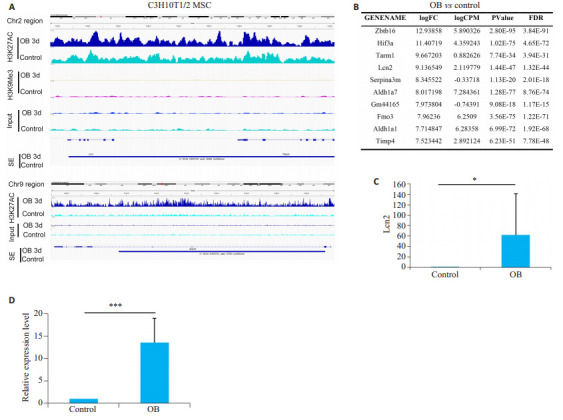
成骨分化初期Lcn2基因全域出现超级增强子并促进其mRNA表达
Detection of super- enhancers in whole lipocalin 2 (Lcn2) gene domain in the early stage of osteogenic differentiation. A: Signals of H3K27AC, H3K9Me3 and Input of the Lcn2 locus and the signals of H3K27AC and Input of the Zbtb16 locus displayed by IGV software. B: RNA-sequencing results of the top 10 up-regulated genes in C3H10T1/2 cells after 3 days of osteogenic induction (OB). C: Relative fold upregulation of Lcn2 (ordinate: RPKM). D: Real- time quantitative PCR showing relative expression of Lcn2 in C3H10T1/2 cells after 3 days of osteogenic induction. Data are presented as Mean±SD. *P < 0.05; ***P < 0.001.
3. 讨论
骨质疏松症(OP)属于代谢性骨病,其特征为骨量的丢失,成骨细胞减弱或破骨细胞增多引起的失衡使得骨脆性增加进而容易发生骨折[15]。SOP老年性骨质疏松症是由衰老、氧化应激等原因导致成骨细胞介导的骨形成(骨合成代谢)严重减少,继发骨合成代谢(骨形成)/ 分解代谢(骨吸收)失衡,导致骨丢失及骨组织退行性变的代谢性疾病[16]。间充质干细胞(MSCs)具有多种分化潜能,可分化为成骨细胞、脂肪细胞或软骨细胞,在维持正常骨稳定性方面发挥重要作用[16]。
随着年龄的增长,骨形成减少是由于MSCs分化为成骨细胞谱系受损,从而导致骨髓脂肪生成增加[17]。MSCs的减少和分化改变是老年骨质疏松症的主要原因之一[18]。老年性骨质疏松主要与骨形成减少有关,骨基质和矿物质成分的变化也可能导致骨脆性增加[19]。老年C57BL/6J雄鼠的股骨远端/胫骨近端是分析老年性骨质疏松的理想模型[17]。我们分析了16月龄C57BL/6J雄鼠相对于3月龄雄鼠股骨远端总蛋白表达谱的差异[16]。
MSCs向成骨细胞的命运决定和分化过程中,osterix(OSX)是关键转录因子[20]。未成熟的成骨细胞分化成成熟的成骨细胞,表达碱性磷酸酶(ALP)以使细胞外基质(ECM)成熟。ECM成熟后,基质矿化通过各种成骨细胞标志物,如骨钙素OCN的表达以高度有序的过程发生。OSX可诱导ALP和OCN的表达[21]。衰老细胞稳定停滞,产生复杂的分泌物如:促炎细胞因子、趋化因子和细胞外基质蛋白(SASP)[22],并经历包括转录、表观遗传、形态学和代谢改变在内的特征性变化,衰老细胞主要通过SASP产生有害影响[23]。
分泌蛋白Lcn2在老年小鼠中股骨远端松质骨中表达进一步增多,且在血清中分泌增强。由于老年小鼠的BMSC成骨分化相对于年轻小鼠显著减弱,老年小鼠中表达增强的Lcn2可能反而抑制BMSC的成骨细胞分化。C3H/10T1/2细胞系属于一种可靠的MSCs细胞模型[24]。本研究进一步使用不同浓度梯度的Lcn2 RP处理间充质干细胞系C3H/10T1/2,证实了Lcn2导致其成骨分化减弱(体现在ALP活性减低及成骨分化关键转录因子OSX和OCN蛋白的表达减低)。
与本研究结果相符,Lcn2水平升高与非脊柱骨折住院治疗密切相关,特别是髋部、上肢以及肋骨和胸骨骨折[25]。绝经后骨质疏松女性血清Lcn2明显高于对照组且有统计学差异,表明在绝经后骨质疏松患者中Lcn2升高[26]。血清中Lcn2的mRNA在骨质疏松人群中表达升高[27]。Lcn2与衰老障碍有关。例如,它在大脑中的过度表达与高胰岛素抵抗增加有关,从而导致肥胖[28]。Lcn2也被认为是多发性硬化症的标志物[29],并被描述为与氧化应激、炎症和神经元脱髓鞘有关,进而导致认知障碍[30]。RNA-seq监测小鼠9个月、15个月和24个月时四种组织(包括大脑、血液、皮肤和肝脏),在衰老过程中Lcn2随着年龄的增长而表达增加[31]。分析老年小鼠血清Lcn2蛋白升高原因,可能是由于衰老组织中Lcn2表达增强所致分泌增多。
为进一步阐明Lcn2抑制成骨分化的可能作用机制,我们利用ChIP- seq分析了诱导成骨分化前后C3H10T1/2间充质干细胞Lcn2基因座位的修饰组蛋白结合情况,以期明确:成骨分化过程中,Lcn2基因区域的组蛋白修饰在表观遗传学层面对其表达的调控。既往研究显示,H3K27AC富集于转录活化的启动子和增强子区,而H3K9Me3则富集于转录抑制的基因区域。然而,Lcn2对于MSC的成骨分化过程却是必须的,体现在如下几个方面:MSC成骨分化的过程中,转录活化标志-组蛋白H3K27AC在Lcn2基因启动子区和基因体区的结合明显增强,超级增强子(根据H3K27AC信号以ROSE软件计算)覆盖整个Lcn2基因座位并直接导致其表达水平急剧上升,提示Lcn2是间充质干细胞正常成骨分化所必须的。相反,转录抑制标志-组蛋白H3K9me3在这些区域的结合则持续处于较低水平。这些组蛋白修饰导致Lcn2的mRNA表达水平急剧升高。
Lcn2这种在发育阶段促进成骨分化,而在老年时分泌增多抑制成骨分化的现象提示Lcn2可能具有反向多效性[32],即在发育时与成骨分化密切关联,但在衰老时过度表达和分泌以自限性抑制MSC的成骨分化。
综上所述,在成骨分化的早期,Lcn2基因的启动子区和基因体形成超级增强子促进Lcn2表达;而在老年小鼠中Lcn2表达进一步增强并反过来抑制成骨细胞分化,提示Lcn2在骨发育和骨衰老中的作用具有反向多效性。本研究为靶向Lcn2治疗老年骨质疏松提供了理论基础,但还需进一步明确血清升高的Lcn2和老年小鼠骨形成减弱之间的因果关系和具体作用机制。
Biography
陈梓锋,副主任医师,E-mail: chenzifeng@pyhospital.com.cn
Funding Statement
广东省自然科学基金(2020A1515011035);番禺区科技计划项目(2018-Z04-67)
Contributor Information
陈 梓锋 (Zifeng CHEN), Email: chenzifeng@pyhospital.com.cn.
王 婷 (Ting WANG), Email: wangting1101smu@163.com.
References
- 1.An J, Yang H, Zhang Q, et al. Natural products for treatment of osteoporosis: the effects and mechanisms on promoting osteoblastmediated bone formation. Life Sci. 2016;147:46–58. doi: 10.1016/j.lfs.2016.01.024. [DOI] [PubMed] [Google Scholar]
- 2.PD Amelio, C Tamone, F Sassi, et al. Teriparatide increases the maturation of circulating osteoblast precursors. Osteoporos Int. 2012;23(4):1245–53. doi: 10.1007/s00198-011-1666-2. [DOI] [PubMed] [Google Scholar]
- 3.McClung MR. Using osteoporosis therapies in combination. Curr Osteoporos Rep. 2017;15(4):343–52. doi: 10.1007/s11914-017-0376-x. [DOI] [PubMed] [Google Scholar]
- 4.Atsuchi W, Shigeki Y, Mikio N, et al. Osteosarcoma in SpragueDawley mice after long-term treatment with teriparatide (human parathyroid hormone (1-34)) J Toxicol Sci. 2012;37(3):617–29. doi: 10.2131/jts.37.617. [DOI] [PubMed] [Google Scholar]
- 5.Whyte W, Orlando D, Hnisz D, et al. Master transcription factors and mediator establish super-enhancers at key cell identity genes. Cell. 2013;153(2):307–19. doi: 10.1016/j.cell.2013.03.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Miyamoto T, Kashima H, Yamada Y, et al. Lipocalin 2 enhances migration and resistance against cisplatin in endometrial carcinoma cells. PLoS One. 2016;11(5):e0155220. doi: 10.1371/journal.pone.0155220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Mosialou I, Shikhel S, Liu JM, et al. MC4R-dependent suppression of appetite by bone-derived lipocalin 2. Nature. 2017;543(7645):385–90. doi: 10.1038/nature21697. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Schmidt-Ott KM, Mori K, Li JY, et al. Dual action of neutrophil gelatinase-associated lipocalin. J Am Soc Nephrol. 2007;18(2):407–13. doi: 10.1681/ASN.2006080882. [DOI] [PubMed] [Google Scholar]
- 9.Li DH, Sun WY, Fu BW, et al. Lipocalin-2-The myth of its expression and function. Basic Clin PharmacolToxicol. 2020;127(2):142–51. doi: 10.1111/bcpt.13332. [DOI] [PubMed] [Google Scholar]
- 10.Costa D, Lazzarini E, Canciani B, et al. Altered bone development and turnover in transgenic mice over-expressing lipocalin-2 in bone. J Cell Physiol. 2013;228(11):2210–21. doi: 10.1002/jcp.24391. [DOI] [PubMed] [Google Scholar]
- 11.Capulli M, Rufo A, Teti A, et al. Global transcriptome analysis in mouse calvarial osteoblasts highlights sets of genes regulated by modeled microgravity and identifies a "mechanoresponsive osteoblast gene signature". J Cell Biochem. 2009;107(2):240–52. doi: 10.1002/jcb.22120. [DOI] [PubMed] [Google Scholar]
- 12.Rucci N, Capulli M, Piperni SG, et al. Lipocalin 2: a new mechanoresponding gene regulating bone homeostasis. J Bone Miner Res. 2015;30(2):357–68. doi: 10.1002/jbmr.2341. [DOI] [PubMed] [Google Scholar]
- 13.Gong Y, Li Z, Zou S, et al. Vangl2 limits chaperone-mediated autophagy to balance osteogenic differentiation in mesenchymal stem cells. Dev Cell. 2021;56(14):2103–20.e9. doi: 10.1016/j.devcel.2021.06.011. [DOI] [PubMed] [Google Scholar]
- 14.Whyte W, Orlando D, Hnisz D, et al. Master transcription factors and mediator establish super-enhancers at key cell identity genes. Cell. 2013;153(2):307–19. doi: 10.1016/j.cell.2013.03.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Yang TL, Shen H, Liu A, et al. A road map for understanding molecular and genetic determinants of osteoporosis. Nat Rev Endocrinol. 2020;16(2):91–103. doi: 10.1038/s41574-019-0282-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Qadir A, Liang S, Wu Z, et al. Senile osteoporosis: the involvement of differentiation and senescence of bone marrow stromal cells. Int J Mol Sci. 2020;21(1):E349. doi: 10.3390/ijms21010349. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chen Q, Shou P, Zheng C, et al. Fate decision of mesenchymal stem cells: adipocytes or osteoblasts? Cell Death Differ. 2016;23(7):1128–39. doi: 10.1038/cdd.2015.168. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Devlin MJ, Rosen CJ. The bone-fat interface: basic and clinical implications of marrow adiposity. Lancet Diabetes Endocrinol. 2015;3(2):141–7. doi: 10.1016/S2213-8587(14)70007-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Compston JE, McClung MR, Leslie WD. Osteoporosis. Lancet. 2019;393(10169):364–76. doi: 10.1016/S0140-6736(18)32112-3. [DOI] [PubMed] [Google Scholar]
- 20.Chan WCW, Tan Z, To MKT, et al. Regulation and role of transcription factors in osteogenesis. Int J Mol Sci. 2021;22(11):5445. doi: 10.3390/ijms22115445. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Amarasekara DS, Yun H, Kim S, et al. Regulation of osteoclast differentiation by cytokine networks. Immune Netw. 2018;18(1):e8. doi: 10.4110/in.2018.18.e8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Farr Joshua N, Fraser Daniel G, Wang HT, et al. Identification of senescent cells in the bone microenvironment. J Bone Miner Res Off JAm Soc Bone Miner Res. 2016;31(11):1920–9. doi: 10.1002/jbmr.2892. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Birch J, Gil J. Senescence and the SASP: many therapeutic avenues. Genes Dev. 2020;34(23-24):1565–76. doi: 10.1101/gad.343129.120. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Tang QQ, Otto TC, Lane MD. Commitment of C3H10T1/2 pluripotent stem cells to the adipocyte lineage. Proc Natl Acad Sci USA. 2004;101(26):9607–11. doi: 10.1073/pnas.0403100101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Lim WH, Wong G, Lim EM, et al. Circulating lipocalin 2 levels predict fracture-related hospitalizations in elderly women: a prospective cohort study. J Bone Miner Res. 2015;30(11):2078–85. doi: 10.1002/jbmr.2546. [DOI] [PubMed] [Google Scholar]
- 26.罗 世全. 外周血Lcn2、25-(OH)2D3的表达与绝经后骨质疏松症患者骨密度的关系. 西藏医药. 2021;42(06):70–2. [Google Scholar]
- 27.谢 远龙, 孙 文超, 谢 江涛. 人脂质运载蛋白2基因调控骨髓间充质干细胞成骨分化和骨质疏松小鼠骨强度. 中华实验外科杂志. 2018;35(5):4. [Google Scholar]
- 28.Ferreira AC, Dá Mesquita S, Sousa JC, et al. From the periphery to the brain: Lipocalin-2, a friend or foe? Prog Neurobiol. 2015;131:120–36. doi: 10.1016/j.pneurobio.2015.06.005. [DOI] [PubMed] [Google Scholar]
- 29.Al Nimer F, Elliott C, Bergman J, et al. Lipocalin-2 is increased in progressive multiple sclerosis and inhibits remyelination. Neurol Neuroimmunol Neuroinflamm. 2016;3(1):e191. doi: 10.1212/NXI.0000000000000191. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Suk K. Lipocalin-2 as a therapeutic target for brain injury: an astrocentric perspective. Prog Neurobiol. 2016;144:158–72. doi: 10.1016/j.pneurobio.2016.08.001. [DOI] [PubMed] [Google Scholar]
- 31.Srivastava A, Barth E, Ermolaeva MA, et al. Tissue-specific gene expression changes are associated with aging in mice. Genomics Proteomics Bioinformatics. 2020;18(4):430–42. doi: 10.1016/j.gpb.2020.12.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Schmeisser K, Parker JA. Pleiotropic effects of mTOR and autophagy during development and aging. Front Cell Dev Biol. 2019;7:192. doi: 10.3389/fcell.2019.00192. [DOI] [PMC free article] [PubMed] [Google Scholar]


