Abstract
目的
探讨8周的双氢杨梅素(DHM)对1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)/丙磺舒(probenecid)(MPTP/p)诱导慢性帕金森病(PD)小鼠运动功能障碍的影响及其分子机制。
方法
C57BL/6小鼠腹腔注射MPTP/p构建PD模型,将60只健康雄性小鼠随机分为4组(n=15):对照组(Control)、模型组(PD)、DHM干预组(PD+DHM)、阳性对照NEC-1抑制剂组(PD+NEC-1)。除对照组外,其余小鼠(n=45)腹腔注射MPTP(25 mg·kg-1·d-1)联合Probenecid(250 mg·kg-1·d-1),每周2次,干预5周构建慢性PD模型。造模结束后,DHM干预组进行8周DHM灌胃处理(100 mg·kg-1·d-1,5 d/周),阳性对照组进行5周NEC-1腹腔注射(6.25 mg·kg-1·d-1,2 d/周)。随机选取小鼠进行运动协调性测试(n=10);免疫荧光染色观察黑质内TH、GFAP、Iba-1的表达(n=3);ELISA检测小鼠血清中IL-1β;试剂盒测定纹状体内LDH酶活性;RT-PCR测定TNF-α及IL-6的mRNA水平;Western blot检测小鼠纹状体中TH和病理蛋白α-syn、神经炎症、细胞焦亡、坏死性凋亡及自噬相关蛋白的表达。1-甲基-4-苯基吡啶离子(MPP+)激活Bv-2小胶质细胞,采用不同浓度的DHM(3.12、6.25、12.5 μg/mL)及自噬抑制剂3-MA进行干预;Western blot检测干预后Bv-2细胞自噬及NLRP3炎症小体相关蛋白的表达水平;PI染色检测细胞的死亡情况。
结果
与对照组相比,PD组小鼠存在运动功能障碍,且TH的阳性细胞数及蛋白水平显著下降(P < 0.001),而DHM干预显著改善了小鼠的运动协调能力,增加TH(P=0.0023),降低α-syn的表达(P < 0.001)。8周的DHM干预降低了PD小鼠纹状体中胶质细胞异常活化,下调GFAP(P=0.045)和Iba-1(P < 0.001)的表达;降低TNF-α(P=0.0015)、IL-6(P < 0.001)的mRNA和蛋白水平,上调IL-4(P < 0.001),减轻神经炎症反应;DHM通过下调Caspase1的活性、NLRP3炎症小体、GSDMD-N、IL-1β、IL-18的表达水平(P < 0.001)抑制细胞焦亡;降低LDH、p-RIPK1、RIPK1、p-RIPK3、RIPK3、MLKL的水平(P < 0.001),上调Caspase8(P=0.8944),改善坏死性凋亡;上调Beclin1和ULK1(P < 0.001),下调p62和LC3 Ⅰ(P < 0.001),激活自噬。体外实验结果表明,不同浓度的DHM干预(3.25、6.5、12.5 μg/mL)均可通过改善MPP+诱导的Bv-2细胞自噬受损,抑制NLRP3炎症小体的激活减轻炎症,而抑制自噬钝化了DHM的抗炎功效。
结论
DHM能改善慢性MPTP/p诱导PD小鼠的运动协调能力障碍,其机制可能是通过激活自噬抑制神经胶质细胞活化引起的神经炎症反应、细胞焦亡以及坏死性凋亡。
Keywords: 双氢杨梅素, MPTP, 丙磺舒, 细胞焦亡, 坏死性凋亡, 自噬, 神经炎症
Abstract
Objective
To investigate the effect of 8-week dihydromyricetin (DHM) treatment on motor ability of mice with MPTP/probenecid-induced Parkinson's disease (PD) and explore the molecular mechanism.
Methods
Sixty C57BL/6 mice were randomized into the control group, PD model group, PD+DHM group and PD+NEC-1 group (n=15). In the latter 3 groups, the mice were treated with 25 mg·kg-1·d-1 MPTP and 250 mg·kg-1·d-1 probenecid twice a week for 5 weeks to establish PD models; DHM (100 mg·kg-1·d-1) was administered 5 times a week via gavage for 8 weeks and NEC-1 (6.25 mg·kg-1·d-1, twice a week) via intraperitoneal injection for 5 weeks. The changes in motor function of the mice were assessed, and the expressions of TH, GFAP and Iba-1 in the substantia nigra were detected with immunofluorescence assay; serum levels of IL-1β and LDH were detected using ELISA. The mRNA expressions of TNF-α and IL-6 were determined with RT-PCR, and the expressions of TH and proteins associated with pyroptosis, neuroinflammation, necroptosis and autophagy in the striatum were detected using Western blotting. MPP +-activated Bv-2 cells were treated with different concentrations of DHM or 3-MA, and the expressions of proteins associated with autophagy and NLRP3 were detected using Western blotting; PI staining was used to detect cell necroptosis.
Results
The PD mouse models showed significantly reduced TH-positive cells and TH protein expression (P < 0.001). DHM obviously ameliorated motor deficits and TH loss in PD mice, increased TH expression (P=0.0023), decreased α-syn levels (P < 0.001), lowered the protein expressions of GFAP (P=0.045) and Iba-1 (P < 0.001) and the mRNA and protein levels of TNF-α (P=0.0015) and IL-6 (P < 0.001), and increased IL-4 level (P < 0.001). The 8-week DHM treatment significantly suppressed pyroptosis and necroptosis and activated autophagy in the striatum of the PD mice. In MPP +-induced Bv-2 cells, DHM treatment effectively reversed autophagy impairment and inhibited NLRP3 and TNF-α, IL-6 and IL-1β release, and the anti--inflammatory effects of DHM was obviously blunted by 3-MA.
Conclusion
DHM can improve motor function of PD mice probably by activating autophagy to inhibit pyroptosis and necroptosis and reduce neuroinflammation.
Keywords: dihydromyricetin, MPTP, probenecid, pyroptosis, necroptosis, autophagy, neuroinflammation
帕金森病(PD)是一种锥体外系功能障碍的中枢神经退行性疾病,常见于中老年人群,70~79岁最易发病,85岁以上老年人患病率高达3%~5%[1]。PD的病理改变主要是患者脑内多巴胺(DA)神经元呈慢性进行性丧失,造成大脑黑质-纹状体投射系统中DA和乙酰胆碱浓度失衡,最终引起相应的运动功能障碍[2]。最新研究表明,坏死性凋亡是一种由炎症性胱天蛋白酶Caspase诱导的坏死性和炎症性的细胞促炎程序性死亡方式,它与神经胶质细胞激活引起的神经炎症密切相关[3]。自噬通过自噬小体对胞内物质的降解,在维持细胞内稳态方面作用重大。已有研究表明,自噬缺陷或不足会诱发神经细胞功能障碍,进而引发AD、PD等神经退行性疾病[4]。双氢杨梅素(DHM)是一种从葡萄属植物中提取的多酚羟基双氢黄酮醇类化合物,其抗炎、抗氧化、神经保护等作用对神经退行性疾病疗效显著[5]。已有研究表明,DHM可改善高脂联合STZ诱导二型糖尿病大鼠的PD样病理改变,减少病理蛋白α-syn的聚集[6]。体外研究也表明,DHM可有效减少PD细胞模型中α-syn的异常集聚,抑制炎症,改善PD病理进程[5]。此外,DHM还具有拮抗高糖诱导的PC12细胞发生细胞凋亡[7]、抑制肝损伤细胞模型细胞焦亡的作用[8]。虽然研究证明了DHM具备抑炎、抗凋亡等功效,但在1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)/丙磺舒(probenecid)(MPTP/p)诱导的慢性PD小鼠模型中,DHM是否是通过激活细胞自噬进而抑制细胞焦亡和坏死性凋亡未见研究报道。因此,本文通过建立慢性MPTP/p诱导PD小鼠模型,旨在观察8周DHM干预对PD小鼠运动协调功能障碍的影响及其分子机制,以期为DHM新药的开发以及PD未来的治疗方向提供相应的理论依据。
1. 材料和方法
1.1. 实验动物
SPF级8周龄健康雄性C57BL/6小鼠60只(动物质量合格编号:NO.42010200005621),购于三峡大学[生产许可证号:SCXK(鄂)2017-0012]。按照最佳饲养空间(每笼2~4只)将小鼠随机分笼,采用国家标准啮齿类动物SPF级饲料及垫料,饲养温度23~25 ℃,湿度55% ~ 63%,12 h光照/12 h黑暗,定期更换垫料,保证所有小鼠可自由饮食。本动物实验按照1995年神经科学学会批准的动物使用政策和人类神经科学研究进行,由武汉体育学院动物管理伦理委员会监督(实验动物伦理审批号:S0087-20210628-01)。
1.2. 动物分组及处理
1周适应性喂养后随机分为4组(n=15):对照组(Control)、模型组(PD)、DHM干预组(PD+DHM)、NEC-1抑制剂组(PD+NEC-1)。PD模型的制备:PD组、PD+DHM组、PD+NEC-1组小鼠腹腔注射MPTP(25 mg·kg-1·d-1)联合丙磺舒(250 mg·kg-1·d-1),两种药物间隔1 h,2次/周,共5周。密切观察小鼠在造模期间的精神状态及行为学改变,并采取相应的保暖措施。此外,PD+NEC-1组小鼠进行腹腔注射NEC-1抑制剂,给药量为6.25 mg·kg-1·d-1,2 d/周,共5周。造模成功后,PD+DHM组小鼠进行8周DHM灌胃处理,给药量为100 mg·kg-1·d-1,5d/周,共8周。
1.3. 细胞实验
小鼠小胶质细胞Bv-2细胞株来自于广西医科大学,用含10%FBS的DMEM进行恒温培养,至细胞生长对数期后开始实验。采用MPP+激活Bv-2小胶质细胞造模。实验分组:对照组(Control)、单纯DHM干预组(Control+6.25 μg/mL)、模型组(MPP+)、不同浓度DHM干预组(3.25、6.5、12.5 μg/mL)、3-MA抑制剂组(3-MA)。先将MPP+或3-MA自噬抑制剂溶解在DMEM中配制成储存液,使用时用培养液稀释至相应浓度。造模干预:500 μmol/L的MPP+刺激Bv-2细胞24 h;DHM低/中/高浓度干预:MPP+刺激后,不同浓度的DHM分别处理22 h;3-MA自噬抑制剂干预:10 mmol/L的3-MA处理细胞24 h。Western blot检测干预后Bv-2细胞相关蛋白的表达;PI染色试剂盒检测细胞凋亡。
1.4. 主要试剂及仪器
主要试剂及仪器如:MPTP、MPP+(Sigma);丙磺舒、NEC-1、3-MA(MCE);DHM(ALB);LDH试剂盒(南京建成);组织固定液(武汉赛维尔生物);ECL化学发光超敏显色试剂(中国赛默飞);IL-1β试剂盒(依科赛);胎牛血清、DMEM培养基(GIBCO);胰蛋白酶、青链霉素和PBS(塞维尔);RIPA蛋白裂解液、BCA蛋白定量试剂盒、PI坏死染色试剂盒(碧云天);Rotor-Rod转棒仪(北京尤比爱生物);样品处理系统(上海净信科技);小型冷冻高速离心机(Eppendorf);超声细胞粉碎仪(宁波新芝生物);超敏荧光及化学发光仪(上海勤翔);酶标仪(上海Thermo);电泳仪(北京六一仪器厂);转膜仪(海天能科技)。
1.5. 实验方法
1.5.1. Rota-Rod Test转棒试验
采用转棒仪进行运动协调能力的检测,实验方案包括3 d训练(3~25 r/min,5 min)和1 d测试(5~35 r/min,5 min),运动方案参考文献并做适当改动。实验开始前,先让小鼠在转棒仪上适应60 s。启动后,电脑开始自动记录小鼠的运动时间,当小鼠跌落,红外线感应后转棒仪停止转动,此转动时长为该小鼠的转棒潜伏期Time on rotarod(s),5次/d,每次间隔30 min,取平均值。每组小鼠训练结束后均对转棒仪进行酒精擦拭,去除小鼠气味,避免对运动表现产生干扰。
1.5.2. 蛋白免疫印迹分析(Western blotting)
干预后将小鼠脱颈、剪头、取脑,取出两侧纹状体组织置于抗凝EP管中,置-80 ℃冰箱待测;称取适量纹状体组织匀浆后,制作胶板进行SDS-PAGE电泳,先以45 V恒压电泳30 min,后调至85 V恒压。以330 mA恒定电流转PVDF膜75 min;脱脂奶粉中常温封闭70 min;洗膜(6 min×4次),4 ℃孵育一抗10 h,洗膜,常温孵育二抗90 min,洗膜。使用ECL化学发光试剂将目的条带置于超敏荧光及化学发光仪中曝光,后续进行蛋白统计分析。检测指标:TH(ab75875);Iba-1(ab178846);GFAP (#D1F4Q);NLRP3(GB11300);Cleaved-Caspase1 (AF4005);Caspase1(5418/Asp2);Caspase8(GB11594);TNF-α(A0277);IL-1β(26048-1);IL-18(ES10872);IL-6 (GB11117);IL-4(ER1706-55);p-RIPK1(AP1230);RIPK1(17519-1-AP);p-RIPK3(AP1260);RIPK3 (A5431);p62(GB11690);MLKL(AP1260);ULK1 (GB11580);Beclin1(66665-1);LC3 Ⅰ (#12741);GSDMD-N(HA721144);GAPDH(Proteintech);二抗鼠/兔(塞维尔)。
1.5.3. 免疫荧光染色
每组随机选取3只小鼠取其全脑,用一次性针头在其表面扎孔后放入灌有通用型组织固定液的离心管中,静置贮存4 ℃冰箱待用。对黑质组织进行TH、GFAP、Iba-1免疫荧光染色,主要操作步骤:将切片脱水分别放入二甲苯Ⅰ和Ⅱ溶液中各15 min,再分别放入无水乙醇Ⅰ和Ⅱ溶液中5 min,最后再经由85% 和75%的酒精脱水5 min,用蒸馏水洗。把切片放在pH=8.0的EDTA抗原修复缓冲液,先用中火烧8 min到沸腾,熄火停止8 min,再改成中低火烧7 min;自然冷却降温,放入pH=7.4的PBS中,洗涤4 min,共3次;甩出PBS滴入BSA,封闭30 min。把封闭液洗掉后加一抗,4 ℃冰箱过夜;PBS甩干加二抗,在温箱内避光保存45 min;PBS甩干圈内滴加DAPI染液,避光静置10 min;PBS洗后甩干加入自发荧光淬灭剂,5 min后用流动的水冲洗2倍的时间;甩干后把切片封片,镜检拍照。
1.5.4. 酶联免疫吸附试验(ELISA)
实验结束后,次日进行实验取材。眼球取血后将收集好血液常温静置2 h,分离出血清(4 ℃,1500 r/min,15 min),置-80 ℃冰箱待用;体外定量检测小鼠血清中IL-1β的浓度。主要步骤为:将标准品工作液和待检样品分别加入反应孔中,100 μL/孔;用封板膜封板,37 ℃保温箱里放60~120 min左右;撕掉封板膜,手动洗板;倒掉液体加入洗液,倒扣拍干,重复3~6遍;加同体积生物素化抗体;之后温育、洗涤,加同体积酶结合物工作液,再温育(避光静置30 min)、洗涤;加入同体积的TMB底物,37 ℃避光15~35 min;加入同体积的2 mol/L硫酸,当颜色变为黄色即可。打开酶标仪预热,测定吸光度A490 nm。
1.5.5. LDH酶活性测定
收集组织,使用乳酸脱氢酶(LDH)检测试剂盒测定小鼠纹状体内LDH的酶活性。一切操作步骤均严格按照试剂盒说明书进行。
1.5.6. RT-PCR检测mRNA表达
在纹状体样本中加入Trizol,经氯仿、异丙醇体系提取组织总mRNA,经逆转录合成对应的cDNA,完成RT-PCR的检测。
1.6. 统计学分析
采用SPSS22.0进行数据处理,使用Image J、Graphpad Prism 8.0作图,结果均以均数±标准差来表示。单因素方差分析用于多组间比较。以P < 0.05为差异具有统计学意义。所有实验都独立重复3次。
2. 结果
2.1. DHM干预改善MPTP/p引起的小鼠运动协调障碍及神经毒性
行为学结果显示:与Control对照组相比,PD组小鼠转棒停留时间明显下降(P < 0.001)。而较PD组相比,DHM干预后明显延长小鼠在转棒上的停留时间(P= 0.0049,图 1B)。TH是大脑DA能神经元分泌的一种神经递质多巴胺的前体。实验通过Western blot检测纹状体内TH和α-syn的表达(图 1C),与Control相比,PD组TH蛋白水平显著下降(P < 0.001),α-syn的表达显著上升(P=0.0484)。而PD+DHM组TH的表达较PD组显著增加(P=0.0023),病理蛋白α-syn的水平显著下降(P < 0.001)。此外,免疫荧光检测小鼠黑质中TH阳性DA能神经元的数量的表达情况(图 1D):Control组小鼠黑质组织内TH阳性细胞多而稠密,TH红色荧光强度较为显著,分布也较为均匀。与对照组组小鼠相比,模型组小鼠黑质组织内TH阳性数量大量减少(P=0.001),红色荧光强度明显较弱(P < 0.001)。而DHM干预后小鼠黑质中TH阳性细胞数显著增多(P=0.0085),TH荧光亮度也明显增强(P=0.0127)。
图 1.

DHM干预改善慢性MPTP/p引起的小鼠运动协调障碍及TH的降低
DHM ameliorates motor dysfunction and loss of TH in MPTP/p-induced PD mice. A: Flow chart of interventions in the experimental. B: Time on rotarod. C: Expression of TH and α-syn in the striatum of the mice (with GAPDH as the loading control). D: Immunofluorescence staining of TH in the substantia nigra of the mice (Original magnification: ×100). Data are expressed as Mean±SD and analyzed using one-way ANOVA. #P < 0.05, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs PD.
2.2. DHM干预降低MPTP/p诱导的胶质细胞活化和神经炎症
采用Western blot和免疫荧光染色对黑质和纹状体进行检测。与对照组相比,PD组小鼠纹状体内GFAP(P < 0.001)和Iba-1(P=0.0148)的表达水平均明显增加,存在神经胶质细胞的过度激活。而DHM干预后小鼠纹状体中GFAP(P=0.045)及Iba-1(P < 0.001,图 2A)的蛋白水平显著下降。与Western blot结果相一致,免疫荧光染色结果表明(图 2B、C),在数量上,与Control组相比,MPTP/p处理后小鼠黑质中GFAP和Iba-1的阳性细胞数显著增加(P < 0.001),再次验证PD模型组小鼠存在小胶质细胞过度激活现象。且在细胞形态上,PD组小鼠黑质中GFAP神经元树突分叉增加,阳性荧光面积显著下降(P < 0.001)。Iba-1小胶质细胞的胞体变大,细胞核大而弥散,神经元的树突消失。而DHM干预后,小鼠GFAP和Iba-1的数量显著降低(P < 0.001),阳性荧光面积显著下降(P < 0.001),小胶质细胞的极化状态也得到了改善,GFAP神经元树突分叉减少,Iba-1胞体肿胀缩小,树突棘也增多。RT-PCR检测结果表明(图 2D),与对照组相比,PD组小鼠纹状体内神经促炎因子TNF-α、IL-6的mRNA水平均显著升高(P < 0.001),DHM干预后显著下降(P < 0.001)。此外,与Control组相比,TNF-α、IL-6的表达在PD组小鼠纹状体内也显著增加(P < 0.001),而抗炎因子IL-4的蛋白水平显著降低(P < 0.001)。DHM干预后TNF-α(P=0.0015)和IL-6(P < 0.001)的蛋白水平均显著降低,IL-4的水平显著增加(P < 0.001,图 2E)。
图 2.

DHM干预改善了MPTP/p诱导的胶质细胞活化和神经炎症
DHM treatment inhibits microglia activation and neuroinflammation in MPTP/p-induced PD mice. A: Expressions of GFAP and Iba-1 in the striatum of the mice. B, C: Immunofluorescence staining of GFAP and Iba-1 in the substantia nigra of the mice in each group (×400). The white box shows the enlarged local glial cells. D: The mRNA expression of TNF-α and IL-6 in the striatum of the mice. E: Expressions of TNF-α, IL-6 and IL-4 in the striatum of mice. Data are presented as Mean±SD and analyzed using one-wayANOVA. #P < 0.05, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs PD.
2.3. DHM抑制MPTP/p诱导的细胞焦亡
采用Western blot和RT-PCR技术对小鼠纹状体进行检测(图 3A、B),与对照组相比,PD组小鼠纹状体内焦亡相关蛋白NLRP3(P=0.0033)、Cleaved-Caspase1(P=0.0025)、IL-1β(P=0.0492)、IL-18(P < 0.001)的表达均显著增加,GSDMD-N也呈现增加的趋势但无统计学意义(P=0.0886)。而DHM干预后小鼠纹状体内上述指标的表达均显著下降(P < 0.001)。同时,ELISA结果显示(图 3C),PD组小鼠血清中IL-1β的表达较对照组相比异常升高(P < 0.001),而DHM干预后IL-1β的水平较PD组显著下降(P < 0.001)。
图 3.

DHM干预减轻了MPTP/p诱导的细胞焦亡
DHM ameliorates pyroptosis in PD mice. A, B: Expressions of NLRP3, cleaved caspase1/caspase1, GSDMD-N, IL-1β and IL-18 in the striatum of the mice. C: Expressions of IL-1β detected by ELISA. Data are presented as Mean±SD and analyzed using one-wayANOVA. #P < 0.05, ##P < 0.01, ###P < 0.001 vs Control; ***P < 0.001 vs PD.
2.4. DHM干预抑制MPTP/p诱导的坏死性凋亡
与对照组相比,模型组小鼠存在运动功能障碍(P < 0.001),PD+NEC-1处理可以显著提高模型鼠的运动能力(P=0.0086,图 4A)。检测小鼠纹状体中LDH的释放水平,相比Control组,模型组小鼠纹状体内LDH的水平明显上升(P < 0.001),DHM干预后显著下降(P < 0.001,图 4B)。此外,Western blot检测结果显示(图 4C、D),与Control对照组相比,PD小鼠纹状体内坏死性凋亡p-RIPK1和RIPK1的表达均显著增高(P < 0.001),p-RIPK3(P=0.994)、RIPK3(P=0.0743)和MLKL(P= 0.0773)蛋白表达也呈现增多的趋势但无统计学意义,Caspase8的表达显著下降(P < 0.001)。DHM干预后p-RIPK1、RIPK1、p-RIPK3、RIPK3、MLKL的水平明显降低(P < 0.001),Caspase8的表达呈现增高的趋势但无统计学意义(P=0.8944)。同时,细胞PI染色结果表明,与Con对照组相比,MPP+组坏死性凋亡PI细胞数(P < 0.001)和PI阳性荧光面积(P=0.0011)均显著增高。3种不同剂量的DHM干预可不同程度的降低上述2项指标,且6.5 μg/mL的效果最好(图 4E)。
图 4.

DHM干预降低了由MPTP/p诱导的坏死性凋亡
DHM treatment attenuates necroptosis in the striatum of PD mice. A: Time on rotarod. B: Expressions of LDH detected by ELISA. C, D: Expression of p-RIPK1, RIPK1, p-RIPK3, RIPK3, MLKL and Caspase8 in the striatum of the mice. E: Immunofluorescence staining of PI in Bv-2 cells (Scale bar: 20 μm). Data are presented as Mean±SD and analyzed using one-way ANOVA. ##P < 0.01, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs MPP+.
2.5. DHM可改善受损自噬抑制细胞焦亡和坏死
与对照组相比,PD组ULK1和Beclin1的表达水平明显下降(P < 0.001),而自噬降解蛋白p62和LC3 Ⅰ的表达水平较高(P < 0.001)。而与PD模型组相比,PD+ DHM组的ULK1和Beclin1的表达显著上升(P < 0.001,图 5A),p62和LC3Ⅰ的表达显著下降(P < 0.001)。此外,细胞实验结果表明(图 5B、C):与Con组相比,MPP+组自噬相关蛋白ULK1、Beclin1、LC3 Ⅱ/Ⅰ显著下降(P < 0.001),p62显著上升(P < 0.001);焦亡和坏死刺激蛋白NLRP3(P < 0.001)、IL-1β(P < 0.001)、TNF-α(P= 0.016)、IL-6(P < 0.001)的表达水平明显升高。而与MPP+模型组相比,不同浓度的DHM均可不同程度的提高自噬蛋白ULK1、Beclin1、LC3 Ⅱ/Ⅰ的表达(P < 0.05或P < 0.001),降低p62的表达(P < 0.001);同时NLRP3、IL-1β、TNF-α、IL-6的表达下降(P < 0.05,P < 0.01或P < 0.001),且综合比较,DHM剂量6.5 μg/mL的效果最好。此外,与DHM干预组相比,3-MA处理钝化了DHM对焦亡相关蛋白NLRP3(P=0.0652)、IL-1β(P < 0.001),以及坏死刺激蛋白TNF-α(P=0.0373)、IL-6(P=0.1070)的抑制效应。
图 5.
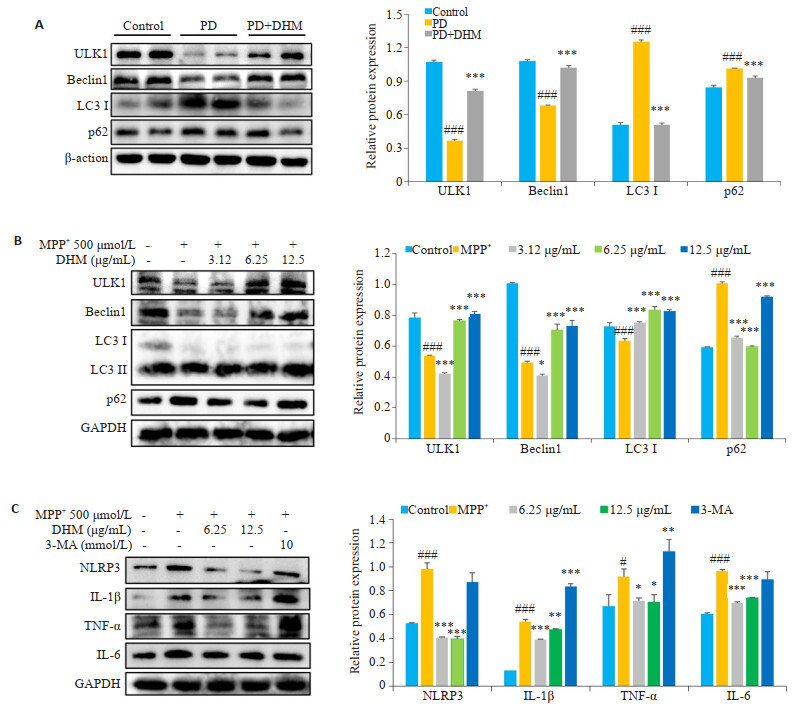
DHM可改善受损自噬抑制细胞焦亡和坏死
DHM alleviates pyroptosis and necroptosis by promoting autophagy. A: Expressions of ULK1, Beclin1, LC3Ⅰ and p62 in the striatum of the mice. B, C: Expressions of ULK1, Beclin1, LC3 Ⅱ/Ⅰ, p62, NLRP3, IL-1β, TNF-α and IL-6 in Bv-2 cells. Data are presented as Mean±SD and analyzed using one-way ANOVA. #P < 0.05, ###P < 0.001 vs Control; *P < 0.05, **P < 0.01, ***P < 0.001 vs PD/MPP+.
3. 讨论
α-syn是PD的主要病理特征,可通过诱发炎症反应致使DA能神经元损伤[9]。DA神经元可以分泌神经递质多巴胺,TH是多巴胺的合成限速酶。在PD早期就已出现黑质DA神经元丢失、纹状体α-syn的增多及TH的减少,而阻止或延缓DA神经元的丢失是有效治疗PD的一种方式。既往研究发现,在众多构建PD模型的化学药物中,MPTP/p的效果最佳[10]。在体内MPTP被分解成MPP+,被DA能神经元摄取后可通过抑制胞内线粒体呼吸链的形成及功能,产生氧化应激反应,使神经元损伤或死亡[11]。有研究表明急性MPTP处理(15 mg/kg,1次/2 h,4次/d)可损伤C57小鼠黑质-纹状体系统中的DA能神经元,出现运动功能障碍的同时TH蛋白水平也显著下降[12]。MPTP亚急性处理(25 mg·kg-1·d-1,5 d)同样可诱导C57小鼠出现运动障碍,降低纹状体TH的表达[13]。由于慢性MPTP干预构建PD模型所产生的症状与PD患者的临床病理表现更为接近,因此在本实验中,我们主要通过采用每周2次,为期5周的慢性干预方式构建PD小鼠模型。运动行为学结果表明,PD小鼠较Control组存在明显的运动功能障碍,黑质和纹状体组织内α-syn表达增加的同时伴随TH降低,表明PD小鼠模型存在DA能神经元受损,慢性造模成功。
天然产物对PD、AD等脑神经退行性疾病具有有效的神经保护作用[14]。我们团队的前期研究发现,在D-半乳糖诱导的大鼠脑衰老模型中,DHM可通过抑制miR-34a上调SIRT1和下调mTOR信号通路激活自噬,且与DHM高剂量组(200 mg/kg)相比,低剂量组(100 mg/kg)表现出较强的抗衰老作用[15]。此外,在D-半乳糖诱导的大鼠骨骼肌萎缩模型中,同样是100 mg/kg的DHM给药量可显著降低细胞凋亡并促进骨骼肌受损自噬的激活,表现出最佳的干预效果[16]。上述研究从侧面体现出DHM的干预效果呈现非剂量-药效依赖性,分析原因可能与其较差的血液吸收性,缓慢的清除途径有关[17]。鉴于前期的研究基础及药效动力学因素,本实验主要采用100 mg/kg作为本研究的药物实验剂量。坏死性凋亡参与了脑神经疾病的发生,而抑制坏死性凋亡可显著改善慢性缺血性中风小鼠的认知功能和神经炎性反应[18]。因此,为了证明坏死性凋亡是否参与MPTP/p诱导的运动功能障碍,我们在实验中设置了坏死性凋亡抑制剂NEC-1作为模型组的阳性对照,且行为学结果表明,NEC-1抑制剂组小鼠的运动能力较PD组得到了显著改善。值得一提的是,DHM干预对PD小鼠运动能力的影响与阳性对照NEC-1抑制剂组产生的保护作用相似。上述结果表明,DHM干预可显著减轻因MPTP/p药物毒性引起的运动协调障碍,提高肢体协调性、恢复运动能力。Ren等[19]研究证实,DHM干预能有效促进MPTP诱导PD小鼠模型中TH蛋白的表达及运动功能的恢复。同时,该效果与PD治疗药物左旋多巴(L-DOPA)阳性对照组作用相似,8周DHM干预可显著减少三苯氧胺诱导的PD小鼠模型中DA神经元的死亡,改善小鼠运动功能障碍[20]。
神经胶质细胞能感知并响应免疫细胞分泌的促炎细胞因子,从而调节中枢神经系统的炎症反应。MPTP的毒性作用可激活MG,促进小鼠黑质组织Iba-1和GFAP的表达[21]。有文献证明在PD患者及动物模型的黑质-纹状体中,存在星形胶质细胞和小胶质细胞(MG)的过度激活和免疫细胞的浸润,促炎因子(IL-1β、IL-6、TNF-α)可加剧DA能神经元死亡[22, 23]。由于DHM能较好的通过血脑屏障,其在抑制炎症反应方面具有显著的疗效[24]。已有研究表明,DHM对BAC-α-syn-GFP转基因小鼠星形胶质细胞和MG介导的神经炎症反应有较好的预防作用[5]。体外实验也表明,DHM可显著减少MPP+诱导MES23.5细胞中炎症介质的产生[19]。因此,在本研究中,我们通过Western blot和免疫荧光染色检测DHM对PD小鼠黑质和纹状体内神经胶质细胞和炎性介质的影响。结果显示,PD模型小鼠黑质组织内GFAP和Iba-1的表达较对照组显著增高,而DHM干预后显著降低,且对MG的抑制作用优于星形胶质细胞,DHM还逆转了PD小鼠纹状体内GFAP和Iba-1异常增高的蛋白表达。同时,通过结合RT-PCR证实DHM可从mRNA和蛋白水平全面抑制胶质细胞炎性介质的产生和释放,促进抗炎因子的表达,减少炎症因子的侵润。MG中NLRP3炎症小体及炎症因子的释放,也是引起DA能神经元损伤的重要原因[25]。神经胶质细胞活化可激活NLRP3炎症小体,活化未成熟的Caspase1,切割GSDMD,使其成为具有成孔活性的GSDMD-N,进而破坏细胞膜的完整性,引发细胞焦亡;同时释放IL-1β和IL-18诱导炎症反应[26]。已有文献证实MG中NLRP3的激活可加重MPTP诱导DA能神经元丢失引起的运动功能障碍,而敲除NLRP3基因可保护DA能神经元,改善运动功能[21, 27]。我们的研究证实,DHM干预可显著降低PD小鼠纹状体内NLRP3、Cleaved-Caspase1/Caspase1、GSDMD-N、IL-1β、IL-18的表达,抑制MPTP/p诱导的NLRP3炎症小体的激活及细胞焦亡,减少DA神经元受损。此外,除了对中枢神经系统的影响,DHM对血液循环系统中的IL-1β也有较好的抑制作用。
胞内LDH酶的释放水平是评价细胞膜完整性和细胞毒性的重要指标。我们的研究发现,PD小鼠纹状体内LDH的表达较对照组明显升高,表明MPTP/p处理可诱导细胞坏死。而DHM可有效降低细胞毒性,降低LDH的表达抑制细胞坏死。坏死性凋亡激活的关键是形成活化的RIP1/RIP3/MLKL蛋白复合体,抑制RIP1则可抑制RIP1/RIP3/MLKL信号介导的细胞坏死进程[28]。已有研究证实,敲除坏死性凋亡基因RIP3/MLKL可有效减弱由MPTP诱导的炎症反应[29]。有文献表明,MPTP处理诱导小鼠运动功能障碍的同时,体内RIP1/RIP3/MLKL信号被激活并共定位于TH阳性细胞,提示TH细胞发生坏死性凋亡导致的神经元丢失与运动功能障碍有关[30]。为进一步分析DHM是否是通过抑制坏死性凋亡改善PD小鼠的运动功能障碍,我们检测了坏死性凋亡的相关指标,结果发现MPTP/p诱导的慢性PD小鼠纹状体内确实存在RIP1/RIP3/MLKL坏死性凋亡信号的异常激活,且与小鼠黑质组织中TH阳性细胞的丢失、纹状体TH蛋白含量的下降、运动功能障碍呈正相关。而DHM干预后则显著降低了PD小鼠坏死性凋亡信号,促进TH的表达及运动功能的恢复,表明DHM可明显抑制MPTP/p诱导的坏死性凋亡,对炎症-坏死性凋亡循环有一定的遏制作用。
自噬起始蛋白ULK1[31]、自噬泡关键蛋白Beclin1、参与自噬小体成熟与延伸的LC3[32]、自噬底物p62[33]等均是调控细胞自噬的关键蛋白。已有研究证明DHM可通过上调人脐静脉内皮细胞中Beclin1、LC3的表达,下调p62增加自噬小体数量,促进自噬[34]。DHM还可通过加强p62与胞质蛋白伴侣分子Keap-1的相互作用,促进线粒体自噬的发生[35]。为了探究DHM改善MPTP/p焦亡和坏死性凋亡是否和诱导细胞自噬有关,我们采用Western blot技术对自噬相关蛋白进行检测。结果显示,MPTP/p诱导的PD小鼠存在明显的自噬功能障碍,而DHM处理可明显上调PD小鼠纹状体内ULK1和Beclin1的表达,降低了LC3Ⅰ和p62的表达水平,表明DHM可逆转MPTP/p诱导的自噬功能下降。此外,有研究表明自噬受限可激活NLRP3炎性小体加重MPTP诱导PD小鼠的DA能神经元病变和炎症反应,而促进自噬则可抑制NLRP3的激活进而减轻炎症[21]。同时激活星形胶质细胞的自噬水平也可增强抗炎作用[36]。因此,为了进一步验证自噬、焦亡和坏死性凋亡之间的关系,我们进行体外实验探究自噬抑制剂3-MA对焦亡和坏死性凋亡的影响。实验发现,MPP+可诱导Bv-2细胞出现自噬功能障碍和NLRP3炎症小体的激活,DHM干预(3.25、6.5、12.5 μg/mL)可通过改善细胞受损自噬,抑制NLRP3炎症小体减轻细胞焦亡,且DHM剂量6.5 μg/mL效果最好。而与DHM干预组相比,自噬抑制剂3-MA处理可钝化DHM对焦亡相关蛋白NLRP3、IL-1β以及坏死趋化蛋白TNF-α、IL-6的抑制效应,表明DHM有可能通过增强自噬抑制焦亡和坏死性凋亡发挥神经保护作用。
综上所述,本研究在PD动物模型及细胞模型层面上验证,DHM干预可明显改善MPTP/p诱导慢性PD小鼠的运动协调能力障碍,其机制可能与DHM激活自噬抑制细胞焦亡、坏死性凋亡降低神经炎症反应有关。以上研究结果初步证实了DHM在MPTP/p诱导慢性PD动物模型中的治疗作用,但DHM介导的自噬激活调控机制还有待进一步探索。在未来的研究工作中,可利用自噬基因敲除鼠或自噬抑制剂/激动剂体内干预构建PD模型后深入探讨DHM在自噬缺陷或不同自噬条件下对PD的治疗作用,为PD候选药物的开发提供科学依据。
Biography
张蒙,在读博士研究生,E-mail: zm15071235925@163.com
Funding Statement
国家自然科学基金(81601228);教育部人文社会科学研究规划基金(21YJA890014)
Supported by National Natural Science Foundation of China (81601228)
Contributor Information
张 蒙 (Meng ZHANG), Email: zm15071235925@163.com.
寇 现娟 (Xianjuan KOU), Email: kouxianjuan@126.com.
References
- 1.Schlossmacher MG, Tomlinson JJ, Santos G, et al. Modelling idiopathic Parkinson disease as a complex illness can inform incidence rate in healthy adults: the PR EDIGT score. Eur J Neurosci. 2017;45(1):175–91. doi: 10.1111/ejn.13476. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Torun NA, Senel GB, Gunduz A, et al. Sleep parameters associated with long-term outcome following subthalamic deep brain stimulation in Parkinson's disease. Rev Neurol (Paris) 2020;176(4):277–84. doi: 10.1016/j.neurol.2019.07.020. [DOI] [PubMed] [Google Scholar]
- 3.Yu P, Zhang X, Liu N, et al. Pyroptosis: mechanisms and diseases. Signal Transduct Target Ther. 2021;6(1):1–21. doi: 10.1038/s41392-020-00451-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Mohammadi A, Amooeian VG, Rashidi E. Dysfunction in brainderived neurotrophic factor signaling pathway and susceptibility to schizophrenia, parkinson's and alzheimer's diseases. Curr Gene Ther. 2018;18(1):45–63. doi: 10.2174/1566523218666180302163029. [DOI] [PubMed] [Google Scholar]
- 5.Wu JZ, Ardah M, Haikal C, et al. Dihydromyricetin and Salvianolic acid B inhibit alpha-synuclein aggregation and enhance chaperonemediated autophagy. Transl Neurodegener. 2019;8:18. doi: 10.1186/s40035-019-0159-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Li Q, Chen N, Luo JD, et al. Dihydromyricetin improves Parkinson's disease-like lesions in T2DM rats by activating AMPK/ULK1 pathway. Sheng Li Xue Bao. 2023;75(1):59–68. [PubMed] [Google Scholar]
- 7.吕 慧婕, 朱 责梅, 陈 维昭, et al. 二氢杨梅素通过下调JNK信号拮抗高糖诱导的PC12细胞凋亡. 生物化学与生物物理进展. 2018;45(6):663–71. doi: 10.16476/j.pibb.2017.0477. [DOI] [Google Scholar]
- 8.Cheng QC, Fan J, Deng XW, et al. Dihydromyricetin ameliorates chronic liver injury by reducing pyroptosis. World J Gastroenterol. 2020;26(41):6346–60. doi: 10.3748/wjg.v26.i41.6346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Alam P, Bousset L, Melki R, et al. α-synuclein oligomers and fibrils: a spectrum of species, a spectrum of toxicities. J Neurochem. 2019;150(5):522–34. doi: 10.1111/jnc.14808. [DOI] [PubMed] [Google Scholar]
- 10.Narmashiri A, Abbaszadeh M, Ghazizadeh A. The effects of 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine (MPTP) on the cognitive and motor functions in rodents: a systematic review and meta-analysis. Neurosci Biobehav Rev. 2022;140:104792. doi: 10.1016/j.neubiorev.2022.104792. [DOI] [PubMed] [Google Scholar]
- 11.Chen T, Hou RH, Xu SJ, et al. Donepezil regulates 1-methyl-4-phenylpyridinium-induced microglial polarization in parkinson's disease. ACS Chem Neurosci. 2015;6(10):1708–14. doi: 10.1021/acschemneuro.5b00026. [DOI] [PubMed] [Google Scholar]
- 12.Qiu JR, Chen Y, Zhuo J, et al. Urolithin A promotes mitophagy and suppresses NLRP3 inflammasome activation in lipopolysaccharideinduced BV2 microglial cells and MPTP-induced Parkinson's disease model. Neuropharmacology. 2022;207:108963. doi: 10.1016/j.neuropharm.2022.108963. [DOI] [PubMed] [Google Scholar]
- 13.Gao J, Zhang WX, Chai XQ, et al. Asparagine endopeptidase deletion ameliorates cognitive impairments by inhibiting proinflammatory microglial activation in MPTP mouse model of Parkinson disease. Brain Res Bull. 2022;178:120–30. doi: 10.1016/j.brainresbull.2021.11.011. [DOI] [PubMed] [Google Scholar]
- 14.胡 丹东, 崔 玉娟, 张 继. 神经酸对帕金森病小鼠运动障碍的改善及保护作用. 中国药理学通报. 2021;37(11):1524–9. [Google Scholar]
- 15.Kou XJ, Liu XR, Chen XB, et al. Ampelopsin attenuates brain aging of D-gal-induced rats through miR-34a-mediated SIRT1/mTOR signal pathway. Oncotarget. 2016;7(46):74484–95. doi: 10.18632/oncotarget.12811. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kou XJ, Li J, Liu XR, et al. Ampelopsin attenuates the atrophy of skeletal muscle from d-gal-induced aging rats through activating AMPK/SIRT1/PGC-1α signaling cascade. Biomed Pharmacother. 2017;90:311–20. doi: 10.1016/j.biopha.2017.03.070. [DOI] [PubMed] [Google Scholar]
- 17.Fan L, Tong Q, Dong WW, et al. Tissue distribution, excretion, and metabolic profile of dihydromyricetin, a flavonoid from vine tea (Ampelopsis grossedentata) after oral administration in rats. J Agric Food Chem. 2017;65(23):4597–604. doi: 10.1021/acs.jafc.7b01155. [DOI] [PubMed] [Google Scholar]
- 18.Lin QS, Chen P, Wang WX, et al. RIP1/RIP3/MLKL mediates dopaminergic neuron necroptosis in a mouse model of Parkinson disease. Lab Invest. 2020;100(3):503–11. doi: 10.1038/s41374-019-0319-5. [DOI] [PubMed] [Google Scholar]
- 19.Ren ZX, Zhao YF, Cao T, et al. Dihydromyricetin protects neurons in an MPTP-induced model of Parkinson's disease by suppressing glycogen synthase kinase-3 beta activity. Acta Pharmacol Sin. 2016;37(10):1315–24. doi: 10.1038/aps.2016.42. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Guo CH, Cao T, Zheng LT, et al. Development and characterization of an inducible Dicer conditional knockout mouse model of Parkinson's disease: validation of the antiparkinsonian effects of a sigma-1 receptor agonist and dihydromyricetin. Acta Pharmacol Sin. 2020;41(4):499–507. doi: 10.1038/s41401-020-0379-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Qin Y, Qiu JR, Wang P, et al. Impaired autophagy in microglia aggravates dopaminergic neurodegeneration by regulating NLRP3 inflammasome activation in experimental models of Parkinson's disease. Brain Behav Immun. 2021;91:324–38. doi: 10.1016/j.bbi.2020.10.010. [DOI] [PubMed] [Google Scholar]
- 22.Booth HDE, Hirst WD, Wade-Martins R. The role of astrocyte dysfunction in parkinson's disease pathogenesis. Trends Neurosci. 2017;40(6):358–70. doi: 10.1016/j.tins.2017.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Xiong XY, Liu L, Yang QW. Functions and mechanisms of microglia/macrophages in neuroinflammation and neurogenesis after stroke. Prog Neurobiol. 2016;142:23–44. doi: 10.1016/j.pneurobio.2016.05.001. [DOI] [PubMed] [Google Scholar]
- 24.Ren ZX, Yan PJ, Zhu LS, et al. Dihydromyricetin exerts a rapid antidepressant-like effect in association with enhancement of BDNF expression and inhibition of neuroinflammation. Psychopharmacology(Berl) 2018;235(1):233–44. doi: 10.1007/s00213-017-4761-z. [DOI] [PubMed] [Google Scholar]
- 25.黄 河灵, 高 玉元, 聂 坤, et al. 巨噬细胞移动抑制因子介导MPP+/MPTP诱导的小胶质细胞NLRP3炎症小体的激活. 南方医科大学学报. 2021;41(7):972–9. doi: 10.12122/j.issn.1673-4254.2021.07.02. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Yu P, Zhang X, Liu N, et al. Pyroptosis: mechanisms and diseases. Signal Transduct Target Ther. 2021;6(1):128. doi: 10.1038/s41392-021-00507-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Panicker N, Kam TI, Wang H, et al. Neuronal NLRP3 is a parkin substrate that drives neurodegeneration in Parkinson's disease. Neuron. 2022;110(15):2422–37. doi: 10.1016/j.neuron.2022.05.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Huang ZJ, Zhou T, Sun XW, et al. Necroptosis in microglia contributes to neuroinflammation and retinal degeneration through TLR4 activation. Cell Death Differ. 2018;25(1):180–9. doi: 10.1038/cdd.2017.141. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Chen FX, Su XF, Lin ZY, et al. Necrostatin-1 attenuates early brain injury after subarachnoid hemorrhage in rats by inhibiting necroptosis. Neuropsychiatr Dis Treat. 2017;13:1771–82. doi: 10.2147/NDT.S140801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.林清松. RIP1/RIP3/MLKL介导帕金森病多巴胺能神经元程序性坏死的机制研究[D]. 福州: 福建医科大学, 2019.
- 31.Vargas JNS, Wang CX, Bunker E, et al. Spatiotemporal control of ULK1 activation by NDP52 and TBK1 during selective autophagy. Mol Cell. 2019;74(2):347–62. e6. doi: 10.1016/j.molcel.2019.02.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Hill SM, Wrobel L, Rubinsztein DC. Post-translational modifications of Beclin 1 provide multiple strategies for autophagy regulation. Cell Death Differ. 2019;26(4):617–29. doi: 10.1038/s41418-018-0254-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Sánchez-Martín P, Komatsu M. Physiological stress response by selective autophagy. J Mol Biol. 2020;432(1):53–62. doi: 10.1016/j.jmb.2019.06.013. [DOI] [PubMed] [Google Scholar]
- 34.钟 惠娟, 陈 璐, 廖 慧颖, et al. 二氢杨梅素调控自噬抑制氧化低密度脂蛋白诱导人脐静脉内皮细胞损伤的研究. 中国现代医学杂志. 2017;27(23):31–7. [Google Scholar]
- 35.Tan MD, Jiang B, Wang HH, et al. Dihydromyricetin induced lncRNA MALAT1-TFEB-dependent autophagic cell death in cutaneous squamous cell carcinoma. J Cancer. 2019;10(18):4245–55. doi: 10.7150/jca.32807. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Xie WW, Zheng W, Liu M, et al. BRF1 ameliorates LPS-induced inflammation through autophagy crosstalking with MAPK/ERK signaling. Genes Dis. 2018;5(3):226–34. doi: 10.1016/j.gendis.2018.04.004. [DOI] [PMC free article] [PubMed] [Google Scholar]


