Abstract
目的
探究表皮生长因子受体酪氨酸激酶抑制剂阿美替尼对神经母细胞瘤SH-SY5Y的作用。
方法
CCK-8法、集落克隆法和流式细胞术检测不同浓度阿美替尼(0、2、4、8 μmol/L)对SH-SY5Y细胞增殖、细胞存活和细胞凋亡的影响;透射电镜观察阿美替尼处理后SH-SY5Y细胞亚显微结构;Transwell小室实验检测阿美替尼对SH-SY5Y细胞侵袭及迁移的作用;Western blot实验检测阿美替尼对SH-SY5Y细胞凋亡和侵袭迁移相关蛋白Bax、Bcl-2、E-Cadherin、Vimentin、MMP2、MMP9表达的影响;SH-SY5Y细胞注射到5周龄BALB/C裸鼠皮下,建立裸鼠皮下瘤动物模型,每组6只,设置空白对照组、阿美替尼处理组(15 mg/kg)、阳性药环磷酰胺处理组(20 mg/kg),测量裸鼠肿瘤体积及体质量变化,HE染色观察阿美替尼对荷瘤裸鼠心、肝、脾、肺、肾的毒副作用。
结果
CCK-8结果表明,相比于对照组,阿美替尼能够抑制SH-SY5Y细胞增殖(P<0.05),其作用24、48、72 h的IC50分别为5.004、3.728、3.228 μmol/L;集落克隆结果表明阿美替尼能够抑制SH-SY5Y细胞存活;流式细胞术结果表明阿美替尼诱导SH-SY5Y细胞发生凋亡(P<0.05),透射电镜下观察到阿美替尼处理后具有典型的细胞凋亡形态学特征;Transwell小室实验结果表明阿美替尼能够抑制SH-SY5Y细胞的侵袭迁移能力(P<0.01);Western blot实验结果表明阿美替尼处理后SH-SY5Y细胞中E-Cadherin、Bax蛋白表达水平上调,Bcl-2、Vimentin、MMP2、MMP9蛋白表达水平下调(P<0.05);动物实验结果表明阿美替尼能够抑制神经母细胞瘤的生长,HE染色结果表明阿美替尼没有对小鼠脏器产生明显毒性。
结论
阿美替尼能够抑制神经母细胞瘤SH-SY5Y细胞增殖并诱导细胞发生凋亡,通过下调MMP2、MMP9蛋白表达,从而抑制神经母细胞瘤侵袭和迁移。
Keywords: 神经母细胞瘤, 阿美替尼, 增殖, 凋亡, 侵袭迁移, 上皮间质转化,
Abstract
Objective
To investigate the effects of aumolertinib, an epidermal growth factor receptor tyrosine kinase inhibitor (EGFR-TKI), on biological behaviors of neuroblastoma SH-SY5Y cells.
Methods
CCK-8 assay, colony-forming assay, Transwell assay and flow cytometry were used to assess the effects of 2, 4 and 8 μmol/L aumolertinib on proliferation, survival, migration, invasion and apoptosis of SH-SY5Y cells, and the changes in ultrastructure of the cells were observed using transmission electron microscopy. The protein expressions of Bax, Bcl-2, E-cadherin, vimentin, MMP2, and MMP9 in the treated cells were detected using Western blotting. A nude mouse model bearing subcutaneous SH-SY5Y cell xenograft were treated with aumolertinib (15 mg/kg) or cyclophosphamide (20 mg/kg), and the tumor volume and body mass changes was measured. HE staining was used to observe adverse effects of the treatment on the heart, liver, spleen, lungs and kidneys.
Results
Aumolertinib significantly inhibited the proliferation and viability of SH-SY5Y cells (P<0.05) with IC50 of 5.004, 3.728 and 3.228 µmol/L at 24, 48 and 72 h, respectively. Aumolertinib treatment induced obvious apoptosis of the cells, which showed characteristic morphological changes of apoptosis under transmission electron microscope. The treatment also inhibited the invasion and migration abilities of SH-SY5Y cells (P<0.01), up-regulated the expression levels of E-cadherin and Bax and lowered the expression levels of Bcl-2, vimentin, MMP2 and MMP9 (P<0.05). In the nude mouse models, treatment with aumolertinib effectively inhibited the growth of neuroblastoma without causing significant toxicity to the vital organs.
Conclusion
Aumolertinib inhibits proliferation, survival, invasion and migration and induces apoptosis in SH-SY5Y cells by downregulating MMP2 and MMP9 expression.
Keywords: neuroblastoma, aumolertinib, proliferation, apoptosis, invasion, migration, epithelial mesenchymal transition
神经母细胞瘤(NB)是一种儿童中最常见的颅外实体肿瘤,约占所有儿童肿瘤患者的8%,约90%的病例发生在5岁以下儿童中[1]。神经母细胞瘤来源于胚胎神经嵴细胞,具有较强的侵袭转移性和致死性[2, 3],约占所有儿童癌症死亡人数的15%[4],NB起病隐匿,多数儿童患者在就诊时已经发生了多部位转移,预后较差[5],严重威胁儿童的生命健康与生活质量。人们在防治神经母细胞瘤进展方面收效甚微,目前以细胞毒类化疗药物为主[6],但化疗药物由于缺乏靶向性,常引起胃肠道等不良反应[7],其治疗效果令人沮丧。因此,临床上迫切需要寻找新的治疗药物,以改善NB的治疗效果和不良预后。
PI3K/AKT/mTOR信号通路级联反应能够调控神经母细胞瘤的发生发展[8],此信号通路在大多数NB中被激活,能够促进肿瘤的存活、耐药、增殖、侵袭转移等[9]。此外,还有多种突变基因在神经母瘤细胞中被发现,间变性淋巴瘤激酶(ALK)突变基因是神经母瘤复发和转移等不良预后的驱动因素,其与神经母瘤发生发展过程密切相关[6]。有研究表明,ALK能够激活PI3K/AKT/mTOR信号通路[8],这可能与ALK突变促进NB细胞增殖、侵袭迁移等恶性进展相关。因此,干预PI3K/AKT/mTOR通路可能是治疗ALK突变NB的潜在策略。PI3K/AKT/mTOR信号通路是表皮生长因子受体(EGFR)下游信号通路之一,EGFR能够阻断PI3K/AKT/mTOR信号传导途径,在肿瘤细胞增殖、侵袭和转移过程中具有重要作用[10-16]。有研究表明阿美替尼能够通过抑制EGFR/PI3K/AKT信号通路,抑制MDA-MB-231乳腺癌细胞增殖,诱导细胞发生自噬和凋亡[17]。同时,有临床研究报道:表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗ALK突变患者具有显著的临床获益[18]。因此,EGFR-TKI可能是治疗神经母细胞瘤ALK突变患者的可行策略。
阿美替尼是我国自主研发的第3代EGFR-TKI,目前尚无关于阿美替尼对神经母细胞瘤体内外作用的相关报道。本研究以神经母瘤细胞SH-SY5Y为研究对象,体外观察阿美替尼对SH-SY5Y细胞增殖、存活、凋亡、侵袭迁移的影响,通过构建裸鼠异种移植瘤模型来评价阿美替尼体内抗肿瘤作用,旨在为临床治疗神经母细胞瘤提供更多的解决方案,为阿美替尼应用于临床治疗神经母细胞瘤提供相应的理论和实验依据。
1. 材料和方法
1.1. 细胞株与动物
人神经母细胞瘤SH-SY5Y细胞,购自上海中乔新舟生物科技有限公司。动物:SPF级BALB/C裸鼠,购自杭州子源实验动物科技有限公司,许可证号:SCXK (浙)2019-0004。
1.2. 试剂
阿美替尼(江苏豪森药业有限公司)、环磷酰胺(MedChemExpress)、Bax抗体、Bcl-2抗体、MMP9抗体和β-Actin抗体(Affinity)、E-cadherin抗体、Vimentin抗体和MMP2抗体(proteintech),RPMI 1640培养基、胎牛血清(Gibco)、CCK-8试剂(APE BIO),Annexin VFITC/PI试剂盒(贝博生物),Transwell小室(Corning),胰酶消化液(新赛美),青霉素-链霉素溶液和BCA蛋白浓度测定试剂盒(biosharp),RIPA裂解液(碧云天生物)。
1.3. 细胞培养
SH-SY5Y细胞培养于含有10%胎牛血清和1%青霉素-链霉素的RPMI 1640培养基中,置于37℃、5% CO2的恒温培养箱中培养。
1.4. CCK-8法检测细胞增殖
SH-SY5Y细胞按6000/孔种于96孔板中,置于37 ℃、5% CO2培养箱中培养,待细胞密度达到60%~80%左右时吸出培养基,加入含有不同浓度阿美替尼的培养基,每组设置6个复孔,分别孵育24、48、72 h后,每孔加入10 µL CCK-8溶液,培养箱中孵育30 min左右,酶标仪测定吸光度A值,细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)×100%,计算药物半数抑制浓度。
1.5. 集落克隆法检测细胞存活
SH-SY5Y细胞按2000/孔种于6孔板中,细胞贴壁后吸除培养基,加入含有不同浓度阿美替尼的培养基,10 d后移除培养基,用PBS清洗2遍,4%多聚甲醛固定30min,结晶紫染色,室温放置干燥后拍照,实验重复3次。
1.6. 细胞形态学观察
将SH-SY5Y细胞按2×105/孔接种于6孔板中,待细胞密度达到60%~80%时吸除培养基,加入含有不同浓度阿美替尼的培养基,培养24 h后使用倒置显微镜拍照,实验重复3次。
1.7. 流式细胞术检测细胞凋亡
将SH-SY5Y细胞按2×105/孔种于6孔板中,待细胞密度达到60%~80%时吸去培养基,加入含有不同浓度阿美替尼的培养基,培养24 h后收集细胞,加入Annexin V-FITC/PI双染试剂染色,纱布过滤后流式细胞仪上机检测,实验重复3次。
1.8. 电镜观察细胞凋亡
将SH-SY5Y细胞种于100 mm大皿中,待细胞密度达到60%~80%时吸去培养基,加入含有4 µmol/L阿美替尼的培养基作用24 h,900 g收集细胞,PBS洗两遍,加入2.5%常温戊二醛固定液固定细胞,透射电子显微镜采集图片,实验重复3次。
1.9. Transwell侵袭实验
基质胶与无血清培养基按照1∶8比例稀释,在Transwell小室上室内加入50 μL基质胶,置于培养箱中60 min左右。收集SH-SY5Y细胞,使用无血清1640培养基配含有不同浓度阿美替尼的细胞悬液,取2×104个细胞加入上室,下室加入600 μL含有10% 胎牛血清的培养基,培养24 h后取出上室,用PBS轻轻冲洗,加入4%多聚甲醛室温固定15 min,结晶紫染液室温染色20 min,PBS冲洗后室温晾干,倒置显微镜下观察拍照,实验重复3次。
1.10. Transwell迁移实验
无需加入基质胶,其余步骤同1.9。
1.11. Western blot检测相关蛋白表达
将SH-SY5Y细胞种于100 mm大皿中,待细胞密度达到60%~80%时吸去培养基,加入含有不同浓度阿美替尼的培养基,培养24 h后刮取蛋白,BCA蛋白浓度试剂盒检测蛋白浓度以定量。蛋白上样,电泳,转膜,封闭,相应一抗4 ℃孵育过夜,二抗于室温孵育1.5 h,ECL试剂盒显影曝光,凝胶成像系统采集图像,Image J软件扫描条带灰度值,实验重复3次。
1.12. 体内实验
收集SH-SY5Y细胞,将细胞重悬于PBS与基质胶悬液中,将混悬细胞注射到5周BALB/C裸鼠皮下,待肿瘤体积长至100 mm3左右,随机分为3组给药:模型对照组、阿美替尼治疗组、阳性药物环磷酰胺治疗组,每组6只,分别灌胃给予生理盐水、灌胃给予阿美替尼15 mg/kg、腹腔注射给予环磷酰胺20 mg/kg,给药剂量根据《药理实验方法学》折算[19],成人体质量按60 kg估算,成人与小鼠的用药换算系数为9.01,各给药组按0.1 mL/10 g折算给药体积,对照组给予等体积生理盐水,阿美替尼治疗组1 d给药1次,环磷酰胺治疗组2 d给药1次,治疗周期持续14 d。每3 d记录1次裸鼠体质量、肿瘤体积大小(瘤体积=长×宽2/2)、治疗结束后取裸鼠心、肝、脾、肺、肾组织行HE染色,称瘤质量。动物研究经蚌埠医学院实验动物教学与研究委员会批准(伦动科批字[2022]第177号)。
1.13. 统计学方法
采用Graphpad Prism 7.0软件对实验结果进行分析,数据以均数±标准差表示,采用单因素方差分析检验实验组间差异,P<0.05表示差异具有统计学意义。
2. 结果
2.1. 阿美替尼抑制SH-SY5Y细胞增殖和存活
给予SH-SY5Y细胞不同浓度阿美替尼培养24、48、72 h后,每孔加入10 µL CCK-8,结果显示随着药物浓度和给药时间的增加,SH-SY5Y细胞存活率下降,阿美替尼作用于SH-SY5Y细胞24、48、72 h的IC50分别为5.004、3.728、3.228 μmol/L(图 1A)。集落克隆结果显示阿美替尼能够抑制SH-SY5Y细胞集落形成(图 1B);给予不同浓度阿美替尼处理24 h后,通过显微镜观察SH-SY5Y细胞形态与密度,与对照组相比,给药组细胞皱缩、细胞密度明显降低(图 1C)。
图 1.
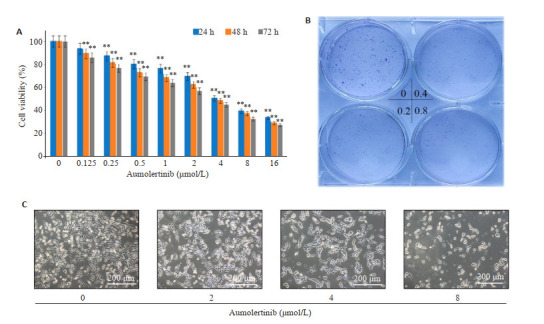
阿美替尼抑制SH-SY5Y细胞增殖和存活
Aumolertinib inhibits proliferation and survival of SH-SY5Y cells. A: CCK-8 assay. B: Colony-forming assay. C: Morphological changes of SH-SY5Y cells. **P<0.01 vs control.
2.2. 阿美替尼诱导SH-SY5Y细胞凋亡
给予SH-SY5Y细胞不同浓度阿美替尼处理24 h,流式细胞仪检测细胞凋亡情况,结果表明:与对照组相比,随着阿美替尼给药浓度的增加,SH-SY5Y细胞凋亡率增加,差异具有显著性(P<0.05,图 2A、B);透射电镜结果表明:相比于对照组,阿美替尼处理后SH-SY5Y细胞内观察到染色质凝集于核膜周围,细胞发生凋亡(图 2C);Western blot实验检测凋亡相关蛋白Bax、Bcl-2的表达,结果表明:与对照组相比,不同浓度阿美替尼处理组SH-SY5Y细胞中Bax蛋白表达显著升高(P<0.01),Bcl-2蛋白表达显著下降(P<0.01,图 2D、E)。
图 2.
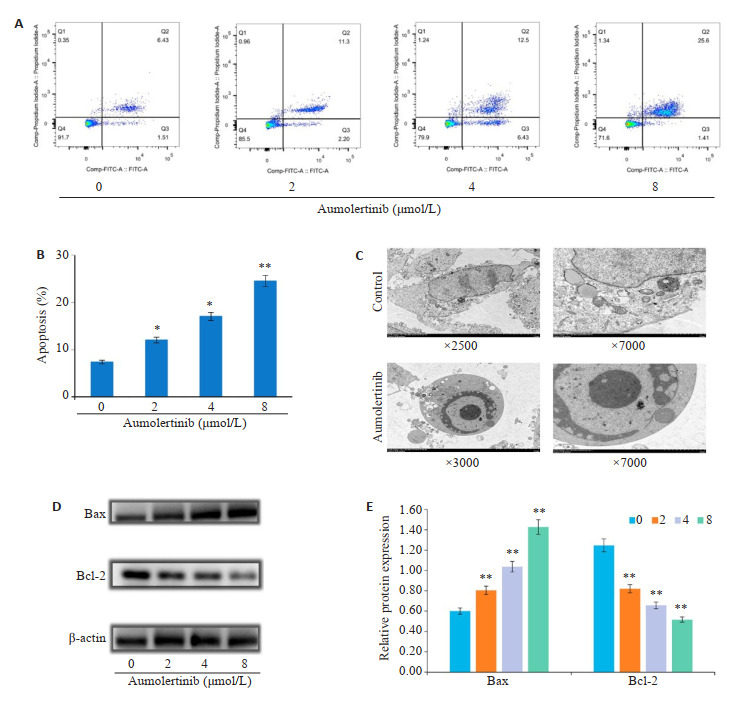
阿美替尼诱导SH-SY5Y细胞凋亡
Aumolertinib induces apoptosis of SH-SY5Y cells. A: Apoptosis of SH-SY5Y cells treated with different concentrations of aumolertinib for 24 h detected by flow cytometry. B: Percentages of apoptotic cells. C: Electron microscopy of SH-SY5Y cells treated with aumolertinib (4 μmol/L). D, E: Expression of Bax and Bcl-2 in SH-SY5Y cells detected by Western blotting. *P<0.05, **P<0.01 vs 0 group.
2.3. 阿美替尼抑制SH-SY5Y细胞侵袭、迁移
与对照组相比,给予阿美替尼处理组细胞的侵袭和迁移数目明显减少(P<0.01,图 3A、B);Western blot实验检测侵袭迁移相关蛋白E-Cadherin、Vimentin、MMP2、MMP9的表达,结果表明:与对照组相比,不同浓度阿美替尼处理组SH-SY5Y细胞中E-Cadherin蛋白表达显著升高(P<0.05),Vimentin、MMP2、MMP9蛋白表达显著下降(P<0.05,图 3C、D)。
图 3.
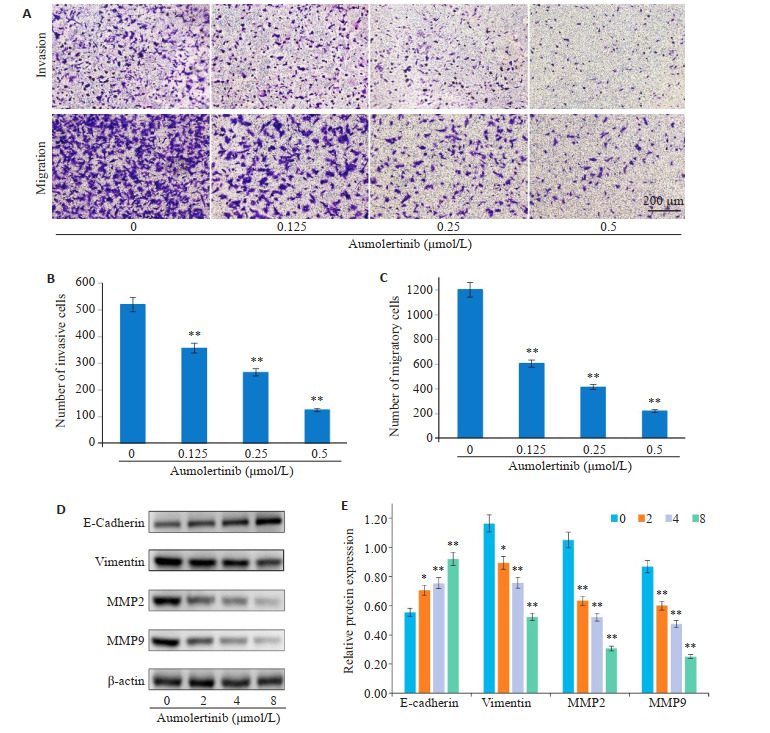
阿美替尼抑制SH-SY5Y细胞侵袭、迁移
Aumolertinib inhibits invasion and migration of SH-SY5Y cells. A: Results of crystal violet staining. B: Numbers of SH-SY5Y cells passing through Transwell chamber. C, D: Expression of E-cadherin, vimentin, MMP2 and MMP9 in SH-SY5Y cells detected by Western blotting. *P<0.05, **P<0.01 vs control.
2.4. 阿美替尼体内抗肿瘤作用
与对照组相比,阿美替尼(15 mg/kg)能够显著抑制肿瘤生长(P<0.01,图 4A~C),但对裸鼠体质量变化影响不大(P>0.05,图 4D)。HE染色结果表明阿美替尼治疗没有造成明显的器官损伤(图 4E)。
图 4.
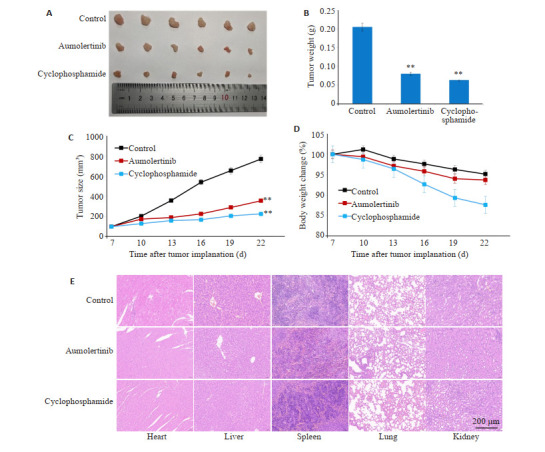
阿美替尼体内抗肿瘤作用
Anti-tumor effects of aumolertinib in tumor-bearing nude mice. A: Aumolertinib inhibits growth of subcutaneous SH-SY5Y cell xenografts in nude mice. B: Tumor weight in nude mice. C: Tumor volume in nude mice. D: Body weight of the nude mice. E: HE staining of the heart, liver, spleen, lung and kidney tissues of the treated mice. **P<0.01 vs Control.
3. 讨论
神经母瘤细胞中有多种突变基因被发现,最常见的有MYCN基因扩增、ALK基因突变等[20],ALK能够激活PI3K/AKT/mTOR信号通路[21, 22],PI3K/AKT/mTOR信号通路激活又能够促进神经母瘤细胞的增殖、存活、侵袭转移等[23, 24],ALK突变促进NB恶性进展可能与其激活此通路相关。研究发现PI3K/AKT/FOXO3a通路能够下调ALK基因突变,抑制MYCN基因扩增及其活性[25]。阿美替尼是第3代EGFR-TKI,是一种小分子靶向治疗药物,其通过靶向EGFR,抑制其磷酸化,可以阻断下游PI3K/AKT/mTOR信号通路传导[26],抑制肿瘤增殖、侵袭转移等。本实验从体内外观察阿美替尼对神经母瘤细胞SH-SY5Y的作用,发现阿美替尼能够抑制细胞增殖及诱导细胞凋亡;Transwell实验结果表明阿美替尼能够抑制SH-SY5Y细胞侵袭迁移;裸鼠体内实验结果表明阿美替尼能够抑制NB进展,对小鼠体重没有明显影响且对荷瘤小鼠的心肝脾肺肾等脏器没有明显毒副作用。
CCK-8、集落克隆实验结果表明不同浓度阿美替尼能够呈时间、剂量依赖性的抑制SH-SY5Y细胞增殖与存活;通过流式细胞术实验,我们明确了阿美替尼处理后能够诱导SH-SY5Y细胞发生凋亡,通过透射电镜观察到:相比于对照组,阿美替尼处理后SH-SY5Y细胞亚显微结构具有明显凋亡特征,同时通过Western blot实验发现阿美替尼能够上调细胞中促凋亡蛋白Bax的表达、下调抗凋亡蛋白Bcl-2的表达。以上结果表明阿美替尼能够诱导细胞发生凋亡,阿美替尼抑制SH-SY5Y细胞增殖的作用可能与诱导细胞凋亡有关。
肿瘤细胞侵袭转移是肿瘤恶化的主要驱动因素,是影响NB患者预后及导致患者死亡的主要原因。上皮间质转化(EMT)是指由上皮细胞到间质细胞的转化,其分子生物学特征在于上皮细胞标志物(如E-cadherin表达下调)、间质细胞标志物(如Vimentin表达上调)表达的变化[27]。肿瘤细胞发生EMT,使细胞的迁移和运动能力得以提高,增强细胞的侵袭能力,促进肿瘤细胞经过血液或淋巴循环向远处转移[28, 29]。基质金属蛋白酶(MMPs)是一类锌离子和钙离子依赖的蛋白酶家族[30],细胞外基质和基底是癌细胞转移过程中的一道屏障,其降解是肿瘤侵袭转移的重要环节[31]。有研究表明:MMPs通过降解细胞外基质,在肿瘤侵袭和转移等过程中发挥关键作用,据相关文献报道:细胞外基质和基底膜的主要成分是Ⅳ型胶原蛋白,MMP2、MMP9能够降解此胶原蛋白,MMP2、MMP9在结直肠癌、神经母细胞瘤、膀胱癌等疾病中均有表达[32],所以MMP2、MMP9被认为是肿瘤转移进展中的生物标志物,有望成为抗肿瘤治疗过程中的潜在靶点。Transwell实验结果表明阿美替尼能够抑制SH-SY5Y细胞的侵袭和迁移能力,Western blot实验结果表明阿美替尼处理后,SH-SY5Y细胞中E-cadherin蛋白表达上调,Vimentin蛋白表达下调;此外,MMP2和MMP9蛋白表达也下调。以上结果表明阿美替尼能够抑制神经母细胞瘤SH-SY5Y细胞侵袭、迁移,逆转上皮间质转化。
本研究通过荷瘤裸鼠动物模型来探究阿美替尼体内抗肿瘤作用,结果表明阿美替尼在体内具有较好的抗肿瘤作用,且对裸鼠心、肝、脾、肺、肾等脏器无明显毒副作用。
综上所述,本研究通过体内外实验发现阿美替尼具有较好的抗神经母细胞瘤的作用,阿美替尼作为第3代EGFR-TKI,能够抑制神经母瘤细胞SH-SY5Y增殖、侵袭、迁移,诱导细胞凋亡,抑制裸鼠皮下移植瘤生长,为神经母细胞瘤临床治疗提供新的策略,为阿美替尼临床应用于神经母细胞瘤提供理论依据。
Biography
刘雪柔,硕士,E-mail: 3417912098@qq.com
Funding Statement
安徽省重点研究与开发计划资助项目(202104g01020017);安徽省优秀科研创新团队项目(2022AH010084);蚌埠医学院重大科技项目孵育计划(2020byfy001);安徽省大学生创新创业项目(S202110367026)
Contributor Information
刘 雪柔 (Xuerou LIU), Email: 3417912098@qq.com.
李 娴 (Xian LI), Email: 648217586@qq.com.
李 姗姗 (Shanshan LI), Email: lishanshan900122@163.com.
References
- 1.Davidoff AM. Neonatal neuroblastoma. Clin Perinatol. 2021;48(1):101–15. doi: 10.1016/j.clp.2020.11.006. [DOI] [PubMed] [Google Scholar]
- 2.Gonzalez Malagon SG, Liu KJ. Linking neural crest development to neuroblastoma pathology. Development. 2022;149(15):200331–43. doi: 10.1242/dev.200331. [DOI] [PubMed] [Google Scholar]
- 3.Ponzoni M, Bachetti T, Corrias MV, et al. Recent advances in the developmental origin of neuroblastoma: an overview. J Exp Clin Cancer Res. 2022;41(1):92–119. doi: 10.1186/s13046-022-02281-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Pezeshki PS, Moeinafshar A, Ghaemdoust F, et al. Advances in pharmacotherapy for neuroblastoma. Expert Opin Pharmacother. 2021;22(17):2383–404. doi: 10.1080/14656566.2021.1953470. [DOI] [PubMed] [Google Scholar]
- 5.Khoei S, Boustani MR, Pak N. An atypical imaging characteristic of calvarial metastasis of neuroblastoma as multiple multi-loculated cystic masses with internal blood-fluid levels: a case report. BMC Neurol. 2022;22(1):471–4. doi: 10.1186/s12883-022-03001-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Salemi F, Alam W, Hassani MS, et al. Neuroblastoma: Essential genetic pathways and current therapeutic options. Eur J Pharmacol. 2022;926:175030. doi: 10.1016/j.ejphar.2022.175030. [DOI] [PubMed] [Google Scholar]
- 7.Singh S, Singh N, Sharma S. Genetic polymorphisms in the mismatch repair pathway (MMR) genes contribute to hematological and gastrointestinal toxicity in North Indian lung cancer patients treated with platinum-based chemotherapy. J Biochem Mol Toxicol. 2022;36(11):e23183. doi: 10.1002/jbt.23183. [DOI] [PubMed] [Google Scholar]
- 8.Zafar A, Wang W, Liu G, et al. Molecular targeting therapies for neuroblastoma: progress and challenges. Med Res Rev. 2021;41(2):961–1021. doi: 10.1002/med.21750. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Wu DD, Gao YR, Li T, et al. PEST-containing nuclear protein mediates the proliferation, migration, and invasion of human neuroblastoma cells through MAPK and PI3K/AKT/mTOR signaling pathways. BMC Cancer. 2018;18(1):499–513. doi: 10.1186/s12885-018-4391-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Tang Q, Cao H, Tong N, et al. Tubeimoside-I sensitizes temozolomide-resistant glioblastoma cells to chemotherapy by reducing MGMT expression and suppressing EGFR induced PI3K/Akt/mTOR/NF-κB-mediated signaling pathway. Phytomedicine. 2022;99:154016. doi: 10.1016/j.phymed.2022.154016. [DOI] [PubMed] [Google Scholar]
- 11.Huang R, Dai Q, Yang RX, et al. A review: PI3K/AKT/mTOR signaling pathway and its regulated eukaryotic translation initiation factors may be a potential therapeutic target in esophageal squamous cell carcinoma. Front Oncol. 2022;12:817916. doi: 10.3389/fonc.2022.817916. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sun X, Lu ZY, Liang ZZ, et al. Transcriptomics and proteomics characterizing the anticancer mechanisms of natural rebeccamycin analog loonamycin in breast cancer cells. Molecules. 2022;27(20):6958–72. doi: 10.3390/molecules27206958. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.da Silva-Oliveira RJ, Gomes INF, da Silva LS, et al. Efficacy of combined use of everolimus and second-generation pan-EGRF inhibitors in KRAS mutant non-small cell lung cancer cell lines. Int J Mol Sci. 2022;23(14):7774. doi: 10.3390/ijms23147774. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Qayum A, Shah SM, Singh SK. Divergent signaling pathways may lead to convergence in cancer therapy-A review. Cell Physiol Biochem. 2022;56(2):180–208. doi: 10.33594/000000512. [DOI] [PubMed] [Google Scholar]
- 15.Shawish I, Barakat A, Aldalbahi A, et al. Acetic acid mediated for one-pot synthesis of novel pyrazolyl s-triazine derivatives for the targeted therapy of triple-negative breast tumor cells (MDA-MB-231) via EGFR/PI3K/AKT/mTOR signaling cascades. Pharmaceutics. 2022;14(8):1558–89. doi: 10.3390/pharmaceutics14081558. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.张 恒毅, 庞 金龙, 张 语涵, et al. AZD9291通过抑制PI3K-AKT-mTOR通路抑制鼻咽癌细胞的增殖和迁移. 南方医科大学学报. 2022;42(9):1403–9. doi: 10.12122/j.issn.1673-4254.2022.09.18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.葛 贤明, 周 巧, 张 语涵, et al. EGFR酪氨酸激酶抑制剂HS-10296诱导三阴乳腺癌MDA-MB-231细胞发生自噬和凋亡. 南方医科大学学报. 2020;40(7):981–7. doi: 10.12122/j.issn.1673-4254.2020.07.10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ren KH, Qin WW, Wang Y, et al. Detection of an EML4-ALK fusion mutation secondary to epidermal growth factor receptor-tyrosine kinase inhibitor (EGFR-TKI) therapy for lung cancer: a case report. Ann Palliat Med. 2022;11(7):2503–9. doi: 10.21037/apm-22-744. doi: 10.21037/apm-22-744. [DOI] [PubMed] [Google Scholar]
- 19.徐 叔云. 药理实验方法学. 北京: 人民卫生出版社; 2002. [Google Scholar]
- 20.Parkinson LM, Gillen SL, Woods LM, et al. The proneural transcription factor ASCL1 regulates cell proliferation and primes for differentiation in neuroblastoma. Front Cell Dev Biol. 2022;10:942579. doi: 10.3389/fcell.2022.942579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Redaelli S, Ceccon M, Antolini L, et al. Synergistic activity of ALK and mTOR inhibitors for the treatment of NPM-ALK positive lymphoma. Oncotarget. 2016;7(45):72886–97. doi: 10.18632/oncotarget.12128. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Lambertz I, Kumps C, Claeys S, et al. Upregulation of MAPK Negative Feedback Regulators and RET in Mutant ALK Neuroblastoma: Implications for Targeted Treatment. Clin Cancer Res. 2015;21(14):3327–39. doi: 10.1158/1078-0432.CCR-14-2024. [DOI] [PubMed] [Google Scholar]
- 23.Gao WS, Yang H, Huang WB, et al. microRNA-29a-3p regulates SHSY5Y cell proliferation and neurite growth through interaction with PTEN-PI3K/AKT/mTOR signaling pathway. Dis Markers. 2022;2022:1–9. doi: 10.1155/2022/8151161. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 24.Ye MJ, Gao RN, Chen SY, et al. Downregulation of MEG3 and upregulation of EZH2 cooperatively promote neuroblastoma progression. J Cell Mol Med. 2022;26(8):2377–91. doi: 10.1111/jcmm.17258. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Claeys S, Denecker G, Durinck K, et al. ALK positively regulates MYCN activity through repression of HBP1 expression. Oncogene. 2019;38(15):2690–705. doi: 10.1038/s41388-018-0595-3. [DOI] [PubMed] [Google Scholar]
- 26.Ge X, Zhang Y, Huang F, et al. EGFR tyrosine kinase inhibitor Almonertinib induces apoptosis and autophagy mediated by reactive oxygen species in non-small cell lung cancer cells. Hum Exp Toxicol. 2021;40(12_suppl):S49–62. doi: 10.1177/09603271211030554. [DOI] [PubMed] [Google Scholar]
- 27.Zhang M, Zhu JH, Wang W, et al. Active legumain promotes invasion and migration of neuroblastoma by regulating epithelialmesenchymal transition. Open Life Sci. 2022;17(1):676–85. doi: 10.1515/biol-2022-0012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Ge Z, Shang Y, Wang W, et al. Brown adipocytes promote epithelial mesenchymal transition of neuroblastoma cells by inducing PPAR-γ/UCP2 expression. Adipocyte. 2022;11(1):335–45. doi: 10.1080/21623945.2022.2073804. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Dev A, Sardoiwala MN, Sharma A, et al. Nanoacetylated N-(4-Hydroxyphenyl) Retinamide Modulates Histone AcetylationMethylation Epigenetic Disparity to Restrict EpithelialMesenchymal Transition in Neuroblastoma. ACS Med Chem Lett. 2022;13(7):1109–17. doi: 10.1021/acsmedchemlett.2c00135. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.de Almeida LGN, Thode H, Eslambolchi Y, et al. Matrix metalloproteinases: from molecular mechanisms to physiology, pathophysiology, and pharmacology. Pharmacol Rev. 2022;74(3):712–68. doi: 10.1124/pharmrev.121.000349. [DOI] [PubMed] [Google Scholar]
- 31.Tewari BP, Chaunsali L, Prim CE, et al. A glial perspective on the extracellular matrix and perineuronal net remodeling in the central nervous system. Front Cell Neurosci. 2022;16:1022754. doi: 10.3389/fncel.2022.1022754. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Wątroba S, Wiśniowski T, Bryda J, et al. The role of matrix metalloproteinases in pathogenesis of human bladder cancer. Acta Biochim Pol. 2021;68(4):547–55. doi: 10.18388/abp.2020_5600. [DOI] [PubMed] [Google Scholar]


