Abstract
目的
基于图论分析探讨宫颈癌放疗后癌因性失眠患者脑功能网络小世界和节点属性的变化,并明确功能网络与个体-靶向经颅磁刺激(IT-TMS)治疗失眠效果的相关性。
方法
采集30名患者和30名相匹配的健康对照者的静息态功能磁共振(rs-fMRI)数据,患者接受加速智能神经调节TMS疗法治疗;使用图论分析,通过GRETNA软件提取失眠中小世界网络的属性特征和构建功能连通性矩阵;收集患者IT-TMS治疗前后的和健康对照者的匹兹堡睡眠质量指数(PSQI)、失眠严重程度指数(ISI)、焦虑自评量表(SAS)和抑郁自评量表(SDS)等量表,研究失眠改善与功能网络的相关性;统计分析采用SPSS软件及基于网络的统计分析方法。
结果
两组在年龄和受教育程度方面差异均无统计学意义(P>0.05),在PSQI、ISI、SAS和SDS量表数据差异有统计学意义(P<0.05);两组均符合小世界网络属性,与对照组相比,在基线时患者组小世界网络全局属性表现出σ、EI、Cp和Lp显著减少(P<0.05),Eg显著增加(P<0.05),这些特征在IT-TMS治疗后均有所改善,且失眠症状显著改善;经IT-TMS治疗后节点网络功能连接减少,且右侧岛叶和左侧额上回之间的功能连通性减少与ISI评分的改善相关。
结论
宫颈癌放疗后癌因性失眠患者大脑网络信息整合能力受损,IT-TMS通过降低默认网络和突显网络的超连通性,显著改善了失眠症状。
Keywords: 宫颈癌, 放疗, 癌因性失眠, 图论分析, 小世界网络, 个体-经颅磁刺激
Abstract
Objective
To analyze the changes of brain small-world and node function network properties in patients with insomnia following radiotherapy for cervical cancer based on graph theory analysis and explore the correlation between functional networks and the clinical efficacy of individual-target transcranial magnetic stimulation (IT-TMS) for treatment of insomnia.
Methods
The resting state functional magnetic resonance imaging (rs-fMRI) data were collected from 30 patients with insomnia following radiotherapy for cervical cancer and 30 matched healthy individuals. All the patients received accelerated intelligent neuromodulation TMS therapy. Using graph theory analysis and GRETNA software, the functional connectivity matrices were constructed and the attribute features were extracted. The scores on the Pittsburgh Sleep Quality Index (PSQI), Insomnia Severity Index (ISI), Self-Rating Anxiety Scale (SAS), and Self-Rating Depression Scale (SDS) of the participants were collected before and after IT-TMS, and the correlation between improvement in insomnia and the functional network was investigated.
Results
The two groups matched for age, gender, and education level (P>0.05) showed significant differences in PSQI, ISI, SAS and SDS scores (P<0.05). Both groups showed attributes of the small-world network. Compared with the healthy individuals, the patients showed significantly decreased σ, EI, Cp and Lp (P<0.05) and increased Eg (P<0.05) at baseline, which, along with insomnia symptoms, were all improved after IT-TMS treatment. The patients showed reduced functional connections of the node network at follow-up compared with the baseline, and the low functional connectivity between the right insula and left superior frontal gyrus was correlated with the improvement of ISI scores.
Conclusion
The patients with insomnia following radiotherapy for cervical cancer have impaired information integration ability of the brain network, IT-TMS can significantly improve insomnia symptoms by reducing the hyperconnectivity between the default mode network and the salience network.
Keywords: cervical cancer, radiotherapy, insomnia, graph theory analysis, small-world network, individual-transcranial magnetic stimulation
失眠是世界范围内严重的公共卫生问题[1],其中继发性失眠是指有明确诱因的失眠[2, 3],在癌症群体中最常见的是继发癌因性失眠[4],即由于放疗化疗等治疗方式对人体正常组织的影响,患者接受治疗后均会存在疼痛感,伴随恶心、呕吐、厌食、疲劳等不适,引起癌因性失眠症状[5]。睡眠不足极易引起癌症患者免疫系统紊乱[6],降低生存时间和生存质量。目前认知行为治疗和药物治疗是最常用的治疗手段,然而认知行为治疗需要较长的治疗周期,成本较高并且疗效有限[7];药物治疗有可能带来诸如记忆障碍和精神错乱等副作用[8],与癌症的药物治疗也可能产生相互干扰,因此亟需新的有效治疗手段。类比前期原发性失眠研究结果[9],从癌因性失眠患者大脑功能网络异常变化入手,寻找潜在的差异脑网络作为干预治疗的理论基础,目前还未见相关报道。
根据报道,在失眠患者中通常观察到膝下前扣带皮层的活动受损[10, 11],且失眠患者的杏仁核活动发生异常改变,对负性刺激的加工被强化并且持续时间更长[12, 13]。先前的研究发现,失眠患者的默认网络[14]和突显网络[15]表现出异常的连通性,这与主观睡眠障碍、高觉醒、不适应情绪调节和情绪状态整合紊乱有关[16]。此外,失眠患者的右侧额中回的灰质体积显著减少,影响边缘系统增强了负面经历的回忆[17]。这些结果表明广泛的功能网络异常可能是失眠的发病机制之一。然而上述对失眠发病的机制研究聚焦于某个单一脑区或者孤立核团的功能改变,无法从整体上把握失眠发生的脑网络机制,而图论分析是通过计算全局和局部的神经网络特征分析全脑连接组的拓扑结构[18],更适合阐明失眠患者潜在的病理生理机制,在癌因性失眠的研究还未见相关报道。本研究创新地通过基于静息态功能磁共振(rs-fMRI)数据的图论分析方法研究宫颈癌放疗后癌因性失眠患者小世界网络和节点网络的改变,并将个体-靶向经颅磁刺激(IT-TMS)和个体背外侧前额叶(DLPFC)靶点相结合,从而探究癌因性失眠发病的脑网络机制和TMS干预治疗的机制,为癌因性失眠的治疗提供新的理论基础,最终期望改善癌症患者的睡眠质量和生存质量。
1. 资料和方法
1.1. 研究对象
本研究收集2018年1月~2021年6月于陕西省肿瘤医院妇科肿瘤科就诊的宫颈癌患者。患者均处于ⅠA期、ⅠB1期或ⅡA1期,接受根治性放射治疗。由专业且经验丰富的医生进行标准化筛查,依据《精神障碍诊断和统计手册》第5版诊断为失眠。同步从本地社区招募年龄匹配的女性健康对照者。所有受试者均接受全面的身体和神经系统检查,并进行量表评估,包括匹兹堡睡眠质量指数(PSQI)量表,失眠严重程度指数(ISI)量表,焦虑自评量表(SAS)和抑郁自评量表(SDS)。患者须符合:PSQI得分≥8;没有其它睡眠障碍;年龄50~60岁。健康对照者须符合:无睡眠障碍史;PSQI≤7。两组均适用以下排除标准:有其它精神疾病;轮班工人;有其他睡眠障碍,如睡眠呼吸暂停;体质量指数≥30;有重大神经或医学疾病史;有酗酒、吸毒史;有MRI禁忌症,如幽闭恐惧症、金属植入物、起搏器等;怀孕、哺乳或处于月经期的女性患者。总共纳入30名患者和30名年龄和受教育程度相匹配的女性健康对照者。本研究已获得陕西省肿瘤医院研究伦理审查委员会的批准(医伦审【2017】第145号),纳入研究的受试者均已签署知情同意书。
1.2. 磁共振数据采集
影像采集均使用联影Discovery 770 3.0 T MRI扫描仪。受试者被要求在整个采集过程中保持静止和清醒,扫描在18点到20点之间进行。静息态功能成像采用以下参数:视野(FOV)=224 mm×224 mm,matrix=64×64,回波时间(TE)=30 ms,重复时间(TR)=2000 ms,层厚=4 mm,翻转角=90◦,voxel size=3.5 mm×3.5 mm×40 mm。T1加权图像采用以下参数:TR=7.24 ms,TE=3.10 ms,FOV=256 mm×256 mm,翻转角=10◦,层厚=0.5 mm,voxel size=0.5 mm×0.5 mm×1 mm。两组受试者均采用相同的参数。
1.3. 数据预处理
使用DPABI软件(http://rfmri.org/dpabi)对rs-fMRI图像进行预处理,该软件再现了REST(http://www.restfmri.net)和SPM12(www.fil.ion.ucl.ac.uk/spm)中的程序。去除前10幅图像以确保MRI信号稳定,然后对其余200张图像进行时间校正和运动校正,在此期间计算平均平移,排除平移大于2 mm或旋转大于2°的受试者数据。然后使用DARTEL方法将图像在空间上标准化到MNI空间,并使用半高全宽6 mm×6 mm×6 mm的高斯核进行平滑处理,随后进行时间带通滤波(0.01~0.08 Hz)。最后使用Friston-24模型回归脑脊液信号和白质头动信号。
1.4. 脑网络分析
根据图论分析,使用GRETNA软件(http://www.nitrc.org/projects/gretna/)分析脑网络属性。使用AAL图谱,将全脑分为116个网络节点,计算所有可能节点两两之间的时间序列的Pearson相关系数,为每个参与者生成一个116×116的相关矩阵。与之前的一项研究类似[19],为了确保所有参与者的节点和连接数量匹配,使用间隔为0.01稀疏阈值(8%≤s≤50%),将每个受试者的相关矩阵转换为二进制矩阵,从而在整个稀疏阈值范围内构建了大脑功能连接体,得到了聚类系数(Cp)、归一化聚类系数(γ)和本地效率(El)等功能分离指标,特征路径长度(Lp)、归一化特征路径长度(λ)和全球效率(Eg)等功能整合指标,以及小世界指标σ(σ=γ/λ)。计算每个网络指标的曲线下面积(AUC),以进行进一步的统计比较。
1.5. TMS治疗
使用磁刺激器(深圳英智)结合神经导航机器人(黑海豚®,西安索立德)进行IT-TMS治疗。参考之前的研究[20]方法确定个体左侧DLPFC刺激靶点。首先,采用层次凝聚聚类算法将DLPFC和膝下前扣带皮层(sgACC)划分为根据相关体素配对定义的多个功能亚核团。对于每个功能亚核团,可以识别出一个单一的时间序列值,它表示与中值时间序列相关性最强的时间序列。其次,计算了亚核团间Spearman相关系数矩阵。最后,通过考虑亚核团与目标靶区的负相关性,亚核团的体素大小、空间浓度和分散度来确定DLPFC中的最优刺激靶点,在90%的静息运动阈值下,每天进行10次间歇性θ脉冲刺激(iTBS)治疗:每次输出1800个脉冲,间隔50 min进行下一次治疗,连续治疗5 d(共90 000个脉冲)。
1.6. 统计学分析
使用SPSS18.0软件进行卡方检验和t检验,比较失眠患者和健康对照者的人口统计学和临床量表差异,以P<0.05为差异有统计学意义。采用双样本t检验或配对样本t检验鉴别网络指标的变化,显著性阈值设置为P<0.05,并使用错误发现率(FDR)标准对多重比较进行校正。将预处理步骤中计算出的年龄和平均平移作为协变量。最后,使用基于网络的统计分析(NBS)方法来确定两组(基线时患者组和随访时患者组,随访时间点是IT-TMS治疗结束后的第10天)间功能连通性的显著性差异,使用BrainNet软件对NBS揭示的有统计学差异脑区进行可视化显示。提取显示异常差异(患者组基线时与随访时比较,与健康对照组比较)的每个网络指标的AUC值,用MedCalc软件计算得出P值,使用SPSS软件进行Pearson分析检验网络指标的变化与临床评分之间的相关性。区域节点参数包括节点中心度、节点效率和节点介素。
2. 结果
2.1. 人口统计学分析及临床量表
所有的受试者都是右利手。两组在年龄和受教育程度上无统计学差异(P>0.05,表 1)。失眠患者的PSQI、ISI、SAS和SDS评分均显著高于健康对照者(P<0.01,表 1)。经IT-TMS治疗后,所有评分均有显著改善(P<0.01,表 2)。平均平移显示的头动在患者组基线时与随访时没有显著差异(P>0.05,基线时平均平移0.137± 0.031,随访时平均平移0.129±0.025),在基线时患者组与健康对照组也没有显著差异(P>0.05,健康对照组平均平移0.128±0.019)。
表 1.
人口统计学及临床量表结果
Demographic and clinical characteristics of the participants
| Characteristics | Patients (n=30) | Healthy controls (n=30) | P |
| PSQI: Pittsburgh sleep quality index; ISI: Insomnia severity index; SAS: Self-rating anxiety scale; SDS: Self-rating depression scale; N/A: Not applicable. | |||
| Age (years) | 52.5±6.4 | 53.7±6.3 | 0.89 |
| Education (years) | 16.7±3.8 | 17.1±2.6 | 0.79 |
| Duration of insomnia (months) | 36.1±10.5 | N/A | N/A |
| PSQI | 13.7±2.4 | 4.69±1.6 | < 0.01 |
| ISI | 21.5±3.2 | 4.65±3.3 | < 0.01 |
| SAS | 54.3±7.6 | 42.3±7.0 | < 0.01 |
| SDS | 56.8±9.2 | 44.4±7.1 | < 0.01 |
表 2.
IT-TMS治疗前后的临床量表结果
Clinical characteristics of the patients before and after IT-TMS
| Characteristics | Baseline (n=30) | Follow-up (n=30) | P |
| PSQI: Pittsburgh sleep quality index; ISI: Insomnia severity index; SAS: Self-rating anxiety scale; SDS: Self-rating depression scale. | |||
| PSQI | 13.7±2.4 | 6.9±2.3 | < 0.01 |
| ISI | 21.5±3.2 | 6.9±2.1 | < 0.01 |
| SAS | 54.3±7.6 | 47.4±6.6 | < 0.01 |
| SDS | 56.8±9.2 | 46.2±6.7 | < 0.01 |
2.2. 小世界网络全局拓扑属性
在0.08~0.48的稀疏阈值下,所有3组(健康对照组,基线时患者组,随访时患者组)的功能网络均符合小世界网络属性(σ > 1,γ > 1,λ ≈ 1,图 1A~C)。双样本t检验显示,与健康对照组相比,基线时患者组小世界网络表现出显著减少的小世界属性σ(图 1A),更低的功能分离指标(EI和Cp,图 1D、E)和异常的功能整合指标(增加的Eg和减少的Lp,图 1F、G)。患者组经IT-TMS治疗后,随访时的上述小世界指标相较于基线时发生了显著逆转(P<0.05),功能分离和功能整合效率得到了改善。
图 1.
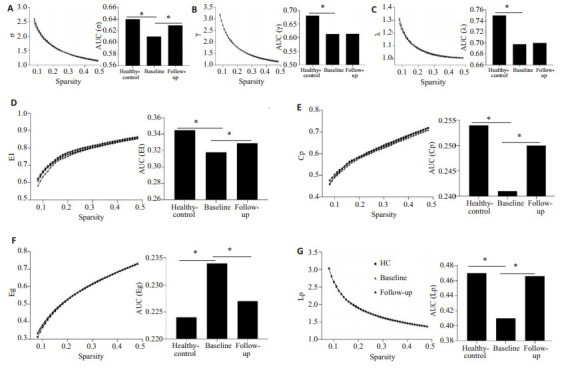
小世界网络全局拓扑属性的改变
Alteration of global topological properties of small-world network across the sparsity in the two groups. A: σ; B: γ; C: λ; D: EI; E: Cp; F: Eg; G: Lp. HC: health control. *P<0.05.
2.3. 节点网络局部拓扑属性
基于NBS和配对t检验计算,将患者组经IT-TMS治疗后与基线时患者组之间网络拓扑和区域网络的差异进行了评估,获得有差异的脑区间连接(Edge)和节点(Node),使用BrainNet软件对NBS揭示的有统计学差异脑区进行可视化显示,发现在随访时与基线时相比节点网络间的功能连接减少,主要变化的节点区域有:左侧:前扣带回,额上回,顶上回,丘脑,杏仁核;右侧:前扣带回,额上回,颞中回,丘脑,岛叶和杏仁核(图 2,表 3)。
图 2.

IT-TMS治疗后节点网络局部拓扑属性的改变
Alteration of local topological properties of the node network after IT-TMS treatment in the patients. L: left; R: right.
表 3.
局部拓扑属性改变的节点网络参数
Network parameters of the nodes with altered local topological properties
| Regions | Betweenness (P) | Centrality (P) | Nodal efficiency (P) |
| Baseline>follow-up | |||
| Left | |||
| Anterior cingulate gyrus | 0.0002 | 0.0009 | 0.0027 |
| Superior frontal gyrus | 0.0033 | 0.0138 | 0.0269 |
| Superior parietal gyrus | 0.0017 | 0.0147 | 0.0400 |
| Thalamus | 0.0005 | 0.0318 | 0.0179 |
| Amygdala | 0.0018 | 0.2467 | 0.1377 |
| Right | |||
| Anterior cingulate gyrus | 0.0002 | 0.0301 | 0.0345 |
| Superior frontal gyrus | 0.0030 | 0.0006 | 0.0010 |
| Middle temporal gyrus | 0.1221 | 0.0050 | 0.0489 |
| Thalamus | 0.0004 | 0.0158 | 0.0031 |
| Insula | 0.0009 | 0.0344 | 0.0413 |
| Amygdala | 0.0015 | 0.1358 | 0.1547 |
2.4. 功能连接与临床改善的相关性
在患者组,未发现全局网络属性与临床量表评分的改变之间的相关性;ISI量表评分的改变与右侧岛叶和左侧额上回节点之间的功能连通性变化存在显著相关性(R2=0.276,P<0.01,图 3)。
图 3.

IT-TMS治疗后ISI量表的改善与功能连接变化的相关性
Correlation between functional connectivity changes and ISI improvement after IT-TMS treatment.
3. 讨论
本研究基于rs-fMRI数据首次使用图论分析发现宫颈癌放疗后癌因性失眠患者大脑网络表现出小世界属性,患者表现出以聚类系数降低等为主要特征的网络属性异常,表明宫颈癌放疗后癌因性失眠是一种不局限于单一脑区的、而是以整体脑网络连接异常为特征的疾病,患者的大脑网络信息整合能力受损。我们发现患者经IT-TMS作用于个体化DLPFC靶点治疗后,失眠症状均有显著缓解,且功能节点网络的局部连接也发生了显著降低,包括前扣带回,额上回,顶上回,颞中回,丘脑,岛叶和杏仁核等,表明节点在信息传输和整合中的作用改善,且TMS通过减少默认网络(额上回)和突显网络(前扣带回、丘脑、岛叶、杏仁核)的连通性发挥治疗效果,这些脑区是潜在的宫颈癌放疗后癌因性失眠诊断和治疗的影像学标记物。
使用fMRI数据的多个神经影像学研究提高了我们对失眠潜在的神经机制的理解。使用任务态的fMRI研究显示,失眠患者在执行任务中,额上回和额下回的活动减少[21, 22],杏仁核内情绪刺激异常激活[23, 24]。rs-fMRI研究评估低频振荡幅度(ALFF)和局部区域一致性(ReHo)在患者中也发现了异常[25, 26]。除了区域损伤外,功能连接信息提供了更多的失眠相关神经机制,研究人员发现杏仁核、岛叶、后扣带回和海马体存在异常的功能连接[27]。然而,这些研究都局限在某个孤立的大脑区域或单一功能连接上,而大脑是一个复杂的信息处理系统,可以协调多个区域作为一个网络,因此有必要从网络的角度来研究失眠的神经机制。
基于图论分析方法,我们使用GRETNA工具箱在全局网络水平上研究了大脑功能性连接体的拓扑特性,发现宫颈癌放疗后癌因性失眠患者在基线时表现出较差效率的小世界特性,以及异常的功能分离(El和Cp)和功能整合(Eg和Lp)指标(图 1)。功能分离是指局部网络效率,El和Cp的降低表明网络内相邻节点之间信息传输的速度受到了损害[28]。功能整合确保了跨区域信息的迅速传递,异常增强的功能整合(较高的Eg和较低的Lp)表明大脑网络中的并行信息传递受损,网络整体通信效率下降[29]。宫颈癌放疗后癌因性失眠患者El和Cp降低,这一变化也发生在原发性失眠患者中[13],说明失眠患者都表现出脑网络信息传输速度的下降。然而,与原发性失眠患者不同的是,Eg和Lp在宫颈癌放疗后癌因性失眠患者中发生改变,说明癌因性失眠还存在信息传输效率的下降。本研究表明,宫颈癌放疗后癌因性失眠是一种涉及多个神经回路的连接障碍疾病,而不是影响单一区域的局灶性病理。
根据高觉醒理论,难以入睡和维持睡眠的困难与功能连接程度的异常增加有关[16]。前期研究结果表明,在失眠患者中发现岛叶和丘脑的活动受损和连接异常上升[12, 15, 26, 27]。岛叶是突显网络中的一个重要区域,协助过滤不相关感觉信号并传递显著信息,有助于入睡;丘脑是高觉醒系统的一个关键区域,保护睡眠免受外部干扰,并筛选在正常睡眠中投射到大脑皮层的信息,有助于维持睡眠状态[30]。本研究使用IT-TMS治疗显著改善了失眠量表,缓解了失眠症状(表 2),并发现经TMS治疗后岛叶和丘脑相关的功能连通性降低(图 2,表 3),表明岛叶和丘脑屏蔽不相关信息并阻止来自上行网状激活系统感觉信号干扰的能力有所改善,这与高觉醒理论关于失眠和功能连接异常增加的表述一致[16],即失眠的改善与岛叶和丘脑的功能恢复密切相关[15, 27]。此外,失眠量表改善越多,右侧岛叶和左侧额上回的功能连接越少(图 3),提示TMS通过降低突显网络[15]和默认网络[14]的超连通性,抑制额上回对岛叶功能的干扰[16],增强岛叶过滤异常信号的能力,缓解失眠症状。
本研究仍有几点不足:未发现ISI量表的变化与小世界网络属性的改善之间的相关性,这可能是由于网络内相邻节点之间信息传输速度、网络整体通信效率的改善等小世界属性与失眠症状的改善趋势不一致,需要在更大样本中验证小世界网络与临床改善的相关性,并推广目前的结果;只探讨了静息功能组织的状态,而没有考虑大脑结构连接或其他动态功能连接,这些数据可以提供更可靠的信息;没有控制安慰剂效应,进一步的研究应该建立一个安慰剂对照的刺激[31]。总之,本研究提供了宫颈癌放疗后癌因性失眠症状所涉及的神经网络机制和IT-TMS改善失眠症状的脑网络机制的客观影像学证据,有利于加深对失眠的神经病理机制的了解,从而提供治疗失眠疾病的新视角。
Biography
刘欢,硕士,E-mail: 771383629@qq.com
Funding Statement
陕西省自然科学基础研究计划(S2020-JC-QN-0788)
Contributor Information
刘 欢 (Huan LIU), Email: 771383629@qq.com.
穆 允凤 (Yunfeng MU), Email: 837358473@qq.com.
References
- 1.Xue T, Wu X, Chen SJ, et al. The efficacy and safety of dual orexin receptor antagonists in primary insomnia: a systematic review and network meta-analysis. Sleep Med Rev. 2022;61:101573. doi: 10.1016/j.smrv.2021.101573. [DOI] [PubMed] [Google Scholar]
- 2.McCrae CS, Lichstein KL. Secondary insomnia: diagnostic challenges and intervention opportunities. Sleep Med Rev. 2001;5(1):47–61. doi: 10.1053/smrv.2000.0146. [DOI] [PubMed] [Google Scholar]
- 3.张 文宇, 李 军, 杨 金亮, et al. 继发性失眠的护理研究进展. 河北中医. 2015;(5):786–9. doi: 10.3969/j.issn.1002-2619.2015.05.053. [DOI] [Google Scholar]
- 4.Savard J, Savard MH. Insomnia and cancer. Sleep Med Clin. 2013;8(3):373–87. doi: 10.1016/j.jsmc.2013.04.006. [DOI] [Google Scholar]
- 5.Zhang H, Li Y, Li M, et al. A randomized controlled trial of mindfulness-based stress reduction for insomnia secondary to cervical cancer: sleep effects. Appl Nurs Res. 2019;48:52–7. doi: 10.1016/j.apnr.2019.05.016. [DOI] [PubMed] [Google Scholar]
- 6.Theobald DE. Cancer pain, fatigue, distress, and insomnia in cancer patients. Clin Cornerstone. 2004;6(1):S15–21. doi: 10.1016/S1098-3597(05)80003-1. [DOI] [PubMed] [Google Scholar]
- 7.Okajima I, Nakajima S, Ochi M, et al. Association among changes in sleep-related beliefs, sleep reactivity, and improvement of insomnia following cognitive behavioral therapy. SleepMed. 2017;29:96–7. doi: 10.1016/j.sleep.2016.08.021. [DOI] [PubMed] [Google Scholar]
- 8.Hrehová L, Mezian K. Non-pharmacologic treatment of insomnia in primary care settings. Int J Clin Pract. 2021;75(6):e14084. doi: 10.1111/ijcp.14084. [DOI] [PubMed] [Google Scholar]
- 9.Jiang CG, Zhang T, Yue FG, et al. Efficacy of repetitive transcranial magnetic stimulation in the treatment of patients with chronic primary insomnia. Cell Biochem Biophys. 2013;67(1):169–73. doi: 10.1007/s12013-013-9529-4. [DOI] [PubMed] [Google Scholar]
- 10.Yan CQ, Liu CZ, Wang X, et al. Abnormal functional connectivity of anterior cingulate cortex in patients with primary insomnia: a resting-state functional magnetic resonance imaging study. Front Aging Neurosci. 2018;10:167. doi: 10.3389/fnagi.2018.00167. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Zhu YF, Zhao XM, Yin H, et al. Functional connectivity density abnormalities and anxiety in primary insomnia patients. Brain Imaging Behav. 2021;15(1):114–21. doi: 10.1007/s11682-019-00238-w. [DOI] [PubMed] [Google Scholar]
- 12.Huang ZY, Liang PP, Jia XQ, et al. Abnormal amygdala connectivity in patients with primary insomnia: evidence from resting state fMRI. Eur J Radiol. 2012;81(6):1288–95. doi: 10.1016/j.ejrad.2011.03.029. [DOI] [PubMed] [Google Scholar]
- 13.黄 伟康, 李 志铭, 吴 水天, et al. 静息态功能磁共振成像分析原发性失眠患者大脑的小世界网络. 南方医科大学学报. 2021;41(3):424–9. [Google Scholar]
- 14.Pang R, Zhan YF, Zhang YL, et al. Aberrant functional connectivity architecture in participants with chronic insomnia disorder accompanying cognitive dysfunction: a whole-brain, data-driven analysis. Front Neurosci. 2017;11:259. doi: 10.3389/fnins.2017.00259. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chen MC, Chang CT, Glover GH, et al. Increased insula coactivation with salience networks in insomnia. Biol Psychol. 2014;97:1–8. doi: 10.1016/j.biopsycho.2013.12.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Lu FM, Liu CH, Lu SL, et al. Disrupted topology of frontostriatal circuits is linked to the severity of insomnia. Front Neurosci. 2017;11:214. doi: 10.3389/fnhum.2017.00214. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Tahmasian M, Noori K, Samea F, et al. A lack of consistent brain alterations in insomnia disorder: an activation likelihood estimation meta-analysis. Sleep Med Rev. 2018;42:111–8. doi: 10.1016/j.smrv.2018.07.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Xia MR, He Y. Functional connectomics from a "big data" perspective. NeuroImage. 2017;160:152–67. doi: 10.1016/j.neuroimage.2017.02.031. [DOI] [PubMed] [Google Scholar]
- 19.Song K, Li J, Zhu YQ, et al. Altered small-world functional network topology in patients with optic neuritis: a resting-state fMRI study. Dis Markers. 2021;2021:1–9. doi: 10.1155/2021/9948751. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cole EJ, Phillips AL, Bentzley BS, et al. Stanford neuromodulation therapy (SNT): a double-blind randomized controlled trial. Am J Psychiatry. 2022;179(2):132–41. doi: 10.1176/appi.ajp.2021.20101429. [DOI] [PubMed] [Google Scholar]
- 21.Altena E, Van Der Werf YD, Sanz-Arigita EJ, et al. Prefrontal hypoactivation and recovery in insomnia. Sleep. 2008;31(9):1271–6. [PMC free article] [PubMed] [Google Scholar]
- 22.Drummond SPA, Walker M, Almklov E, et al. Neural correlates of working memory performance in primary insomnia. Sleep. 2013;36(9):1307–16. doi: 10.5665/sleep.2952. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Baglioni C, Spiegelhalder K, Regen W, et al. Insomnia disorder is associated with increased amygdala reactivity to insomnia-related stimuli. Sleep. 2014;37(12):1907–17. doi: 10.5665/sleep.4240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.武 肖玲, 李 中林, 邹 智, et al. 失眠患者杏仁核功能连接的静息态功能磁共振成像. 中华实用诊断与治疗杂志. 2020;34(2):183–7. doi: 10.13507/j.issn.1674-3474.2020.02.023. [DOI] [Google Scholar]
- 25.Liu CH, Liu CZ, Zhang JH, et al. Reduced spontaneous neuronal activity in the insular cortex and thalamus in healthy adults with insomnia symptoms. Brain Res. 2016;1648:317–24. doi: 10.1016/j.brainres.2016.07.024. [DOI] [PubMed] [Google Scholar]
- 26.Wang TY, Li SM, Jiang GH, et al. Regional homogeneity changes in patients with primary insomnia. Eur Radiol. 2016;26(5):1292–300. doi: 10.1007/s00330-015-3960-4. [DOI] [PubMed] [Google Scholar]
- 27.Wang TY, Yan JH, Li SM, et al. Increased insular connectivity with emotional regions in primary insomnia patients: a resting-state fMRI study. Eur Radiol. 2017;27(9):3703–9. doi: 10.1007/s00330-016-4680-0. [DOI] [PubMed] [Google Scholar]
- 28.Duan J, Xia MR, Womer FY, et al. Dynamic changes of functional segregation and integration in vulnerability and resilience to schizophrenia. Hum Brain Mapp. 2019;40(7):2200–11. doi: 10.1002/hbm.24518. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Yu M, Dai ZJ, Tang XW, et al. Convergence and divergence of brain network dysfunction in deficit and non-deficit schizophrenia. Schizophr Bull. 2017;43(6):1315–28. doi: 10.1093/schbul/sbx014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Del Felice A, Formaggio E, Storti SF, et al. The gating role of the thalamus to protect sleep: an f-MRI report. Sleep Med. 2012;13(4):447–9. doi: 10.1016/j.sleep.2011.07.021. [DOI] [PubMed] [Google Scholar]
- 31.Wu GR, Wang XW, Baeken C. Baseline functional connectivity may predict placebo responses to accelerated rTMS treatment in major depression. Hum Brain Mapp. 2020;41(3):632–9. doi: 10.1002/hbm.24828. [DOI] [PMC free article] [PubMed] [Google Scholar]


