Abstract
Die Ursachen der postinterventionellen Gewichtszunahme nach Lebensstiländerung, psychologischer Therapie, Pharmakotherapie oder chirurgischen Maßnahmen gehen weit über einen Motivations- oder Compliance-Verlust der Betroffenen hinaus. Der Gewichtszunahme liegen komplexe periphere und zentrale Mechanismen zugrunde, deren Ausmaß individuell unterschiedlich zu sein scheint und die darauf ausgerichtet sind, die Nahrungszufuhr durch reduziertes Sättigungs- und vermehrtes Hungergefühl zu erhöhen (gastrointestinale Hormone) und den Energieverbrauch zu reduzieren (metabolische Adaptierung). Diese Mechanismen erschweren das Abnehmen und Gewichthalten in einem „adipogenen“ Lebensraum, wie wir in weltweit immer häufiger vorfinden, ungemein. Das Verständnis dieser molekularen Mechanismen sollte in die Planung von Therapieprogrammen zur langfristigen Gewichtsreduktion, welche eine entsprechende Nachsorge zur Prävention und individualisierten Therapie einer postinterventionellen Gewichtszunahme beinhalten sollten, miteinbezogen werden. Dabei empfiehlt es sich, die therapeutischen Maßnahmen und Kontrollintervalle nach dem Ausmaß der Gewichtszunahme pro Zeitintervall auszurichten.
Schlüsselwörter: Adipositas, Metabolische Adaptierung, Lebensstil, Energieverbrauch, Hunger und Sättigung
Abstract
Decreasing levels of patient motivation or compliance are far from being the only causes of postinterventional weight regain after lifestyle, psychological, pharmacological and surgical interventions. Weight regain originates from a complex and individually varying set of central and peripheral mechanisms, with the overall purpose of increasing food intake by both stimulating hunger and reducing satiety (mediated by gastrointestinal hormones) and decreasing the body’s energy demands (via metabolic adaption). These mechanisms counteract any attempts to reduce or maintain body weight in today’s increasingly prevalent adipogenic environments. The knowledge about the biological mechanisms of body weight regulation should be taken into consideration when planning treatment programs for long-term weight reduction, including follow-up treatment for the prevention and individualized treatment of postinterventional weight regain. Therapeutic measures as well as the frequency of medical follow-ups should be based on the extent of weight regain.
Keywords: Obesity, Metabolic adaptation, Lifestyle, Energy expenditure, Hunger and satiety
Als postinterventionelle Gewichtszunahme („weight regain“) bezeichnet man jenen Prozess, im Zuge dessen es nach einer Maßnahme zur Gewichtsreduktion zu einer neuerlichen Gewichtszunahme kommt. Eine Gewichtszunahme nach einer Intervention (Lebensstiländerung, psychologische Therapie, Pharmakotherapie oder chirurgische Maßnahmen) ist häufig. Sie beruht auf hormonellen und metabolischen Veränderungen, Wiederauftreten von gewichtsfördernden Verhaltensmustern, fehlender Therapieadhärenz, psychosozialen Problemen, psychischen Erkrankungen und anatomischen Adaptierungen nach operativen Eingriffen zur Gewichtsreduktion (Tab. 1; [1]). Maßnahmen zur Vermeidung und Behandlung einer postinterventionellen Gewichtszunahme (Tab. 2) sollten ein grundlegender Bestandteil jeglicher Adipositastherapie sein [2, 3].
| 1.1. Metabolische und therapeutische Faktoren |
|
Veränderte Medikation, gewichtsfördernde Medikamente: – Antidepressiva: Mirtazapin, Paroxetin, Amitriptylin, Nortriptylin – Antipsychotika: Lithium – Neuroleptika: Clozapin, Olanzapin – Antidiabetika: Insulin, Sulfonylharnstoffe, Glitazone – Antihypertensiva: Betablocker – Kontrazeptiva: Gestagene – Kortikosteroide |
|
Vorliegen einer Endokrinopathie: – Hypercortisolismus – Schilddrüsenfunktionsstörung – Androgene Tumoren – Polyzystisches Ovarsyndrom |
| Genetische Syndrome (z. B. Prader-Willi-Syndrom) bei Auftreten von Adipositas bereits im Kindesalter |
| Niedriger Anteil an aktiver Körperzellmasse (BCM) |
| Vermehrter Hunger, verminderte Sättigung |
| 1.2. Verhaltens- und Umgebungsfaktoren |
| Zu geringes Bewegungspensum, -angebot |
| Sozioökonomische Grundlagen |
| 1.3. Psychologische Faktoren [24–30] |
|
Psychische Erkrankungen: – Essstörungen – Depressionen – Persönlichkeitsstörungen (z. B. Borderline-Syndrom) – Angststörungen – Suchterkrankungen – Schizophrenie – Traumatische Erlebnisse |
| Substanzgebundene (Nahrungsmittel) und -ungebundene (Essverhalten) Suchtsymptomatik, u. a. chemisches und emotionales Craving, Kontrollverlust, Rückfallmanagement |
| Krankhafte Essmuster (s. unten) |
| Soziokulturelle Grundlagen (z. B. Biografie, Lerngeschichte, Kultur, Wirtschaft) |
| Über die Energiezufuhr hinausgehende Funktionen des Essens (u. a. Belohnungs- und Verstärkersystem, Entspannung, Langeweile, Stressabbau, unbewusstes Essen, mangelnde Impulskontrolle) |
| Selbstbild, Selbstwert |
| 1.4. Diätetische Faktoren |
| Zu hohe Energiezufuhr |
|
Krankhafte Essmuster: – Essattacken (Binge Eating) – Permanentes „Dahinessen“ (Grazing) – Essen in der Nacht (Night-Eating-Syndrom) – Primäre Aufnahme von weichen Speisen (Soft-Food-Syndrom) – Vermeidendes Essverhalten nach bariatrischer Chirurgie („Postsurgical Eating Avoidance Disorder“) – Andere Essstörungen |
| 1.5. Anatomische und chirurgische Faktoren nach bariatrischer Operation |
| Dilatation der gastrojejunalen Anastomose: Durch Erweiterung der Anastomose zwischen Magenpouch und Jejunum kann es zu einer schnelleren Pouchentleerung und somit verminderten Restriktion kommen. Neben einer Gewichtszunahme kann dies auch zu Dumpingsymptomatik, besonders bei Nahrungsaufnahme nichtkomplexer Kohlenhydrate, führen [31] |
| Dilatation des Magenpouches: Besonders bei High-Volume-Eatern, die trotz Sättigungsgefühl weiter essen, kann es zu einer Vergrößerung des Fassungsvolumens des Pouches, verminderten Restriktion und somit Zunahme der möglichen Portionsgrößen kommen [32, 33] |
| Vorhandensein einer gastrogastralen Fistel: Besonders bei PatientInnen mit chronischen Ulzera kann eine Verbindung zwischen Pouch und Restmagen entstehen. Dadurch kommen sowohl der Restmagen als auch der ausgeschaltete biliopankreatische Schenkel wieder in die Nahrungspassage [34] |
| Fundusrest: Bleibt bei der primären Operation ein Teil des Fundus am Pouch bestehen, so kann es nach initialer Gewichtsabnahme wieder zu einer Gewichtszunahme kommen [32, 35] |
| Dünndarmadaptation: Wenige PatientInnen leiden trotz einwandfreien Pouches unter einer Gewichtszunahme. Dies kann auf eine Adaption des in der Essenspassage verbliebenen Dünndarms, der die Nahrungsaufnahme des aus der Passage genommenen Dünndarms ausgleicht, zurückgeführt werden [32, 36] |
| 2.1. Medizinische, diätologische, sportmedizinische und psychologische Kontrolltermine |
| Kontrolle der Umsetzung von diätetischen Empfehlungen |
| Überprüfung des aktuellen Ausmaßes und der Arten der Bewegung (s. Tab. 2, Maßnahmen 2.4) |
| Evaluierung psychosozialer Veränderung (privates und berufliches soziales Umfeld, subjektive Erwartungen und Bedürfnisse etc.) |
| Evaluierung hinsichtlich des Auftretens von Depressionen, Suchtverschiebung und anderer psychischer Erkrankungen |
| Entwicklung von krankhaftem Essverhalten (s. Tab. 1, Faktoren 1.4) |
| 2.2. Eigenbeobachtung |
| Führung eines Ernährungs‑, Bewegungstagebuches [2] |
| Verwendung eines Schrittzählers, Aktivitätstrackers [21, 37] |
| Regelmäßige Gewichtskontrollen (1- bis 2‑mal/Woche) [2] |
| Bewusstmachung/Stärkung der Wahrnehmung von Essverhalten und Umgang damit (s. Tab. 2, Maßnahmen 2.5) |
| 2.3. Diätetische Maßnahmen |
| Individuell angepasste Empfehlungen, die den Energie- und Eiweißbedarf, die Vorlieben, Unverträglichkeiten, Vortherapien (konservativ, bariatrisch) und Begleiterkrankungen der PatientInnen berücksichtigen [21] |
| Exploration von möglichen Ernährungsdefiziten |
|
Exploration folgender Faktoren: – Aktuelle Ernährungs- und Trinkgewohnheiten (cave: Softdrinks, Alkohol) – Aufklärung/Erlernen der Unterscheidung zwischen Durstgefühl und Hunger – Umgang mit Heißhunger/Gusto/Snacking – Planung von regelmäßigen Mahlzeiten, Mahlzeitenabständen – Bewusstes Essen mit Wahrnehmen von Essgeschwindigkeit und Kaufrequenz |
| Intermittierender Einsatz von Formuladiäten zur Gewichtsstabilisierung [23] |
| 2.4. Bewegungsmaßnahmen [20, 38, 39] |
| Bewegung mit mittlerer Intensität im Ausmaß von mindestens 150 min, besser 250–300 min pro Woche; dies entspricht etwa einem zusätzlichen Energieverbrauch von 2000 kcal pro Woche. Zusätzlich mindestens 2 Einheiten mit muskelkräftigender Bewegung (je mindesten 10 min) |
| Reduktion der sitzenden Tätigkeiten |
| Erhöhung der Alltagsaktivität |
| 2.5. Psychologische Maßnahmen [40] |
| Eingeübte Verhaltensänderungsstrategien [41] und Zielorientierung [42] evaluieren |
| Reflexion von individuellem Emotions- und Stressmanagement [42] sowie Evaluierung der Copingstrategien (u. a. Entspannungstraining, Achtsamkeitsübungen) und der Rückfallprophylaxe |
| Intrinsische Motivation [24], Selbstführsorge und Selbstwirksamkeit fördern und stärken |
|
Spezielle Aspekte, die bei PatientInnen nach bariatrischer Operation besonders berücksichtigt werden sollten: – Jegliche Psychopathologie kann das Outcome beeinflussen [43–45] – Abklärung der Suizidalität [44, 46–48] – Suchtverlagerung [36], Substanzmissbrauch und selbstschädigendes Verhalten [43, 46–50] – Förderung des positiven Einflusses von psychosozialen Interventionen [48] – Abklärung traumatischer Erlebnisse [25] – Längerfristige postoperative Begleitung begünstigt den Erhalt der Gewichtsreduktion [51] |
| Bei Vorhandensein von psychischen Erkrankungen und/oder psychopharmakologischer Medikation empfiehlt sich bereits präinterventionell und insbesondere bei Auftreten einer postinterventionellen Gewichtszunahme und/oder Verschlechterung des psychischen Befindens eine rasche Kontaktaufnahme mit der/dem behandelnden PsychologIn und FachärztIn |
| Exploration psychischer Befindlichkeiten und klinischer Symptome (Entwicklung von psychischen Störungen, Suchtverlagerung hin zu substanzgebundenen und -ungebundenen Süchten) [52] |
| Auffälligkeiten im Ess- und Trinkverhalten, die eine Gewichtszunahme begünstigen, abklären und bearbeiten (u. a. Craving, Grazing, Nibbling, Loss of Control Eating, Overeating, Emotional Eating, Chewing and Spitting, Night-Eating-Syndrom) |
| 2.6. Medizinische Maßnahmen |
| Anpassung der Medikation an den Therapieverlauf und Begleiterkrankungen |
| Fortführung bzw. Start mit einer antiadipösen Pharmakotherapie (GLP-1 Rezeptoragonisten (zukünftig GIP/GLP-1 Rezeptoragonisten), Naltrexon/Bupropion, Lipasehemmer) insbesondere bei einer moderaten bzw. raschen klinisch relevanten Gewichtszunahme (s. Abschnitt „Beurteilung einer relevanten postinterventionellen Gewichtszunahme“) [21, 22] |
| Exploration von möglichen Mikro- und Makronährstoffdefiziten |
| Internistische Evaluierung bei atypischem Therapieverlauf bzw. unklarer Gewichtszunahme, ggf. erneute endokrinologische Diagnostik bei klinischen/laborchemischen Auffälligkeiten |
| Evaluierung der Möglichkeit für einen Rehabilitationsaufenthalt mit Stoffwechselschwerpunkt |
| 2.7. Chirurgische Maßnahmen |
| Die Art der Reversionsoperation sollte im Kontext mit den Ursachen der Gewichtszunahme stehen [1]: |
| Pouchresizing [32, 33] |
| Pouchbanding [53] |
| Pouchresizing + Pouchbanding, um Redilatation zu verhindern [32] |
| Neuanlage der gastrojejunalen Anastomose; endoskopische Verengung der gastrojejunalen Anastomose [54] |
| Versetzen der Fußpunktanastomose (Verlängerung des komplett aus der Essenspassage genommenen biliopankreatischen Schenkels) [36] |
| Umwandlungsoperation: Bei PatientInnen mit „sleeve gastrectomy“ kann bei klinisch relevanter Gewichtszunahme eine Umwandlung auf Y‑Roux-Magenbypass oder „single anastomosis duodeno-ileal bypass + sleeve gastrectomy“ (SADI-S) erfolgen, um eine Malabsorption hinzuzufügen [55] |
Physiologische Grundlagen der Gewichtszunahme
Gastrointestinale Hormone
Gastrointestinale Hormone konnten als zentrale Regulatoren des Energiestoffwechsels identifiziert werden. Sie regulieren homöostatische und hedonische Kreisläufe, welche das Essverhalten beeinflussen und eine adäquate Kalorienaufnahme zur Energiebedarfsdeckung gewährleisten. Die veränderte Hormonsekretion nach Gewichtsreduktion ist eine zentrale Ursache der Aktivierung von physiologischen Prozessen, welche eine neuerliche Gewichts- und Körperfettzunahme bewirken [4]. Hierbei kommt es zu kompensatorischen Änderungen im Hormonprofil mit einer reduzierten Sekretion von anorexigenen Hormonen wie „glucagon-like peptide 1“ (GLP-1), Peptide YY (PYY), Cholecystokinin (CCK), Amylin und Leptin sowie zu steigenden Spiegeln von orexigenen Hormonen wie Ghrelin und pankreatischem Polypeptid. Diese Anpassungen resultieren in einem vermindertem Sättigungsgefühl, vermehrtem Hungergefühl und einem gesteigertem Verlangen nach Nahrung [5–8].
Nach einer Gewichtsabnahme konnten im Vergleich zu einer normalgewichtigen Gruppe bei Menschen mit Adipositas niedrigere postprandiale Spiegel von GLP‑1, PYY und CCK bis zu einem Jahr nach der Intervention gefunden werden [9–11]. Das Ansprechen auf Veränderungen der gastrointestinalen Hormone im Zuge einer Kalorienrestriktion scheint variabel und somit mitbestimmend für das individuelle Risiko einer postinterventionellen Gewichtsabnahme zu sein [4].
Metabolische Adaptierung
Der Grundumsatz (GU) beträgt rund 60–70 % des täglichen Gesamtenergiebedarfs und ist hauptsächlich von der Körperzusammensetzung, insbesondere der fettfreien Masse (FFM) abhängig. Eine Abnahme der FFM geht mit einer Reduktion des GU einher. Allerdings kommt es nach einer Gewichtsreduktion zu einer größeren Abnahme des GU als ausschließlich durch die Änderung der Körperzusammensetzung zu erklären wäre. Dieser Unterschied wird als metabolische Adaptierung (MA) bezeichnet und kann ein klinisch relevantes Ausmaß annehmen. Es wird angenommen, dass auch hormonelle Faktoren (Leptin, Schilddrüsenhormone, Insulin) für die Reaktion des Körpers auf eine Kalorienrestriktion über Beeinflussung der Herzfrequenz, des Blutdrucks und des sympathischen Nervensystems, verantwortlich sein dürften [12–15]. Es konnte gezeigt werden, dass die MA über einen längeren Zeitraum und auch nach einer Gewichtszunahme bestehen bleiben kann [15]. Individuelle Abweichungen in der MA könnten mitverantwortlich für Unterschiede bei der postinterventionellen Gewichtszunahme sein [16].
Neurobiologische Vulnerabilität
Heißhunger und das Ansprechen auf Nahrungsreize nehmen insbesondere bei Menschen zu, die sich einer Kalorienrestriktion unterziehen. Dieser Effekt scheint bei Menschen mit Adipositas besonders ausgeprägt zu sein [17, 18]. Diese Vulnerabilität dürfte deutlichen individuellen Schwankungen unterliegen. Mittels funktioneller Magnetresonanztomographie wird versucht, prädiktive neurobiologische Marker im Belohnungssystem, die appetitanregende Kreisläufe aktivieren und so zu Hyperphagie und Gewichtszunahme führen, zu identifizieren [19]. Diesbezüglich steht die Forschung jedoch noch am Anfang.
Beurteilung einer relevanten postinterventionellen Gewichtszunahme
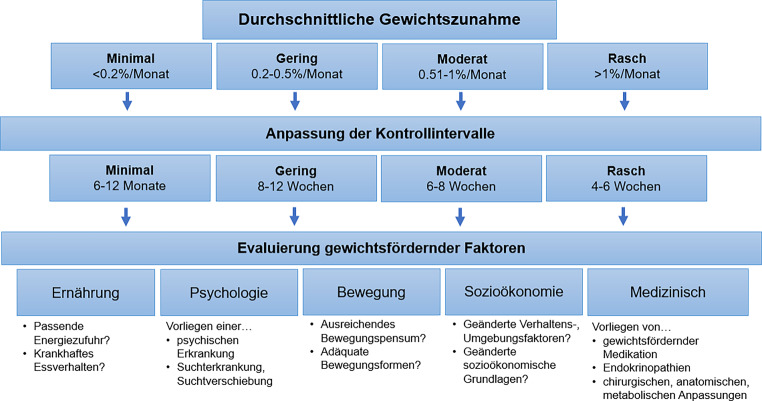
Da der Energiebedarf direkt mit der Körpermasse in Verbindung steht, wird die Verwendung des Nadir-Gewichts als Referenz zur Beurteilung einer relevanten Gewichtszunahme empfohlen. Sie sollte pro Zeitintervall abgebildet werden [14]. Das Ausmaß der durchschnittlichen Gewichtszunahme pro Monat, ausgehend vom Nadir-Gewicht, kann folgendermaßen beurteilt werden:
minimal: < 0,2 %,
gering: 0,2 bis < 0,5 %,
moderat: 0,5–1 %,
rasch: > 1 %.
Eine rasche Gewichtszunahme von > 1 % pro Monat führt somit zu einer klinisch relevanten Gewichtsveränderung von > 5 % innerhalb von 6 Monaten. Um einer Gewichtszunahme zeitnah entgegenwirken zu können, empfiehlt es sich, mit dem Patienten am vorläufigen Interventionsende, ein „Warngewicht“, dass sich an einer durchschnittlichen geringen Gewichtszunahme (< 0,5 % pro Monat) orientiert, zu vereinbaren.
Beispiel: Ein Patient wiegt nach der Intervention 100 kg (= Nadir-Gewicht). Ein Warngewicht von 5 kg, das wäre eine Gewichtszunahme von < 0,5 % vom Nadir-Gewicht über 12 Monate, wird vereinbart.
Bei Erreichen des Warngewichts sollte eine rasche Kontrolle am betreuenden Zentrum bzw. der Ordination erfolgen, um individuelle Maßnahmen zur Vermeidung einer weiteren Gewichtszunahme einzuleiten [2, 14].
Maßnahmen zur Prävention von Gewichtszunahme
Präinterventionelle Abklärung und Aufklärung
Eine sorgfältige präinterventionelle Abklärung zur Identifikation von Faktoren, welche eine postinterventionelle Gewichtszunahme begünstigen (Tab. 1), wird empfohlen. Zusätzlich sollten mit den PatientInnen die physiologischen Mechanismen einer Gewichtsreduktion bzw. -zunahme und die damit verbundenen Benefits und Risiken für die persönliche Gesundheit besprochen werden, um das Verständnis für die geplanten Maßnahmen zu stärken. Für die Gewichtsreduktion soll eine sinnvolle Geschwindigkeit und eine klare, realistische Zieldefinition (hinsichtlich Köpergewicht, Kleidergröße, Bewegungsziele etc.) vorgegeben werden [3, 20].
Postinterventionelle Vereinbarungen und Monitoring
Postinterventionelle Vereinbarungen sollen regelmäßige Gewichtskontrollen (1- bis 2‑mal pro Woche) sowie ein individuelles Warngewicht (s. oben) umfassen [2]. Im ersten Jahr nach konservativer Gewichtsabnahme und bariatrischer Operation [1] sollen regelmäßige medizinische, diätologische, sportmedizinische und psychologische Kontrolltermine, zumindest alle 3 Monate, eingeplant werden (Tab. 2, Maßnahmen 2.1). Die Kontrollintervalle sollen abhängig vom Ausmaß der Gewichtszunahme angepasst werden (Abb. 1; [14]). Bei Erreichen des vereinbarten Warngewichts wird eine umgehende Wiedervorstellung im betreuenden Zentrum/in der Ordination empfohlen [2].
Pharmakotherapie
Allfällige medikamentöse Therapie sollte v. a. hinsichtlich möglicher gewichtssteigernder Medikamente (Tab. 1, Faktoren 1.1) evaluiert werden [21]. Zusätzlich ist die Einleitung bzw. Anpassung einer antiadipösen Pharmakotherapie (GLP-1 Rezeptoragonisten, Naltrexon/Bupropion, Lipasehemmer) zu erwägen [1, 20–22].
Management von PatientInnen mit Gewichtszunahme
Bei einer minimalen bis geringen Gewichtszunahme stehen die Evaluierung und Forcierung der Lebensstilmaßnahmen (Ernährung, Bewegung, Verhalten; Tab. 2, Maßnahmen 2.3–2.5) im Vordergrund. Bei den jeweiligen Kontrollterminen, deren Intervalle an die Geschwindigkeit der Gewichtszunahme angepasst werden sollten, empfiehlt sich die Erhebung von gewichtsfördernden Faktoren (Tab. 1). Bei moderater und rascher Gewichtszunahme sollte neben den Lebensstilmaßnahmen an eine Erweiterung der Therapie mit ggf. Einsatz einer Pharmakotherapie zur Gewichtsreduktion und/oder chirurgischen Maßnahmen gedacht werden [1, 20–23].
Rehabilitationsaufenthalt mit Stoffwechselschwerpunkt
Eine stationäre Rehabilitation empfiehlt sich, um Abstand von den Alltagsroutinen zu bekommen und die biopsychosozialen Umstände der neuerlichen Gewichtszunahme hinterfragen, verstehen und verändern zu können. Daran anschließend sollte dem/der PatientIn eine längerfristige multiprofessionelle Begleitung im Alltag (medizinisch, psychologisch, diätologisch) angeraten werden.
Funding
Open access funding provided by Medical University of Vienna.
Interessenkonflikt
R. Kruschitz, M. Fahrnberger, D.M. Felsenreich, C. Ress, B. Andersen, K. Aydinkoc-Tuzcu, C. Ciardi, S.L. Huber und F.W. Kiefer geben an, dass kein Interessenkonflikt besteht.
Footnotes
Hinweis des Verlags
Der Verlag bleibt in Hinblick auf geografische Zuordnungen und Gebietsbezeichnungen in veröffentlichten Karten und Institutsadressen neutral.
Literatur
- 1.Busetto L, Dicker D, Azran C, Batterham RL, Farpour-Lambert N, Fried M, et al. Practical recommendations of the obesity management task force of the European Association for the Study of Obesity for the post-bariatric surgery medical management. Obes Facts. 2017;10:597–632. doi: 10.1159/000481825. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Durrer Schutz D, Busetto L, Dicker D, Farpour-Lambert N, Pryke R, Toplak H, et al. European practical and patient-centred guidelines for adult obesity management in primary care. Obes Facts. 2019;12:40–66. doi: 10.1159/000496183. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.National Institute for Health and Care Excellence (NICE) Weight management: lifestyle services for overweight or obese adults (PH53) 2014. [Google Scholar]
- 4.Busetto L, Bettini S, Makaronidis J, Roberts CA, Halford JCG, Batterham RL. Mechanisms of weight regain. Eur J Intern Med. 2021;93:3–7. doi: 10.1016/j.ejim.2021.01.002. [DOI] [PubMed] [Google Scholar]
- 5.Cummings DE, Weigle DS, Frayo RS, Breen PA, Ma MK, Dellinger EP, et al. Plasma ghrelin levels after diet-induced weight loss or gastric bypass surgery. N Engl J Med. 2002;346:1623–1630. doi: 10.1056/NEJMoa012908. [DOI] [PubMed] [Google Scholar]
- 6.Crujeiras AB, Goyenechea E, Abete I, Lage M, Carreira MC, Martínez JA, et al. Weight regain after a diet-induced loss is predicted by higher baseline leptin and lower ghrelin plasma levels. J Clin Endocrinol Metab. 2010;95:5037–5044. doi: 10.1210/jc.2009-2566. [DOI] [PubMed] [Google Scholar]
- 7.Zhao X, Han Q, Gang X, Lv Y, Liu Y, Sun C, et al. The role of gut hormones in diet-induced weight change: a systematic review. Horm Metab Res. 2017;49:816–825. doi: 10.1055/s-0043-115646. [DOI] [PubMed] [Google Scholar]
- 8.Nymo S, Coutinho S, Eknes P, Vestbostad I, Rehfeld J, Truby H, et al. Investigation of the long-term sustainability of changes in appetite after weight loss. Int J Obes. 2018;42:1489–1499. doi: 10.1038/s41366-018-0119-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Iepsen EW, Lundgren J, Holst JJ, Madsbad S, Torekov SS. Successful weight loss maintenance includes long-term increased meal responses of GLP-1 and PYY3–36. Eur J Endocrinol. 2016;174:775–784. doi: 10.1530/EJE-15-1116. [DOI] [PubMed] [Google Scholar]
- 10.Thom G, Dombrowski SU, Brosnahan N, Algindan YY, Lopez-Gonzalez RM, Roditi G, et al. The role of appetite-related hormones, adaptive thermogenesis, perceived hunger and stress in long-term weight-loss maintenance: a mixed-methods study. Eur J Clin Nutr. 2020;74:622–632. doi: 10.1038/s41430-020-0568-9. [DOI] [PubMed] [Google Scholar]
- 11.DeBenedictis JN, Nymo S, Ollestad KH, Boyesen GA, Rehfeld JF, Holst JJ, et al. Changes in the homeostatic appetite system after weight loss reflect a normalization toward a lower body weight. J Clin Endocrinol Metab. 2020;105:e2538–e2546. doi: 10.1210/clinem/dgaa202. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Leibel RL, Rosenbaum M, Hirsch J. Changes in energy expenditure resulting from altered body weight. N Engl J Med. 1995;332:621–628. doi: 10.1056/NEJM199503093321001. [DOI] [PubMed] [Google Scholar]
- 13.Müller MJ, Enderle J, Bosy-Westphal A. Changes in energy expenditure with weight gain and weight loss in humans. Curr Obes Rep. 2016;5:413–423. doi: 10.1007/s13679-016-0237-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Istfan NW, Lipartia M, Anderson WA, Hess DT, Apovian CM. Approach to the patient: management of the post-bariatric surgery patient with weight regain. J Clin Endocrinol Metab. 2021;106:251–263. doi: 10.1210/clinem/dgaa702. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Fothergill E, Guo J, Howard L, Kerns JC, Knuth ND, Brychta R, et al. Persistent metabolic adaptation 6 years after “the biggest loser” competition: persistent metabolic adaptation. Obesity. 2016;24:1612–1619. doi: 10.1002/oby.21538. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Faria SL, Faria OP, de Cardeal M, de Ito MK, Buffington C. Diet-induced thermogenesis and respiratory quotient after Roux-en-Y gastric bypass surgery: a prospective study. Surg Obes Relat Dis. 2014;10:138–143. doi: 10.1016/j.soard.2013.09.020. [DOI] [PubMed] [Google Scholar]
- 17.Nijs IMT, Muris P, Euser AS, Franken IHA. Differences in attention to food and food intake between overweight/obese and normal-weight females under conditions of hunger and satiety. Appetite. 2010;54:243–254. doi: 10.1016/j.appet.2009.11.004. [DOI] [PubMed] [Google Scholar]
- 18.Massey A, Hill AJ. Dieting and food craving. A descriptive, quasi-prospective study. Appetite. 2012;58:781–785. doi: 10.1016/j.appet.2012.01.020. [DOI] [PubMed] [Google Scholar]
- 19.Stice E, Burger K. Neural vulnerability factors for obesity. Clin Psychol Rev. 2019;68:38–53. doi: 10.1016/j.cpr.2018.12.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Brix JM, Andersen B, Aydinkoc-Tuzcu K, Beckerhinn P, Brossard-Eitzinger A, Cavini A, et al. Übergewicht und Adipositas bei Erwachsenen: Allgemeine Behandlungsgrundsätze und konservatives Management. Wien Klin Wochenschr. 2023;135(Suppl X). [DOI] [PMC free article] [PubMed]
- 21.Wharton S, Lau DCW, Vallis M, Sharma AM, Biertho L, Campbell-Scherer D, et al. Obesity in adults: a clinical practice guideline. Can Med Assoc J. 2020;192:E875–E891. doi: 10.1503/cmaj.191707. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Redmond IP, Shukla AP, Aronne LJ. Use of weight loss medications in patients after bariatric surgery. Curr Obes Rep. 2021;10:81–89. doi: 10.1007/s13679-021-00425-1. [DOI] [PubMed] [Google Scholar]
- 23.Berg A, Bischoff SC, Colombo-Benkmann M, Ellrott T, Hauner H, Heintze C, et al. Interdisziplinäre Leitlinie der Qualität S3 zur „Prävention und Therapie der Adipositas“. Version 2.0 (April 2014; in Überarbeitung).. https://adipositas-gesellschaft.de/dag/leitlinien. Zugegriffen: 21.04.2023.
- 24.Satyal MK, Basso JC, Tegge AN, Metpally AR, Bickel WK. A novel model of obesity prediction: neurobehaviors as targets for treatment. Behav Neurosci. 2021;135:426–442. doi: 10.1037/bne0000385. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Ruffault A, Vaugeois F, Barsamian C, Lurbe i Puerto K, Le Quentrec-Creven G, Flahault C, et al. Associations of lifetime traumatic experience with dysfunctional eating patterns and postsurgery weight loss in adults with obesity: a retrospective study. Stress Health. 2018;34:446–456. doi: 10.1002/smi.2807. [DOI] [PubMed] [Google Scholar]
- 26.Husky MM, Mazure CM, Ruffault A, Flahault C, Kovess-Masfety V. Differential associations between excess body weight and psychiatric disorders in men and women. J Womens Health. 2018;27:183–190. doi: 10.1089/jwh.2016.6248. [DOI] [PubMed] [Google Scholar]
- 27.Chauvet-Gelinier J-C, Roussot A, Cottenet J, Brindisi M-C, Petit J-M, Bonin B, et al. Depression and obesity, data from a national administrative database study: geographic evidence for an epidemiological overlap. PLoS ONE. 2019;14:e0210507. doi: 10.1371/journal.pone.0210507. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Mannan M, Mamun A, Doi S, Clavarino A. Prospective associations between depression and obesity for adolescent males and females—A systematic review and meta-analysis of longitudinal studies. PLoS ONE. 2016;11:e0157240. doi: 10.1371/journal.pone.0157240. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.DeHart WB, Snider SE, Pope DA, Bickel WK. A reinforcer pathology model of health behaviors in individuals with obesity. Health Psychol. 2020;39:966–974. doi: 10.1037/hea0000995. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Guerrero Pérez F, Sánchez-González J, Sánchez I, Jiménez-Murcia S, Granero R, Simó-Servat A, et al. Food addiction and preoperative weight loss achievement in patients seeking bariatric surgery. Eur Eat Disord Rev. 2018;26:645–656. doi: 10.1002/erv.2649. [DOI] [PubMed] [Google Scholar]
- 31.Kefurt R, Langer FB, Schindler K, Shakeri-Leidenmühler S, Ludvik B, Prager G. Hypoglycemia after Roux-en-Y gastric bypass: detection rates of continuous glucose monitoring (CGM) versus mixed meal test. Surg Obes Relat Dis. 2015;11:564–569. doi: 10.1016/j.soard.2014.11.003. [DOI] [PubMed] [Google Scholar]
- 32.Felsenreich DM, Langer FB, Bichler C, Kristo I, Jedamzik J, Eilenberg M, et al. Surgical therapy of weight regain after Roux-en-Y gastric bypass. Surg Obes Relat Dis. 2019;15:1719–1728. doi: 10.1016/j.soard.2019.07.002. [DOI] [PubMed] [Google Scholar]
- 33.Iannelli A, Schneck A-S, Hébuterne X, Gugenheim J. Gastric pouch resizing for Roux-en-Y gastric bypass failure in patients with a dilated pouch. Surg Obes Relat Dis. 2013;9:260–267. doi: 10.1016/j.soard.2012.05.003. [DOI] [PubMed] [Google Scholar]
- 34.Forsell P, Hellers G, Laveskog U, Westman L. Validation of pouch size measurement following the Swedish adjustable gastric banding using endoscopy, MRI and barium swallow. Obes Surg. 1996;6:463–467. doi: 10.1381/096089296765556340. [DOI] [PubMed] [Google Scholar]
- 35.Al-Bader I, Khoursheed M, Al Sharaf K, Mouzannar DA, Ashraf A, Fingerhut A. Revisional laparoscopic gastric pouch resizing for inadequate weight loss after Roux-en-Y gastric bypass. Obes Surg. 2015;25:1103–1108. doi: 10.1007/s11695-015-1579-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Fobi M, Lee H, Igwe D, Jr, James E, Stanczyk M, Eyong P, et al. Revision of failed gastric bypass to distal Roux-en-Y gastric bypass: a review of 65 cases. Obes Surg. 2001;11:190–195. doi: 10.1381/096089201321577866. [DOI] [PubMed] [Google Scholar]
- 37.Swift DL, Johannsen NM, Lavie CJ, Earnest CP, Church TS. The role of exercise and physical activity in weight loss and maintenance. Prog Cardiovasc Dis. 2014;56:441–447. doi: 10.1016/j.pcad.2013.09.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Donnelly JE, Blair SN, Jakicic JM, Manore MM, Rankin JW, Smith BK. Appropriate physical activity intervention strategies for weight loss and prevention of weight regain for adults. Med Sci Sports Exerc. 2009;41:459–471. doi: 10.1249/MSS.0b013e3181949333. [DOI] [PubMed] [Google Scholar]
- 39.Yumuk V, Tsigos C, Fried M, Schindler K, Busetto L, Micic D, et al. European guidelines for obesity management in adults. Obes Facts. 2015;8:402–424. doi: 10.1159/000442721. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Wilfley DE, Hayes JF, Balantekin KN, Van Buren DJ, Epstein LH. Behavioral interventions for obesity in children and adults: evidence base, novel approaches, and translation into practice. Am Psychol. 2018;73:981–993. doi: 10.1037/amp0000293. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Wadden TA, Tronieri JS, Butryn ML. Lifestyle modification approaches for the treatment of obesity in adults. Am Psychol. 2020;75:235–251. doi: 10.1037/amp0000517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Powell SM, Fasczewski KS, Gill DL, Davis PG. Go with the FLOW: Implementation of a psychological skills intervention in an exercise program for post-bariatric surgery patients. J Health Psychol. 2020;25:2260–2271. doi: 10.1177/1359105318793182. [DOI] [PubMed] [Google Scholar]
- 43.Hoyt T, Walter FA. The relationship of presurgical personality assessment inventory scales to BMI following bariatric surgery. Health Psychol. 2022;41:184–192. doi: 10.1037/hea0001142. [DOI] [PubMed] [Google Scholar]
- 44.Peterhänsel C, Petroff D, Klinitzke G, Kersting A, Wagner B. Risk of completed suicide after bariatric surgery: a systematic review: suicide after bariatric surgery. Obes Rev. 2013;14:369–382. doi: 10.1111/obr.12014. [DOI] [PubMed] [Google Scholar]
- 45.Sheets CS, Peat CM, Berg KC, White EK, Bocchieri-Ricciardi L, Chen EY, et al. Post-operative psychosocial predictors of outcome in bariatric surgery. Obes Surg. 2015;25:330–345. doi: 10.1007/s11695-014-1490-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.de Zwaan M, Müller A. Therapie der Adipositas. Psych Up2date. 2014;8:173–184. doi: 10.1055/s-0034-1369967. [DOI] [Google Scholar]
- 47.Bhatti JA, Nathens AB, Thiruchelvam D, Grantcharov T, Goldstein BI, Redelmeier DA. Self-harm emergencies after bariatric surgery: a population-based cohort study. JAMA Surg. 2016;151:226. doi: 10.1001/jamasurg.2015.3414. [DOI] [PubMed] [Google Scholar]
- 48.Kalarchian MA, Marcus MD. Psychosocial concerns following bariatric surgery: current status. Curr Obes Rep. 2019;8:1–9. doi: 10.1007/s13679-019-0325-3. [DOI] [PubMed] [Google Scholar]
- 49.Herpertz S, Kessler H, Jongen S. Psychosomatic and psychosocial questions regarding bariatric surgery: what do we know, or what do we think we know? Z Psychosom Med Psychother. 2017;63:344–369. doi: 10.13109/zptm.2017.63.4.344. [DOI] [PubMed] [Google Scholar]
- 50.Castaneda D, Popov VB, Wander P, Thompson CC. Risk of suicide and self-harm is increased after bariatric surgery—A systematic review and meta-analysis. Obes Surg. 2019;29:322–333. doi: 10.1007/s11695-018-3493-4. [DOI] [PubMed] [Google Scholar]
- 51.Voils CI, Adler R, Strawbridge E, Grubber J, Allen KD, Olsen MK, et al. Early-phase study of a telephone-based intervention to reduce weight regain among bariatric surgery patients. Health Psychol. 2020;39:391–402. doi: 10.1037/hea0000835. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Özkan M, Kavak M. Cross-addiction in bariatric surgery candidates. J Nurse Pract. 2022;18:185–189. doi: 10.1016/j.nurpra.2021.11.012. [DOI] [Google Scholar]
- 53.Moon RC, Teixeira AF, Jawad MA. Treatment of weight regain following Roux-en-Y gastric bypass: revision of pouch, creation of new gastrojejunostomy and placement of proximal pericardial patch ring. Obes Surg. 2014;24:829–834. doi: 10.1007/s11695-014-1188-z. [DOI] [PubMed] [Google Scholar]
- 54.Thompson CC, Chand B, Chen YK, DeMarco DC, Miller L, Schweitzer M, et al. Endoscopic suturing for transoral outlet reduction increases weight loss after Roux-en-Y gastric bypass surgery. Gastroenterology. 2013;145:129–137.e3. doi: 10.1053/j.gastro.2013.04.002. [DOI] [PubMed] [Google Scholar]
- 55.Osorio J, Lazzara C, Admella V, Franci-León S, Pujol-Gebellí J. Revisional laparoscopic SADI-S vs. Duodenal switch following failed primary sleeve gastrectomy: a single-center comparison of 101 consecutive cases. Obes Surg. 2021;31:3667–3674. doi: 10.1007/s11695-021-05469-9. [DOI] [PubMed] [Google Scholar]