Resumen
La tuberculosis se ubica entre las enfermedades infecciosas con mayor mortalidad y morbilidad a nivel mundial, por detrás de la actual pandemia de COVID-19. Puede afectar a cualquier órgano, aunque la principal forma de infección es respiratoria. La correcta activación de la respuesta inmune logra eliminar o contener a la bacteria en un estado de latencia; sin embargo, la enfermedad activa es progresiva y debe ser tratada bajo estricta supervisión. El tratamiento para la tuberculosis es prolongado y consiste en una combinación de varios antifímicos; por lo tanto, se asocia a la aparición de una gran diversidad de efectos adversos. Estos efectos son la principal causa de abandono terapéutico, que a su vez facilita la aparición de cepas farmacorresistentes. De ahí la importancia de desarrollar nuevas estrategias terapéuticas con el objetivo de disminuir la dosis del fármaco o bien su tiempo de administración. Para lograr estos objetivos se ha propuesto el uso de nanovehículos, que son sistemas de liberación de fármacos controlados y dirigidos. Específicamente, los liposomas son formulaciones que presentan ventajas al ser administrados por vía respiratoria, ya que esta facilita el alcance a la mucosa respiratoria y a los pulmones, que es el principal órgano afectado en la infección por tuberculosis. En la presente revisión se analiza el uso de nanovehículos como sistemas efectivos de entrega de fármacos, así como las formulaciones que se encuentran en estudio. También se proponen perspectivas para la aplicación de la nanotecnología en el desarrollo de nuevos tratamientos farmacológicos para la tuberculosis.
Palabras clave: Tuberculosis, Liposomas, Farmacorresistencia Microbiana
Abstract
Tuberculosis is among the infectious diseases with the highest mortality and morbidity worldwide, behind the COVID-19 pandemic. It can affect any organ, although the respiratory infection is the most common. The correct activation of the immune response eliminates or contain the bacteria; however, the active disease is progressive and must be treated under strict supervision. Treatment for tuberculosis is prolonged and consists of a combination of several antibiotics associated with a wide variety of adverse effects. These effects are the main cause of therapeutic abandonment, which facilitates the appearance of drug-resistant strains. Hence the importance of developing new therapeutic strategies to reduce the dose of the drug or its administration time. To achieve these objectives, the use of nano-vehicles, which are controlled and directed drug release systems, has been proposed. Specifically, liposomes are formulations that have advantages when administered by the respiratory route since they facilitate the reach of the respiratory mucosa and the lungs, which are the main organs affected by tuberculosis. This review analyzes the use of nano-vehicles as effective drug delivery systems and the formulations under study. Perspectives for the application of nanotechnology in the development of new pharmacological treatments for tuberculosis are also proposed.
Keywords: Tuberculosis; Liposomes; Drug Resistance, Microbial
Introducción
La tuberculosis (TB) es una enfermedad infecciosa causada por el complejo Mycobaterium tuberculosis (Mtb) que incluye linajes de micobacterias altamente relacionadas entre sí. En el 2020 se reportó como una de las enfermedades infecciosas con niveles más altos de mortalidad a nivel mundial, solo por detrás de la COVID-19. En el informe global de la Organización Mundial de la Salud (OMS) del 2021 se reportaron alrededor de 10 millones de casos de TB activa, así como un incremento del 10% de casos de TB resistente a la rifampicina e isoniazida (MDR-TB), que son los fármacos de primera línea utilizados para tratar la infección. En este mismo reporte se discute que la actual pandemia por COVID-19 ha dificultado el tratamiento y el diagnóstico de TB, por lo que se espera un rápido incremento de casos y muertes.1 Adicionalmente, se estima que un 25% de la población mundial se encuentra infectada de manera latente con Mtb, que causa alrededor de 4000 muertes al día.2 Cabe mencionar que ese 25% de la población mundial presenta una variación del 5 al 10% de riesgo de desarrollar la infección activa durante su vida. En conjunto estos datos evidencian la necesidad de desarrollar nuevas alternativas terapéuticas para el tratamiento de la infección.
La Mtb puede infectar cualquier órgano; sin embargo, la infección pulmonar es la forma más común de TB. Esta se presenta principalmente por la inhalación de aerosoles que contienen el bacilo y que son dispersados por medio de tos, habla y estornudos de pacientes con TB activa. Cuando los bacilos ingresan a las vías respiratorias, el sistema inmune innato del huésped genera diversos mecanismos de protección. Se estima que alrededor de 70% de las personas expuestas al bacilo lo eliminarán de manera eficaz, es decir, solo el 30% se infectará y de estos, solo el 10% llegará a desarrollar la enfermedad activa; el resto de los casos contendrá al bacilo en un estado de latencia.3 La habilidad de restringir o eliminar al bacilo Mtb depende de una adecuada activación de la respuesta inmune.
Respuesta inmune asociada a la infección de TB
La primera respuesta frente a la infección por Mtb es la respuesta inmune innata, es decir, cuando los bacilos inhalados ingresan a las vías respiratorias y alcanzan el espacio alveolar, interactúan con células dendríticas (CD), células del epitelio pulmonar y macrófagos alveolares (MA), y estos últimos son el principal hospedero de los bacilos. Como parte de la respuesta inmune innata, destaca la producción de citocinas y quimiocinas que inducen el reclutamiento de otras células del sistema inmune, como los monocitos, los fagocitos, los linfocitos y las CD al sitio de infección, además de que promueven la secreción de sustancias bactericidas, como los péptidos antimicrobianos (AMPs).4
Posteriormente ocurre la presentación antigénica, que consiste en el procesamiento del antígeno por parte de las CD o los MA para poder presentar pequeños fragmentos a los linfocitos, los cuales, al reconocer estos fragmentos, finalmente se van a activar para iniciar la respuesta inmune adquirida. La activación promueve la producción de IL-12 por parte de CD y MA, lo que a su vez desencadena el incremento de linfocitos Th1 productores de interferón (IFN)-γ. En este punto puede desarrollarse la infección activa, aunque en la mayoría de los casos el IFN-γ mantiene activos a los MA que orquestan la formación de granulomas, estructuras celulares que promueven la contención bacilar y evitan su diseminación. Por lo tanto, la secreción de ambas citocinas es de gran importancia, puesto que se asocian a la eliminación del bacilo y por lo tanto a la resolución de la enfermedad.5
Cuando se logra formar el granuloma, el individuo infectado se encuentra en estado de latencia. Durante esta etapa el 90% de las personas infectadas permanece asintomática y no son contagiosas. El estado de latencia puede prolongarse durante varias décadas y en algunos pacientes la infección se reactivará. Los mecanismos implicados en la reactivación de la infección son complejos y no se encuentran del todo descritos; sin embargo, parece que una disminución de la respuesta inmune del huésped activa la infección del bacilo, por ejemplo, cuando el paciente tiene comorbilidades como VIH (virus de inmunodeficiencia humana) o diabetes mellitus tipo 2, o bien factores ambientales o asociados a cambios en la respuesta del sistema inmune por envejecimiento.6
Durante la reactivación, el bacilo escapa del granuloma y continúa su replicación, que lleva a la necrosis del tejido pulmonar y al inicio de la enfermedad activa.6 No obstante, a pesar de su alta contagiosidad y gravedad, esta enfermedad es curable, siempre y cuando se diagnostique en tiempo y se lleve a cabo un tratamiento adecuado y efectivo.7,8
La TB y los retos que enfrenta su tratamiento farmacológico
En México, el tratamiento contra la TB está basado en la Norma Oficial Mexicana para la Prevención y Control de la Tuberculosis en la Atención Primaria a la Salud,9 como se resume en el cuadro I. En la mayoría de los pacientes, la TB es curable con este esquema de terapia; sin embargo, en alrededor del 10% de los casos no hay respuesta efectiva y aproximadamente la mitad de estos se han asociado a la presencia de cepas multirresistentes MDR-TB. En los casos en los que se detectan pacientes con cepas MDR-TB, la OMS establece un tratamiento acortado, indicado en el cuadro I, y de manera complementaria se recomienda que el apego al mismo sea estrictamente supervisado por una persona capacitada.9,10 Aunque actualmente el tratamiento contra la TB se encuentra establecido y su eficacia es cercana al 90%, el principal problema al que se enfrenta el sistema de salud incluye la aparición de cepas farmacorresistentes derivadas del abandono del mismo debido a la considerable aparición de efectos adversos.10
Cuadro I. Tratamiento primario acortado estrictamente supervisado (TAES) y tratamiento acortado para MDR-TB.

A. Tratamiento primario: se inicia con una fase intensiva que consiste en la administración de 60 dosis de lunes a viernes de R, H, Z y E. Posteriormente se continua con una fase de sostén que consta de tres dosis intermitentes a la semana de R y H, hasta completar 45 tomas. B. Se recomienda un esquema oral acortado con bedaquilina de 9 a 12 meses en pacientes en los que se ha excluido la resistencia a fluoroquinolonas. Modificado de la NOM-006-SSA2-20139 y la Guía unificada de la OMS y OPS12
La resistencia de Mtb puede ser clasificada de acuerdo con la sensibilidad que presenta frente a los antibióticos. Las cepas que son resistentes a rifampicina se conocen como RR-TB. Mientras que la TB que además es resistente a isoniazida, como se mencionó anteriormente, se conoce como multifarmacorresistente (MDR-TB), que puede desarrollar resistencia al menos a una fluoroquinolona de cualquier generación, la cual a su vez se clasificaría como TB preextensivamente farmacorresistente (pre-XDR-TB). Este tipo de cepas pueden obtener aún más resistencia a otros antibióticos. Las cepas extremadamente resistentes a los fármacos (XDR-TB) son realmente difíciles de tratar, ya que tienen resistencia a rifampicina, isoniazida, a alguna fluoroquinolona y a antibióticos de segunda generación, como la bedaquilina o la linezolida. Los pacientes diagnosticados con este tipo de cepas tienen mal pronóstico y un porcentaje de cura muy bajo.11
Durante la pandemia por COVID-19, el número de personas que se había reportado que estaban inscritas en tratamiento MDR/RR-TB disminuyó en un 15 % de acuerdo con datos de la OMS en 2021. Esto refleja que aproximadamente 2 de cada 3 personas que presentan infección de TB por cepas MDR/RR-TB no están recibiendo tratamiento adecuado. Se sugiere que esto está influenciado no solo por el aumento de cepas resistentes, sino también por la escasa disponibilidad de fármacos, inestabilidad política y desventajas socioeconómicas en muchas áreas. Además, la caída de estas cifras refleja el enorme impacto de la COVID-19 en términos de acceso a los servicios para el tratamiento de TB.1
La TB resistente a fármacos es una amenaza y un obstáculo para los esfuerzos globales en su eliminación. Está claro que a pesar de los esfuerzos recientes, estamos fallando en diagnosticar y tratar a 300,000 personas al año con esta forma de TB.1 Se necesita más atención e inversión en servicios de diagnóstico, productos farmacéuticos e investigación. Existen a la fecha diversos grupos de trabajo que dirigen sus investigaciones a la terapéutica, con el fin de reducir la duración del tratamiento a 4 meses para la TB sensible a antibióticos, y de 6 a 9 meses para cepas MDR. Las opciones se basan en la búsqueda de moduladores de la respuesta inmune que, en combinación con los fármacos nuevos, puedan eliminar a la micobacteria en menos tiempo. Por otra parte, nuestro grupo de investigación propone el reposicionamiento de fármacos y el uso de nanovehículos con el objetivo de dirigir a los fármacos de manera específica a su blanco terapéutico, buscando disminuir su toxicidad e incrementando la eficacia.
Liposomas: los nanovehículos de mayor éxito comercial
La nanotecnología se encarga de la obtención de materiales en el rango de la nanoescala (1 a 100 nm) para aplicaciones en diversas áreas, entre ellas la biomedicina. Dichos materiales son conocidos como nanomateriales y su tamaño les confiere propiedades físicas y químicas diferentes que las de los materiales en gran escala. Por ejemplo, un nanomaterial tiene una gran área superficial, lo que permite colocar en su interior o en su superficie una mayor cantidad de moléculas de fármacos. A estos constructos se los denomina nanovehículos.
Los nanomateriales se clasifican en 4 grupos: 1) inorgánicos, que incluyen nanopartículas metálicas y óxidos de metales; 2) orgánicos, donde encontramos partículas ensambladas con polímeros, lípidos, entre otras; 3) basados en carbono, que consideran al grafeno, óxido de grafeno y nanotubos de carbono; 4) nanocompositos, donde se agrupan estructuras con dos materiales de naturaleza química diferente (figura 1).
Figura 1. Clasificación de los nanomateriales de acuerdo con su naturaleza química.
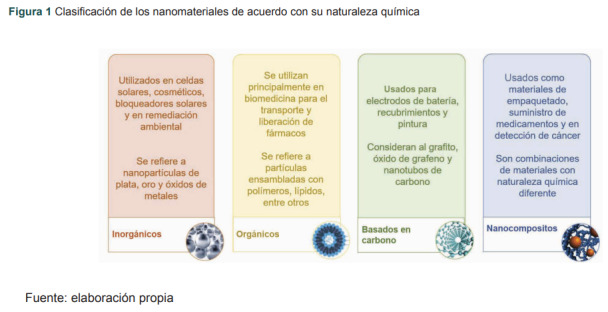
Fuente: elaboración propia.
El uso de nanovehículos disminuye la dosis, el número de administraciones y los posibles efectos tóxicos del fármaco o la molécula bioactiva, ya que protege al fármaco de la degradación y puede controlar la liberación para alcanzar la dosis terapéutica durante un mayor periodo de tiempo. Por otro lado, el tamaño del nanovehículo hace posible que se dirija a un sitio específico del organismo. Por ejemplo, a un tumor o a una región inflamada por infección bacteriana, como en el caso de la TB, con lo que focaliza su efecto sin alterar regiones de tejido sanas.
Entre los nanomateriales de naturaleza orgánica, se encuentran los ensamblados con lípidos, particularmente los liposomas, que son estructuras (la mayoría esféricas) de doble capa lipídica y que han servido desde hace más de 20 años como vehículo de diversos fármacos. Tal es el caso de AmBisome® liposomal, formulación de anfotericina B utilizada para el tratamiento de infecciones originadas por hongos, DaunoXome® y Doxil®, que contienen los quimioterapéuticos daunorrubicina y doxorrubicina, respectivamente. Con estas formulaciones, se disminuyen las dosis y el tiempo de tratamiento en el paciente.
En la figura 2 se observa una representación de los liposomas, que pueden estar constituidos por fosfolípidos sintéticos o naturales y cuya estructura les confiere la particularidad de ser anfipáticos; es decir, su grupo fosfato es hidrofílico y la cadena hidrocarbonada es hidrofóbica.13 Por lo tanto, este arreglo permite que el liposoma acarree fármacos hidrosolubles en el centro y la superficie de su estructura o fármacos hidrofóbicos en la membrana.
Figura 2. Estructura de un liposoma unilaminar.
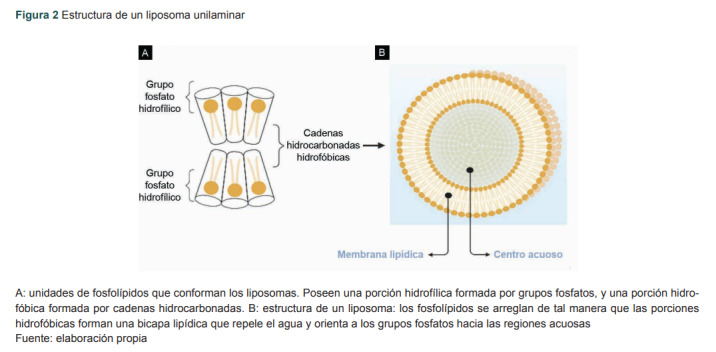
A: unidades de fosfolípidos que conforman los liposomas. Poseen una porción hidrofílica formada por grupos fosfatos, y una porción hidrofóbica formada por cadenas hidrocarbonadas. B: estructura de un liposoma: los fosfolípidos se arreglan de tal manera que las porciones hidrofóbicas forman una bicapa lipídica que repele el agua y orienta a los grupos fosfatos hacia las regiones acuosas.
Fuente: elaboración propia.
Además, los liposomas pueden ser clasificados por la cantidad de bicapas lipídicas que los conforman en vesículas uni-, oligo- y multilaminares. Las vesículas unilaminares pueden ser a su vez subcategorizadas en pequeñas (≤ 100 nm), grandes (≥ 100 nm y ≤ 1µm) y gigantes (≥ 1µm). Las vesículas oligolaminares se refieren a aquellas que tienen de 2 a 5 láminas concéntricas, mientras que las multilaminares poseen más de 5 láminas.13
Si se considera la forma de cada liposoma y la naturaleza de los fármacos (ya sea hidrofílicos o hidrofóbicos), se sugiere el uso de vesículas unilaminares para la entrega de fármacos hidrosolubles, debido a que su centro acuoso es de mayor tamaño, mientras que las oligo- y multilaminares son para la entrega de fármacos liposolubles.14
Liposomas para la entrega efectiva de fármacos
Debido a su alto éxito en biomedicina, los liposomas incluso fueron elegidos en la fabricación de las vacunas contra SARS-CoV-2 por BioNTech-Pfizer y Moderna para encapsular el ARN mensajero de la proteína S del virus.15 Es por ello que resulta interesante la continuidad de la investigación de liposomas como nanovehículos de fármacos y biomoléculas para enfermedades infecciosas de gran importancia en el sector salud, como la TB.
El uso de liposomas para la administración de fármacos presenta las ventajas de que son biocompatibles, biodegradables y aseguran su liberación al sitio específico del organismo donde ejercerá su efecto terapéutico. Por lo tanto, un fármaco cargado en liposomas disminuye la dosis terapéutica, y puede atenuar o eliminar efectos adversos. En una administración intravenosa, un antibiótico libre sufre degradación por parte de enzimas en el torrente sanguíneo o se une a proteínas para ser excretado. El fármaco restante se dirige rápidamente a diferentes tejidos y se acumula en ellos, sean tejidos sanos o no. En contraste, un fármaco en un liposoma es protegido de las enzimas y de la unión a proteínas; además, la mayor parte de estos nanovehículos se acumula en el tejido afectado o de interés. Este último proceso puede ser logrado por: 1) acumulación pasiva, es decir, que el tejido afectado tenga cambios en la permeabilidad celular y diferente pH y, por lo tanto, le sea más fácil al liposoma ingresar; y 2) acumulación activa, que se refiere a cuando se coloca una molécula de reconocimiento (por ejemplo, un anticuerpo) en la superficie del nanovehículo, lo que incrementa la afinidad a un tejido específico (figura 3).16,17,18
Figura 3. Entrega de fármacos por liposomas.
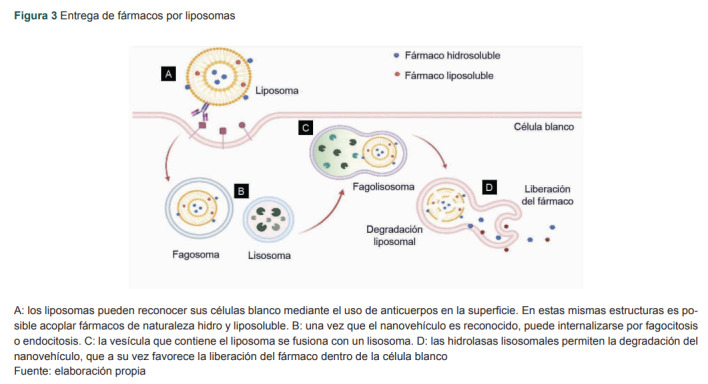
A: los liposomas pueden reconocer sus células blanco mediante el uso de anticuerpos en la superficie. En estas mismas estructuras es posible acoplar fármacos de naturaleza hidro y liposoluble. B: una vez que el nanovehículo es reconocido, puede internalizarse por fagocitosis o endocitosis. C: la vesícula que contiene el liposoma se fusiona con un lisosoma. D: las hidrolasas lisosomales permiten la degradación del nanovehículo, que a su vez favorece la liberación del fármaco dentro de la célula blanco.
Fuente: elaboración propia.
Tratamientos para la tuberculosis con el uso de liposomas
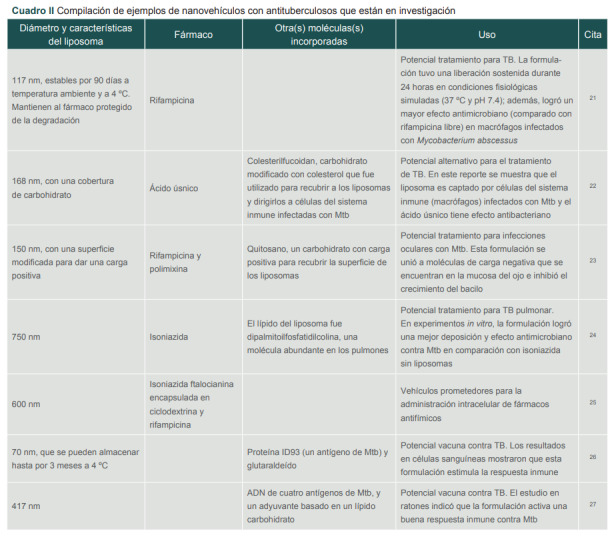
Los nanovehículos que se han reportado como los más adecuados para el tratamiento de infecciones pulmonares son los liposomas. Esto se debe principalmente a su gran similitud con el surfactante pulmonar que evita la irritación local.19 Además, se ha reportado que los liposomas son altamente captados por los macrófagos, que es la principal célula huésped de Mtb, lo que permite alcanzar la concentración mínima inhibitoria en el sitio de acción, así como reducir el potencial de desarrollo de resistencia a los fármacos.20 En este sentido, se investigan fármacos antituberculosos de primera y segunda línea, como rifampicina, isoniazida y ciprofloxacina, así como otras moléculas bioactivas, como el ácido úsnico, la polimixina y la ftalocianina. En el cuadro II se muestran algunos ejemplos de las investigaciones recientes en esta materia, donde vemos que el tamaño de los liposomas es de 150 a 800 nm aproximadamente, y los estudios in vitro (cultivos de células animales o bacterias, simulación de órganos) muestran que una formulación de liposoma-antibiótico tiene mayor efecto antibacteriano contra el Mtb. Asimismo, los liposomas se proponen como vehículos de vacunas contra la tuberculosis y con ellos se espera mejorar la protección inmunológica contra el bacilo, al utilizar proteínas o segmentos de ADN de la bacteria para inducir la respuesta inmune del organismo de forma más selectiva y a largo plazo.
Cuadro II. Compilación de ejemplos de nanovehículos con antituberculosos que están en investigación.
Perspectivas en aplicación de nanotecnología para nuevos tratamientos farmacológicos para TB
A medida que los fármacos se vuelven más complejos y cada vez más tóxicos, se necesitan nuevos métodos de administración para transportarlos a las células y tejidos deseados del cuerpo. Asimismo, la búsqueda de nuevos tratamientos para combatir a la TB se ha extendido, ya que existe una distribución y acumulación diferencial del fármaco en las lesiones tuberculosas, lo que forma una ventana temporal y espacial de monoterapia (un solo fármaco) que es favorable para el desarrollo de resistencia farmacológica.28 En este sentido, los nanovehículos permiten mejorar la biodisponibilidad y dirección del mismo al conferirles mayor estabilidad y solubilidad.29 También ayudan en el transporte a través de las membranas y prolongan el tiempo de circulación para aumentar la seguridad y la eficacia del fármaco encapsulado.30,31
Los macrófagos, monocitos, células epiteliales y células dendríticas captan a los nanovehículos fácilmente por fagocitosis o endocitosis, un proceso en el que estas son internalizadas para formar vesículas endocíticas. Los endosomas se fusionan con los lisosomas donde los contenidos son degradados por hidrolasas lisosomales, liberando los fármacos encapsulados dentro de las células fagocíticas (ver figura 3). Dado que los macrófagos se reclutan continuamente en el área de infección de la TB y son la principal célula hospedera de Mtb, los nanovehículos que contienen medicamentos antituberculosos pueden ser dirigidos hacia estas células infectadas.32
Como ya se describió anteriormente, varios estudios han demostrado la eficacia de diferentes nanoestructuras para tratar la TB.33,34,35 Además de los liposomas, se han utilizado polímeros biodegradables para recubrir nanopartículas de plata que son antibacterianas, con lo que se logra un efecto de sinergia. Otro ejemplo es el uso de nanopartículas conjugadas con ciclodextrina, un carbohidrato ampliamente usado en la industria farmacéutica para encapsular fármacos. Estas nanopartículas poseen efectos inmunomoduladores y propiedades antiinfecciosas, ya que son reconocidas por dectina-1, un receptor expresado en macrófagos. De la misma manera, estudios in vivo con nanopartículas lipídicas sólidas cargadas de isoniazida dirigidas a macrófagos mostraron una mejor agregación de los macrófagos en la superficie de las vías respiratorias y una mayor captación del antibiótico a nivel intracelular.33
Otros estudios han demostrado que las micelas polipeptídicas recubiertas de alginato de sodio con bedaquilina encapsulada aumentan la actividad antimicobacteriana del fármaco en comparación con su forma libre.36 Del mismo modo, las nanopartículas de quitosano con bedaquilina no mostraron toxicidad celular, en comparación con la bedaquilina oral. Asimismo, se demostró que los nanovehículos de quitosano apuntaban a una alta concentración de bedaquilina en los pulmones.37 De manera similar, nanopartículas de quitosano inhalable cargadas con isoniazida y rifampicina mostraron una citotoxicidad más baja y una reducción efectiva de la infección bacteriana en ratones BALB/c después de la administración pulmonar con un sistema nebulizado con compresor.38
Por otra parte se ha descrito que los liposomas manosilados en aerosol entregan nanotransportadores a macrófagos alveolares in vitro e in vivo de manera más eficiente en comparación con liposomas no modificados.39 Adicionalmente, el uso de nanopartículas lipídicas sólidas modificadas con manosa inhalable (MAN-IC-SLN) cargada con isoniazida y dirigidas a macrófagos mostró una mayor captación celular del fármaco (hasta un 97 %), en comparación con el no modificado (42 %).40
Estas evidencias respaldan el uso de nanopartículas para el tratamiento de la TB y se deben buscar más ensayos clínicos apropiados para determinar la seguridad, eficacia y farmacocinética de los nanovehículos cargados con los diferentes antifímicos en los pacientes con TB.
Conclusión
La evidencia recopilada en este artículo implica que los nanomateriales, particularmente los liposomas, tienen un potencial notable como nanovehículos de fármacos para el tratamiento de la TB. Las principales ventajas de los liposomas son la protección del fármaco, una mayor carga de moléculas por volumen de dosis, la reducción de la frecuencia de dosificación y la mejora de la biodisponibilidad del fármaco. A la fecha, existen formulaciones liposomales para otras enfermedades, como algunos tipos de cáncer, algunas infecciones por hongos y las vacunas contra SARS-CoV-2. Para TB, las investigaciones aún están en fases preclínicas, pero el éxito de formulaciones en los últimos años apuntala el paso de los estudios clínicos en el mediano y largo plazo, con resultados efectivos para evitar la resistencia antimicrobiana, acortar el tiempo de los tratamientos y mejorar la calidad de vida del paciente.
Notas
los autores han completado y enviado la forma traducida al español de la declaración de conflictos potenciales de interés del Comité Internacional de Editores de Revistas Médicas, y no fue reportado alguno que tuviera relación con este artículo.
Referencias
- 1.World Health Organization. Global tuberculosis report 2021. World Health Organization; Geneva: 2021. Disponible en: https://www.who.int/publications/i/item/9789240037021 . [Google Scholar]
- 2.Moreira JD, Koch BEV, van-Veen S, et al. Functional Inhibition of Host Histone Deacetylases (HDACs) Enhances in vitro and in vivo Anti-mycobacterial Activity in Human Macrophages and in Zebrafish. Front Immunol. 2020;11:36. doi: 10.3389/fimmu.2020.00036. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Jilani TN, Avula A, Zafar-Gondal A, et al. Active Tubercolosis. StatPearls Publishing; Treasure Island, FL: 2023. [PubMed] [Google Scholar]
- 4.Maertzdorf J, Tönnies M, Lozza L, et al. Mycobacterium tuberculosis Invasion of the Human Lung: First Contact. Front Immunol. 2018;9:1346. doi: 10.3389/fimmu.2018.01346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Dheda K, Schwander SK, Zhu B, et al. The immunology of tuberculosis: from bench to bedside. Respirology. 2010;15(3):433–450. doi: 10.1111/j.1440-1843.2010.01739.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.De-Waal AM, Hiemstra PS, Ottenhoff TH, et al. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 2022;77(4):408–416. doi: 10.1136/thoraxjnl-2021-217997. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Rendón A, Soto-Monciváis B, Olivares-Martínez P, et al. Coexistencia de tuberculosis y Covid-19. Salud Publica Mex. 2021;63(3):328. doi: 10.21149/12213. [DOI] [PubMed] [Google Scholar]
- 8.Antonio-Arques V, Franch-Nadal J, Cayla JA. Diabetes and tuberculosis: A syndemic complicated by COVID-19. Med Clin. 2021;157(6):288–293. doi: 10.1016/j.medcle.2021.04.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Norma Oficial Mexicana NOM-006-SSA2-2013 para la prevencion y control de la tuberculosis. Diario Oficial de la Federación; México: 2013. Disponible en: https://dof.gob.mx/nota_detalle.php?codigo=5321934&fecha=13/11/2013#gsc.tab=0 . [Google Scholar]
- 10.Lanido-Laborín R. Guía para la Atención de Personas con Tuberculosis Resistente a Fármacos. Secretaría de Salud; México: 2016. 37 diapositivas. Disponible en: http://www.cenaprece.salud.gob.mx/programas/interior/micobacteriosis/descargas/pdf/GuiaDeLaOMSparaTratamientoDeTB.pdf . [Google Scholar]
- 11.Dean AS, Tosas-Auguet O, Glaziou P, et al. 25 years of surveillance of drug-resistant tuberculosis: achievements, challenges, and way forward. Lancet Infect Dis. 2022;22(7):191–196. doi: 10.1016/S1473-3099(21)00808-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Organización Panamericana de la Salud. Directrices unificadas de la OMS sobre el tratamiento de la tuberculosis farmacorresistente. World Health Organization; Washington: 2020. 107 p. [PubMed] [Google Scholar]
- 13.Buya AB, Witika BA, Bapolisi AM, et al. Application of Lipid-Based Nanocarriers for Antitubercular Drug Delivery: A Review. Pharmaceutics. 2021;13(12):2041. doi: 10.3390/pharmaceutics13122041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Pattni BS, Chupin VV, Torchilin VP. New Developments in Liposomal Drug Delivery. Chem Rev. 2015;115(19):10938–10966. doi: 10.1021/acs.chemrev.5b00046. [DOI] [PubMed] [Google Scholar]
- 15.Patel R, Kaki M, Potluri VS, et al. A comprehensive review of SARS-CoV-2 vaccines: Pfizer, Moderna & Johnson & Johnson. Hum Vaccin Immunother. 2022;18(1):2002083. doi: 10.1080/21645515.2021.2002083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ortega-Berlanga B, Gonzalez C, Navarro-Tovar G. Recent Advances in the Use of Lipid-Based Nanoparticles Against Glioblastoma Multiforme. Arch Immunol Ther Exp (Warsz) 2021;69(1):8. doi: 10.1007/s00005-021-00609-6. [DOI] [PubMed] [Google Scholar]
- 17.Fan Y, Marioli M, Zhang K. Analytical characterization of liposomes and other lipid nanoparticles for drug delivery. J Pharm Biomed Anal. 2021;192:113642. doi: 10.1016/j.jpba.2020.113642. [DOI] [PubMed] [Google Scholar]
- 18.Almeida B, Nag OK, Rogers KE, et al. Recent Progress in Bioconjugation Strategies for Liposome-Mediated Drug Delivery. Molecules. 2020;25(23):5672. doi: 10.3390/molecules25235672. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Mehanna MM, Mohyeldin SM, Elgindy NA. Respirable nanocarriers as a promising strategy for antitubercular drug delivery. J Control Release. 2014;187:183–197. doi: 10.1016/j.jconrel.2014.05.038. [DOI] [PubMed] [Google Scholar]
- 20.Abu-Lila AS, Ishida T. Systems: Design Optimization and Current Applications. Biol Pharm Bull. 2017;40(1):1-10. doi: 10.1248/bpb.b16-00624. [DOI] [PubMed] [Google Scholar]
- 21.Rinaldi F, Hanieh PN, Sennato S, et al. Rifampicin-Liposomes for Mycobacterium abscessus Infection Treatment: Intracellular Uptake and Antibacterial Activity Evaluation. Pharmaceutics. 2021;13(7):1070. doi: 10.3390/pharmaceutics13071070. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Lima-Salviano T, Dos-Santos Macedo DC, De-Siqueira Ferraz Carvalho R, et al. Fucoidan-Coated Liposomes: A Target System to Deliver the Antimicrobial Drug Usnic Acid to Macrophages Infected with Mycobacterium tuberculosis. J Biomed Nanotechnol. 2021;17(8):1699–1710. doi: 10.1166/jbn.2021.3139. [DOI] [PubMed] [Google Scholar]
- 23.Bazán-Henostroza MA, Curo-Melo KJ, Nishitani-Yukuyama M, et al. Cationic rifampicin nanoemulsion for the treatment of ocular tuberculosis. Coloides Surf A Physicochem Eng Asp. 2020;597:124755. [Google Scholar]
- 24.Chimote G, Banerjee R. In vitro evaluation of inhalable isoniazid-loaded surfactant liposomes as an adjunct therapy in pulmonary tuberculosis. J Biomed Mater Res B Appl Biomater. 2010;94(1):1–10. doi: 10.1002/jbm.b.31608. [DOI] [PubMed] [Google Scholar]
- 25.Nkanga CI, Roth M, Walker RB, et al. Co-Loading of Isoniazid-Grafted Phthalocyanine-in-Cyclodextrin and Rifampicin in Crude Soybean Lecithin Liposomes: Formulation, Spectroscopic and Biological Characterization. J Biomed Nanotechnol. 2020;16(1):14–28. doi: 10.1166/jbn.2020.2880. [DOI] [PubMed] [Google Scholar]
- 26.Adeagbo BA, Akinlalu AO, Phan T, et al. Controlled Covalent Conjugation of a Tuberculosis Subunit Antigen (ID93) to Liposome Improved In Vitro Th1-Type Cytokine Recall Responses in Human Whole Blood. ACS Omega. 2020;5(48):31306–31313. doi: 10.1021/acsomega.0c04774. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Tian M, Zhou Z, Tan S, et al. Formulation in DDA-MPLA-TDB Liposome Enhances the Immunogenicity and Protective Efficacy of a DNA Vaccine against Mycobacterium tuberculosis Infection. Front Immunol. 2018;9:310. doi: 10.3389/fimmu.2018.00310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Prideaux B, Via LE, Zimmerman MD, et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 2015;21(10):1223–1227. doi: 10.1038/nm.3937. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Rodriguez-Carlos A, Martinez-Gutierrez F, Torres-Juarez F, et al. Antimicrobial Peptides-based Nanostructured Delivery Systems: An Approach for Leishmaniasis Treatment. Curr Pharm Des. 2019;25(14):1593–1603. doi: 10.2174/1381612825666190628152842. [DOI] [PubMed] [Google Scholar]
- 30.Nasiruddin M, Neyaz MK, Das S. Nanotechnology-Based Approach in Tuberculosis Treatment. Tuberc Res Treat. 2017;2017:4920209. doi: 10.1155/2017/4920209. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Da-Silva PB, De-Freitas ES, Bernegossi J, et al. Nanotechnology-Based Drug Delivery Systems for Treatment of Tuberculosis--A Review. J Biomed Nanotechnol. 2016;12(2):241–260. doi: 10.1166/jbn.2016.2149. [DOI] [PubMed] [Google Scholar]
- 32.Singh J, Garg T, Rath G, et al. Advances in nanotechnology-based carrier systems for targeted delivery of bioactive drug molecules with special emphasis on immunotherapy in drug resistant tuberculosis - a critical review. Drug Deliv. 2016;23(5):1676–1698. doi: 10.3109/10717544.2015.1074765. [DOI] [PubMed] [Google Scholar]
- 33.Abdel-Aziz MM, Elella MHA, Mohamed RR. Green synthesis of quaternized chitosan/silver nanocomposites for targeting Mycobacterium tuberculosis and lung carcinoma cells (A-549) Int J Biol Macromol. 2020;142:244–253. doi: 10.1016/j.ijbiomac.2019.09.096. [DOI] [PubMed] [Google Scholar]
- 34.Amarnath-Praphakar R, Jeyaraj M, Ahmed M, et al. Silver nanoparticle functionalized CS-g-(CA-MA-PZA) carrier for sustainable anti-tuberculosis drug delivery. Int J Biol Macromol. 2018;118:1627–1638. doi: 10.1016/j.ijbiomac.2018.07.008. [DOI] [PubMed] [Google Scholar]
- 35.Yunus-Basha R, T-S SK, Doble M. Dual delivery of tuberculosis drugs via cyclodextrin conjugated curdlan nanoparticles to infected macrophages. Carbohydr Polym. 2019;218:53–62. doi: 10.1016/j.carbpol.2019.04.056. [DOI] [PubMed] [Google Scholar]
- 36.Soria-Carrera H, Lucia A, De-Matteis L, et al. Polypeptidic Micelles Stabilized with Sodium Alginate Enhance the Activity of Encapsulated Bedaquiline. Macromol Biosci. 2019;19(4):e1800397. doi: 10.1002/mabi.201800397. [DOI] [PubMed] [Google Scholar]
- 37.Rawal T, Patel S, Butani S. Chitosan nanoparticles as a promising approach for pulmonary delivery of bedaquiline. Eur J Pharm Sci. 2018;124:273–287. doi: 10.1016/j.ejps.2018.08.038. [DOI] [PubMed] [Google Scholar]
- 38.Cunha L, Rodrigues S, Rosa-Da Costa AM, et al. Inhalable chitosan microparticles for simultaneous delivery of isoniazid and rifabutin in lung tuberculosis treatment. Drug Dev Ind Pharm. 2019;45(8):1313–1320. doi: 10.1080/03639045.2019.1608231. [DOI] [PubMed] [Google Scholar]
- 39.Chono S, Kaneko K, Yamamoto E, et al. Effect of surface-mannose modification on aerosolized liposomal delivery to alveolar macrophages. Drug Dev Ind Pharm. 2010;36(1):102–107. doi: 10.3109/03639040903099744. [DOI] [PubMed] [Google Scholar]
- 40.Ma C, Wu M, Ye W, et al. Inhalable solid lipid nanoparticles for intracellular tuberculosis infection therapy: macrophage-targeting and pH-sensitive properties. Drug Deliv Transl Res. 2021;11(3):1218–1235. doi: 10.1007/s13346-020-00849-7. [DOI] [PubMed] [Google Scholar]


