Abstract
临床常用人眼识别癫痫颅内脑电异常放电致痫灶(EZ)定位的方式具有一定局限性,而目前通过提取颅内脑电特征进行致痫区定位的准确率也有待进一步提高。神经脆弱性作为一种运用动态网络模型的新方法,在癫痫致痫区定位方面表现出潜在的应用价值。本文采用神经脆弱性分析方法对20名患者35次癫痫发作的立体定向脑电图信号进行了分析,进而利用随机森林模型对致痫灶电极进行了分类,并与通过短时傅里叶变换提取的六个不同频段时频特征的分类结果进行了比较。结果显示,基于时频分析的致痫灶电极工作特征曲线下面积(AUC)介于0.870(δ频段)至0.956(高γ频段)之间,且曲线下面积随频段频率的升高而升高,而利用神经脆弱性进行分类的AUC可达0.957,且将神经脆弱性融合γ及高γ频段时频特性进行分类后AUC可进一步提升至0.969。本文验证了神经脆弱性在识别癫痫致痫病灶方面的有效性,为进一步的临床应用提供了理论参考。
Keywords: 癫痫, 神经脆弱性, 时频分析, 随机森林
Abstract
There are some limitations in the localization of epileptogenic zone commonly used by human eyes to identify abnormal discharges of intracranial electroencephalography in epilepsy. However, at present, the accuracy of the localization of epileptogenic zone by extracting intracranial electroencephalography features needs to be further improved. As a new method using dynamic network model, neural fragility has potential application value in the localization of epileptogenic zone. In this paper, the neural fragility analysis method was used to analyze the stereoelectroencephalography signals of 35 seizures in 20 patients, and then the epileptogenic zone electrodes were classified using the random forest model, and the classification results were compared with the time-frequency characteristics of six different frequency bands extracted by short-time Fourier transform. The results showed that the area under curve (AUC) of epileptic focus electrodes based on time-frequency analysis was 0.870 (delta) to 0.956 (high gamma), and its classification accuracy increased with the increase of frequency band, while the AUC by using neural fragility could reach 0.957. After fusing the neural fragility and the time-frequency characteristics of the γ and high γ band, the AUC could be further increased to 0.969, which was improved on the original basis. This paper verifies the effectiveness of neural fragility in identifying epileptogenic zone, and provides a theoretical reference for its further clinical application.
Keywords: Epilepsy, Neural fragility, Time-frequency analysis, Random forest
0. 引言
癫痫(epilepsy)是一种常见的慢性神经系统疾病,目前全球癫痫患者已经超过1 500万[1-2]。大部分癫痫患者可以通过药物治疗获得较好的疗效,但仍有约30%的患者为药物难治性癫痫(drug-resistant epilepsy,DRE)[3-5],据统计约有50%的耐药性癫痫为局灶性癫痫。对于这类患者,切除致痫区域(epileptogenic zone,EZ)可以完全消除癫痫发作[6-7],然而手术效果与致痫区域的定位准确程度密切相关。
立体定向脑电图(stereoelectroencephalography,SEEG)是一种侵入性的脑电图检测技术,主要通过脑内电极的立体定向植入来记录大脑深部结构的电活动,以确定癫痫发作起源及放电扩散的皮层区域[8-9]。癫痫发作时脑电图中会出现棘波、尖波、棘慢复合波、尖慢复合波以及高度节律失调等癫痫特征波[10-11]。由于颅内脑电的电极植入量很大,通过肉眼识别单一电极记录的五分钟时长的癫痫特征波便要花费一个小时左右[12-13],且人工阅图也极易受到主观性影响[14],因此为了进一步提升癫痫异常波的识别速度和精度,癫痫脑电特征信号的提取分析显得尤为重要。
癫痫脑电信号的时频特征是目前识别致痫病灶最常用的特征,常用的提取方法主要包括短时傅里叶变换、小波变换等[15-16]。早期研究人员更关注癫痫β和γ频段的快速放电或振荡,有研究发现致痫区的某种特定电生理特征会在这些特定频段有所表现[17-18]。近年来,高频振荡(high frequency oscillations,HFOs)的提出使得一些研究更关注于癫痫脑电高频段的时频特征[19]。基于HFOs和时频分析的致痫区自动识别方法也得到了广泛的应用。Jrad等[19]利用Gabor变换提取高频段特征并结合支持向量机进行了致痫灶电极定位。Lai等[20]利用短时能量估计和卷积神经网络方法结合HFOs对致痫灶进行了分类预测。虽然有研究证实HFOs与癫痫发生有着密不可分的关系[21],然而现有手段还无法将生理性HFOs(80~200 Hz)和病理性HFOs(200~500 Hz)分别提取出来,因此基于HFOs的癫痫病灶定位研究也受到了一定质疑。
近期,Li等[22]提出了以一种动态网络模型来预测癫痫发作以及致痫病灶定位的新方法,并命名为“神经脆弱性”。由于通常采集到的脑电信号都是徘徊在一个基线,而系统中每一个节点对干扰的承受能力不同,对于癫痫患者而言脆弱的神经元在较小的扰动作用下便会发生变化,因此只要计算在每个电极上使系统产生不稳定的最小扰动即可判断电极是否位于致痫区域。与时频分析不同的是,神经脆弱性方法不仅考虑了单个电极的特征,还将电极置于与其他电极间相互作用的动态网络中并利用它在网络中的特征进行致痫区定位。Li等[23]将神经脆弱性与包括不同频段时频特征在内的其他二十种常用于癫痫病灶定位的方式进行了对比,结果显示神经脆弱性的预测准确率要高于其他特征。
致痫区域的判定是癫痫病灶切除手术的重要一环,目前对癫痫颅内脑电信号的研究往往只注重单一通道的特征分析,对于多通道之间相互联系的研究相对较少,一些基于多通道特征进行致痫区定位方法的准确率也有待进一步提高。因此,本文以临床采集的癫痫患者SEEG信号为基础,分别提取癫痫发作前后的神经脆弱性特征以及不同频段的时频特征,利用随机森林模型分别对致痫灶电极进行分类,并将神经脆弱性和时频特征进行融合以进一步提升定位准确率,为神经脆弱性在癫痫定位的临床应用提供理论参考。
1. 方法
1.1. 数据来源
本文的数据来源于天津市环湖医院记录的癫痫患者24小时SEEG信号。将记录的数据按癫痫发作前30 s到癫痫结束截取数据,总共截取了20名患者共计35次癫痫发作时期的信号,并对所有癫痫SEEG数据进行重采样、滤波、去伪迹等预处理。同时由具有丰富临床经验的医生通过人工阅图方式识别判断并确定致痫灶电极与非致痫灶电极。
1.2. 神经脆弱性
首先利用滑动时间窗将原始信号分为多个时间段,而后在每个时间窗内计算时间转移矩阵,并以此为基础计算最小扰动:
 |
1 |
其中 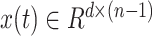 ,d为电极数目,n为时间窗内点的个数,且n>d,利用最小二乘的方式求解近似解A。A为单个时间窗内的时间转移矩阵,计算矩阵A的最小列扰动,即导致电极产生不稳定所需的最小扰动
,d为电极数目,n为时间窗内点的个数,且n>d,利用最小二乘的方式求解近似解A。A为单个时间窗内的时间转移矩阵,计算矩阵A的最小列扰动,即导致电极产生不稳定所需的最小扰动  ,具体公式如下:
,具体公式如下:
 |
2 |
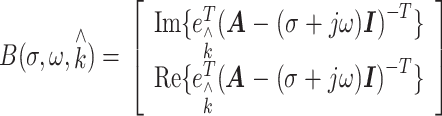 |
3 |
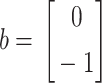 |
4 |
其中  ,d为电极数目,
,d为电极数目, ,
,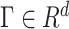 ,
,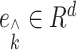 为第k个元素为1的单位向量。λ = σ + jω为设定的特征值,其中–1 < ω ≤ 1。所需最小扰动越小的电极发生癫痫的可能性越高。
为第k个元素为1的单位向量。λ = σ + jω为设定的特征值,其中–1 < ω ≤ 1。所需最小扰动越小的电极发生癫痫的可能性越高。
在计算每个节点的最小扰动后进行归一化:
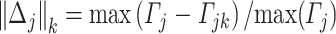 |
5 |
其中j代表时间窗所在位置,k代表电极位置, 即为神经脆弱性的大小。
即为神经脆弱性的大小。
2. 结果
2.1. 神经脆弱性分析及时频分析结果
本文以预处理后的癫痫SEEG数据为研究对象,首先根据动态网络模型对SEEG数据的神经脆弱性特征进行分析,得到癫痫患者SEEG信号神经脆弱性的时间分布热图。结果显示癫痫发作前后不同患者致痫区域的神经脆弱性特征都发生了明显变化。以P_01患者为例,图1给出了P_01患者癫痫发作前30 s到发作后60 s的神经脆弱性分布,其中虚线为识别到的患者SEEG信号发生明显变化的时间点,作为癫痫发作的起始时刻。由结果可以看出,在癫痫发作前不同电极的神经脆弱性存在差异,而癫痫发作后个别电极的脆弱性较发作前明显升高。由于癫痫首先在一个或几个电极发作而后扩散到多个电极,因此如图中结果所示,致痫灶电极与非致痫灶电极之间的差异随时间逐渐增大。
图 1.
Neural fragility heatmaps of P_01 patient
P_01患者神经脆弱性分布热图
为了探究神经脆弱性在所有患者致痫和非致痫灶电极间的差异,本文计算了20名患者共计35次癫痫发作后致痫灶电极和非致痫灶电极神经脆弱性的均值,结果如图2所示。其中,35名患者致痫区域的神经脆弱性为0.552 ± 0.146,非致痫区域为0.331 ± 0.127。配对样本t检验结果显示,癫痫患者致痫灶电极和非致痫灶电极神经脆弱性均值之间的差值为0.220,95%置信区间为0.189~0.251,具有统计学意义(P < 0.001)。
图 2.

Mean of neural fragility of EZ and nEZ electrodes in all patients
所有患者致痫灶电极和非致痫灶电极神经脆弱性的均值
将预处理后的SEEG数据按频率分为δ频段(0.5~4 Hz)、θ频段(4~8 Hz)、α频段(8~13 Hz)、β频段(13~30 Hz)、γ频段(30~90 Hz)以及高γ频段(90~250 Hz)六个频段,利用短时傅里叶变换方法分析癫痫患者所有电极通道SEEG信号能量随时间和频率变化的整体情况,得到不同频段时频特征分布热图。以P_01患者为例,其每个频段内的平均时频谱分布结果如图3所示。图中横轴为时间,纵轴为电极序号,虚线表示SEEG信号发生明显变化的时刻。为了消除各频段能量不同带来的影响,同时避免因电极植入位置和深度不同所造成的时频分布差异,以每一电极开始6 s的平均值为基线进行了归一化处理。从结果可以看出,δ、θ、α和β频段癫痫发作时的能量变化明显高于γ和高γ频段。此外在癫痫发作前δ、θ、α频段能量也会间歇出现不规律的变化,而γ和高γ频段则未出现较大的能量波动。
图 3.
Time frequency presentation of different frequency bands of P_ 01 patient
P_01患者不同频段时频图
2.2. 基于神经脆弱性和时频特征的病灶定位结果
本文通过随机森林方法提取SEEG神经脆弱性以及不同频段时频谱特征对致痫灶电极和非致痫灶电极进行了分类。在分类过程中,将不同特征分布热图中各个电极第10*n(n=1, 2, ..., 10)分位数作为电极特征值,每次随机抽取一名患者15%的电极为训练集,全部电极为测试集,并反复进行10次,以减小随机抽取的偶然性。图4给出了运用随机森林进行分类所得到的神经脆弱性以及6个频段时频谱特征分类结果的受试者工作特征曲线(receiver operating characteristic,ROC)。从基于时频谱特征的分类结果可以看出,γ频段和高γ频段的曲线下面积(area under curve,AUC)分别为0.946和0.956,δ、θ、α、β频段的曲线下面积分别为0.870、0.879、0.876、0.895,即γ和高γ频段的预测准确率要明显高于其余4个频段,同时γ和高γ频段预测的方差明显小于其他频段。结果还显示,基于神经脆弱性的曲线下面积为0.957,与时频谱分类结果相比,神经脆弱性具有更高的预测准确率。
图 4.
Receiver operating characteristic curves of different characteristics of epileptic SEEG
癫痫SEEG不同特征分类ROC曲线
对7种特征的独立样本t检验结果如表1所示。结果表明,基于神经脆弱性、γ频段和高γ频段时频谱与基于低频段δ、θ、α和β频段时频谱的曲线下面积比较,差异均有统计学意义(P<0.001),而基于神经脆弱性、高γ和γ频段时频谱的曲线下面积之间差异无统计学意义。
表 1. Independent sample t-test for AUC of different features.
不同特征预测曲线下面积独立样本t检验
| A组 vs. B组 | P值 | A组 vs. B组 | P值 | |
| γ vs. δ | < 0.001 | 神经脆弱性 vs. δ | < 0.01 | |
| γ vs. θ | < 0.001 | 神经脆弱性 vs. θ | < 0.001 | |
| γ vs. α | < 0.001 | 神经脆弱性 vs. α | < 0.001 | |
| γ vs. β | < 0.001 | 神经脆弱性 vs. β | < 0.001 | |
| 高γ vs. δ | < 0.001 | γ vs. 神经脆弱性 | 0.208 | |
| 高γ vs. θ | < 0.001 | γ vs. 高γ | 0.489 | |
| 高γ vs. α | < 0.001 | 高γ vs. 神经脆弱性 | 0.835 | |
| 高γ vs. β | < 0.001 | — | — |
进一步将神经脆弱性与时频分析中效果最好的γ和高γ频段的时频特征相结合,分别在决策层通过系数加权的方式将单个结果融合成最终的公共决策从而对致痫病灶进行定位,相应的曲线下面积结果如表2所示。神经脆弱性分别融合γ频段和高γ频段后,曲线下面积分别为0.966和0.963,相较于单一特征的神经脆弱性分类结果有所提高,而γ、高γ和神经脆弱性三者进行融合的曲线下面积可进一步提升至0.969。
表 2. AUC of different feature fusion.
不同特征融合的曲线下面积
| 特征 | AUC |
| 神经脆弱性+γ | 0.966 |
| 神经脆弱性+高γ | 0.963 |
| 神经脆弱性+γ+高γ | 0.969 |
3. 讨论
近二十年来的大量动物实验及临床试验证明,频率在80 Hz以上的信号与癫痫的发作息息相关。一系列使用SEEG、硬膜下电极或术中皮质脑电图的回顾性研究显示,手术切除产生高频震荡的组织可以达到良好的术后效果[24]。相比之下,低频功率升高不能作为癫痫发作的特殊标志,这主要是由于低频域信号的变化偶尔出现在发作间期或非病变区域所致[25]。本文中利用低频段时频谱的分类结果也证实了这一点,首先基于低频段(δ、θ、α、β)时频谱的分类准确率均低于高频段(γ、高γ),其次低频段预测准确率的平均方差也明显高于高频段。从时频分布热图中可以看出,在癫痫发作前δ、θ、α频段能量也会间歇出现不规律的波动,而γ和高γ频段则未出现较大的能量波动,这些不规律的波动可能与其他脑活动有关,这也导致了低频段时频谱特征的分类效果较差。γ频段(30~90 Hz)虽然不在高频振荡所在频率范围,但其分类准确率与其他低频段相比明显提升。在高频振荡还未得到普及之前,γ频段时频分析在癫痫病灶定位研究中占有一席之地[26]。
本文基于神经脆弱性的癫痫致痫区定位的曲线下面积为0.957,高于时频特征,通过将神经脆弱性与高频段时频特征进行融合后定位的曲线下面积为0.969。时频特征尤其是HFOs是癫痫病灶定位的常用方式,基于时频分析的癫痫定位往往能取得不错的效果,但大多数利用时频特性进行病灶定位的研究忽视了各个电极间的联系。目前的临床实践已有大量证据表明癫痫是一种网络性疾病[27-28]。癫痫发作时单个电极所在区域发生的变化往往会首先引起研究者的关注,但电极间的联系也不可忽视[29]。相对于时频分析从单一电极出发的方法,神经脆弱性考虑了整个电极系统对单个节点的影响。另一类方式是基于相关或相干性计算癫痫各电极之间的信号关系来构建复杂网络[30],通过网络中心度或聚类系数等特征参数进行病灶定位,虽然考虑了电极间的联系,但由于在癫痫发作方面的复杂网络方法仍缺乏理论支持,对最终的结果没有合理的解释,因此也还未取得广泛认可。神经脆弱性在计算单个电极的致痫性时综合考虑了所有电极信号对它产生的影响,同时从癫痫的结构脆弱性和网络组织等方面来描述癫痫,因此可获得较好的精度。本文通过提取癫痫患者神经脆弱性特征进行致痫灶电极与非致痫灶电极分类,验证了该方法的有效性,并通过将神经脆弱性和高频段时频特性进行融合,进一步提升了致痫区定位的准确度。
4. 总结
神经脆弱性方法从动态网络模型的角度出发,综合考虑了所有电极信号对单一电极的影响,在癫痫致痫区定位方面具有广阔的应用前景。本文首先对癫痫患者SEEG信号进行了神经脆弱性分析,结果显示所有患者癫痫发作前后致痫灶电极和非致痫灶电极的神经脆弱性均存在显著差异。而后通过随机森林模型对基于神经脆弱性和多个频段时频特征的分类结果进行了对比,结果表明基于神经脆弱性的分类准确率高于基于时频特征的分类结果,同时将神经脆弱性和高频段时频特征进行融合的定位准确率得到进一步提升,提示神经脆弱性在致痫灶电极识别方面具有较高的精度,为癫痫病灶定位提供了参考。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:尹宁负责指导、修改和审校论文,贾哲沛负责数据分析处理、撰写初稿和修改论文,王乐负责收集处理数据,董宜林负责修改和审校论文。
Funding Statement
国家科技部重点研发计划项目(2022YFC2402203)
References
- 1.Rajendra Acharya U, Fujita H, Sudarshan V K, et al Application of entropies for automated diagnosis of epilepsy using EEG signals: A review. Know-Based Syst. 2015;88:85–96. doi: 10.1016/j.knosys.2015.08.004. [DOI] [Google Scholar]
- 2.Beghi M, Cornaggia C M, Frigeni B, et al Learning disorders in epilepsy. Epilepsia. 2010;47(2):14–18. doi: 10.1111/j.1528-1167.2006.00681.x. [DOI] [PubMed] [Google Scholar]
- 3.熊敏, 苏化庆, 向明钧 癫痫发病机制的研究进展. 中国当代医药. 2019;26(30):24–27. doi: 10.3969/j.issn.1674-4721.2019.30.007. [DOI] [Google Scholar]
- 4.Worrell G A, Litt B, Lee K H, et al Unsupervised classification of high-frequency oscillations in human neocortical epilepsy and control patients. J Neurophysiol. 2010;104(5):2900–2912. doi: 10.1152/jn.01082.2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Piao Y S, Lu D H, Chen L, et al Neuropathological findings in intractable epilepsy: 435 Chinese cases. Brain Pathol. 2010;20(5):902–908. doi: 10.1111/j.1750-3639.2010.00386.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Jehi L The epileptogenic zone: concept and definition. Epilepsy Curr. 2018;18(1):12–16. doi: 10.5698/1535-7597.18.1.12. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.蒋忱希, 李晓楠 脑电活动高频振荡现象定位致痫区在癫痫外科中应用的研究进展. 癫痫与神经电生理学杂志. 2017;26(6):376–378. [Google Scholar]
- 8.Massimo C, Francesco C, Laura C, et al Stereoelectroencephalography in the presurgical evaluation of focal epilepsy: a retrospective analysis of 215 procedures. Neurosurgery. 2005;57(4):706–718. doi: 10.1227/01.NEU.0000176656.33523.1e. [DOI] [PubMed] [Google Scholar]
- 9.Xu C, Zhou W Stereoelectroencephalography-guided radiofrequency thermocoagulation (SEEG-guided RF-TC) in patients with drug-resistant focal epilepsy. Transl Neurosci. 2017;3(1):40–47. doi: 10.18679/CN11-6030_R.2017.006. [DOI] [Google Scholar]
- 10.马东华, 郑旭媛, 王真. 基于形态成分分析的癫痫脑电棘波检测. 生物医学工程学杂志, 2013, 30(4): 710-713, 723.
- 11.Rajendra Acharya U, Shu L O, Yuki H, et al Deep convolutional neural network for the automated detection and diagnosis of seizure using EEG signals. Comput Biol Med. 2018;100(1):270–278. doi: 10.1016/j.compbiomed.2017.09.017. [DOI] [PubMed] [Google Scholar]
- 12.李晓楠, 杨小枫 高频振荡自动检测方法的研究与进展. 临床神经外科杂志. 2018;15(4):314–317. [Google Scholar]
- 13.崔刚强, 夏良斌, 梁建峰, 等. 基于小波多尺度分析和极限学习机的癫痫脑电分类算法. 生物医学工程学杂志, 2016, 33(6): 1025-1030, 1038.
- 14.陈爽爽, 周卫东, 袁琦, 等 基于多特征的颅内脑电癫痫检测方法. 中国生物医学工程学报. 2013;32(3):279–283. [Google Scholar]
- 15.张健钊, 姜威, 贲睨烨 基于样本熵与小波包能量特征提取和Real AdaBoost算法的正常期、癫痫间歇与发作期的脑电自动检测. 生物医学工程学杂志. 2016;33(6):1031–1038. [PubMed] [Google Scholar]
- 16.刘伟楠, 刘燕, 佟宝同, 等 基于功率谱的睡眠中癫痫发作预测. 生物医学工程学杂志. 2018;35(3):329–336. doi: 10.7507/1001-5515.201708062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Wendling F, Bartolomei F, Bellanger J, et al. Epileptic fast intracerebral EEG activity: evidence for spatial decorrelation at seizure onset. Brain, 2003, 126(Pt 6): 1449-1459.
- 18.Jacobs J, LeVan P, Chtillon C, et al. High frequency oscillations in intracranial EEGs mark epileptogenicity rather than lesion type. Brain, 2009, 132(Pt 4): 1022-1037.
- 19.Jrad N, Kachenoura A, Merlet I, et al Automatic detection and classification of high-frequency oscillations in depth-EEG signals. IEEE T Bio Eng. 2016;64(9):2230–2240. doi: 10.1109/TBME.2016.2633391. [DOI] [PubMed] [Google Scholar]
- 20.Lai D, Zhang X, Ma K, et al Automated detection of high frequency oscillations in intracranial EEG using the combination of short-time energy and convolutional neural networks. IEEE Access. 2019;7:82501–82511. doi: 10.1109/ACCESS.2019.2923281. [DOI] [Google Scholar]
- 21.练欢, 但炜, 谢延风, 等 高频振荡对致痫灶定位的研究进展. 临床神经外科杂志. 2022;19(2):224–227. [Google Scholar]
- 22.Li A, Inati S, Zaghloul K, et al. Fragility in epileptic networks: the epileptogenic zone// 2017 American Control Conference(ACC). Seattle: IEEE, 2017: 2817-2822.
- 23.Li A, Huynh C, Fitzgerald Z, et al Neural fragility as an EEG marker of the seizure onset zone. Nat Neurosci. 2021;24(10):1465–1474. doi: 10.1038/s41593-021-00901-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Jacobs J, Zijlmans M, Zelmann R, et al High-frequency electroencephalographic oscillations correlate with outcome of epilepsy surgery. Ann Neurol. 2010;67(2):209–220. doi: 10.1002/ana.21847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Tang X, Xia L Liu W, et al Analysis of frequency domain of EEG signals in clinical location of epileptic focus. Clin EEG Neursci. 2013;44(1):25–30. doi: 10.1177/1550059412451215. [DOI] [PubMed] [Google Scholar]
- 26.闫秀鹏, 王海祥, 周文静, 等 基于高频颅内脑电的致痫区定位和网络分析. 北京生物医学工程. 2017;36(3):229–236. [Google Scholar]
- 27.姚晨, 王圆庆, 黎思娴, 等 论癫痫症状学. 癫痫杂志. 2022;8(2):174–183. [Google Scholar]
- 28.李尊钰, 袁冠前, 黄平, 等 基于立体定向脑电图的颞叶致痫网络独立有效相干分析. 生物医学工程学杂志. 2019;36(4):541–547. doi: 10.7507/1001-5515.201806003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Grinenko O, Li J, Mosher J C, et al A fingerprint of the epileptogenic zone in human epilepsies. Brain. 2018;141(1):117–131. doi: 10.1093/brain/awx306. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Yaffe R B, Borger P, Megevand P, et al Physiology of functional and effective networks in epilepsy. Clin Neurophysiol. 2015;126(2):227–236. doi: 10.1016/j.clinph.2014.09.009. [DOI] [PubMed] [Google Scholar]





