Resumen
El síndrome de insuficiencia cardíaca (IC) es un problema de salud pública global. Por su parte, la diabetes tipo 2 es un factor de riesgo asociado a sobrepeso/obesidad y sedentarismo. El presente consenso busca recopilar la información disponible sobre la relación entre la IC y la diabetes tipo 2, y presentar, de manera práctica y resumida, las recomendaciones de manejo basadas en la evidencia científica. El documento se estructura en la descripción de la epidemiología de la IC y la diabetes tipo 2; la fisiopatología de la IC y la diabetes tipo 2; las complicaciones cardiovasculares de la diabetes tipo 2; los estadios de la IC; el manejo de la diabetes tipo 2 en pacientes con IC; y el manejo de la IC en pacientes con diabetes tipo 2. Por último, en el apartado de conclusiones se presenta una clara tendencia creciente de ambos eventos y se señala la necesidad del inicio de actividades preventivas, así como también el papel favorable de los fármacos antidiabéticos en el tratamiento de los pacientes con IC.
Palabras clave: Insuficiencia cardíaca, Diabetes tipo 2, Consenso
Abstract
Heart failure (HF) syndrome is a global public health issue. On the other hand, type 2 diabetes is a risk factor associated with overweight/obesity and a sedentary lifestyle. This consensus aims to compile information available on the relationship between HF and type 2 diabetes and present, in a summarized and practical way, the management recommendations based on scientific evidence. The document includes the description of the epidemiology of HF and type 2 diabetes; pathophysiology of HF and type 2 diabetes; cardiovascular complications of type 2 diabetes; stages of HF; management of type 2 diabetes in patients with HF; and management of HF in patients with type 2 diabetes. Lastly, in the conclusions section, the growing trend of both events and the need to start preventive activities is presented, as well as the favorable role of antidiabetic drugs in the treatment of patients with HF.
Keywords: Heart failure, Type 2 diabetes, Consensus
Introducción
El síndrome de insuficiencia cardíaca (IC) es un problema de salud pública tanto en los países desarrollados como en aquellos en vías de desarrollo. La magnitud del problema radica principalmente en su alta tasa de morbimortalidad y en los altos gastos de salud relacionados, en primera instancia, a su tratamiento en etapas avanzadas1-3. Latinoamérica es una región heterogénea, con países desarrollados y en vías de desarrollo, con factores de riesgo relevantes para la presentación de IC, como son la hipertensión arterial, la fiebre reumática y la enfermedad de Chagas4.
La diabetes tipo 2 como factor de riesgo cardiovascular modificable ha aumentado de manera vertiginosa en nuestra región, probablemente como consecuencia de los fenómenos de sobrepeso/obesidad y sedentarismo, los cuales han afectado a millones de personas de manera silenciosa desde mucho antes que la pandemia por SARS-CoV-25.
El Consejo Interamericano de Falla Cardíaca e Hipertensión Pulmonar (CIFACAH) de la Sociedad Interamericana de Cardiología (SIAC) decidió convocar un grupo de trabajo formado por expertos de todo el continente americano para la revisión científica del binomio IC y diabetes tipo 2. El objetivo del presente documento es recopilar la información disponible sobre la relación entre la IC y la diabetes tipo 2, y presentar de manera práctica y resumida las recomendaciones de manejo basadas en la evidencia científica hasta el momento de la revisión.
Epidemiología de la diabetes tipo 2 en Latinoamérica
La diabetes tipo 2 es uno de los mayores problemas para los sistemas de salud de los países de Latinoamérica. La International Diabetes Federation (IDF) calcula que 34 millones de adultos con diabetes tipo 2 residen en nuestra región, y pronostica un crecimiento del 62% en el número de casos esperados para el año 20455,6. Según datos publicados por la IDF en 2019, en Latinoamérica 12 países tenían una prevalencia de diabetes tipo 2 por arriba del valor promedio mundial. De estos, los países con mayor prevalencia de diabetes tipo 2 en adultos de entre 20 y 79 años en la región fueron Puerto Rico (15.4%), México (14.8%), Cuba (10.68%), Nicaragua (10.0%) y Costa Rica (9.5%), mientras que los países con menor prevalencia fueron Ecuador (5.5%), Perú (5.6%), Honduras (6.0%), Argentina (6.2%) y Bolivia (6.2%). De otro lado, los países que tuvieron mayor número de pacientes fallecidos por diabetes tipo 2 por año fueron Brasil (108,587), México (85,931), Colombia (17,037), Argentina (15,545) y Venezuela (10,241)1,3.
En la mayoría de los países de la región, la diabetes tipo 2 se encuentra entre las primeras cinco causas de mortalidad. Entre los pacientes con diabetes tipo 2, las causas de muerte más frecuentes son la cardiopatía isquémica y los infartos cerebrales5.
La obesidad en Latinoamérica ha aumentado en niños, adolescentes y en especial en adultos jóvenes. En la mayoría de los países de Latinoamérica, más del 40% de los adultos tienen un índice de masa corporal mayor de 25 kg/m2. Existen factores ambientales que contribuyen al incremento de la prevalencia de la obesidad, como los cambios en los patrones de alimentación, el incremento en el acceso y el consumo de alimentos y bebidas con alta densidad calórica, la disminución del tiempo dedicado a la actividad física y el incremento de las labores sedentarias7.
El síndrome metabólico permite la detección a mediano plazo de casos con alto riesgo de desarrollar diabetes tipo 2. La prevalencia del síndrome metabólico en Latinoamérica es alta, reportándose desde el 18.8% en Perú hasta el 49.8% en México8.
Existen particularidades de los pacientes con diabetes tipo 2 en Latinoamérica. Los movimientos migratorios de las provincias o zonas rurales hacia las capitales o zonas urbanas determinan cambios de conducta que incrementan el riesgo de desarrollar diabetes tipo 2. En 2018, el 82% de la población latinoamericana se concentraba en zonas urbanas, fenómeno en transición por la creciente migración y urbanización de las comunidades. La etnicidad amerindia o afroamericana se asocia a mayor riesgo de diabetes tipo 2. El componente genético amerindio aumenta el riesgo de diabetes tipo 2 por las variantes en los genes SLC16A11 y HNF19. La población de origen nativo americano expresa la diabetes tipo 2 a una edad más temprana y con índices de masa corporal más bajos en comparación con los caucásicos. Alguna comorbilidad, como el colesterol unido a lipoproteínas de alta densidad (HDL) bajo y la hipertrigliceridemia, así como complicaciones crónicas como la retinopatía y la nefropatía diabéticas, son más comunes en los mestizos. La etnicidad afroamericana aumenta el riesgo de tener hipertensión arterial y obesidad.
Los factores de riesgo cardiovascular son comunes entre las personas con diabetes tipo 2; si se incluyen solo los modificables, como la hipercolesterolemia, la hipertensión arterial y el tabaquismo, existe una prevalencia del 65%. El colesterol unido a lipoproteínas de baja densidad (LDL) > 100 mg/dl está presente en el 74.8% de las personas con diabetes tipo 2. Por otro lado, el 50% de las personas con diabetes tipo 2 padecen hipertensión arterial10,11. La aparición temprana de la enfermedad en poblaciones mestizas aumenta el impacto social y económico de la diabetes tipo 2 en Latinoamérica, ya que incrementa la probabilidad de sufrir complicaciones crónicas e incapacidad de forma prematura en etapas productivas de la vida5.
De la diabetes tipo 2 a la insuficiencia cardíaca
A través de los estudios epidemiológicos hemos aprendido que la IC y la diabetes tipo 2 tienen una relación frecuente, con implicaciones relevantes desde la perspectiva de la fisiopatología y el pronóstico de ambas enfermedades. Los primeros datos acerca de su relación se remontan al estudio de Framingham, en el cual se reportó que los hombres y las mujeres con diabetes tipo 2 presentaban un riesgo 2 y 4 veces mayor, respectivamente, de desarrollar IC durante los 18 años de seguimiento en comparación con los no diabéticos12.
Esta relación entre la IC y la diabetes tipo 2 ha sido confirmada por otros estudios epidemiológicos, como el estudio de Reykjavik13, que reportó que la prevalencia de la IC era del 12% en los pacientes con diabetes tipo 2 y del 3% en los no diabéticos, o el estudio de seguimiento de la National Health and Nutrition Examination Survey (NHANES), que mostró un riesgo relativo de 1.814.
En relación con las hospitalizaciones, los pacientes con diabetes tipo 2 y con IC tienen una frecuencia de hospitalizaciones de 2.2 a 4.3 veces más que los no diabéticos, independientemente de que se trate de pacientes con IC con fracción de eyección preservada (ICFEP) o con fracción de eyección reducida (ICFER), y tienen el doble de riesgo de muerte por causas cardiovasculares y no cardiovasculares que los no diabéticos durante la hospitalización15,16.
De la insuficiencia cardíaca a la diabetes tipo 2
La prevalencia de la diabetes tipo 2 en los pacientes con IC es mayor que en la población en general. En el estudio Randomized Evaluation of Strategies for Left Ventricular Dysfunction (RESOLVD)17, el 43% de los pacientes con disfunción ventricular izquierda tenían diabetes tipo 2 o intolerancia a la glucosa al inicio del estudio. En el Studies of Left Ventricular Dysfunction (SOLVD)18 se detectó diabetes de reciente inicio en el 22% de los pacientes en seguimiento. En un estudio de cohorte con más de 5000 pacientes con diagnóstico de IC de novo, el 27.3% de los pacientes desarrollaron diabetes tipo 2 durante el seguimiento a 5 años19. Lo anterior se puede explicar, en parte, porque la IC se asocia con la alteración del metabolismo miocárdico por un cambio del uso de los ácidos grados al uso de glucosa, con acumulación de productos lipídicos que inhiben la señalización de la insulina20.
En un estudio de cohorte de pacientes con IC, la resistencia a la insulina se correlacionó con factores metabólicos como la circunferencia de la cintura, los triglicéridos séricos y el colesterol HDL, y con factores pronósticos como la clase funcional de la New York Heart Association (NYHA)21.
Los pacientes con IC pueden tener sensibilidad a la insulina disminuida, niveles de insulina aumentados e intolerancia a la glucosa sin presentar alteraciones de la glucosa en ayunas22. En la transición de la resistencia a la insulina a la diabetes tipo 2, alrededor del 20-40% de la masa de células de los islotes pancreáticos se pierde por apoptosis23.
Los estudios clínicos relacionados con el tratamiento farmacológico en la ICFER, como el Candesartan in Heart Failure Assessment of Reduction in Mortality and Morbidity (CHARM)24 y el Prospective Comparison of ARNI With ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure (PARADIGM-HF)25, demostraron que el 22-25% de los pacientes eran prediabéticos y el 13-26% eran diabéticos tipo 2 no diagnosticados.
Fisiopatología de la insuficiencia cardíaca y la diabetes tipo 2
Numerosos estudios observacionales han demostrado que la diabetes tipo 2 se asocia con un mayor riesgo de desarrollar IC. Los estudios clínicos también han demostrado que la presencia de resistencia a la insulina se asocia a mayor riesgo de IC. Desde el punto de vista clínico, las principales causas de IC en el paciente con diabetes tipo 2 son la enfermedad coronaria y la hipertensión arterial, pero también la favorecen la disfunción renal, la obesidad y el efecto perjudicial directo de diabetes tipo 2 sobre el miocardio26.
El verdadero mecanismo subyacente del circuito de retroalimentación entre la diabetes tipo 2 y la ICFER es la resistencia a la insulina, mientras que la hiperglucemia representa un mecanismo posterior que contribuye a esta interacción de retroalimentación. Ambos factores producen múltiples cambios fisiopatológicos en el sistema cardiovascular, incluyendo la disfunción endotelial, el deterioro de la eficiencia energética, la lipotoxicidad, la activación inflamatoria, la acumulación de derivados del oxígeno y la miocardiopatía inducida por hiperglucemia (Fig. 1)27.
Figura 1.
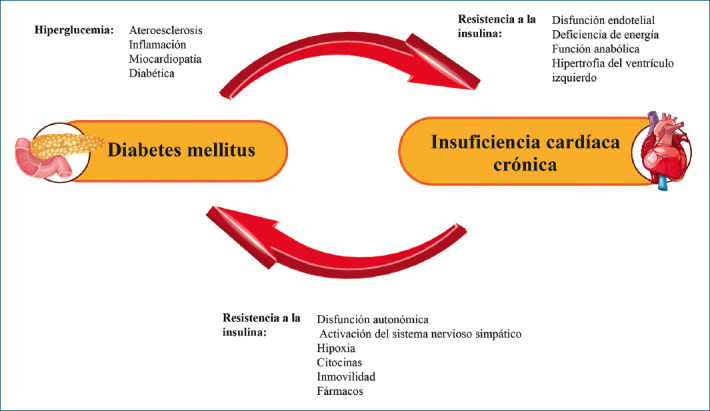
Mecanismos humorales y celulares que favorecen la aparición de insuficiencia cardíaca en los pacientes con diabetes tipo 2.
Resistencia a la insulina en la insuficiencia cardíaca
Si bien la diabetes tipo 2 puede contribuir al desarrollo de IC, varios aspectos fisiopatológicos de la IC también contribuyen al desarrollo de resistencia a la insulina (Fig. 2).
Figura 2.
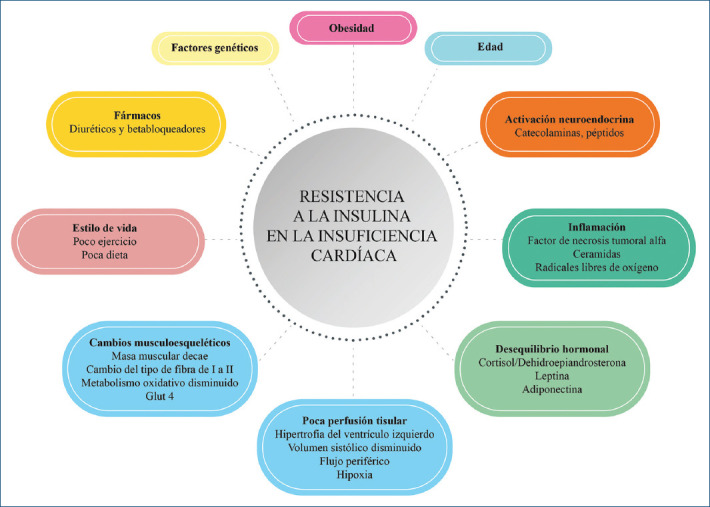
Fisiopatología de la resistencia a la insulina en la insuficiencia cardíaca.
Existen factores específicos relacionados con la IC que contribuyen al desarrollo de resistencia a la insulina, como la activación neuroendocrina y la activación inflamatoria. Se ha demostrado que los sistemas hormonales están anormalmente regulados en la IC. La baja perfusión tisular conduce a hipoxia en varios tejidos y órganos periféricos, y puede provocar cambios en el miocardio y en el músculo esquelético, afectando el tipo de fibra, el metabolismo oxidativo y el transportador de glucosa tipo 1 y 428.
Miocardiopatía diabética
Se entiende por miocardiopatía diabética a la disfunción miocárdica presente en el paciente diabético en ausencia de otra causa cardiovascular (hipertensiva, valvular o isquémica). El corazón del diabético tiene una alteración del metabolismo energético. En condiciones normales, el corazón obtiene su energía en un 70% a partir de la oxidación de ácidos grasos libres. En el diabético, la oxidación de ácidos grasos libres se incrementa hasta un 90%, contribuyendo a anormalidades en el metabolismo energético y la disfunción cardíaca. Los niveles elevados de ácidos grasos libres causan acumulación de lípidos en los cardiomiocitos, con las subsecuentes lipotoxicidad y apoptosis, desarrollando disfunción miocárdica aun en ausencia de enfermedad cardíaca estructural. Esta mala adaptación conduce a una disminución de las reservas energéticas y de la eficiencia cardíaca29.
Complicaciones cardiovasculares en el paciente con diabetes tipo 2
El riesgo de por vida de desarrollar enfermedad cardiovascular en los diabéticos tipo 2 es alto: un 67% en los hombres y un 57% en las mujeres a la edad de 50 años30. En un metaanálisis de 37 estudios de cohorte prospectivos, la tasa de enfermedad coronaria mortal fue aproximadamente 3.5 veces mayor en los pacientes con diabetes tipo 2 que en aquellos sin diabetes31.
La evidencia indica que el riesgo de enfermedad cardiovascular comienza en la prediabetes y aumenta significativamente en las personas con diabetes tipo 2. La glucosa alterada en ayunas (100-126 mg%) aumenta de forma independiente el riesgo de enfermedad coronaria en un 15% en mujeres y en un 7% en hombres32.
La diabetes tipo 2 está asociada con un aumento significativo de la mortalidad por todas las causas, un aumento de la mortalidad de 2 veces en los hombres y un aumento de la mortalidad de 3 veces en las mujeres33.
Aunque la incidencia de complicaciones relacionadas con la diabetes tipo 2 ha disminuido en las últimas dos décadas, los pacientes con diabetes tipo 2 siguen teniendo un riesgo significativamente mayor de complicaciones cardiovasculares en comparación con las personas sin diabetes34.
La enfermedad macrovascular conduce a infarto de miocardio (IM), accidente vascular cerebral (AVC) y enfermedad arterial periférica. El proceso patológico primario asociado con la enfermedad macrovascular es la aterosclerosis. La diabetes tipo 2 confiere una elevación aproximada de 2 veces en el riesgo de enfermedad cardiovascular; riesgo equivalente a la presencia de un IM previo. Los pacientes con diabetes tipo 2 tienen peores resultados después de un síndrome coronario agudo y tasas más altas de reinfarto y de IC35,36.
La enfermedad microvascular conduce a retinopatía, nefropatía y neuropatía, que son las principales causas de morbilidad en los pacientes diabéticos. Estas formas de enfermedad microvascular están relacionadas con la duración de la hiperglucemia y sus efectos posteriores, como la acumulación de poliol, la lesión inducida por productos finales de glicación avanzada, la permeabilidad vascular y el estrés oxidativo37.
Estadios de la insuficiencia cardíaca en los pacientes con diabetes tipo 2
De manera conjunta, la American Heart Association y el American College of Cardiology clasificaron la IC en estadios, con el objetivo de implementar medidas terapéuticas en el continuo cardiovascular de la IC. Esta clasificación de consenso en estadios A a D ha permitido establecer recomendaciones terapéuticas de forma sistemática38.
En el estadio A, considerado el estadio primordial de la IC, se incluyen los pacientes con diabetes tipo 2 y aquellos con factores de riesgo para desarrollo de IC, como hipertensión, obesidad y antecedentes familiares de enfermedad cardíaca. En este estadio se promueven las medidas preventivas y las modificaciones del estilo de vida.
En el estadio B, considerado de «preinsuficiencia», existe evidencia de disfunción diastólica o sistólica asintomática. Este estadio de preinsuficiencia puede encontrarse hasta en el 27.6% de los pacientes diabéticos en estudios ecocardiográficos39. Las recomendaciones terapéuticas en este estadio se enfocan en el control de los factores de riesgo cardiovascular, optimizar el control de la diabetes tipo 2 y abordar las alteraciones estructurales mediante terapia farmacológica y modificaciones en el estilo de vida.
En el estadio C, los pacientes manifiestan síntomas de IC en presencia de patología estructural cardíaca. El manejo de estos pacientes debe ser multidisciplinario e integral. Se incluyen en el manejo multidisciplinario modificaciones en el estilo de vida y terapia farmacológica específica para la IC y la comorbilidad, con el objetivo de reducir la mortalidad y las hospitalizaciones, mejorar la calidad de vida y prevenir la progresión de la IC.
En el estadio D, denominado estadio de «IC avanzada», existe persistencia de la sintomatología a pesar del tratamiento médico óptimo y generalmente los pacientes requieren opciones de tratamiento avanzado, como trasplante cardíaco, soporte circulatorio mecánico o cuidados paliativos. Según la base de datos de la United Network of Organ Sharing, aproximadamente el 18% de los pacientes sometidos a trasplante cardíaco son diabéticos y la sobrevida a largo plazo de los pacientes con diabetes no complicada es similar a la de los pacientes no diabéticos40.
Es importante señalar que, en todos los estadios de la IC, el control de la diabetes tipo 2 desempeña un papel fundamental en el manejo de la IC en los pacientes diabéticos. El control estricto de la glucemia, junto con el manejo de cualquier otra comorbilidad, puede ayudar a mejorar los resultados clínicos y reducir el riesgo de progresión de la IC.
Biomarcadores en la insuficiencia cardíaca y la diabetes tipo 2
Existen biomarcadores que pueden ser utilizados para el diagnóstico y el pronóstico de la IC en los pacientes diabéticos. En primer lugar, tenemos los péptidos natriuréticos, los cuales se liberan en respuesta al estrés parietal cardíaco y permiten establecer el diagnóstico de IC. El uso de los péptidos natriuréticos para el diagnóstico de IC en pacientes con sospecha de IC tiene un nivel de evidencia I en las guías actuales41,42. Existen pocos estudios relacionados con el uso de los péptidos natriuréticos en prevención primaria de la IC. El estudio PONTIAC evaluó la estrategia de titulación de terapia neurohormonal en pacientes diabéticos de alto riesgo basada en el valor de la porción N-terminal del propéptido natriurético tipo B (NT-proBNP). En este estudio, el desenlace primario compuesto de muerte/hospitalización por causa cardíaca se redujo significativamente en el grupo de intervención. Pese a las críticas metodológicas, este estudio demostró una oportunidad de prevención de la IC en los pacientes diabéticos43.
Las troponinas cardíacas son unas proteínas estructurales del miocito cuya presencia en sangre traduce daño cardíaco. En los pacientes con IC hay concentraciones anormales de troponinas cardíacas circulantes. Esta producción de troponinas cardíacas se asocia con una alteración de la hemodinámica o disfunción cardíaca. Los valores elevados de troponinas cardíacas se asocian con mayor riesgo de eventos cardiovasculares y peor pronóstico44.
La albuminuria está relacionada con daño glomerular y suele referirse como un biomarcador de función renal. Sin embargo, la IC puede estar asociada con el desarrollo de albuminuria y se ha relacionado con un mayor riesgo de eventos cardiovasculares y peor pronóstico. En un reciente análisis del registro BIOSTAT-CHF se observó que la presencia de micro- o macroalbuminuria se relacionó con la expresión de biomarcadores de congestión cardíaca, como el NT-proBNP. Además, los pacientes con micro- o macroalbuminuria tuvieron peor pronóstico que aquellos con normoalbuminuria45.
Manejo de la diabetes tipo 2 en los pacientes con insuficiencia cardíaca
Medidas no farmacológicas
Las principales medidas no farmacológicas en el manejo de la IC en los pacientes diabéticos están relacionadas con cambios en estilo de vida. Las intervenciones en el estilo de vida enfocadas en la pérdida de peso mediante modificaciones en la ingesta calórica y la actividad física mejoran el control glucémico y el estado físico de los pacientes diabéticos46. El ejercicio puede mejorar la capacidad funcional de los pacientes con diabetes tipo 2 e IC. En el estudio HF-ACTION, los pacientes con diabetes tipo 2 que fueron incluidos en el grupo de intervención tuvieron una mejoría significativa del consumo máximo de oxígeno y de la caminata de 6 minutos en comparación con el grupo de tratamiento habitual47.
Se debe sugerir a todo paciente diabético tipo 2 con sobrepeso u obesidad la pérdida de peso de forma gradual con la combinación del control de calorías y la realización de actividad física.
Medidas farmacológicas
El objetivo del manejo farmacológico de la diabetes tipo 2 en los pacientes con IC debe ir más allá del control glucémico. Hay que tener en cuenta que muchos medicamentos antidiabéticos pueden empeorar la IC por su efecto antinatriurético y sus posibles efectos adversos en el miocardio; algunos incluso pueden propiciar arritmias cardíacas y llevar a la muerte48. A continuación, se detallan los grupos farmacológicos para el control glucémico y la evidencia relacionada con el riesgo cardiovascular.
METFORMINA
La metformina, en un análisis originado del UKPDS, logró una reducción de IM del 39%, de la muerte de causa coronaria del 50% y de AVC del 41%49. Se ha demostrado su seguridad en todos los estadios de la IC, con tasas de muerte y de hospitalización más bajas que para la insulina y las sulfonilureas50,51.
Ha existido una consideración especial sobre la ocurrencia de acidosis láctica con el uso de metformina. Sin embargo, en un metaanálisis52 de pacientes utilizando metformina, en comparación con otros antihiperglucemiantes, no se demostró de manera consistente un aumento de la acidosis láctica con metformina, por lo que sigue teniendo un perfil de seguridad adecuado.
SULFONILUREAS
Las sulfonilureas muestran datos de seguridad inconsistentes. En algunos estudios observacionales, la terapia con sulfonilureas se asoció con mayor riesgo de muerte en pacientes con IC29. Un estudio canadiense de registros de pacientes mostró un aumento de la mortalidad en los pacientes que estaban usando una sulfonilurea (hazard ratio [HR]: 2.0; intervalo de confianza del 95% [IC95%]: 1.9-2.2)53. Otros estudios, como el Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified Release Controlled Evaluation (ADVANCE), no hallaron diferencias en el riesgo de hospitalizaciones por IC en pacientes con control intensivo con estos medicamentos en comparación con los que recibieron el tratamiento estándar54.
TIAZOLIDINEDIONAS
Las tiazolidinedionas han demostrado un aumento significativo de la hospitalización por IC en pacientes sin datos de IC previa. En el estudio PROactive, que incluyó 5238 pacientes con enfermedad macrovascular, la pioglitazona se asoció con una disminución de muertes por causa cardiovascular, AVC e IM, pero hubo un aumento en el riesgo de eventos por IC en comparación con placebo55. En el estudio RECORD, que incluyó 4447 pacientes sin IC, el riesgo de muerte o de hospitalización por IC aumentó casi al doble con el uso de rosiglitazona en comparación con sulfonilureas y metformina56. Basándose en la evidencia científica, estos medicamentos están contraindicados en los pacientes con IC.
INHIBIDORES DEL COTRANSPORTADOR DE SODIO Y GLUCOSA TIPO 2
Los inhibidores del cotransportador de sodio y glucosa tipo 2 (iSGLT2), o gliflozinas, han revolucionado el manejo del control glucémico. Estos fármacos se iniciaron como una opción más dentro del arsenal para las hiperglucemias, pero tras los estudios seguridad cardiovascular se cambió la perspectiva de estos medicamentos en materia de prevención cardiovascular (Tabla 1).
Table 1.
Estudios clínicos de seguridad cardiovascular con iSGLT2
| EMPA-REG OUTCOME57 | CANVAS58 | DECLARE-TIMI 5859 | |
|---|---|---|---|
| Diseño | |||
| – Número de pacientes | 7020 | 10,142 | 17,160 |
| – Pacientes con enfermedad CV | > 99% | 65.6% | 40.6% |
| – Desenlace primario | Eventos CV mayores «de 3 puntos» | Eventos CV mayores «de 3 puntos» | Eventos CV mayores «de 3 puntos» |
| – Desenlaces secundarios | Muerte CV/HIC, HIC | Muerte CV/HIC, HIC | Muerte CV/HIC, HIC |
| – Seguimiento | 3.1 años | 2.4 años | 4.2 años |
| Resultados | |||
| – Eventos CV mayores «de 3 puntos» | HR: 0.86 (IC95%: 0.74-0.99) | HR: 0.86 (IC95%: 0.75-0.97) | HR: 0.93 (IC95%: 0.84-1.03) |
| – Muerte CV/HIC | HR: 0.66 (IC95%: 0.55-0.79) | HR: 0.78 (IC95%: 0.67-0.91) | RH: 0.83 (IC95%: 0.73-0.95) |
| – HIC | HR: 0.65 (IC95%: 0.50-0.85) | HR: 0.67 (IC95%: 0.52-0.87) | HR: 0.73 (IC95%: 0.61-0.88) |
CANVAS: Canagliflozin Cardiovascular Assessment Study; CV: cardiovascular; DECLARE-TIMI 58: Dapagliflozin Effect on Cardiovascular Events–Thrombolysis in Myocardial Infarction 58; EMPA-REG OUTCOME: Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients; HIC: hospitalización por insuficiencia cardíaca; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
El primer estudio publicado relacionado con las gliflozinas fue el Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients (EMPA-REG OUTCOME), con empagliflozina, en el que se evaluó el riesgo de muerte por causa cardiovascular, IM no fatal y AVC no fatal en pacientes con diabetes. En el estudio se logró una reducción del 14% del objetivo combinado de muerte por causa cardiovascular, IM no fatal y AVC no fatal (HR: 0.86; IC95%: 0.74-0.99), y adicionalmente se logró una reducción del 35% en el riesgo de hospitalización por IC (HR: 0.65; IC95%: 0.50-0.85)57.
Posteriormente se publicó el Canagliflozin Cardiovascular Assessment Study (CANVAS), con canagliflozina, que involucró un mayor número de pacientes con riesgo cardiovascular. En este estudio se logró una reducción del 16% del objetivo combinado de muerte por causa cardiovascular, IM no fatal y AVC no fatal (HR: 0.86; IC95%: 0.75-0.97), y de modo similar al estudio anterior, se logró una reducción del 33% en el riesgo de hospitalización por IC (HR: 0.67; IC95%: 0.52-0.87)58.
El estudio Dapagliflozin Effect on Cardiovascular Events–Thrombolysis in Myocardial Infarction 58 (DECLARE-TIMI 58), con dapagliflozina, incluyó el mayor número de pacientes con riesgo cardiovascular, para prevención tanto primaria como secundaria. Este estudio demostró la reducción del objetivo combinado de muerte u hospitalización por IC (HR: 0.83; IC95%: 0.73-0.95)59.
Los estudios Comparative Effectiveness of Cardiovascular Outcomes in New Users of SGLT-2 Inhibitors (CVD-REAL) 1 y CVD-REAL 2 han logrado demostrar la efectividad y la seguridad de los iSGLT2 en relación con la enfermedad cardiovascular como un efecto de clase60,61.
INHIBIDORES DE LA DIPEPTIDIL-PEPTIDASA 4
El primer estudio de seguridad cardiovascular con inhibidores de la dipeptidil-peptidasa 4 (iDDP4) fue el Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus – Thrombolysis in Myocardial Infarction 53 (SAVOR-TIMI 53), que incluyó 16,492 pacientes con diabetes de alto riesgo cardiovascular y comparó el tratamiento con saxagliptina frente a placebo. En este estudio, el desenlace cardiovascular primario combinado de muerte por causa cardiovascular, IM no fatal o AVC no fatal fue similar en ambos grupos. Además, el uso de saxagliptina se relacionó con un aumento de las hospitalizaciones por IC (HR: 1.27; IC95%: 1.07-1.51)62.
Un análisis post hoc de los pacientes que requirieron hospitalización por IC del estudio SAVOR-TIMI 53 demostró que los pacientes con mayor tasa de hospitalización por IC tenían otros factores adicionales, como compromiso de la función renal y una elevada concentración de péptidos natriuréticos63.
Otros tres estudios de desenlaces cardiovasculares con alogliptina, sitagliptina y linagliptina (EXAMINE, TECOS y CARMELINA, respectivamente) no demostraron un aumento significativo en el riesgo de hospitalización por IC con el uso de iDDP4 en comparación con placebo64-66.
AGONISTAS DEL RECEPTOR DEL PÉPTIDO SIMILAR AL GLUCAGÓN TIPO 1
Los agonistas del receptor del péptido similar al glucagón tipo 1 (aGLP-1) han demostrado seguridad cardiovascular en sus ensayos clínicos, e incluso dos fármacos del grupo, la liraglutida y la semaglutida, han demostrado una reducción del riesgo cardiovascular. Además, los aGLP-1 no aumentan el riesgo de hospitalizaciones por IC.
El primer estudio de seguridad cardiovascular con aGLP-1 fue el Evaluation of Lixisenatide in Acute Coronary Syndrome (ELIXA), que incluyó 6068 pacientes diabéticos con un evento coronario agudo reciente y comparó el tratamiento con lixisenatida frente a placebo. El desenlace cardiovascular primario combinado de muerte por causa cardiovascular, IM no fatal, AVC no fatal u hospitalización por angina inestable fue similar en ambos grupos. No hubo diferencias significativas en la frecuencia de hospitalizaciones por IC67.
El estudio Liraglutide Effect and Action in Diabetes: Evaluation of Cardiovascular Outcome Results (LEADER), que incluyó 9340 pacientes diabéticos de alto riesgo cardiovascular, comparó el tratamiento con liraglutida frente a placebo. En este estudio, el desenlace cardiovascular primario combinado de muerte cardiovascular, IM no fatal o AVC no fatal fue reducido con liraglutida en un 13% (HR: 0.87; IC95%: 0.78-0.97). No hubo diferencias significativas en ambos grupos en cuanto a la frecuencia de hospitalizaciones por IC68.
El Trial to Evaluate Cardiovascular and Other Long-term Outcomes with Semaglutide in Subjects with Type 2 Diabetes (SUSTAIN-6), que incluyó 3297 pacientes diabéticos de alto riesgo cardiovascular, comparó el tratamiento con semaglutida frente a placebo. En este estudio, el desenlace cardiovascular primario combinado de muerte por causa cardiovascular, IM no fatal o AVC no fatal fue reducido con semaglutida en un 26% (HR: 0.74; IC95%: 0.58-0.95). No hubo diferencias significativas en ambos grupos en la frecuencia de hospitalizaciones por IC69.
INSULINA
El empleo de insulina en el tratamiento farmacológico del paciente diabético es un marcador de cronicidad, así como de gravedad. La insulinoterapia tiene efectos sobre el sistema cardiovascular, mejorando discretamente el gasto cardíaco. Sin embargo, se ha sugerido que el uso de insulina exógena puede exacerbar el estrés metabólico mediado por la insulina al aumentar la glucolipotoxicidad70.
Los primeros estudios de seguridad con insulina demostraron un incremento del riesgo cardiovascular en pacientes diabéticos con IC, con aumento de la mortalidad por causa cardiovascular y de las hospitalizaciones por IC71. El estudio Outcome Reduction with an Initial Glargine Intervention (ORIGIN), que incluyó 12,537 pacientes de alto riesgo cardiovascular, comparó el tratamiento con insulina de acción prolongada glargina frente al tratamiento estándar en pacientes diabéticos o con intolerancia a la glucosa. En este estudio, el desenlace primario compuesto de muerte por causa cardiovascular, IM no fatal o AVC fue similar en ambos grupos72.
El Trial Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events (DEVOTE), que incluyó 7637 pacientes diabéticos de alto riesgo cardiovascular, comparó el tratamiento con insulina de acción ultraprolongada degludec frente a insulina glargina. En este estudio, el desenlace primario combinado de muerte por causa cardiovascular, IM no fatal o AVC no fatal fue similar en ambos grupos73.
Manejo de la insuficiencia cardíaca en pacientes con diabetes tipo 2
La IC es frecuente entre los pacientes con diabetes tipo 2, alcanzando una prevalencia del 22% en los mayores de 65 años. De la misma manera, la diabetes tipo 2 es un mediador importante de la disfunción miocárdica que conduce a la IC74,75.
En los pacientes hospitalizados por IC, la proporción de diabetes tipo 2 asciende hasta el 40%. Los pacientes con diabetes tipo 2 tienen un riesgo mayor de muerte por causa cardiovascular y de hospitalización por IC en comparación con los no diabéticos. Se ha demostrado que el diagnóstico de diabetes tipo 2 aumenta el riesgo de mortalidad por todas las causas y de mortalidad por causa cardiovascular en las etiologías isquémicas y no isquémicas de la IC76.
La evidencia actual sugiere que todas las intervenciones efectivas para mejorar el pronóstico en los pacientes con IC son beneficiosas en pacientes con y sin diabetes77. El tratamiento farmacológico de la IC en el paciente diabético debe incluir fármacos que hayan demostrado una reducción del riesgo de mortalidad y de hospitalización por IC.
Los betabloqueadores y los inhibidores de la enzima convertidora de angiotensina son beneficiosos en los pacientes con diabetes tipo 2, y su uso se ha asociado a una reducción de la mortalidad y de las hospitalizaciones por IC. También los antagonistas de los receptores de la angiotensina II han demostrado su eficacia en pacientes con IC con y sin diabetes. Los antagonistas de los receptores de mineralocorticoides son igualmente efectivos en pacientes con IC con y sin diabetes.
En el estudio PARADIGM-HF, con sacubitril/valsartán, se demostró un efecto similar en el desenlace primario en pacientes con ICFER con y sin diabetes tipo 2. Además, el tratamiento con sacubitril/valsartán se asoció con una mayor reducción de la hemoglobina glucosilada y con una menor tasa de inicio de insulina o de otro antidiabético25,78.
Los resultados de los estudios con dapagliflozina, empagliflozina y sotagliflozina en pacientes con IC han permitido el nacimiento de una nueva línea de tratamiento farmacológico para pacientes con IC (Tabla 2).
Tabla 2.
Estudios clínicos sobre el uso de iSGLT2 en insuficiencia cardíaca crónica
| DAPA-HF79 | EMPEROR-Reduced80 | EMPEROR-Preserved81 | DELIVER82 | |
|---|---|---|---|---|
| Diseño | ||||
| – Número de pacientes | 4,744 | 3,730 | 5,988 | 6,263 |
| – Característica clínica | ICFER | ICFER | ICFEP + ICFELR | ICFEP + ICFELR |
| – Desenlace primario | Muerte CV/empeoramiento IC | Muerte CV/primera HIC | Muerte CV/HIC | Muerte CV/empeoramiento IC |
| – Seguimiento | 18.2 meses | 16 meses | 26.2 meses | 2.3 años |
| Resultados | ||||
| – Desenlace primario | HR: 0.74 (IC95%: 0.65-0.85) | HR: 0.75 (IC95%: 0.65-0.86) | HR: 0.79 (IC95%: 0.69-0.90) | HR: 0.82 (IC95%: 0.73-0.92) |
| – Muerte CV | HR: 0.82 (IC95%: 0.69-0.98) | HR: 0.92 (IC95%: 0.75-1.12) | HR: 0.91 (IC95%: 0.76-1.09) | HR: 0.88 (IC95%: 0.74-1.05) |
| – HIC | HR: 0.70 (IC95%: 0.59-0.83) | HR: 0.70 (IC95%: 0.58-0.85) | HR: 0.71 (IC95%: 0.60-0.83) | HR: 0.77 (IC95%: 0.67-0.89) |
CV: cardiovascular; DAPA-HF: Dapagliflozin and Prevention of Adverse Outcomes in Heart Failure; DELIVER: Dapagliflozin Evaluation to Improve The Lives of Patients with Preserved Ejection Fraction Heart Failure; EMPEROR-Preserved: Empagliflozin Outcome Trial in Patients with Chronic Heart Failure with Preserved Ejection Fraction; EMPEROR-Reduced: Empagliflozin Outcome Trial in Patients with Chronic Heart Failure and a Reduced Ejection Fraction; HIC: hospitalización por insuficiencia cardíaca; HR: hazard ratio; IC: insuficiencia cardíaca; IC95%: intervalo de confianza del 95%; ICFELR: insuficiencia cardíaca con fracción de eyección levemente reducida; ICFEP: insuficiencia cardíaca con fracción de eyección preservada; ICFER: insuficiencia cardíaca con fracción de eyección reducida.
El estudio Dapagliflozin and Prevention of Adverse Outcomes in Heart Failure (DAPA-HF), que incluyó pacientes con ICFER, comparó el tratamiento con dapagliflozina frente a placebo. En este estudio, el desenlace primario combinado de muerte por causa cardiovascular y empeoramiento de la IC fue reducido con dapagliflozina en un 26% (HR: 0.74; IC95%: 0.65-0.85). El desenlace secundario de muerte cardiovascular u hospitalización por IC fue reducido con dapagliflozina en un 25% (HR: 0.75; IC95%: 0.65-0.85). El desenlace secundario de hospitalización por IC fue reducido con dapagliflozina en un 30% (HR: 0.70; IC95%: 0.59-0.83). La reducción del riesgo con dapagliflozina fue similar en pacientes con y sin diabetes79.
El Empagliflozin Outcome Trial in Patients with Chronic Heart Failure and a Reduced Ejection Fraction (EMPEROR-Reduced), que incluyó pacientes con ICFER, comparó el tratamiento con empagliflozina frente a placebo. En este estudio, el desenlace primario combinado de muerte por causa cardiovascular y primera hospitalización por empeoramiento de la IC fue reducido con empagliflozina en un 25% (HR: 0.75; IC95%: 0.65-0.86). El desenlace secundario de hospitalización por IC fue reducido con empagliflozina en un 30% (HR: 0.70; IC95%: 0.58-0.85). La reducción del riesgo con empagliflozina fue similar en pacientes con y sin diabetes80.
El Empagliflozin Outcome Trial in Patients with Chronic Heart Failure with Preserved Ejection Fraction (EMPEROR-Preserved), que incluyó pacientes con IC y fracción de eyección > 40%, comparó el tratamiento con empagliflozina frente a placebo. En este estudio, el desenlace primario combinado de muerte por causa cardiovascular y hospitalización por IC fue reducido con empagliflozina en un 21% (HR: 0.79; IC95%: 0.69-0.90). El desenlace secundario de hospitalización por IC fue reducido con empagliflozina en un 29% (HR: 0.70; IC95%: 0.60-0.83). La reducción del riesgo con empagliflozina fue similar en pacientes con y sin diabetes81.
El más reciente estudio de IC con iSGLT2 es el Dapagliflozin Evaluation to Improve The Lives of Patients with Preserved Ejection Fraction Heart Failure (DELIVER), que incluyó pacientes con IC y fracción de eyección > 40%, y comparó el tratamiento con dapagliflozina frente a placebo (Tabla 2). En este estudio, el desenlace primario combinado de muerte por causa cardiovascular y empeoramiento de la IC fue reducido con dapagliflozina en un 18% (HR: 0.82; IC95%: 0.73-0.92). El desenlace secundario de empeoramiento de la IC fue reducido con dapagliflozina en un 21% (HR: 0.79; IC95%: 0.69-0.91). La reducción del riesgo con dapagliflozina fue similar en pacientes con y sin diabetes82.
El estudio Effect of Sotagliflozin on Cardiovascular Events in Patients with Type 2 Diabetes Post Worsening Heart Failure (SOLOIST-WHF), que incluyó 1222 pacientes diabéticos con IC y reciente hospitalización por descompensación aguda, comparó el tratamiento con sotagliflozina frente a placebo. En este estudio, el desenlace primario combinado de muerte por causa cardiovascular, hospitalización y visita urgente por IC fue reducido con sotagliflozina en un 33% (HR 0.67; IC95%: 0.52-0.85). En este estudio, el 79% de los pacientes con IC tenían una fracción de eyección < 50%83.
Recientemente se ha publicado un metaanálisis que incluye los datos de los estudios clínicos EMPEROR-Reduced, EMPEROR-Preserved, DAPA-HF, DELIVER y SOLOIST-WHF. Este metaanálisis demuestra una reducción del desenlace primario combinado de muerte por causa cardiovascular y hospitalización por IC. Los resultados relacionados con este desenlace primario combinado fueron consistentes en los estudios clínicos con ICFEP o con IC con fracción de eyección levemente reducida (ICFELR), así como también en los cinco estudios clínicos combinados84.
Conclusiones y recomendaciones
La prevalencia de IC y de diabetes tipo 2 va en aumento en Latinoamérica, y la evidencia científica reciente demuestra un mayor riesgo cardiovascular en los pacientes con IC y diabetes. Estas situaciones obligan a que los profesionales de la salud de la región inicien tempranamente medidas preventivas en estos pacientes. Sin embargo, los cambios fisiopatológicos de la diabetes tipo 2, por sí sola o junto con otros factores de riesgo cardiovascular, pueden favorecer el desarrollo de ICFER, ICFELR o ICFEP.
Existen grupos de fármacos antidiabéticos que han demostrado una reducción del riesgo cardiovascular en los pacientes con diabetes tipo 2 y que deben ser considerados como herramientas de prevención cardiovascular en estos pacientes. Teniendo en cuenta lo anterior, desde el CIFACAH de la SIAC:
– Se recomienda el uso de iSGLT2 para la reducción de eventos cardiovasculares mayores.
– Se recomienda el uso de aGLP-1 para la reducción de eventos cardiovasculares mayores.
El tratamiento de la IC en el paciente con diabetes tipo 2 debe incluir, en primera línea, fármacos que hayan demostrado reducir el riesgo de mortalidad y de hospitalizaciones por IC. Teniendo en cuenta lo anterior, desde el CIFACAH de la SIAC:
– Se recomienda el uso de iSGLT2 en pacientes con IC con y sin diabetes.
– Se puede considerar el uso de metformina en pacientes con diabetes e IC.
– Se puede considerar el uso de aGLP-1 en pacientes con diabetes e IC.
– Se puede considerar el uso de insulina en pacientes con diabetes e IC.
– Se puede considerar el uso de iDPP4 en pacientes con diabetes e IC.
– No se recomienda el uso de sulfonilureas en pacientes con diabetes e IC.
– Se contraindica el uso de tiazolidinedionas en pacientes con diabetes e IC.
Financiamiento
Ninguna.
Conflicto de intereses
Ninguno.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Bibliografía
- 1.Mosterd A, Hoes AW. Clinical epidemiology of heart failure. Heart. 2007;93:1137–46. doi: 10.1136/hrt.2003.025270. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M, et al. Heart disease and stroke statistics —2016 update:a report from the American Heart Association. Circulation. 2016;133:e38–e360. doi: 10.1161/CIR.0000000000000350. [DOI] [PubMed] [Google Scholar]
- 3.Roger VL. Epidemiology of heart failure. Circulation Res. 2013;113:646–59. doi: 10.1161/CIRCRESAHA.113.300268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Bocchi EA, Arias A, Verdejo H, Díez M, Gómez E, Castro P. Interamerican Society of Cardiology. The reality of heart failure in Latin America. J Am Coll Cardiol. 2013;62:949–58. doi: 10.1016/j.jacc.2013.06.013. [DOI] [PubMed] [Google Scholar]
- 5.Aguilar Salinas CA. Epidemiología de la diabetes tipo 2 en Latinoamérica. Guías ALAD sobre el diagnóstico, control y tratamiento de la diabetes mellitus tipo 2 con medicina basada en evidencia. Edición 2019. In: Aguilar Salinas CA, Aschner P, editors. Ciudad de México. México: Permanyer México; 2020. pp. 1–7. [Google Scholar]
- 6.World Health Organization. Report of a WHO Consultation on Obesity, Geneva, 3-5 June 1997. Geneva: World Health Organization; 1998. Obesity:preventing and managing the global epidemic. [PubMed] [Google Scholar]
- 7.Ruilope LM, Nunes Filho ACB, Nadruz W, Rodri´guez Rosales FF, Verdejo-Paris J. Obesity and hypertension in Latin America:current perspectives. Hipertensio´n y Riesgo Vascular. 2018;35:70–6. doi: 10.1016/j.hipert.2017.12.004. [DOI] [PubMed] [Google Scholar]
- 8.Cominato L, Di Biagio GF, Lellis D, Franco RR, Mancini MC, de Melo ME. Obesity prevention:strategies and challenges in Latin America. Curr Obes Rep. 2018;7:97–104. doi: 10.1007/s13679-018-0311-1. [DOI] [PubMed] [Google Scholar]
- 9.The SIGMA (Slim Initiative in Genomic Medicine for the Americas) Type 2 Diabetes Consortium. Sequence variants in SLC16A11 are common risk factor for type 2 diabetes in Mexico. Nature. 2014;506:97–101. doi: 10.1038/nature12828. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bello O, Aguilar Salinas CA. Diabetes in Latin America. In: Dagogo Jack S, editor. Diabetes mellitus in developing countries and underserved communities. Switzerland: Springer; 2017. pp. 101–26. [Google Scholar]
- 11.Carrillo-Larco RM, Barengo NC, Albitres-Flores L, Bernabé-Ortiz A. The risk of mortality among people with type 2 diabetes in Latin America:a systematic review and meta-analysis of population-based cohort studies. Diabetes Metab Res Rev. 2019;35:e3139. doi: 10.1002/dmrr.3139. [DOI] [PubMed] [Google Scholar]
- 12.Kannel WB, Hjortland M, Castelli WP. Role of diabetes in congestive heart failure:the Framingham study. Am J Cardiol. 1974;34:29–34. doi: 10.1016/0002-9149(74)90089-7. [DOI] [PubMed] [Google Scholar]
- 13.Thrainsdottir IS, Aspelund T, Thorgeirsson G, Gudnason V, Hardarson T, Malmberg K, et al. The association between glucose abnormalities and heart failure in the population-based Reykjavik study. Diabetes Care. 2005;28:612–6. doi: 10.2337/diacare.28.3.612. [DOI] [PubMed] [Google Scholar]
- 14.He J, Ogden LG, Bazzano LA, Vupputuri S, Loria C, Whelton PK. Risk factors for congestive heart failure in US men and women:NHANES I epidemiologic follow-up study. Arch Intern Med. 2001;161:996–1002. doi: 10.1001/archinte.161.7.996. [DOI] [PubMed] [Google Scholar]
- 15.Cavender MA, Steg PG, Smith SC, Jr, Eagle K, Ohman EM, Goto S, et al. REACH Registry Investigators. Impact of diabetes mellitus on hospitalization for heart failure, cardiovascular events, and death:outcomes at 4 years from the Reduction of Atherothrombosis for Continued Health (REACH) registry. Circulation. 2015;132:923–31. doi: 10.1161/CIRCULATIONAHA.114.014796. [DOI] [PubMed] [Google Scholar]
- 16.Sarma S, Mentz RJ, Kwasny MJ, Fought AJ, Huffman M, Subacius H, et al. EVEREST investigators. Association between diabetes mellitus and post-discharge outcomes in patients hospitalized with heart failure:findings from the EVEREST trial. Eur J Heart Fail. 2013;15:194–202. doi: 10.1093/eurjhf/hfs153. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Suskin N, McKelvie RS, Burns RJ, Latini R, Pericak D, Probstfield J, et al. Glucose and insulin abnormalities relate to functional capacity in patients with congestive heart failure. Eur Heart J. 2000;21:1368–75. doi: 10.1053/euhj.1999.2043. [DOI] [PubMed] [Google Scholar]
- 18.Vermes E, Ducharne A, Bourassa MG, Lessard M, White M, Tardif JC. Enalapril reduces the incidence of diabetes in patients with chronic heart failure:insight from the studies of left ventricular dysfunction (SOLVD) Circulation. 2003;107:1291–6. doi: 10.1161/01.cir.0000054611.89228.92. [DOI] [PubMed] [Google Scholar]
- 19.Romero SP, García-Egido A, Escobar MA, Andrey JL, Corzo R, Pérez V, et al. Impact of new-onset diabetes mellitus and glycemic control on the prognosis of heart failure patients:a propensity-matched study in the community. Int J Cardiol. 2013;167:1206–16. doi: 10.1016/j.ijcard.2012.03.134. [DOI] [PubMed] [Google Scholar]
- 20.Heck PM, Dutka DP. Insulin resistance and heart failure. Curr Heart Fail Rep. 2009;6:89–94. doi: 10.1007/s11897-009-0014-8. [DOI] [PubMed] [Google Scholar]
- 21.Alzadjali MA, Godfrey V, Khan F, Choy A, Doney AS, Wong AK, et al. Insulin resistance is highly prevalent and is associated with reduced exercise tolerance in nondiabetic patients with heart failure. J Am Coll Cardiol. 2009;53:747–53. doi: 10.1016/j.jacc.2008.08.081. [DOI] [PubMed] [Google Scholar]
- 22.Swan JW, Walton C, Godsland IF, Clark AL, Coats AJ, Oliver MF. Insulin resistance in chronic heart failure. Eur Heart J. 1994;15:1528–32. doi: 10.1093/oxfordjournals.eurheartj.a060425. [DOI] [PubMed] [Google Scholar]
- 23.Cerasi E, Kaiser N, Leibowitz G. Type 2 diabetes and beta-cell apoptosis. Diabetes Metab. 2000;26((Suppl 3)):13–6. [PubMed] [Google Scholar]
- 24.Preiss D, Zetterstrand S, McMurray JJ, Ostergren J, Michelson EL, Granger CB, et al. Candesartan in Heart Failure Assessment of Reduction in Mortality and Morbidity Investigators. Predictors of development of diabetes in patients with chronic heart failure in the Candesartan in Heart Failure Assessment of Reduction in Mortality and Morbidity (CHARM) program. Diabetes Care. 2009;32:915–20. doi: 10.2337/dc08-1709. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Kristensen SL, Preiss D, Jhund PS, Squire I, Cardoso JS, Merkely B, et al. PARADIGM-HF Investigators and Committees. Risk related to pre-diabetes mellitus and diabetes mellitus in heart failure with reduced ejection fraction:insights from prospective comparison of ARNI with ACEI to determine impact on global mortality and morbidity in Heart Failure Trial. Circ Heart Fail. 2016;9:e002560. doi: 10.1161/CIRCHEARTFAILURE.115.002560. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Bozkurt B, Aguilar D, Deswal A, Dunbar SB, Francis GS, Horwich T, et al. Contributory risk and management of comorbidities of hypertension, obesity, diabetes mellitus, hyperlipidemia, and metabolic syndrome in chronic heart failure:a scientific statement from the American Heart Association. Circulation. 2016;134:e535–78. doi: 10.1161/CIR.0000000000000450. [DOI] [PubMed] [Google Scholar]
- 27.Seferovic PM, Paulus WJ. Clinical diabetic cardiomyopathy:a two-faced disease with restrictive and dilated phenotypes. Eur Heart J. 2015;36:1718–27. doi: 10.1093/eurheartj/ehv134. [DOI] [PubMed] [Google Scholar]
- 28.Doehner W, Frenneaux M, Anker SD. Metabolic impairment in heart failure:the myocardial and systemic perspective. J Am Coll Cardiol. 2014;64:1388–400. doi: 10.1016/j.jacc.2014.04.083. [DOI] [PubMed] [Google Scholar]
- 29.Dunlay SM, Givertz MM, Aguilar D, Allen LA, Chan M, Desai AS, et al. Type 2 diabetes mellitus and heart failure:a scientific statement from the American Heart Association and the Heart Failure Society of America:this statement does not represent an update of the 2017 ACC/AHA/HFSA heart failure guideline update. Circulation. 2019;140:e294–e324. doi: 10.1161/CIR.0000000000000691. [DOI] [PubMed] [Google Scholar]
- 30.Lloyd-Jones DM, Leip EP, Larson MG, D'Agostino RB, Beiser A, Wilson PWF, et al. Prediction of lifetime risk for cardiovascular disease by risk factor burden at 50 years of age. Circulation. 2006;113:791–8. doi: 10.1161/CIRCULATIONAHA.105.548206. [DOI] [PubMed] [Google Scholar]
- 31.Huxley R, Barzi F, Woodward M. Excess risk of fatal coronary heart disease associated with diabetes in men and women:meta-analysis of 37 prospective cohort studies. BMJ. 2006;332:73–8. doi: 10.1136/bmj.38678.389583.7C. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.The Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease:a collaborative meta-analysis of 102 prospective studies. Lancet. 2010;375:2215–22. doi: 10.1016/S0140-6736(10)60484-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Booth GL, Kapral MK, Fung K, Tu JV. Relation between age and cardiovascular disease in men and women with diabetes compared with non-diabetic people:a population-based retrospective cohort study. Lancet. 2006;368:29–36. doi: 10.1016/S0140-6736(06)68967-8. [DOI] [PubMed] [Google Scholar]
- 34.Gregg EW, Li Y, Wang J, Burrows NR, Ali MK, Rolka D, et al. Changes in diabetes-related complications in the United States, 1990-2010. N Engl J Med. 2014;370:1514–23. doi: 10.1056/NEJMoa1310799. [DOI] [PubMed] [Google Scholar]
- 35.Juutilainen A, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Type 2 diabetes as a “coronary heart disease equivalent”:an 18-year prospective population-based study in Finnish subjects. Diabetes Care. 2005;28:2901–7. doi: 10.2337/diacare.28.12.2901. [DOI] [PubMed] [Google Scholar]
- 36.Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction. N Engl J Med. 1998;339:229–34. doi: 10.1056/NEJM199807233390404. [DOI] [PubMed] [Google Scholar]
- 37.Zhang Y, Sun X, Icli B, Feinberg MW. Emerging roles for microRNAs in diabetic microvascular disease:novel targets for therapy. Endocr Rev. 2017;38:145–68. doi: 10.1210/er.2016-1122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Hunt SA, Abraham WT, Chin MH, Feldman AM, Francis GS, Ganiats TG, et al. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult. J Am Coll Cardiol. 2005;46:1116–43. doi: 10.1016/j.jacc.2005.08.022. [DOI] [PubMed] [Google Scholar]
- 39.From AM, Scott CG, Chen HH. The development of heart failure in patients with diabetes mellitus and pre-clinical diastolic dysfunction a population-based study. J Am Coll Cardiol. 2010;55:300–5. doi: 10.1016/j.jacc.2009.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Russo MJ, Chen JM, Hong KN, Stewart AS, Ascheim DD, Argenziano M, et al. Survival after heart transplantation is not diminished among recipients with uncomplicated diabetes mellitus:an analysis of the United Network of Organ Sharing database. Circulation. 2006;114:2280–7. doi: 10.1161/CIRCULATIONAHA.106.615708. [DOI] [PubMed] [Google Scholar]
- 41.McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42:3599–726. doi: 10.1093/eurheartj/ehab368. [DOI] [PubMed] [Google Scholar]
- 42.Heidenreich P, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. J Am Coll Cardiol. 2022;79:e263–e421. doi: 10.1016/j.jacc.2021.12.012. [DOI] [PubMed] [Google Scholar]
- 43.Huelsmann M, Neuhold S, Resl M, Strunk G, Brath H, Francesconi C, et al. PONTIAC (NT-proBNP selected prevention of cardiac events in a population of diabetic patients without a history of cardiac disease):a prospective randomized controlled trial. J Am Coll Cardiol. 2013;62:1365–72. doi: 10.1016/j.jacc.2013.05.069. [DOI] [PubMed] [Google Scholar]
- 44.Kociol RD, Pang PS, Gheorghiade M, Fonarow GC, O'Connor CM, Felker GM. Troponin elevation in heart failure:prevalence, mechanisms, and clinical implications. J Am Coll Cardiol. 2010;56:1071–8. doi: 10.1016/j.jacc.2010.06.016. [DOI] [PubMed] [Google Scholar]
- 45.Boorsma EM, Ter Maaten JM, Damman K, van Essen BJ, Zannad F, van Veldhuisen DJ, et al. Albuminuria as a marker of systemic congestion in patients with heart failure. Eur Heart J. 2023;44:368–80. doi: 10.1093/eurheartj/ehac528. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Look AHEAD Research Group. Wing RR, Bolin P, Brancati FL, Bray GA, Clark JM, Coday M, et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013;369:145–54. doi: 10.1056/NEJMoa1212914. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Banks AZ, Mentz RJ, Stebbins A, Mikus CR, Schulte PJ, Fleg JL, et al. Response to exercise training and outcomes in patients with heart failure and diabetes mellitus:insights from the HF-ACTION Trial. J Card Fail. 2016;22:485–91. doi: 10.1016/j.cardfail.2015.12.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Packer M. Have we really demonstrated the cardiovascular safety of anti-hyperglicaemic drugs?Rethinking the concepts of macrovascular and microvascular disease in type 2 diabetes. Diabetes Obes Metab. 2018;20:1089–95. doi: 10.1111/dom.13207. [DOI] [PubMed] [Google Scholar]
- 49.UK Prospective Diabetes Study (UKPDS) Group. Effect of intensive blood glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34) Lancet. 1998;352:854–65. [PubMed] [Google Scholar]
- 50.Eurich DT, Majumdar SR, McAlister FA, Tsuyuki RT, Johnson JA. Improved clinical outcomes associated with metformin in patients with diabetes and heart failure. Diabetes Care. 2005;28:2345–51. doi: 10.2337/diacare.28.10.2345. [DOI] [PubMed] [Google Scholar]
- 51.Masoudi FA, Inzucchi SE, Wang Y, Havranek EP, Foody JM, Krumholz HM. Thiazolidinediones, metformin, and outcomes in older patients with diabetes and heart failure:an observational study. Circulation. 2005;111:583–90. doi: 10.1161/01.CIR.0000154542.13412.B1. [DOI] [PubMed] [Google Scholar]
- 52.Eurich DT, Weir DL, Majumdar SR, Tsuyuki RT, Johnson JA, Tjosvold L, et al. Comparative, safety, and effectiveness of metformin in patients with diabetes mellitus and heart failure:systematic review of observational studies involving 34,000 patients. Circ Heart Fail. 2013;6:395–402. doi: 10.1161/CIRCHEARTFAILURE.112.000162. [DOI] [PubMed] [Google Scholar]
- 53.Ke C, Morgan S, Smolina K, Gasevic D, Qian H, Khan N. Mortality and cardiovascular risk of sulfonylureas in South Asian, Chinese and other Canadians with Diabetes. Can J Diabetes. 2017;41:150–5. doi: 10.1016/j.jcjd.2016.08.218. [DOI] [PubMed] [Google Scholar]
- 54.ADVANCE Collaborative Group. Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med. 2008;358:2560–72. doi: 10.1056/NEJMoa0802987. [DOI] [PubMed] [Google Scholar]
- 55.Dormandy JA, Charbonnel B, Eckland DJ PROactive Investigators. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events):randomised controlled trial. Lancet. 2005;366:1279–89. doi: 10.1016/S0140-6736(05)67528-9. [DOI] [PubMed] [Google Scholar]
- 56.Home PD, Pocock SJ, Beck-Nielsen H, Curtis PS, Gomis R, Hanefeld M, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD):a multicentre, randomised, open-label trial. Lancet. 2009;373:2125–35. doi: 10.1016/S0140-6736(09)60953-3. [DOI] [PubMed] [Google Scholar]
- 57.Zinman B, Wanner C, Lachin JM. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med. 2015;373:2117–28. doi: 10.1056/NEJMoa1504720. [DOI] [PubMed] [Google Scholar]
- 58.Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med. 2017;377:644–57. doi: 10.1056/NEJMoa1611925. [DOI] [PubMed] [Google Scholar]
- 59.Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, et al. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2019;380:347–57. doi: 10.1056/NEJMoa1812389. [DOI] [PubMed] [Google Scholar]
- 60.Kosiborod M, Cavender MA, Fu AZ, Wilding JP, Khunti K, Holl RW, et al. Lower risk of heart failure and death in patients initiated on sodium-glucose cotransporter-2 inhibitors versus other glucose-lowering drugs:the CVD-REAL study (Comparative Effectiveness of Cardiovascular Outcomes in New Users of Sodium-Glucose Cotransporter-2 Inhibitors) Circulation. 2017;136:249–59. doi: 10.1161/CIRCULATIONAHA.117.029190. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Kosiborod M, Lam CSP, Kohsaka S, Kim DJ, Karasik A, Shaw J, et al. Cardiovascular events associated with SGLT-2 inhibitors versus other glucose-lowering drugs:the CVD-REAL 2 study. J Am Coll Cardiol. 2018;71:2628–39. doi: 10.1016/j.jacc.2018.03.009. [DOI] [PubMed] [Google Scholar]
- 62.Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med. 2013;369:1317–26. doi: 10.1056/NEJMoa1307684. [DOI] [PubMed] [Google Scholar]
- 63.Scirica BM, Braunwald E, Raz I, Cavender MA, Morrow DA, Jarolim P. Heart failure, saxagliptin, and diabetes mellitus:observations from the SAVOR-TIMI 53 randomized trial. Circulation. 2014;130:1579–88. doi: 10.1161/CIRCULATIONAHA.114.010389. [DOI] [PubMed] [Google Scholar]
- 64.Zannad F, Cannon CP, Cushman WC, Bakris GL, Menon V, Perez AT, et al. EXAMINE Investigators. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE:a multicentre, randomised, double- blind trial. Lancet. 2015;385:2067–76. doi: 10.1016/S0140-6736(14)62225-X. [DOI] [PubMed] [Google Scholar]
- 65.Green JB, Bethel MA, Armstrong PW, Buse JB, Engel SS, Garg J, et al. TECOS Study Group. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2015;373:232–42. doi: 10.1056/NEJMoa1501352. [DOI] [PubMed] [Google Scholar]
- 66.Rosenstock J, Perkovic V, Johansen OE, Cooper ME, Kahn SE, Marx N, et al. CARMELINA Investigators. Effect of linagliptin vs placebo on major cardiovascular events in adults with type 2 diabetes and high cardiovascular and renal risk:the CARMELINA randomized clinical trial. JAMA. 2019;321:69–79. doi: 10.1001/jama.2018.18269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Pfeffer MA, Claggett B, Díaz R, Dickstein K, Gerstein HC, Kober LV, et al. Lixisenatide in patients with type 2 diabetes and acute coronary syndrome. N Engl J Med. 2015;373:2247–57. doi: 10.1056/NEJMoa1509225. [DOI] [PubMed] [Google Scholar]
- 68.Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2016;375:311–22. doi: 10.1056/NEJMoa1603827. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 69.Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jodar E, Leiter LA, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2016;375:1834–44. doi: 10.1056/NEJMoa1607141. [DOI] [PubMed] [Google Scholar]
- 70.Nolan CJ, Ruderman NB, Prentki M. Intensive insulin for type 2 diabetes:the risk of causing harm. Lancet Diabetes Endocrinol. 2013;1:9–10. doi: 10.1016/S2213-8587(13)70027-5. [DOI] [PubMed] [Google Scholar]
- 71.Murcia AM, Hennekens CH, Lamas GA, Jiménez-Navarro M, Rouleau JL, Flaker GC. Impact of diabetes on mortality in patients with myocardial infarction and left ventricular dysfunction. Arch Intern Med. 2004;164:2273–9. doi: 10.1001/archinte.164.20.2273. [DOI] [PubMed] [Google Scholar]
- 72.Gerstein HC, Bosch J, Dagenais GR, Díaz R, Jung H, Maggioni AP, et al. Basal insulin and cardiovascular and other outcomes in dysglycemia. N Engl J Med. 2012;367:319–28. doi: 10.1056/NEJMoa1203858. [DOI] [PubMed] [Google Scholar]
- 73.Marso SP, McGuire DK, Zinman B, Poulter NR, Emerson SS, Pieber TR, et al. Efficacy and safety of degludec versus glargine in type 2 diabetes. N Engl J Med. 2017;377:723–32. doi: 10.1056/NEJMoa1615692. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 74.Bertoni AG, Hundley WG, Massing MW, Bonds DE, Burke GL, Goff DC. Heart failure prevalence, incidence, and mortality in the elderly with diabetes. Diabetes Care. 2004;27:699–703. doi: 10.2337/diacare.27.3.699. [DOI] [PubMed] [Google Scholar]
- 75.Devereux RB, Roman MJ, Paranicas M, O'Grady MJ, Lee ET, Welty TK, et al. Impact of diabetes on cardiac structure and function:the strong heart study. Circulation. 2000;101:2271–6. doi: 10.1161/01.cir.101.19.2271. [DOI] [PubMed] [Google Scholar]
- 76.Cubbon RM, Adams B, Rajwani A, Mercer BN, Patel PA, Gherardi G, et al. Diabetes mellitus is associated with adverse prognosis in chronic heart failure of ischaemic and non-ischaemic aetiology. Diab Vasc Dis Res. 2013;10:330–6. doi: 10.1177/1479164112471064. [DOI] [PubMed] [Google Scholar]
- 77.Seferovic PM, Petrie MC, Filippatos GS, Anker SD, Rosano G, Bauersachs J, et al. Type 2 diabetes mellitus and heart failure:a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018;20:853–72. doi: 10.1002/ejhf.1170. [DOI] [PubMed] [Google Scholar]
- 78.Seferovic JP, Claggett B, Seidelmann SB, Seely EW, Packer M, Zile MR, et al. Effect of sacubitril/valsartan versus enalapril on glycaemic control in patients with heart failure and diabetes:a post-hoc analysis from the PARADIGM-HF trial. Lancet Diabetes Endocrinol. 2017;5:333–40. doi: 10.1016/S2213-8587(17)30087-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martínez FA, et al. DAPA-HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med. 2019;381:1995–2008. doi: 10.1056/NEJMoa1911303. [DOI] [PubMed] [Google Scholar]
- 80.Packer M, Anker SD, Butler J, Filippatos G, Pocock SJ, Carson P, et al. EMPEROR-Reduced Trial Investigators. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med. 2020;383:1413–24. doi: 10.1056/NEJMoa2022190. [DOI] [PubMed] [Google Scholar]
- 81.Anker SD, Butler J, Filippatos G, Ferreira J, Bocchi E, Böhm M, et al. EMPEROR-Preserved Trial Investigators. Empagliflozin in heart failure with preserved ejection fraction. N Engl J Med. 2021;385:1451–61. doi: 10.1056/NEJMoa2107038. [DOI] [PubMed] [Google Scholar]
- 82.Solomon SD, McMurray JJV, Claggett B, de Boer RA, DeMets D, Hernández AF, et al. Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction. N Engl J Med. 2022;387:1089–98. doi: 10.1056/NEJMoa2206286. [DOI] [PubMed] [Google Scholar]
- 83.Bhatt DL, Szarek M, Steg PG, Cannon CP, Leiter LA, McGuire DK, et al. SOLOIST-WHF Trial Investigators. Sotagliflozin in patients with diabetes and recent worsening heart failure. N Engl J Med. 2021;384:117–28. doi: 10.1056/NEJMoa2030183. [DOI] [PubMed] [Google Scholar]
- 84.Vaduganathan M, Docherty KF, Claggett BL, Jhund PS, de Boer RA, Hernández AF, et al. SGLT-2 inhibitors in patients with heart failure:a comprehensive meta-analysis of five randomised controlled trials. Lancet. 2022;400:757–67. doi: 10.1016/S0140-6736(22)01429-5. [DOI] [PubMed] [Google Scholar]


