Points clés
Le spectre clinique de la carence en vitamine B12 s’étend de la forme asymptomatique à la menace du pronostic vital; une pancytopénie et une hémolyse intramédullaire entraînant une pseudo-microangiopathie thrombotique (pseudo-MAT) se produisent dans certains cas.
La pseudo-MAT associée à une carence en vitamine B12 est souvent diagnostiquée par erreur comme un purpura thrombocytopénique thrombotique (PTT); comparativement au PTT, elle est associée à un taux de lacticodéshydrogénase plus élevé, à une anémie plus sévère, à une numération des réticulocytes inférieure, à un volume globulaire moyen plus élevé et à une neutropénie.
La pancytopénie secondaire à une carence en vitamine B12 se traite par l’injection intramusculaire de vitamine B12.
Le dosage de la vitamine B12 devrait être systématique en cas de soupçon de MAT.
Un homme âgé de 76 ans s’est présenté au service d’urgence d’un hôpital communautaire avec une faiblesse généralisée, de la fatigue, une baisse de l’appétit, une perte pondérale de 25 livres (11,3 kg) et une dyspnée d’effort, apparues 6 mois plus tôt, sans symptômes infectieux ni saignements. Il n’avait pas d’antécédents personnels ou familiaux de troubles hématologiques; le vitiligo était son seul antécédent médical notable. À l’examen réalisé au service d’urgence, le patient avait un ictère scléral et une hypopigmentation cutanée, correspondant au vitiligo, et des signes vitaux normaux. Il n’avait ni hépatosplénomégalie ni lymphadénopathie palpables, et l’examen neurologique s’est avéré normal.
Les premières analyses sanguines ont révélé une pancytopénie, avec un taux d’hémoglobine de 45 g/L (plage normale 135–175 g/L), un volume globulaire moyen de 111 fL (plage normale 80–100 fL), une leucocytémie de 2,9 × 109/L (plage normale 4,0–11,0 × 109/L) et une numération plaquettaire de 68 × 109/L (plage normale 150– 400 × 109/L). La formule sanguine complète précédente, réalisée 3 ans auparavant, était normale. Des analyses complémentaires ont révélé une hyperbilirubinémie non conjuguée, un taux considérablement élevé de lacticodéshydrogénase (LDH), des schizocytes sur le frottis sanguin périphérique et un taux de réticulocytes étonnamment normal, compte tenu de la gravité de son anémie, ainsi que des résultats évoquant des anomalies de la coagulation (tableau 1). La fonction rénale était normale; les dosages ultrasensibles des troponines et l’électrocardiographie étaient sans particularités.
Tableau 1:
Résultats d’analyses de laboratoire inclus dans l’évaluation et le bilan initiaux d’un homme âgé de 76 ans atteint de pseudo-microangiopathie thrombotique causée par une grave carence en vitamine B12
| Analyse | Valeur | Plage de référence |
|---|---|---|
| Hémoglobine, g/L | 45 | 135–175 |
| VGM, fL | 111 | 80–100 |
| Plaquettes, × 109/L | 68 | 150–400 |
| Leucocytes, × 109/L | 2,9 | 4–11 |
| Neutrophiles, × 109/L | 1,8 | 2–6,3 |
| Frottis sanguin périphérique | Peu de schizocytes, nombre modéré de dacryocytes | |
| RIN | 1,4 | 0,9–1,2 |
| TCA, s | 30 | 27–42 |
| Fibrinogène, g/L | 1,5 | 1,9–4,7 |
| Créatinine, μmol/L | 92 | 64–111 |
| Débit de filtration glomérulaire estimé, mL/min | 74 | > 60 |
| Bilirubine totale, μmol/L | 72,8 | 3,4–20,5 |
| Bilirubine non conjuguée, μmol/L | 58 | 0–12 |
| Bilirubine conjuguée, μmol/L | 14,8 | 1,6–8,6 |
| Test direct à l’antiglobuline | Négatif | Négatif |
| Lacticodéshydrogénase, U/L | > 4500 | 110–230 |
| Numération des réticulocytes, × 109/L | 80 | 10–100 |
| Haptoglobine, g/L | Absente | Présente |
| Troponine ultrasensible, ng/L | 10 | < 34 |
| Vitamine B12, pmol/L* | < 117 | 138–652 |
| Dépistage des antiphospholipides* | Négatif | |
| D-dimères, ng/mL* | 40 052 | < 500 |
| Dépistage des AAN* | Négatif | |
| Facteur rhumatoïde, IU/mL* | 15 | < 10 |
| ADAMTS13*, % | 56 | < 10 : diminution considérable de l’activité d’ADAMTS13 |
| Anticorps anti-ADAMTS13* | Négatif | Négatif |
| Anticorps anti-cellules pariétales* | Négatif | < 1:80 |
| Anticorps anti-facteur intrinsèque* | Négatif | Négatif |
| Cytométrie de flux pour l’hémoglobinurie paroxystique nocturne* | Négatif | Négatif |
Remarque : AAN = anticorps antinucléaires, RIN = rapport international normalisé, TCA = temps de céphaline activée, ADAMTS13 = désintégrine et métalloprotéinase à motifs thrombospondines de type 13, VGM = volume globulaire moyen.
Analyses de laboratoire demandées dès le transfert à l’hôpital de soins tertiaires (2e jour d’hospitalisation).
Le patient a été hospitalisé et a vu un spécialiste en médecine interne le lendemain. Son anémie a été traitée avec une transfusion de 4 unités de concentré de globules rouges. L’hémolyse, la thrombocytopénie et la présence de schizocytes évoquaient une microangiopathie thrombotique (MAT), plus précisément un purpura thrombocytopénique thrombotique (PTT). Le patient a obtenu un score PLASMIC (outil de diagnostic du PTT) de 5, indiquant un risque intermédiaire de déficit grave de l’enzyme ADAMTS131. Un traitement composé de 60 mg de prednisone à prise orale (1 mg/kg) par jour et d’une perfusion continue de 100 mL de plasma par heure a été initié, et le patient a été transféré dans un hôpital de soins tertiaires pour consulter un hématologue et recevoir une plasmaphérèse thérapeutique en urgence.
Les analyses sanguines réalisées à l’arrivée à l’hôpital de soins tertiaires ont révélé une aggravation de la thrombopénie (26 × 109/L), une absence d’haptoglobine et un taux de D-dimères fortement élevé. Le score diagnostique de coagulation intravasculaire disséminée (CIVD) de la Société internationale de thrombose et d’hémostase s’élevait à 7, indiquant une CIVD décompensée. Après la transfusion, nous avons refait un frottis sanguin, qui s’est avéré sans schizocytes, mais a révélé une hypersegmentation des neutrophiles, une thrombocytopénie et une anisopoïkilocytose érythrocytaire (figure 1). Les examens complémentaires ont écarté le syndrome des antiphospholipides, l’anémie hémolytique auto-immune et l’hémoglobinurie paroxystique nocturne (tableau 1). Le taux sérique de vitamine B12, obtenu lors du deuxième jour d’hospitalisation, était inférieur au seuil de détection du laboratoire (< 117 pmol/L, plage normale 138–652 pmol/L).
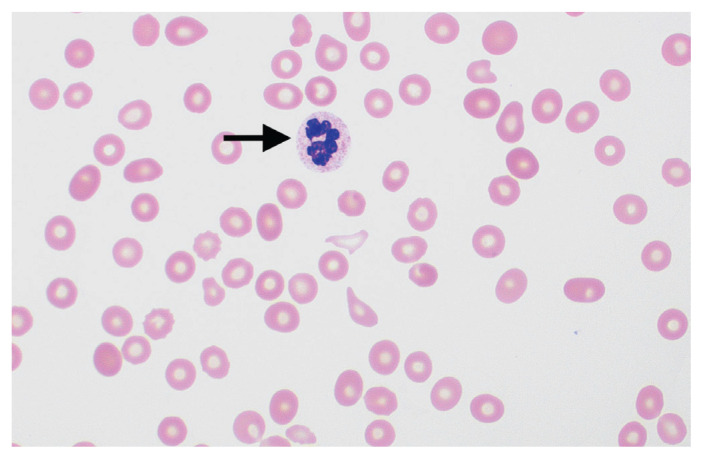
Figure 1:
Frottis sanguin périphérique d’un patient atteint de pseudomicroangiopathie thrombotique, présentant un neutrophile hypersegmenté (flèche), une thrombocytopénie et une anisopoïkilocytose érythrocytaire (variabilité dans la forme et la taille des érythrocytes), indiquant une grave carence en vitamine B12 (coloration de WrightGiemsa, grossissement × 100). Image fournie par Shreyash Dalmia et Anath Lionel MD, département de médecine de l’Université McMaster, Hamilton, Ont.
Compte tenu du taux sérique de vitamine B12 indétectable, nous avons diagnostiqué une grave carence en vitamine B12 entraînant une pancytopénie, une hémolyse intramédullaire et une CIVD. Nous avons arrêté la perfusion de plasma et les corticostéroïdes au troisième jour d’hospitalisation et n’avons pas administré de plasmaphérèse thérapeutique. Quelques jours plus tard, le taux d’ADAMTS13 était redevenu normal (56 %), sans signe d’anticorps anti-ADAMTS13, écartant le diagnostic de PTT.
Nous avons administré de la vitamine B12 intramusculaire (1000 μg/j) à partir du troisième jour d’hospitalisation, puis prescrit de la vitamine B12 par voie orale au moment du congé. Les anomalies des analyses sanguines se sont estompées pendant les 7 jours passés à l’hôpital (tableau 2). Un mois plus tard, à une visite de suivi, les symptômes avaient disparu, toutes les valeurs hématologiques s’étaient améliorées, et le taux de vitamine B12 était normal. Les dosages d’anticorps anti-cellules pariétales et anti-facteur intrinsèque étaient négatifs, diminuant la probabilité que l’anémie pernicieuse soit la cause de la carence en vitamine B12, sans pour autant qu’on puisse exclure cette possibilité.
Tableau 2:
Résultats d’analyses de laboratoire avant et après l’administration de vitamine B12 par voie intramusculaire pour une grave carence en vitamine B12 se manifestant par une pseudo-microangiopathie thrombotique
| Analyse | Plage de référence | Jour d’hospitalisation | ||||||
|---|---|---|---|---|---|---|---|---|
| Jour 1 | Jour 2 | Jour 3* | Jour 4 | Jour 5 | Jour 7 | Jour 35 | ||
| Hémoglobine, g/L | 135–175 | 45 | 103† | 71 | 71 | 75 | 79 | 120 |
| VGM, fL | 80–100 | 111 | 93,1 | 94,4 | 92,5 | 96,3 | 98,8 | 89 |
| Plaquettes, × 109/L | 150–400 | 68 | 26 | 19 | 16 | 13 | 54 | 184 |
| Leukocytes, × 109/L | 4–11 | 2,9 | 2 | 2 | 2,8 | 2 | 4 | 3,7 |
| Bilirubine non conjuguée, μmol/L | 0–12 | 58 | 50,7 | 51 | 55 | |||
| Lacticodéshydrogénase, U/L | 110–230 | > 4500 | 4424 | > 2000‡ | 1308 | 155 | ||
| D-dimères, ng/mL | < 500 | 40 052 | 22 036 | 38 392 | 2875 | 1396 | 304 | |
| RIN | 0,9–1,2 | 1,4 | 1,2 | 1,3 | 1,3 | 1,3 | 1,4 | 1,1 |
| Vitamine B12, pmol/L | 138–652 | < 117 | 404 | |||||
Remarque : RIN = rapport international normalisé, VGM = volume globulaire moyen.
Première dose de vitamine B12 intramusculaire administrée le 3e jour d’hospitalisation.
Après la transfusion de 4 unités de concentré de globules rouges.
Résultat de laboratoire inexact > 2000 U/L.
Discussion
Ce cas illustre que le spectre clinique de la carence en vitamine B12 peut comprendre des maladies menaçant le pronostic vital, avec des troubles hématologiques comme la pancytopénie, la pseudo-MAT et la CIVD décompensée. La thrombocytopénie grave, les marqueurs d’hémolyse positifs, la présence de schizocytes sur le frottis sanguin périphérique et le taux très élevé de LDH (> 1000 U/mL) appuyaient un diagnostic possible de MAT; le diagnostic différentiel comprenait le PTT, un syndrome hémolytique, un syndrome hémolytique atypique ou une MAT secondaire d’origine médicamenteuse, infectieuse ou cancéreuse. Concernant le taux élevé de LDH, notre diagnostic différentiel comprenait d’autres causes d’hémolyse, une infection, un cancer, une hémorragie intracrânienne, une myopathie et une défaillance polyviscérale (encadré 1). La détection d’une grave carence en vitamine B12 et la normalisation des troubles hématologiques à la suite de l’administration de vitamine B12 nous ont permis d’établir le diagnostic de grave carence. Son tableau clinique souligne l’importance de demander un dosage de la vitamine B12 en cas de pancytopénie inexpliquée ou de suspicion de MAT.
Encadré 1 : Diagnostic différentiel pour le taux élevé de lacticodéshydrogénase (> 1000 U/mL)
-
Hémolyse
Microangiopathies thrombotiques comme : purpura thrombocytopénique thrombotique, syndrome urémique hémolytique, syndrome urémique hémolytique atypique, coagulation intravasculaire disséminée, hypertension artérielle maligne, crise rénale sclérodermique, syndrome catastrophique des antiphospholipides
Autres causes d’hémolyse intravasculaire : anémie hémolytique auto-immune, réaction transfusionnelle hémolytique, anémie hémolytique congénitale (p. ex., anémie falciforme), hémolyse mécanique (p. ex., brûlures, dysfonctionnement de la valve prothétique)
-
Cancer
Lymphome, leucémie, tumeurs solides, syndrome de lyse tumorale
-
Infections
Pneumonie pneumocystique, tuberculose, septicémie bactérienne, méningite bactérienne, encéphalite, myocardite, VIH
Défaillance polyviscérale (en particulier des poumons, des reins et du foie), souvent secondaire à un choc
-
Myopathie
Rhabdomyolyse, myopathies auto-immunes telles que la polymyosite et la dermatomyosite, traumatisme
Hémorragie intracrânienne
-
Atteinte myocardique
Infarctus du myocarde de type 1, ischémie liée à la demande, atteinte d’origine médicamenteuse
Grave carence en vitamine B12
La vitamine B12 est essentielle pour la synthèse de l’ADN, la production de l’ensemble des lignées cellulaires hématologiques et la synthèse de la myéline2,3. Aux États-Unis, on estime que la prévalence de la carence en vitamine B12 atteindrait 6 %–20 %3. Cette carence, généralement asymptomatique ou légèrement symptomatique, est souvent diagnostiquée en ambulatoire. Les symptômes fréquents comprennent une fatigue subaiguë ou chronique, des palpitations, un ictère et des anomalies neurologiques, dont une neuropathie périphérique et une ataxie (perte de la proprioception et de la sensation de la vibration). La vitamine B12 est présente dans les aliments d’origine animale comme la viande rouge, la volaille, les œufs et les produits laitiers. Les causes fréquentes de cette carence comprennent une malabsorption secondaire à une anémie pernicieuse, une résection gastrique ou intestinale, une maladie intestinale inflammatoire, des causes iatrogènes comme la prise prolongée de metformine ou d’inhibiteurs de la pompe à protons, une carence nutritionnelle due au végétalisme ou l’alcoolisme3,4. Dans le cas de notre patient, l’origine de la carence reste incertaine : les dosages d’anticorps anti-cellules pariétales et anti-facteur intrinsèque étaient négatifs, mais la sensibilité modeste de ces examens (90 % et 60 %, respectivement) ne permet pas d’écarter l’anémie pernicieuse5.
Les manifestations hématologiques de la carence en vitamine B12 comprennent l’anémie mégaloblastique accompagnée d’érythrocytes macrocytaires et de neutrophiles hypersegmentés, comme chez notre patient (figure 1). La carence plus grave mène parfois à la pancytopénie. Des taux élevés d’acide méthylmalonique et d’homocystéine peuvent confirmer le diagnostic de carence en vitamine B12 si le taux sérique de la vitamine n’est pas concluant ou est à la limite normale inférieure3,4.
Quelle qu’en soit la cause, la carence en vitamine B12 se traite par des suppléments de vitamine B12 par voie orale ou intramusculaire. En cas de neuropathie ou de pancytopénie, il est préférable d’administrer le traitement initial par voie intramusculaire3. La pancytopénie guérit en général dans les 2 mois suivant le début du traitement, tandis que les déficits neurologiques peuvent mettre 3 mois ou plus à disparaître, et peuvent être irréversibles dans certains cas3,4.
Dans sa forme la plus grave, la carence en vitamine B12 peut ressembler à une microangiopathie thrombotique, comme le PTT. Les signes cardinaux se recoupent avec d’autres microangiopathies thrombotiques : anémie et marqueurs d’hémolyse anormaux, schizocytes sur le frottis sanguin périphérique, LDH élevé et thrombocytopénie (tableau 3). On estime que de 1 %–3 % des cas de grave carence en vitamine B12 se manifestent par une pseudo-MAT1,6.
Tableau 3:
Anomalies des analyses sanguines pour la pseudo-microangiopathie thrombotique (MAT) secondaire à une carence en vitamine B12, par rapport au purpura thrombocytopénique thrombotique (PTT) et à la coagulation intravasculaire disséminée (CIVD)
| Pseudo-MAT secondaire à une carence en vitamine B12 deficiency (± CIVD) | PTT | CIVD | |
|---|---|---|---|
| Hémoglobine | ↓↓ | ↓ | ↓ |
| VGM | ↑ | −/↑ | – |
| Plaquettes | ↓ | ↓ | ↓ |
| Leucocytes | ↓ | – | – |
| Réticulocytes | −/↓ | ↑ | ↑ |
| Frottis sanguin périphérique | Neutrophiles hypersegmentés, schizocytes (peu), dacrocytes | Schizocytes | Schizocytes (peu) |
| RIN | −/↑ | – | ↑ |
| TCA | −/↑ | – | ↑ |
| Fibrinogène | −/↓ | – | ↓ |
| Créatinine | – | −/↑ | −/↑ |
| Bilirubine non conjuguée | ↑ | ↑↑ | ↑ |
| Test direct à l’antiglobuline | Négatif | Négatif | Négatif |
| Lacticodéshydrogénase | ↑↑ | ↑ | −/↑ |
| Haptoglobine | ↓ | ↓ | ↓ |
| D-dimères, ng/mL | −/↑ | – | ↑↑ |
| ADAMTS13, % | > 10 | < 10 | > 10 |
| Taux de vitamine B12 | ↓↓ | – | – |
Remarque : RIN = rapport international normalisé, TCA = temps de céphaline activée, ADAMTS13 = désintégrine et métalloprotéinase à motifs thrombospondines de type 13, VGM = volume globulaire moyen.
Il est essentiel de distinguer la pseudo-MAT du PTT, ce dernier étant associé, en l’absence de traitement, à un taux de mortalité de 80 %–90 % et, si le traitement est retardé de plus de 24 heures, à un risque de décès multiplié par 1,4 et à un risque d’événement thrombotique majeur multiplié par 2,92,7. Le PTT acquis est défini comme la présence d’auto-anticorps entraînant un déficit sévère de l’enzyme ADAMTS13, qui est normalement responsable du clivage des volumineux multimères du facteur de Von Willebrand en circulation. Sans l’enzyme ADAMTS13, ces multimères s’accumulent, ce qui cause une occlusion microvasculaire (entraînant une microthrombose, puis des lésions aux organes cibles), la consommation des plaquettes (entraînant une thrombocytopénie) et la fragmentation des érythrocytes dans la microcirculation (entraînant la présence de schizocytes sur le frottis sanguin). Le score PLASMIC est un outil de dépistage clinique du déficit sévère en ADAMTS13; un score élevé de 6 ou 7 a une valeur prédictive positive de 72 %, tandis qu’un score faible de 0–4 exclut le diagnostic de PTT8. Le patient décrit ici avait un score PLASMIC de 5, ne permettant ni de confirmer ni d’exclure le PTT.
Le diagnostic de PTT est confirmé par la présence d’anémie hémolytique microangiopathique, avec un taux d’ADAMTS13 inférieur à 10 %. Malheureusement, comme l’analyse de l’ADAMTS13 prend des jours ou des semaines, il faudrait administrer immédiatement un traitement empirique en cas d’indice de suspicion du PTT élevé. Le traitement du PTT comprend l’immunosuppression et la plasmaphérèse thérapeutique, qui élimine l’inhibiteur d’ADAMTS13 et corrige le déficit en ADAMTS13 avec du plasma provenant d’un groupe de donneurs. On évite généralement la transfusion plaquettaire en raison du risque théorique d’aggravation de la thrombose; la transfusion d’érythrocytes n’est pas contre-indiquée. En revanche, le traitement de la pseudo-MAT secondaire à une carence en vitamine B12 se résume à la supplémentation vitaminique2.
Le diagnostic erroné des graves carences en vitamine B12 est fréquent en cas de pseudo-MAT. Dans une analyse documentaire de 2017, 39 % des cas de pseudo-MAT secondaires à une carence en vitamine B12 avaient été traités comme un PTT, avec une perfusion de plasma ou une plasmaphérèse thérapeutique9. Le temps médian pour parvenir au bon diagnostic s’élevait à 2 semaines9. Koshy et ses collègues6 ont comparé les manifestations cliniques des cas de PTT et des cas de pseudoMAT secondaire à une carence en vitamine B12 survenus entre 1997 et 2019. En moyenne, par rapport aux personnes atteintes de PTT, celles atteintes de pseudo-MAT avaient une anémie plus grave (taux d’hémoglobine de 61 g/L c. 94 g/L), un VGM (109 fL c. 86 fL) et un taux de LDH (3539 UI/L c. 1183 UI/L) plus élevés, et un index réticulocytaire (0,4 % c. 2,4 %), une numération absolue des neutrophiles (2,4 × 109/L c. 7,7 × 109/L) et une bilirubine totale (1,6 mg/dL c. 5,2 mg/dL) plus faibles. En outre, la fonction rénale et les anticorps contre le facteur intrinsèque étaient normaux dans la plupart (69 %) des cas de pseudo-MAT. Le score PLASMIC n’a pas permis de distinguer clairement ces troubles; les personnes atteintes de pseudo-MAT ont obtenu un score médian de 4,9 (probabilité de PTT intermédiaire), contre 6,1 (probabilité de PTT élevée) pour les personnes atteintes de PTT.
La CIVD décompensée entraînée par une grave carence en vitamine B12, comme chez ce patient, est rare10. La coagulation intravasculaire disséminée est un syndrome clinique provoqué par l’activation généralisée et inappropriée de la coagulation, la consommation des facteurs de coagulation, la fibrinolyse et la production de produits de dégradation de la fibrine. Les causes typiques sont une infection massive, un cancer, un décollement placentaire et un traumatisme majeur. Les anomalies aux analyses de laboratoire comprennent une forte concentration de D-dimères, une grave thrombocytopénie, un rapport international normalisé élevé et une hypofibrinogénémie. Aboona et ses collègues10 ont montré que, tout comme ce fut le cas pour notre patient, les anomalies aux analyses de laboratoire découlant de la CIVD secondaire à une carence en vitamine B12 se corrigeaient avec une simple supplémentation en vitamine B12. Une théorie proposée pour expliquer la CIVD due à une carence en vitamine B12 est que l’apoptose des érythroblastes immatures entraîne la libération de pièges extracellulaires des neutrophiles et, ainsi, la formation de microthrombi ainsi que la consommation de facteurs de coagulation10.
Conclusion
Nous décrivons un patient atteint d’une grave carence en vitamine B12 ayant entraîné une pancytopénie, une pseudo-MAT et une CIVD. Le dosage de la vitamine B12 devrait être systématique en cas de soupçon de MAT.
La section Études de cas présente de brefs rapports de cas à partir desquels des leçons claires et pratiques peuvent être tirées. Les rapports portant sur des cas typiques de problèmes importants, mais rares ou sur des cas atypiques importants de problèmes courants sont privilégiés. Chaque article commence par la présentation du cas (500 mots maximum), laquelle est suivie d’une discussion sur l’affection sous-jacente (1000 mots maximum). La soumission d’éléments visuels (p. ex., tableaux des diagnostics différentiels, des caractéristiques cliniques ou de la méthode diagnostique) est encouragée. Le consentement des patients doit impérativement être obtenu pour la publication de leur cas. Renseignements destinés aux auteurs : www.cmaj.ca
Voir la version anglaise de l’article ici : www.cmaj.ca/lookup/doi/10.1503/cmaj.230959
Footnotes
Intérêts concurrents: Aucun déclaré.
Cet article a été révisé par des pairs.
Les auteurs ont obtenu le consentement du patient.
Collaborateurs : Tous les auteurs ont contribué à l’élaboration et à la conception de l’étude ainsi qu’à l’ébauche du manuscrit, ont révisé de façon critique son contenu intellectuel important, ont donné leur approbation finale pour la version destinée à être publiée et endossent l’entière responsabilité de tous les aspects du travail.
Références
- 1.Bendapudi PK, Hurwitz S, Fry A, et al. Derivation and external validation of the PLASMIC score for rapid assessment of adults with thrombotic microangiopathies: a cohort study. Lancet Haematol 2017;4:e157–64. [DOI] [PubMed] [Google Scholar]
- 2.Hassouneh R, Shen S, Lee O, et al. Severe vitamin B12 deficiency mimicking microangiopathic hemolytic anemia. J Hematol 2021;10:202–5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Langan RC, Goodbred AJ. Vitamin B12 deficiency: recognition and management. Am Fam Physician 2017;96:384–9. [PubMed] [Google Scholar]
- 4.Langan RC, Zawistoski KJ. Update on vitamin B12 deficiency. Am Fam Physician 2011;83:1425–30. [PubMed] [Google Scholar]
- 5.Bizzaro N, Antico A. Diagnosis and classification of pernicious anemia. Autoimmun Rev 2014;13:565–8. [DOI] [PubMed] [Google Scholar]
- 6.Koshy AG, Freed JA. Clinical features of vitamin B12 deficiency mimicking thrombotic microangiopathy. Br J Haematol 2020;191:938–41. [DOI] [PubMed] [Google Scholar]
- 7.Sawler D, Parker A, Britto J, et al. Time from suspected thrombotic thrombocytopenic purpura to initiation of plasma exchange and impact on survival: a 10-year provincial retrospective cohort study. Thromb Res 2020;193:53–9. [DOI] [PubMed] [Google Scholar]
- 8.Li A, Khalighi PR, Wu Q, et al. External validation of the PLASMIC score: a clinical prediction tool for thrombotic thrombocytopenic purpura diagnosis and treatment. J Thromb Haemost 2018;16:164–9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tun AM, Myint ZW, Hernandez CR, et al. Vitamin B12 deficiency-related pseudo-thrombotic microangiopathy might be misdiagnosed and treated with plasma product therapy: review of the literature and analysis of the reported cases. Blood 2017;130(Suppl 1):5576. [Google Scholar]
- 10.Aboona MB, Rapaich L, Etman A, et al. A rare presentation of pernicious anemia manifesting as disseminated intravascular coagulation. J Med Cases 2022;13:557–60. [DOI] [PMC free article] [PubMed] [Google Scholar]