Estimado Editor:
Paciente varón de 63 años de edad sin antecedentes sistémicos ni oculares que acude al servicio de urgencias presentando un cuadro de ojo rojo doloroso acompañado de fotofobia de días de evolución con agudeza visual conservada. A la exploración se observan células inflamatorias en cámara anterior junto con un mínimo defecto epitelial no infiltrado (1x1mm). Se diagnostica de uveítis anterior aguda y se comienza tratamiento tópico con colirio de dexametasona 1mg/ ml y ciclopentolato 10mg/ml junto con ofloxacino 5mg/ml, para evitar sobreinfecciones del defecto epitelial.
En la revisión a la semana el paciente no presenta mejoría de la inflamación intraocular pero sí un aumento de tamaño del defecto epitelial sin apreciarse ningún signo de infiltrado corneal. Se intensifica la pauta antiinflamatoria y profiláctica añadiendo pomada nocturna de Terracortril® (oxitetraciclina 5mg/g, hidrocortisona 10mg/g, polimixina B 10000U/g). Se reevalua al paciente a las 48 horas, cuando se aprecia por primera vez un infiltrado corneal de 4x4.5mm, hipopion menos de 1mm y pliegues estromales junto con la reacción inflamatoria ya conocida en cámara anterior. Tras una anamnesis más detallada el paciente refiere haber estado realizando tareas de campo los días anteriores.
Se contacta en ese momento con el laboratorio de Micro-biología para toma de muestras solicitando cultivo de bacterias y hongos. Tras informe de la tinción de Gram ese mismo día (Figura 1A) se retiran los corticoides y se pautan colirios fortificados para bacterias (vancomicina 50mg/ml y ceftazidima 50mg/ ml, 1 gota cada dos horas sin descanso nocturno) y tratamiento empírico para queratomicosis con colirio fortificado de voriconazol al 1% horario (10mg/ml), al no disponer de natamicina al 5%. Se añadió al tratamiento voriconazol oral (400 mg/12 horas las primeras 24 horas, luego 200 mg/12 horas).
Figura 1.
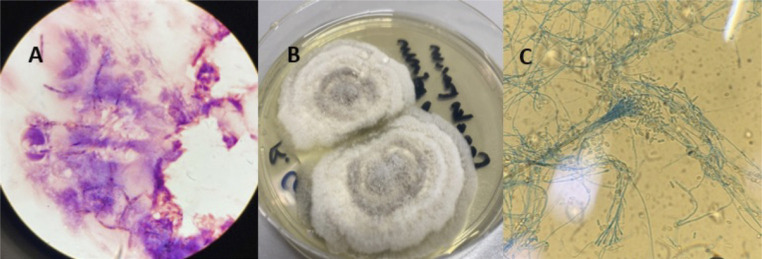
A: Estructuras fúngicas en la tinción de Gram. B: Colonias en agar Sabouraud. C: Técnica azul de algodón de lactofenol, observación microscópica del graphium
El raspado corneal fue inoculado en agar sangre, chocolate, Sabouraud cloranfenicol y BHI (Brain Heart Infusion), incubándose a 35ºC. A las 48 horas se observa en todas ellas un crecimiento de colonias algodonosas, con tonalidad blanca en el borde y gris verdoso en el interior (Figura 1B).
Se llevó a cabo una primera identificación mediante la técnica de azul algodón de lactofenol, en el que se observaron hifas hialinas, septadas, con conidióforos largos que soportan conidios individuales, ovalados, únicos y de base truncada. Según la observación microscópica, la presencia de graphium (Figura 1C) y ausencia de pigmento difusible amarillo en el agar, nos hizo sospechar la presencia de Scedosporium apiospermum complex.
Tras la imposibilidad de poder concluir la especie, se deriva a nuestro centro de referencia para realizar la técnica de biología molecular, siendo identificado como Scedosporium apiospermum sensu estricto. La sensibilidad fue testada mediante CMI, anfotericina B 16 mg/L, itraconazol >8 mg/L, voriconazol 2mg/L, posaconazol >8 mg/L, isavuconazol >8 mg/L, terbinafina >16 mg/L, caspofungina 1 mg/L, micafungina 0,12 mg/L, anidulafungina 0,03mg/L.
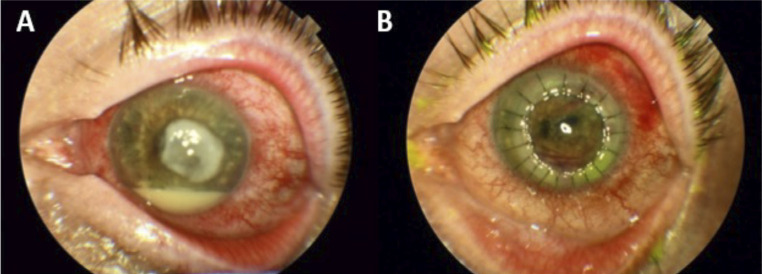
El paciente evoluciona de forma tórpida, con fluctuaciones en el tamaño del hipopion, infiltrado estable en tamaño y con aclaramiento progresivo, aunque con inicios de melting corneal (Figura 2A); por lo que se añade vitamina C oral 1 g/24h, doxiciclina oral 100 mg/12 horas y colirio de suero autólogo al 20%/6 horas en un intento de frenar la lisis colágena. Al mes del inicio del cuadro se empieza a conseguir una mejoría clínica con aclaramiento del infiltrado y la casi total resolución del hipopion. Sin embargo, el paciente acude a urgencias semanas después presentado dolor agudo tras un esfuerzo. Con el diagnóstico de perforación corneal se decide realizar una queratoplastia penetrante de urgencia en caliente, con inyección intracamerular de voriconazol (100 µg/0,1ml) y anfotericina B (0,05 mg/ml), consiguiéndose resecar completamente el infiltrado. El paciente siguió tras la cirugía una terapia antiinflamatoria con colirio de dexametasona (1 mg/ml) en pauta descendente, voriconazol tópico 1% cada 6 horas profiláctico y lubricación abundante para cuidar la superficie ocular. Se envía la córnea al laboratorio de Microbiología aislán-dose nuevamente Scedosporium apiospermum sensu estricto, con idéntica CMI para el voriconazol.
Figura 2.
A: Imagen ocular tras 15 días de tratamiento, donde se observa la lesión corneal e hipopion. B: Imagen tras queratoplastia penetrante.
A los tres meses de la intervención la presión ocular se mantiene normal en 10 mmHg y la agudeza visual en 0.3, con puntos corneales in situ y sin signos de recidiva infecciosa (Figura 2B).
Las queratomicosis son infecciones fúngicas, supurativas y ulceradas, cuya prevención y tratamiento son difíciles de abordar. Pueden producir daños devastadores, incluso pérdida del globo ocular, si se deja que progresen sin control.
En países desarrollados, la queratitis fúngica filamentosa suele producirse en hombres sanos que se dedican a trabajos agrícolas, como consecuencia de traumatismo con materia vegetal contaminado con esporas fúngicas, que se implantan en el estroma corneal [1-2]. Otros factores de riesgo incluyen anomalías corneales, inmunosupresión local por uso de corticoides, empleo de soluciones o lentes de contacto contaminadas, cirugía ocular previa o trastorno sistémico [2]. En el caso que nos ocupa, al rehistoriar al paciente, confirmó el antecedente de traumatismo con materia vegetal durante una poda.
En el seno de inflamación corneal sospecharemos una etiología fúngica, cuando el curso sea lento, tórpido, presente una úlcera de aspecto radiado (plumoso), lesiones satélites e hipopion recurrente [2,3]. Aunque el diagnóstico de sospecha es clínico, es necesario filiar rápida y certeramente el agente etiológico responsable, con un adecuado raspado corneal [4]. En casos donde se reepiteliza el epitelio tras el trauma y la queratitis tiene lugar en el interior del tejido estromal, puede ser necesaria la biopsia corneal.
En nuestro paciente fue determinante el hecho de realizar la tinción de Gram del raspado corneal, donde se observaron hifas septadas, lo que permitió el ajuste del tratamiento. El examen directo es barato, simple y rápido y aunque es posible observar estructuras fúngicas con KOH, se prefiere usar tinciones como el Gram, Giemsa o blanco de calcoflúor [4]. El diagnóstico de confirmación continúa siendo el cultivo [4-5]. El material obtenido generalmente es escaso y debe ser sembrado directamente en la propia cabecera del enfermo, en medios de cultivo para bacterias, hongos, virus o Acanthamoeba (si existe sospecha clínica). La mayoría de los hongos oculares crecen en 2 o 3 días, aunque es prudente esperar dos semanas, para descartar su presencia [3]. Sin embargo, un cultivo negativo no descarta el diagnóstico de presunción, debido a que no tiene el 100% de sensibilidad.
Dentro de los hongos miceliales implicados, Fusarium y Aspergillus son los aislados con mayor frecuencia. En cuanto a las especies de Scedosporium son más inusuales de encontrar entre los causantes de queratitis [6]. El primer caso de queratitis por Scedosporium fue descrito en 1955 [7] y continúa siendo inusual. Dentro de dicho género, las especies con mayor relevancia clínica para el hombre son: S. apiospermum, S. boydii, S. aurantiacum, S. dehoogii y S. minutisporum [8]. La presencia de sinnemas o graphium puede ser observada en todas excepto S. dehoogii. Destaca S. apiospermum complex como el más frecuente en nuestro medio. Los métodos fenotípicos convencionales son bastante limitados para la diferenciación de las diferentes especies, así que llevar a cabo una identificación precisa, requiere enfoques moleculares en la mayoría de las ocasiones [9].
En nuestro paciente se aisló Scedosporium apiospermum sensu estricto. Un hongo de distribución mundial, aislándose en suelo, plantas, agua dulce y estancada. La posibilidad de encontrarlo en estos lugares, sumado a la capacidad del hongo de diseminación, favorece el compromiso de la vía ocular o la vía respiratoria [10].
El estado inmunitario de los pacientes juega un papel muy importante. En pacientes inmunocompetentes se desarrollan normalmente infecciones locales como son las infecciones cutáneas, micetoma, otitis, infecciones osteoarticulares y oculares. Sin embargo, en pacientes inmunodeprimidos, se han descrito casos de infección profunda, infecciones diseminadas, endocarditis, infecciones del SNC, infecciones respiratorias similares a aspergilosis, así como casos de enfermedad broncopulmonar alérgica [11].
Las infecciones oculares causadas por el complejo de especies de S. apiospermun son infrecuentes, siendo las presentaciones más comunes la queratitis (84,6%) y la escleroqueratitis (15,3%) [12]. Los pacientes suelen tener un pronóstico visual desfavorable con una baja probabilidad de conservación del órgano, debido al retraso en el diagnóstico o mala respuesta a los antifúngicos [2]. Sin embargo, si se detecta rápidamente, se instaura una pauta de tratamiento adecuada y se asegura un buen cumplimiento de la misma, aumenta mucho las probabilidades de éxito.
Tras establecer el diagnóstico, se debe tratar la queratitis con antifúngicos tópicos pautados en intervalos cortos de tiempo. El tratamiento de elección para infecciones por Scedosporium spp, según las guías internacionales es el voriconazol [13]. Es obligatorio realizar el estudio de sensibilidad in vitro, aunque no están establecidos los puntos de corte clínicos en este género. Sin embargo, su interpretación posibilita una terapia racional.
La pauta ideal, consiste en administrar colirio fortificado de voriconazol al 1%, 1 gota cada hora durante las primeras 48 horas. Si existe respuesta clínica se puede plantear, aplicarlo cada 2 horas, respetando el descanso nocturno. La duración del tratamiento antifúngico tópico no está bien establecida, aunque es larga (habitualmente 6 semanas para Candida spp y 12 semanas para los hongos filamentosos) [3]; debiendo prolongarse 3 semanas después de la aparente curación clínica [14]. Esto requiere una vigilancia estrecha para ir reduciendo gradualmente los fármacos. En caso de baja respuesta clínica podría optarse por el uso de inyección intraestromal o intracamerular con un máximo de 4 inyecciones en intervalos de 72 horas [15].
El tratamiento sistémico debería considerarse en pacientes con lesiones severas y en todo paciente inmunodeprimido, siendo voriconazol de elección debido a sus características farmacocinéticas y farmacodinámicas (dosis de carga 400mg cada 12 horas el primer día, seguido de 200-300 mg cada 12 horas; en pacientes de >40 kilos de peso) [14]. Para asegurar que las concentraciones son óptimas, se determinan los niveles séricos en el valle, entre los 5 y 7 días del inicio el tratamiento oral [16].
A pesar de haber introducido el antifúngico de elección (tópico y oral) desde el diagnóstico microbiológico, se produjo una perforación ocular que llevo a una queratoplastia penetrante. Habiendo sido descartadas la falta de sensibilidad al voriconazol y las concentraciones plasmáticas insuficientes de dicho fármaco (4.73 µg/ml en el valle).
Sigue habiendo un alto porcentaje de fracaso terapéutico; el escenario futuro podría mejorar con la incorporación de nuevas técnicas diagnósticas y el desarrollo de nuevos fármacos. El microscopio confocal es una técnica no invasiva, subjetiva y útil en el caso de queratitis fúngicas y por Acanthamoeba [7,17]. Por otro lado, en el laboratorio de microbiología, las técnicas de biología molecular, presentan una alta sensibilidad y especificidad, permitiendo acortar el tiempo de respuesta a 4-8 horas frente a los 15 días del cultivo [4]. Sin embargo, ambas no se encuentran implantadas en la práctica clínica, debido a su coste.
En lo que respecta a los nuevos antifúngicos, parece prometedor el uso de olorofim en la escedosporiasis. El fármaco actúa ejerciendo la muerte celular fúngica mediante la inhibición de la enzima dihidroorotato deshidrogenasa (DHODH) en la vía de la sínstesis de la pirimidina [18]. La comercialización de olorofim sigue pendiente de la aprobación por parte de la Agencia Europea del Medicamento (EMA) y la Food and Drugs Administration (FDA).
A modo de conclusión, el pronóstico de las queratomicosis depende la rapidez con la que se instaure un tratamiento específico, lo que requiere una estrecha colaboración oftalmólogo y microbiólogo para determinar con certeza la etiología de los procesos supurativos corneales, donde la tinción de Gram nos aporta un gran valor.
FINANCIACIÓN
Los autores declaran no haber recibido financiación para la realización del estudio
CONFLICTO DE INTERÉS
Los autores no presentan ningún conflicto de interés
References
- 1.Karaca U. Scedosporium apiospermium keratitis: a case report. J Med Case Rep 2022. Mar 4;16 (1):91. Doi: 10.1186/s13256-022-03315-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Sharma N, Bagga B, Singhal D, Nagpal R, Kate A, Saluja G, et al. Fungal keratitis: A review of clinical presentations, treatment strategies and outcomes. Ocul Surf. 2022. Apr; 24:22-30. doi: 10.1016/j.jtos.2021.12.001. Epub 2021 Dec 13. [DOI] [PubMed] [Google Scholar]
- 3.Ricardson MD, Warnock DW. Keratomycosis. Fungal infection. Diagnosis and management. 4th ed. 2012. [Google Scholar]
- 4.Chang CC, Chen S. Fungal Eye Infections: New Hosts, Novel Emerging Pathogens but No New Treatments? Advances in Diagnosis of Invasive Fungal Infections. Current Fungal Infection Reports 2018. 12(2):66-70. 10.1007/s12281-018-0315-z [DOI] [Google Scholar]
- 5.Keche A, Behera S, Tigga R, Sahu V, Mishra N. P165 Mycological profile of keratitis from tertiary care center in the state of Chattisgarh, India. Med Mycol. 2022. Sep; 60(Suppl 1): myac072P165. doi: 10.1093/mmy/myac072.P165 [DOI] [Google Scholar]
- 6.Pota CE, Ayaz Y, Ünal M, Koyuncu Özyurt Ö. Fungal keratitis caused by Scedosporium apiosperumum: a case report. J Med Case Rep. 2022. Sep 7; 16(1):340. doi: 10.1186/s13256-022-03566-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Izadi A, Soleimani M, Dos Santos CO, Tehupeiory-Kooreman MC, Daie Ghazvini R, Hashemi SJ, et al.Fungal keratitis caused by Pseudallescheria boydii: clinical and mycological characteristics. J Ophthalmic Inflamm Infect. 2021. Sep 24;11(1):30. doi: 10.1186/s12348-021-00255-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.García-Gutiérrez A, Moi Fat VC, Puerta-Mateo A, Cuétara MS.. Complicated abscess by uncommon etiology. Enferm Infecc Microbiol Clin (Engl Ed) 2020. Jan;38(1):33-35. Doi: 10.1016/j.eimc.2019.05.009. Epub 2019 Jun 27 [DOI] [PubMed] [Google Scholar]
- 9.Kim H, Ahn JY, Chung IY, Seo SW, Yoo WS, Shin JH, et al.A case report of infectious scleritis with corneal ulcer caused by Scedosporium aurantiacum.Medicine (Baltimore). 2019. Jul;98(27):e16063. doi: 10.1097/MD.0000000000016063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Palma-Fernández R , Montecinos-Astorga A, Fica A, Godoy-Martínez P, Aguilera I, Pinar-Pacheco C. Invasive ocular fungal infection by Scedosporium apiospermum in an immunocompromised patient. Rev Chilena Infectol 2021. Aug;38(4):568-573. doi: 10.4067/S0716-10182021000400568. [DOI] [PubMed] [Google Scholar]
- 11.Ramirez-Garcia A, Pellon A, Rementeria A, Buldain I, BarretoBergter E, Rollin-Pinheiroet al. Scedosporium and Lomentospora: an updated overview of underrated opportunists. Med Mycol. 2018. Apr 1:56 (suppl_1):102-125. doi: 10.1093/mmy/myx113. [DOI] [PubMed] [Google Scholar]
- 12.Ramakrishnan S, Mandlik K, Sanket Sathe T, Gubert J, Krishnan T, Baskaran P. Ocular infections caused by Scedosporium apiospermum: A case series. Indian J Ophthalmol. 2018. Jan; 66(1): 137–140. doi: 10.4103/ijo.IJO_524_17 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Hoenigl M, Salmanton-García J, Walsh TJ, Nucci M, Neoh CF, Jenks JD, et al. Global guideline for the diagnosis and management of rare mould infections: an initiative of the European Confederation of Medical Mycology in cooperation with the International Society for Human and Animal Mycology and the American Society for Microbiology. Lancet Infect Dis. 2021. Aug;21(8):e246-e257. doi: 10.1016/S1473-3099(20)30784-2 [DOI] [PubMed] [Google Scholar]
- 14.Hoffman JJ , Arunga S , Mohamed Ahme A, Hu VH , Burton MJ. Management of Filamentous Fungal Keratitis: A Pragmatic Approach. J Fungi (Basel). 2022. Oct 11;8(10):1067. doi: 10.3390/jof8101067 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Sharma N, Sahay P, Maharana PK, Singhal D, Saluja G, Bandivadekar P, et al. Management Algorithm for Fungal Keratitis: The TST (Topical, Systemic, and Targeted Therapy)Protocol.Cornea. 2019. Feb;38(2):141-145.doi: 10.1097/ICO.0000000000001781 [DOI] [PubMed] [Google Scholar]
- 16.Boyd MKE, Dao H, Estep JD, Huttenbach YT, Hemmige V. Utilization of voriconazole drugmonitoring in thetreatment of cutaneous Scedosporium apiospermum infection Med Mycol Case Rep 2018. Sep 13;22:52-54. Doi: 10.1016/j.mmcr.2018.09.002 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Watson SL, Cabrera-Aguas M, Keay L, Khoo P, McCall D, Lahra MM. Mycoses. 2020 The clinical and microbiological features and outcomes of fungal keratitis over 9 years in Sydney, Australia. Jan;63(1):43-51. doi: 10.1111/myc.13009. Epub 2019 Oct 27. [DOI] [PubMed] [Google Scholar]
- 18.Rivero-Menéndez O, Cuenca-Estrella M, Alastruey-Izquierdo A. In vitro activity of olorofim against clinical isolates of Scedosporium species and Lomentospora prolificans using EUCAST and CLSI methodologies.J Antimicrob Chemother. 2020. Dec 1;75(12):3582-3585 doi: 10.1093/jac/dkaa351 [DOI] [PubMed] [Google Scholar]