Abstract
目的
探讨抗内皮细胞抗体(anti-endothelial cell antibodies, AECA)预测早期流产的临床意义。
方法
选取2020年1月至2022年12月于北京大学人民医院进行产检并完善AECA的无自身免疫病史孕妇122例。根据早期流产史(流产时孕周<12周),将研究对象分为早期流产组和对照组,采用t检验、非参数Wilcoxon检验、Chi-square检验、Fisher确切概率法比较两组一般资料和实验室指标,多因素Logistic回归模型分析早期流产的相关因素。随访孕妇的自然流产情况,Kaplan-Meier生存分析比较AECA阳性和AECA阴性孕妇的自然流产率。
结果
(1) 共纳入122例孕妇,其中早期流产组35例(28.7%),平均年龄(32.1±6.1)岁;对照组87例(71.3%),平均年龄(30.7±5.1)岁。早期流产组有更多的妊娠次数[3 (2, 4) vs. 1 (1, 2), Z=-6.402, P < 0.001]和高血压合并症(11.4% vs.1.1%, P=0.024)。早期流产组AECA的阳性率(34.3% vs. 8.0%, χ2=13.070, P < 0.001)和免疫球蛋白G升高的比例(17.1% vs. 4.6%, P=0.032)显著高于对照组。(2)多因素Logistic回归分析结果显示,妊娠次数增加(OR=4.149, 95%CI: 2.287~7.529, P < 0.001)、AECA阳性(OR=4.288, 95%CI: 1.157~15.893, P=0.029)、免疫球蛋白G升高(OR=6.177, 95%CI: 1.156~33.015, P=0.033)是早期流产的危险因素。(3)将122例孕妇分为AECA阳性组(19例)和AECA阴性组(103例),生存分析显示,孕12周时AECA阳性组的胎儿生存率显著低于AECA阴性组(84.2% vs. 96.1%, P=0.035)。
结论
妊娠次数增加、AECA阳性及免疫球蛋白G升高是导致早期流产的显著危险因素;AECA的检测有助于预测早期流产,可以为改善妊娠结局提供依据。
Keywords: 抗内皮细胞抗体, 早期流产, 危险因素
Abstract
Objective
To explore the clinical significance of anti-endothelial cell antibodies (AECA) in predicting early miscarriage.
Methods
A total of 122 pregnant women with no history of autoimmune diseases who underwent prenatal examination at Peking University People's Hospital from January 2020 to December 2022 were selected, and they were tested for AECA. Based on the history of early miscarriage (gestational age at miscarriage < 12 weeks), the participants were divided into an early miscarriage group and a control group. t-tests, non-parametric Wilcoxon tests, Chi-square tests, and Fisher's exact probability method were used to compare general information and laboratory indicators between the two groups. A multivariate Logistic regression model was used to analyze the factors associated with early miscarriage. The natural miscarriage rates were assessed through follow-up with pregnant women, and Kaplan-Meier survival analysis was employed to compare the natural miscarriage rates between AECA-positive and AECA-negative pregnant women.
Results
(1) A total of 122 pregnant women were enrolled, comprising 35 cases (28.7%) in the early miscarriage group, with an average age of (32.1±6.1) years, and 87 cases (71.3%) in the control group, with an average age of (30.7±5.1) years. The early miscarriage group had higher gravidity [3 (2, 4) vs. 1 (1, 2), Z=-6.402, P < 0.001] and a higher prevalence of hypertension (11.4% vs.1.1%, P=0.024). The positive rate of AECA in the early miscarriage group (34.3% vs. 8.0%, χ2=13.070, P < 0.001) and the proportion of elevated immunoglobulin G (17.1% vs. 4.6%, P=0.032) were significantly higher than that in the control group. (2) Multivariate logistic regression analysis showed that higher gravidity (OR=4.149, 95%CI: 2.287-7.529, P < 0.001), AECA positivity (OR= 4.288, 95% CI: 1.157-15.893, P=0.029), and elevated immunoglobulin G levels (OR =6.177, 95%CI: 1.156-33.015, P=0.033) were risk factors for early miscarriage. (3) The 122 pregnant women were categorized into two groups: the AECA-positive group (19 cases) and the AECA-negative group (103 cases). Survival analysis demonstrated that at the end of 12 weeks of gestation, the fetal survival rate in the AECA-positive group was significantly lower than that in the AECA-negative group (84.2% vs. 96.1%, P= 0.035).
Conclusion
Higher gravidity, AECA positivity, and elevated immunoglobulin G levels are significant risk factors for early miscarriage. The results demonstrate that AECA is a novel predicting test in early miscarriage.
Keywords: Anti-endothelial cell antibodies, Early miscarriage, Risk factors
近年来不孕不育的发生率逐渐增加,且呈现年轻化趋势[1]。虽然生育辅助技术在提高临床妊娠率方面发挥了积极作用,但是在孕早期的前12周内,患者自然流产的风险仍然相对较高,单胎活产率仅为35%左右[2]。大约15% 的女性一生中会经历流产,这是早孕中最常见的并发症。然而这个数字可能更高,因为非常早的流产往往不被识别[3];因此,研究早期流产的相关因素,尽早预测,适时干预,具有重要意义。早期流产定义为妊娠12周内发生的流产[4],影响因素复杂多样,包括父母双方遗传、子宫解剖、内分泌紊乱、胎盘发育异常、激素水平异常、母亲肥胖或消瘦、宫腔或全身感染等[5]。近年来,自身免疫因素已被认为是流产的关键因素[6]。
抗内皮细胞抗体(anti-endothelial cell antibo-dies, AECA)是一组针对内皮细胞膜抗原产生异质性作用的抗体,最早在20世纪70年代初通过间接免疫荧光技术被描述为能够与大鼠肾脏内皮细胞发生结合的人类抗体[7]。AECA可以结合内皮细胞,通过补体介导或者抗体依赖细胞毒作用,破坏内皮细胞,促进细胞因子、趋化因子的分泌,导致血管损伤,在系统性红斑狼疮、抗磷脂综合征、系统性硬化症和系统性血管炎等免疫疾病中具有疾病诊断及活动度评估的作用[8]。有研究指出,AECA与自然流产密切相关[9],一方面,AECA可能导致血管内皮损伤[10],引发血液高凝状态和胎盘血管栓塞性病变,其中产生针对内皮细胞的抗体是内皮细胞损伤的重要机制之一[9];另一方面,在妊娠过程中, 会发生血管内膜细胞来源的滋养层单核细胞向子宫内膜的迁移,抗内皮细胞抗体可能会抑制这些滋养层单核细胞的迁移, 从而导致胎儿流产[11]。
本研究对早期流产的相关因素进行分析,同时探讨AECA与早期流产的相关性,为临床预测早期流产的发生和尽早干预改善妊娠结局提供依据。
1. 资料与方法
1.1. 研究对象
纳入标准:选取2020年1月至2022年12月于北京大学人民医院进行产检的病例。排除标准:(1)生殖系统畸形的产妇、夫妇一方/双方染色体异常的病例;(2)有不良生活习性的患者,如作息不规律、吸烟、酗酒、滥用药物;(3)狼疮抗凝血因子/抗心磷脂抗体/抗β2-糖蛋白Ⅰ(beta-2 glycoprotein Ⅰ, β2GPⅠ)抗体阳性患者;(4)有明确自身免疫病病史的病例。(5)未行AECA检测的孕妇。
本研究共纳入3 138例产妇,其中2 821例未行AECA检测被排除。完善AECA检测的317例患者中有61例生殖系统畸形,16例夫妇一方/双方染色体异常,43例不良生活习性病例,39例狼疮抗凝血因子/抗心磷脂抗体/抗β2-GPⅠ抗体阳性病例,36例自身免疫病病例(包括桥本氏甲状腺炎2例、甲状腺功能亢进症9例、免疫性血小板减少性紫癜6例、自身免疫性溶血性贫血2例、自身免疫性肝病1例、多发性硬化症1例、类风湿关节炎10例、系统性红斑狼疮2例、混合型结缔组织病2例、干燥综合征1例),这些病例被排除,最终有122例患者符合研究标准。
本研究获得北京大学人民医院伦理审查委员会批准(批准号:2019PHB252),受试者均签署知情同意书。
1.2. 方法
AECA检测:血清EACA水平检测采用来自德国欧蒙医学诊断有限公司的间接免疫荧光试剂盒,样本1 ∶100稀释后检测患者血清AECA,荧光显微镜下在细胞质中可见绿色颗粒荧光判定为阳性。
收集患者临床、产前检查的实验室资料,包括一般资料(年龄、首次妊娠年龄、孕次、受孕方式及合并症)、实验室检查[血常规、血脂、甲状腺功能、AECA、抗核抗体、抗干燥综合征抗原A(Sjögren’ s syndrome antigen A, SSA)抗体、抗干燥综合征抗原B (Sjögren’s syndrome antigen B, SSB)抗体、抗双链脱氧核糖核酸(double-stranded DNA, dsDNA) 抗体、抗U1小核糖核蛋白(U1-ribonucleoprotein, U1-RNP)抗体、补体、免疫球蛋白等]。根据是否有早期自然流产史(流产时孕周<12周),将研究对象分为早期流产组和对照组,分析早期流产的相关因素。随访两组孕妇到分娩前,记录自然流产情况并进行分析。
1.3. 统计学分析
使用SPSS 26.0软件对数据进行统计分析。连续变量呈正态分布的数据以x±s表示,组间比较采用t检验。非正态分布数据采用中位数M (P25,P75) 表示,组间比较采用非参数Wilcoxon检验。分类变量用百分数(%)表示,采用Chi-square检验或Fisher确切概率法进行比较。单因素Logistic回归分析中P < 0.1的变量按逐步向前迭代法纳入多因素Logistic回归模型进行相关因素分析。Kaplan-Meier生存分析用于比较AECA阳性组和AECA阴性组孕妇的自然流产率。P < 0.05为差异有统计学意义。
2. 结果
2.1. 一般资料
早期流产组35例(28.7%),对照组87例(71.3%)。早期流产组有更多的妊娠次数[3 (2, 4) vs. 1 (1, 2), Z=-6.402, P < 0.001]及高血压合并症(11.4% vs.1.1%, P=0.024)。两组患者的年龄、首次受孕年龄等方面差异无统计学意义,见表 1。
表 1.
早期流产组和对照组一般资料比较
Comparisons of demographic characteristics between the early miscarriage group and control group
| Variables | Early miscarriage group (n=35) | Control group (n=87) | Z/t/χ2 | P |
| N/A, not applicable. | ||||
| Age/years, x±s | 32.1±6.1 | 30.7±5.1 | -1.129 | 0.264 |
| Age at first conception/years, x±s | 26.9±5.1 | 28.0±4.6 | 1.125 | 0.265 |
| Number of pregnancies, M (P25,P75) | 3 (2, 4) | 1 (1, 2) | -6.402 | < 0.001 |
| Artificial insemination, n (%) | 8 (22.9) | 12 (13.8) | 1.496 | 0.221 |
| Hyperthyroidism, n (%) | 0 (0) | 1 (1.1) | N/A | >0.999 |
| Hypothyroidism, n (%) | 6 (17.1) | 7 (8.0) | 1.319 | 0.251 |
| Hypertension, n (%) | 4 (11.4) | 1 (1.1) | N/A | 0.024 |
| Diabetes, n (%) | 2 (5.7) | 1 (1.1) | N/A | 0.198 |
| Hyperlipidemia, n (%) | 0 (0) | 2 (2.3) | N/A | >0.999 |
| Uterine fibroids, n (%) | 2 (5.7) | 12 (13.8) | N/A | 0.346 |
| Malignant tumor, n (%) | 4 (11.4) | 2 (2.3) | N/A | 0.056 |
2.2. 早期流产组及对照组实验室指标的差异
早期流产组AECA的阳性率(34.3% vs. 8.0%, χ2=13.070, P < 0.001)及免疫球蛋白G(immunoglobulin G,IgG)升高的比例(17.1% vs. 4.6%, P=0.032)显著高于对照组。两组相比,早期流产组的血小板计数有下降趋势,抗SSB抗体阳性率有升高趋势,但差异无统计学意义,见表 2。
表 2.
早期流产组和对照组实验室指标比较
Comparison of laboratory indexes between the early miscarriage group and control group
| Variables | Early miscarriage group (n=35) | Control group (n=87) | Z/t/χ2 | P |
| WBC, white blood cell; HGB, hemoglobin; PLT, blood platelet; TG, triglycerides; HDL-C, high-density lipoprotein cholesterol; LDL-C, low-density lipoprotein cholesterol; T3, Serum total triiodothyronine; T4, serum total thyroxine; ANA, antinuclear antibody; AECA, anti-endothelial cell antibo-dy; SSA, Sjögren’ s syndrome antigen A; SSB, Sjögren’ s syndrome antigen B; dsDNA, double-stranded DNA; RNP, ribonucleoprotein; C3, complement 3; C4, complement 4; IgA, immunoglobulin A; IgG, immunoglobulin G; IgM, immunoglobulin M; N/A, not applicable. | ||||
| WBC/(×109/L), x±s | 8.3 ± 4.5 | 8.9 ± 4.2 | 0.663 | 0.510 |
| HGB/(g/L), x±s | 108.7 ± 24.2 | 110.3± 23.1 | 0.339 | 0.736 |
| PLT/ (×109/L), x±s | 136.6 ± 89.3 | 171.3 ± 95.5 | 1.898 | 0.062 |
| TG/(mmol/L),x±s | 2.7 ± 1.2 | 2.8 ± 1.9 | 0.384 | 0.702 |
| HDL-C/(mmol/L), x±s | 1.6 ± 0.4 | 1.7 ± 0.5 | 1.383 | 0.171 |
| LDL-C/(mmol/L), x±s | 3.1 ± 1.3 | 3.2 ± 1.0 | 0.211 | 0.834 |
| T3/(μg/dL), x±s | 96.6 ± 48.4 | 121.0 ± 38.2 | 1.351 | 0.196 |
| T4/(μg/dL), x±s | 8.6 ± 3.1 | 10.7 ± 3.7 | 1.582 | 0.128 |
| ANA positive, n (%) | 2 (5.7) | 3 (3.4) | N/A | 0.624 |
| AECA positive, n (%) | 12 (34.3) | 7 (8.0) | 13.070 | < 0.001 |
| Anti-SSA antibody positive, n (%) | 3 (8.6) | 2 (2.3) | N/A | 0.142 |
| Anti-SSB antibody positive, n (%) | 2 (5.7) | 0 (0) | N/A | 0.081 |
| Anti-dsDNA antibody positive, n (%) | 0 (0) | 1 (1.1) | N/A | >0.999 |
| Anti-U1-RNP antibody positive, n (%) | 1 (2.9) | 0 (0) | N/A | 0.287 |
| Low C3, n (%) | 4 (11.4) | 8 (9.2) | N/A | 0.741 |
| Low C4, n (%) | 7 (20.0) | 17 (19.5) | 0.003 | 0.954 |
| Elevated IgA, n (%) | 0 (0) | 2 (2.3) | N/A | >0.999 |
| Elevated IgG, n (%) | 6 (17.1) | 4 (4.6) | N/A | 0.032 |
| Elevated IgM, n (%) | 1 (2.9) | 3 (3.4) | N/A | >0.999 |
| D-dimer/(μg/L), M (P25,P75) | 412.5 (207.5, 791.0) | 588.0 (346.0, 1138.8) | -0.726 | 0.468 |
2.3. 早期流产的相关因素分析
多因素Logistic回归分析结果显示,妊娠次数增加(OR=4.149, 95%CI: 2.287~7.529, P < 0.001)、AECA阳性(OR=4.288, 95%CI: 1.157~15.893, P=0.029)、IgG升高(OR=6.177, 95%CI: 1.156~33.015, P=0.033)是早期流产的危险因素,见表 3。
表 3.
早期流产的二元Logistic回归分析结果
Results of binary logistic regression analysis for early miscarriage
| Variables | Univariate | Multivariate | |||||||||
| B | Wald | P | OR | 95%CI | B | Wald | P | OR | 95%CI | ||
| PLT, blood platelet; AECA, anti-endothelial cell antibody; IgG, immunoglobulin G. | |||||||||||
| Number of pregnancies | 1.432 | 25.573 | < 0.001 | 4.188 | 2.404-7.295 | 1.423 | 21.906 | < 0.001 | 4.149 | 2.287-7.529 | |
| Hypertension | 2.407 | 4.476 | 0.034 | 11.097 | 1.194-103.141 | ||||||
| PLT/(×109/L) | -0.004 | 3.288 | 0.070 | 0.996 | 0.992-1.000 | ||||||
| AECA positive | 1.786 | 11.292 | 0.001 | 5.963 | 2.105-16.889 | 1.456 | 4.743 | 0.029 | 4.288 | 1.157-15.893 | |
| Elevated IgG | 1.457 | 4.583 | 0.032 | 4.293 | 1.131-16.296 | 1.821 | 4.534 | 0.033 | 6.177 | 1.156-33.015 | |
2.4. 随访流产情况
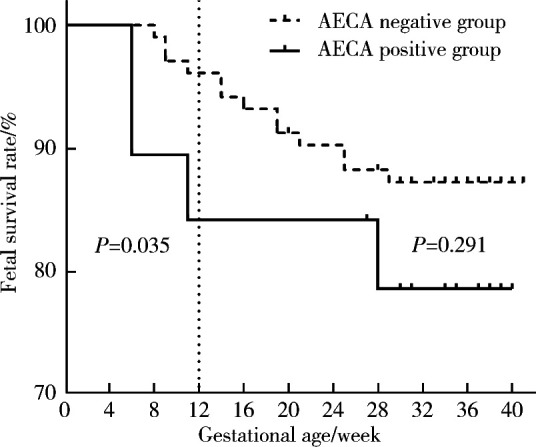
将122例孕妇按照AECA检测结果分为AECA阳性组(19例)和AECA阴性组(103例),并随访到分娩前。生存分析显示(图 1),孕12周时AECA阳性组的胎儿生存率显著低于AECA阴性组(84.2% vs. 96.1%, P=0.035)。直到分娩前,两组孕妇的胎儿生存率差异无统计学意义(78.9% vs. 87.4%, P=0.291)。
图 1.
AECA阳性孕妇和AECA阴性孕妇生存率比较
Comparison of fetal survival rates between AECA-positive pregnant women and AECA-negative pregnant women
ACEA, anti-endothelial cell antibodies.
3. 讨论
早期不明原因自然流产与孕妇生活环境、既往流产史、生殖道感染等多种因素相关,然而,具体引起早期流产的病生理机制尚未阐明,从而无法为临床治疗提供依据[12]。本研究发现,妊娠次数的增加、AECA的阳性状态以及IgG的升高与早期流产的风险增加相关,提示免疫状态失衡在早期流产发病机制中的潜在作用,为临床早期预测妊娠结局和制定干预措施提供了思路。
在内皮细胞受损的过程中,免疫机制发生紊乱,导致损伤的内皮细胞发生抗原性改变,进而刺激机体产生了AECA。由于AECA是一组异质性的自身抗体,可针对不同内皮细胞的抗原产生免疫反应,AECA对内皮细胞的影响会因抗原的多样性而呈现差异。AECA在损伤的内皮区域形成免疫复合物,吸引补体和炎症细胞的参与,进一步加剧局部炎症和损伤的程度[13]。β2GPⅠ作为与抗磷脂抗体相关的AECA抗原已得到广泛承认[14],β2GPⅠ通过与内皮细胞膜上的磷脂结合,引起β2GPⅠ和/或磷脂结构变化,暴露与抗β2GPⅠ抗体或抗磷脂抗体结合的位点,促成抗β2GPⅠ抗体或抗磷脂抗体与内皮细胞结合,触发血管内皮细胞炎症,最终形成血栓[15]。然而对于其他大多数AECA抗原目前尚未明确,如ERM蛋白[16]、内皮蛋白C受体[17],这些抗原在不同疾病的致病过程中的确切作用机制也尚未完全清楚。
深入的机制研究提示AECA可通过多种途径导致内皮细胞损伤。有研究认为局部炎症细胞产生的趋化因子介导了炎性细胞的浸润,同时参与了AECA对血管内皮细胞损伤的病理机制,指出血管内皮的损伤是抗体依赖的由细胞介导的细胞毒作用,而非补体介导[18]。相反,另一些学者认为,AECA上调细胞间黏附分子1、血管细胞黏附分子1以及E-选择蛋白的表达,促进白细胞介素-1、白细胞介素-6、白细胞介素-8和单核细胞趋化蛋白1的表达增加,这个过程刺激了内皮细胞自身分泌,促使白细胞黏附,不仅限于抗体依赖的细胞毒作用,而是涉及更广泛的细胞信号调控作用[19]。另外,补体激活诱导的血栓性炎症在血栓形成中也起着重要作用[20]。AECA刺激血管内皮细胞产生组织因子、血管性假血友病因子,促进血栓形成[21]。综上所述,AECA可能通过多种机制导致滋养血管栓塞、胎盘功能障碍、发育不良,从而引发早期流产。本研究结果显示,AECA阳性患者早期流产风险增加,因此,检测AECA可能有助于评估早期流产高危人群,但具体作用机制以及如何进行临床干预有待进一步研究。
AECA可作为血管损伤和血管炎的生物标志物,临床中主要见于系统性血管炎、系统性红斑狼疮、系统性硬化症、皮肌炎等系统性自身免疫疾病,与狼疮性肾炎和系统性血管炎的疾病活动度密切相关[22]。AECA在自身免疫甲状腺疾病等器官特异性自身免疫性疾病中的作用暂未见报道。
血清IgG升高表明可能存在免疫系统的调节失衡或感染等状态。目前已知自身免疫性IgG抗体,如甲状腺抗体、抗磷脂抗体、抗核抗体等均与早期流产显著相关[23-24]。本研究发现早期流产患者的IgG显著升高,为进一步查找流产原因提供了线索,提示临床诊疗时,应明确升高的IgG的具体成分,并与其他免疫学指标联合检测,以提高预测价值,并为后续干预提供依据。
与本研究结果相似,有研究发现流产的风险随着既往妊娠次数增加而增加,但随着活产次数增加而降低[25]。孕妇年龄较大、有流产史是早期流产的显著危险因素[26]。同时,多次妊娠可能导致子宫结构发生变化,包括子宫内膜的形态改变、厚度变薄和子宫肌层的弹性下降,这些变化可能影响胚胎的着床和发育,从而增加早期流产的风险。
本研究对早期流产的相关因素进行探讨,发现妊娠次数增加、AECA阳性以及IgG升高是导致早期流产的显著危险因素。此外,孕12周时,AECA阳性组的胎儿生存率显著低于AECA阴性组,进一步支持了AECA在早期流产中的不良影响。对少部分研究人群进行了已知的流产相关因素变量检测,如抗甲状腺过氧化物酶抗体,但未纳入到回归分析中,可能对结果产生一定的偏差。
本研究存在一些不足之处:(1)本研究是小样本的回顾性研究,研究对象来自三甲医院,限制了统计效能,应开展多中心大规模的前瞻性研究,进一步验证结果;(2)免疫指标评估并非常规产前检查内容,进行自身抗体检测的研究对象可能本身存在流产的高危因素,因此,造成研究结果存有偏倚,若能建立我国完整的育龄期女性产前筛查及随访数据库,包括免疫指标评估,可更全面地了解早期流产相关因素。
综上所述,在临床实践中,可以考虑通过检测AECA和IgG水平来评估早期流产的风险,从而为高风险患者定制个体化的干预措施,以提高妊娠的成功率。此外,进一步的研究可以探索干预策略,例如调节免疫反应、降低血液凝结风险等,以减少不良孕产结局。
Funding Statement
中华国际医学交流基金会(Z-2018-40-2101)和北京大学人民医院研究与发展基金(RD 2022-66)
Supported by the China International Medical Foundation (Z-2018-40-2101) and Peking University People' s Hospital Scientific Research Development Funds (RD 2022-66)
Contributor Information
张 晓盈 (Xiao-ying ZHANG), Email: zhangxiaoying@pkuph.edu.cn.
贾 汝琳 (Ru-lin JIA), Email: 1036013457@qq.com.
References
- 1.Madendag IC, Sahin ME, Madendag Y, et al. Evaluation of the levels of secretory leukocyte protease inhibitor in the cervical mucus of women with unexplained infertility. J Obstet Gynaecol Res. 2020;46(7):1128–1132. doi: 10.1111/jog.14299. [DOI] [PubMed] [Google Scholar]
- 2.Yang XL, Chen F, Yang XY, et al. Efficacy of low-molecular-weight heparin on the outcomes of in vitro fertilization/intracytoplasmic sperm injection pregnancy in non-thrombophilic women: A meta-analysis. Acta Obstet Gynecol Scand. 2018;97(9):1061–1072. doi: 10.1111/aogs.13359. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Quenby S, Gallos ID, Dhillon-Smith RK, et al. Miscarriage matters: The epidemiological, physical, psychological, and economic costs of early pregnancy loss. Lancet. 2021;397(10285):1658–1667. doi: 10.1016/S0140-6736(21)00682-6. [DOI] [PubMed] [Google Scholar]
- 4.Jiang L, Xu X, Cao Z, et al. Comparison of frozen embryo transfer outcomes between uterine infusion of granulocyte colony-stimulating factor and growth hormone application in patients with thin endometrium: A retrospective study. Front Endocrinol (Lausanne) 2021;12:725202. doi: 10.3389/fendo.2021.725202. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Qu P, Yan M, Zhao D, et al. Association between pre-pregnancy body mass index and miscarriage in an assisted reproductive technology population: A 10-year cohort study. Front Endocrinol (Lausanne) 2021;12:646162. doi: 10.3389/fendo.2021.646162. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Shankarkumar U, Pradhan VD, Patwardhan MM, et al. Autoantibody profile and other immunological parameters in recurrent spontaneous abortion patients. Niger Med J. 2011;52(3):163–166. doi: 10.4103/0300-1652.86126. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Lindqvist KJ, Osterland CK. Human antibodies to vascular endothelium. Clin Exp Immunol. 1971;9(6):753–760. [PMC free article] [PubMed] [Google Scholar]
- 8.Alessandri C, Bombardieri M, Valesini G. Pathogenic mechanisms of anti-endothelial cell antibodies (AECA): Their prevalence and clinical relevance. Adv Clin Chem. 2006;42:297–326. doi: 10.1016/S0065-2423(06)42008-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.杜 欣莹, 管 立学, 王 美, et al. 血清抗内皮细胞抗体定量分析与复发性自然流产相关性研究. 中国优生与遗传杂志. 2009;17(6):23–25. [Google Scholar]
- 10.Cacciola R, Gentilini Cacciola E, Vecchio V, et al. Impact of anti-endothelial cell antibodies (AECAs) in patients with polycythemia vera and thrombosis. Diagnostics (Basel) 2022;12(5):1077. doi: 10.3390/diagnostics12051077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Roussev RG, Stern JJ, Kaider BD. Anti-endothelial cell antibo-dies: Another cause for pregnancy loss? Am J Reprod Immunol. 1998;39(2):89–95. doi: 10.1111/j.1600-0897.1998.tb00340.x. [DOI] [PubMed] [Google Scholar]
- 12.蒋 莎, 李 娜, 张 杨, et al. Toll样受体4通过调节性T细胞引起不明原因复发性流产的机制研究进展. 中华生殖与避孕杂志. 2018;38(10):6. [Google Scholar]
- 13.Zilla P, von Oppell U, Deutsch M. The endothelium: A key to the future. J Card Surg. 1993;8(1):32–60. doi: 10.1111/j.1540-8191.1993.tb00574.x. [DOI] [PubMed] [Google Scholar]
- 14.Youinou P, Le Dantec C, Bendaoud B, et al. Endothelium, a target for immune-mediated assault in connective tissue disease. Autoimmun Rev. 2006;5(3):222–228. doi: 10.1016/j.autrev.2005.06.012. [DOI] [PubMed] [Google Scholar]
- 15.张 梦莹, 李 志, 吕 坤, et al. 系统性红斑狼疮患者血清抗内皮细胞抗体和抗β2糖蛋白Ⅰ抗体水平及其对人脐静脉内皮细胞增殖的影响. 中国临床药理学与治疗学. 2013;18(2):142–146. [Google Scholar]
- 16.Hussain M, Chen P, Zhang Y, et al. Moesin expression is correlated with its involvement in patients with Behcet' s disease. Arch Med Sci. 2020;16(4):924–930. doi: 10.5114/aoms.2020.92911. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Mutoh T, Shirai T, Ishii T, et al. Identification of two major autoantigens negatively regulating endothelial activation in Takayasu arteritis. Nat Commun. 2020;11(1):1253. doi: 10.1038/s41467-020-15088-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Meyer O, Kaiser P, Haim T, et al. Anti-vascular endothelial cell antibodies (AECA): Comparison of two assay methods and clinical applications. Rev Rhum Engl Ed. 1995;62(11):737–747. [PubMed] [Google Scholar]
- 19.Blank M, Krause I, Goldkorn T, et al. Monoclonal anti-endothe-lial cell antibodies from a patient with Takayasu arteritis activate endothelial cells from large vessels. Arthritis Rheum. 1999;42(7):1421–1432. doi: 10.1002/1529-0131(199907)42:7<1421::AID-ANR16>3.0.CO;2-O. [DOI] [PubMed] [Google Scholar]
- 20.Thomas AM, Gerogianni A, McAdam MB, et al. Complement component C5 and TLR molecule CD14 mediate heme-induced thromboinflammation in human blood. J Immunol. 2019;203(6):1571–1578. doi: 10.4049/jimmunol.1900047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Belizna C, Duijvestijn A, Hamidou M, et al. Antiendothelial cell antibodies in vasculitis and connective tissue disease. Ann Rheum Dis. 2006;65(12):1545–1550. doi: 10.1136/ard.2005.035295. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.母 洪洪, 张 湘燕, 张 程. 抗内皮细胞抗体检测临床应用研究进展. 现代医药卫生. 2020;36(30):374–376. [Google Scholar]
- 23.Akhtar MA, Agrawal R, Brown J, et al. Thyroxine replacement for subfertile women with euthyroid autoimmune thyroid disease or subclinical hypothyroidism. Cochrane Database Syst Rev. 2019;6(6):CD011009. doi: 10.1002/14651858.CD011009.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Arachchillage D, Pericleous C. Evolution of antiphospholipid syndrome. Semin Thromb Hemost. 2023;49(3):295–304. doi: 10.1055/s-0042-1760333. [DOI] [PubMed] [Google Scholar]
- 25.Poorolajal J, Cheraghi P, Cheraghi Z, et al. Predictors of miscarriage: A matched case-control study. Epidemiol Health. 2014;36:e2014031. doi: 10.4178/epih/e2014031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Walter K. Early pregnancy loss. JAMA. 2023;329(16):1426. doi: 10.1001/jama.2023.4973. [DOI] [PubMed] [Google Scholar]


