Abstract
目的
构建乳酸乳球菌(Lactococcus lactis, LL)为载体的细粒棘球绦虫(Echinococcus granulosus, Eg)重组LL-Eg95(rLL-Eg95)疫苗,并研究其表达效率。
方法
以pCD-Eg95为模板扩增Eg95基因,采用XbaⅠ和HindⅢ双酶切后插入pMG36e,构建重组质粒pMG36e-Eg95,转化大肠埃希菌BL21(DE3)感受态细胞,抽提质粒进行双酶切鉴定;电穿孔转化乳酸乳球菌MG1363株,构建细粒棘球绦虫重组LL-Eg95疫苗,抽提质粒进行PCR鉴定。
结果
重组质粒用双酶切鉴定可切出预期大小的片段,以具有罗红霉素抗性的重组LL中抽提的质粒为模板进行PCR可扩增出471 bp的Eg95基因;SDS-PAGE显示重组LL可表达相对分子质量为16.5×103的Eg95蛋白,表达蛋白约占菌体总蛋白的17%;免疫印迹表明表达蛋白可被细粒棘球蚴感染的鼠血清识别。
结论
成功构建了细粒棘球绦虫重组LL-Eg95疫苗,表达的Eg95具有特异的抗原性。
Keywords: 乳酸乳球菌, 细粒棘球绦虫, Eg95, 疫苗
Abstract
Objective
To construct Lactococcus lactis (LL)-based recombinant LL-Eg95 (rLL-Eg95) vaccine for Echinococcus granulosus (Eg) and to examine its expression efficiency.
Methods
Eg95 gene was obtained by PCR from the template of pCD-Eg95. Then, pMG36e was inserted in the Eg95 gene after double cleaving with restriction endonucleases XbaⅠ and HindⅢ to construct recombinant plasmid pMG36e-Eg95, which was transformed into E.coli BL2 (DE3) competent cells. The recombinant plasmid was extracted and identified by double restriction endonuclease digestion and was then electroporated into LL MG1363 to construct rLL-Eg95 vaccine. Then, the plamid was extracted and identified by PCR.
Results
Examination of the recombinant plasmid by double restriction endonuclease digestion showed that the segment was of the expected length. PCR showed that 471 base pairs of Eg95 gene were amplified when the plasmid extracted from roxithromycin-resistant recombinant LL was used as the template. Analysis by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) showed that the relative molecular mass of the Eg95 protein expressed was approximately 16.5×103 and that the amount of the expressed protein was 17% of the total bacterial proteins. Western blot findings suggested that the expressed protein could be recognized by mice serum infected with hydatid cyst.
Conclusion
The rLL-Eg95 vaccine was successfully constructed, expressing Eg95 protein that has specific antigenicity.
Keywords: Lactococcus lactis, Echinococcus granulosus, Eg95, Vaccine
细粒棘球绦虫(Echinococcus granulosus, Eg)的续绦期幼虫,俗称细粒棘球蚴(hydatid cyst),可在寄生的中间宿主或转续宿主体内导致囊型棘球蚴病(cystic echinococcosis, CE),又称细粒棘球蚴病(echinococcosis granulosus)或囊型包虫病(cystic hydatid disease),这是一种国家卫健委重点防治的寄生虫病。对于已发CE病例的首选治疗方法仍是外科手术,早期小棘球蚴或难做手术的病例可采用化疗药物或中药进行治疗,但存在一定的毒副作用,可能需要探索新的治疗途径[1]。现有研究证实将Eg95的重组蛋白或DNA疫苗接种小鼠,Eg原头节攻击后可产生一定的保护力,表明它是有效的疫苗候选分子[2-3]。
已有研究[4]表明病毒载体介导的Eg疫苗包括牛痘病毒疫苗(rMVA-Eg95)、羊口疮病毒疫苗(rORFV-Eg95)、山羊痘病毒疫苗(rGPV-Eg95)和狂犬病毒疫苗(rRABV-Eg95)等,细菌载体介导Eg疫苗包括鼠伤寒沙门氏菌疫苗(rSt-Eg95/Eg95-Ferr)、卡介苗疫苗(rBCG-Eg95)、根癌农杆菌疫苗(rAt-Eg95-EgA31)和两歧双歧杆菌菌苗(rBb-Eg95-EgA31)等。病毒载体的自身蛋白及其双链RNA具有免疫佐剂效应,但人群普遍具有抗病毒抗体影响其免疫效果;重组沙门氏菌苗的表达产物与天然蛋白存在差异,表达水平较低;重组BCG疫苗表达外源基因需特殊载体等;转基因植物疫苗很少被公众认可和接受;重组Bb疫苗长期低剂量口服有可能产生免疫耐受现象。因此,还需要研制新型载体疫苗。乳酸乳球菌(Lactococcus lactis, LL)具有加速食品酸化、增加食物营养及改善食物品质等作用,将LL作为疫苗载体具有操作简便、转化效率高和重复性好等优点[5]。本研究在早期制备的重组质粒pCD-Eg95基础上[6],将该质粒采用电转染技术转化LL,制备重组LL-Eg95疫苗,这将为CE的免疫预防提供新途径。
1. 材料与方法
1.1. 材料
1.1.1. 菌株和质粒
遵义医科大学周必英教授提供乳酸乳球菌MG1363株和BL21(pMG36e)菌株,本所构建和保存了BL21(pCD-Eg95)重组菌株。
1.1.2. 主要试剂
上海生工提供高效感受态细胞制备试剂盒、质粒提取试剂盒、高保真即用PCR扩增试剂盒、N, N-亚甲基双丙烯酰胺、丙烯酰胺、联苯二胺和考马斯亮蓝;Fermentas公司提供DNA marker;北京鼎国兴盛生物技术公司提供蛋白marker;北京鼎今生物科技公司提供辣根过氧化物酶(HRP)标记的羊抗鼠抗体;本所自制细粒棘球蚴感染的鼠血清、LB培养基和MRS培养基。
1.2. 方法
1.2.1. 引物设计与合成
根据GenBank上登录的细粒棘球绦虫Eg95的cDNA序列及pMG36e载体的特点自行设计1对引物,P1为Eg95上游引物,引物序列为:5'-GCTCTAGAATGGCATTCCAGTTATGTCTC-3',P2为Eg95下游引物,引物序列为5'-GCAAGCTTTCACATTACAGTGCTTTCCTTCTTGC-3';在上、下游引物的5′端分别引入XbaⅠ和HindⅢ酶切位点(下划线部分)和2个保护性碱基(GC)。引物委托上海生工公司制备。
1.2.2. Eg95抗原基因的扩增
1.2.2.1. pCD-Eg95质粒的扩增
将保存的BL21(pCD-Eg95)重组菌用接种环挑取后,划线接种至含50 μg/mL氨苄青霉素的LB固体培养基,在CO2培养箱培养48~72 h;用接种环挑选上述筛选培养基上的单个菌落,加入含50 μg/mL氨苄青霉素的LB培养液中,用细菌振荡器在37 ℃和200 r/min转速下培养48~72 h后,通过质粒抽提试剂盒抽提目标质粒。
1.2.2.2. Eg95抗原基因的PCR扩增及鉴定
以质粒pCD-Eg95为模板,PCR扩增Eg95抗原基因。扩增体系如下:PCR master 25 μL,P1、P2引物各2 μL,重组质粒模板2 μL,去离子水19 μL加入PCR反应管中,再加入25μL石蜡油进行密封;扩增条件如下:在94 ℃进行预变性2 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,共进行30个循环,最后在72 ℃进行延伸10 min;吸取3 μL PCR产物,通过12 g/L琼脂糖凝胶电泳进行鉴定。
1.2.3. pMG36e载体的提取
将保存的BL21(pMG36e)菌株用接种环挑取后,划线接种至含5 μg/mL罗红霉素的LB固体培养基上,37 ℃孵育48~72 h;挑选单个菌落至含5 μg/mL罗红霉素的LB培养液中,37 ℃ 250 r/min振摇培养48~72 h,按照UNIQ-10柱式质粒小量抽提试剂盒的说明书抽提质粒pMG36e。
1.2.4. 重组质粒pMG36e-Eg95的构建及鉴定
1.2.4.1. 目的基因和载体的酶切
Eg95的PCR产物和载体pMG36e分别用XbaⅠ和HindⅢ进行双酶切。酶切体系各60 μL:9.4 μL灭菌去离子水,6 μL 10×Tango Buffer,42 μL PCR产物或载体,1.3 μL XbaⅠ,1.3 μL HindⅢ。在离心转速5000 r/min条件下离心15 s,置37 ℃水浴2 h。
1.2.4.2. 酶切产物的纯化
按照UNIQ-l0柱式PCR产物纯化试剂盒的说明书进行操作。
1.2.4.3. 连接
按照酶切后载体与目的基因约1∶5的摩尔比及T4 DNA连接酶的说明建立20 μL连接体系:加入4 μL目的基因、12 μL载体大片段、2 μL 10×T4 Buffer、2 μL T4 DNA连接酶。在离心转速5000 r/min条件下离心15 s,4 ℃过夜后置70 ℃ 10 min灭活T4 DNA连接酶。
1.2.4.4. 连接产物转化BL21感受态细菌
将连接产物转化BL21感受态细菌,用细菌振荡器在37 ℃和1500 r/min转速下培养1 h,随即接种在含5 μg/mL罗红霉素的LB固体培养基上,37 ℃孵育48~72 h。
1.2.4.5. 重组质粒pMG36e-Eg95的酶切鉴定
挑取上述筛选培养基上单个菌落至含5 μg/mL罗红霉素的LB培养液中,用细菌振荡器在37 ℃和200 r/min转速下培养48~72 h后,用质粒抽提试剂盒提取重组质粒pMG36e-Eg95。然后用1.2.4.1中的酶切体系进行XbaⅠ和HindⅢ双酶切鉴定。
1.2.5. 乳酸乳球菌MG1363株感受态的制备
将保存的乳酸乳球菌MG1363株用接种环挑取后,划线接种在MRS固体培养基上,37 ℃孵育48~72 h;挑选单个菌落加至100 mL MRS液体培养基(含0.5 mol/L蔗糖)中,37 ℃厌氧培养24~72 h,冰浴2.5 h。4 ℃在离心转速5000 r/min条件下离心10 min,弃上清;加入50 mL预冷的10%甘油,4 ℃在离心转速3000 r/min条件下离心10 min,弃上清;加入25 mL预冷的10%甘油,4 ℃在离心转速2000 r/min条件下离心10 min,弃上清;加入10 mL预冷的10%甘油,4 ℃在离心转速1500 r/min条件下离心10 min,弃上清;加入1.5 mL预冷的10%甘油,混匀,此细菌可用于电转化。
1.2.6. rLL-Eg95疫苗的构建与鉴定
将直径1 cm的电穿孔杯冰浴10 min,加入20 μL重组质粒pMG36e-Eg95和80 μL乳酸乳球菌MG1363株感受态,混匀后静置10 min,放入电穿孔仪的槽中,设置电压0.5~2.5 kV,时间常数5 ms和转化次数1~10次进行摸索;电击后在电穿孔杯加入1 mL MRS培养基,用细菌振荡器在37 ℃和150 r/min转速下培养2 h,用接种环挑取菌液,划线接种至含5 μg/mL罗红霉素的平板上,在CO2培养箱培养48~72 h;用接种环挑选单个菌落,加入MRS培养基(含0.5 mol/L蔗糖和5 μg/mL罗红霉素)进行增菌培养48~72 h,用质粒抽提试剂盒提取目标载体,以提取的质粒为模板采用PCR进行鉴定;PCR扩增体系和反应条件同1.2.2.2。
1.2.7. rLL-Eg95疫苗的表达与鉴定
1.2.7.1. rLL-Eg95疫苗的表达
用接种环挑取经过鉴定的重组rLL菌,将其接种至MRS选择培养基(含0.5 mol/L蔗糖和5 μg/mL罗红霉素),用细菌振荡器在37 ℃和200 r/min转速下进行振荡培养,分别于培养后1、2、3、4和5 d收集1 mL菌液,在离心转速5000 r/min条件下离心2 min,采集菌体沉淀。将菌体沉淀进行煮沸裂解,将全菌体进行100 g/L的SDS-PAGE电泳,凝胶通过凝胶成像仪进行扫描和分析。
1.2.7.2. rLL-Eg95疫苗的免疫印迹
将rLL-Eg95疫苗和空载体LL(pMG36e)疫苗分别进行SDS-PAGE电泳,然后,通过半干法将凝胶蛋白转移至硝酸纤维膜,在150 mA恒流条件下转膜2 h。转膜后封闭2 h,磷酸盐缓冲液洗涤3次;加入1∶100稀释的细粒棘球蚴感染的鼠血清100 μL孵育2 h,磷酸盐缓冲液洗涤3次;再加入1∶1000稀释的HRP标记的羊抗鼠IgG抗体100 μL孵育2 h,磷酸盐缓冲液洗涤3次;用底物联苯二胺进行显色,然后成像。
2. 结果
2.1. 重组质粒pMG36e-Eg95的双酶切鉴定
重组质粒与空载体分别进行双酶切后,酶切产物采用12 g/L琼脂糖电泳进行检测(图1),重组质粒出现大小约3600 bp的载体条带和471 bp的Eg95基因条带,而空载体无471 bp的条带。
图 1.
Double restriction endonuclease identification of pMG36e-Eg95
重组质粒pMG36e-Eg95的双酶切鉴定
M: DNA marker; 1 and 2: pMG36e vector; 3 and 4: endonuclease products of pMG36e-Eg95.
2.2. rLL-Eg95疫苗的PCR鉴定
将抽提的目标质粒作为底物进行PCR克隆,琼脂糖凝胶电泳图像见图2,克隆出大小约471 bp的目的基因片段,与Eg95基因相符。
图 2.
PCR identification of the rLL-Eg95 vaccine
rLL-Eg95疫苗的PCR鉴定
M: DNA marker; 1-6: PCR products of pMG36e-Eg95.
2.3. rLL-Eg95疫苗的SDS-PAGE分析
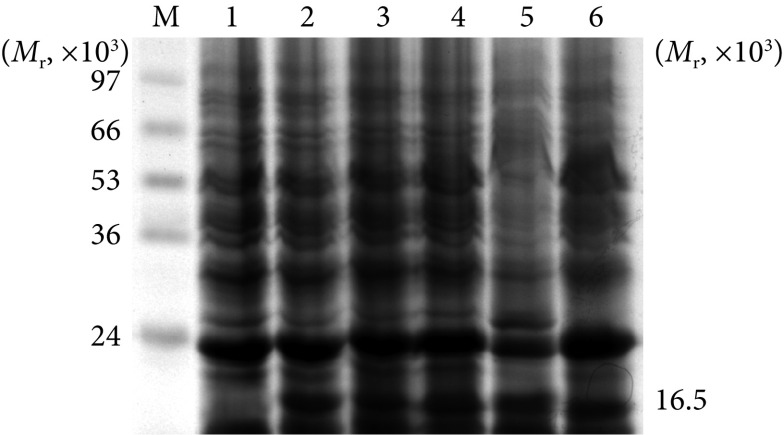
rLL-Eg95疫苗培养0~5 d后,SDS-PAGE检测表达产物,结果如图3,出现相对分子质量为16.5×103的蛋白条带,培养2~3 d时表达量较高,表达蛋白约占菌体总蛋白的17%,未培养的重组LL未见目的蛋白的表达。
图 3.
SDS-PAGE analysis of the Eg95 protein expressed in the rLL-Eg95 vaccine
rLL-Eg95疫苗表达产物的SDS-PAGE分析
M: protein marker; 1: rLL-Eg95 with no culturing; 2-6: rLL-Eg95 after culturing for 1, 2, 3, 4 and 5 d, respectively.
2.4. rLL-Eg95疫苗的免疫印迹鉴定
如图4所示,细粒棘球蚴感染的鼠血清可特异性结合重组LL菌呈现的目的蛋白,目的蛋白的条带位于相对分子质量为16.5×103处,空质粒对照组未见目的蛋白的条带。
图 4.
Western blot of the Eg95 protein expressed in the rLL-Eg95 vaccine
rLL-Eg95疫苗表达产物的免疫印迹鉴定
M: proein marker; 1: control; 2: Eg95 protein.
3. 讨论
早期研究[4]提示Eg95分子是一种相对分子质量为24.5×103的天然六钩蚴抗原。其编码基因全长为715 bp,其中462 bp基因可编码相对分子质量为16.5×103的含153个氨基酸的蛋白质。本课题组[7-10]先后以BCG、根癌农杆菌(Agrobacterium tumefaciens, At)、两歧双歧杆菌(Bifidobacteria bifidum, Bb)和粪肠球菌(Enterococcus faecalis, Efs)为载体构建了rBCG-Eg95疫苗、转Eg95-EgA31融合基因苜蓿、rBb-Eg95-EgA31疫苗和rEfs-Eg95-EgA31疫苗,实验结果表明上述载体疫苗可产生有效的免疫应答,从而对抗Eg原头节的攻击感染,但只能诱导宿主产生部分保护力,因此,还需要开发新的疫苗载体,把Eg疫苗的研究推向一个新的高度。
为了将外源DNA有效引入乳酸乳球菌,需构建大肠埃希菌-乳球菌穿梭表达载体。这类载体常分为组成型和诱导型,其中pMG36e和pNZ8148是其中的模式载体[11]。本研究选择pMG36e表达质粒,是因为该质粒选择p32启动子作为RNA聚合酶结合的区域,在该启动子的作用下,Eg95基因的表达大体恒定在一定水平上,在不同组织部位表达水平大致相似,使用罗红霉素作为标记容易筛选。已有研究表明pMG36e质粒大小为3.6 kb,通常含有p32启动子及其下游部分的开放阅读框、来自pUC18的多克隆位点、来自乳酸乳球菌乳脂亚种蛋白酶(PrtP)基因的转录终止子、pWV01的复制子和源自pE194质粒的罗红霉素抗性基因(EmR)等。
乳酸乳球菌NCD0712株经过紫外线照射可得到MG1363株,本研究即采用该菌株。乳酸乳球菌的细胞壁厚而且复杂,摄取外源DNA较为困难,采用电穿孔(electroporation, EP)技术进行转染具有作用机制相对明确和转化效率高等优点[12],EP利用高于某一阈值的外加电脉冲刺激细胞膜,导致细胞的膜磷脂双分子结构发生重排,形成瞬时性空洞,从而使外源性大分子通过空洞进入细胞。不同乳酸乳球菌的菌株具有不同的电转染条件,需要进行优化。脉冲场电压、电容、脉冲时间、脉冲次数、细胞生长期以及细胞密度、细菌培养温度、细胞电击前后冰浴时间、质粒大小、浓度、构象和纯度、电穿孔缓冲液和电穿孔后培养液等因素影响EP的转化效率。本研究将对数生长期的细菌制成感受态,采用1.6 kV/cm的电压和2次脉冲即可获得较高的转染效率,转化效率可达104~108/μg的DNA。
近期报道以LL为载体的疫苗[13-19]有:表达猪带绦虫(Taenia Solium)TSOL18蛋白的重组LL-TSOL18疫苗、表达柔嫩艾美耳球虫(Eimeria tenella)3-1E蛋白的重组LL-3-1E-CWA疫苗、表达硕大利什曼原虫(Leishmania major)PPsp15的重组LL-PPsp15疫苗、表达羊种布鲁氏菌(Brucella melitensis)OMP31蛋白的重组LL-OMP31疫苗、表达流产布鲁氏菌(Brucella abortus)BLS蛋白的重组LL-BLS疫苗、表达1型鸭乙肝病毒VP1蛋白的重组LL-VP1疫苗以及表达禽腺病毒4型六邻体蛋白的重组LL-hexon疫苗。它们的接种剂量为5×108 CFU或2×109 CFU,接种次数为1次、3次或连续多次,接种途径有口服灌胃或皮下注射等,结果发现疫苗多次口服或皮下注射BALB/c鼠能诱导混合型的Th1和Th2应答,可部分对抗柔嫩艾美耳球虫卵囊的口服攻击、硕大利什曼原虫前鞭毛体的皮下注射攻击、流产布鲁氏菌的腹腔注射攻击、1型鸭乙肝病毒的眼鼻感染攻击或禽腺病毒4型的皮下注射攻击,但均未诱导完全的保护力。已知LL是一种常见的口服益生菌,以LL为载体的疫苗也应该采取口服接种为最佳选择,但现有的保护力结果尚不尽如人意,因此需要探索疫苗口服接种的剂量、次数、每次接种后的间隔时间以及可否加入佐剂等,也需要摸索病原体的攻击途径、次数和能否对抗病原体的连续或联合攻击,进一步阐明疫苗诱导的免疫应答机制,这对于开拓这类疫苗的应用市场具有一定意义。
本实验将抽提的pMG36e-Eg95质粒采用电转染技术转化LL感受态,筛选和诱导培养后从重组LL抽提目标质粒,将其作为底物通过PCR可克隆出471 bp的Eg95基因,表明重组LL疫苗已初步制备,这为下一步的疫苗实验提供了新材料。本研究经SDS-PAGE显示rLL-Eg95疫苗培养2~3 d后可表达相对分子质量为16.5×103的Eg95蛋白;借助薄层扫描显现重组菌的表达效率达到17%;免疫印迹提示细粒棘球蚴感染的鼠血清可特异识别rLL表达的Eg95蛋白,提示rLL表达的目的蛋白能够正确折叠,具有特异的抗原性,这为下一步rLL疫苗的保护力研究奠定了基础。
* * *
作者贡献声明 李文桂负责论文构思、经费获取、提供资源、调查研究、监督指导、验证、可视化和初稿写作,欧兴坤和何爱琳负责研究方法、数据审编和正式分析。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿,并同意对工作的所有方面负责。
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 30801052、No. 30671835、No. 30500423、No. 30200239)资助
References
- 1.WEN H, VUITTON L, TUXUN T, et al Echinococcosis: advances in the 21 century. Clin Microbiol Rev. 2019;32(2):e00075–18. doi: 10.1128/CMR.00075-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.林仁勇, 丁剑冰, 卢晓梅, 等 细粒棘球绦虫Eg95抗原基因疫苗体外瞬时表达及对小鼠诱导的免疫应答. 中国寄生虫学与寄生虫病杂志. 2004;24(4):204–208. doi: 10.3969/j.issn.1000-7423.2004.04.003. [DOI] [PubMed] [Google Scholar]
- 3.丁剑冰, 魏晓丽, 马秀敏, 等 细粒棘球绦虫Eg95重组蛋白诱导小鼠免疫应答的研究. 新疆医科大学学报. 2005;28(4):305–307. doi: 10.3969/j.issn.1009-5551.2005.04.006. [DOI] [Google Scholar]
- 4.李文桂, 陈雅棠 载体介导的细粒棘球绦虫Eg95疫苗的研制现状. 中华地方病学杂志. 2023;42(8):684–688. doi: 10.3760/cma.j.cn231583-20220226-00046. [DOI] [Google Scholar]
- 5.刘乃芝, 亓秀晔, 郭杨丽, 等 基因工程重组乳酸菌防控动物疫病的研究进展. 中国畜牧兽医. 2020;47(4):1199–1208. doi: 10.16431/j.cnki.1671-7236.2020.04.026. [DOI] [Google Scholar]
- 6.周辉, 李文桂 细粒棘球绦虫重组pCD-Eg95质粒构建及鉴定. 重庆医科大学学报. 2009;34(1):13–15. doi: 10.13406/j.cnki.cyxb.2009.01.003. [DOI] [Google Scholar]
- 7.李文桂, 朱佑明 细粒棘球绦虫重组BCG-Eg95疫苗诱导的保护力观察. 免疫学杂志. 2007;23(4):383–385. doi: 10.3969/j.issn.1000-8861.2007.04.009. [DOI] [Google Scholar]
- 8.周必英, 陈雅棠, 李文桂, 等 细粒棘球绦虫重组Bb-Eg95-EgA31融和基因疫苗构建及鉴定. 中国人兽共患病学报. 2009;25(6):502–506. doi: 10.3969/j.issn.1002-2694.2009.06.002. [DOI] [Google Scholar]
- 9.叶艳菊, 李文桂 细粒棘球绦虫转Eg95-EgA31融合基因苜蓿疫苗诱导小鼠免疫应答的研究. 细胞与分子免疫学杂志. 2010;26(8):750–753. doi: 10.13423/j.cnki.cjcmi.005768. [DOI] [PubMed] [Google Scholar]
- 10.李文桂, 欧兴坤, 何爱琳 粪肠球菌介导的细粒棘球绦虫重组Efs-Eg95-EgA31疫苗的构建、鉴定及表达. 中国病原生物学杂志. 2022;17(9):1025–1029. [Google Scholar]
- 11.高莹, 李淼, 孙元, 等 乳酸乳球菌表达系统的发展现状与前景展望. 微生物学报. 2022;62(3):895–905. doi: 10.13343/j.cnki.wsxb.20210341. [DOI] [Google Scholar]
- 12.NIKYAR A, BOLHASSAN A Electroporation: an effective method for in vivo gene delivery. Drug Delivery Lett. 2022;12(1):35–45. doi: 10.2174/2210303112666220127113328. [DOI] [Google Scholar]
- 13.ZHOU B Y, SUN J C, LI X, et al Analysis of immune responses in mice orally immunized with recombinant pMG36e-SP-TSO18/Lactococcus lactis and pMG36e-TSO18/Lactococcus lactis vaccines of Taenia solium. J Immunol Res. 2018;2018:9262631. doi: 10.1155/2018/9262631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.LI G H, MA C L, WANG D, et al Recombinant Lactococcus lactis co-expressing dendritic cell target peptide and Etenella 3-1E protein: immune response and efficacy against homologous challenge. Food Agri Immunol. 2020;31(1):379–392. doi: 10.1080/09540105.2020.1733495. [DOI] [Google Scholar]
- 15.DAVARPANAH E, SEYED N, BAHRAMI F, et al Lactococcus lactis expressing sandfly PPsp15 salivary protein confers long-term protection against Leishmania major in BALB/c mice. PLoS Negl Trop Dis. 2020;14(1):e0007939. doi: 10.1371/journal.pntd.0007939. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.SHIRDAST H, EBRAHIMZADEH F, TAROMCHI A H, et al Recombinant Lactococcus lactis displaying OMP31 antigen of Brucella melitensis can induce an immunogenic response in BALB/c mice. Probiotics Antimicrob Prot. 2020;13(1):80–89. doi: 10.1007/s12602-020-09684-1. [DOI] [PubMed] [Google Scholar]
- 17.FATEHI Z, DOOSTI A, JAMI M S, et al Oral vaccination with novel Lactococcus lactis mucosal live vector-secreting brucella lumazine synthase (BLS) protein induces humoral and cellular immune protection against Brucella abortus. Arch Microbiol. 2023;205(4):122. doi: 10.1007/s00203-023-03471-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.ZHANG X T, ZHANG R H, WANG J Y, et al Construction of recombinant Lactococcus lactis strain expressing VP1 fusion protein of Duck hepatitis A virus type 1 and evaluation of its immune effect. Vaccines. 2021;9(12):1479. doi: 10.3390/vaccines9121479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.JIA Z P, MA C L, YANG X L, et al Oral immunization of recombinant Lactococcus lactis and Enterococcus faecalis expressing dendritic cell targeting peptide and hexon protein of Fowl adenovirus 4 induces protective immunity against homologous infection. Front Vet Sci. 2021;8:632218. doi: 10.3389/fvets.2021.632218. [DOI] [PMC free article] [PubMed] [Google Scholar]