Abstract
目的
评估组蛋白去乙酰化酶6(histone deacetylase 6, HDAC6)在糖尿病肾病小鼠足细胞损伤中的作用。
方法
①选用8周龄雄性CD-1小鼠,链脲佐菌素(streptozocin, STZ)诱导糖尿病肾病模型,成模后分为4组:对照+溶剂组(CTL+Veh, n=5),对照+CAY10603组(CTL+CAY10603, n=3),糖尿病肾病+溶剂组(STZ+Veh, n=9),糖尿病肾病+CAY10603组(STZ+CAY10603, n=7)。CTL+Veh组和CTL+CAY10603组小鼠不造模,STZ+Veh组和STZ+CAY10603组造糖尿病肾病模型,4组均每天1次腹腔注射溶剂或5 mg/kg的HDAC6特异性抑制剂CAY10603,持续2周。CAY10603治疗2周后,主要通过尿蛋白/肌酐比值和肾脏病理评估其疗效。②培养体外人足细胞,细胞分为4组:对照组,转化生长因子β(transforming growh factor-β, TGFβ)组, TGFβ+CAY10603(250 nmol/L)组,TGFβ+CAY10603(500 nmol/L)组。对照组不加药,后3组给予5 ng/µL TGFβ刺激足细胞36 h,后2组再加入不同剂量的CAY10603继续刺激12 h。通过蛋白免疫印迹,主要检测CAY10603对NLRP3炎症小体的抑制作用。③建立HDAC6基因敲除小鼠,STZ诱导糖尿病肾病模型,小鼠分为4组:C57BL/6J野生型组(WT, n=6),HDAC6基因敲除组(HDAC6 KO, n=6),野生型小鼠糖尿病肾病组(WT+STZ, n=10),HDAC6基因敲除小鼠糖尿病肾病组(HDAC6 KO+STZ, n=9)。造模成功16周后取材,主要评估尿蛋白/肌酐比值和肾脏病理变化。
结果
经过2周治疗,与STZ+Veh组相比,STZ+CAY10603组小鼠尿蛋白/肌酐比值降低(P<0.05),有效改善肾小球系膜增宽(P<0.05)。CTL+Veh组和CTL+CAY10603组各项指标差异无统计学意义。在体外足细胞中,与对照组相比,TGFβ组出现NLRP3炎症小体活化,CAY10603治疗可抑制NLRP3炎症小体活化,以高剂量组表现明显(P<0.05)。与WT组比较,WT+STZ组尿蛋白/肌酐比值增高(P<0.05),表现出显著的肾小球硬化,足细胞数量丢失。与WT+STZ组相比,HDAC6 KO+STZ组有效降低了小鼠的尿蛋白/肌酐比值(P<0.05),改善了肾脏病理变化。WT组和HDAC6 KO组上述差异则无统计学意义。
结论
抑制HDAC6可通过阻止NLRP3炎症小体活化缓解糖尿病肾病小鼠蛋白尿和足细胞损伤。
Keywords: 糖尿病肾病, 足细胞, HDAC6, NLRP3炎症小体
Abstract
Objective
To investigate the role of histone deacetylase 6 (HDAC6) in podocyte injury in diabetic kidney disease (DKD) in mice.
Methods
1) The 8-week-old male CD-1 mice were selected to construct the model of DKD with streptozocin (STZ). After the model was established, the mice were intraperitoneally injected with HDAC6 inhibitor CAY10603 (5mg/kg/daily) or same volume vehicle as control. The mice were divided into four groups, control (CTL)+vehicle (Veh) (n=5), CLT+CAY10603 (n=3), STZ+Veh (n=9), and STZ+CAY10603 (n=7). Mice in STZ+Veh and STZ+CAY10603 groups developed DKD, while mice in the CTL+Veh and CTL+CAY10603 groups were served as normal controls. The therapeutic effect was evaluated through urine albumin-to-creatinine ratio (uACR) and renal pathology after the 2-week treatment with CAY10603. 2) Human podocytes were cultured in vitro and were divided into four groups as follows: CTL, transforming growth factor-β (TGFβ), TGFβ+CAY10603 (250 nmol/L), and TGFβ+CAY10603 (500 nmol/L) groups. The control group did not receive any treatment, the last three groups were given 36-h TGFβ treatment at 5 ng/µL, with or without CAY10603 as indicated for an additional 12 h. Western blot was performed to determine the inhibitory effect of CAY10603 on NLRP3 inflammasome. 3) HDAC6 knockout (KO) mice were generated and used to create STZ-induced model of DKD. The mice were divided into four groups: C57BL/6J wild type (WT) (n=6), HDAC6 KO (n=6), WT+STZ (n=10), and HDAC6 KO+STZ (n=9). Samples were collected 16 weeks after successful modeling and changes in uACR and renal pathology were evaluated accordingly.
Results
After 2 weeks of treatment, mice in the STZ+CAY10603 group exhibited reduction in uACR (P<0.05) and inhibition of glomerular mesangium expansion (P<0.05) compared with those of the mice in the STZ+Veh group. There was no statistically significant difference in the indicators between the CTL+Veh group and the CTL+CAY10603 group. In vitro cultured podocytes, compared with the control group, NLRP3 inflammasome activation was seen in the TGFβ group. CAY10603 treatment significantly inhibited the activation of NLRP3 in the dosage-dependent manner (P<0.05). Compared with those of the WT group, the WT+STZ group showed increased uACR (P<0.05), obvious glomerulosclerosis and loss of podocytes numbers. Compared with those of the WT+STZ group, the HDAC6 KO+STZ group showed effectively reduction of uACR (P<0.05) and improvement in the renal pathological changes in mice. There was no significant difference in these aspects between the WT and HDAC6 KO groups.
Conclusion
Inhibition of HDAC6 alleviates proteinuria and podocyte injury in the mouse model of DKD by suppressing the activation of NLRP3 inflammasome.
Keywords: Diabetic kidney disease, Podocytes, Histone deacetylase 6, NLRP3 inflammasome
组蛋白去乙酰化酶(histone deacetylases, HDACs)的活性与足细胞损伤密切相关[1]。 HDAC1和HDAC2通过调节早期生长应答因子(early growth response 1, EGR1)的活性促进足细胞损伤和蛋白尿的发生[2];HDAC4抑制足细胞自噬活性导致足细胞损伤[3];HDAC9通过JAK2/STAT3通路调节足细胞氧化应激、凋亡和验证[4];因此,HDAC抑制剂被用于治疗足细胞损伤和蛋白尿,如Valproic acid (HDAC Ⅰ类抑制剂)[5]、MC1568(HDAC Ⅱa类抑制剂)[6]、SAHA(广谱HDAC抑制剂)[2]和Tubastatin A(HDAC6抑制剂)[7]等HDAC抑制剂均可有效缓解小鼠模型蛋白尿和足细胞损伤。
HDAC6具有1215个氨基酸,是HDAC家族中最为特殊的成员,因其有两个在功能上相互独立的HDAC催化结构域,HDAC6可靶向多种底物,如α-Tubulin、Tau蛋白、皮质蛋白、热休克蛋白和过氧化物酶;HDAC6还具有一个泛素结合域,可用于结合泛素蛋白酶体,清除错误折叠的蛋白;HDAC6是聚集体重要的成员[8]。
HDAC6在糖尿病肾病的肾小球足细胞和肾小管细胞上的表达均显著高于正常[9]。本课题组在既往研究中利用糖尿病肾病患者肾小管间质转录组表达谱结合Connectivity Map(CMap)数据库筛选,并结合动物实验证实HDAC6特异性抑制剂CAY10603通过抑制肾小管和巨噬细胞NLRP3炎症小体活化,有效延缓糖尿病肾病小鼠肾小管损伤和间质纤维化[9]。但HDAC6在糖尿病肾病足细胞损伤中的作用尚不明确。本研究拟评估抑制HDAC6对糖尿病肾病小鼠足细胞损伤的保护作用,进而探讨HDAC6对足细胞NLRP3炎症小体活化的影响。
1. 材料与方法
1.1. 主要抗体与试剂
链脲佐菌素(streptozotocin, STZ)(Sigma公司,S0130),CAY10603(MCE公司,HY-18613),WT1抗体(Abcam公司,ab89901),Synaptopodin抗体(Genetex公司,GTX39067),α-SMA抗体(Proteintech公司,14395),HDAC6抗体(Cell Signaling Technology公司,7558),NLRP3抗体(Cell Signaling Technology公司,13158),Caspase-1抗体(Proteintech公司,22915-1-AP),COL1A1抗体(Cell Signaling Technology公司,72026),α-Tubulin抗体(Proteintech公司,11224-1-AP)。
1.2. 人足细胞培养
33 ℃、体积分数5%CO2恒温培养箱用于人足细胞(英国布里斯托大学Saleem教授惠赠)增殖,增殖至80%~90%时进行细胞传代,置于37 ℃、体积分数5%CO2恒温培养箱,分化7~14 d用于实验。
1.3. 糖尿病肾病小鼠造模方法分组干预
HDAC6基因敲除小鼠(HDAC6 KO)购于上海南模生物,品系全名C57BL/6Smoc-HDAC6em1Somc,目录号 NMOL/L-KO-18009。选取8~10周龄雄性C57BL/6J野生型(WT)、HDAC6 KO和CD-1小鼠(北京维通利华实验动物技术有限公司),注射STZ前一天晚上禁食12 h,第二天早上腹腔注射150 mg/kg STZ。仅注射1次STZ,等待1周后测定血糖,血糖不低于11.1 mmol/L为糖尿病肾病小鼠造模成功,低于11.1 mmol/L则补注射50 mg/kg STZ,注射1周后重新测定血糖,血糖低于11.1 mmol/L的小鼠则被剔除出组。
1.4. 小鼠分组干预
本课题组前期结果[9]发现,相比于1 mg/kg和2 mg/kg CAY10603的治疗剂量,5 mg/kg CAY10603表现出更佳的治疗效果,并且对正常小鼠血清乳酸脱氢酶无任何影响。本研究取5 mg/kg CAY10603用于腹腔注射小鼠。腹腔注射相同体积的溶剂(5%DMSO+50%PEG300+45%ddH2O)作为对照。选用8周龄雄性CD-1小鼠,STZ诱导构建糖尿病肾病模型,小鼠分为4组:①对照+溶剂组(CTL+Veh, n=5);②对照+CAY10603组(CTL+CAY10603, n=3);③糖尿病肾病+溶剂组(STZ+Veh, n=9);④糖尿病肾病+CAY10603组(STZ+CAY10603, n=7)。STZ+Veh组和STZ+CAY10603组待小鼠成模后2周,每天1次腹腔注射溶剂或5 mg/kg的CAY10603,持续2周。CTL+Veh组和CTL+CAY10603组小鼠不造模,每天1次腹腔注射溶剂或5 mg/kg的CAY10603,持续2周。CAY10603治疗2周后,将小鼠麻醉处死,收集外周血离心后分离血清,使用Creatinine Assay Kit(BioAssay Systems, DICT-500)检测血肌酐,使用Urea Assay Kit(BioAssay Systems, DIUA-100)检测血尿素氮;收集尿液检测尿白蛋白/肌酐比值;收集肾脏用于肾脏组织病理染色(PAS染色、免疫组化染色和免疫荧光染色)。主要观察指标为尿蛋白/肌酐比值和肾脏病理。
为了进一步观察HDAC6基因敲除对于糖尿病肾病足细胞损伤的作用,我们选用HDAC6基因敲除小鼠,并通过腹腔注射STZ诱导糖尿病肾病。小鼠共分为4组:C57BL/6J野生型组(WT, n=6),HDAC6基因敲除组(HDAC6 KO, n=6),C57BL野生型小鼠糖尿病肾病组(WT+STZ, n=10),HDAC6基因敲除小鼠糖尿病肾病组(HDAC6 KO+STZ, n=9)。造模成功后,于第5、7、9、11、13、15周监测血糖,第16周处死小鼠,收集尿液检测尿白蛋白/肌酐比值;收集肾脏用于肾脏组织病理染色(PAS染色、免疫组化染色和免疫荧光染色)。主要观察指标为尿蛋白/肌酐比值和肾脏病理变化。
1.5. 小鼠尿白蛋白和尿肌酐测定
取1 μL尿液稀释500倍测定尿白蛋白含量Albumin ELISA Kit (Genetex, GTX37052),取5 μL尿液测定尿肌酐含量(Creatinine Assay Kit, BioAssay Systems, DICT-500),根据测定的结果计算尿白蛋白/肌酐比值。
1.6. 小鼠肾脏组织PAS染色、免疫组化染色和免疫荧光染色
体积分数4%多聚甲醛固定的肾脏,石蜡包埋后2.5 μm连续切片,80 ℃烤片4 h,脱蜡。
PAS染色:蒸馏水冲洗后,用过碘酸溶液氧化10 min,再用蒸馏水清洗3遍,每次5 min,入Schiff试剂染色完成并冲洗后,入苏木素溶液染核,蒸馏水冲洗吹干之后,二甲苯封片。
免疫组化染色和免疫荧光染色:抗原修复之后,室温封闭30 min,加入稀释好的NLRP3抗体(1∶100稀释)于4 ℃过夜;第二天,PBST清洗5遍。对于免疫组化染色,加入组化染色试剂盒中通用二抗,室温孵育2 h,DAB显色之后,吹干,二甲苯封片。对于免疫荧光染色,加入稀释后的WT1抗体(1∶100)、Synaptopodin抗体(1∶400)或α-SMA抗体(1∶400)于4 ℃过夜;第二天,PBST清洗5遍,加入荧光二抗,室温避光孵育2 h;PBST清洗5遍,吹干,使用含有DAPI-Aqueous、Fluoroshield(Abcam, ab104139)的封固剂封片,激光共聚焦显微镜拍照(蔡司LSM900,德国)。
利用ImageJ软件对肾小球系膜区面积(对应肾小球中系膜区阳性面积/肾小球面积)进行定量分析,肾小球足细胞数量通过对每个肾小球中WT1阳性细胞进行计数定量。
1.7. 人足细胞分组干预
取分化后的人足细胞,分为4组:①对照组;② TGFβ组;③ TGFβ+CAY10603(250 nmol/L)组; ④TGFβ+CAY10603(500 nmol/L)组。对照组细胞不加任何药物;TGFβ组细胞加入5 ng/µL TGFβ刺激足细胞36 h;TGFβ+CAY10603(250 nmol/L)和TGFβ+CAY10603(500 nmol/L)组加入5 ng/µL TGFβ刺激足细胞36 h后,加入CAY10603继续刺激12 h。以Western blot检测4组人足细胞中α-SMA、Col1a1、HDAC6、NLRP3、Caspase-1蛋白的表达,主要观察CAY10603对NLRP3炎症小体的抑制作用。
1.8. Western blot检测人足细胞中蛋白的表达
足细胞孔板置于冰上,吸去培养基和上清,用预冷的PBS清洗3遍;加入蛋白裂解液SD-001,细胞刮蛋白,用移液器吹打几次并吸入预冷的离心柱中;14000×g 4 ℃离心30 s取出;立刻将收集管放置于冰上,弃去离心管柱,蛋白提取完成;蛋白裂解物加入蛋白缓冲液后99 ℃煮10 min,置于冰上备用。Western blot中使用的一抗抗体为α-SMA抗体(1∶2000),Col1a1抗体(1∶2000),HDAC6抗体(1∶1000),NLRP3抗体(1∶1000稀释),Caspase-1抗体(1∶5000)和内参蛋白α-Tubulin抗体(1∶5000)。利用AlphaView SA软件分析目标蛋白灰度值与内参蛋白α-Tubulin灰度值的比值,来评估蛋白相对表达量。
1.9. 统计学方法
使用GraphPad Prism 9软件进行统计学分析。所有实验数据均以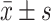 呈现,各实验组之间比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
呈现,各实验组之间比较采用单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2. 结果
2.1. HDAC6抑制剂CAY10603对糖尿病肾病小鼠肾功能的影响
见图1。与CTL+Veh组相比,STZ+Veh组和STZ+CAY10603组小鼠血糖、血尿素氮水平增高(P<0.0001或P<0.01),STZ+Veh组小鼠尿白蛋白/肌酐比值和血肌酐水平升高(P<0.01或P<0.05);与STZ+Veh组相比,STZ+CAY10603组血糖、血尿素氮水平差异无统计学意义,但尿白蛋白/肌酐比值和血肌酐水平降低(P<0.05)。CAY10603作用于对照组小鼠对上述指标均无改善,CTL+Veh组和CTL+CAY10603组相比,差异均无统计学意义。
图 1.

The effect of CAY10603, a HDAC6 inhibitor, on blood glucose, urine albumin-creatinine ratio (uACR), and renal function in mouse with diabetic kidney disease
HDAC6抑制剂CAY10603对糖尿病肾病小鼠血糖、尿白蛋白/肌酐比值和肾功能的影响
* P<0.05, ** P<0.01, *** P<0.001, **** P<0.0001. CTL+Veh group, n=5; CTL+CAY10603 group, n=3; STZ+Veh group, n=9; STZ+CAY10603 group, n=7. uACR: urine albumin-to-creatinine ratio.
2.2. HDAC6抑制剂CAY10603对糖尿病肾病小鼠肾脏病理的影响
见图2。与CTL+Veh组相比,STZ+Veh组小鼠肾小球出现系膜区增宽和肾小球硬化;与STZ+Veh组比较,STZ+CAY10603组小鼠肾小球膜区增宽和肾小球硬化得到明显改善,肾小球系膜区面积差异有统计学意义(P<0.0001)。而CAY10603对对照小鼠肾脏病理无明显影响,CTL+Veh组和CTL+CAY10603组相比,肾小球系膜区面积差异无统计学意义。
图 2.

The effect of CAY10603 on renal pathology in mice with diabetic kidney disease (PAS staining)
HDAC6抑制剂CAY10603对糖尿病肾病小鼠肾脏病理的影响(PAS染色)
**** P<0.0001. CTL+Veh group, n=5; CTL+CAY10603 group, n=3; STZ+Veh group, n=9; STZ+CAY10603 group, n=7.
2.3. HDAC6抑制剂CAY10603对足细胞上皮-间质转分化的影响
以足细胞标志物WT1和Synaptopodin进行免疫荧光染色发现(图3),与CTL+Veh组相比,STZ+Veh组小鼠足细胞数量下调,STZ+CAY10603组小鼠足细胞数量高于STZ+Veh组(P<0.001),表明CAY10603有效阻止了糖尿病肾病小鼠足细胞的丢失。小鼠肾组织免疫荧光染色显示,与CTL+Veh组相比,STZ+Veh组肾小球α-SMA表达增高,STZ+CAY10603组肾小球中的间质细胞标志物α-SMA表达显著下调。在体外人足细胞中, Western blot结果显示TGF-β组较对照组HDAC6蛋白表达升高,间质细胞标志物Col1a1和α-SMA表达上调(P<0.05);而CAY10603可同时抑制HDAC6、Col1a1和α-SMA的表达(P<0.001),两个剂量组与TGF-β组比较差异均有统计学意义(P<0.001或P<0.01),但两个剂量组间比较,差异无统计学意义。见图4。结果表明CAY10603有效阻断足细胞上皮-间质转分化。
图 3.

Immunofluorescence (IF) staining of podocyte markers WT1 and synaptopodin (×180)
小鼠肾组织足细胞标志物免疫荧光染色(×180)
*** P<0.001. CTL+Veh group, n=5; CTL+CAY10603 group, n=3; STZ+Veh group, n=9; STZ+CAY10603 group, n=7.
图 4.

The restorative effect of CAY10603 on podocyte injury
HDAC6抑制剂CAY10603修复足细胞损伤
A, The expression of α-SMA in mouse glomerular podocytes was detected by IF staining (×180). B, Western blot analysis of HDAC6, Col1a1 and α-SMA proteins in human podocytes. a: control group; b: TGFβ group; c: TGFβ+CAY10603 (250 nmol/L) group; d: TGFβ+CAY10603 (500 nmol/L) group; n=3. * P<0.05, ** P<0.01, *** P<0.001.
2.4. HDAC6抑制剂CAY10603抑制足细胞NLRP3炎症小体活化
免疫组化染色发现与CTL+Veh组小鼠相比,STZ+Veh组小鼠足细胞中NLRP3表达增高(P<0.0001);与STZ+Veh组相比,STZ+CAY10603组小鼠足细胞中NLRP3的表达被抑制(P<0.0001)。在体外人足细胞中,Western blot结果显示,TGF-β组较对照组NLRP3表达上调,Caspase-1活化(P<0.01或P<0.05);与TGF-β组相比,HDAC6抑制剂CAY10603可同时抑制NLRP3的表达和Caspase-1活化(P<0.01或P<0.05)。见图5。体外和体外结果显示,CAY10603可以抑制足细胞中NLRP3炎症小体活化。
图 5.

Inhibitory effect of CAY10603 on the activation of NLRP3 inflammasome in podocytes
HDAC6抑制剂CAY10603对足细胞NLRP3炎症小体活化的影响
A, NLRP3 protein was detected by immunohistochemical (IHC) staining (×150); CTL+Veh group (n=5), CTL+CAY10603 group (n=3), STZ+Veh group (n=9), and STZ+CAY10603 group (n=7). B, Western blot analysis of NLRP3 and Caspase-1 proteins in human podocytes. a: control group; b: TGFβ group; c: TGFβ+CAY10603 (250 nmol/L) group; d: TGFβ+CAY10603 (500 nmol/L) group; n=3. *P<0.05, **P<0.01, ****P<0.0001.
2.5. HDAC6基因敲除缓解糖尿病肾病小鼠足细胞损伤和蛋白尿
见图6。与WT组和HDAC6 KO组相比,WT+STZ和HDAC6 KO+STZ两组每个时点的血糖均增高(P<0.01);WT和HDAC6 KO两组间,以及WT+STZ和HDAC6 KO+STZ两组间血糖差异无统计学意义。与WT组相比,WT+STZ组uACR增高,HDAC6 KO+STZ组低于WT+STZ组(P<0.001),WT组和HDAC6 KO组间的uACR差异无统计学意义。通过PAS染色结果发现,WT+STZ组相比于WT组表现出显著的肾小球硬化;与WT+STZ组相比,HDAC6 KO+STZ组肾小球硬化得到显著改善。免疫荧光和免疫组化染色发现,WT+STZ组相比于WT组展现出明显的足细胞数量丢失和NLRP3表达增加;与WT+STZ组相比,HDAC6 KO+STZ组足细胞数量丢失和NLRP3的表达被抑制。HDAC6基因敲除可以有效缓解糖尿病肾病小鼠足细胞损伤和蛋白尿的发生。
图 6.

HDAC6 gene knockout protected podocyte from injury in diabetic kidney disease
HDAC6基因敲除对糖尿病小鼠的影响
WT group, n=6; HDAC6 KO group, n=6; WT+STZ group, n=10; HDAC6 KO+STZ group, n=9. *** P<0.001. # P<0.01, HDAC6 KO group and WT group, vs. WT+STZ group and HDAC6 KO+STZ group.
3. 讨论
糖尿病肾病是糖尿病最常见的微血管并发症之一,也是目前全世界范围内导致终末期肾脏疾病的首要原因[10]。足细胞损伤是糖尿病肾病和蛋白尿发生发展的关键环节,足细胞损伤严重程度与蛋白尿水平呈正相关,与糖尿病肾病发生发展密切相关[11]。所以,足细胞损伤的机制值得深入研究,并有利于靶向足细胞治疗靶点的发现。尽管研究表明,HDAC6抑制剂Tubacin可有效缓解2型糖尿病肾病小鼠的蛋白尿和足细胞损伤[7],但是,仍然缺乏充分证据证明HDAC6参与糖尿病肾病足细胞损伤。本研究利用1型糖尿病肾病小鼠模型证实了,药物抑制HDAC6或者基因敲除HDAC6均可以有效缓解足细胞损伤和蛋白尿。
本课题组前期首次证实了CAY10603在糖尿病肾病中的治疗作用,通过动物实验和细胞实验证实CAY10603通过抑制肾小管上皮细胞和巨噬细胞中NLRP3炎症小体的激活从而发挥治疗糖尿病肾病的作用,延缓肾小管间质纤维化和炎症细胞的浸润[9]。足细胞中NLRP3炎症小体的活化在糖尿病肾病足细胞损伤和蛋白尿的发生发展中扮演着重要的角色[12],足细胞中特异性敲除NLRP3小鼠有效缓解糖尿病肾病足细胞的损伤和蛋白尿水平,相反,足细胞中特异性过表达NLRP3小鼠表现出更加严重的足细胞损伤和蛋白尿水平。在此,结合小鼠肾组织和体外培养人足细胞证实,抑制HDAC6可以通过抑制足细胞NLRP3炎症小体激活及其下游效应分子Caspase-1活化而发挥治疗足细胞损伤和蛋白尿的作用。因此,本研究结果表明,靶向HDAC6可以同时抑制肾脏足细胞和肾小管上皮细胞,以及巨噬细胞中NLRP3炎症小体活化,发挥治疗糖尿病肾病的作用。
几十年来,糖尿病肾病的治疗药物始终局限在降糖药和降压药[13]。钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂[14]和非甾体类盐皮质激素受体(MR)拮抗剂[15]也是近年来开发的可以延缓糖尿病肾病进程的有效药物,然而,糖尿病肾病的治疗药物的选择性仍然很局限,寻找和开发新的治疗药物和靶点仍迫在眉睫。虽然HDAC广谱抑制剂被证实可以有效缓解糖尿病肾病动物的肾功能,但大量临床试验发现了HDAC广谱抑制剂的毒副作用和脱靶效应[16]。CAY10603是新型的HDAC6高度选择性的特异性抑制剂,与其他HDAC6特异性抑制剂(Tubacin、Tubastatin A、Ricolinostat、ACY-738、Vorinostat等)相比,CAY10603具有更低的半抑制浓度(IC50=2 pmol/L)[17]。CAY10603已被证实在急性肺损伤[18]、黑色素瘤[19]、胆管癌[20]、胶质瘤[21]等模型中发挥作用,CAY10603对HDAC6的IC50极低,因此减少了CAY10603在使用过程中的毒副作用和脱靶效应,是治疗糖尿病肾病的候选药物。笔者注意到,药物抑制HDAC6或者基因敲除HDAC6缓解糖尿病肾病小鼠蛋白尿的功效独立于降血糖,并且CAY10603短期治疗对糖尿病肾病小鼠的尿素氮并无减少的作用,因此,CAY10603可以联合其他降糖药或保肾药同时应用,可能可以发挥对糖尿病肾病更强的治疗作用。但本研究仍存在不足,仅仅在1型糖尿病肾病小鼠模型中观察了CAY10603对尿蛋白和足细胞的治疗作用,课题组将在后续的研究中观察CAY10603在多种糖尿病肾病小鼠中的疗效。
* * *
作者贡献声明 侯庆负责论文构思、数据审编、研究方法、提供资源、可视化和初稿写作 ,阚淑妍负责正式分析、研究方法、提供资源和可视化,徐峰和张明超负责正式分析和研究方法,刘志红和蒋松负责论文构思、经费获取、监督指导、初稿写作和审读与编辑写作。所有作者已经同意将文章提交给本刊,且对将要发表的版本进行最终定稿并同意对工作的所有方面负责。
利益冲突 所有作者均声明不存在利益冲突
Funding Statement
国家自然科学基金(No. 82370733)和江苏省科学技术厅基础研究计划(自然科学基金)(No. BK20211130)资助
Contributor Information
庆 侯 (Qing HOU), Email: nj_houqing@163.com.
松 蒋 (Song JIANG), Email: js1120@163.com.
References
- 1.LIU M, QIAO Z, ZHANG Y, et al Histone deacetylases take center stage on regulation of podocyte function. Kidney Dis (Basel) 2020;6(4):236–246. doi: 10.1159/000507117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.INOUE K, GAN G, CIARLEGLIO M, et al Podocyte histone deacetylase activity regulates murine and human glomerular diseases. J Clin Invest. 2019;129(3):1295–1313. doi: 10.1172/JCI124030. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.WANG X, LIU J, ZHEN J, et al Histone deacetylase 4 selectively contributes to podocyte injury in diabetic nephropathy. Kidney Int. 2014;86(4):712–725. doi: 10.1038/ki.2014.111. [DOI] [PubMed] [Google Scholar]
- 4.LIU F, ZONG M, WEN X, et al Silencing of histone deacetylase 9 expression in podocytes attenuates kidney injury in diabetic nephropathy. Sci Rep. 2016;6:33676. doi: 10.1038/srep33676. [DOI] [PMC free article] [PubMed] [Google Scholar] [Retracted]
- 5.Van BENEDEN K, GEERS C, PAUWELS M, et al Valproic acid attenuates proteinuria and kidney injury. J Am Soc Nephrol. 2011;22(10):1863–1875. doi: 10.1681/ASN.2010111196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.HE X, SUN T, ZHANG P, et al Selective inhibition of histone deacetylase class Ⅱa with MC1568 ameliorates podocyte injury. Front Med (Lausanne) 2022;9:848938. doi: 10.3389/fmed.2022.848938. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.REGNA N L, VIESON M D, LUO X M, et al Specific HDAC6 inhibition by ACY-738 reduces SLE pathogenesis in NZB/W mice. Clin Immunol. 2016;162:58–73. doi: 10.1016/j.clim.2015.11.007. [DOI] [PubMed] [Google Scholar]
- 8.PULYA S, AMIN S A, ADHIKARI N, et al HDAC6 as privileged target in drug discovery: a perspective. Pharmacol Res. 2021;163:105274. doi: 10.1016/j.phrs.2020.105274. [DOI] [PubMed] [Google Scholar]
- 9.HOU Q, KAN S, WANG Z, et al Inhibition of HDAC6 with CAY10603 ameliorates diabetic kidney disease by suppressing NLRP3 inflammasome. Front Pharmacol. 2022;13:938391. doi: 10.3389/fphar.2022.938391. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.LIU Z Nephrology in China. Nat Rev Nephrol. 2013;9(9):523–528. doi: 10.1038/nrneph.2013.146. [DOI] [PubMed] [Google Scholar]
- 11.NAGATA M Podocyte injury and its consequences. Kidney Int. 2016;89(6):1221–1230. doi: 10.1016/j.kint.2016.01.012. [DOI] [PubMed] [Google Scholar]
- 12.SHAHZAD K, FATIMA S, KHAWAJA H, et al Podocyte-specific NLRP3 inflammasome activation promotes diabetic kidney disease. Kidney Int. 2022;102(4):766–779. doi: 10.1016/j.kint.2022.06.010. [DOI] [PubMed] [Google Scholar]
- 13.DOSHI S M, FRIEDMAN A N Diagnosis and management of type 2 diabetic kidney disease. Clin J Am Soc Nephrol. 2017;12(8):1366–1373. doi: 10.2215/CJN.11111016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.DEFRONZO R A, REEVES W B, AWAD A S Pathophysiology of diabetic kidney disease: impact of SGLT2 inhibitors. Nat Rev Nephrol. 2021;17(5):319–334. doi: 10.1038/s41581-021-00393-8. [DOI] [PubMed] [Google Scholar]
- 15.BAKRIS G L, AGARWAL R, ANKER S D, et al Effect of finerenone on chronic kidney disease outcomes in type 2 diabetes. N Engl J Med. 2020;383(23):2219–2229. doi: 10.1056/NEJMoa2025845. [DOI] [PubMed] [Google Scholar]
- 16.LECHNER S, MALGAPO M I P, GRÄTZ C, et al Target deconvolution of HDAC pharmacopoeia reveals MBLAC2 as common off-target. Nat Chem Biol. 2022;18(8):812–820. doi: 10.1038/s41589-022-01015-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.ZHAO Y, LIANG T, HOU X, et al Recent development of novel HDAC6 isoform-selective Inhibitors. Curr Med Chem. 2021;28(21):4133–4151. doi: 10.2174/0929867327666201111142653. [DOI] [PubMed] [Google Scholar]
- 18.LIU L, ZHOU X, SHETTY S, et al HDAC6 inhibition blocks inflammatory signaling and caspase-1 activation in LPS-induced acute lung injury. Toxicol Appl Pharmacol. 2019;370:178–183. doi: 10.1016/j.taap.2019.03.017. [DOI] [PubMed] [Google Scholar]
- 19.PENG X, LI L, CHEN J, et al Discovery of novel histone deacetylase 6 (HDAC6) inhibitors with enhanced antitumor immunity of anti-PD-L1 immunotherapy in melanoma. J Med Chem. 2022;65(3):2434–2457. doi: 10.1021/acs.jmedchem.1c01863. [DOI] [PubMed] [Google Scholar]
- 20.KHORSANDI S E, DOKAL A D, RAJEEVE V, et al Computational analysis of cholangiocarcinoma phosphoproteomes identifies patient-specific drug targets. Cancer Res. 2021;81(22):5765–5776. doi: 10.1158/0008-5472.CAN-21-0955. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.HUANG Z, XIA Y, HU K, et al Histone deacetylase 6 promotes growth of glioblastoma through the MKK7/JNK/c-Jun signaling pathway. J Neurochem. 2020;152(2):221–234. doi: 10.1111/jnc.14849. [DOI] [PubMed] [Google Scholar]


