Abstract
阿尔茨海默症(AD)是一种以认知障碍为特征的神经退行性疾病,其主要临床表现是空间工作记忆(SWM)障碍,严重影响患者身心健康,而现有药物疗法存在治愈率低等问题,因此非药物物理疗法逐渐受到人们广泛关注。近年来,一种通过40 Hz光闪烁刺激(40 Hz-LFS)改善AD模型动物SWM功能的新方案取得初步进展,然而具体神经机制尚不清楚。因此,本研究将基于交叉频率耦合(CFC)探究40 Hz-LFS调控SWM功能的潜在神经机制。本文以10只成年维斯塔尔(Wistar)大鼠为研究对象,首先应用20、40、60 Hz的频率进行光闪烁刺激(LFS)实时作用,分析不同频率LFS对海马体(HPC)和内侧前额叶皮层(mPFC)神经振荡的夹带效应。结果显示,40 Hz-LFS能够形成夹带效应,调控低频γ(lγ)节律振荡的活动强度;随后将大鼠分为实验组和对照组,每组5只,进行40 Hz-LFS长期作用(7 d),并通过T迷宫任务检测其SWM功能,应用相位幅值耦合(PAC)分析HPC与mPFC间(HPC-mPFC)回路的CFC变化。结果表明,实验组的行为学表现得到提升,θ节律和lγ(θ-lγ)的PAC增强,差异具有统计学意义。本文研究结果提示,长期40 Hz-LFS能够有效改善大鼠的SWM功能,其原因可能是促进了相关神经回路中振荡的跨节律信息交流。期望通过本文研究,可为今后进一步研究40 Hz-LFS改善认知功能的机制及促进其临床应用奠定基础。
Keywords: 40 Hz光闪烁刺激, 空间工作记忆, 相位幅值耦合, 神经振荡, 海马-内侧前额叶皮层
Abstract
Alzheimer’s disease (AD) is a neurodegenerative disease characterized by cognitive impairment, with the predominant clinical diagnosis of spatial working memory (SWM) deficiency, which seriously affects the physical and mental health of patients. However, the current pharmacological therapies have unsatisfactory cure rates and other problems, so non-pharmacological physical therapies have gradually received widespread attention. Recently, a novel treatment using 40 Hz light flicker stimulation (40 Hz-LFS) to rescue the cognitive function of model animals with AD has made initial progress, but the neurophysiological mechanism remains unclear. Therefore, this paper will explore the potential neural mechanisms underlying the modulation of SWM by 40 Hz-LFS based on cross-frequency coupling (CFC). Ten adult Wistar rats were first subjected to acute LFS at frequencies of 20, 40, and 60 Hz. The entrainment effect of LFS with different frequency on neural oscillations in the hippocampus (HPC) and medial prefrontal cortex (mPFC) was analyzed. The results showed that acute 40 Hz-LFS was able to develop strong entrainment and significantly modulate the oscillation power of the low-frequency gamma (lγ) rhythms. The rats were then randomly divided into experimental and control groups of 5 rats each for a long-term 40 Hz-LFS (7 d). Their SWM function was assessed by a T-maze task, and the CFC changes in the HPC-mPFC circuit were analyzed by phase-amplitude coupling (PAC). The results showed that the behavioral performance of the experimental group was improved and the PAC of θ-lγ rhythm was enhanced, and the difference was statistically significant. The results of this paper suggested that the long-term 40 Hz-LFS effectively improved SWM function in rats, which may be attributed to its enhanced communication of different rhythmic oscillations in the relevant neural circuits. It is expected that the study in this paper will build a foundation for further research on the mechanism of 40 Hz-LFS to improve cognitive function and promote its clinical application in the future.
Keywords: 40 Hz light flicker stimulation, Spatial working memory, Phase-amplitude coupling, Neural oscillations, Hippocampus-medial prefrontal cortex
0. 引言
阿尔茨海默症(Alzheimer’s disease,AD)是一种进行性老年神经退行疾病[1-2],其临床表现为记忆、执行、语言等认知功能障碍,是最常见的早老性痴呆类型。AD患者通常伴随不同程度的认知功能障碍,日常生活能力逐渐下降,严重影响了患者身心健康。目前AD的治疗仍是一个难题,现有药物仅能起到暂时缓解作用,且只对半数患者有效[3],因此亟需发展新的治疗方法。近年来,来自麻省理工学院的研究团队基于AD动物模型和人类患者γ节律振荡异常[4-5],提出一种新颖的非药物物理治疗方案,即利用40 Hz光闪烁刺激(light flicker stimulation,LFS)(40 Hz—LFS)等外部视觉刺激能够在相应脑区中产生夹带效应特性,调控认知功能相关脑区γ节律振荡的强度,从而达到缓解病理特征的效果[6-7]。其中,夹带效应被定义为“神经振荡与外部刺激的节律同步”,即脑内神经振荡与外部刺激的对应节律达到相位同步[8]。通过夹带效应,LFS不仅有效提升了视觉皮层和多个认知相关脑区的γ振荡功率,缓解了AD模型动物的β淀粉样蛋白(β-amyloid,Aβ)斑块沉积等病理特征[9-10],还改善了AD模型动物的认知功能[11-12]。然而,40 Hz—LFS方案调控认知功能的神经电生理机制尚不明确。
研究表明,认知行为的神经机制可能是相关脑区之间的神经信息协同作用,例如海马体(hippocampus,HPC)[13]和内侧前额叶皮层(medial prefrontal cortex,mPFC)[14]都是学习和记忆所必需的大脑结构,两个脑区之间的信息协同作用对于成功执行认知任务至关重要,尤其是空间工作记忆(spatial working memory,SWM)[15]。SWM是实时记住空间位置的能力,是认知行为中的一项重要功能,SWM障碍是AD的主要临床特征之一[16]。研究表明,在执行SWM任务时,HPC—mPFC回路中的神经振荡能够通过交叉频率耦合(cross-frequency coupling,CFC)跨脑区协同作用[15]。其中,低频振荡相位与高频振荡幅值主要通过相位幅值耦合(phase amplitude coupling,PAC)在SWM形成和维持期间发挥关键性作用[17]。例如,HPC脑区θ节律(4~12 Hz)与mPFC脑区γ节律(30~100 Hz)振荡之间的PAC强度在小鼠成功执行SWM任务时升高[18],而认知障碍模型动物则表现出PAC受损,表明θ—γ节律的PAC与SWM任务编码过程密切相关[19-20],可能是关键神经机制。因此,基于HPC—mPFC回路PAC角度探究40 Hz—LFS调控认知功能的神经电生理机制,对促进该方案治疗AD等认知障碍疾病的临床应用具有重要意义。
本研究旨在探究40 Hz-LFS对大鼠SWM功能的影响,以及HPC—mPFC回路θ—γ节律信息协同的神经电生理机制。本文首先分析了20、40、60 Hz的LFS实时作用对大鼠HPC和mPFC脑区的夹带效应,以探究对γ节律振荡的调控作用;随后进行40 Hz—LFS长期作用,并通过T迷宫任务评估大鼠的SWM表现;同时计算HPC-mPFC回路θ—γ节律的PAC,从不同节律振荡远程协同作用的角度探究40 Hz—LFS长期作用影响SWM功能的神经机制,为促进40 Hz—LFS治疗AD等认知障碍疾病的临床应用提供理论支持。
1. 材料和方法
本研究所有实验程序均按照《实验动物护理和使用指南》[21]进行,所有实验步骤环节均已通过了河北工业大学生物医学伦理委员审查(审查编号:HEBUTaCUC2022052)。
1.1. 微电极阵列植入手术与神经电信号获取
本实验以10只雄性成年维斯塔尔(Wistar)大鼠为研究对象,体重为300~350 g。动物饲养期间给予充足的水和食物;执行行为学任务期间,限制饮食使大鼠体重保持在自由进食状态下的85%,以保持食欲。
通过外科手术将多通道微电极阵列植入大鼠HPC和mPFC,以获取其神经信号。本实验使用异氟烷气体麻醉大鼠并固定于立体定位仪进行手术过程,依据脑图谱[22]将两个8通道的镍铬合金微电极阵列(2×4 配置排列,直径35 μm,电极间距300 μm)植入大鼠腹侧HPC(前囟后4.5~6.5 mm,旁开4.5~5.5 mm,深度为距离脑皮层表面6.5~7.5 mm)和mPFC(前囟前2.5~4.5 mm,旁开0.2~1.0 mm,深度为距离脑皮层表面2.5~3.0 mm)。在电极到达目标脑区后,使用螺钉和牙科水泥进行包埋固定。术后单独饲养,并给予大鼠5~7 d恢复时间。基于植入的多通道微电极阵列,应用在体多通道电生理记录系统OmniPlex 128(Plexon Inc.,美国)能够记录大鼠HPC和mPFC的神经集群活动,通过放大(增益:5 000)和低通滤波(0.3~300.0 Hz)获取采样率为1 000 Hz的局部场电位(local field potentials,LFPs),以进行后续分析。
1.2. LFS方案
首先应用不同频率(20、40、60 Hz)LFS进行实时作用实验,分析夹带效应随刺激频率的变化情况,实验步骤如下:
(1)静息态5 min;
(2)20 Hz:光刺激5 min+伪刺激5 min,50%占空比为25 ms亮和25 ms暗;
(3)40 Hz:光刺激5 min+伪刺激5 min,50%占空比为12.5 ms亮和12.5 ms暗;
(4)60 Hz:光刺激5 min+伪刺激5 min,50%占空比为8.33 ms亮和8.33 ms暗;
每个刺激步骤间隔为1 h。其中,静息态是不接受刺激且处于静息的无任务状态;光刺激是使用亮度范围在300~1 200 lux,具有50%占空比的周期性方波,以颜色为自然光的发光二极管(light emitting diode,LED)进行特定频率的LFS[5];伪刺激是使用一个不透光的黑色挡板将光源遮住,使大鼠处于在LED闪烁时接收不到光刺激的状态。
随后将10只大鼠随机分为2组:对照组和实验组,每组5只。对实验组大鼠进行连续7 d(1 h/d)的LFS长期作用,具体操作步骤为:将大鼠从饲养室运出后,首先置于昏暗的环境中习惯1 h,然后再引入刺激笼(三面黑色、一面透明,且透明一侧固定有LED阵列)开始LFS,时长为1 h,如图1所示;期间允许大鼠在笼内自由活动,但没有食物和水;刺激完成后,将大鼠放回笼中休息1 h,然后再运回饲养室。对照组,在1 h的LFS期间仅接受正常室内光线照射,其它条件与实验组相同。
图 1.
Diagram of rats under LFS
大鼠LFS示意图
1.3. SWM行为学任务
基于食物奖励的T迷宫延迟选择交替任务,是一种测试SWM的行为学实验范式[23],广泛应用于脑认知活动评估。本研究使用的“T迷宫”由一个起始臂(臂端为起始区域)和两个具有食物奖励的目标臂(臂端有固定食槽,可放置食物作为奖励)组成,如图2所示。
图 2.
Diagram of the delayed-alternation task on T-maze
T迷宫延迟交替任务示意图
T迷宫任务,包括训练阶段和测试阶段。训练阶段,大鼠接受训练(20次/d)至正确率达到“学会”标准。过程简述如下:每次任务包括自由选择和延迟交替选择两个过程。在自由选择过程中,大鼠从起始区域出发至行为选择参考点(reference point,RP)进行选择,然后向左或向右移动进入任意一个目标臂以获得食物奖励。随后大鼠返回起始区域,并在等待5 s后,开始延迟交替选择过程,即大鼠必须选择与自由选择过程中相反的目标臂,才能获得食物奖励,并记录为行为学正确;反之,则记录为错误。之后,大鼠自主回到起始区域,本次任务结束。当大鼠行为学正确率连续2 d超过80%时,被认为达到“学会”的标准,完成训练阶段。随后进行测试阶段,过程与训练阶段相同,执行5 d(20次/d)。
1.4. 数据处理与分析
应用在体多通道电生理记录系统OmniPlex 128(Plexon Inc.,美国)记录不同频率LFS实时作用时的LFPs,以及T迷宫任务测试阶段的LFPs,并随机选取每只大鼠20次行为学正确的数据进行分析。对于LFPs数据,首先通过小波(coif5)变换去除基线漂移,并通过陷波滤波器消除50 Hz工频干扰。使用数学分析软件Matlab 9.1(MathWorks Inc.,美国)函数库中的韦尔奇功率谱方法(Pwelch)计算信号的功率谱密度(power spectral density,PSD),以分析其活动强度,使用500 ms时间窗口和50%重叠。
采用PAC方法测量慢节律(θ)相位和快节律(γ)幅值之间的耦合模式,并通过调制指数(modulation index,MI)(以符号MI表示)的方法[24]进行计算,过程简述如下:首先使用一组窄带滤波器分别检测θ振荡相位的上升和下降斜率,并使用宽带滤波器找到波谷和波峰,以消除慢节律信号相位因单调变化而形成的伪耦合现象,并将相位信号标记为φ(t)。然后,将φ(t)的每个周期分为4个相位段,分别对应波峰至波谷的下降以及上升时期,再将每个相位段平均分成4份,则一个相位周期被分为16个相位段。对于γ振荡,使用一个带宽固定、且频率中心在γ节律范围逐步平移的滤波器进行滤波,其带宽至少是相位信号频率的两倍。由于HPC中的主要θ节律振荡约为8 Hz,带宽应至少为16 Hz,本研究选取的带宽为20 Hz,符合两倍的要求。然后利用希尔伯特变换计算γ振荡的幅值包络,记为A(t)。
接下来,计算每个相位段对应γ振荡包络Ay的平均值。将各相位段所求的Ay除以各相位段均值的总和,从而将幅值信息转化为分布概率的信息,如式(1)所示:
 |
1 |
式中,Ay(j)表示相位段j处的γ幅值包络Ay的平均值,Pj为Ay(j)的分布概率,N为相位段的个数。当各个相位段所对应的幅值均值相同时,此分布为均匀分布。应用标准化熵度量H来表征调制结果,定义如式(2)所示:
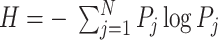 |
2 |
当Pj = 1/N时,H达到最大值,记为Hmax。通过标准化,可以得到基于熵的MI。本研究使用MI来表示信号间的PAC强度,如式(3)所示:
 |
3 |
当MI接近0时,表示相位和幅值的耦合强度较低;MI较大时,表示存在较高强度的耦合。
1.5. 统计分析
本研究共记录了10只大鼠的200次任务,平均每只大鼠20次。应用统计软件GraphPad Prism 9.0(GraphPad Prism Software Inc., 美国)的单因素方差分析(one-way ANOVA)来分析LFS实时作用结果中的统计学意义;应用t检验分析实验组和对照组之间的差异,以判断是否具有统计学意义。文中数据均以均值±标准误表示,检验水准为0.05。
2. 结果
2.1. 不同频率LFS实时作用的夹带效应
为探究不同频率LFS对大鼠高阶认知脑区的夹带效应,本研究分析了大鼠HPC和mPFC脑区的LFPs在受到20、40、60 Hz频率LFS实时作用时的功率变化,并使用PSD表示。如图3所示,为大鼠HPC和mPFC脑区LFPs对应刺激频率处的PSD变化,图3中黑色曲线表示静息态,红色表示各频率LFS作用,蓝色表示伪刺激,阴影为标准差。相比静息态和伪刺激,LFPs分别在20 Hz—LFS和40 Hz—LFS作用时,对应频率LFPs的PSD出现尖峰;而60 Hz—LFS作用时,则没有出现尖峰。提示,20 Hz和40 Hz的刺激频率可能会在HPC和mPFC脑区形成夹带效应,而60 Hz的刺激频率则不会。
图 3.

PSD changes of LFPs at corresponding stimulus frequencies
对应刺激频率LFPs的功率谱密度变化
如图4所示,为大鼠HPC和mPFC神经振荡对应频率处PSD在LFS实时作用下的统计结果。
图 4.
Comparison of PSD of LFPs at corresponding stimulus frequencies in resting, light flicker stimulating and pseudo-stimulating states (*P < 0.01)
静息态、LFS和伪刺激状态下对应刺激频率LFPs的功率谱密度对比(*P < 0.01)
(1)20 Hz—LFS实时作用结果显示,HPC脑区20 Hz节律振荡的PSD在三种状态下的差异具有统计学意义[F(2,147)= 65.99,P < 0.01)],LFS时的PSD高于静息态(t = 9.72,P < 0.01)和伪刺激(t = 10.16,P < 0.01),差异具有统计学意义,静息态与伪刺激的差异无统计学意义(t = 0.43,P > 0.99);mPFC脑区PSD的差异也具有统计学意义[F(2,147) = 75.01,P < 0.01],LFS时的PSD高于静息态(t = 10.75,P < 0.01)和伪刺激(t = 10.46,P < 0.01),差异具有统计学意义,静息态与伪刺激的差异无统计学意义(t = 0.29,P > 0.99)。
(2)40 Hz—LFS实时作用结果显示,HPC脑区40 Hz节律振荡的PSD在三种状态下的差异具有统计学意义[F(2,147) = 62.75,P < 0.01],LFS时的PSD高于静息态(t = 10.20,P < 0.01)和伪刺激(t = 9.11,P < 0.01),差异具有统计学意义,静息态与伪刺激的差异无统计学意义(t = 1.09,P = 0.826);mPFC脑区PSD的差异也具有统计学意义[F(2,147) = 70.88,P < 0.01],LFS时的PSD高于静息态(t = 10.88,P < 0.01)和伪刺激(t = 9.63,P < 0.01),差异具有统计学意义,而静息态与伪刺激的差异无统计学意义(t = 1.24,P = 0.647)。
(3)60 Hz—LFS实时作用结果显示,HPC脑区60 Hz节律振荡的PSD在三种状态下的差异无统计学意义[F(2,147) = 0.45,P = 0.826],同时mPFC脑区的差异也不具有统计学意义[F(2,147) = 0.25,P = 0.779]。
结果提示,20 Hz—LFS和40 Hz—LFS均能够明显增强对应频率处的PSD,即能够在大鼠的HPC和mPFC脑区形成夹带效应。
基于θ、γ节律与SWM的密切关系[18-19],进一步分析不同频率的LFS实时作用对θ、γ节律PSD的影响,包括θ(4~12 Hz)、低频γ(low-frequency γ,lγ)(30~60 Hz)和高频γ(high-frequency γ,hγ)(60~100 Hz)节律,结果如图5所示。
图 5.
Comparison of PSD of oscillations in various rhythms at resting state and LFS with different frequencies (*P < 0.01)
静息态和不同频率LFS作用时各节律振荡功率谱密度的对比(*P < 0.01)
HPC脑区lγ节律PSD的组间差异具有统计学意义[F(3,196) = 142.70,P < 0.01],40 Hz—LFS作用时高于静息态(t = 17.03,P < 0.01)、20 Hz—LFS(t = 15.98,P < 0.01)和60 Hz—LFS(t = 17.53,P < 0.01),差异具有统计学意义;θ和hγ的PSD统计结果显示组间差异不具有统计学意义[θ:F(3,196) = 1.98,P = 0.118;hγ:F(3,196) = 2.03,P = 0.111]。mPFC的结果与HPC类似,lγ节律PSD的组间差异具有统计学意义[F(3,196) = 34.75,P < 0.01],40 Hz—LFS作用时高于静息态(t = 9.13,P < 0.01)、20 Hz—LFS(t = 6.96,P < 0.01)和60 Hz—LFS(t = 8.33,P < 0.01),差异具有统计学意义;θ和hγ的PSD统计结果则显示组间差异不具有统计学意义[θ:F(3,196) = 0.51,P = 0.673;hγ:F(3,196) = 1.01,P = 0.387]。结果提示,40 Hz—LFS能够显著增强HPC和mPFC脑区lγ节律神经振荡的活动功率。
2.2. 40 Hz—LFS长期作用对大鼠T迷宫行为表现的影响
为探究长期40 Hz—LFS对SWM功能的影响,本研究通过T迷宫延迟交替选择任务检测了大鼠在40 Hz—LFS作用7 d后的SWM行为表现。首先,统计训练过程中大鼠每天的正确率,以及满足行为学标准(如“1.3小节”中所述,至少连续两天正确率超过80%)所需要的天数。结果如图6所示,随着训练天数的增加,正确率呈逐渐上升趋势,且各组大鼠在经过训练之后均满足行为学标准,数据以均值±标准差表示。实验组满足行为学标准的平均时长[t=(4.00 ± 0.32) d]少于对照组[t=(6.28 ± 0.51) d],差异具有统计学意义(t = 4.00,P < 0.01)。结果表明,实验组大鼠需要较少的时间和训练就能够学会相同的任务,反映出其SWM功能得到改善。
图 6.
Behavior performance of rats in T-maze delayed alternative choice task
大鼠T迷宫延迟交替选择任务行为表现
2.3. 40 Hz—LFS长期作用对大鼠HPC—mPFC回路PSD的影响
为探究40 Hz—LFS长期作用改善大鼠SWM行为表现的神经机制,本研究分析了实验组和对照组大鼠HPC和mPFC脑区神经振荡在静息状态下的活动变化,结果如图7所示。所有节律的PSD在两组数据中的差异均无统计学意义(P > 0.05)。该研究结果提示,40 Hz—LFS长期作用并没有改变大鼠静息状态下HPC和mPFC脑区40 Hz神经振荡的活动强度。
图 7.
Comparison of PSD of oscillations in various rhythms between two groups of rats
两组大鼠各节律振荡的功率谱密度对比
2.4. 40 Hz—LFS长期作用对大鼠HPC—mPFC回路PAC机制的影响
选取大鼠T迷宫任务延迟交替过程中关键时期[23, 25]的LFP数据(RP前1 s的决策时期)进行分析,以探索两组大鼠的PAC模式变化。如图8所示,为大鼠HPC—mPFC回路的PAC模式示意图,横轴代表θ相位的频率,纵轴为γ幅值的频率,PAC强度用MI表示,颜色越接近红色表示MI越高。由图8可见,在γ节律之间发现不同的耦合峰值,表明γ节律范围内可能存在不同的耦合模式。为此,将γ节律范围分为lγ(30~60 Hz)和hγ(60~100 Hz),分别统计其与θ相位之间的耦合强度。
图 8.
PAC pattern of the HPC-mPFC circuit in rats
大鼠HPC—mPFC回路的PAC模式示意图
如图9所示,为两组大鼠的MI对比结果。其中,实验组HPC(θ)—mPFC(lγ)的MI高于对照组,差异具有统计学意义(t = 2.54,P = 0.016)。同时,mPFC(θ)—HPC(lγ)的MI结果也显示实验组高于对照组,差异具有统计学意义(t = 2.63,P = 0.012)。而两组MI在HPC(θ)— mPFC(hγ)(t = 0.17,P = 0. 868)和mPFC(θ)—HPC(hγ)(t = 1.29,P = 0.204)的差异无统计学意义。研究结果提示,40 Hz—LFS长期作用能够增强大鼠HPC—mPFC回路θ—lγ之间的PAC强度。
图 9.
MI comparison of HPC-mPFC between two groups
两组大鼠HPC—mPFC的MI对比
3. 讨论
本研究通过分析不同频率LFS实时作用在HPC和mPFC脑区形成的夹带效应,以及40 Hz—LFS长期作用后,大鼠执行T迷宫任务的行为表现与HPC—mPFC回路θ—γ节律的PAC模式,从不同节律神经振荡协同作用的角度,探究了40 Hz—LFS影响大鼠SWM功能的神经机制。结果发现,40 Hz—LFS实时作用能够显著增强lγ节律的振荡活动,对HPC和mPFC脑区形成有效的夹带效应,达到调控神经振荡目的。Adaikkan等[10]的研究也表明,40 Hz—LFS能够有效夹带视觉皮层以及HPC等高阶脑区的γ节律,增强γ节律振荡活动的功率,与本研究的结果一致。此外,本研究还发现60 Hz—LFS没有表现出明显的夹带效应,可能的原因是,视觉诱发的神经振荡响应在大脑空间传播时对刺激频率很敏感,频率较高时(>54 Hz)更多地集中在视觉皮层[26],并没有传输到HPC和mPFC等脑区。Lee等[27]还报道了节律性LFS对人体进行刺激时,频率为34~38 Hz的白光能够同步人体大脑中更强且范围更广的γ振荡。这些研究表明,节律性LFS在包含40 Hz的lγ节律范围内可能比在hγ节律范围更适合夹带效应。尽管这种基于LFS的物理刺激模式能够有效增强神经振荡活动强度,调控大脑皮层神经活动,但仍需对刺激模式进一步优化,如结合声音和不同颜色的光(如蓝光和红光等),以达到更好的刺激效果。
本文大鼠行为学结果表明,相比未受刺激的对照组,经过40 Hz—LFS的实验组大鼠达到T—迷宫任务标准所需的天数较少,即SWM功能得到改善。而之前的研究也报道了,40 Hz—LFS能够有效改善实验动物莫里斯水迷宫等SWM任务的表现[9-10],与本研究结果一致。此外,相关研究还从分子蛋白水平探究了可能的作用机制,结果表明40 Hz—LFS长期作用能够有效降低AD模型小鼠的Aβ和微管相关蛋白(tubulin-associated unit,tau)水平[4],减少小胶质介导的炎症应答[9],增强相关基因和蛋白质的表达[11],促进神经元中突触传递和细胞内转运[12],从而起到神经保护作用[10],达到改善AD的效果。这些结果都为促进40 Hz—LFS的发展提供了支持,然而在临床应用中,这种非药物性的疗法仍然是一个相对较新的研究领域,仍需进一步开发其潜在的治疗效果[28-29],为将来治疗AD提供一种可能的选择。
由于LFPs可以直接反映神经元集群的电生理活动,因此研究LFPs特征对探究神经系统认知功能的作用机制具有重要意义。本研究发现,40 Hz—LFS长期作用没有对静息态的神经振荡活动造成影响,而是提高了大鼠T迷宫任务过程中HPC和mPFC脑区θ—lγ的PAC强度,表明40 Hz—LFS加强了HPC—mPFC回路不同节律神经振荡的协同作用。有研究表明,不同节律神经振荡之间的PAC可能是大鼠执行认知任务的关键神经机制,尤其是HPC和mPFC脑区的PAC在大鼠的认知任务活动中有效编码了SWM[13, 18, 25]。Tort等[25]和Wang等[23]的研究表明,PAC峰值出现在T迷宫任务RP附近的决策期间,反映出PAC在不同时间尺度上主动参与认知任务的动态过程,体现了PAC在编码认知任务中的神经作用机制。此外,本研究还发现θ相位与多个γ子节律幅值发生了耦合,可能是由于不同的γ子节律范围具有独立的生理意义,并在SWM过程发挥不同的功能。具体而言,40 Hz—LFS长期作用显著增强了θ—lγ的PAC强度,对θ—hγ无明显影响,可能的原因是40 Hz—LFS长期刺激对lγ节律振荡的活动强度有增强效果,进而加强了与θ节律的耦合作用,但并没有对hγ产生作用。结合大鼠SWM行为学结果,本研究结果提示,θ—lγ的PAC上升引起的HPC—mPFC回路神经信息协同作用增强,可能是40 Hz—LFS改善大鼠SWM任务行为表现的神经机制。然而,本研究也存在样本量较少、刺激时长不完善等局限性,故尚需进一步完善相关研究内容。
4. 结论
本研究基于在体多通道电生理记录系统OmniPlex 128(Plexon Inc.,美国)实时分析了大鼠HPC和mPFC脑区在不同频率(20、40、60 Hz)LFS实时作用时的夹带效应,随后进行40 Hz—LFS长期作用,并通过T迷宫延迟交替任务评估大鼠的SWM表现,同时计算了HPC—mPFC回路θ—γ节律的PAC强度。结果表明,40 Hz—LFS实时作用表现出明显的夹带现象,能够显著增强lγ节律振荡的活动功率;长期作用则显著改善大鼠SWM任务行为表现,增强其认知水平,提高HPC—mPFC回路θ—lγ的PAC强度,加强不同节律振荡以CFC方式进行的跨脑区协同作用。
综上,本研究结果表明40 Hz—LFS长期作用有效增强了大鼠HPC—mPFC回路θ—lγ的PAC强度,促进了不同节律振荡在脑区间的协同作用,进而改善了大鼠的SWM功能,为今后研究40 Hz—LFS改善认知功能的机制及促进其临床应用提供了支持。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:作者王龙龙参与了论文的选题、实验设计、数据采集和分析、论文写作;作者李双燕和徐桂芝参与了论文的选题、实验设计、论文内容审核和论文修改;作者李润泽参与了数据采集、分析和论文修改。
伦理声明:本研究所有实验步骤环节均已通过了河北工业大学生物医学伦理委员审查(审查编号:HEBUTaCUC2022052)。
Funding Statement
国家自然科学基金资助项目(51737003,51677053);河北省引进留学人员资助项目(C20200315)
Contributor Information
双燕 李 (Shuangyan LI), Email: lishuangyan@hebut.edu.cn.
桂芝 徐 (Guizhi XU), Email: gzxu@hebut.edu.cn.
References
- 1.Breijyeh Z, Karaman R. Comprehensive review on Alzheimer's disease: causes and treatment. Molecules. 2020, 25(24): 5789.
- 2.Wu L, Xian X, Xu G, et al Toll-like receptor 4: A promising therapeutic target for Alzheimer's disease. Mediators Inflamm. 2022;2022:7924199. doi: 10.1155/2022/7924199. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Malaiya A, Singhai M, Singh M, et al Recent update on the Alzheimer's disease progression, diagnosis and treatment approaches. Curr Drug Targets. 2022;23(10):978–1001. doi: 10.2174/1389450123666220526155144. [DOI] [PubMed] [Google Scholar]
- 4.Iaccarino H F, Singer A C, Martorell A J, et al Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 2016;540(7632):230–235. doi: 10.1038/nature20587. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Singer A C, Martorell A J, Douglas J M, et al Noninvasive 40-Hz light flicker to recruit microglia and reduce amyloid beta load. Nat Protoc. 2018;13(8):1850–1868. doi: 10.1038/s41596-018-0021-x. [DOI] [PubMed] [Google Scholar]
- 6.Chen M, Chen Y, Huo Q, et al. Enhancing GABAergic signaling ameliorates aberrant gamma oscillations of olfactory bulb in AD mouse models. Mol Neurodegener. 2021, 16(1): 14.
- 7.Gaubert S, Raimondo F, Houot M, et al. EEG evidence of compensatory mechanisms in preclinical Alzheimer's disease. Brain. 2019, 142(7): 2096-2112.
- 8.张雪, 袁佩君, 王莹, 等 知觉相关的神经振荡-外界节律同步化现象. 生物化学与生物物理进展. 2016;43(4):308–315. doi: 10.16476/j.pibb.2016.0097. [DOI] [Google Scholar]
- 9.Adaikkan C, Tsai L H Gamma entrainment: Impact on neurocircuits, glia, and therapeutic opportunities. Trends Neurosci. 2020;43(1):24–41. doi: 10.1016/j.tins.2019.11.001. [DOI] [PubMed] [Google Scholar]
- 10.Adaikkan C, Middleton S J, Marco A, et al Gamma entrainment binds higher-order brain regions and offers neuroprotection. Neuron. 2019;102(5):929–943. doi: 10.1016/j.neuron.2019.04.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Martorell A J, Paulson A L, Suk H J, et al Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and iImproves cognition. Cell. 2019;177(2):256–271. doi: 10.1016/j.cell.2019.02.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Zheng L, Yu M, Lin R, et al Rhythmic light flicker rescues hippocampal low gamma and protects ischemic neurons by enhancing presynaptic plasticity. Nat Commun. 2020;11(1):3012. doi: 10.1038/s41467-020-16826-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Vivekananda U, Bush D, Bisby J A, et al Theta power and theta-gamma coupling support long-term spatial memory retrieval. Hippocampus. 2021;31(2):213–220. doi: 10.1002/hipo.23284. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mclaughlin A E, Diehl G W, Redish A D Potential roles of the rodent medial prefrontal cortex in conflict resolution between multiple decision-making systems. Int Rev Neurobiol. 2021;158:249–281. doi: 10.1016/bs.irn.2020.11.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Zielinski M C, Shin J D, Jadhav S P Coherent coding of spatial position mediated by theta oscillations in the hippocampus and prefrontal cortex. J Neurosci. 2019;39(23):4550–4565. doi: 10.1523/JNEUROSCI.0106-19.2019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Labban S, Alshehri F S, Kurdi M, et al Melatonin improves short-term spatial memory in a mouse model of Alzheimer's disease. Degener Neurol Neuromuscul Dis. 2021;11:15–27. doi: 10.2147/DNND.S291172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Victorino D B, Faber J, Pinheiro D J L L, et al. Toward the identification of neurophysiological biomarkers for Alzheimer’s disease in down syndrome: A potential role for cross-frequency phase-amplitude coupling analysis. Aging Dis, 2023,14(2): 428-449.
- 18.Tamura M, Spellman T J, Rosen A M, et al Hippocampal-prefrontal theta-gamma coupling during performance of a spatial working memory task. Nat Commun. 2017;8(1):2182. doi: 10.1038/s41467-017-02108-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Abubaker M, Al Qasem W, Kvašňák E Working memory and cross-frequency coupling of neuronal oscillations. Front Psychol. 2021;12:756661. doi: 10.3389/fpsyg.2021.756661. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Morici J F, Weisstaub N V, Zold C L. Hippocampal-medial prefrontal cortex network dynamics predict performance during retrieval in a context-guided object memory task. Proc Natl Acad Sci U S A, 2022, 119(20): e2203024119.
- 21.National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the care and use of laboratory animals. 8th ed. Washington (DC): National Academies Press (US); 2011. DOI: 10.17226/12910.
- 22.Yang P, Wang Z, Zhang Z, et al The extended application of the rat brain in stereotaxic coordinates in rats of various body weight. J Neurosci Methods. 2018;307:60–69. doi: 10.1016/j.jneumeth.2018.06.026. [DOI] [PubMed] [Google Scholar]
- 23.Wang J, Zhang S, Liu T, et al Directional prefrontal-thalamic information flow is selectively required during spatial working memory retrieval. Front Neurosci. 2022;16:1055986. doi: 10.3389/fnins.2022.1055986. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.López-Madrona V J, Pérez-Montoyo E, Álvarez-Salvado E, et al ferent theta frameworks coexist in the rat hippocampus and are coordinated during memory-guided and novelty tasks. Elife. 2020;9:e57313. doi: 10.7554/eLife.57313. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Tort A B, Kramer M A, Thorn C, et al Dynamic cross-frequency couplings of local field potential oscillations in rat striatum and hippocampus during performance of a T-maze task. Proc Natl Acad Sci U S A. 2008;105(51):20517–20522. doi: 10.1073/pnas.0810524105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Tsoneva T, Garcia-Molina G, Desain P Neural dynamics during repetitive visual stimulation. J Neural Eng. 2015;12(6):066017. doi: 10.1088/1741-2560/12/6/066017. [DOI] [PubMed] [Google Scholar]
- 27.Lee K, Park Y, Suh S W, et al Optimal flickering light stimulation for entraining gamma waves in the human brain. Sci Rep. 2021;11(1):16206. doi: 10.1038/s41598-021-95550-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.He Q, Colon-Motas K M, Pybus A F, et al A feasibility trial of gamma sensory flicker for patients with prodromal Alzheimer’s disease. Alzheimers Dement (N Y) 2021;7(1):e12178. doi: 10.1002/trc2.12178. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Zibrandtsen I C, Agger M, Kjaer T W Gamma entrainment in a large retrospective cohort: Implications for photic stimulation therapy for Alzheimer's disease. J Alzheimers Dis. 2020;75(4):1181–1190. doi: 10.3233/JAD-200083. [DOI] [PubMed] [Google Scholar]










