Abstract
心电监测在心血管疾病诊断、预防、康复中具有重要的临床价值。随着物联网、大数据、云计算、人工智能(AI)等科技的快速发展,穿戴式心电正扮演着越来越重要的角色。伴随人口老龄化进程加剧,心血管病防治模式升级愈发紧迫,利用AI技术辅助临床解析长程心电进而提高心血管病早期检测和风险预警能力,成为智慧医疗领域的一个重要方向。穿戴式心电智能监测需要监测终端和云端的协同智能,同时医疗应用场景的明确有助于穿戴式心电监测的精准实施。本文首先总结了心电领域相关的AI技术研究和应用进展,然后通过三个案例阐述了穿戴式心电监测中AI计算如何与临床进行协同,最后探讨了心电AI研究的两个核心问题——AI技术的可靠性和价值,并展望了心电AI发展的机遇和未来挑战。
Keywords: 心电监测, 智慧医疗, 穿戴式心电, 人工智能
Abstract
Electrocardiogram (ECG) monitoring owns important clinical value in diagnosis, prevention and rehabilitation of cardiovascular disease (CVD). With the rapid development of Internet of Things (IoT), big data, cloud computing, artificial intelligence (AI) and other advanced technologies, wearable ECG is playing an increasingly important role. With the aging process of the population, it is more and more urgent to upgrade the diagnostic mode of CVD. Using AI technology to assist the clinical analysis of long-term ECGs, and thus to improve the ability of early detection and prediction of CVD has become an important direction. Intelligent wearable ECG monitoring needs the collaboration between edge and cloud computing. Meanwhile, the clarity of medical scene is conducive for the precise implementation of wearable ECG monitoring. This paper first summarized the progress of AI-related ECG studies and the current technical orientation. Then three cases were depicted to illustrate how the AI in wearable ECG cooperate with the clinic. Finally, we demonstrated the two core issues—the reliability and worth of AI-related ECG technology and prospected the future opportunities and challenges.
Keywords: Electrocardiogram monitoring, Smart medical, Wearable electrocardiogram, Artificial intelligence
0. 引言
世界卫生组织2021年发布的数据显示,全球每年约有1 790万人死于心血管疾病,占死亡总数的32%,排名第一[1]。《中国心血管健康与疾病报告2020》指出,我国心血管病患者已达3.3亿[2],老龄化进程的加速发展以及居民生活方式的变化,将进一步推高我国心血管病的发病率和死亡率,加重医疗资源的负担。在心血管疾病防控形势愈发严峻的当下,如何利用快速发展的人工智能(artificial intelligence,AI)技术,发挥医工交叉优势,提升疾病智能化诊疗和风险管控水平,特别是在新冠疫情等重大突发性公共卫生事件背景下,减轻医生负担,提高疾病防治效率,减少医疗资源浪费,已成为我国国民经济发展的重大战略课题[3]。
近年来,AI技术的发展对推进心电大数据信息挖掘和辅助诊断起到了重要作用。图1展示了自第一张心电图(electrocardiogram,ECG)采集之后,AI和心电采集设备的发展脉络,值得注意的是穿戴式心电监测设备,尤其是单导心电贴呈现井喷态势。伴随心电采集设备和监测场景的丰富,一些旧问题愈发明显,例如伪差和噪声干扰,同时新的应用场景也催生了针对心电分析的新需求,比如长程监测中抓取有效心电片段和异常捕捉、居家监测中对包括心电的多模态生理信号的融合等。本文首先概述了当前AI技术在心电辅助诊断领域的研究进展,而后从三个典型应用案例说明AI技术改变了穿戴式心电和临床的联动,最后对该领域尚待解决的问题进行剖析并展望穿戴式心电AI的发展趋势。
图 1.
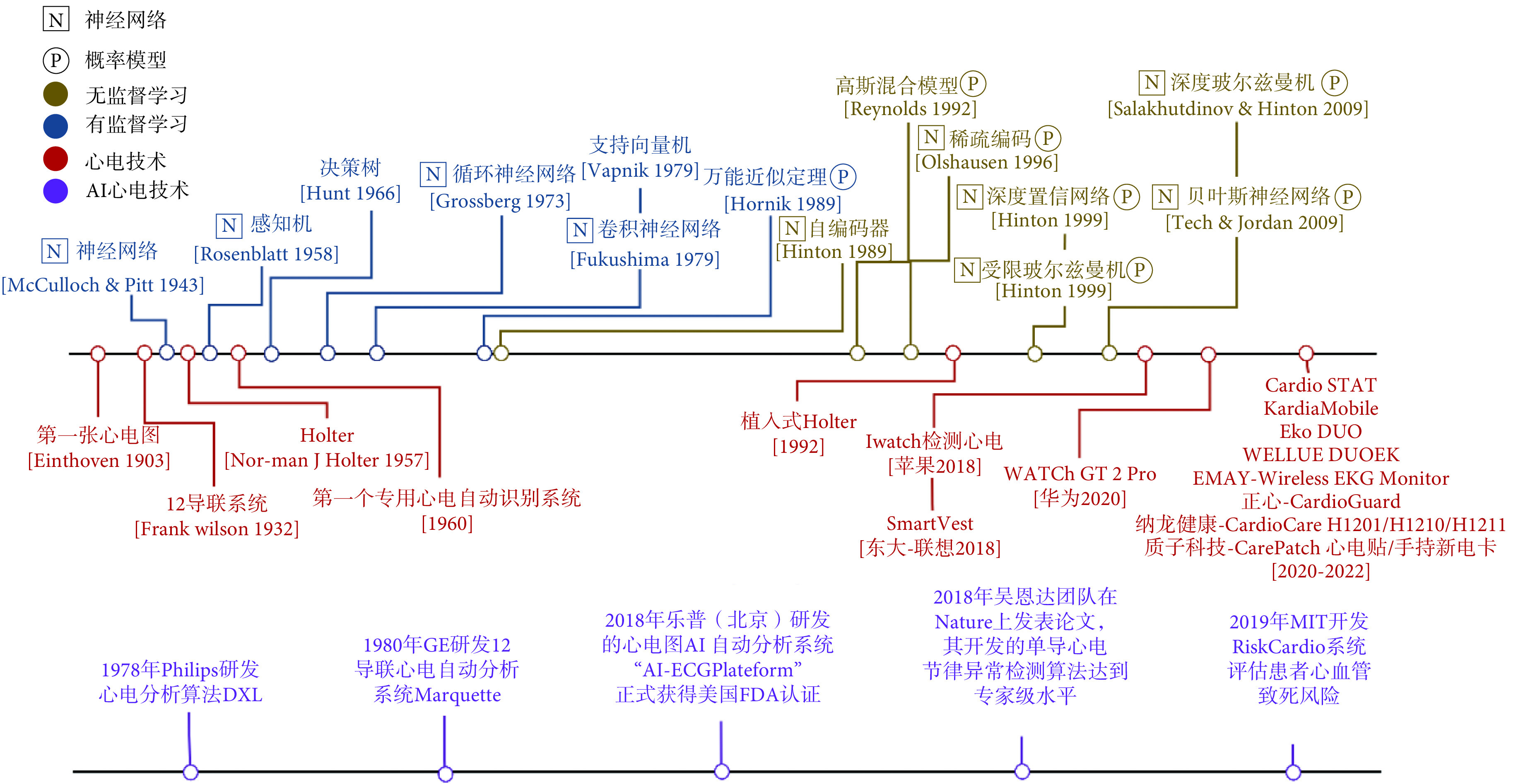
Development diagram for the technology and product of AI and ECG monitoring
AI与心电监测技术和产品发展脉络图
1. 心电领域的AI研究与应用
1.1. AI与心电的结合
自1956年达特茅斯会议首次提出至今,AI已经发展了60多年。发展早期由于算力等因素的限制,AI主要发展方向为专家系统[4],处理过程需首先根据先验知识与经验手动提取有效特征并根据特征进行决策判断。然而,这对专业知识要求较高且泛化性较差。随着算力等限制因素得到逐步改善,数据驱动的方式渐渐成为主流。此类算法本质是通过对足够大样本量的数据进行训练,自动提取有用特征信息进行决策判断。近年来,基于此策略的深度学习(deep learning,DL)风靡一时。例如,2012年Geoffrey Hinton团队[5]在ImageNet上首次使用DL进行图像分类并完胜其他团队。然而,DL算法仍然面临如模型可解释性不强、泛化性不高、对数据的质量与数量要求高等难点。对此,如今的研究也提出许多细支领域(可解释性学习、鲁棒学习、小样本与零样本学习等)来解决相应挑战。
AI技术很早就应用于临床心血管病检查。早期人们使用决策树、logistic回归等方法辅助医生决策,例如预测急性冠脉综合征患者临床预后的风险[6]。ECG可以反映心脏周期性电活动变化,被广泛应用到临床疾病诊断。Holter和穿戴式心电监护由于记录时间较长,心电数据量大,传统机器学习(machine learning,ML)处理时一般首先降低数据维度,提取少量信号特征作为诊断参考,同时大部分的心电特征需要人为标注。
近年来DL在图像和语音识别领域的成功为AI分析穿戴式心电提供了参考。2018年吴恩达教授团队基于53 549位患者的91 232条心电标注数据开发了一种针对单导心电的多种节律异常识别的DL模型[7]。之后从2019年至今,以苹果和华为智能手表采集的单导心电为基础来探索结合穿戴式生理信号监测的房颤(atrial fibrillation,AF)管理模式的研究相继出现[8-9],每一项研究都采用同步的植入式心电监测设备或Holter采集的心电作为AF事件发生标注的金标准。由此可见,作为数据驱动的算法,DL需要带有高质量标注信息的心电数据库作为支撑,因此心电数据库建设尤为重要。
1.2. 心电数据库的发展
在实际24 h动态监测应用中,ECG分析和诊断的准确性不够理想,关键在于绝大多数心电算法是基于MIT-BIH等临床静态数据库分析发展而来的,这些信号质量相对较高,但与真实动态监测环境情况不同。因此,建设面向真实日常监测场景的动态心电数据库,进行数据库节律和形态特征的标注和开源工作势在必行。
国外常见的动态心电数据库包括Sudden Cardiac Death Holter Database[8]、INCART和Icentia11K。国内东南大学刘澄玉教授团队依托中国生理信号挑战赛(China Physiological Signal Challenge,CPSC)建设了面向各个任务的心电数据库,如CPSC2019发布2 000条高难度QRS检测的动态心电数据[10];随后CPSC开始发布面向特定任务的精标动态心电数据库,如2020年发布的长程单导早搏检测数据库和2021年发布的二导联阵发性房颤(paroxysmal atrial fibrillation,PAF)定位数据库。表1汇总了可获取的开源动态心电数据库。
表 1. Summary of dynamic ECG database.
动态心电数据库汇总
1.3. 心电分析中的AI技术路线
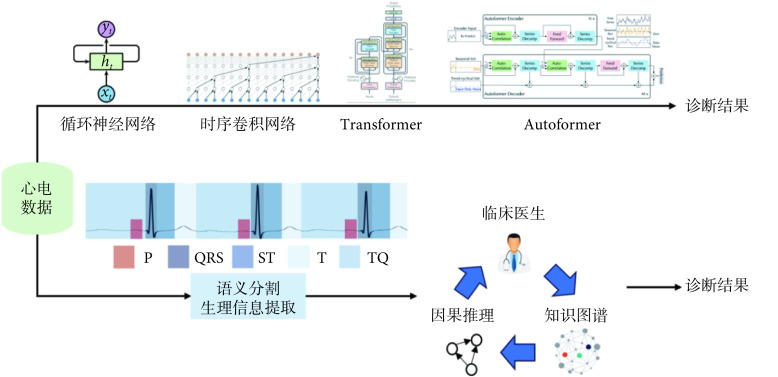
针对心电分类,AI研究有两条技术路线(见图2),一条是构建端到端DL模型,目前多数研究都遵循该路线。虽然技术核心是基于DL的有监督学习,但是研究者们会结合心电特性设计使用上下文信息的网络结构,并在模型中引入局部和全局特征的融合机制。不仅如此,人们开始意识到DL的瓶颈在心电分类任务中同样明显,比如数据的长尾分布问题、多标签问题、混淆数据带来的脏标签问题[11-12]以及分布外数据的检出问题等。同时,由于心电分类任务的临床属性,人们更希望在获取诊断结果的同时能回溯模型的判别依据,通过反卷积等技术反演跟踪深度网络内部对数据的高维表达,但这种高维表达目前还难以被直观理解。
图 2.
Two main technical routes of AI research for ECG analysis at present
目前心电AI研究的两条主要技术路线
第二条路线是先对心电做语义解析,量化心电特征,再以心电特征为基础开发自动化诊断方法。这类方法的本质是将临床中医生对心电的解析任务用自动化的方式复现,让医生在审查心电自动化诊断结果的同时,回溯作为高级诊断任务依据的低级特征。解析的第一步是对心电进行语义分割。如图2所示,一个完整心拍被分割为五部分特征:P波、QRS波群、ST段、T波和TP段。对于穿戴式心电,由于噪声干扰和个体变异等影响,精准的特征分割极具挑战。传统方法立足于对心电子波形态特征和节律信息的提取,并设定规则定位子波。近两年的研究证明,基于规则的方法对复杂心电解析的性能远远低于有监督学习的方法。以基础的QRS波群定位为例,相比基于规则的方法,基于DL模型的算法性能提升接近一倍[13]。
语义分割是解析心电其他特征的基础,即便获取绝大多数特征,如何推理建立异常映射模型依然存在挑战。此类工作可以参考医学专家系统,该系统通过建立临床知识图谱,实现患者个体化分析。拓展到心电自动化分析,我们首先基于心电信号分割结果提取临床医生观察ECG的经验信息,比如PR间期、QRS波群形态、ST-T段形态、P波持续时间、电轴偏转等,并进一步与患者性别、年龄、身高、体重等信息共同组成患者个体档案信息。通过使用注意力机制[14]、因果网络[15]等方法,关联机器自动学习特征与疾病,建立医务人员能理解的推理模型。
2. AI改变穿戴式心电与临床的协作
如何串联院内外生理监测一直是临床重点关注的领域,从术前追踪到术后随访,从慢病管理到异常捕捉,穿戴式设备解放了临床监测患者的时间和场景约束。尤其是当前处于后疫情时代,为了避免院内发生聚集性感染并释放医疗资源,国家正在引导对患者在居家或日常生活场景下实施易操作、低成本的生理数据监测。穿戴式设备采集的生理数据是长程且冗余的,且易受到强噪声干扰,单纯依靠人工捕捉穿戴式设备数据异常是不可实现的,只能依靠自动化算法。AI技术则是目前分析穿戴式数据的研究重点,以数据为驱动的DL方法可以充分利用穿戴式设备提供的时序大数据。强噪声干扰在过去需要挖掘和建模目标信号的特性才能避免,并且有性能上限,而对于AI技术,合理利用噪声有利于模型自学习到目标数据的本质属性[16]。
心电监测是心血管疾病筛查和心肺慢病管理的必要环节。穿戴式心电分析算法的发展可以分为两个角度:一是垂直应用穿戴式心电筛查心血管疾病,最典型的临床应用是针对AF患者的术后随访和预后管理;二是将心电视为穿戴式监测的一环,将之与其他同步生理信号融合分析,横向扩展其他监测领域。由于心电采集成本低且直接反映心脏电生理活动,与其他生理信号如呼吸、血氧、心音等存在强关联,因此心电采集与其他传感集合输出的同步多模生理数据可以更全面地反映被测人的心肺循环、运动耐力和心脑血管状态。本章节选取了三个典型场景描述穿戴式心电及AI技术在临床中的作用,分别为AF管理、CHF干预和睡眠监测。
2.1. 房颤管理
作为常见心率失常现象,AF具有广泛的临床表现,常与心力衰竭(congestive heart failure,CHF)、脑卒中等疾病相关。目前AI管理AF主要体现在AF复发和相关疾病得病率预测两方面,可通过心脏植入式电气设备或穿戴式无创心电监测设备监测AF患者,其中穿戴式设备可以反馈AF持续时间和发生次数,是一种廉价、无创的AF管理方法。
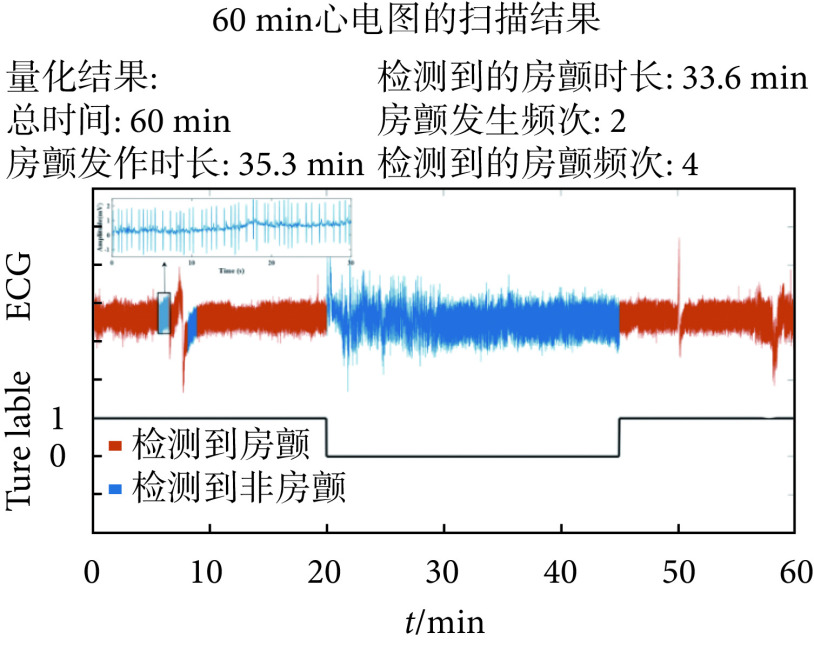
AF筛查是目前大部分穿戴式心电监测设备的重点功能模块,华为和苹果公司针对智能手表中的心电甚至脉搏波监测都做了AF检测的拓展,因此也涌现了大量基于穿戴式心电的AF筛查研究。其中由于PAF隐匿性高,准确检测PAF对于AF的治疗方案至关重要。目前有很多成熟的AF识别算法,如基于P波形态信息和基于RR间期节律信息判断AF[17],以及基于DL的AF识别算法[18]。Babaeizadeh等[19]使用P波和RR间期特征训练了一个决策树分类器,实现了92%的灵敏度和97%的阳性预测率。Mohebbi等[20]提出了一种基于支持向量机(support vector machine,SVM)、光谱特征和非线性特征的AF检测器,实现了96.30%的灵敏度和92.86%的阳性预测率。在日常心电监测环境下,建立一个有效的AF负荷量化模型需要构建穿戴式AF心电数据库并采用先进的ML方法[21],能够在长程穿戴式心电数据中准确评估AF类型及其严重程度,用于AF患者术前评估和术后连续跟踪,从而缓解医生在AF管理中提取有效临床信息的负担。图3展示了如何在长程单导心电中利用AF检测来评估一个PAF患者的AF负荷。
图 3.
AF burden assessment using AF localization in long-term single-lead ECGs of a patient with paroxysmal AF
阵发性房颤患者长程单导心电数据中基于房颤定位的房颤负荷评估
影响AF复发率的原因主要是手术方案和患病程度[22]。在传统静态参数评分模型基础上引入动态心电监测,连续监测AF负荷指标,建立融合静态统计学信息和动态心电信息的AF复发风险评估模型,可充分利用长程心电数据信息而不仅是临床参数,对临床AF术后监管意义重大。
另外,通过AI技术可以分析AF相关疾病的患病风险。研究发现PAF患者脑卒中得病率高于非阵发性患者,低于持续性和永久性患者[23],因此通过AI模型对AF事件进行识别和定位可用来评估PAF患者的脑卒中患病风险,有效降低脑卒中漏诊率和误报率[24]。如表2[13, 16, 21, 25-27]所示,包含或针对AF的心电数据库不断被公开,这是AI管理AF的数据基础,通过模式识别技术以及早期诊断干预,有可能更好地对临床AF等慢性病实施个性化治疗。
表 2. Summary of AF ECG database.
房颤心电数据库汇总
2.2. 心衰干预
目前全球有超过6 000万充血性CHF患者,即慢性CHF,多数由于心室的泵血和充盈能力不足导致。大多数CHF患者有心脏病病史,针对病因治疗将显著改善CHF预后,其中收缩性CHF常见病因是冠心病,积极重建血运可防止CHF恶化;舒张性CHF常见病因是高血压,控制血压极其重要,否则可能诱发急性CHF。由于慢性CHF需要长期管理,因此治疗CHF的目标不仅要改善症状,还要针对心肌重构的机制,延缓和防止心肌重构的发展,降低CHF的住院率和死亡率。
常见的CHF筛查手段包括超声心动图、心脏磁共振和管状血管造影术,此类方法往往操作复杂,不适用于慢性CHF患者的居家管理。目前的研究提出多种基于ECG的CHF检测和分类算法。Kamath[28]和Acharya等[29]分别使用去趋势波动分析和11层卷积神经网络(convolutional neural network,CNN)来区分正常人和CHF患者的ECG,并在PhysioNet数据库上进行测试,测试了3 510个正常窦性心律片段和同等数量的CHF片段,分别达到了98.2%和98.97%的准确率。Darmawahyuni等[30]建立了基于长短期记忆递归神经网络(long short term memory,LSTM)的循环神经网络(recurrent neural networks,RNN)模型,在包含来自290名患者的549个记录的PTB数据库上进行测试,识别CHF的准确率高达99.86%。虽然去趋势波动分析能通过直观的方式评估心电的内在复杂性,包括提取心电的非线性和稳定性特征,但在性能上很难超越可以提取高维特征并能够捕获信号长程时间依赖性特征的CNN和RNN模型。在实际基于ECG的CHF筛查任务中,可被临床接受的生理指征更重要,而目前的DL模型无法提供,因此临床应用中更需要一个综合生理信号指标提取和深度学习的方法。
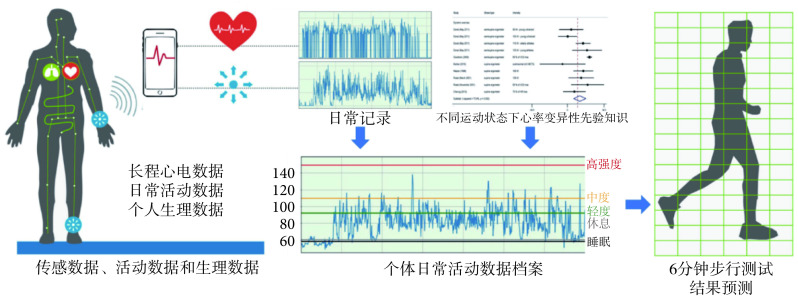
慢性CHF患者的临床症状之一为运动不耐受。研究证明,在全身运动中,心输出量和氧气输送对CHF患者的运动耐受性有显著影响。6分钟步行测试被用来确定治疗干预的效果和预后。尽管该测试容易进行,但仍需专业设备和人士进行分析,使用可穿戴式检测设备可提供方便且持续的监测,从而更容易区分病情恶化和病情良好的患者(见图4)。研究发现,对CHF患者进行远程监测可以帮助减少因计划外心血管原因导致的住院率和死亡率[31]。
图 4.
Prediction of the results of 6-minute walk test by wearable ECGs combined with activity and physiological data
通过穿戴式心电数据、活动数据和个人生理数据预测6分钟步行测试结果
穿戴式心电具有互联性,可以产生和汇集多个传感器的数据,为AI在CHF干预方面提供新的诊断、分类、风险分层和疾病管理见解,以提供更个性化和更具成本效益的治疗方案。例如,合并来自多个传感器的数据流,并使用来自ML模型的决策支持,通过不断训练和迭代,以超出人类准确度的水平来调整CHF治疗方案中利尿剂的剂量。
2.3. 睡眠监测
睡眠障碍已成为影响人们正常生活的重要因素之一。长期的睡眠障碍不仅会影响人体的各个主要系统,还会引发肥胖、糖尿病和神经精神疾病等医学问题。因此,对睡眠结构进行精细化分析并评估睡眠状态非常重要。
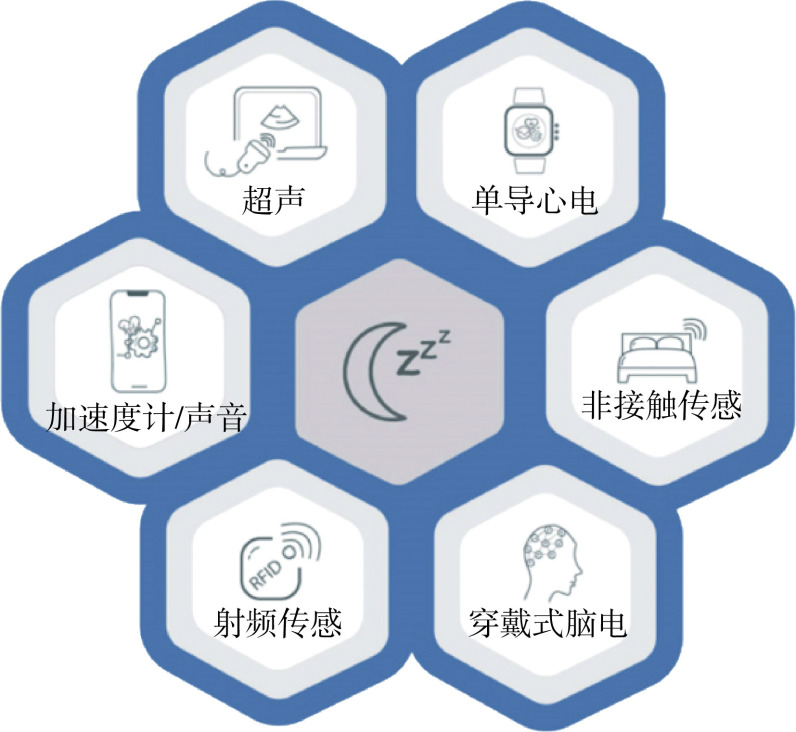
多导睡眠图(polysomnography,PSG)是目前睡眠监测的“金标准”,包含同步脑电、眼电、心电、呼吸和血氧信号,可以用来进行睡眠分期并精细分析睡眠状态。采集该信号时需要专业睡眠医师在特定环境下对被测人进行操作,并严格按照Rechtschaffen & Kales睡眠分期规则记录与分析。对比PSG,穿戴式生理信号监测佩戴舒适,且能做到日常监测,可还原睡眠受试者的真实睡眠状态。相应的,一些采集代价高昂的生理传感(脑电和眼电)会被丢弃,但是心电、呼吸和血氧等生理信号被集成进穿戴式设备中,同时由于穿戴和居家属性,加速度计和声音等数据也被用来作为综合睡眠分析的补充[32]。
在睡眠监测场景下,穿戴式心电已成为多模态生理监测的一环(见图5),虽然也存在仅利用心电数据做睡眠监测的研究,但仅使用心电数据会造成睡眠异常事件检测功能的缺失。与之相反,基于穿戴式设备采集的多模态生理信号并结合其他生理特征为在长期睡眠监测中捕捉异常信号提供了一种低成本、易使用的方案。基于此,自动检测睡眠状态及时间的LSTM递归神经网络[33],以及通过结合多模式多视角的摄像机网络和隐藏班马尔可夫模型分析患者姿势和量化姿势运动动力学的MASH框架被提出。而针对睡眠呼吸暂停诊断,心电、血氧、鼻气流的结合也使诊断变得更简单方便。
图 5.
Multi-modal sensing in sleep monitoring
睡眠监测中的多模数据传感
作为特殊的RNN网络,LSTM网络能捕捉多模态信号的长期依赖关系和动态变化,同时具有较强的泛化能力和鲁棒性,每个LSTM层对应一个输入信号并学习该信号的时序特征,输出一个隐藏状态向量。不同层的隐藏状态向量进行拼接或加权平均得到一个包含多模态信号共同信息的综合特征向量,再使用全连接层或分类器处理得到最终决策结果,如睡眠质量评估或者睡眠阶段划分等。
MASH框架是基于服务网格的微服务平台,能实现多模态信号处理任务的分布式部署,具有较高的可靠性和可观测性。首先,将不同类型的信号分配给不同微服务,每个微服务可使用不同的编程语言和部署方式来处理信号,如特征提取等;接着利用框架提供的服务网格功能,实现微服务之间的通信和协作;再利用框架提供的服务治理功能,实现微服务之间的安全访问和权限控制;最后,利用框架提供的监控能力实现微服务之间的数据采集和分析。
针对睡眠监测,AI首先可以帮助医生进行睡眠障碍诊断[34]。这是通过将收集的传感器数据转换为预定义知识(如类别标签)来实现的,为手动睡眠阶段评分提供一种廉价且客观的替代方案;其次,AI可以通过自动分析功能从可穿戴设备和移动应用程序收集的数据提供健康生活方式建议,使临床医生能够跟踪人们在家中睡眠模式的变化;或者与智能物联配合,如通过调节灯光和温度为患者提供更好的睡眠质量。
3. 穿戴式心电终端侧和云端侧的AI
如何针对心电采用合适的信号处理方法并开发相应的特征解析和辅助诊断算法只是心电AI的一个方面,AI在某个领域的应用还需解决如何在垂直方向与特定行业相结合。对于心电监测,特别是穿戴式心电监测,终端侧智能和云端侧智能的开发看重的是分析时效与海量数据处理。在监测终端,当异常事件发生时,特别是急性心肌梗死等危险事件发生时,AI需要快速反馈响应、与医疗机构交互和确诊异常事件,辅助医生实施有效干预。在监测云端,海量数据存储和处理也是一大挑战。若按500 Hz采样率,平均每人每日会产生大约4 000万个采样数据,5G时代的到来有助于解决大数据实时传输问题,但现有的云端服务器在性能上并不足以支撑大量人群监测并发产生的海量心电数据。为了解决问题,需要终端侧智能和云端侧智能的有效协同(如图6所示)。
图 6.
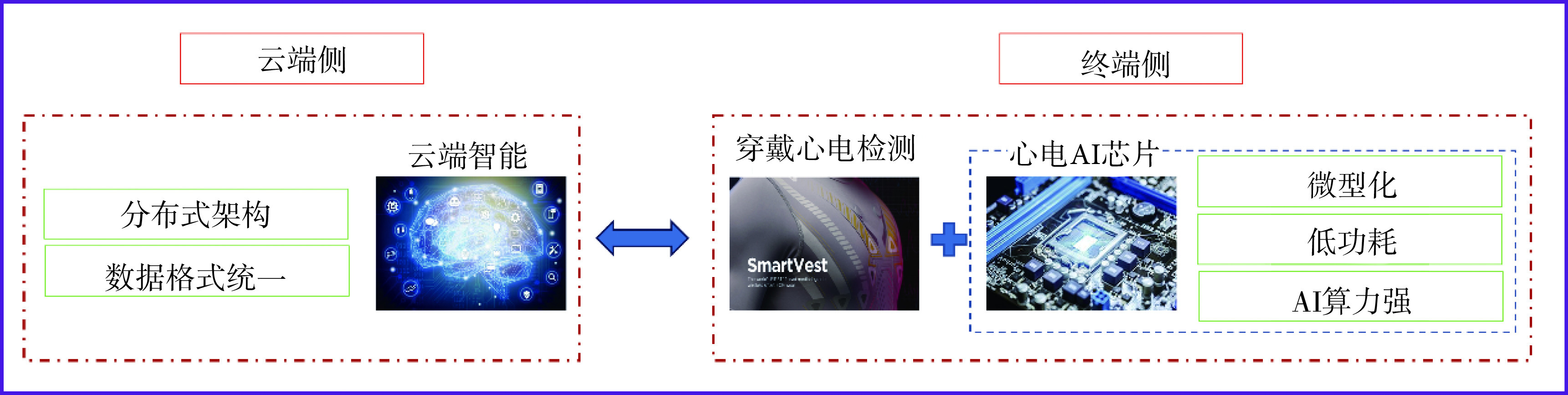
Collaborative framework for the edge and cloud intelligence in wearable ECG monitoring
穿戴式心电终端侧智能与云端侧智能协同框架
终端侧技术重点是心电AI芯片的研究。长程心电监测要求终端硬件电路微型化、低功耗并具备实时数据分析能力,因此发展心电AI芯片是必然趋势。目前对于通用AI芯片研究,Nvidia公司在Tensor Core基础上,推出Jetson系列嵌入式AI芯片。Intel公司的Nervana系列神经网络处理器、Google公司的TPU、Apple公司基于ARM架构的仿生芯片,以及华为公司的麒麟芯片都集成了AI处理功能。可以预见,随着穿戴式技术的发展,未来大量的心电监测需求将从云端转向终端,而AI芯片、物联网和5G技术的发展均为终端的心电AI提供了更多技术条件。
云端侧技术重点是时序数据AI处理模型和与模型适配的架构协议。数据从性质上分为静态结构化数据(影像、生化数据)和动态时序数据(多数生理数据)。目前云端AI计算架构基本为分布式架构,包括以Python为基础的前端描述模型、具备异构计算能力的后端引擎以及支持自动优化的计算框架等。对于云端心电AI,需要考虑数据存储格式和数据AI模型设计。心电云作为医疗服务的专有云,需要多个医院共享心电数据,但各医院信息化软件和数据存储格式不统一,这需要厂家和相关部门的顶层设计引导。云端心电处理模型为时序模型,所以云端需要采用对于时序模型(尤其是伪周期生理数据模型)具有兼容性的AI框架,如Google的TensorFlow、Meta AI的PyTorch和MXNet以及百度的PaddlePaddle等。
4. 心电AI研究核心问题思考
4.1. 心电AI的可靠性思考
与一般的消费级应用不同,医疗应用强调可靠性,尤其是针对病患的强医疗应用,如术后心电监测、日常自检筛查等。如果疾病风险没有被及时发现,可能会延误病情,甚至带来生命危险。以人脸识别为例,人脸识别技术基于上亿人脸数据库不断积累和相关算法的不断完善,被广泛应用到身份验证场景,包括支付、验票等,然而使用三维打印的脸模欺骗支付验证等情况屡见不鲜。因此,在实际应用中,人脸识别技术只是作为风险控制的一个环节,即使欺骗发生,还有其他风险控制方案如金额转移上限设定能及时止损。任何AI技术应用并不仅仅是技术本身,还涉及相关多个层面的风险控制问题。
事实上,针对AI模型的对抗攻击已经在包括医学影像诊断等多个领域被证实会干扰最终结果[35]。如诊断ECG时,在不改变病理性异常的前提下,只需要攻击心电原始信号就能让原来被准确识别为AF的信号被识别为正常信号[36]。
由于医疗实践的复杂性,医疗技术均难以实现100%精度。对医生和患者而言,一项医疗技术的可靠性并不仅取决于检测精度是否达到100%,而在于风险是否可控。即使是有经验的医生,当参考ECG诊断患者心脑血管疾病时也需结合患者各项临床指标进行确认。因此,规避风险的关键在于增加心电AI应用的中间环节,将AI分析结果作为医生疾病判断的辅助信息。在致力于提升心电AI诊断模型精度的同时,注重输出结果置信度的评估,基于不确定性估计和可解释AI方法,用临床可接受的证据“告诉”医生AI分析的结果是否可信以及为什么可信[37]。
由于AI模型的特征表达与医生经验不同,未来随着算法发展,可以将AI对心电数据的高维表达映射到一般性临床知识经验层面,并由此发现经验之外的知识。借助AI做到这点非常关键,不同于人的有限注意力,AI算法可以从冗余的长程穿戴式心电信息中捕获细节的变化和异常,而这些可能不易被临床医生察觉或需要消耗大量的时间进行度量。以P波离散度分析为例,如果AI算法能精确地检测出P波时程,就能快速计算P波离散度,而不需要人工逐拍手动标记,从而有效预测PAF以及评价抗房性心律失常药物。在特征精确提取和有效ML基础上,配合这些经过临床验证的因果关联信息,会大大提高心血管疾病的早期检测精度。
4.2. 心电AI的价值思考
对于临床医生而言,心电AI技术可从疾病筛查、诊断和跟踪三个层面提供帮助。从筛查层面,AI技术可以帮助医生从大量慢性心血管病患者中筛选出高危人群,将有限精力集中到有需求的患者身上。从诊断层面,AI技术显然可以大大提高医生阅图速度,提升诊断效率。从跟踪层面,医生可以借助长程心电监测和AI分析及时了解药物效果或术后康复情况。
对于患者而言,目前以疾病为中心的医疗模式很难兼顾个体化需求,在以健康为中心的新医疗模式下,穿戴式心电监测中的AI技术提高了院外心电监测的可靠性和效率。长时心电监测对查找病因、跟踪患者治疗情况这些强医疗应用场景具有不可替代的价值。以对昏厥病因的筛查为例,多项循证医学结果显示,在昏厥病因的多种检测方法中,植入式Holter的阳性检测率名列榜首[38]。随着长程有效的穿戴式心电监测和筛查技术的发展,类似昏厥的寻因和跟踪成本会大幅降低。但是,目前心电AI检测的功能和准确性有限,大部分情况仍需医生通过肉眼回看记录心电波形进行确诊。受信号质量的影响,传统QRS波定位方法不足以支撑长时精确的RR间期特征输出。而AI算法可以帮助提升心电特征定位和异常事件判断的精度,尤其是针对被噪声干扰的低质量穿戴心电信号。
此外,心电AI技术的发展和进步还需要一个相对成熟的临床验证模式,需要考虑模型输出对医生进行医学介入的影响。举例来说,如果AI算法过分强调敏感性,那么在临床诊断中,过多的假阳性报告势必引起医生对患者真实异常的处理迟钝化。因此,建立一个科学合理的验证机制非常重要,包括如何针对不同疾病/异常类型设计不同随机对照试验。将来,懂AI的临床医生和/或能够结合临床的AI专家会成为智慧医疗研究领域的重要和稀缺资源。
5. 机遇和挑战
2019年11月,美国心脏学会科学会议公布了一项由斯坦福大学医学院和纽约大学医学院领衔的“医疗和侵入性方法的健康效果国际比较研究”成果,研究结果表明,对于大部分心脏病患者而言,仅接受药物治疗和生活方式建议,并不比那些接受侵入性手术(如支架或搭桥手术)的患者具有更高的心脏病发作或死亡风险[39]。这项研究表明了现阶段心血管病防治的一个重要问题:临床医生应如何根据患者状况科学合理地制定治疗方案?长程心电监测加心电AI无疑为准确辅助医生决策提供了重要的参考价值。
当前加速的社会老龄化进程加剧了心血管病等慢病的监控压力,加上原本医疗资源的紧张,迫切需要AI技术的发展来减轻医疗压力,同时国民个体健康意识的提升也成为相关医疗AI技术的需求源动力,这些都为心电AI技术的发展提供了良好的机遇。但是医疗问题是严肃的,无论是心电AI技术还是其他临床AI技术,都只有在经过严格临床验证且普遍被医生接受的情况下,才能真正在医疗场景中发挥价值。穿戴式心电中AI计算的可靠性、可解释性和长程连续数据价值的挖掘,是未来研究突破的重点。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:王星尧负责全文内容编排和撰写,李茜负责全文材料整理和格式调整,马彩云、张铄和林钰洁分别负责房颤、心电AI计算和心衰材料整理,李建清和刘澄玉负责论文指导工作。
Funding Statement
国家重点研发计划(2019YFE0113800);国家自然科学基金项目(62171123,62071241,6211101445)
References
- 1.WHO. Cardiovascular diseases (CVDs). Geneva: WHO, 2021.
- 2.中国心血管健康与疾病报告编写组 中国心血管健康与疾病报告2020概要. 中国循环杂志. 2021;36(6):521–545. doi: 10.3969/j.issn.1000-3614.2021.06.001. [DOI] [Google Scholar]
- 3.刘澄玉, 杨美程, 邸佳楠, 等 穿戴式心电: 发展历程、核心技术与未来挑战. 中国生物医学工程学报. 2019;38(6):641–652. doi: 10.3969/j.issn.0258-8021.2019.06.001. [DOI] [Google Scholar]
- 4.Tsumoto S Automated extraction of medical expert system rules from clinical databases based on rough set theory. Inf Sci. 1998;112:67–84. doi: 10.1016/S0020-0255(98)10021-X. [DOI] [Google Scholar]
- 5.Krizhevsky A, Sutskever I, Hinton G E ImageNet classification with deep convolutional neural networks. Commun ACM. 2012;60:84–90. [Google Scholar]
- 6.Pollack C J, Sites F D, Shofer F S, et al Application of the TIMI risk score for unstable angina and non-ST elevation acute coronary syndrome to an unselected emergency department chest pain population. Acad Emerg Med. 2006;13(1):13–18. doi: 10.1197/j.aem.2005.06.031. [DOI] [PubMed] [Google Scholar]
- 7.Hannun A Y, Rajpurkar P, Haghpanahi M, et al Cardiologist-level arrhythmia detection and classification in ambulatory electrocardiograms using a deep neural network. Nat Med. 2019;25(1):65–69. doi: 10.1038/s41591-018-0268-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Guo Y, Wang H, Zhang H, et al Photoplethysmography-based machine learning approaches for atrial fibrillation prediction: a report from the huawei heart study. JACC Asia. 2021;1(3):399–408. doi: 10.1016/j.jacasi.2021.09.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Zhou X, Wen J, Wen Y, et al Enhanced P wave recognition through ra-xiphoidal lead by Huawei watch ECG recording. Heart Rhythm. 2022;19(5):199–200. [Google Scholar]
- 10.Gao H, Liu C, Wang X, et al An open-access ECG database for algorithm evaluation of QRS detection and heart rate estimation. J Med Imag Health Inform. 2019;9(9):1853–1858. doi: 10.1166/jmihi.2019.2800. [DOI] [Google Scholar]
- 11.Zhou K, Liu Z, Qiao Y, et al Domain generalization: A survey. IEEE Trans Pattern Anal Mach Intell. 2023;45(4):4396–4415. doi: 10.1109/TPAMI.2022.3195549. [DOI] [PubMed] [Google Scholar]
- 12.Zhang S, Li Y, Wang X, et al Label decoupling strategy for 12-lead ECG classification. Knowl-Based Syst. 2023;263:110298. doi: 10.1016/j.knosys.2023.110298. [DOI] [Google Scholar]
- 13.Liu F, Liu C, Zhao L, et al An open access database for evaluating the algorithms of electrocardiogram rhythm and morphology abnormality detection. J Med Imag Health Inform. 2018;8(7):1368–1373. doi: 10.1166/jmihi.2018.2442. [DOI] [Google Scholar]
- 14.Chu Q, Ouyang W, Li H, et al. Online multi-object tracking using CNN-based single object tracker with spatial-temporal attention mechanism// 2017 IEEE International Conference on Computer Vision (ICCV). Venice: IEEE, 2017: 4846-4855.
- 15.Jiang Y, Luo C, Li X, et al Progressive reduction in gray matter in patients with schizophrenia assessed with MR imaging by using causal network analysis. Radiology. 2018;287(2):633–642. doi: 10.1148/radiol.2017171832. [DOI] [PubMed] [Google Scholar]
- 16.He K, Chen X, Xie S, et al. Masked autoencoders are scalable vision learners// 2022 IEEE/CVF Conference on Computer Vision and Pattern Recognition (CVPR). New Orleans: IEEE, 2022: 15979-15988.
- 17.Liu C, Oster J, Reinertsen E, et al A comparison of entropy approaches for AF discrimination. Physiol Meas. 2018;39(7):074002. doi: 10.1088/1361-6579/aacc48. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ma C, Wei S, Chen T, et al Integration of results from convolutional neural network in a support vector machine for the detection of atrial fibrillation. IEEE Trans Instrum Meas. 2021;70:2504610. [Google Scholar]
- 19.Babaeizadeh S, Gregg R E, Helfenbein E D, et al Improvements in atrial fibrillation detection for real-time monitoring. J Electrocardiol. 2009;42(6):522–526. doi: 10.1016/j.jelectrocard.2009.06.006. [DOI] [PubMed] [Google Scholar]
- 20.Mohebbi M, Ghassemian H Prediction of paroxysmal atrial fibrillation based on non-linear analysis and spectrum and bispectrum features of the heart rate variability signal. Comput Meth Prog Bio. 2012;105(1):40–49. doi: 10.1016/j.cmpb.2010.07.011. [DOI] [PubMed] [Google Scholar]
- 21.Ma C, Liu C, Wang X, et al A multistep paroxysmal atrial fibrillation scanning strategy in long-term ECGs. IEEE Trans Instrum Meas. 2022;71:1–10. [Google Scholar]
- 22.Efremidis M, Letsas K P, Georgopoulos S, et al Safety, long-term outcomes and predictors of recurrence following a single catheter ablation procedure for atrial fibrillation. Acta Cardiol. 2019;74(4):319–324. doi: 10.1080/00015385.2018.1494114. [DOI] [PubMed] [Google Scholar]
- 23.Boriani G, Pettorelli D Atrial fibrillation burden and atrial fibrillation type: clinical significance and impact on the risk of stroke and decision making for long-term anticoagulation. Vasc Pharmacol. 2016;83:26–35. doi: 10.1016/j.vph.2016.03.006. [DOI] [PubMed] [Google Scholar]
- 24.Elkin P L, Mullin S, MardekiaN J, et al Using artificial intelligence with natural language processing to combine electronic health record’s structured and free text data to identify nonvalvular atrial fibrillation to decrease strokes and death: Evaluation and case-control study. J Med Internet Res. 2021;23(11):e28946. doi: 10.2196/28946. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Behar J A, Rosenberg A A, Weiser-Bitoun I, et al PhysioZoo: a novel open access platform for heart rate variability analysis of mammalian electrocardiographic data. Front Physiol. 2018;9:1390. doi: 10.3389/fphys.2018.01390. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Attia Z I, Harmon D M, Behr E R, et al Application of artificial intelligence to the electrocardiogram. Eur Heart J. 2021;42(46):4717–4730. doi: 10.1093/eurheartj/ehab649. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Zheng J, Zhang J, Danioko S, et al A 12-lead electrocardiogram database for arrhythmia research covering more than 10,000 patients. Sci Data. 2020;7(1):48. doi: 10.1038/s41597-020-0386-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Kamath C A new approach to detect congestive heart failure using detrended fluctuation analysis of electrocardiogram signals. J Eng Sci Technol. 2015;10(2):145–159. [Google Scholar]
- 29.Acharya U R, Fujita H, Oh S L, et al Deep convolutional neural network for the automated diagnosis of congestive heart failure using ECG signals. Appl Intell. 2019;49(1):16–27. doi: 10.1007/s10489-018-1179-1. [DOI] [Google Scholar]
- 30.Darmawahyuni A, Nurmaini S, Yuwandini M, et al Congestive heart failure waveform classification based on short time-step analysis with recurrent network. Inform Med Unlocked. 2020;21:100441. doi: 10.1016/j.imu.2020.100441. [DOI] [Google Scholar]
- 31.Schubert C, Archer G, Zelis J M, et al Wearable devices can predict the outcome of standardized 6-minute walk tests in heart disease. NPJ Digit Med. 2020;3(1):1–9. doi: 10.1038/s41746-019-0211-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lee S H, Kim Y-S, Yeo M-K, et al Fully portable continuous real-time auscultation with a soft wearable stethoscope designed for automated disease diagnosis. Sci Adv. 2022;8(21):eabo5867. doi: 10.1126/sciadv.abo5867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Sano A, Chen W, Lopez-Martinez D, et al Multimodal ambulatory sleep detection using LSTM recurrent neural networks. IEEE J Biomed Health Inform. 2018;23(4):1607–1617. doi: 10.1109/JBHI.2018.2867619. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Shahin M, Ahmed B, Hamida S T-B, et al Deep learning and insomnia: assisting clinicians with their diagnosis. IEEE J Biomed Health Inform. 2017;21(6):1546–1553. doi: 10.1109/JBHI.2017.2650199. [DOI] [PubMed] [Google Scholar]
- 35.Ghaffari Laleh N, Truhn D, Veldhuizen G P, et al Adversarial attacks and adversarial robustness in computational pathology. Nat Commun. 2022;13(1):5711. doi: 10.1038/s41467-022-33266-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Han X, Hu Y, Foschini L, et al Deep learning models for electrocardiograms are susceptible to adversarial attack. Nat Med. 2020;26(3):360–363. doi: 10.1038/s41591-020-0791-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Vranken J F, van de Leur R R, Gupta D K, et al Uncertainty estimation for deep learning-based automated analysis of 12-lead electrocardiograms. Eur Heart J-Digit Health. 2021;2(3):401–415. doi: 10.1093/ehjdh/ztab045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Sivakumaran S, Krahn A D, Klein G J, et al A prospective randomized comparison of loop recorders versus Holter monitors in patients with syncope or presyncope. Am J Med. 2003;115(1):1–5. doi: 10.1016/S0002-9343(03)00233-X. [DOI] [PubMed] [Google Scholar]
- 39.Maron D J, Hochman J S, O'Brien S M, et al International study of comparative health effectiveness with medical and invasive approaches (ISCHEMIA) trial: Rationale and design. Am Heart J. 2018;201:124–135. doi: 10.1016/j.ahj.2018.04.011. [DOI] [PMC free article] [PubMed] [Google Scholar]