Abstract
脓毒症患者中性粒细胞(PMN)的趋化迁移能力减弱,导致细菌清除率下降,加速了脓毒症病程的发展。对脓毒症患者PMN的趋化性进行量化,有助于表征脓毒症患者的免疫健康状况。微流控芯片具有试剂消耗低、近生理环境、迁移过程可视化等优点,被广泛用于细胞趋化性分析。目前,采用微流控芯片进行PMN趋化性的研究,主要受限于细胞分离操作繁琐和微流控芯片通量低。本文首先设计了一款惯性细胞分选芯片,利用白细胞(主要包括粒细胞、淋巴细胞和单核细胞)和红细胞在螺旋微通道中运动时,会受到不同大小惯性力和迪恩阻力的作用,而移动至螺旋微通道的不同位置聚焦这一基本原理,实现两大类细胞无标记分离。随后,本文设计了多通道细胞迁移芯片,构建了微流控PMN惯性无标记分选及趋化性分析平台,惯性细胞分选芯片分离出白细胞群后注入多通道细胞迁移芯片,可在15 min内完成PMN对趋化肽(fMLP)的趋化性测试。其余细胞,如单核细胞运动缓慢、淋巴细胞需要预先激活与增殖培养,而不会发生明显趋化迁移现象。本研究招募的脓毒症患者(n = 6)和健康志愿者(n = 3)测试结果表明,脓毒症患者PMN的趋化性指数(CI)和迁移速度(v)明显弱于健康志愿者。综上,本文构建的微流控PMN惯性无标记分选及趋化性分析平台可以作为细胞无标记分选及迁移研究的新工具。
Keywords: 脓毒症, 微流控芯片, 中性粒细胞, 分选, 趋化性
Abstract
Reduced chemotactic migration of polymorphonuclear neutrophil (PMN) in sepsis patients leads to decreased bacterial clearance and accelerates the progression of sepsis disease. Quantification of PMN chemotaxis in sepsis patients can help characterize the immune health of sepsis patients. Microfluidic microarrays have been widely used for cell chemotaxis analysis because of the advantages of low reagent consumption, near-physiological environment, and visualization of the migration process. Currently, the study of PMN chemotaxis using microfluidic chips is mainly limited by the cumbersome cell separation operation and low throughput of microfluidic chips. In this paper, we first designed an inertial cell sorting chip to achieve label-free separation of the two major cell types by using the basic principle that leukocytes (mainly granulocytes, lymphocytes and monocytes) and erythrocytes move to different positions of the spiral microchannel when they move in the spiral microchannel under different strength of inertial force and Dean's resistance. Subsequently, in this paper, we designed a multi-channel cell migration chip and constructed a microfluidic PMN inertial label-free sorting and chemotaxis analysis platform. The inertial cell sorting chip separates leukocyte populations and then injects them into the multi-channel cell migration chip, which can complete the chemotaxis test of PMN to chemotactic peptide (fMLP) within 15 min. The remaining cells, such as monocytes with slow motility and lymphocytes that require pre-activation with proliferative culture, do not undergo significant chemotactic migration. The test results of sepsis patients (n=6) and healthy volunteers (n=3) recruited in this study showed that the chemotaxis index (CI) and migration velocity (v) of PMN from sepsis patients were significantly weaker than those from healthy volunteers. In conclusion, the microfluidic PMN inertial label-free sorting and chemotaxis analysis platform constructed in this paper can be used as a new tool for cell label-free sorting and migration studies.
Keywords: Sepsis, Microfluidic chip, Polymorphonuclear neutrophil, Sorting, chemotaxis
0. 引 言
脓毒症患者进入重症监护室的最初6 h内,若诊断和治疗被延误,病死率明显增加。如果早期能对病情准确识别并合理地实施治疗策略,可明显改善脓毒症预后。中性粒细胞(polymorphonuclear neutrophil,PMN)在抵抗疾病和保护宿主方面发挥着至关重要的作用[1]。研究发现,严重脓毒症患者的PMN向感染部位移行的能力受到了抑制,从而不能及时地控制感染[2-3]。即时监测脓毒症期间PMN趋化迁移功能变化,对于开展脓毒症的预警与辅助诊断,评估患者免疫健康状态和预后具有重要的科学意义。
微流控芯片最早起源于20世纪90年代,经过短短几十年的发展,已经取得了令人瞩目的成绩,其中细胞趋化性分析是最重要的研究领域之一。这主要是因为微流控芯片具有分析快速、成本低、重现性好、集成化并可以在接近生理环境下运行等特点[4-8]。Ellett等[9]设计了迷宫式微流控芯片,全血直接注入微流控芯片后,观察到脓毒症患者PMN在狭窄微通道中的特异性自发迁移行为。Ren等[10]研制了一种填充了三维凝胶基质的三维微流控芯片,研究了T细胞在生理性皮肤炎症物质和抗炎治疗药物作用下的跨内皮迁移反应。本项目组将微流控芯片与智能手机集成,研究了慢性阻塞性疾病患者PMN的迁移行为[11]。最近,还有一些研究人员报道了多通道细胞迁移芯片,以提高实验分析效率。例如,Berthier等[12]开发了由50个独立梯度单元组成的微流控芯片,研究了严重复发性细菌感染患者PMN的趋化性。Wu等[13]开发了一种具有八个独立单元的微流控芯片,用于PMN和癌细胞的迁移行为研究。多通道细胞迁移芯片需要实时显微镜来记录和跟踪细胞迁移路径[14]。由于显微镜的视野有限,多通道细胞迁移芯片仅能显示一个独立迁移通道[15-16]。扩大显微镜数量或旋转/移动物镜可以提高检测通量,但将增加成本和运行多个设备的时间。此外,多通道细胞迁移芯片通常不具备分离细胞的能力或未配备分离细胞的辅件,从而限制了临床诊断应用。采用多通道细胞迁移芯片测试趋化性时,需要采用密度梯度离心法分离PMN,费力且耗时,并可能导致细胞活化和损伤[1]。商用试剂盒促进了基于微流控芯片的细胞迁移研究,但仍需要离心,且成本高。在微流控芯片上利用微通道结构、细胞大小差异、抗原抗体反应,直接快速地分离血液里的PMN,特别适用于病体模型下PMN的功能表型即时分析[17-21]。然而,这些芯片的制造和预处理过程十分复杂。近年来,惯性微流控芯片已被开发用于从少量外周血中分离细胞[22-24]。例如,Hou等[25]开发了一种惯性微流控PMN分选和功能表型分析方法,用于糖尿病患者PMN的快速无标记纯化和滚动行为分析。Jundi等[22]采用惯性微流控技术,从50 μL外周血中分离出PMN并用于下游吞噬功能、活性氧生成功能等的评估。Jiang等[26]开发了集成化微流控手持式无标记肿瘤细胞分选仪,用于从临床胸腔积液中高通量分离恶性肿瘤细胞。综上,微流控脓毒症患者PMN惯性无标记分选及趋化性分析的研究尚处于起步阶段。
本文首先设计了惯性细胞分选芯片(简称:惯性芯片),依托惯性力和迪恩阻力,分离白细胞群(直径约7~20 μm)和红细胞群(直径约5~7 μm)。其中,本文主要关注的PMN(直径约为10~15 μm)[27-28]。随后,设计了多通道细胞迁移芯片(简称:多通道芯片),构建了微流控PMN惯性无标记分选及趋化性分析平台。一般而言,白细胞群中的单核细胞迁移所需时间大概要1~5 h[29],而淋巴细胞一般需要经过增殖培养才能进行趋化迁移检测[30]。而本文设计的惯性芯片和多通道芯片,预期能在30 min内完成细胞分选和PMN的趋化性分析,而无需任何其他操作。本文进一步招募健康志愿者和脓毒症患者参与设计芯片的有效性测试,记录并分析了健康志愿者和脓毒症患者之间PMN趋化性的差异,以期验证微流控PMN惯性无标记分选及趋化性分析平台的可行性。本文创新性地将惯性芯片和多通道芯片相整合,旨在为基于微流控技术的细胞趋化性研究提供芯片设计思想和方法参考。
1. 实验部分
1.1. 仪器和试剂
本研究所用仪器列举如下:
倒置荧光显微镜(DMI8,Leica Inc.,德国);CO2恒温细胞培养箱(D180,瑞沃德,中国);高速相机(AEM136M-16G,千眼狼,中国);恒压泵(OB1 MK3,Elveflow,法国);流式细胞仪(Guava easyCyte,Merck,德国)。
本研究所用试剂列举如下:
人纤维连接蛋白(fibronectin)(货号:F2006,SIGMA-Aldrich,美国);趋化肽N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucyl-phenyl-alanine,fMLP)(货号:F3506,SIGMA-Aldrich,美国);磷酸缓冲盐溶液(phosphate buffered saline,PBS)(货号:02-024-1ACS,Biological Industries,以色列);罗斯威尔·帕克纪念研究所-1640(Roswell Park memorial institute 1640,RPMI-1640)培养基(货号:SH30809.01,Cytiva,美国);牛血清白蛋白(bovine albumin,BSA)(货号:A1933,SIGMA-Aldrich,美国);CD66b-FITC抗体(货号:305104,BioLegend,美国); 红细胞裂解液(货号:07800,STEMCELL,加拿大);5 μm聚苯乙烯微球(货号:UniFlu PS-0205G,瑞格科技,中国);10 μm聚苯乙烯微球(货号:UniFlu PS-0210O,瑞格科技,中国)。
1.2. 惯性芯片工作原理
微流体通常与主要的粘性阻力相关,即雷诺数(Reynolds number,Re)(以符号Re表示)较低,这些阻力导致层流剖面沿流线夹带悬浮颗粒和细胞在微通道中的不同位置聚焦[31-33]。惯性芯片分离原理如图1所示,由于径向离心加速度,在曲线通道内会形成上下两个对称的反向迪恩涡流(Dean vortices,Dean)(以符号Dean表示)[34],如式(1)所示:
图 1.
Schematic diagram of inertial chip structure and separation principle
惯性芯片结构及分离原理示意图
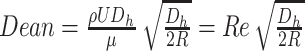 |
1 |
其中,ρ是流体密度,U是通道中的平均速度,Dh水力直径,μ是流体的动态粘度,R是通道的曲率半径。Dean对悬浮在溶液中的粒子会产生迪恩阻力(FD),FD沿Dean流动的方向拖拽颗粒在通道内壁和外壁来回移动。外壁颗粒迁移到内壁完成一半Dean循环,继续运动返回外壁完成全Dean循环[35-36],如式(2)所示:
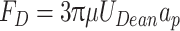 |
2 |
其中,Dean流速(以符号UDean表示)(UDean = 1.8 × 10−4 Dean1.63),ap粒子直径,π表示圆周率。除FD外,颗粒和细胞在内壁附近还会受到惯性升力(FL)的影响,如式(3)所示:
 |
3 |
其中,fL是无量纲升力系数,它是雷诺数和归一化横截面位置(x/h)的函数[37],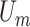 是最大流速。较大颗粒(ap/通道高度h≥0.07)受FL作用强于FD会持续聚焦在内壁,不完成全Dean循环,较小颗粒则在FD牵引下完成全Dean循环。
是最大流速。较大颗粒(ap/通道高度h≥0.07)受FL作用强于FD会持续聚焦在内壁,不完成全Dean循环,较小颗粒则在FD牵引下完成全Dean循环。
1.3. 惯性芯片设计与仿真
惯性芯片结构尺寸如图1所示,芯片通道的横剖面宽为500 μm,高为100 μm,总长10 cm,曲率半径8.4 mm,设置螺旋圈数为2圈,螺距为2 mm。样本口和鞘液口、出口1和出口2之间角度设置为60 º,通过实验测试,确定样本口和出口1通道宽度150 μm,鞘液口和出口2通道宽度350 μm。图1中,①、②、③分别为相应红色虚线框的放大示意图,用以详细描述芯片尺寸及功能。
使用有限元分析软件COMSOL Multiphysics 5.5(COMSOL Inc.,瑞典)模拟分析了不同流量条件下,惯性芯片对于5 μm和10 μm模拟微球的分选性能。应用粒子跟踪函数来追寻螺旋微通道中的微球轨迹分布情况。设置仿真参数:流体材料为水,流体温度设置为20.35 ℃,流体密度ρ来自材料,动力黏度μ来自材料。样本入口和鞘液入口设置不同流速,出口压力为0 Pa。
1.4. 多通道芯片设计与前处理
多通道芯片设计和制备,参考本课题组之前的工作——文献[38]。如图2所示,每个单元结构设计有细胞培养液入口、趋化剂入口、细胞加载口、废液口、蛇形微通道、迁移通道、隔离带,以及细胞校准区。其中蛇形微通道高70 μm、宽80 μm;迁移通道高70 μm、宽270 μm;隔离带高3 μm、宽30 μm;细胞校准区长860 μm、宽40 μm。细胞从细胞加载口注入后,将整齐排列在细胞校准区的隔离带边缘。趋化剂入口和细胞培养液入口连接有蛇形微通道,并设置有压力平衡连接通道,用于平衡趋化剂入口和细胞培养液入口的压力差。蛇形微通道末端在迁移通道中汇聚,并通过层流和扩散机制在迁移通道中形成稳定的化学浓度梯度场。图2中分别展示了迁移通道的俯视图和不同角度的横截面图。多通道芯片使用前需要分别使用2.5 μg/mL的fibronectin溶液和细胞培养基(浓度为0.4%的BSA,经RPMI-1640稀释)包被微通道,时长为1 h。
图 2.

Schematic diagram of multi-channel chip structure
多通道芯片结构示意图
1.5. 微流控PMN惯性无标记分选及趋化性分析平台构建与实验测试
1.5.1. 平台构建
如图3所示,细胞分选及趋化性分析平台主要由以下部分组成:惯性芯片、多通道芯片、微流体驱动控制单元(包括气源口1、气源口2,用于调节流速)、样本存储管(15 mL,用于装载样本液形成样本流)、鞘液存储管(15 mL,用于装载纯水形成鞘流)、纯化管(15 mL,用于收集目标液体)、废液管(15 mL,用于收集废液)、气路、连接管路(红、蓝线)和控制软件。
图 3.
Schematic diagram of the microfluidic PMN inertial label-free sorting and chemotaxis analysis platform
微流控PMN惯性无标记分选及趋化性分析平台示意图
1.5.2. 荧光微球分选实验
本文以红色5 μm和绿色10 μm的荧光微球群分别模拟红细胞群和PMN群,分别取30 μL和20 μL加入到装有12 mL去离子水的样本存储管中稀释为3×106个/mL和1.5 × 105个/mL。然后,如图3所示,将气源口1、样本存储管和样本口相互连接,向惯性芯片中泵入样本液,气源口2、鞘液存储管和鞘液口相互连接向惯性芯片中泵入鞘液。调节流速,利用高速相机观察两种荧光微球在出口1和出口2的聚焦情况。纯化管收集惯性芯片出口1中的微球溶液。废液管收集惯性芯片出口2中的微球溶液。最后,以流式细胞仪检测样本存储管、纯化管和废液管中两种微球的比例。
1.5.3. PMN分选与趋化性实验
将50 μL CD66b-FITC抗体加入到1 mL人体血液样本中,室温孵育30 min;然后将9 mL红细胞裂解液与上述1 mL人体血液样本混合,冰上裂解10 min。取裂解后溶液400 μL装入样本存储管,加入含有浓度为5%的BSA的PBS溶液,定容至12 mL,制备成30倍稀释的样本液。取裂解后溶液200 μL装入样本存储管,加入含有5%BSA的PBS溶液,定容至12 mL,制备成60倍稀释的样本液。按照1.5.1和1.5.2小节的描述,连接各个试剂管和管路,调节流速,高速相机采集惯性芯片出口1和出口2的细胞分离图像。随后,为了确定PMN的分离率,用流式细胞仪分别从样本存储管和纯化管中采集1 × 104个PMN,根据采取1 × 104个PMN所需的样本体积来推测样本存储管和纯化管中含有的PMN总个数,进而计算PMN的分离率。分离率为纯化管中PMN数除以样本存储管中PMN数。为了确定PMN的迁移能力,首先将纯化管中的细胞溶液离心后去上清液,再用1 mL细胞培养基重悬。接着取20 μL重悬液注入多通道芯片的细胞加载口。然后,分别向趋化剂入口和细胞培养液入口注入50 μL浓度为100 nmol/L的fMLP和细胞培养基。PMN迁移运动15 min后,荧光显微镜采集迁移通道中的细胞分布图像。由于单核细胞迁移运动需1~5 h[29],淋巴细胞需增殖培养才有活性[30],因而理论上仅观察到PMN的趋化运动。
1.5.4. 脓毒症患者PMN分选与趋化性实验
本研究经中国科学院合肥物质科学研究院伦理委员会批准(编号:YXLL-2023-06),所有参与者均签署书面知情同意书。依据脓毒症新指南(Sepsis 3.0)标准,选择“血细胞培养呈阳性+序贯器官衰竭评分≥2分”的6名入住重症监护室患者,患者平均年龄62岁;另招募3名体检结果正常的志愿者作为对照组;排除孕妇、输血患者和白细胞减少且低于2 × 109 个/mL的患者。本研究首先将9 mL红细胞裂解液与1 mL静脉血混合,裂解10 min。取裂解溶液200 μL装入样本存储管,加入含有浓度为5%的BSA的PBS溶液,定容至12 mL,制备成60倍稀释的样本液。按1.5.3小节所述,进行细胞分选和趋化性实验。本文共设计了3个实验序列:健康志愿者1与脓毒症患者1和2;健康志愿者2与脓毒症患者3和4;健康志愿者3与脓毒症患者5和6。以6帧/min速率采集90张PMN迁移图像。使用公共图像处理软件Image J(National Institute of Mental Health,美国)获取单个PMN的迁移运动轨迹。每个单元的迁移通道中需要追踪30个细胞。通过计算趋化性指数(chemotaxis index,CI)和迁移速度(以符号v表示)来评估PMN的迁移运动能力。CI,是指细胞朝向浓度梯度运动的位移除以迁移的总路程,体现细胞能否准确快速到达病灶处的能力;迁移速度,为总迁移距离与实验时间的比值。此外,还将15 min细胞迁移时间分割成10份,计算了脓毒症患者和健康志愿者群的PMN随时间变换的速度vi(i = 1, 2, …, 10),以观测细胞迁移运动过程中的细胞迁移运动变化情况[38]。实验均重复3次,结果表示为平均值±标准偏差。
2. 结果与讨论
2.1. 惯性芯片分选仿真结果
本文设计的惯性芯片依靠FL和FD共同作用,使微球或细胞聚焦在芯片不同位置,需满足微球或细胞分离的流速条件,为此利用三维仿真软件对参数范围进行初步摸索。如图4所示,展现了10 μm和5 μm模拟微球成功分离的最佳流速,以及分离现象产生变化的样本流及鞘流的临界值。当鞘流设置为0.84 mL/min、样本流为0.09 mL/min时,10 μm和5 μm模拟微球完全分离。说明此条件下,FL和FD相互均衡,使模拟微球在芯片不同位置聚焦。以此流速为基准值,再分别固定样本流改变鞘流、固定鞘流改变样本流来观察10 μm和5 μm模拟微球的分离情况。如图4鞘流截止流速和最佳流速对比所示,当样本流固定为0.1 m/s时,鞘流最小可调整到0.4 m/s,最大设置到0.6 m/s,10 μm和5 μm模拟微球的分离情况发生改变;另如图4样本流截止流速和最佳流速所示,当鞘流固定为0.5 m/s时,样本流最小可调整到0.05 m/s,最大设置到0.2 m/s,10 μm和5 μm模拟微球会不完全分离。
图 4.
Finite element analysis software simulation results
有限元分析软件仿真结果
2.2. 荧光微球分选结果
如图5所示,本文首先基于微流控细胞惯性无标记分选及趋化性分析平台,研究了不同样本流速和鞘液流速条件下,10 μm和5 μm微球聚焦流中心位置与螺旋通道内壁的距离,来确定最佳样本流速和鞘液流速。当样本流速设置为0.42 mL/min,鞘液流速设置为5.7 mL/min时,惯性芯片中10 μm绿色微球聚焦流和5 μm红色微球聚焦流间的距离最大,则此流速为最佳流速。同时流式细胞仪检测结果表明,初始样本中10 μm和5 μm微球各占55.8%和43.3%。在最佳流速下出口1纯化管中收集到的10 μm微球占比为78.0%,出口2废液管中5 μm微球占比为88.3%。说明惯性芯片收集目标微球,滤除背景干扰微球的能力较好。综上,惯性芯片实现了不同粒径大小荧光微球在螺旋通道不同位置的聚焦和分离。
图 5.
Microsphere separation phenomena and separation results
微球分离现象和分离结果
2.3. PMN分选和趋化性测试结果
采用微流控细胞惯性无标记分选及趋化性分析平台,调节样本流为0.42 mL/min,鞘液为5.7 mL/min进行细胞分选。如图6所示,30倍稀释的样本液,红细胞群与白细胞群存在交集,而60倍稀释的样本液被注入惯性芯片时,白细胞群和红细胞群可以实现稳定分离聚焦。分选的白细胞群注入多通道芯片完成15 min的趋化运动后,采集迁移通道中的明场和荧光图像。结果表明,CD66b-FITC抗体标记的PMN可以穿过细胞校准区的隔离带并在迁移通道中进行迁移运动。迁移通道中CD66b-FITC抗体标记的PMN呈现出明显的绿色荧光[39]。流式细胞仪计数结果表明,PMN的分离效率约在60%。PMN分离效率与其他惯性芯片相当,然而,其他研究需裂解全血后,再对红细胞群进行洗涤滤除后通入芯片进行细胞分离[25],相较于本文加入红细胞裂解液后直接利用惯性芯片进行分离更为繁琐,故本文分选流程更为便捷高效。
图 6.
PMN sorting and chemotactic migration results
PMN分选与趋化迁移结果
2.4. 脓毒症患者PMN分选和趋化性分析
目前,已知脓毒症患者PMN趋化迁移功能受损导致感染扩散与患者不良预后密切相关,主要是由于PMN释放各种酶、炎症介质等,导致组织损伤并最终发展为器官功能障碍和衰竭。因此,分析PMN的趋化迁移功能变化,对于脓毒症的预警与辅助诊断以及监测患者免疫状态和预后具有重要意义。微流控细胞惯性无标记分选及趋化性分析平台实验结果如图7所示,健康志愿者1与脓毒症患者1和2的CI值分别为0.72、0.46、0.57,健康志愿者2与脓毒症患者3和4的CI值分别为0.73、0.51、0.42,健康志愿者3与脓毒症患者5和6的CI值分别为0.71、0.60、0.52,脓毒症患者组CI值平均低于健康志愿者组。因此,本文推断脓毒症患者的PMN趋化性受损,表现为偏向梯度方向运动。在此基础上,如图7所示,本文进一步比较了脓毒症患者组和健康志愿者组的v值。健康志愿者1与脓毒症患者1、2的v值分别为0.28 μm/s、0.14 μm/s、0.13 μm/s,健康志愿者2与脓毒症患者3、4的v值分别为0.25 μm/s、0.18 μm/s、0.14 μm/s,健康志愿者3与脓毒症患者5、6的v值分别为0.30 μm/s、0.16 μm/s、0.15 μm/s。实验结果表明,脓毒症患者组v值平均低于健康志愿者组。同时本文计算了15 min内随时间变化的vi值。观察到健康志愿者PMN的v值在各个时间段内均优于脓毒症患者。过往研究已经表明,PMN主要通过其膜表面的趋化因子受体CXCR2识别感染部位的高浓度趋化物质,并观察到脓毒症患者及动物模型离体PMN的CXCR2存在表达下调或敏感性降低,因而对多种趋化因子如fMLP、白三烯B4(Leukotriene B4,LTB4)或白细胞介素-8(Interleukin-8,IL-8)的反应性降低[40]。同时,无论健康志愿者还是脓毒症患者的PMN,其v值均会先上升到一定阈值之后,就随时间推移而逐渐趋于平缓。这可能是当PMN进入低浓度趋化因子梯度环境时,细胞膜表面的趋化因子受体蛋白逐渐被吸引激活,细胞趋化反应逐渐上升,而当趋化因子浓度不断升高,逐渐减少的受体蛋白难以吸收过量趋化因子导致细胞的迁移反应不断降低[41-43]。由此可见,基于微流控细胞惯性无标记分选及趋化性分析平台监测到脓毒症患者PMN的趋化性受损,主要表现为CI和v值降低,此与前人研究结论保持一致。
图 7.
Comparative analysis of PMN chemotactic behavior in septic patients and healthy volunteers
脓毒症患者和健康志愿者PMN趋化行为对比分析
3. 结论
本文创新性地将惯性芯片和多通道芯片相整合,首先利用惯性聚焦原理无标记分选白细胞群,随后直接检测PMN响应竞争梯度时的趋化迁移行为,以高效率方式实现了脓毒症患者和健康志愿者对照PMN趋化迁移参数的差异化分析。目前研究旨在为基于微流控技术的细胞趋化性研究提供芯片设计思想和方法参考。通过改变惯性芯片和多通道芯片的尺寸,微流控细胞惯性无标记分选及趋化性分析平台同样适用于肿瘤细胞分选与趋化性分析。后期将继续优化微流控细胞惯性无标记分选及趋化性分析平台,为脓毒症的预警与辅助诊断、监测脓毒症患者免疫状态和预后,提供新方法和新工具。
重要声明
利益冲突声明:本文全体作者均声明不存在利益冲突。
作者贡献声明:高朝茹和杨柯设计实验和撰写论文,杨逍和刘利娟进行数据收集和数据分析,周金华和王月进行文中图片润色和芯片制备,刘勇和朱灵指导实验和修改论文。
伦理声明:本研究通过了中国科学院合肥物质科学研究院医学伦理委员会的审批(批文编号:YXLL-2023-06)。
Funding Statement
国家自然科学基金资助项目(31800713);中国科学院青年创新促进会资助项目(2021442,Y2022111);安徽省自然科学基金资助项目(2308085MC75)
National Natural Science Foundation of China; Youth Innovation Promotion Association Chinese Academy of Sciences; The Anhui Provincial Natural Science Foundation
Contributor Information
勇 刘 (Yong LIU), Email: lywhn@sina.com.
柯 杨 (Ke YANG), Email: keyang@aiofm.ac.cn.
References
- 1.Ellett F, Marand A L, Irimia D Multifactorial assessment of neutrophil chemotaxis efficiency from a drop of blood. Journal of Leukocyte Biology. 2022;111(6):1175–1184. doi: 10.1002/JLB.3MA0122-378RR. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Yang Y, Liu L, Guo Z, et al Investigation and assessment of neutrophil dysfunction early after severe burn injury. Burns. 2021;47(8):1851–1862. doi: 10.1016/j.burns.2021.02.004. [DOI] [PubMed] [Google Scholar]
- 3.Sun R, Huang J, Yang Y, et al Dysfunction of low-density neutrophils in peripheral circulation in patients with sepsis. Scientific Reports. 2022;12(1):685. doi: 10.1038/s41598-021-04682-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Zhao W, Zhao H, Li M, et al Microfluidic devices for neutrophil chemotaxis studies. Journal of Translational Medicine. 2020;18(1):168. doi: 10.1186/s12967-020-02335-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Ren J, Wang N, Guo P, et al Recent advances in microfluidics-based cell migration research. Lab on a Chip. 2022;22(18):3361–3376. doi: 10.1039/D2LC00397J. [DOI] [PubMed] [Google Scholar]
- 6.Mcminn P H, Hind L E, Huttenlocher A, et al Neutrophil trafficking on-a-chip: an in vitro, organotypic model for investigating neutrophil priming, extravasation, and migration with spatiotemporal control. Lab on a Chip. 2019;19(21):3697–3705. doi: 10.1039/C9LC00562E. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Hu C, Liu J, Chen H, et al Microfluidic platforms for gradient generation and its applications. Biochemistry & Analytical Biochemistry. 2017;6(2):100320. [Google Scholar]
- 8.李慧来, 杨逍, 吴晓松, 等 多通道微流控芯片的设计、仿真及细胞迁移应用研究. 生物医学工程学杂志. 2022;39(1):128–138. doi: 10.7507/1001-5515.202105002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Ellett F, Jorgensen J, Marand A L, et al Diagnosis of sepsis from a drop of blood by measurement of spontaneous neutrophil motility in a microfluidic assay. Nat Biomed Eng. 2018;2(4):207–214. doi: 10.1038/s41551-018-0208-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Ren X, Getschman A E, Hwang S, et al Investigations on T cell transmigration in a human skin-on-chip (SoC) model. Lab on a Chip. 2021;21(8):1527–1539. doi: 10.1039/D0LC01194K. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Yang K, Wu J, Peretz-soroka H, et al Mkit: a cell migration assay based on microfluidic device and smartphone. Biosensors and Bioelectronics. 2018;99:259–267. doi: 10.1016/j.bios.2017.07.064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Berthier E, Surfus J, Verbsky J, et al An arrayed high-content chemotaxis assay for patient diagnosis. Integrative Biology. 2010;2(11-12):630–638. doi: 10.1039/c0ib00030b. [DOI] [PubMed] [Google Scholar]
- 13.Wu J, Kumar-kanojia A, Hombach-klonisch S, et al A radial microfluidic platform for higher throughput chemotaxis studies with individual gradient control. Lab on a Chip. 2018;18(24):3855–3864. doi: 10.1039/C8LC00981C. [DOI] [PubMed] [Google Scholar]
- 14.Yang K, Peretz-Soroka H, Wu J, et al Fibroblast growth factor 23 weakens chemotaxis of human blood neutrophils in microfluidic devices. Scientific Reports. 2017;7(1):3100. doi: 10.1038/s41598-017-03210-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Jimenez-Valdes R J, Rodriguez-Moncayo R, Cedillo-Alcantar D F, et al Massive parallel analysis of single cells in an integrated microfluidic platform. Analytical Chemistry. 2017;89(10):5210–5220. doi: 10.1021/acs.analchem.6b04485. [DOI] [PubMed] [Google Scholar]
- 16.Bhattacharjee N, Folch A Large-scale microfluidic gradient arrays reveal axon guidance behaviors in hippocampal neurons. Microsystems & Nanoengineering. 2017;3:17003. doi: 10.1038/micronano.2017.3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Agrawal N, Toner M, Irimia D Neutrophil migration assay from a drop of blood. Lab on a Chip. 2008;8(12):2054–2061. doi: 10.1039/b813588f. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Butler K L, Ambravaneswaran V, Agrawal N, et al Burn injury reduces neutrophil directional migration speed in microfluidic devices. PloS one. 2010;5(7):e11921. doi: 10.1371/journal.pone.0011921. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hoang A N, Jones C N, Dimisko L, et al Measuring neutrophil speed and directionality during chemotaxis, directly from a droplet of whole blood. Technology. 2013;1(1):49. doi: 10.1142/S2339547813500040. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Sackmann E K H, Berthier E, Schwantes E A, et al Characterizing asthma from a drop of blood using neutrophil chemotaxis. Proc Natl Acad Sci U S A. 2014;111(16):5813–5818. doi: 10.1073/pnas.1324043111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Sackmann E K, Berthier E, Young E W, et al Microfluidic kit-on-a-lid: a versatile platform for neutrophil chemotaxis assays. Blood. 2012;120(14):e45–e53. doi: 10.1182/blood-2012-03-416453. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Jundi B, Ryu H, Lee D H, et al Leukocyte function assessed via serial microlitre sampling of peripheral blood from sepsis patients correlates with disease severity. Nature Biomedical Engineering. 2019;3(12):961–973. doi: 10.1038/s41551-019-0473-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Jeon H, Lee D H, Jundi B, et al Fully automated, sample-to-answer leukocyte functional assessment platform for continuous sepsis monitoring via microliters of blood. ACS Sensors. 2021;6(7):2747–2756. doi: 10.1021/acssensors.1c00887. [DOI] [PubMed] [Google Scholar]
- 24.Zeming K K, Lu R, Woo K L, et al Multiplexed single-cell leukocyte enzymatic secretion profiling from whole blood reveals patient-specific immune signature. Analytical Chemistry. 2021;93(10):4374–4382. doi: 10.1021/acs.analchem.0c03512. [DOI] [PubMed] [Google Scholar]
- 25.Hou H W, Petchakup C, Tay H M, et al Rapid and label-free microfluidic neutrophil purification and phenotyping in diabetes mellitus. Scientific Reports. 2016;6:29410. doi: 10.1038/srep29410. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Jiang F, Xiang N Integrated microfluidic handheld cell sorter for high-throughput label-free malignant tumor cell sorting. Analytical Chemistry. 2022;94(3):1859–1866. doi: 10.1021/acs.analchem.1c04819. [DOI] [PubMed] [Google Scholar]
- 27.Vona G, Sabile A, Louha M, et al Isolation by size of epithelial tumor cells: a new method for the immunomorphological and molecular characterization of circulating tumor cells. The American Journal of Pathology. 2000;156(1):57–63. doi: 10.1016/S0002-9440(10)64706-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Zabaglo L, Ormerod M G, Parton M, et al Cell filtration-laser scanning cytometry for the characterisation of circulating breast cancer cells. Cytometry A. 2003;55(2):102–108. doi: 10.1002/cyto.a.10071. [DOI] [PubMed] [Google Scholar]
- 29.Ward P A Chemotaxis of mononuclear cells. The Journal of Experimental Medicine. 1968;128(5):1201–1221. doi: 10.1084/jem.128.5.1201. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Wilkinson P C, Komai-Koma M, Newman I Locomotion and chemotaxis of lymphocytes. Autoimmunity. 1997;26(1):55–72. doi: 10.3109/08916939709009550. [DOI] [PubMed] [Google Scholar]
- 31.Seo J, Lean M H, Kole A Membrane-free microfiltration by asymmetric inertial migration. Applied Physics Letters. 2007;91:033901. doi: 10.1063/1.2756272. [DOI] [Google Scholar]
- 32.Bhagat A A, Hou H W, Li L D, et al Pinched flow coupled shear-modulated inertial microfluidics for high-throughput rare blood cell separation. Lab on a Chip. 2011;11(11):1870–1878. doi: 10.1039/c0lc00633e. [DOI] [PubMed] [Google Scholar]
- 33.Di Carlo D, Irimia D, Tompkins R G, et al Continuous inertial focusing, ordering, and separation of particles in microchannels. Proc Natl Acad Sci U S A. 2007;104(48):18892–18897. doi: 10.1073/pnas.0704958104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Di Carlo D Inertial microfluidics. Lab on a Chip. 2009;9(21):3038–3046. doi: 10.1039/b912547g. [DOI] [PubMed] [Google Scholar]
- 35.Bhagat A A S, Kuntaegowdanahalli S S, Papautsky I Continuous particle separation in spiral microchannels using dean flows and differential migration. Lab on a Chip. 2008;8(11):1906–1914. doi: 10.1039/b807107a. [DOI] [PubMed] [Google Scholar]
- 36.Ookawara S, Street D, Ogawa K Numerical study on development of particle concentration profiles in a curved microchannel. Chemical Engineering Science. 2006;61(11):3714–3724. doi: 10.1016/j.ces.2006.01.016. [DOI] [Google Scholar]
- 37.Abdulla A, Liu W, Gholamipour-Shirazi A, et al High-throughput isolation of circulating tumor cells using cascaded inertial focusing microfluidic channel. Analytical Chemistry. 2018;90(7):4397–4405. doi: 10.1021/acs.analchem.7b04210. [DOI] [PubMed] [Google Scholar]
- 38.Yang X, Gao C, Liu Y, et al Simplified cell magnetic isolation assisted SC2 chip to realize “sample in and chemotaxis out”: validated by healthy and T2DM patients’ neutrophils. Micromachines. 2022;13(11):1820. doi: 10.3390/mi13111820. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Wu J, Hillier C, Komenda P, et al An all-on-chip method for testing neutrophil chemotaxis induced by fMLP and COPD patient’s sputum. Technology. 2016;4(2):104–109. doi: 10.1142/S2339547816500035. [DOI] [Google Scholar]
- 40.Alves-Filho J C, Freitas A, Souto F O, et al Regulation of chemokine receptor by Toll-like receptor 2 is critical to neutrophil migration and resistance to polymicrobial sepsis. Proc Natl Acad Sci U S A. 2009;106(10):4018–4023. doi: 10.1073/pnas.0900196106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Blackwood R A, Hartiala K T, Kwoh E E, et al Unidirectional heterologous receptor desensitization between both the fMLP and C5a receptor and the IL-8 receptor. Journal of Leukocyte Biology. 1996;60(1):88–93. doi: 10.1002/jlb.60.1.88. [DOI] [PubMed] [Google Scholar]
- 42.Coles R B, Ranney R R, Freer R J, et al Thermal regulation of FMLP receptors on human neutrophils. Journal of Leukocyte Biology. 1989;45(6):529–537. doi: 10.1002/jlb.45.6.529. [DOI] [PubMed] [Google Scholar]
- 43.Yang K, Wu J, Xu G, et al A dual-docking microfluidic cell migration assay (D2-Chip) for testing neutrophil chemotaxis and the memory effect. Integrative Biology. 2017;9(4):303–312. doi: 10.1039/C7IB00037E. [DOI] [PMC free article] [PubMed] [Google Scholar]








