Abstract
目的
探讨同种异体纳米脂肪联合富血小板血浆对大鼠压力性损伤创面的影响及治疗效果。
方法
将40只SD大鼠成功建立压力性损伤模型后,随机分为4组(10只/组):纳米脂肪联合富血小板血浆处理组(NP组)、单纯纳米脂肪处理组(N组)、单纯富血小板血浆处理组(P组)、对照组(C组)。处理后观察创面愈合情况,第1、3、5、7、10、14天拍照,计算创面愈合率;第5、10、14天取创面标本行HE染色,Masson染色,CD31、MCP-1免疫组织化学染色及VEGF蛋白质免疫印迹检测,观察创面炎性细胞浸润,胶原生成、沉积及排列,血管新生、炎性因子表达及VEGF表达情况。
结果
压力性损伤模型及纳米脂肪制备成功,PRP内血小板计数约为正常全血的6.2倍。创面表面观察显示,NP组愈合最快,其各观察点的创面愈合率明显高于其余3组(P < 0.05),N组与P组无明显差异(P > 0.05),第7、14天时明显高于C组(P < 0.05)。HE染色显示,NP组第5天炎性细胞浸润增强,真皮及表皮生长快于其他组,第14天基本完全愈合,N组与P组各时间点组织变化相似,且优于C组(P < 0.05)。Masson染色显示,NP组各时间点压力性损伤创面相对胶原表达量以及排列顺序明显优于其他组(P < 0.05),N组及P组在各时间点也较C组有明显差异(P < 0.05)。CD31免疫组化显示不同时间点NP组血管新生数目高于其余3组(P < 0.05),N组及P组各时间点差异无统计学意义(P > 0.05),但两组新生血管数目均高于C组。MCP-1免疫组化结果示,第5天NP组压力性损伤创面MCP-1相对表达强于其他组(P < 0.05),N组及P组同时亦高于C组(P < 0.05)。VEGF蛋白质免疫印迹检测显示,NP组PI创面3个时间点VEGF表达明显高于其余3组(P < 0.05),第5、10天时N组、P组及C组相近,仅在第14天时N组及P组明显强于C组(P < 0.05)。
结论
纳米脂肪联合富血小板血浆治疗压力性损伤创面可显著促进创面愈合,两者联合具有协同作用,为压力性损伤创面的临床治疗提供一种新的可靠方案。
Keywords: 压力性损伤, 纳米脂肪, 富血小板血浆, 创面愈合
Abstract
Objective
To investigate the effect of allogeneic nanofat combined with platelet-rich plasma (PRP) for treatment of pressure injury wounds in rats.
Methods
Forty SD rat models with pressure injury wounds were randomly divided into 4 groups (n=10) for treatment with nanofat, PRP (platelet count about 6.2 times that of normal whole blood), nanofat combined with PRP, or PBS only (control group).Wound healing was observed on days 1, 3, 5, 7, 10 and 14 and wound healing rate was calculated. On days 5, 10 and 14, tissue samples were taken from the wounds for HE staining, Masson staining, immunohistochemistry, and Western blotting to observe inflammatory cell infiltration, collagen formation, deposition and arrangement, angiogenesis, inflammatory factor expression and VEGF expression in the wounds.
Results
The combined treatment with nanofat and PRP achieved the highest wound healing rates at all the time points of observation (P < 0.05), enhanced inflammatory cell infiltration on day 5, and accelerated dermal and epidermal growth compared with the other treatments (P < 0.05). The combined treatment also more effectively promoted collagen expression and its regular arrangement (P < 0.05) and enhanced angiogenesis in the wounds than nanofat and PRP alone, without significant difference between the latter two treatments (P > 0.05). Immunohistochemistry and Western blotting showed that the expressions of MCP-1 and VEGF in the wounds were the highest in the combined treatment group (P < 0.05) and were higher in nanofat and PRP treatment groups than in the control group (P < 0.05).
Conclusion
Nanofat combined with PRP can significantly promote healing of pressure injury wounds in rats, and their synergistic effect sheds light on a new strategy for treatment of pressure injury wounds.
Keywords: pressure injury, nanofat, platelet rich plasma, wound healing
压力性损伤(PI)是由压力或压力联合剪切力导致的皮肤和/或皮下组织的局部损伤,通常位于骨隆突处,但有时也与医疗器械或其他物体有关[1, 2]。研究发现PI发生率逐年增加,远超人们想象,已经成为家庭及社会严重的健康问题[3, 4]。我国流行病学统计显示,PI患者约占慢性创面住院患者的9.2%[5],大多数合并脊髓损伤、四肢瘫痪、外周血管疾病、神经系统疾病、糖尿病、癌症、心力衰竭、感觉麻痹或丧失以及其他限制患者活动的疾病[6]。而且PI形成机制复杂,影响因素多,易迁延不愈并伴发感染、窦道,通常不能遵循正常创面愈合过程,难以依靠单一治疗技术实现较快治愈,是慢性难愈合创面修复所面临的难题之一[7, 8]。多种治疗技术联合应用是目前临床治疗或改善PI创面的主要趋势,但治疗技术怎样联合更优化仍需要大量的基础实验和临床应用研究来阐明。
创面修复是一个复杂且有序进行的生物过程,需要多种因素的共同参与,相互调控,高度协调,最终实现创面愈合[6]。经过研究探索,目前治疗PI的技术有多种[9-12],其中干细胞疗法及血小板浓缩制品具有较好的前景[13, 14]。干细胞治疗创面领域以纳米脂肪较为先进。纳米脂肪富含脂肪干细胞(ADSCs)及细胞外基质等成分, 其中ADSCs具有多重分化及自分泌或旁分泌多种细胞因子、生长因子、炎性因子的生物学能力,对创面具有综合而全面的修复效果;并且纳米脂肪制备工艺筒单、成本低、所需时间短,已被证明具有组织修复和再生作用[15]。有研究通过建立大鼠糖尿病模型[16],使用自体纳米脂肪治疗后足全层皮肤缺损创面发现,纳米脂肪处理组比PBS处理组更快实现创面愈合,可以显著促进创面再上皮化及血管生成。但在实际应用中也存在一些问题,例如由于慢性创面局部缺氧或宿主免疫反应,ADSCs移植后长时间存活率低,严重影响修复效果[16]。为克服这一问题,有学者研究ADSCs与联合治疗全层皮肤破损创面,发现提升创面环境生长因子浓度可明显提高ADSCs的存活率,促进血管生成,改善创面血运,并能优化再上皮化过程[17]。该研究说明提高生长因子的有效性或者维持生长因子在体内的持续作用可以使ADSCs在创面修复上取得更好的效果,提示将纳米脂肪与高浓度生长因子或生长因子制品联合应用于慢性难愈合创面,其中血小板浓缩制品是一良好联合选择。
血小板作为一种多功能细胞,激活后可释放多种生长因子,其浓缩制品已广泛应用于组织损伤修复领域,以富血小板血浆(PRP)最常见[18, 19]。在难愈合PI创面治疗中,PRP通过调节基质金属蛋白酶以及肉芽组织中特定蛋白的表达,降低白细胞介素-8、肿瘤坏死因子-α等促炎因子水平,显著加速创面愈合,缩短治疗时间,且不增加并发症[14]。另外PRP在创面修复领域已经得到广泛认可,其除含有高浓度血小板外,还含有大量白细胞和纤维蛋白,激活后可以大量释放多种生长因子,高浓度的白细胞参与创面的炎症反应,增强创面的抗感染能力,纤维连接蛋白为创面修复提供支架,可有效促进难愈性创面的愈合[20]。但纳米脂肪与PRP在PI创面中的应用研究极少,几乎处于空白阶段,因此本研究进行基础实验,将纳米脂肪与PRP联合应用于PI创面,观察创面修复效果,以期获得良好结果,丰富PI创面修复的思路与手段,为临床应用贡献重要依据。
1. 材料和方法
1.1. 实验动物
SPF级健康雄性SD大鼠46只,其中4周龄40只,8周龄6只,由济南朋悦实验动物繁育有限公司提供,许可证号SCXK(鲁)20190003。本研究经解放军第960医院科研伦理委员会批准(2021科研伦理审第110号),实验人员具备山东省动物实验从业人员资质,所有实验内容均符合中国伦理委员会有关动物研究的指导原则。
1.2. 主要试剂及仪器
主要试剂:磷酸盐缓冲溶液(Servicebio),CD31抗体(Servicebio),anti-VEGF(Abcam),anti-MCP-1(Abcam),HRP酶标二抗(Servicebio),HE染色试剂盒(Servicebio),Masson染色试剂盒(Servicebio)。
主要仪器:高强度钕铁硼磁铁(深圳鑫弘昌磁材有限公司),脂肪乳糜器(上海KIAPL),螺口注射器(镇江康利医疗器械有限公司),台式离心机(北京白洋医疗器械有限公司),凝胶电泳仪(北京君意东方电泳设备有限公司)。
1.3. 实验方法
1.3.1. 建立PI动物模型
缺血再灌注损伤原理是目前PI形成的公认机制[21, 22]。参考该机制,仿照Strong团队的造模方式[23],将40只背部备皮后的SD大鼠,于背正中线两侧相距10 mm处轻轻提起背部皮肤,两侧对称放置直径15 mm、厚度5 mm、磁力2400 Gs的强力磁铁,作压迫处理。12 h磁铁压迫、12 h释放为1个循环,共3个循环。处理后第1、5天取创面及创周组织行HE染色。若第1天皮肤结构破坏,组织水肿,少量炎性细胞浸润,第5天出现大量炎性细胞浸润,组织细胞变性坏死,即可确认PI动物模型建立成功(图 1)。
图 1.
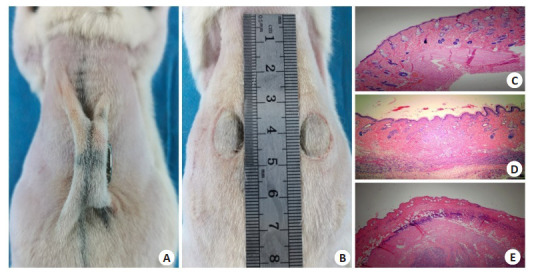
压力性损伤模型制备
Preparation of the rat model with pressure injury wound. A: Magnet compression treatment. B: Pressure injury wounds on the back of a rat. C: HE staining of normal skin tissue (Original magnification: ×40). D: HE staining of wound tissue on the first day after modeling (×40). E: HE staining of wound tissue on day 5 after modeling (×40).
1.3.2. 制备纳米脂肪
6只供体SD大鼠禁食禁饮8 h后,10%水合氯醛0.4 mL/100 g腹腔注射联合异氟醚吸入麻醉成功,仰卧位固定大鼠四肢。双侧腹股沟区备皮、消毒后剪开腹股沟处皮肤分离出皮下脂肪垫,放入预冷PBS中,剔除血管筋膜,洗涤3遍后充分剪碎,将剪碎的脂肪放入15 mL离心管中以800 g离心5 min,收集离心后的上层脂肪至10 mL螺口注射器内,另一10 mL螺口注射器通过脂肪糜化器与其相连,反复推挤30次进行乳化,再通过0.8 mm过滤网过滤,得到可以通过27G针头注射的乳糜液即为纳米脂肪[24](图 2)。
图 2.

纳米脂肪的制备
Preparation of nanofat. A: Extraction of inguinal fat from SD rats. B: Inguinal fat. C: Inguinal fat shearing. D: Adipose tissue after centrifugation. E: Emulsification through fat chime. F: Successfully prepared nanofat.
1.3.3. 制备PRP
同法麻醉6只供体SD大鼠后,腹部备皮、消毒,仰卧位固定。无菌条件下打开腹腔,充分暴露腹主动脉,抗凝化的穿刺针轻柔匀速抽出血液,并立即注入2 mL枸橼酸钠真空采集管中,SD大鼠采血后采用过量麻醉法处死。将采取的SD大鼠全血分别留取1 mL,其余血液采用两次离心法分离提取PRP[25](图 3)。
图 3.

两次离心法分离提取PRP
Preparation of platelet-rich plasma (PRP) through centrifugation. A: Whole blood before centrifugation. B: After first centrifugation. C: After the second centrifugation. D: Final PRP.
1.3.4. 创面处理
于造模成功后第1天,根据创面处理方式,NP组给予0.3 mL纳米脂肪+0.3 mL PRP;N组给予0.3 mL纳米脂肪+0.3 mL PBS;P组给予0.3 mL PRP+ 0.3 mL PBS;C组给予0.6 mLPBS处理,均采取创缘上下左右4点及中央基底部平均注射,处理后外敷无菌敷贴,包扎固定。
1.3.5. 创面取材
创面处理后第5、10、14天按随机数字表法每组抽取2只SD大鼠,上述方法麻醉后,在距创缘外2 mm处切取创周及全部创面组织。
1.3.6. 创面愈合情况
创面处理后第1、3、5、7、10、14天拍照,运用Image J软件测量创面面积,计算创面愈合率。创面愈合率=(原始创面面积-剩余创面面积/原始创面面积)×100%。
1.3.7. HE染色
将创面标本制备成厚度为5 μm的石蜡切片。再经过脱蜡至水,行HE染色,光学显微镜下观察创面组织炎性反应情况及结构变化。
1.3.8. Masson染色
创面标本石蜡切片脱蜡至水,Masson染色试剂盒步骤染色,镜检并采集图像,观察创面胶原沉积及排列情况,并运用Image J软件计算各组创面的胶原相对表达量。每张切片在显微镜高倍镜下(×400)随机选择5个视野,应用Image J软件计算胶原相对表达量,相对胶原表达量=(蓝染的胶原纤维面积/视野总面积)×100%。
1.3.9. CD31、MCP-1免疫组织化学染色
创面标本石蜡切片脱蜡复水,水洗后EDTA抗原修复,3%过氧化氢溶液消除内源性过氧化物酶活性,血清封闭后一抗anti-CD31(1∶300稀释,GB113151)、anti-MCP-1(1∶2000稀释,ab7202/R)孵育,放入湿盒内4 ℃过夜。去除一抗后PBS冲洗,滴加二抗(HRP标记)37 ℃孵育30 min,DAB显色,苏木素复染,中性树胶封片镜检。显微镜下观察并随机选取5个高倍镜(×400)下不重叠的视野,计数新生血管数目以及MCP-1阳性表达情况。
1.3.10. 蛋白质免疫印迹检测
将创面标本置于研钵中,剪碎、研磨至粉末状,冰上裂解30 min后离心,收集上清液,BCA法测试样本蛋白浓度。测定后PBS稀释,与上样缓冲液混合,100 ℃变性5 min。制备分离胶及浓缩胶,置于电泳槽中后上样,先在80 V恒压下电泳至溴酚蓝染料从浓缩胶进入分离胶,再将电流调至120 V恒压继续电泳至溴酚蓝达凝胶底部为止。转膜,脱脂奶粉封闭,一抗anti-VEGF(1∶2000稀释,ab7202)、内参抗体GAPDH(1∶1000稀释,TA-08)4 ℃孵育过夜。弃去一抗,TBST摇床洗涤,加入二抗孵育60 min,再洗涤,ECL化学发光成像,采集图像分析。运用Image J图像分析软件对获得每个特异性条带积分灰度进行半定量分析,目的条带量分别除以其内参条带量,得到的数值即为内参校正后的各样品中目的蛋白相对含量。
1.4. 统计学分析
应用SPSS 17.0软件进行统计学分析。资料符合正态分布时用均数±标准差表示,不符合正态分布用四分位数表示。各组符合正态分布且方差齐时,组间比较采用方差分析检验,两两比较采用LSD检验;各组不符合正态分布或方差不齐时,组间比较采用Kruskal-wallis非参数检验。P < 0.05为差异有统计学意义。
2. 结果
2.1. PRP血小板计数
PRP中血小板计数为(2219.3±312.5)×109/L,正常血血小板计数约为(360.6±62.1)×109/L,达到PRP制备要求。
2.2. 创面愈合观察
NP组SD大鼠背部PI创面痂皮脱落时间短于其他3组,处理后第5天即出现少部分脱落,创面愈合快。处理后第3、5、7、10、14天,NP组创面愈合率均明显高于C组(图 4)。第7、10、14天创面愈合率高于N组及P组;第10、14天N组、P组高于C组,差异均具有统计学意义(P < 0.05)。整个观察期间,N组、P组创面愈合率大致相同,两组差异无统计学意义(P > 0.05,表 1)。
图 4.

各处理组大鼠压力性损伤创面愈合情况观察
Gross observation of pressure injury wound healing in each treatment group. Wound healing was better in NP group than in N group, P group and control group at all the time points.
表 1.
各组每个时间点压力性损伤创面愈合率的比较
Comparison of wound healing rates among the groups at each time point (%, Mean±SD)
| Group | 3 days | 5 days | 7 days | 10 days | 14 days |
| ◇P < 0.05 vs NP; ☆P < 0.05 vs N; △P < 0.05 vs P; *P < 0.05 vs C. N: Nanofat treatment group; P: PRP treatment group; C: Control group; NP: Combine treatment group. | |||||
| NP | 11.9±6.0* | 35.0±9.1* | 51.3±4.0☆△* | 84.4±1.5☆△* | 99.1±0.8☆△* |
| N | 7.7±2.2 | 23.5±1.7 | 37.3±6.9◇ | 72.2±5.3◇* | 95.5±1.0◇* |
| P | 7.2±4.1 | 25.6±5.7 | 35.6±5.0◇ | 70.9±8.9◇* | 95.4±1.4◇* |
| C | 3.1±1.4◇ | 19.2±7.7◇ | 29.5±11.3◇ | 58.0±5.5◇☆△ | 91.0±1.9◇☆△ |
2.3. 组织学检测
2.3.1. HE染色
根据HE染色结果,第5天NP组可见部分痂皮脱落,皮下组织疏松,可见坏死组织溶解形成的不规则空泡,周围大量炎性细胞聚集,其余各组痂皮未脱落,N组、P组真皮层及肌层可见炎性细胞浸润明显,C组炎性细胞浸润不明显,皮下组织可见明显空腔。第10天,NP组、N组及P组痂皮已脱落,肉芽组织生长,真皮层增厚且较前致密,炎性细胞浸润较前减轻,可见脂肪细胞及新生血管形成,而C组痂皮未完全脱落,皮下组织疏松,炎性细胞浸润明显。第14天,NP组表皮再生,部分角化,真皮增厚,表皮与真皮连接致密,可见部分皮肤附属器及脂肪细胞形成,纤维组织排列较其他组有序,N组、P组亦可见表皮再生,与真皮层连接尚可,可见新生脂肪细胞,未见明显皮肤附属器新生,纤维组织排列不齐,C组部分创面仍未上皮化,真皮层增厚程度较其余3组轻,组织层次不明显,连接疏松,纤维组织排列紊乱(图 5)。
图 5.
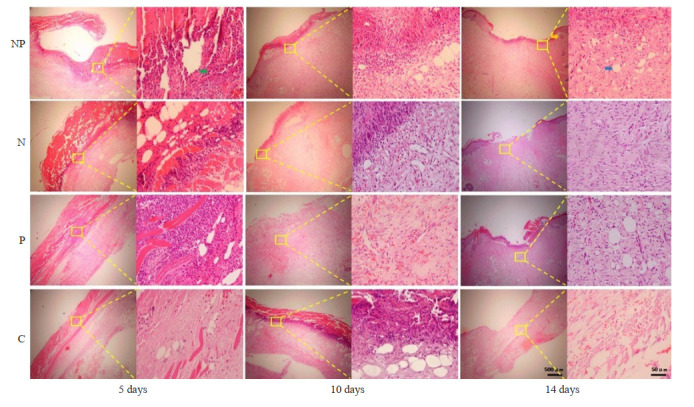
各组处理后第5、10、14天压力性损伤创面HE染色观察
HE staining of pressure injury wounds on the 5th, 10th and 14th days after treatment in each group (×40, ×400). Green arrows indicate inflammatory cell aggregation and infiltration, yellow arrows indicate neonatal skin appendages, and blue arrows indicate neogenic adipocytes.
2.3.2. Masson染色
第5天,NP组、N组、P组炎性细胞浸润较C组明显,NP组胶原沉积较其他3组具有显著差异(P < 0.05)。第10天,NP组胶原沉积量明显增加,主要位于真皮深层及皮下组织,局部呈团块状,排列趋向有序,较其余组具有显著差异(P < 0.05),N组及P组胶原沉积量均较前明显增加,较C组差异明显(P < 0.05)。第14天,NP组胶原沉积较多,呈条索样,排列有序,较其他3组具有显著差异(P < 0.05),N组、P组胶原沉积较前增多,局部呈团块或条索样,排列趋向有序,较C组差异明显(P < 0.05,表 2),C组胶原沉积较前明显增多,但排列紊乱、松散(图 6)。
表 2.
各组每个时间点压力性损伤创面相对胶原表达量的比较
Comparison of collagen expression in the wounds among the groups at each time point (%, Mean±SD)
| Group | 5 days | 10 days | 14 days |
| ◇P < 0.05 vs NP; ☆P < 0.05 vs N; △P < 0.05 vs P; *P < 0.05 vs C. | |||
| NP | 39.4±2.9☆△* | 56.4±1.3☆△* | 78.5±2.8☆△* |
| N | 30.5±1.3◇△* | 48.7±2.1◇* | 66.6±5.3◇* |
| P | 26.1±0.5◇☆* | 49.6±1.4◇* | 68.3±2.8◇* |
| C | 18.4±1.8◇☆△ | 29.7±1.4◇☆△ | 52.1±4.0◇☆△ |
图 6.

各组处理后第5、10、14天压力性损伤创面Masson染色观察
Masson staining of pressure injury wounds on the 5th, 10th and 14th days after treatment in each group (×40, ×400).
2.4. 免疫组织化学染色
2.4.1. CD31免疫组化
第5天,NP组PI创面可见明显管腔结构,成形的微血管数目较其他3组多(P < 0.05),N组、P组也可见染色阳性的内皮细胞,多数呈血管结构(图 7),两组新生血管数目大致相同,与C组比较均具有明显差异(P < 0.05)。第10天,各组创面新生血管数目均明显增多,以NP组最多,C组新生血管数目最少(P < 0.05)。第14天,各组创面新生血管数目均较前减少,但NP组血管数目仍居首位,与其余组具有明显差异(P < 0.05),N组、P组较C组的血管数目差异具有统计学意义(P < 0.05,图 8)。
图 7.

各组不同处理后第5、10、14天压力性损伤CD31免疫组化检测创面血管新生情况
Immunohistochemistry for CD31 for detecting wound angiogenesis on the 5th, 10th and 14th days in each group (×40, ×400). On the 5th, 10th and 14th days after treatment, the number of angiogenesis was the highest in NP group, similar between N group and P group, and was the lowest in the control group.
图 8.

不同时间点各组压力性损伤创面血管新生情况
Angiogenesis of pressure injury wounds in each group at different time points. *P < 0.05.
2.4.2. MCP-1免疫组化
第5天,单核细胞趋化蛋白-1(MCP-1)免疫组化结果显示:4组均可见阳性表达(图 9)。NP组MCP-1相对表达量高于其余3组(P < 0.05),N组、P组相对表达量大致相同,均高于C组(P < 0.05,图 10)。
图 9.
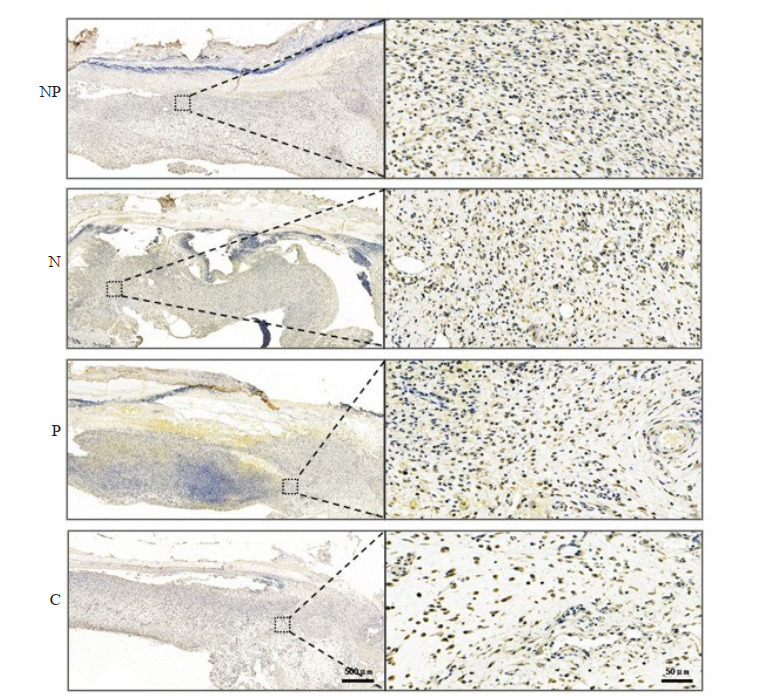
处理后第5天各组压力性损伤创面MCP-1免疫组化检测炎性反应情况
Immunohistochemistry for MCP-1 for assessing inflammation in the wounds in each group on the 5th day after treatment (×40, ×400). The expression of MCP-1 was the highest in NP group, similar between N group and P group, and the lowest in C group.
图 10.

处理后第5天各组压力性损伤创面MCP-1表达情况
Expression of MCP-1 in pressure injury wounds of each group on the 5th day after treatment. *P < 0.05.
2.5. 蛋白质免疫印迹检测
第5天,血管内皮生长因子(VEGF)蛋白免疫印迹结果显示,NP组VEGF表达高于其余组(P < 0.05)。第10天,NP组VEGF表达仍高于其他3组(P < 0.05),N组表达比P组弱,与C组大致相同。处理后第14天,NP组VEGF表达依旧高于其余3组,N组与P组趋于一致,但均与C组比较有明显差异(P < 0.05),C组表达最少(图 11)。
图 11.

不同时间点各组压力性损伤创面血管生长因子表达情况
Expression of vascular growth factor in pressure injury wounds of each group at different time points. *P < 0.05.
3. 讨论
本实验结果显示,NP组创面愈合速度明显快于其余3组,可能源于纳米脂肪联合PRP治疗时,ADSCs依托纳米脂肪的ECM成分、PRP的纤维蛋白结构,可以更稳定的保留并更早的发挥作用。此外,PRP中血小板激活也可分泌大量细胞因子,如VEGF、血小板源性生长因子、成纤维细胞生长因子、转化生长因子、表皮生长因子、白细胞介素等,促进细胞增殖、新生血管形成、软组织修复以及间充质干细胞分化,加速创面愈合[26]。创面表面观察及HE染色显示,创面愈合早期注射纳米脂肪、PRP后,炎性细胞浸润较对照组明显,痂皮较快脱落。这一方面源于注射纳米脂肪后,其中的油脂、液体成分以及ECM等成分引起创面组织发生生物学反应,引起单核细胞/巨噬细胞大量增殖;另一方面是PRP中本身含有高浓度的白细胞,能够调控创面组织的炎性反应,增强抗感染能力[27, 28]。
Masson染色发现,NP组胶原相对表达量高于其余组,且排列更有序。这与雷肖璇等[29]实验结果是一致的,该实验将人ADSCs联合PRP治疗组小鼠皮肤全层损伤创面,发现联合组有较多新生胶原纤维,单纯ADSCs及对照组创面组织中胶原纤维较少,但单纯应用纳米脂肪、PRP也具有一定促进作用。纳米脂肪联合PRP治疗PI创面,其中的ADSCs依托PRP持续、均匀地释放各种生长因子,更好地向成纤维细胞转化,增加ECM和胶原的合成,有利于创面愈合。有研究发现,ADSCs联合PRP应用于糖尿病足溃疡创面时,能够显著促进肉芽组织形成及胶原表达,这与调控Notch信号通路有关;此外,该通路还能积极调节细胞增殖、血管生成及炎性反应,促进创面愈合[30]。本实验纳米脂肪联合PRP治疗促进PI创面胶原表达的具体机制尚需进一步研究。
本实验中MCP-1免疫组化检测显示,第5天NP组PI创面单核细胞趋化因子表达最高,N组及P组次之,C组最低。MCP-1是创面修复早期潜在的重要介质之一,对单核细胞/巨噬细胞向创面募集有关键作用[31]。这与创面处理后第5天标本HE染色观察到的炎性细胞浸润情况是一致的,说明纳米脂肪、PRP均可通过促进MCP-1表达,适当增强PI创面愈合早期炎性反应,有助于创面修复,而且两者联合效果更佳。
VEGF被认为是促进创面血管生成最常见、最有效的因子,与其受体VEGF-R结合,可以促进内皮细胞增殖、迁移,分化为功能性血管[32]。本实验中VEGF蛋白质免疫印迹检测表明纳米脂肪联合PRP应用,与其余3组比较,可以显著促进PI创面VEGF表达,有利于血管生成,为创面修复提供充足的氧气及营养,加速创面愈合。VEGF蛋白质免疫印迹结果与CD31免疫组化结果交相呼应。本实验对不同处理的大鼠PI创面进行CD31免疫组化染色,发现纳米脂肪联合PRP治疗的PI创面血管新生情况优于其余组,新生血管数目显著高于单独应用纳米脂肪、PRP以及PBS处理组,这与VEGF的功能有关。VEGF激活金属蛋白激酶,活化成血管细胞迁移、分化为血管内皮细胞,形成新生血管,亦可作为中间介质,介导一些细胞成分、细胞因子发挥作用,促进血管生成,对于创面修复具有重要作用[33]。
综上所述,与单纯纳米脂肪、单纯PRP以及PBS处理组比较,纳米脂肪联合PRP治疗PI创面,相同时间具有更高的创面愈合率,皮肤结构恢复速度更快,胶原表达量更多,也可以通过增强创面VEGF的表达,促进创面血管新生,重建创面血运,两者具有明显协同作用。
Biography
张铭,硕士,住院医师,E-mail: 449096047@qq.com
Funding Statement
济南市年科学技术发展计划(201912010)
Contributor Information
张 铭 (Ming ZHANG), Email: 449096047@qq.com.
陈 铭锐 (Mingrui CHEN), Email: mrchensd@sina.com.
References
- 1.Alshahrani B, Sim J, Middleton R. Nursing interventions for pressure injury prevention among critically ill patients: a systematic review. J Clin Nurs. 2021;30(15/16):2151–68. doi: 10.1111/jocn.15709. [DOI] [PubMed] [Google Scholar]
- 2.Edsberg LE, Black JM, Goldberg M, et al. Revised national pressure ulcer advisory panel pressure injury staging system: revised pressure injury staging system. J Wound Ostomy Continence Nurs. 2016;43(6):585–97. doi: 10.1097/WON.0000000000000281. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Hartmann CW, Solomon J, Palmer JA, et al. Contextual facilitators of and barriers to nursing home pressure ulcer prevention. Adv Skin Wound Care. 2016;29(5):226–38. doi: 10.1097/01.ASW.0000482113.18800.1c. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Nancy M, Ellen MP, Emanuele C, et al. The role of nutrition for pressure injury prevention and healing: the 2019 international clinical practice guideline recommendations. Adv Skin Wound Care. 2020;33(3):1–2. doi: 10.1097/01.ASW.0000654548.09548.2b. [DOI] [PubMed] [Google Scholar]
- 5.余 墨声, 朱 占永, 赵 月强, et al. 慢性创面的临床治疗进展. 临床外科杂志. 2016;24(3):165–7. doi: 10.3969/j.issn.1005-6483.2016.03.001. [DOI] [Google Scholar]
- 6.Hajhosseini B, Longaker MT, Gurtner GC. Pressure injury. Ann Surg. 2020;271(4):671–9. doi: 10.1097/SLA.0000000000003567. [DOI] [PubMed] [Google Scholar]
- 7.张 铭, 于 浩, 陈 铭锐. 压力性损伤创面治疗方法研究进展. 中华整形外科杂志. 2022;38(4):451–8. doi: 10.3760/cma.j.cn114453-20210914-00385. [DOI] [Google Scholar]
- 8.Vélez-Díaz-Pallarés M, Lozano-Montoya I, Abraha I, et al. Nonpharmacologic interventions to heal pressure ulcers in older patients: an overview of systematic reviews (the SENATORONTOP series) JAm Med DirAssoc. 2015;16(6):448–69. doi: 10.1016/j.jamda.2015.01.083. [DOI] [PubMed] [Google Scholar]
- 9.Hong NY, Yang C, Zhong RS, et al. Research progress on the effect mechanism of acupuncture-moxibustion for pressure injuries. ChinAcupunct Moxibust. 2023;43(8):120–6. doi: 10.13703/j.0255-2930.20221013-k0001. [DOI] [PubMed] [Google Scholar]
- 10.Song Z, Guo X, Zhang X. Effects of topical oxygen therapy on chronic traumatic wounds and its impact on granulation tissue. Am J Transl Res. 2021;13(6):7294–9. [PMC free article] [PubMed] [Google Scholar]
- 11.Kottner J, Cuddigan J, Carville K, et al. Prevention and treatment of pressure ulcers/injuries: the protocol for the second update of the international Clinical Practice Guideline 2019. J Tissue Viability. 2019;28(2):51–8. doi: 10.1016/j.jtv.2019.01.001. [DOI] [PubMed] [Google Scholar]
- 12.路 璐, 李 慧芳, 张 修航, et al. 压力性损伤的临床研究进展. 中华保健医学杂志. 2020;22(5):558–60. doi: 10.3969/j.issn.1674-3245.2020.05.036. [DOI] [Google Scholar]
- 13.Kim KI, Park S, Im GI. Osteogenic differentiation and angiogenesis with cocultured adipose-derived stromal cells and bone marrow stromal cells. Biomaterials. 2014;35(17):4792–804. doi: 10.1016/j.biomaterials.2014.02.048. [DOI] [PubMed] [Google Scholar]
- 14.Liu Q, Zhang N, Li ZN, et al. Efficacy of autologous platelet-rich plasma gel in the treatment of refractory pressure injuries and its effect on wound healing time and patient quality of life. Clinics. 2021;76:e2355–62. doi: 10.6061/clinics/2021/e2355. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chen L, Wang ZC, Ma JJ, et al. Autologous nanofat transplantation accelerates foot wound healing in diabetic rats. Regen Med. 2019;14(3):231–41. doi: 10.2217/rme-2018-0169. [DOI] [PubMed] [Google Scholar]
- 16.Chiou GJ, Crowe C, McGoldrick R, et al. Optimization of an injectable tendon hydrogel: the effects of platelet-rich plasma and adipose-derived stem cells on tendon Healing In vivo. Tissue Eng A. 2015;21(9/10):1579–86. doi: 10.1089/ten.TEA.2014.0490. [DOI] [PubMed] [Google Scholar]
- 17.Bhang SH, Park J, Yang HS, et al. Platelet-rich plasma enhances the dermal regeneration efficacy of human adipose-derived stromal cells administered to skin wounds. Cell Transplant. 2013;22(3):437–45. doi: 10.3727/096368912X656162. [DOI] [PubMed] [Google Scholar]
- 18.Cobos R, Aizpuru F, Parraza N, et al. Effectiveness and efficiency of platelet rich plasma in the treatment of diabetic ulcers. Curr Pharm Biotechnol. 2015;16(7):630–4. doi: 10.2174/138920101607150427111926. [DOI] [PubMed] [Google Scholar]
- 19.Kontopodis N, Tavlas E, Papadopoulos G, et al. Effectiveness of platelet-rich plasma to enhance healing of diabetic foot ulcers in patients with concomitant peripheral arterial disease and critical limb ischemia. Int J Low Extrem Wounds. 2016;15(1):45–51. doi: 10.1177/1534734615575829. [DOI] [PubMed] [Google Scholar]
- 20.Yuan T, Guo SC, Han P, et al. Applications of leukocyte- and plateletrich plasma (L-PRP) in trauma surgery. Curr Pharm Biotechnol. 2012;13(7):1173–84. doi: 10.2174/138920112800624445. [DOI] [PubMed] [Google Scholar]
- 21.宁 翠霞, 毕 越英. 压疮的基础实验研究进展. 现代中西医结合杂志. 2017;26(27):3075–8. doi: 10.3969/j.issn.1008-8849.2017.27.040. [DOI] [Google Scholar]
- 22.李 妍雁, 周 晓兰. 国外压疮动物模型研究进展. 护理学报. 2015;22(21):23–6. [Google Scholar]
- 23.Strong AL, Bowles AC, MacCrimmon CP, et al. Adipose stromal cells repair pressure ulcers in both young and elderly mice: potential role of adipogenesis in skin repair. Stem Cells Transl Med. 2015;4(6):632–42. doi: 10.5966/sctm.2014-0235. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Feng JW, Doi K, Kuno S, et al. Micronized cellular adipose matrix as a therapeutic injectable for diabetic ulcer. Regen Med. 2015;10(6):699–708. doi: 10.2217/rme.15.48. [DOI] [PubMed] [Google Scholar]
- 25.Jo CH, Roh YH, Kim JE, et al. Optimizing platelet-rich plasma gel formation by varying time and gravitational forces during centrifugation. J Oral Implantol. 2013;39(5):525–32. doi: 10.1563/AAID-JOI-D-10-00155. [DOI] [PubMed] [Google Scholar]
- 26.Pietramaggiori G, Scherer SS, Mathews JC, et al. Healing modulation induced by freeze-dried platelet-rich plasma and micronized allogenic dermis in a diabetic wound model. Wound Repair Regen. 2008;16(2):218–25. doi: 10.1111/j.1524-475X.2008.00362.x. [DOI] [PubMed] [Google Scholar]
- 27.Sclafani AP, Saman M. Platelet-rich fibrin matrix for facial plastic surgery. Facial Plast Surg Clin NAm. 2012;20(2):177–86. doi: 10.1016/j.fsc.2012.02.004. [DOI] [PubMed] [Google Scholar]
- 28.Kato H, Mineda K, Eto H, et al. Degeneration, regeneration, and cicatrization after fat grafting: dynamic total tissue remodeling during the first 3 months. Plast Reconstr Surg. 2014;133(3):303–13. doi: 10.1097/PRS.0000000000000066. [DOI] [PubMed] [Google Scholar]
- 29.雷 肖璇, 许 鹏程, 张 磊, et al. 人脂肪源性间充质干细胞和富血小板血浆对小鼠全层皮肤缺损创面愈合的影响. 中华烧伤杂志. 2018;34(12):887–94. doi: 10.3760/cma.j.issn.1009-2587.2018.12.013. [DOI] [Google Scholar]
- 30.Ebrahim N, Dessouky AA, Mostafa O, et al. Adipose mesenchymal stem cells combined with platelet-rich plasma accelerate diabetic wound healing by modulating the Notch pathway. Stem Cell Res Ther. 2021;12(1):392. doi: 10.1186/s13287-021-02454-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.DiPietro LA, Polverini PJ, Rahbe SM, et al. Modulation of JE/MCP-1 expression in dermal wound repair. Am J Pathol. 1995;146(4):868–75. [PMC free article] [PubMed] [Google Scholar]
- 32.Zhang Y, Xiao LL, Li JX, et al. Improved fat transplantation survival by using the conditioned medium of vascular endothelial growth factor transfected human adipose-derived stem cells. Kaohsiung J Med Sci. 2017;33(8):379–84. doi: 10.1016/j.kjms.2017.05.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.史 旭锋, 魏 冬, 余 小平, et al. 血管内皮生长因子介导的血管新生促进创面愈合的研究进展. 中华损伤与修复杂志: 电子版. 2021;16(6):536–8. [Google Scholar]


