Abstract
Introducción
La obtención de hemocultivos (HC) se realiza en el 15% de los pacientes atendidos con sospecha de infección en los Servicios de Urgencias Hospitalarios (SUH) con una rentabilidad diagnóstica variable (2-20%). La mortalidad a 30 días de los pacientes con bacteriemia es dos o tres veces mayor que el resto con el mismo proceso. La procalcitonina (PCT) es un biomarcador que se ha utilizado como herramienta de ayuda en la predicción de bacteriemia en los SUH. El objetivo principal de esta revisión sistemática es investigar la precisión diagnóstica de la PCT para predecir bacteriemia verdadera en los pacientes adultos atendidos con sospecha clínica de infección en el SUH, así como identificar un valor específico de PCT como el más relevante desde el punto de vista diagnóstico de decisión clínica que pueda recomendarse para la toma de decisiones.
Método
Se realiza una revisión sistemática siguiendo la normativa PRISMA en las bases de datos de PubMed, Web of Sciencie, EMBASE, Lilacs, Cochrane, Epistemonikos, Tripdata-base y ClinicalTrials.gov desde enero de 2010 hasta 31 mayo 2023 sin restricción de idiomas y utilizando una combinación de términos MESH: “Bacteremia/Bacteraemia/Blood Stream Infection”, “Procalcitonin”, “Emergencies/Emergency/ Emergency Department” y “Adults”. Se incluyeron estudios de cohortes observacionales y parcialmente una revisión sistemática. No se realizaron técnicas de metaanálisis, pero los resultados se compararon narrativamente.
Resultados
Se identificaron un total de 1.372 artículos de los cuales se analizaron finalmente 20 que cumplían los criterios de inclusión. Los estudios incluidos representan un total de 18.120 HC procesados con 2.877 bacteriemias (15,88%). Diez estudios fueron calificados de calidad alta, 9 moderada y 1 baja. El ABC-COR de todos los estudios se sitúa desde 0,68 (IC 95%: 0,59-0,77) hasta 0,98 (IC 95%: 0,97-0,99). El valor de PCT >0,5 ng/ml es el más utilizado y propuesto hasta en diez de los trabajos que se incluyen en esta revisión cuyo rendimiento medio estimado es de un ABC-COR de 0,833. Si solo se tiene en cuenta los resultados de los 6 estudios de alta calidad que utilizan un punto de corte >0,5 ng/ml de PCT, el resultado medio estimado del ABC-COR es de 0,89 con Se de 77,6% y Es del 78%.
Conclusiones
La PCT tiene una precisión diagnóstica de bacteriemia considerable en los pacientes atendidos en los SUH por los distintos procesos infecciosos. El punto de corte >0,5 ng/ml se ha posicionado como el más adecuado para predecir la existencia de bacteriemia y se puede utilizar para descartar ésta razonablemente.
Palabras clave: Servicios de Urgencias, Bacteriemia, Hemocultivos, Diagnóstico, Pronóstico, Procalcitonina
Abstract
Introduction
Obtaining blood cultures (HC) is performed in 15% of the patients treated with suspicion of infection in the Hospital Emergency Services (ED) with a variable diagnostic yield (2-20%). The 30-day mortality of patients with bacteremia is two or three times higher than the rest with the same process. Procalcitonin (PCT) is a biomarker that has been used as a tool to help predict bacteremia in HEDs. The main objective of this systematic review is to investigate the diagnostic accuracy of PCT in predicting true bacteraemia in adult patients treated with clinical suspicion of infection in the ED, as well as to identify a specific PCT value as the most relevant from the clinical decision diagnostic point of view that can be recommended for decision making.
Method
A systematic review was performed following the PRISMA guidelines in the PubMed, Web of Science, EMBASE, Lilacs, Cochrane, Epistemonikos, Tripdatabase and ClinicalTrials. gov databases from January 2010 to May 31, 2023 without language restrictions and using a combination of MESH terms: “Bacteremia/ Bacteraemia/ Blood Stream Infection”, “Procalcitonin”, “Emergencies/ Emergency/ Emergency Department” and “Adults”. Observational cohort studies and partially an systematic review were included. No meta-analysis techniques were performed, but the results were compared narratively.
Results
A total of 1,372 articles were identified, of which 20 that met the inclusion criteria were finally analyzed. The included studies represent a total of 18,120 processed HC with 2,877 bacteraemias (15.88%). Ten studies were rated as high, 9 moderate and 1 low quality. The AUC-COR of all the studies ranges from 0.68 (95% CI: 0.59-0.77) to 0.98 (95% CI: 0.97-0.99). The PCT value >0.5 ng/ml is the most widely used and proposed in up to ten of the works included in this systematic review, whose estimated mean yield is an AUC-COR of 0.833. If only the results of the 6 high-quality studies using a cut-off point (PC) >0.5 ng/mL PCT are taken into account, the estimated mean AUC-COR result is 0.89 with Se of 77.6% and It is 78%.
Conclusions
PCT has a considerable diagnostic accuracy of bacteraemia in patients treated in EDs for different infectious processes. The CP>0.5 ng/ml has been positioned as the most suitable for predicting the existence of bacteraemia and can be used to reasonably rule it out.
Keywords: Emergency Department, Bacteraemia, Blood cultures, Diagnosis, Prognosis, Procalcitonin
INTRODUCCIÓN
La atención de pacientes con sospecha de un proceso infeccioso en los servicios de urgencias hospitalarios (SUH) se ha incrementado significativamente en las últimas décadas hasta suponer, al menos, el 15% de todas las atenciones diarias en estas áreas asistenciales [1,2].
Asimismo, tanto la gravedad en su presentación clínica como la mortalidad intrahospitalaria y a corto plazo (30 días), también han aumentado en los últimos años, especialmente en aquellos pacientes que cumplen criterios de sepsis, presentan una comorbilidad relevante, inmunodeprimidos, ancianos o ante la sospecha de presentar bacteriemia [1-4]. En este sentido, la mortalidad a los 30 días de los enfermos con bacteriemia verdadera o significativa cuyo aislamiento procede de los hemocultivos (HC) obtenidos en el SUH se ha cifrado entre 10-30%, lo que supone el doble o triple que el resto de pacientes con el mismo proceso pero sin bacteriemia verdadera [5-8]. Ésta se relaciona con la gravedad de la situación clínica (existencia de sepsis-shock séptico), el tipo de foco primario (urinario, respiratorio, abdominal, sistema nervioso, desconocido, etc.) y las características de los pacientes (edad, comorbilidad, situaciones particulares, entre otras) [9,10].
En la valoración inicial de estos enfermos se toman muestras para realizar estudios microbiológicos hasta en un 45% de los casos [1,2]. En este sentido, la obtención de HC se realiza en el 15% de todos los pacientes atendidos con sospecha o confirmación de infección en los SUH [1,2,11]. Aunque, todavía en la actualidad, existe controversia en relación a las indicaciones de cuándo debemos obtener HC en el SUH y su rentabilidad que puede variar del 2-20% [5-8,12-14]. Junto a esta realidad, los considerados “HC contaminados” pueden alcanzar incluso tasas del 30-50% de los aislamientos y, por otro lado, los HC con aislamiento significativo en pacientes dados de alta desde urgencias (ASPAU) pueden representar un 3-5% de los extraídos en el SUH [5-8]. Estos hechos representan verdaderos problemas, al conllevar un incremento de las pruebas diagnósticas realizadas, de la estancia hospitalaria, de los costes y la administración en ocasiones de tratamientos antibióticos innecesarios o, en su caso, altas improcedentes en los casos de ASPAU [5-8,12-14].
Se define bacteriemia ante la presencia de bacterias en la sangre, que se pone de manifiesto por el aislamiento de éstas en los HC [12,13]. A pesar de las nuevas técnicas de detección rápida (del ADN del patógeno o por aplicación de espectrometría de masas, entre otras) [15,16], los HC permiten el diagnóstico etiológico de la infección, aportan información sobre la sensibilidad del microorganismo y favorecen la optimización del tratamiento antimicrobiano [17-19]. Hoy en día, la incidencia de bacteriemia comunitaria se cifra en 1/500 atenciones en los SUH y 1/100 ingresos hospitalarios desde estos [6,11,13].
El origen de los procesos infecciosos más frecuentes sospechados o confirmados de las bacteriemias verdaderas o significativas en los SUH son la infección del tracto urinario (ITU) (45%) y la infección respiratoria (25%). En un segundo plano se sitúan la bacteriemia de origen desconocido y la infección intraabdominal (ambas en alrededor del 10% de los HC extraídos en el SUH) [6,11,13].
Por todo lo dicho, la sospecha y confirmación de la bacteriemia verdadera tiene un relevante significado diagnóstico, pronóstico y nos obliga a cambiar algunas de las decisiones más importantes a tomar de forma inmediata en el SUH. Entre otras, indicar el alta o ingreso, extraer HC y administrar el antimicrobiano adecuado y precoz [10,18-20]. Además, los HC también se obtienen en el SUH como garantía de continuidad asistencial, ya que del conocimiento de sus resultados dependerá el manejo y evolución posterior del paciente en su destino final [10,18-20].
En este contexto clínico, en los últimos años, se ha acentuado la búsqueda de herramientas objetivas de ayuda para intentar predecir, desde la primera valoración del paciente con sospecha de infección grave, un diagnóstico precoz, el pronóstico, la gravedad y, junto con la posible etiología bacteriana, la sospecha de bacteriemia (al ser estos factores claramente determinantes del pronóstico y la mortalidad de los procesos infecciosos) [2,18,19,21].
Los biomarcadores de respuesta inflamatoria e infección (BMRII) han demostrado su utilidad específicamente para predecir y detectar la existencia de bacteriemia verdadera en los pacientes con procesos infecciosos en los SUH [2,22-29]. Muchos tipos de BMRII [proteína C reactiva (PCR), interleucinas (IL) 6 y 8, lactato, proadrenomedulina (proADM), presepsina, receptor de superficie expresado en las células mieloides (sTREM1), receptor soluble del activador del plasminógeno de tipo uroquinasa (suPAR), entre otros], han sido evaluados con este objetivo de forma aislada o formando parte de un modelo o escala predictiva [22-29]. Pero, entre todos ellos destaca la procalcitonina (PCT), que también es muy sensible y específica para predecir infección bacteriana, poder orientar hacia el patógeno causante de la infección, su evolución clínica (a sepsis grave y shock séptico) y la mortalidad [22-30].
El objetivo principal de esta revisión sistemática es investigar la precisión diagnóstica de la PCT para predecir bacteriemia verdadera en los pacientes adultos atendidos con sospecha clínica de infección en el SUH, así como analizar si los distintos estudios logran identificar un valor específico de PCT como el más relevante desde el punto de vista diagnóstico de decisión clínica que pueda recomendarse para la toma de decisiones en los SUH.
MÉTODOS
Se realizó una revisión sistemática (RS) con base en lo establecido por la lista declaración Preferred Reporting Items for Sytematic Reviews and Meta-Analyses (PRISMA) [31]. El protocolo de la revisión ha sido registrado en PROSPERO (ID-442121).
Pregunta PICO. La pregunta de investigación se formuló siguiendo las recomendaciones del formato PICO (Población/ paciente, Intervención, Comparador y Outcomes/desenlaces). Nuestra pregunta fue: “En pacientes adultos atendidos en el SUH con el diagnóstico clínico de infección y con sospecha de presentar bacteriemia (P), ¿el uso de la procalcitonina (C) en comparación con su no utilización (I) mejora la precisión de la predicción diagnóstica de bacteriemia en los HC extraídos en los SUH (O)?
Estrategia de búsqueda y criterios de selección. Se realizó una búsqueda bibliográfica en las bases de datos de PubMed, Web of Sciencie, EMBASE, Lilacs, Cochrane, Epistemonikos, Tripdatabase y ClinicalTrials.gov dirigida a localizar artículos que evaluasen el rendimiento diagnóstico de la PCT para la predicción de bacteriemia en pacientes adultos atendidos en los SUH.
La estrategia de búsqueda inicial combinó los términos MeSH (Bacteremia OR Bacteraemia OR Blood Stream Infection) AND (Procalcitonin) de forma inicial en todas las bases de datos sin restricciones de idioma desde enero de 2010 hasta el 31 de mayo de 2023.
En un segundo paso, se incluyeron los términos (Emergencies OR Emergency OR Emergency Department) y, tercero el término (Adults). Siendo las estrategias de búsquedas secundarias: ((Bacteremia OR Bacteraemia OR Blood Stream Infection) AND (Procalcitonin)) AND ((Emergencies OR Emergency OR Emergency Department)) y (((Bacteremia OR Bacteraemia OR Blood Stream Infection) AND (Procalcitonin)) AND ((Emergencies OR Emergency OR Emergency Department))) AND ((Adults)).
Finalmente, en todas las secuencias de búsqueda se priori-zó la inclusión de revisiones sistemáticas, revisiones sistemáticas-metaanálisis y estudios de cohortes observacionales (analíticos de rendimiento diagnóstico).
Criterios de inclusión y exclusión
Criterios de Inclusión:
- Pacientes adultos (mayores de 14 años) atendidos en el SUH con la sospecha clínica o confirmación de un proceso infeccioso (con o sin criterios de sepsis) originado en la comunidad y posible bacteriemia.
- Para ser incluido entre los estudios de análisis, el artículo informaba sobre las estimaciones de precisión diagnóstica para la bacteriemia de la PCT [dando a conocer el área bajo la curva (ABC) y/o al menos la sensibilidad, la especificidad y los valores p correspondientes].
- La valoración clínica, así como la extracción de la analítica y de la PCT (sanguínea) y de los HC se debe haber hecho en la primera atención del paciente en el ámbito del SUH, siempre dentro de las primeras 24 horas desde la llegada del paciente al hospital.
- Los estudios proporcionaban una descripción de los grupos de pacientes con y sin bacteriemia verdadera, así como de las variables demográficas, epidemiológicas, clínicas, etc.
- En el caso de la PCT (técnicas y métodos de detección utilizados son cuantitativos), dada la falta de estandarización para su medida, sólo se incluyeron aquellos estudios en los que dicha magnitud fuera medida mediante ensayos BRAHMS-like [32].
Criterios de exclusión:
- Pacientes en edad pediátrica (≤ 14 años) o pacientes mixtos (pediátricos y adultos).
- Pacientes atendidos o valorados en otros servicios y entornos (Medicina Intensiva-Críticos, postquirúrgicos, hospitalización, Atención Primaria) o en un entorno distinto al SUH o en entornos mixtos (SUH más otros servicios).
- Posible origen nosocomial del proceso infeccioso.
- Artículos con baja potencia o muestra considerada limitada (escaso número de episodios de bacteriemia verdadera).
- Estudios de casos y controles, revisiones narrativas, informes de casos, editoriales, comentarios o puntos de vista, cartas al director, resúmenes de reuniones o congresos, presentaciones de carteles/posters, etc.
Extracción de datos y análisis de la calidad. La selección de los artículos se determinó utilizando las fases del método PRISMA [31]: 1.- Identificación, 2.- Cribado, 3.- Elegibilidad (idoneidad) y, 4.- Inclusión definitiva de artículos en la revisión.
De cada estudio incluido se extrajo la siguiente información: primer autor; año publicación; país; tamaño de la muestra; diseño del estudio; porcentaje de bacteriemia verdadera; edad media y sexo; tipo paciente/proceso/foco; rendimiento diagnóstico de la PCT según disponibilidad de los datos que se encontraron: sensibilidad, especificidad, valor predictivo positivo (VPP), valor predictivo negativo (VPN) y el área bajo la curva de la característica operativa del receptor (ABC-COR) con sus intervalo de confianza al 95% (IC 95%) cuando estos determinandos y el IC 95% estaban reflejados en los artículos originales; y el punto o valor de decisión (corte) elegido en cada estudio según el índice de Youden o la máxima sensibilidad obtenida o predeterminado por los autores (según lo registrado en cada estudio). Además, se incluye un comentario sobre el tipo de técnica y método utilizado para el análisis de la PCT.
Todos estos datos se compararon por tablas (al no realizarse técnicas de síntesis en este artículo de revisión sistemática).
Se consideró ABC-COR adecuado cuando se obtuviera un valor entre 0,8 y 0,9, muy buena > 0,9 y perfecta si el resultado fue 1 [33].
En el caso de ausencia de ciertos datos relevantes analizados en alguno de los estudios, se intentó contactar con los autores principales para facilitar los datos no publicados o no accesibles. En estos casos, si se recibió respuesta y el dato, se incluyeron. Pero, si no se consiguieron por no existir o no haber respuesta, se excluyó dicho estudio del análisis concreto para el que no se hubiera recuperado la información.
En la fase de elegibilidad tres revisores realizaron la lectura completa del texto de los artículos y los evaluaron de forma independiente y, posteriormente, extrajeron los datos. En caso de desacuerdo, se discutió con un cuarto revisor y se llegó a un consenso unánime.
Para valorar la calidad del método empleado y el riesgo de sesgos de los artículos de cohortes de precisión diagnóstica incluidos en esta RS se utilizó la Newcastle-Ottawa Scale (NOS) para estudios de cohortes (valorada individualmente por dos revisores). Los criterios para la evaluación cualitativa comprendieron tres ítems principales: selección de muestra, comparabilidad y exposición. Cada uno de estos ítems tenía preguntas con opciones y podría recibir 1 o 2 puntos (estrellas/*) si se cumplían los criterios. Los estudios con puntuaciones totales de 1-3, 4-6 y 7-9 se definieron como de baja calidad metodológica (alto riesgo de sesgos), media y alta calidad (bajo riesgo de sesgos), respectivamente [34]. En el caso de las revisiones sistemáticas y metaanálisis se utilizó la herramienta AMSTAR 2 (A MeaSurement Tool to Assess Systematic Reviews-2) [35] para la evaluación del riesgo de sesgos y la calidad de la propia revisión sistemática.
No se realizó transformación de los datos ni se abordó el sesgo de publicación.
Finalmente, no se realizaron técnicas de metaanálisis, pero los resultados se compararon narrativamente y se estimaron las medias de los desenlaces críticos.
RESULTADOS
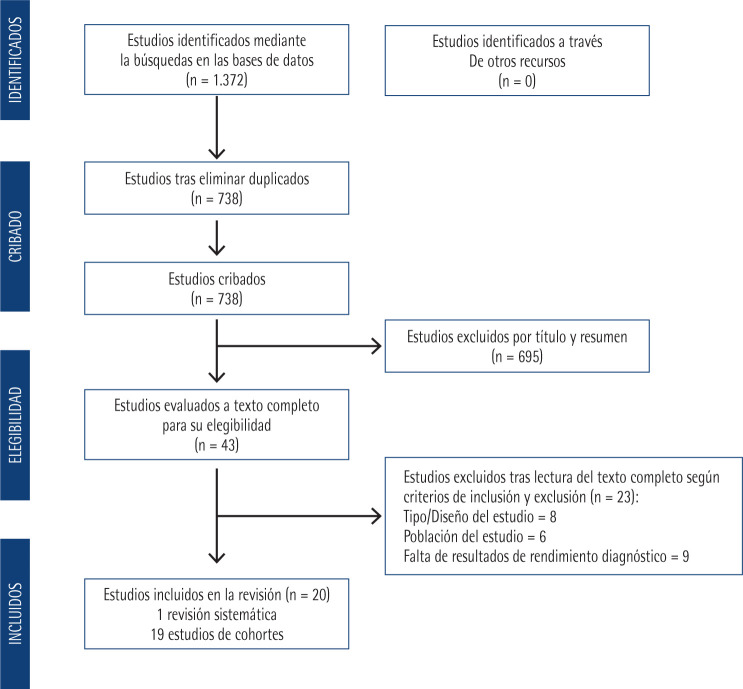
Selección de estudios. El diagrama de flujo de la búsqueda bibliográfica y selección definitiva de los artículos a incluir se muestra en la Figura 1, de acuerdo a las fases del método PRISMA [31]: 1.-Identificación, 2.-Cribado, 3.-Elegibilidad (idoneidad) y, 4.-Inclusión definitiva de artículos en la revisión.
Figura 1.
Diagrama de flujo del proceso de selección de los estudios (según PRISMA)
Se identificaron 1.372 artículos en las bases de datos seleccionadas. Finalmente, 20 fueron los artículos que se incluyeron en esta revisión sistemática: 19 estudios de cohortes [36-54] y una revisión sistemática [24].
Características de los estudios incluidos. En la tabla 1 se muestran las características de los 20 artículos incluidos en esta revisión finalmente en dos idiomas (inglés y español). En primer lugar, una revisión sistemática [24] publicada en el año 2015 de la que se muestran los datos seleccionados de 1.425 pacientes agrupados de 19 estudios incluidos (de los 53 de dicha revisión sistemática) que fueron analizados en un subgrupo independiente de pacientes adultos valorados y con HC extraídos en el SUH. A continuación, el resto artículos de cohortes que fueron publicados desde el 2010 [36] hasta 2022 [53-54].
Tabla 1.
Características de los estudios incluidos en la revision
| Autores Año País Referencia |
n (tamaño de la muestra) | Diseño Cohorte Retrospectiva prospectiva |
Edad (años) Sexo: Hombres (%) |
Tipo paciente/ Proceso/foco |
% bacteriemia del total de la muestra | ABC-COR IC 95% |
Se (%) IC 95% |
Es (%) IC 95% |
VPP (%) IC 95% |
VPN (%) IC 95% |
Procalcitonina Punto corte elegido en el estudio (ng/ml) |
Técnica-metodología valoración de las concentraciones de procalcitonina | Evaluación Calidad Y sesgos NOS |
|||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hoeboer et al. 2015 The Netherlands [24] |
1.425 | RS-M con Prospectivos (16) y retrospectivos (3) |
Media 61 51% |
Fiebre. Sospecha infección. Sepsis. ITU. Neumonías. Neutropenia febril. |
8% | 0,78 nd |
76 (69-82) |
68 (61-75) |
17 nd |
97 nd |
0,5 Aunque varía de 0,15 – 2,0 la media y el más utilizado en 10 ocasiones en 0,5 ng/ml |
Todos cuantitativa con reactivos y técnicas validadas por B.R.A.H.M.S. Diagnostica y una Se de entre 0,09 ng/ml y 0,01 ng/ml | En los 19 estudios seleccionados Media de 12 puntos de la herramienta QUADAS [71] Y valoración de calidad Alta de la Revisión sistemática con la AMSTAR 2 [35] |
|||||
| van Nieuwkoop et al. The Netherlands 2010 [36] |
581 | Prospectivo | Mediana 66 (RIC 46-78) 38% |
ITU | 23% | 0.73 (0.67-0.77) |
95 89-98 |
50 46-55 |
36 31-40 |
97 93-99 |
0,25 | PCT concentración utilizando “Time Resolved Amplified Cryptate Emission technology assay” (TRACE®, Kryptor compact, PCTsensitive; Brahms AG; Hennigsdorf, Germany). | 9 | |||||
| Tudela et al. España 2012 [37] |
412 | Prospectivo | Media 69 60% |
Sospecha infección | 13% | 0,80 (0,73-0,86) |
64 (50-76) |
84 (80-88) |
37 (28-48) |
94 (91-96) |
1 | Ensayo inmunofluorescente (Kryptor, BRAHMS AG, Alemania), se consideraron valores normales inferiores a 0,5 ng/mL | 8 | |||||
| Ahn et al. Corea del Sur 2013 [38] |
355 | Prospectivo | Media 54 (DE 12) 37% |
Neutropenia febril | 10% | 0,82 (0,73-0,90) |
71 nd |
82 nd |
30 nd |
97 nd |
0,5 | VIDAS (BRAHMS PCT). Sensibilidad: 0,05 ng/ml | 6 | |||||
| Julián-Jiménez et al. España 2014 [39] |
127 | Prospectivo | Media 68 (DE 20) 58% |
Neumonía | 23% | 0,95 (0,90-1) |
93 78-98 |
90 82-94 |
73 59-87 |
98 95-100 |
0,95 | Valores de referencia: < 0,5 ng/ml. Método: inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT® ). Sensibilidad: 0,02 ng/ml | 8 | |||||
| Julián-Jiménez et al. España 2014 [40] |
474 | Prospectivo | Media 64 (DE 20) 56% |
Neumonía | 18% | 0,98 (0,90-0,99) |
94 87-98 |
91 88-94 |
70 60-79 |
99 97-99 |
0,95 | Valores de referencia<0,5ng/ml. Método: inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT). Sensibilidad: 0,02 ng/ml | 9 | |||||
| Laukemann et al. Suiza 2015 [41] |
1.083 | Prospectivo | Mediana 67 (RIC 53-78) 58% |
Sospecha de infección | 10% | 0,80 nd |
71 (61-80) |
73 (70-76) |
22 (19-27) |
96 (94-97) |
0,5 | PCT concentraciones a través de KRYPTOR PCT; Thermo Scientific Biomarkers [formerly BRAHMS AG], Hennigsdorf, Germany; lower limit of detection: 0.02 mg/L. | 8 | |||||
| Kim et al Corea del Sur 2015 [42] |
3.305 | Retrospectivo | RANGO 20-90 | Infección | 17% | nd | 76 nd |
65 nd |
32 nd |
91 nd |
1 | VIDAS (BRAHMS PCT). Sensibilidad: 0,05 ng/ml | 4 | |||||
| Julián-Jiménez et al. España 2015 [43] |
328 | Retrospectivo | Media 52 (DE 22) 26% |
Infección del tracto urinario | 13% | 0,98 (0,97-0,99) |
97 (92-99) |
85 (81-89) |
61 (51-72) |
99 (97-99) |
0,5 | Valores de referencia<0,5ng/ml. Método: inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT). Sensibilidad: 0,02 ng/ml | 8 | |||||
| Morales et al. España 2016 [44] |
98 | Prospectivo | Media 44 (DE 21) 67% |
Pacientes con meningitis | 19% | 0,96 (0,92-1) |
95 (74-99) |
72 (53-88) |
69 (48-86) |
95 (77-99) |
1,1 | PCT por inmunoanálisis cuantitativo de electroquimioluminiscencia (ELECSYS BRAHMS PCT®) con una sensibilidad de 0,02 ng/ml. | 6 | |||||
| Contenti et al. Francia 2019 [45] |
359 | Prospectivo | Media 70 (DE 18) 56% |
Infección /sepsis | 20% | 0,84 (0,79-0,87) |
73 (59-84) |
83 (78-87) |
nd | nd | 2,25 | La PCT se midiópor un método de electroquimioluminiscencia (Elecsys® BRAHMS PCT) | 5 | |||||
| García et al. España 2019 [46] |
111 | Prospectivo | Media 63 39% |
Neutropenia febril | 14% | 0,86 (0,78-0,92) |
81 (54-96) |
80 (71-88) |
41 (24-60) |
96 (89-99) |
0,34 | PCT medida en un analizador Cobas e411 (Roche Diagnostic, Mannheim, Germany) por electroinmunoluminiscencia. Con sensibilidad entre 0,02 mg/L, 0,06 mg/L and 0,02 a 100 mg/L, | 6 | |||||
| Kok et al. 2019 Taiwan [47] |
886 | Retrospectivo | ≥ 18 nd |
sepsis | 22 % | 0,72 (0,69-0,75) |
58 (51-65) |
79 (76-82) |
nd | nd | 3,9 | Mini VIDAS (BioMérieux, Marcy-l’étoile, France) B.R.A.H.M.S procalcitonin analysis.The VIDAS B.R.A.H.M.S procalcitonin usa electroquimioluminiscencia. La referencia es 0.5 ng/ml con sensibilidad de 0.05 ng/ml. | 6 | |||||
| Valera-Patiño et al. España 2020 [48] |
569 | Retrospectivo | Mediana 79 (RIC 66-86) 56% |
Infección /sepsis | 31 % | 0,70 (0,65-0,75) |
60 (52-68) |
70 (65-75) |
49 (42-57) |
79 (73-83) |
2,54 | Vidas BRAHMS PCT, el límite de detección está en 0.009 ng/mL y el rango de medición se sitúa entre 0.009-200 ng/ml. | 6 | |||||
| Zafar et al. España 2020 [49] |
1.425 | Retrospectivo | Media 53 (DE 19) 47% |
Sospecha infección | 13% | 0,96 (0,95-0,97) |
88 (85-91) |
91 (88-94) |
57 (53-60) |
98 (96-99) |
0,5 | Método de inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®), que ofrece una sensibilidad de 0,02 ng/mL. | 9 | |||||
| Gornet et al. Francia 2021 [50] |
459 | Retrospectivo | Media 60 (DE 22) 51% |
infección | 9,8% | 0,68 (0,59-0,77) |
56 (41-70) |
66 (62-71) |
15 (10-20) |
93 (90-96) |
0,5 | Cobas 8000 analizador (Roche diagnostic). Las concentraciones de PCT fueron medidas con el Elecsys BRAHMS PCT electroquimioluminiscencia | 9 | |||||
| Leroux et al. Francia 2021 [51] |
852 | Retrospectivo | Media 62 (DE 23) 49% |
Sospecha infección | 9% | 0,74 (0,67-0,80) |
64 (51-74) |
71 (67-74) |
17 (13-22) |
95 (93-97) |
0,5 | Método cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®), que ofrece una sensibilidad de 0,02 ng/mL. | 3 | |||||
| Azijli et al. The Netherlands 2021 [52] |
546 | Prospectivo | Media 64 (DE 17) 55% |
Sospecha de infección para descartar diagnóstico microbiológico y viral | 8,6% | 0,86 (0,81-0,91) |
77 (62-88) |
78 (74-81) |
25 (21-29) |
97 (95-98) |
0,5 | Método cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®), que ofrece una sensibilidad de 0,02 ng/mL. | 5 | |||||
| Rubio-Díaz et al. España 2022 [26] |
4.439 | Prospectivo | Media 67 (DE 18) 59,7% |
Sospecha de Infección | 20,2% | 0,86 (0,85-0,88) |
78 (75-81) |
85 (83-87) |
59 (56-62) |
94 (93-95) |
0,5 | Método cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®), que ofrece una sensibilidad de 0,02 ng/mL. | 8 | |||||
| Jabbour et al. Italia 2022 [53] |
286 | Prospectivo | Mediana 70 (RIC 61-75) | Pacientes con enfermedad hematológica con fiebre | 16% | 0,85 IC 95%: 0,79-0,95 |
93 (81-98) |
65 (58-70) |
30 (27-35) |
98 (95-99) |
0,5 | BRAHMS (Thermo Fisher Diagnostics S.p.A), las muestras de sangre PCT se midieron directamente en el laboratorio central de análisis del Hospital con un ensayo inmunoluminométrico. | 4 | |||||
ABC-COR: área bajo la curva de la característica operativa del receptor; Se: sensibilidad; Es: especificidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo; nd: no disponible; IC 95%: intervalo de confianza al 95%;
RS: revisión sistemática; M: metaanálisis; ITU: infección del tracto urinario; RIC: rango intercuartílico; DE: desviación estándar; NOS: Newcastle-Ottawa Scale; AMSTAR 2: A MeaSurement Tool to Assess Systematic Reviews-2;
QUADAS: Quality Assessment of Diagnostic Accuracy Studies
Nueve se desarrollaron en España [37,39,40,43,44,46,48,49,53], siete en otros países europeos [36,41,45,50,51,52,54] y tres en Asia [38,42,47]. En total se han incluido 18.120 pacientes con 2.877 bacteriemias verdaderas (15,88 %). Las poblaciones fueron heterogéneas ya que presentaron un porcentaje de bacteriemia verdadera desde el 8% [24] hasta el 31% [48], trece fueron prospectivos frente a siete retrospectivos, todos los pacientes eran adultos con una edad media desde 44 (DE 21) años [44] hasta mediana de 79 años [48] y la proporción de hombres varió desde el 37% [38] hasta el 67% [44]. En la mayoría de los estudios (12) la extracción de HC se produjo en pacientes con fiebre o sospecha de infección bacteriana con o sin sepsis [24,26,37,41,42,45,47-52] , dos en diagnosticados de neumonía adquirida en la comunidad [39,40], dos en pacientes con infección del tracto urinario [36,43], dos en enfermos con neutropenia febril [38,46], uno en pacientes con sospecha de meningitis [44] y uno en pacientes con enfermedad hematológica y fiebre [53]. Todos los estudios incluyeron criterios o definiciones para considerar los HC contaminados, considerándose estos como HC negativos. Todos los estudios incluidos utilizaron técnicas y métodos cuantitativos mediante ensayos BRAHMS-like para la obtención de valores de PCT [32]. Por su parte, los puntos de corte o de decisión de PCT considerados con mejor rendimiento o valor clínico por los autores oscilaron entre 0,25 ng/ml [36] hasta 3,9 ng/ml [47]. Aunque, el valor de 0,5 ng/ml de PCT es el más utilizado y propuesto tanto en la revisión sistemática [24] como en nueve estudios [26,38,41,43, 49-53].
Los estudios excluidos tras la lectura a texto completo lo fueron por: ocho por el diseño o tipo de artículo (5 revisiones narrativas [23,25,29,55,57], 2 artículos de opinión [27,56] y 1 de casos y controles [54]); seis porque la población no cumplía los criterios de inclusión de esta RS [7,22,58-61]; y nueve por falta de datos sobre el rendimiento diagnóstico de predicción de bacteriemia por parte de la PCT o la muestra y número de bacteriemias verdaderas era muy limitado [62-70].
En la tabla 2 se muestra la evaluación de la calidad de los estudios de cohortes incluidos y de sus riesgos de sesgos según la escala NOS [34]: 9 de ellos fueron calificados de calidad alta (bajo riesgo de sesgos) [26,36,37,39,40, 41,43,49,50], 9 moderada [38,42,44,45,46,47,48,52,53] y 1 baja (alto riesgo de sesgos) [51]. Para los estudios incluidos y agrupados de la revisión sistemática [24] se asumió el análisis publicado en la misma que utilizó para la evaluación de la calidad la herramienta Quality Assessment of Diagnostic Accuracy Studies (QUADAS) [71], cuyas puntuaciones oscilan entre 0 y 14, para evaluar la calidad metodológica de los estudios incluidos. La media de los 19 estudios válidos incluidos fue de 12 puntos (considerándose de buena calidad y bajo riesgo de sesgos). Previamente, la propia Revisión Sistemática se había evaluado con la herramienta AMSTAR 2 [35] obteniendo una valoración ALTA de confianza en los resultados.
Tabla 2.
Calidad de los estudios incluidos con la valoración de la escala Newcastle-Ottawa
| Estudio | A.- Selección de la muestras o de las cohortes | B.- Comparabilidad de cohortes sobre la base del diseño o análisis |
C.- Desenlace/ resultados |
Puntuación Total (riesgo de sesgo) |
||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
| van Nieuwkoop et al. [36] | * | * | * | * | * | * | * | * | * | 9 (bajo) |
| Tudela et al. [37] |
* | * | * | * | * | * | * | * | - | 8 (bajo) |
| Ahn et al. [38] |
* | * | * | * | - | - | * | * | - | 6 (medio) |
| Julián-Jiménez et al. [39] |
* | * | * | * | * | - | * | * | * | 8 (bajo) |
| Julián-Jiménez et al. [40] |
* | * | * | * | * | * | * | * | * | 9 (bajo) |
| Laukemann et al. [41] | * | * | * | - | * | * | * | * | * | 8 (bajo) |
| Kim et al [42] |
* | * | - | * | - | - | * | - | - | 4 (medio) |
| Julián-Jiménez et al. [43] |
* | * | * | * | * | * | * | * | - | 8 (bajo) |
| Morales et al. [44] |
* | * | * | * | - | - | * | * | - | 6 (medio) |
| Contenti et al. [45] |
* | * | * | - | - | - | * | * | - | 5 (medio) |
| García et al. [46] |
* | * | * | * | - | - | * | * | - | 6 (medio) |
| Kok et al. [47] |
* | * | * | * | - | - | * | * | - | 6 (medio) |
| Valera-Patiño et al. [48] |
* | * | * | * | - | - | * | * | - | 6 (medio) |
| Zafar et al. [49] |
* | * | * | * | * | * | * | * | * | 9 (bajo) |
| Gornet et al. [50] |
* | * | * | * | * | * | * | * | * | 9 (bajo) |
| Leroux et al. [51] |
* | - | - | - | - | - | * | * | - | 3 (alto) |
| Azijli et al. [52] |
* | - | * | * | - | - | * | * | - | 5 (medio) |
| Rubio-Diaz et al. [26] | * | * | * | * | * | - | * | * | * | 8 (bajo) |
| Jabbour et al. [53] |
* | - | * | * | - | - | * | - | - | 4 (medio) |
Wells G, Shea B, O’Connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. URL: http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp
Comparación y rendimientos diagnósticos de la pro-calcitonina según los distintos estudios y puntos de decisión. Los rendimientos y capacidad predictiva de la PCT para bacteriemia verdadera es muy variable dependiendo del estudio (tabla 1) y, entre otros determinantes, del punto de corte elegido. El ABC-COR de todos los estudios se sitúa desde 0,68 (IC 95%:0,59-0,77) [50] hasta 0,98 (IC 95%: 0,90-0,99 [40] y IC 95%: 0,97-0,99 [43]).
El valor de punto de corte > 0,5 ng/ml de PCT es el más utilizado y propuesto hasta en diez de los trabajos que se incluyen en esta revisión sistemática [24,26,38,41,43,49-53] (tabla 3) cuyo rendimiento medio estimado es de un ABC-COR de 0,833. Pero, si solo tenemos en cuenta los resultados de los seis estudios calificados de alta calidad (bajo riesgo de sesgos) [24,26,41,43,49,50] que utilizan un punto de corte > 0,5 ng/ml de PCT, el resultado medio estimado del ABC-COR obtenido es de 0,89 con sensibilidad de 77,6% y especificidad del 78%.
Tabla 3.
Comparación del rendimiento diagnóstico de bacteriemia de los estudios que definieron el punto de decisión de procalcitonina mayor 0,5 ng/ml
| Referencia | ABC-COR IC 95% |
Se (%) IC 95% |
Es (%) IC 95% |
VPP(%) IC 95% |
VPN(%) IC 95% |
|---|---|---|---|---|---|
| Hoeboer et al. [24] | 0,78 nd |
76 (69-82) |
68 (61-75) |
17 nd |
97 nd |
| Rubio-Díaz et al. [26] | 0,86 (0,85-0,88) |
78 (75-81) |
85 (83-87) |
59 (56-62) |
94 (93-95) |
| Ahn et al. [38] | 0,82 (0,73-0,90) |
71 nd |
82 nd |
30 nd |
97 nd |
| Laukemann et al. [41] | 0,80 nd |
71 (61-80) |
73 (70-76) |
22 (19-27) |
96 (94-97) |
| Julián-Jiménez et al. [43] | 0,98 (0,97-0,99) |
97 (92-99) |
85 (81-89) |
61 (51-72) |
99 (97-99) |
| Zafar et al.[49] | 0,96 (0,95-0,97) |
88 (85-91) |
91 (88-94) |
57 (53-60) |
98 (96-99) |
| Gornet et al. [50] | 0,68 (0,59-0,77) |
56 (41-70) |
66 (62-71) |
15 (10-20) |
93 (90-96) |
| Leroux et al. [51] | 0,74 (0,67-0,80) |
64 (51-74) |
71 (67-74) |
17 (13-22) |
95 (93-97) |
| Azijli et al. [52] | 0,86 (0,81-0,91) |
77 (62-88) |
78 (74-81) |
25 (21-29) |
97 (95-98) |
| Jabbour et al. [53] | 0,85 (0,79-0,95) |
93 (81-98) |
65 (58-70) |
30 (27-35) |
98 (95-99) |
ABC-COR: área bajo la curva de la característica operativa del receptor; Se: sensibilidad; Es: especificidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo; nd: no disponible; IC 95%: intervalo de confianza al 95%
DISCUSIÓN
Esta revisión sistemática ha evaluado, en pacientes adultos atendidos en el SUH con el diagnóstico clínico de infección, la capacidad predictiva de bacteriemia verdadera del biomarcador PCT, considerando de forma global todos los pacientes e independientemente del proceso infeccioso que la hubiera originado. Además, de forma secundaria se ha evaluado el rendimiento predictivo de bacteriemia específicamente cuando el punto de corte de la PCT se establece en 0,5 ng/ml. Ya que este valor es evaluado por una mayoría de los artículos incluidos en esta revisión sistemática [24,26,38,41,43,49-53] y coincide con el recomendado por numerosos autores que utilizan la PCT de forma aislada para predecir la existencia de bacteriemia verdadera en los pacientes con infección o sepsis en los SUH [14,22,23,26,72], tanto para pacientes adultos como mayores de 65 años [73,74], como aquellos que la incluyen como una de las variables en los distintos modelos predictivos de bacteriemia que han sido publicados en los últimos años [25,27,29]. Del mismo modo, estos resultados refuerzan o corroboran los encontrados y publicados en otras áreas asistenciales, fundamentalmente desarrollados con pacientes pediátricos, de planta de hospitalización y, sobre todo, de los ingresados en las unidades de cuidados intensivos [7,22, 24, 58-61].
Los rendimientos y capacidad predictiva de la PCT para bacteriemia verdadera en los HC obtenidos en los SUH de pacientes con infecciones comunitarias varia desde 0,68 (IC 95%: 0,59-0,77) [50] hasta 0,98 (IC 95%: 0,97-0,99) [43]. Cuando el punto de corte elegido es 0,5 ng/ml de PCT, que se corresponde con el más aceptado en la actualidad por múltiples autores [23-25,27,62-66,75-77], el resultado medio obtiene un ABC-COR adecuada y útil, casi en el límite de poder calificarla como muy buena, de 0,89 con una con sensibilidad de 77,6% y especificidad de 78%.
Aunque se han publicado otras revisiones sistemáticas y metaanálisis previos sobre la precisión diagnóstica de la PCT para predecir bacteriemia verdadera [22,24], ninguna publicación de forma parcial o completa ha evaluado su rendimiento en pacientes del SUH con procesos comunitarios desde el año 2014 [24]. De ahí, que esta revisión trata de enfatizar en la importancia de estos resultados para normalizar el uso de la PCT como herramienta de ayuda en los SUH, tal y como se usa en servicios de medicina crítica [23-25,62-66,75-78]
En el año 2007, Jones et al [22], en un metaanálisis que incluía solo 4 artículos (de los 17), entre sus estudios, con pacientes de los SUH, mostraba globalmente un ABC-COR de 0,84 (IC 95%: 0,75-0,90), una sensibilidad del 76% (IC 95%:66-84) y una especificidad del 70% (IC 95%:60-79) [22]. Esta revisión sistemática y metanálisis mostraba dudas sobre la utilidad generalizada de la PCT para la precisión diagnóstica de bacteriemia verdadera, pero se debe tener en cuenta las limitaciones de dicha revisión que, incluso en alguno de sus artículos, no tenía como variable dependiente la propia bacteriemia verdadera, si no la existencia de criterios de sepsis, por ejemplo [22].
Posteriormente, Hoeber et al [24] publicaron una revisión sistemática y metanálisis que incluye 58 estudios con 16.514 pacientes (3.420 con bacteriemia) que establece para todos los casos un ABC-COR de 0,79 con un punto de corte óptimo de 0,5 ng/ml con una sensibilidad del 76% (IC 95%: 72-80) y una especificidad del 69% (IC 95%: 64-72). Dentro de la totalidad de casos establece subgrupos donde destaca la menor ABCCOR obtenida en los inmunodeprimidos/neutropénicos, de 0,71, con una sensibilidad del 66% (IC 95%: 54-76) y una especificidad del 78% (IC 95%: 71-83). Por el contrario, el ABCCOR más alta, de 0,88, se obtiene en los pacientes de cuidados intensivos, con una sensibilidad del 89% (IC 95%: 79-94) y una especificidad del 68% (IC 95%: 57-77). En relación al subgrupo de pacientes (1.495) de los SUH, el ABC-COR encontrada fue de 0,78 con sensibilidad del 76% (IC 95%:69-82) y especificidad del 68% (IC 95%:61-75) y un interesante VPN del 97% [24]. De ahí que sus autores recomendaran su utilidad para descartar la presencia de bacteriemia verdadera y así poder valorar el alta de los pacientes desde el SUH [24].
En esta línea, en los estudios incluidos en nuestra revisión a partir del año 2015 [26,41,43,49,50] con 7.734 pacientes de los SUH, mostramos un ABC-COR media estimada incluso mayor (0,85) que la de Hoeber et al [24]. Estos estudios ofrecen una sensibilidad de 56% a 97%, especificidad de 66% a 91% y un VPN de 93% a 99% [26,41,43,49,50]. Por ello, se puede aceptar como una herramienta de ayuda válida para sospechar o predecir la existencia de bacteriemia verdadera en el paciente con distintos procesos infecciosos (fiebre, sepsis, neumonía, ITU, meningitis) en los SUH. Y gracias a los excelentes VPN obtenidos (del 93-99%) para descartar, razonablemente, la coexistencia de bacteriemia verdadera en estos pacientes, con lo que esto implica para las decisiones urgentes a tomar en estas áreas asistenciales como la indicación de extraer HC, decidir el alta o ingreso, tipo de terapia antimicrobiana, entre otras [2,13,14,18,19].
Por otro lado, recientemente se ha publicado como el empleo de la PCT >0,5 ng/ml junto a otros criterios definitorios de sepsis (síndrome de respuesta inflamatoria sistémica) consiguen aumentar de forma significativa la capacidad de predicción de bacteriemia [26], así como distintos modelos predictivos de bacteriemia con excelente rendimientos donde la concentración de PCT >0,5 ng/ml se confirma como el criterio con más peso de dichas escalas en la valoración predictiva de bacteriemia verdadera en los pacientes con infección en los SUH [26,62-66,75,76].
La principal limitación del proceso de elaboración de esta revisión sistemática ha sido encontrar artículos que cumplieran los criterios de inclusión y, especialmente, que fueran exclusivos de pacientes adultos y solo atendidos en los SUH. De hecho, se encontraron muchos en la fase de cribado y de elegibilidad cuyo objetivo eran valorar la capacidad predictiva de bacteriemia verdadera de la PCT, pero, en su gran mayoría desarrollados en hospitalización, pediatría o medicina intensiva [7,22,58-61]. Además, solo se encontró una revisión sistemática-metanálisis donde 19 de sus 53 estudios cumplían con los criterios de inclusión y, junto a estos otros 19 estudios de cohortes.
Otra limitación a tener en cuenta de esta revisión es que el sesgo de publicación no ha sido contemplado.
Por otro lado, no se encontraron problemas ni supusieron dificultades las distintas bases de datos, ni el idioma (se encontraron en inglés y español).
Por otro lado, hoy en día cada vez es mayor la literatura relativa a distintos BMRII donde se evalúa su capacidad predictiva o precisión diagnóstica de bacteriemia verdadera, como en el caso de la PCR, IL 6 y 8, presepsina, proADM, entre otros. Pero, ninguno de ellos hasta el momento ha conseguido superar los resultados de la PCT (de forma aislada o formando parte de un modelo o escala predictiva) [22-29]. Por ello, junto con la disponibilidad actual generalizada de la PCT en los SUH [79]., se refuerza su papel como herramienta de ayuda para la predicción de bacteriemia (además de infección bacteriana y sepsis) [2,19]. En este sentido, aunque en España ya se ha constatado que la disponibilidad de la procalcitonina es real en más del 70% de los SUH, solo en el 69% de estos se usa habitualmente y de forma libre a demanda sin restricciones. En el resto, bien por falta de disponibilidad durante la tarde o la noche, o bien por estar restringida su solicitud a otros especialistas (medicina crítica o infectólogo, por ejemplo) o porque no está en la cartera de servicios del Centro, no se dispone de forma continua de esta determinación en todos los SUH [2,9,79].
Posiblemente, en un futuro muy cercano, en la atención al paciente con infección grave en los SUH, en el propio triaje se dispondrá de escalas o modelos automáticos o electrónicos que seleccionarán a los pacientes con alta probabilidad de infección bacteriana y bacteriemia, a los que se les aplicará los modelos diagnósticos y predictivos de bacteriemia y gravedadmortalidad, de forma que se pueda optimizar el diagnóstico microbiológico (indicación de obtener HC) y las medidas terapéuticas (antibioterapia adecuada y precoz, control del foco) [2,19,27-29,77].
Por último, los autores quieren resaltar la necesidad e importancia de elaborar estudios desde los SUH con pacientes que acuden a ellos con procesos infecciosos comunitarios para confirmar o discutir los resultados y recomendaciones que se hacen, precisamente para los SUH, sin evidencia científica originada sus pacientes y sus procesos [2,9,18,19,23].
CONCLUSIONES
Esta revisión muestra que la PCT tiene una precisión diagnóstica de bacteriemia considerable y representa una herramienta útil para la estratificación del riesgo real de bacteriemia verdadera en los pacientes atendidos en los SUH por los distintos procesos infecciosos que se valoran en dichas áreas asistenciales. Además, el punto de decisión >0,5 ng/ml se ha posicionado como el más adecuado, estudiado y validado para predecir la existencia de bacteriemia siempre de forma combinada con el juicio clínico y otras variables independientes del proceso y del paciente. En particular, dicho punto de corte <0,5 ng/ml se puede utilizar para descartar, razonablemente, la existencia de bacteriemia. De esta forma, facilitaría la toma de decisión de indicación de obtención de HC y la estrategia diagnóstico-terapéutica.
FINANCIACIÓN
Los autores declaran que no han recibido financiación para la realización de este trabajo.
CONFLICTO DE INTERESES
Todos los autores declaran no tener conflictos de interés en relación con este artículo. Ningún autor ha recibido compensación económica por participar en este trabajo.
- AJJ ha participado en reuniones científicas organizadas por Bayer, Sanofi, Boehringer, Esteve, GSK, Lilly, MSD, Pfizer, Tedec Meiji, Roche Diagnostics, Thermo Fisher Scientific, B.R.A.H.M.S. AG, ViroGates y Biomerieux.
- DEG declara la no existencia de conflictos de intereses.
- GMS declara la no existencia de conflictos de intereses.
- LGGR ha participado en reuniones científicas organizadas por ViroGates, Roche Diagnostics, Gentian, Radiometer, Abionic, Nova Biomedical y Snibe.
- JGC ha participado en reuniones organizadas por Bayer, Boehringer, GSK, MSD, Pfizer, Tedec Meiji, Thermo Fisher Scientific, Laboratorios Rubio, Rovi, LeoPharma, Sanofi, Bristol Myers Squibb, AstraZeneca, Novo Nordisk y Angelini.
References
- 1.Martínez Ortiz de Zárate M, González del Castillo J, Julián-Jiménez A, Piñera Salmerón P, Llopis Roca F, Guardiola Tey JM, et al. Estudio INFURG-SEMES: epidemiología de las infecciones atendidas en los servicios de urgencias hospitalarios y evolución durante la última década. Emergencias 2013; 25:368-78. [Google Scholar]
- 2.Julián-Jiménez A, Supino M, López Tapia JD, Ulloa González C, Vargas Téllez LE, González del Castillo J, et al. Puntos clave y controversias sobre la sepsis en los servicios de urgencias: propuestas de mejora para Latinoamérica. Emergencias 2019;31:123-135. PMid: [PubMed] [Google Scholar]
- 3.Bauer M, Gerlach H, Vogelmann T, Preissing F, Stiefel J, Adam D. Mortality in sepsis and septic shock in Europe, North America and Australia between 2009 and 2019–results from a systematic review and meta-analysis. Crit Care. 2020;24:239. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Aguiló Mir S. Identificar al paciente frágil en un servicio de urgencias: un esfuerzo urgente y necesario. Emergencias. 2023;35:165-6. PMid: [PubMed] [Google Scholar]
- 5.López-Izquierdo R, Ramos-Sánchez MC, Eiros JM. Análisis estacional de los hemocultivos solicitados desde un servicio de urgencias hospitalario. Emergencias. 2021;33:70-1. PMid: [PubMed] [Google Scholar]
- 6.Rubio Díaz R, Nieto Rojas I, Julián-Jiménez A. Importancia de los resultados de los hemocultivos: especial atención para los solicitados desde los Servicios de Urgencias. Rev Esp Quimioter. 2020;33:459-61. doi: 10.37201/req/075.2020 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zafar Iqbal-Mirza S, Serrano Romero de Ávila V, Estévez-González R, Rodríguez-González D, Heredero-Gálvez E, Julián-Jiménez A. Ability of procalcitonin to differentiate true bacteraemia from contaminated blood cultures in an emergency department. Enferm Infecc Microbiol Clin. 2019;37:560-568. doi: 10.1016/j.eimc.2019.01.012 [DOI] [PubMed] [Google Scholar]
- 8.Mòdoll Deltell JM, Tudela Hita P. Bacteriemia oculta o bacteriemia en pacientes adultos dados de alta desde Urgencias. Med Clin (Barc). 2014;142:111–3. doi: 10.1016/j.medcli.2013.09.010. [DOI] [PubMed] [Google Scholar]
- 9.Julián-Jiménez A, Gorordo-Delsol LA, Merinos-Sánchez G, Santillán-Santos DA, Rosas Romero FA, Sánchez Arreola D, et al. Declaración de Guadalajara: una visión constructiva desde el servicio de urgencias a partir de la Surviving Sepsis Campaign 2021. Emergencias. 2023;35:53-64. PMid: [PubMed] [Google Scholar]
- 10.Long B, Koyfman A. Best Clinical Practice: Blood Culture Utility in the Emergency Department. J Emerg Med. 2016;51:529-39. doi: 10.1016/j.jemermed.2016.07.003 [DOI] [PubMed] [Google Scholar]
- 11.Cisneros-Herreros JM, Cobo-Reinoso J, Puyol-Rojo M, RodríguezBaño J, Salavert-Lleti M. Guía para el diagnóstico y tratamiento del paciente con bacteriemia. Guías de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Enferm Infecc Microbiol Clin. 2007;25:111-30. doi: 10.1016/s0213-005x(07)74242-8. [DOI] [PubMed] [Google Scholar]
- 12.Guna Serrano MR, Larrosa Escartín N, Marín Arriaza M, Rodríguez Díaz JC. Diagnóstico microbiológico de la bacteriemia y fungemia: hemocultivos y métodos moleculares. Enferm Infecc Microbiol Clin. 2019;37:335-40. doi: 10.1016/j.eimc.2018.03.005. [DOI] [PubMed] [Google Scholar]
- 13.Allerberger F, Kern WV. Bacterial bloodstream infection. Clin Micro-biol Infect. 2020;26:140-141. doi: 10.1016/j.cmi.2019.10.004 [DOI] [PubMed] [Google Scholar]
- 14.Rubio Díaz R, Nieto Rojas I, Julián-Jiménez A. Importancia de la predicción de bacteriemia en los servicios de urgencias: seis años después. Enferm Infecc Microbiol Clin. 2021;39:102-10. doi: 10.1016/j.eimc.2020.04.006 [DOI] [PubMed] [Google Scholar]
- 15.Oviaño M. Rapid identification of microorganisms directly from positive blood cultures by MALDI-TOF MS. Enferm Infecc Microbiol Clin. 2019;37:287-9. doi: 10.1016/j.eimc.2018.12.007 [DOI] [PubMed] [Google Scholar]
- 16.Vardakas KZ, Anifantaki FI, Trigkidis KK, Falagas ME. Rapid molecular diagnostic tests in patients with bacteremia: evaluation of their impact on decision making and clinical outcomes. Eur J Clin Microbiol Infect Dis. 2015;34:2149-60. doi: 10.1007/s10096-015-2466-y [DOI] [PubMed] [Google Scholar]
- 17.Morales Real A. Cuestión de prioridad. Emergencias. 2022;34:476-7. PMid: [PubMed] [Google Scholar]
- 18.Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. 2021;47:1181-1247. doi: 10.1007/s00134-021-06506-y [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Julián-Jiménez A, García DE, González Del Castillo J, López Tapia JD.. De la guías internacionales “Campaña para sobrevivir a la sepsis 2021” a las guías para “Detectar, prevenir la progresión y atender a los pacientes con infección grave en urgencias” elaboradas por urgenciólogos. Emergencias. 2022;34:471-3. PMid: [PubMed] [Google Scholar]
- 20.Tudela P, Giménez M, Mòdol JM. Hemocultivos en los servicios de urgencias, ¿hacia un nuevo enfoque? Med Clin (Barc). 2016;146:455-9. doi: 10.1016/j.medcli.2015.11.026 [DOI] [PubMed] [Google Scholar]
- 21.Montero-Pérez J. Triaje en urgencias: “Separando el grano de la paja”. Emergencias. 2022;34:161-2. PMid: [PubMed] [Google Scholar]
- 22.Jones AE, Fiechtl JF, Brown MD, Ballew JJ, Kline JA. Procalcitonin Test in the Diagnosis of Bacteremia: A Meta-analysis. Ann Emerg Med. 2007;50:34-41. PMid: [DOI] [PubMed] [Google Scholar]
- 23.Julián-Jiménez A, Candel-González FJ, González del Castillo J. Utilidad de los biomarcadores de inflamación e infección en los servicios de urgencias. Enferm Infecc Microbiol Clin. 2014;32:177–90. doi: 10.1016/j.eimc.2013.01.005 [DOI] [PubMed] [Google Scholar]
- 24.Hoeboer SH, van der Geest PJ, Nieboer D, Groeneveld ABJ. The diagnostic accuracy of procalcitonin for bacteraemia: a systematic review and meta-analysis. Clin Microbiol Infect 2015;21:474–481. PMid: [DOI] [PubMed] [Google Scholar]
- 25.Julián-Jiménez A, Candel González FJ, González del Castillo J. Utilidad de los biomarcadores para predecir bacteriemia en los pacientes con infección en urgencias. Rev Esp Quimioter. 2017;30:245-56. PMid: [PubMed] [Google Scholar]
- 26.Rubio-Díaz R, Julián-Jiménez A, González Del Castillo J, GarcíaLamberechts EJ, Huarte Sanz I, Navarro Bustos C, et al. Capacidad del lactato, procalcitonina y de los criterios definitorios de sepsis para predecir mortalidad a 30 días, bacteriemia o infección confirmada microbiológicamente en los pacientes atendidos por sospecha de infección en urgencias. Emergencias. 2022;34:181-9. PMid: [PubMed] [Google Scholar]
- 27.Clemente-Callejo C, Julián-Jiménez A, Candel González FJ, González del Castillo J. Models for bacteraemia risk prediction. Clinical implications. Rev Esp Quimioter 2022; 35 (Suppl. 3): 89-93 doi: 10.37201/req/s03.19.2022. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Velly L, Freund Y. Biomarcadores de la sepsis: ¿historia pasada o futuro apasionante?. Emergencias. 2022;34:474-5. PMid: [PubMed] [Google Scholar]
- 29.Julián-Jiménez A, Rubio-Díaz R, González-Del Castillo J, Candel González FJ, New predictive models of bacteremia in the emergency department: a step forward. Rev Esp Quimioter 2022;35: 344-356 doi: 10.37201/req/015.2022. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.López-Ayala P, Alcaraz-Serna A, Valls Carbó A, Cuadrado Cenzual MA, Torrejón Martínez MJ, López Picado A, et al. Procalcitonina es superior a recuento linfocitario, índice neutrófilo/linfocito y proteína C reactiva para la predicción de mortalidad a 30 días de pacientes con COVID-19 en el servicio de urgencias. Emergencias. 2022;34:119-27. PMid: [PubMed] [Google Scholar]
- 31.Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: An updated guideline for reporting systematic reviews. BMJ. 2021;372:n71. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Huynh HH, Bœuf A, Vinh J, Delatour V; IFCC Working Group on Standardization of Procalcitonin assays (WG-PCT) . Evaluation of the necessity and the feasibility of the standardization of procalcitonin measurements: Activities of IFCC WG-PCT with involvement of all stakeholders. Clin Chim Acta. 2021;515:111-21. PMid: [DOI] [PubMed] [Google Scholar]
- 33.Swets JA. Measuring the accuracy of diagnostic systems. Science. 1988;240:1285-93. PMid: [DOI] [PubMed] [Google Scholar]
- 34.Wells G, Shea B, O’Connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Consultado 22-5-2023. Disponible en: http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp
- 35.Shea BJ, Reeves BC, Wells G, Thuku M, Hamel C, Moran J, et al. AMSTAR 2: a critical appraisal tool for systematic reviews that include randomised or non-randomised studies of healthcare interventions, or both. BMJ. 2017;358:j4008. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.van Nieuwkoop C, Bonten TN, van’t Wout JW, Kuijper EJ, Groeneveld GH, Becker MJ, et al. Procalcitonin reflects bacteremia and bacterial load in urosepsis syndrome: a prospective observational study. Critical Care 2010; 14:R206. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Tudela P, Prat C, Lacoma A, Mòdol JM, Domínguez J, Giménez M, et al. Biomarcadores para la predicción en urgencias de infección bacteriana, bacteriemia y gravedad. Emergencias 2012;24:348-356 [Google Scholar]
- 38.Ahn S, Lee YS, Lim KS, Lee JL. Adding procalcitonin to the MASCC risk-index score could improve risk stratification of patients with febrile neutropenia. Support Care Cancer. 2013;21:2303-8. doi: 10.1007/s00520-013-1787-6. [DOI] [PubMed] [Google Scholar]
- 39.Julián-Jiménez A, Timón Zapata J, Laserna Mendieta EJ, Sicilia-Bravo I, Palomo-de los Reyes MJ, Cabezas-Martínez A, et al. Poder diagnóstico y pronóstico de los biomarcadores para mejorar el manejo de la neumonía adquirida en la comunidad en los servicios de urgencias Enferm Infecc Microbiol Clin. 2014;32:225–235. doi: 10.1016/j.eimc.2013.04.015 [DOI] [PubMed] [Google Scholar]
- 40.Julián-Jiménez A, Timón Zapata J, Laserna Mendieta EJ, Parejo Miguez R, Flores Chacartegui M, Gallardo Schall P. Capacidad de la procalcitonina para predecir bacteriemia en pacientes con neumonía adquirida en la comunidad. Med Clin (Barc). 2014;142:285–292. PMid: [DOI] [PubMed] [Google Scholar]
- 41.Laukemann S, Kasper N, Kulkarni P, Steiner D, Rast AC, Kutz A, et al. Can We Reduce Negative Blood Cultures With Clinical Scores and Blood Markers? Results From an Observational Cohort Study. Medicine 2015; 94:e2264. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Kim SY, Jeong TD, Lee W, Chun S, Min WK. Procalcitonin in the assessment of bacteraemia in emergency department patients: results of a large retrospective study. Ann Clin Biochem. 2015;52: 654–659. PMid: [DOI] [PubMed] [Google Scholar]
- 43.Julián-Jiménez A, Gutiérrez-Martín P, Lizcano-Lizcano A, LópezGuerrero MA, Barroso-Manso A, Heredero-Gálvez E. Utilidad de la procalcitonina y proteína C reactiva para predecir bacteriemia en las infecciones del tracto urinario en el servicio de urgencias Actas Urol Esp. 2015;39:502-510. PMid: [DOI] [PubMed] [Google Scholar]
- 44.Morales Casado MI, Moreno Alonso F, Juárez Belaunde AL, Heredero Gálvez E, Talavera Encinas O, Julián-Jiménez A. Capacidad de la procalcitonina para predecir meningitis bacterianas en el servicio de urgencias. Neurología. 2016;31:9-17. PMid: [DOI] [PubMed] [Google Scholar]
- 45.Contenti J, Occelli C, Lemoel F, Ferrari P, Levraut J. Capacidad diagnóstica de presepsina comparada con otros biomarcadores para predecir sepsis y shock séptico en pacientes con infección siguiendo la definición Sepsis-3 (estudio PREDI). Emergencias 2019;31:311-317. PMid: [PubMed] [Google Scholar]
- 46.García de Guadiana-Romualdo L, Cerezuela-Fuentes P, EspañolMorales I, Esteban-Torrella P, Jiménez-Santos E, Hernando-Holgado A, et al. Prognostic value of procalcitonin and lipopolysaccharide binding protein in cancer patients with chemotherapy-associated febrile neutropenia presenting to an emergency department Biochem Med (Zagreb) 2019;29(1):10702. doi: 10.11613/BM.2019.010702. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Kok VC, Lin CT, Yeh CB, Yang CC, Horng JT. Performance enhancement of procalcitonin by high-sensitivity C-reactive protein at the optimal cutoff in predicting bacteremia in emergency department adult patients. Scand J Clin Lab Invest. 2019;79:25-31. doi: 10.1080/00365513.2018.1550808. [DOI] [PubMed] [Google Scholar]
- 48.Varela-Patiño M, Lopez-Izquierdo R, Velayos-Garcia P, Alvarez-Manzanares J, Ramos-Sanchez C, Carbajosa-Rodriguez V, et al. Usefulness of infection biomarkers for diagnosing bacteremia in patients with a sepsis code in the emergency department. Infez Med. 2020;28:29-36. PMid: . [PubMed] [Google Scholar]
- 49.Zafar Iqbal-Mirza S, Estévez-González R, Serrano-Romero de Ávila V, de Rafael González E, Heredero-Gálvez E, Julián-Jiménez A. Factores predictores de bacteriemia en los pacientes atendidos en el Servicio de Urgencias por infección. Rev Esp Quimioter 2020;33: 32-43. PMid: doi: 10.37201/req/075.2019 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Gornet M, Leroux P, Ramont L, De Ruffi S, Giordano Orsini G, Losset X, et al. Lack of admission biomarkers’ clinical utility in outcomes prediction in patients suspected with infection in the emergency department. Am J Emerg Med. 2021;47:109-114. doi: 10.1016/j.ajem.2021.03.050. [DOI] [PubMed] [Google Scholar]
- 51.Leroux P, De Ruffi S, Ramont L, Gornet M, Giordano Orsini G, Losset X, et al. Clinical Outcome Predictive Value of Procalcitonin in Patients Suspected with Infection in the Emergency Department. Emerg Med Int. 2021:2344212. doi: 10.1155/2021/2344212. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Azijli K, Minderhoud TC, de Gans CJ, Lieveld AWE, Nanayakkara PWB. Optimal use of procalcitonin to rule out bacteremia in patients with possible viral infections. J Am Coll Emerg Physicians Open. 2022;3:e12621. doi: 10.1002/emp2.12621. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Jabbour JP, Ciotti G, Maestrini G, Brescini M, Lisi C, Ielo C, et al. Utility of procalcitonin and C-reactive protein as predictors of Gram-negative bacteremia in febrile hematological outpatients. Support Care Cancer. 2022;30:4303-4314. doi: 10.1007/s00520-021-06782-w. [DOI] [PubMed] [Google Scholar]
- 54.Nishikawa H, Shirano M, Kasamatsu Y, Morimura A, Iida K, Kishi T, et al. Comparison between procalcitonin and C-reactive protein in predicting bacteremias and confounding factors: a case-control study. Clin Chem Lab Med. 2017;55:1043-1052. doi: 10.1515/cclm-2016-0705. PMid: . [DOI] [PubMed] [Google Scholar]
- 55.Matono T, Yoshida M, Koga H, Akinaga R. Diagnostic accuracy of quick SOFA score and inflammatory biomarkers for predicting community-onset bacteremia. Sci Rep. 2022;12:11121. doi: 10.1038/s41598-022-15408-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.El Haddad H, Chaftari AM, Hachem R, Chaftari P, Raad II. Biomarkers of Sepsis and Bloodstream Infections: The Role of Procalcitonin and Proadrenomedullin With Emphasis in Patients With Cancer. Clin Infect Dis. 2018;67:971-977. doi: 10.1093/cid/ciy331. PMid: . [DOI] [PubMed] [Google Scholar]
- 57.Julián-Jiménez A, González Del Castillo J, Candel FJ. Usefulness and prognostic value of biomarkers in patients with community-acquired pneumonia in the emergency department. Med Clin (Barc). 2017;148:501-510. doi: 10.1016/j.medcli.2017.02.024. [DOI] [PubMed] [Google Scholar]
- 58.He C, Wang B, Wang YF, Shen YC. Can procalcitonin be used to diagnose Gram-negative bloodstream infection? Evidence based on a meta-analysis. Eur Rev Med Pharmacol Sci. 2017;21:3253-3261. PMid: . [PubMed] [Google Scholar]
- 59.Lai L, Lai Y, Wang H, Peng L, Zhou N, Tian Y, et al. Diagnostic Accuracy of Procalcitonin Compared to C-Reactive Protein and Interleukin 6 in Recognizing Gram-Negative Bloodstream Infection: A Meta-Analytic Study. Dis Markers. 2020;2020:4873074. doi: 10.1155/2020/4873074. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Jeong S, Park Y, Cho Y, Kim HS. Diagnostic utilities of procalcitonin and C-reactive protein for the prediction of bacteremia determined by blood culture. Clin Chim Acta. 2012;413:1731-6. doi: 10.1016/j.cca.2012.06.030. [DOI] [PubMed] [Google Scholar]
- 61.Yan ST, Sun LC, Jia HB, Gao W, Yang JP, Zhang GQ. Procalcitonin levels in bloodstream infections caused by different sources and species of bacteria. Am J Emerg Med. 2017;35:579-583. doi: 10.1016/j.ajem.2016.12.017. [DOI] [PubMed] [Google Scholar]
- 62.Julián-Jiménez A, Iqbal-Mirza SZ, de Rafael González E, EstévezGonzález R, Serrano-Romero de Ávila V, Heredero-Gálvez E, et al. Predicting bacteremia in patients attended for infections in an emergency department: the 5MPB-Toledo model. Emergencias. 2020;32:81-89. PMid: . [PubMed] [Google Scholar]
- 63.Julián-Jiménez A, García-Lamberechts EJ, González Del Castillo J, Navarro Bustos C, Llopis-Roca F, Martínez-Ortiz de Zarate M, et al. Validation of a predictive model for bacteraemia (MPB5-Toledo) in the patients seen in emergency departments due to infections. Enferm Infecc Microbiol Clin. 2022;40:102-112. doi: 10.1016/j.eimce.2021.12.006. [DOI] [PubMed] [Google Scholar]
- 64.Julián-Jiménez A, Rubio-Díaz R, González del Castillo J, GarcíaLamberechts EJ, Huarte Sanz I, Navarro Bustos C, et al. Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente con infección del tracto urinario en el servicio de urgencias. Actas Urol Esp. 2022;46:629-639. doi: 10.1016/j.acuroe.2022.10.004. [DOI] [PubMed] [Google Scholar]
- 65.Julián-Jiménez A, González Del Castillo J, García-Lamberechts EJ, Rubio Díaz R, Huarte Sanz I, Navarro Bustos C, Martín-Sánchez FJ, et al. Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente con neumonía adquirida en la comunidad en el Servicio de Urgencias. Rev Esp Quimioter. 2021;34:376-382. doi: 10.37201/req/043.2021. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 66.Julián-Jiménez A, García-Lamberechts EJ, González del Castillo J, Rubio Díaz R, Huarte Sanz I, Navarro Bustos C, et al. Utilidad del modelo 5MPB-Toledo para predecir bacteriemia en el paciente anciano. Infectio 2022;26:128-136 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Su CP, Chen TH, Chen SY, Ghiang WC, Wu GH, Sun HY, et al. Predictive model for bacteremia in adult patients with blood cultures performed at the emergency department: a preliminary report. J Microbiol Immunol Infect. 2011;44:449-55. doi: 10.1016/j.jmii.2011.04.006. [DOI] [PubMed] [Google Scholar]
- 68.Ahn S, Lee YS, Lee JL, Lim KS, Yoon SC. A new prognostic model for chemotherapy-induced febrile neutropenia. Int J Clin Oncol. 2016;21:46-52. doi: 10.1007/s10147-015-0853-0. [DOI] [PubMed] [Google Scholar]
- 69.Wyss G, Berger S, Haubitz S, Fankhauser H, Buergi U, Mueller B, et al. The Shapiro-Procalcitonin algorithm (SPA) as a decision tool for blood culture sampling: validation in a prospective cohort study. Infection. 2020;48:523-533. doi: 10.1007/s15010-020-01423-6. [DOI] [PubMed] [Google Scholar]
- 70.Ahn S, Lee YS, Chun YH, Lim KS, Kim W, Lee JL. Predictive factors of bacteraemia in low-risk patients with febrile neutropenia. Emerg Med J. 2012;29:715-9. doi: 10.1136/emermed-2011-200012. [DOI] [PubMed] [Google Scholar]
- 71.Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2 Group . QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155:529-36. doi: 10.7326/0003-4819-155-8-201110180-00009 [DOI] [PubMed] [Google Scholar]
- 72.De Santos Castro PA, Alonso Avilés R. Sobre la capacidad de lactato, procalcitonina y los criterios definitorios de sepsis para predecir A. Julián-Jiménez, et al. mortalidad a 30 días, bacteriemia o infección confirmada microbiológicamente en los pacientes atendidos por sospecha de infección en urgencias. Emergencias. 2022;34:406-406. PMid: [PubMed] [Google Scholar]
- 73.Lai CC, Chen SY, Wang CY, Wang JY, Su CP, Liao CH, et al. Diagnostic value of procalcitonin for bacterial infection in elderly patients in the emergency department. J Am Geriatr Soc. 2010;58:518-22. doi: 10.1111/j.1532-5415.2010.02730.x. [DOI] [PubMed] [Google Scholar]
- 74.Puig-Campmany M, Ris Romeu J. El anciano frágil en urgencias: principales retos. Emergencias. 2022;34:415-7. PMid: [PubMed] [Google Scholar]
- 75.Julián-Jiménez A, González del Castillo J, García-Lamberechts EJ, Huarte Sanz I, Navarro Bustos C, Rubio Díaz R, et al. A bacteraemia risk prediction model: development and validation in an emergency medicine population. Infection. 2022;50:203–221. doi: 10.1007/s15010-021-01686-7 [DOI] [PubMed] [Google Scholar]
- 76.Nieto Rojas I, López Forero WE. Improved profitability and indications for blood culture extraction in emergency departments: another step forward. Rev Esp Quimioter. 2023;36:97-98. PMid: [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Rodic S, Hryciw BN, Selim S, Wang CQ, Lepage MF, Goyal V, Nguyen LH, Fergusson DA, van Walraven C. Concurrent external validation of bloodstream infection probability models. Clin Microbiol Infect. 2023;29:61-69. doi: 10.1016/j.cmi.2022.07.011. [DOI] [PubMed] [Google Scholar]
- 78.Julián-Jiménez A. Hacia la normalización en la atención a los pacientes con COVID-19 en urgencias. Emergencias. 2023;35:321-2. PMid: [PubMed] [Google Scholar]
- 79.Llopis-Roca F, López Izquierdo R, Miro O, García-Lamberechts JE, Julián Jiménez A, González Del Castillo J. Mapa de la situación actual de la atención a la sepsis en los servicios de urgencias españoles. Rev Esp Quimioter. 2022;35:192-203. doi: 10.37201/req/150.2021. [DOI] [PMC free article] [PubMed] [Google Scholar]