Abstract
目的
探讨新风胶囊(XFC)对白介素(IL)-1β诱导的软骨细胞功能的影响及作用机制。
方法
构建IL-1β诱导的软骨细胞炎症模型;SD大鼠灌胃制备XFC含药血清。细胞增殖实验(CCK-8)和流式细胞术筛选最佳XFC含药血清浓度;双荧光素酶报告分析miR-502-5p和TRAF2的靶向关系。构建miR-502-5p抑制表达质粒(inhibitor)及阴性对照组,转染至软骨细胞中。分为对照组(NC),IL-1β组,XFC组,IL-1β+NC-inhibitor,IL-1β+miR-502-5p inhibitor,IL-1β+miR-502-5p inhibitor+XFC最佳含药血清组,酶联免疫吸附试验(ELASA)检测IL-1β、肿瘤坏死因子-α(TNF-α)、IL-4、IL-10的水平。逆转录PCR(RT-PCR)、蛋白质免疫印迹实验(WB)、免疫荧光法检测Ⅱ型胶原α1(COL2A1)、基质金属蛋白酶13(MMP13)、软骨蛋白聚糖抗体(ADAMTS5)和miR-502-5p/TRAF2/NF-κB基因的表达。
结果
与NC组相比,IL-1β组中软骨细胞活力下降,细胞凋亡率升高,且miR-502-5p、IL-4、IL-10和COL2A1表达下降,IL-1β、TNF-α和ADAMTS5、MMP13、TRAF2、NF-κB p65表达升高(P<0.05)。筛选得出20% XFC为最佳含药血清浓度。与IL-1β组相比,XFC含药血清干预后,软骨细胞活力升高,细胞凋亡率下降,IL-1β、TNF-α、ADAMTS5、MMP13、TRAF2、NF-κB p65表达下降,miR-502-5p、IL-4、IL-10和COL2A1表达升高(P<0.05)。与NC-inhibitor相比,转染miR-502-5p inhibitor后,IL-1β、TNF-α、ADAMTS5、MMP13、TRAF2、NF-κB p65表达升高,miR-502-5p、IL-4、IL-10和COL2A1表达下降;与miR-502-5p inhibitor相比,将miR-502-5p inhibitor转染的软骨细胞和最佳XFC含药血清共培养后,XFC含药血清能逆转miR-502-5p抑制状态对软骨细胞炎症和ECM的影响。
结论
XFC抑制软骨细胞炎症、细胞外基质降解,减轻IL-1β诱导的软骨细胞损伤,其机制可能是通过调节miR-502-5p/TRAF2/NF-κB轴。
Keywords: miR-502-5p, 骨关节炎, 新风胶囊, 炎症, 细胞外基质
Abstract
Objective
To investigate the mechanism that mediates the inhibitory effect of Xinfeng Capsule (XFC) on interleukin (IL)-1β-induced impairment of chondrocytes.
Methods
XFC-medicated serum was collected from SD rats with XFC gavage, and its optimal concentration for chondrocyte treatment was determined using Cell Counting Kit-8 assay and flow cytometry. Dual luciferase reporter analysis was performed to analyze the targeting relationship between miR-502-5p and TRAF2. In cultured human chondrocytes induced with IL-1β, the effects of transfection with miR-502-5p inhibitor and XFC-medicated serum, alone or in combination, on expression levels of IL-1β, tumor necrosis factor-α (TNF-α), IL-4, and IL-10 were examined with ELISA, and the changes in the expressions of collagen type Ⅱ alpha 1 (COL2A1), matrix metalloproteinase 13 (MMP13), adisintegrin and metalloproteinase with thrombospondin motifs 5 (ADAMTS5), and miR-502-5p/TRAF2/NF-κB axis gene expression were detected using RT-qPCR, Western blotting, and immunofluorescence assay.
Results
In cultured human chondrocytes, treatment with IL-1β significantly decreased the cell viability, increased cell apoptosis rate, lowered miR-502-5p, IL-4, IL-10, and COL2A1 expressions, and enhanced IL-1β, TNF-α, ADAMTS5, MMP13, TRAF2, and NF-κB p65 expressions (P < 0.05), and these changes were significantly improved by treatment with XFC-medicated serum at the optimal concentration of 20% (P < 0.05). Transfection of the chondrocytes with miR-502-5p inhibitor resulted in elevated expressions of IL-1β, TNF-α, ADAMTS5, MMP13, TRAF2, and NF-κB p65 and lowered expressions of miR-502-5p, IL-4, IL-10, and COL2A1, and XFC-medicated serum obviously reversed the effects of miR-502-5p inhibitor.
Conclusion
XFC can inhibit IL-1β-induced inflammatory response and ECM degradation in cultured human chondrocytes possibly by regulating the miR-502-5p/TRAF2/NF-κB axis.
Keywords: miR-502-5p, osteoarthritis, Xinfeng Capsule, inflammation, extracellular matrix
骨关节炎(OA)是最常见的关节退行性疾病,其特征是软骨损伤和炎症反应[1]。OA发病机制尚不明确,中医药治疗OA疗效确切[2]。关节软骨由独特的细胞外基质(ECM)组成,维持关节软骨内部环境的稳态,包括软骨蛋白聚糖抗体(ADAMTS5)、Ⅱ型胶原蛋白(COL2A1)、基质金属蛋白酶(MMP)等[3]。炎症加速诱导软骨细胞凋亡,导致基质分子丢失,破坏ECM分解和合成平衡[4]。细胞因子,如肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)和转化生长因子-β等,影响ECM蛋白酶合成和降解。另一方面,ECM也参与了炎症细胞的浸润、组织损伤和再生等过程。ECM成分的异常表达会影响免疫细胞的活化、分化和存活[5]。因此,炎症和ECM代谢之间的串扰是OA发病的重要因素。MiRNA是长度约为20~25个核苷酸的小RNA,可以靶向不同途径来调节软骨细胞稳态[6]。既往研究表明,miR-502-5p抑制IL-1β诱导的软骨细胞细胞凋亡和炎症反应,缓解白介素(IL)-1β诱导的ECM代谢失衡[7]。TRAF2是肿瘤坏死因子受体相关因子(TRAF)蛋白家族的一员,是调节软骨细胞凋亡和炎症方面关键蛋白[8]。NF-κB信号通路的异常激活与软骨破坏、滑膜炎症等密切相关[9]。相关文献研究表明,调节p53/miR-502-5p/TRAF2通路能减轻IL-1β诱导的OA软骨细胞损伤[10]。TRAF2-NF-κB信号通路参与机体的炎症反应和免疫应答[11]。但miR-502-5p、TRAF2、NF-κB三者之间在OA软骨细胞的机制尚未报道。
中药复方新风胶囊(XFC,专利号:ZL201310011369.8,注册号:皖药制字Z20050062)全方由黄芪、薏苡仁、蜈蚣、雷公藤组成,具有健脾化湿通络法功效,广泛应用于临床[12, 13]。既往研究表明,XFC降低OA中异常的炎症免疫反应,减轻OA患者的关节疼痛等症状[14]。前期体外实验证实XFC通过miR-23a-3p/PTEN/PI3K/AKT/mTOR抑制OA软骨细胞中免疫炎症反应[15]。既往研究关注XFC调节OA中免疫炎症分子机制[15],而XFC调节OA软骨细胞ECM代谢的机制尚缺乏。关节软骨细胞和细胞外基质是关节软骨的主要组成部分,也是参与OA进展的重要角色[16]。细胞外基质代谢紊乱导致OA关节软骨破坏,进而出现功能丧失。炎症和ECM代谢密切相关。ECM衍生的片段和某些分子的改变,除了发挥趋化活性外,还可能激活免疫细胞,促进炎症反应,进而激活了关键转录因子和炎症信号传导途径,最终造成了关节软骨被破坏、侵蚀[17]。因此,深入了解软骨细胞及细胞外基质在OA发生、发展中的作用,探索调节OA中ECM代谢的有效方法具有重要意义。
IL-1β体外诱导软骨细胞(CH)炎症模型是经典的细胞模型[18]。本研究通过构建IL-1β诱导的软骨细胞炎症模型,以miR-502-5p/TRAF2/NF-κB组合为研究主线,以ECM代谢为研究靶点,以XFC为干预手段,探讨XFC对IL-1β诱导的软骨细胞损伤的影响并从细胞水平分析其抗OA的可能机制,以期为药物的应用提供实验基础。
1. 材料和方法
1.1. 主要药物和试剂
新风胶囊(组成:薏苡仁、黄芪、蜈蚣、雷公藤,皖药制字Z20050062,规格:0.4 g/粒,由安徽中医药大学第一附属医院制剂中心提供。人软骨细胞(CH)购于上海赛百慷生物技术股份有限公司,293T细胞购于赛默飞世尔科技有限公司。
白介素4(IL-4)、白细胞介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白细胞介素10(IL-10)购自武汉基因美科技有限公司。p-NF-κB p65抗体(CST),TRAF2抗体(bioss,p-IKBα抗体(Bioworld);CCK8试剂盒(BIOSS),Annexin V-FITC/PI apoptosis kit(联科生物),Ficoll-Paque(GE)。Trizol(Life technogies);RIPA细胞裂解液购自Beyotime;DMEM培养基购自美国Gibco公司;BD周期试剂盒(BD),4%多聚甲醛固定液(ebiogo),抗荧光淬灭封片剂(含DAPI)(ebiogo),胰酶消化液(Gibco)。双荧光素酶报告实验试剂盒(Promega生物公司),Lipofectamine2000(赛默飞世尔科技有限公司)。
酶标仪(雷杜,RT-6100),离心机(安徽嘉文,JW3021HR),倒置显微镜(OLYMPUS),培养箱(Thermo),流式细胞仪(BECKMAN,CytoFLEX),高速台式冷冻离心机(安徽嘉文仪器装备有限公司),培养箱(Thermo),荧光定量PCR仪(Thermo Scientific),数字切片扫描仪(3DHISTECH)。
1.2. XFC含药血清的制备
SPF级雄性SD大鼠40只,体质量180~220 g,购自安徽省动物实验中心,许可证号SCXK2020-0001,随机分为正常组、XFC组,采用经人-大鼠体表面积比值折算成相当于人临床等效用量,324 mg/kg,按2 mL/100 g体质量进行给药,1次/d,连续给药7 d,末次给药1 h后,分别腹主动脉取血,2500 r/min离心15 min取血清,无菌操作分装,-80 ℃保存备用。本动物实验经安徽中医药大学动物实验伦理委员会批准,伦理号:AHUCM-rats-2023020。
1.3. XFC含药血清对软骨细胞功能的影响
1.3.1. CCK-8检测细胞增殖
胰酶消化对数期软骨细胞(浓度至5~10×104/mL),设置阴性对照组(空白组),IL-1β、10.0%、20.0%和40.0% XFC含药血清,孵育24、48或72 h,每孔加入CCK-8 10 μL,培养4 h。在酶联免疫检测仪测量各孔的吸光值A450 nm。
1.3.2. 流式细胞术(FCM)检测细胞凋亡和细胞周期
取对数期细胞,加入5 μLAnnexin V-FITC和10 μL PI,室温避光孵育5 min,加入缓冲液重悬后,流式细胞仪测定细胞凋亡。另加入25 μL碘化丙啶染色液(×20)和10 µL RNaseA(×50)混匀,测定细胞周期。
1.4. 软骨细胞培养和质粒转染
软骨细胞以含体积分数10%胎牛血清的DMEM培养基,在37 ℃、体积分数5% CO2培养箱中培养。取对数生长期细胞,正常培养的细胞作为对照组(NC);用10 ng/mL的IL-1β刺激软骨细胞(模拟软骨细胞炎症损伤)作为IL-1β组,用最佳浓度XFC含药血清和10 ng/mL的IL-1β处理软骨细胞,设为XFC组,将miR-502-5p抑制表达质粒及阴性对照转染至软骨细胞6 h后,再用10 ng/mL的IL-1β处理24 h,分为(4)NC-inhibitor(IL-1β + NC-inhibitor);(5)miR-502-5p inhibitor(IL-1β + miR-502-5p inhibitor);(6)miR-502-5p inhibitor+XFC(IL-1β+miR-502-5p inhibitor+XFC最佳含药血清)。
1.5. 双荧光素酶实验验证miR-502-5p和TRAF2靶向关系
使用StarBase v2.0数据库预测miR-502-5p与TRAF2的结合位点,进行双荧光素酶报告确定TRAF2和miR-502-5p之间的结合关系,TRAF2野生型(TRAF2-WT)和突变型(TRAF2-MUT)重组荧光素酶报告载体质粒由南京金贝津生物科技有限公司构建。TRAF2-WT基因启动子荧光素酶报告基因序列:CTCTGGGCCTCAGAACTGTGCTGCCTGTGTTCA CGAGGGCATATATGAAGAAGGCATTTCTATTTTA GAAAGCAGTTCGGCCTTCCCAGATAATGCTGCC CGCAGGGAGGTGGAGAGCCTGCCGGCCGTCTG TCCCAGTGATGGATGCACCTGGAAGGGGACCCT GAAAGAATACGAG,TRAF2-MUT基因启动子荧光素酶报告基因序列:CTCTGGGCCTCAGAACTGTGC TGCCTGTGTTCACGAGGGCATATATGAAGAAGG CATTTCTATTTTAGAAAGCAGTTCGGCCTTCTAA TGCCATGCTGCCCGCAGGGAGGTGGAGAGCCT GCCGGCCGTCTGTCCCAGTGATGGATGCACCTG GAAGGGGACCCTGAAAGAATACGAG。hsa-miR-502-5p基因序列是AUCCUUGCUAUCUGGGUGC UA。具体步骤如下:将用于转染的293T细胞和目的质粒铺在96孔板中,待细胞密度达到80%为宜。将10 μL DMEM与0.16 μg的hsa-TRAF2-3UTR目的质粒(野生型和突变型)以及5 pmol的hsa-miR-502-5p和Negative Control(NC)充分混匀后室温放置(溶液A),之后将10 μL DMEM与0.3 μL的转染试剂(Lipofectamine2000,浓度为0.8 mg/mL)充分混匀(溶液B),室温放置5 min。再将溶液A与溶液B充分混匀,室温放置20 min后,将转染混合物加入细胞,37 ℃,5% CO2培养。转染6 h后换取新鲜DMEM培养基,继续转染48 h后收集细胞检测。按照双荧光素酶报告实验试剂盒说明书操作,测定记录Renilla luciferase值,即为荧光素酶活性。细胞分组:TRAF2-WT+mimics-NC、TRAF2-WT + miR-502-5p mimics、TRAF2-MUT + mimics-NC和TRAF2-MUT+miR-502-5p mimics。
1.6. ELASA检测炎症因子
收集各组细胞上清液,按照各试剂盒说明书进行操作,检测IL-1β、TNF-α、IL-4、IL-10的表达。
1.7. RT-PCR检测ECM产物(COL2A1、MMP-13、ADAMTS5)和miR-502-5p、TRAF2、NF-κB p65 mRNA的表达
TRIzol试剂盒提取细胞的总RNA,PrimeScript™ RT reagent Kit with gDNA Eraser试剂盒进行逆转录。qRT-PCR检测试剂盒和SYBR混合物在实时PCR系统上进行分析。U6小核糖核酸(U6)或β-actin作为内部参考基因。通过2-ΔΔCt方法计算miR-502-5p、TRAF2、NF-κB p65、ADAMTS5、MMP 13和COL2A1,以及β-actin和U6的相对表达。引物序列是由Sangon Biotech(中国上海)设计并获得的,详细的引物序列见表 1。
表 1.
RT-PCR各基因引物序列
Primer sequences for qRT-PCR
| Gene | Amplicon size (bp) | Forward primer (5'→3') | Reverse primer (5'→3') |
| β-actin | 96 | CCCTGGAGAAGAGCTACGAG | GGAAGGAAGGCTGGAAGAGT |
| U6 | 94 | CTCGCTTCGGCAGCACA | AACGCTTCACGAATTTGCGT |
| MMP13 | 98 | CAGAACTTCCCAACCGTATTGAT | TGTATTCAAACTGTATGGGTCCG |
| ADAMTS5 | 102 | GTGTCACATGAATGATGCCC | CGACCCTCAAGAACTTTTGC |
| COL2A1 | 104 | TGCATGAGGGCGCGGTA | GGTCCTGGTTGCCGGACAT |
| miR-502-5p | 61 | ACACTCCAGCTGGGATCCTTGCTATCTGG | TGGTGTCGTGGAGTCG |
| miR-502-5p-RT | CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTAGCAC | ||
| TRAF2 | 168 | GAAGGGAGCATTCCTAGACC | TGGCAAGCTCTCACACTTTA |
| NF-κB p65 | 130 | AACCTGGGAATCCAGTGTGT | GCACAGCATTCAGGTCGTAG |
1.8. Western blotting检测TRAF2、p-IKBα、p-NF-κB p65蛋白表达
RIPA细胞裂解液分离提取总蛋白,用NanoDrop 3000对蛋白浓度进行定量。用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白。主要抗体如下:抗p-NF-κB p65(1∶1000;Rabbit),抗p-IKBα(1∶1000;Rabbit),TRAF2(1∶1000;Rabbit)。按照1∶20 000用二抗稀释液稀释辣根过氧化物酶(HRP)标记的二抗。使用增强化学发光(ECL)检测试剂盒进行化学发光。
1.9. 免疫荧光染色分析p-IKBα、p-NF-κB p65蛋白平均荧光强度
收集各组细胞,每孔加入4%多聚甲醛固定20 min后,PBS洗涤3次。每孔加入200 L 0.5%Triton完全覆盖,室温孵育30 min,滴加山羊血清封闭液后,滴加足量的一抗,p-NF-κB p65(1∶200),和p-IKBα(1∶200),置于37 ℃培养箱孵育60 min。除去一抗,滴加足量的免疫荧光二抗(山羊抗小鼠/兔1∶400),将爬片取出,用抗荧光淬灭封片剂(含DAPI)封片。数字切片扫描仪(Pannoramic MIDI)扫描荧光切片。
1.10. 统计学分析
SPSS 22.0(Chicago, IL, U.S.A.)软件进行数据统计,Graphpad绘制图表。Shapiro-Wilk法检查数据的正态性。用均数±标准差描述具有正态分布的连续变量。多组间比较采用单因素方差分析(ANOVA),两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
2. 结果
2.1. 不同浓度XFC含药血清对IL-1β诱导的软骨细胞功能的影响
CKK-8结果显示,与NC组相比,IL-1β组软骨细胞活力下降(P<0.01)。与IL-1β组相比,随XFC浓度的增加,软骨细胞活力逐渐升高,差异有统计学意义(P<0.05或P<0.01)。与同一时间段20%XFC相比,培养24 h后,10%XFC细胞活力低于20%XFC,40%XFC浓度无明显变化;培养48 h后,10%和40%细胞活力低于20% XFC。继续培养72 h后,20%XFC细胞活力高于10% XFC,40%XFC浓度无明显变化(P<0.05或P<0.01)。20%XFC中48 h达到最大值(图 1)。
图 1.

CKK-8检测细胞活力
CKK-8 assay for assessing cell viability in different groups. *P < 0.01 vs NC group; #P < 0.05, ##P < 0.01 vs IL-1β at the same time point, △P < 0.05, △△P < 0.01 vs 20% XFC.
FCM检测细胞周期的变化,与NC组相比,IL-1β诱导的软骨细胞G1的比例升高,S期、G2期比例明显下降(P<0.01),表明IL-1β抑制软骨细胞的增殖;与IL-1β组相比,随XFC浓度的增加,软骨细胞G1的比例降低,G2期比例明显升高(P<0.05或P<0.01)。与20%XFC浓度相比,10%XFC和40%XFC浓度含药血清G1和S期的比例较高,G2期比例较低(P<0.05或P<0.01)。在20% XFC浓度时G1的比例降到最低,G2比例升高到最大值(表 2,图 2)。观察软骨细胞凋亡的情况,与NC组相比,IL-1β诱导的软骨细胞凋亡率升高(P<0.01);与IL-1β组比较,XFC干预后,软骨细胞中凋亡率下降(P<0.05或P<0.01)。与20%XFC组相比,10%XFC和40%浓度XFC细胞凋亡率较高(P<0.05,图 3)。
表 2.
在不同浓度XFC含药血清作用下细胞周期分布
Cell cycle distribution in chondrocytes treated with different concentrations of XFC-medicated serum
| Group | G1 | S | G2 |
| *P<0.01 vs NC group; #P<0.05, ##P<0.01 vs IL-1β group, △ P<0.05, △△P<0.01 vs 20% XFC. | |||
| NC | 60.04±0.05 | 2.34±0.03 | 37.62±0.02 |
| IL-1β | 84.47±0.04* | 2.46±0.01 | 13.06±0.01* |
| 10%XFC | 71.16±0.05#△ | 4.57±0.02#△ | 24.25±0.04#△△ |
| 20%XFC | 61.76±0.02## | 2.23±0.03 | 36.01±0.02## |
| 40%XFC | 69.59±0.03#△ | 5.95±0.05#△ | 24.46±0.05#△△ |
图 2.

FCM检测细胞周期
Flow cytometry for cell cycle analysis in different groups. *P < 0.01 vs NC group; #P < 0.05, ##P < 0.01 vs IL-1β group, △P < 0.05, △△P < 0.01 vs 20% XFC.
图 3.
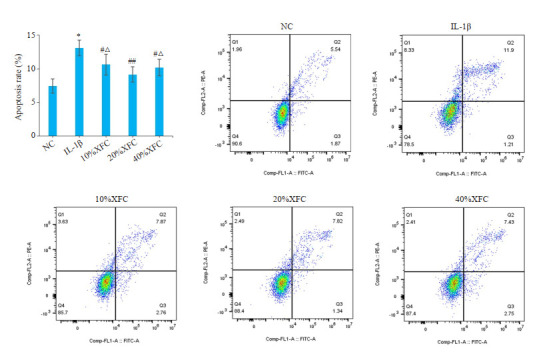
FCM检测细胞凋亡
Flow cytometry for analyzing apoptosis of the chondrocytes with different treatments. *P < 0.01 vs NC group; #P < 0.05, ##P < 0.01 vs IL-1β group, △P < 0.05 vs 20% XFC.
结合CKK-8、细胞周期和细胞凋亡结果,最终,选择20%XFC作为最佳含药血清浓度。
2.2. miR-502-5p和TRAF2靶向关系的验证
双荧光素酶实验结果显示,miR-502-5p与TRAF2 3'-UTR-WT存在结合位点(图 4A)。构建含有野生型(TRAF2-WT)和突变型(TRAF2-MUT)的荧光素酶报告基因质粒。在TRAF2-WT组中,与mimics-NC组相比,miR-502-5p mimics组荧光素酶活性明显降低(P<0.001),在TRAF2-MUT组中,miR-502-5p mimics组荧光素酶活性无显著变化(图 4B)。因此,说明miR-502-5p、TRAF2存在结合位点。
图 4.

双荧光素酶报告检测miR-502-5p和TRAF2靶向关系
Dual luciferase reporter gene assay for verifying the targeting relationship between miR-502-5p and TRAF2. A: Schematic of hsa-miR-502-5p binding to has-TRAF2 site. B: Dual luciferase assay of miR-502-5p with TRAF2. ***P < 0.001.
2.3. XFC含药血清对IL-1β诱导的软骨细胞miR-502-5p、TRAF2、NF-κB p65 mRNA的影响
首先,将miR-502-5p inhibitor转染至IL-1β诱导的软骨细胞中,采用RT- qPCR检测转染效率。与inhibitor NC组相比,miR-502-5p inhibitor组miR-502-5p的表达降低(P<0.01,图 5),说明转染效果较好,故以此进行后续实验。RT-PCR结果表明,与NC组相比,IL-1β刺激的软骨细胞中miR-502-5p mRNA表达下降,TRAF2、NF-κB p65mRNA相对表达上升(P<0.05或P<0.01);而XFC含药血清共培养后,miR- 502- 5p mRNA表达升高,TRAF2、NF-κB p65 mRNA表达下降(P<0.05);转染miR-502-5p inhibitor后,TRAF2、NF-κB p65 mRNA表达明显升高,miR-502-5p mRNA表达降低(P<0.05或P<0.01);将miR-502-5p inhibitor质粒和最佳XFC含药血清共培养,XFC含药血清能逆转miR-502-5p抑制状态下对通过TRAF2、NF-κB p65 mRNA的影响(P<0.05或P<0.01,表 3)。
图 5.

miR-502-5p在IL-1β诱导软骨细胞中的转染效率
Transfection efficiency of miR-502-5p in chondrocytes induced by IL-1β. **P < 0.01.
表 3.
XFC含药血清对IL-1β诱导软骨细胞miR-502-5p、TRAF2、NF-κB p65 mRNA的影响
Effect of XFC-medicated serum on miR-502-5p, TRAF2 and NF-κB p65 mRNA expressions in IL-1β-induced chondrocytes
| Group/indicator | NC | IL-1β | XFC | NC-inhibitor | miR-502-5p inhibitor | miR-502-5p inhibitor+XFC |
| *P<0.05, **P<0.01 vs NC group; #P<0.05 vs IL-1β group, △P<0.05, △△P<0.01 vs NC-inhibitor group; & P<0.05, && P<0.01 vs miR-502-5p inhibitor group. | ||||||
| miR-502-5p mRNA | 1.29±0.09 | 0.79±0.07** | 1.16±0.01# | 0.80±0.10 | 0.36±0.03△△ | 0.82±0.05 && |
| TRAF2 mRNA | 0.79±0.07 | 1.12±0.09* | 0.82±0.06# | 1.12±0.19 | 1.44±0.05△ | 0.89±0.07 && |
| NF-κB p65 mRNA | 1.26±0.01 | 1.43±0.07* | 1.27±0.03# | 1.42±0.13 | 1.66±0.03△ | 1.32±0.01 & |
2.4. XFC含药血清对IL-1β诱导的软骨细胞炎症因子的影响
ELASA结果表明,与NC组相比,IL-1β诱导的软骨细胞中IL-1β、TNF-α表达高于NC组,IL-4和IL-10表达则下降(P<0.05或P<0.01),表明IL-1β诱导软骨细胞炎症状态;而将最佳XFC含药血清共培养后,XFC含药血清抑制IL-1β、TNF-α水平,上调IL-4和IL-10水平(P<0.05或P<0.01);转染miR-502-5p inhibitor质粒后,IL-1β、TNF-α表达明显升高,IL-4和IL-10明显降低(P<0.05);将miR-502-5p inhibitor转染质粒和最佳XFC含药血清共培养,IL-1β、TNF-α明显降低,IL-4和IL-10明显升高(P<0.01),XFC含药血清能逆转miR-502-5p抑制状态下对炎症因子的影响(表 4)。
表 4.
XFC含药血清对IL-1β诱导软骨细胞炎症因子的影响
Effect of XFC-medicated serum on inflammatory factors in IL-1β-induced chondrocytes
| Group/indicator | NC | IL-1β | XFC | NC-inhibitor | miR-502-5p inhibitor | miR-502-5p inhibitor+XFC |
| *P<0.05, **P<0.01 vs NC group; #P<0.05, ##P<0.01 vs IL-1β group, △P<0.05 vs NC-inhibitor group; & P<0.01 vs miR-502-5p inhibitor group. | ||||||
| IL-1β (pg/mL) | 30.26±4.89 | 43.49±3.78** | 35.64±2.55# | 41.24±4.90 | 47.97±7.49△ | 37.09±2.80 & |
| TNF-α (pg/mL) | 52.59±5.74 | 77.92±8.23** | 65.27±3.47## | 75.97±5.95 | 80.21±6.34△ | 68.36±6.22 & |
| IL-4 (pg/mL) | 18.51±2.61 | 13.18±3.39* | 17.71±5.73# | 13.95±2.84 | 10.53±2.12△ | 19.32±5.34 & |
| IL-10 (pg/mL) | 26.48±11.92 | 17.62±5.90** | 22.67±4.01# | 16.57±3.13 | 11.31±5.74△ | 19.59±6.04 & |
2.5. XFC含药血清对IL-1β诱导的软骨细胞ECM代谢的影响
RT-PCR结果表明,与NC组相比,IL-1β组的ECM降解产物(ADAMTS5和MMP13mRNA)相对表达上升,软骨修复产物(COL2A1 mRNA)表达下降(P<0.05或P<0.01);而XFC含药血清共培养后,ADAMTS5、MMP13、TRAF2 mRNA表达下降,COL2A1 mRNA表达升高(P<0.05或P<0.01);转染miR-502-5p inhibitor后,ADAMTS5、MMP13、TRAF2表达明显升高,COL2A1 mRNA表达降低(P<0.05);而将miR-502-5p inhibitor转染质粒和最佳XFC含药血清共培养,XFC含药血清能逆转miR-502-5p抑制状态下对通过细胞ECM产物的影响(P<0.05或P<0.01,表 5)。
表 5.
XFC含药血清对IL-1β诱导软骨细胞ECM产物的影响
Effect of XFC-medicated serum on ECM products in IL-1β-induced chondrocytes
| Group/indicator | NC | IL-1β | XFC | NC-inhibitor | miR-502-5p inhibitor | miR-502-5p inhibitor+XFC |
| *P<0.05, **P<0.01 vs NC group; #P<0.05, ##P<0.01 vs IL-1β group, △ P<0.05 vs NC-inhibitor group; & P<0.05, && P<0.01 vs miR-502-5p inhibitor group. | ||||||
| COL2A1 mRNA | 1.24±0.16 | 0.63±0.07** | 1.15±0.03## | 0.61±0.08 | 0.47±0.02△ | 0.81±0.06 & |
| MMP13 mRNA | 1.47±0.18 | 2.34±0.27** | 1.79±0.06## | 2.22±0.52 | 2.56±0.08△ | 1.81±0.09 && |
| ADAMTS5 mRNA | 1.75±0.08 | 2.09±0.05* | 1.83±0.08# | 2.08±0.14 | 2.21±0.13△ | 1.91±0.05 & |
2.6. XFC含药血清对IL-1β诱导的软骨细胞中TRAF2、p-IKBα、p-NF-κB p65蛋白水平的影响
IL-1β诱导软骨细胞中TRAF2、p-IKBα、p-NF-κB p65蛋白表达高于NC组(P<0.01);XFC含药血清干预共培养细胞后,蛋白表达水平下降(P<0.01);转染miR-502-5p inhibitor后,TRAF2、p-IKBα、p-NF-κB p65蛋白表达升高(P<0.05);与miR-502-5p inhibitor相比,将miR-502-5p inhibitor转染的软骨细胞和最佳XFC含药血清共培养后,TRAF2、p-IKBα、p-NF-κB p65蛋白表达下降(P<0.01,图 6)。
图 6.

XFC含药血清对IL-1β诱导软骨细胞TRAF2、p-IKBα、p-NF-κB p65蛋白表达的影响
Effect of XFC-medicated serum on protein expressiond of TRAF2, p-IKBα and p-NF-κB p65 in IL-1β-induced chondrocytes. A. WB band. B: Relative protein expression of p-NF-κB p65. C: Relative protein expression of p-IKBα. D: Relative protein expression of RAF2. aP < 0.01 vs NC group; bP < 0.01 vs IL-1β group, cP < 0.05 vs NC-inhibitor group; dP < 0.01 vs miR-502-5p inhibitor group.
2.7. XFC含药血清对IL-1β诱导的软骨细胞p-IKBα、p-NF-κB p65平均荧光强度表达的影响
与NC组相比,IL-1β刺激的软骨细胞中p-IKBα、p-NF-κB p65的平均荧光强度显著升高(P<0.01)。XFC含药血清干预后,p-IKBα、p-NF-κB p65的平均荧光强度水平下降(P<0.01);与NC-inhibitor相比,转染miR-502-5p inhibitor后,p-IKBα、p-NF-κB p65的平均荧光强度相对升高(P<0.01);与miR-502-5p inhibitor相比,将miR-502-5p inhibitor转染的软骨细胞和最佳XFC含药血清共培养后,p-IKBα、p-NF-κB p65的平均荧光强度表达下降(P<0.01,图 7、8)。
图 7.

XFC含药血清对p-NF-κB p65平均荧光强度表达的影响
Effect of XFC-medicated serum on p-NF-κB p65 average fluorescence intensity (Immunofluorescence staining, original magnification: × 50). A: Histogram of mean fluorescence intensity (Mean ± SD). aP < 0.01 vs NC group; bP < 0.01 vs IL-1β group, cP < 0.01 vs NC-inhibitor group; dP < 0.01 vs miR-502-5p inhibitor group. B: Nuclei are in blue, positive expression location is in green, Merge is the result of nucleus-protein overlap.
图 8.
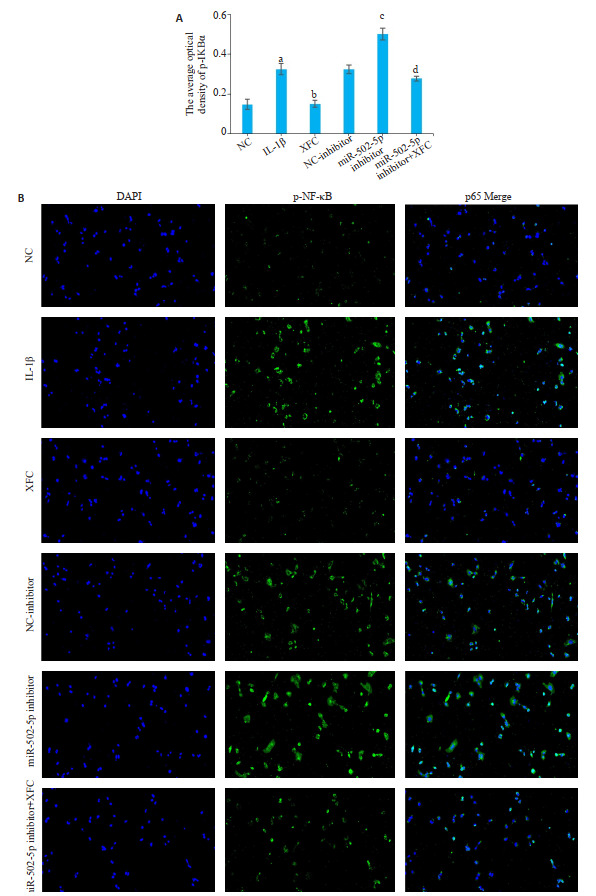
XFC含药血清对p-IKBα平均荧光强度表达的影响
Effect of XFC-medicated serum on p-IKBα average fluorescence intensity (Immunofluorescence staining, ×50). A: Histogram of mean fluorescence intensity (Mean±SD). aP < 0.01 vs NC group; bP < 0.01 vs IL-1β group, cP < 0.01 vs NC-inhibitor group; dP < 0.01 vs miR-502-5p inhibitor group. B: Nuclei are in blue, positive expression location is in green, Merge is the result of nucleus-protein overlap.
3. 讨论
OA中炎症微环境的失衡,导致低度炎症,是软骨退化和滑膜增殖的原因[19]。以中医理论指导和临床实践基础上的新风胶囊,功于健脾化湿通络,正对痹证“脾虚湿盛、脾虚致痹”的病因病机[20],治疗OA的临床疗效明显[21, 22],其作用机制值得进一步研究。新风胶囊主要由黄芪、薏苡仁、雷公藤、蜈蚣组成。方中黄芪、薏苡仁,具有补气健脾化湿之功。现代药理学研究也表明黄芪多糖通过抑制Toll样受体4/核因子κB p65通路的激活改善KOA的ECM降解、炎症反应,改善关节损伤[23]。薏苡仁酯可以减轻CIA模型大鼠关节的炎症反应[24]。臣药雷公藤和蜈蚣,通络,止痹痛。雷公藤有效成分雷公藤甲素可以改善CIA大鼠软骨组织损伤[25]。蜈蚣外达经络,又内走筋骨,可治顽痹,药理学研究表明蜈蚣可有效减轻CIA大鼠关节炎性细胞浸润和关节软骨损伤,达到减轻关节疼痛的效果[26]。
促炎因子,如TNF-α、IL-1β和IL-6的作用与OA的发病机制有关。炎症介质进一步可触发软骨细胞外基质降解,破坏软骨内稳态[27]。COL2A1的减少加速了软骨细胞肥大[28]。MMP-13是参与软骨降解的主要MMP,它具有切割Ⅱ型胶原的特殊能力[29]。ADAMTS5是OA发病机制中的主要聚集酶,是关节软骨分解和基质丧失的主要原因[30]。MicroRNA(miRNA)可以改变mRNA的表达,从而改变特定基因的表达,调节OA软骨细胞基因转录[31]。先前的研究发现,miR-502-5p在IL-1β诱导的软骨细胞中显著下调[32],但目前miR-502-5p在OA中的调节功能研究较少。NF-κB参与OA软骨细胞分解代谢和滑膜炎症[33]。TRAF2是NF-κB通路的关键介质。
IL-1β激活MMPs诱导软骨降解,并抑制聚集聚糖的合成[34]。本研究中,用IL-1β诱导软骨细胞模拟炎症反应,结果表明,软骨细胞活力降低,抑制软骨细胞增殖,凋亡率升高,抑炎因子(IL-4和IL-10)下降,促炎因子(IL-1β、TNF-α)升高,表明模型构建成功。NF-κB在调节炎症免疫反应中起重要作用。IL-1β激活的NF-κB途径与多种炎症病理有关[35]。活化的NF-κB分子可诱导关节破坏,导致OA的进展。Lin等[36]发现川柏素通过抑制NF-κB来抑制IL-1β诱导的软骨细胞炎症。在本研究中,我们发现IL-1β诱导软骨细胞中miR-502-5p、COL2A1 mRNA水平下降,TRAF2、NF-κB p65、ADAMTS5和MMP13mRNA相对表达水平上升,表明IL-1β诱导的软骨细胞存在miR-502-5p、TRAF2、NF-κB表达异常,ECM代谢紊乱。CKK-8和流式细胞术实验筛选最佳的含药血清浓度是20%的含药血清浓度,经XFC含药血清干预后,IL-1β诱导的软骨细胞凋亡率下降,细胞活力升高,表明XFC含药血清对软骨细胞有保护作用。
双荧光素酶报告验证TRAF2可以作为miR-502-5p的下游靶标。转染miR-502-5p inhibitor后,TRAF2、p-IKBα、p-NF-κB p65表达升高,表明miR-502-5p基因干扰后,下游的TRAF2/NF-κB通路异常活化,IL-1β、TNF-α升高,IL-4、IL-10下降,ADAMTS5、MMP13mRNA相对表达明显上升,COL2A1 mRNA相对表达下降,表明miR-502-5p调控TRAF2/NF-κB轴影响软骨细胞炎症反应和软骨ECM代谢过程。将筛选的20%浓度的XFC干预IL-1β诱导的软骨细胞后,IL-1β、TNF-α表达下降,IL-4、IL-10表达升高,且ECM降解产物(ADAMTS5和MMP13mRNA)和TRAF2、NF-κB p65mRNA相对表达量明显下降,软骨修复产物(COL2A1 mRNA)和miR-502-5p mRNA表达上升,表明XFC含药血清抑制IL-1β诱导的软骨细胞中炎症反应和ECM降解,调节miR-502-5p/TRAF2/NF-κB轴。回复实验中,在XFC含药血清干预的基础上,再转染了miR-502-5p inhibitor后,IL-1β、TNF-α表达下降,IL-4、IL-10表达升高,ADAMTS5和MMP13和TRAF2、NF-κB p65表达明显下降,COL2A1表达升高,说明XFC含药血清能逆转miR-502-5p抑制剂作用,进而调节下游TRAF2/NF-κB靶点,调控IL-1β诱导的软骨细胞炎症和ECM代谢。
OA进展的主要因素是慢性炎症和关节软骨ECM代谢紊乱[37]。OA中的慢性炎症诱导软骨细胞的分解代谢活动,导致软骨细胞中基质降解酶(MMP1,MMP13)等表达上调[38]。ECM的变化与炎症下细胞功能之间的相互作用形成了一个正反馈回路,驱动OA的病理学进展。本研究关注OA软骨细胞炎症下ECM与细胞功能之间的相互作用,以及XFC调节这些因素的机制。研究表明,XFC对IL-1β诱导的软骨细胞的细胞外基质具有保护作用,可以抑制ECM降解产物ADAMTS5和MMP13的表达,上调合成产物COL2A1的表达,其机制可能是上调miR-502-5p,靶向TRAF2/NF-κB轴,抑制软骨细胞炎症反应,抑制细胞凋亡,恢复软骨细胞活力。
综上所述,本研究表明新风胶囊对IL-1β诱导的软骨细胞的细胞外基质具有保护作用,抑制软骨细胞炎症反应和ECM降解,其机制可能是通过调节miR-502-5p/TRAF2/NF-κB轴,为临床开发新风胶囊治疗骨关节炎的新策略提供实验支撑。
Funding Statement
国家自然科学基金(82274490);安徽省高等学校科学研究项目(自然科学类)重点项目(2022AH050449);安徽省第12批“115”创新团队(皖人才办)﹝2019﹞1号);安徽省名中医刘健工作室建设项目(中医药发展秘﹝2018﹞11号);安徽省中医药领军人才项目(中医药发展秘﹝2018﹞23号)资助
Supported by National Natural Science Foundation of China (82274490)
References
- 1.郑 祥, 高 颂爱, 尤 浩, et al. 电针可改善骨关节炎大鼠的关节炎症和运动功能: 基于调控Wnt-Wnt-7B/β-catenin信号通路. 南方医科大学学报. 2023;43(4):590–6. [Google Scholar]
- 2.Zhou Q, Liu J, Xin L, et al. Exploratory compatibility regularity of traditional Chinese medicine on osteoarthritis treatment: a data mining and random walk-based identification. Evid Based Complement Alternat Med. 2021;2021:2361512. doi: 10.1155/2021/2361512. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Statzer C, Park JYC, Ewald CY. Extracellular matrix dynamics as an emerging yet understudied hallmark of aging and longevity. Aging Dis. 2023;14(3):670–93. doi: 10.14336/AD.2022.1116. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Han H, Chen M, Li ZY, et al. Corosolic acid protects rat chondrocytes against IL-1β-induced ECM degradation by activating autophagy via PI3K/AKT/mTOR pathway and ameliorates rat osteoarthritis. Drug Des Dev Ther. 2022;16:2627–37. doi: 10.2147/DDDT.S365279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Marangio A, Biccari A, D'Angelo E, et al. The study of the extracellular matrix in chronic inflammation: a way to prevent cancer initiation? Cancers. 2022;14(23):5903. doi: 10.3390/cancers14235903. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zacharjasz J, Mleczko AM, Bąkowski P, et al. Small noncoding RNAs in knee osteoarthritis: the role of microRNAs and tRNA-derived fragments. Int J Mol Sci. 2021;22(11):5711. doi: 10.3390/ijms22115711. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Xu J, Ma XL. Hsa_circ_0032131 knockdown inhibits osteoarthritis progression via the miR-502-5p/PRDX3 axis. Aging. 2021;13(11):15100–13. doi: 10.18632/aging.203073. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Liang SA, Wang ZG, Zhang ZZ, et al. Decreased RIPK1 expression in chondrocytes alleviates osteoarthritis via the TRIF/MyD88-RIPK1-TRAF2 negative feedback loop. Aging. 2019;11(19):8664–80. doi: 10.18632/aging.102354. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.揭 立士, 时 孝晴, 刘 子修, et al. 桃仁-红花通过抑制NF-κB信号通路改善IL-1β诱导的软骨炎症和降解. 中药新药与临床药理. 2023;34(7):936–47. [Google Scholar]
- 10.张 国梁, 王 跃文, 普日布苏荣, et al. p53/miR-502-5p/TRAF2通路对骨关节炎软骨细胞损伤的影响. 中国病理生理杂志. 2018;34(7):1283–90. [Google Scholar]
- 11.ZHANG Ling-ling, ZHANG Feng, SHU Jin-ling, et al. CP-25 inhibits the functions of activated human B cells through regulating BAFF-TRAF2-NF-κB and TNF-alpha-TRAF2-NF-κB signaling. 中国药理学与毒理学杂志. 2017;31(10):982–3. [Google Scholar]
- 12.文 建庭, 刘 健. 构建从脾治痹多元融合的证据链. 风湿病与关节炎. 2021;10(10):39–43. [Google Scholar]
- 13.Liu J, Wang Y, Sun Y, et al. Efficacy and safety of Xinfeng capsule in the treatment of osteoar-thritis: a multicenter, randomized, double-blinded, controlled trial. J Tradit Chin Med. 2020;40(2):284–95. [PubMed] [Google Scholar]
- 14.鲍 丙溪, 刘 健, 万 磊, et al. 骨关节炎患者免疫炎症关键蛋白表达谱变化及中医药的干预研究. 中国免疫学杂志. 2021;37(11):1313–8. [Google Scholar]
- 15.鲍 丙溪, 刘 健, 万 磊, et al. 新风胶囊通过miR-23a-3p/PTEN/PI3K/AKT/mTOR抑制骨关节炎CD4+T与软骨细胞共培养的免疫炎症. 南方医科大学学报. 2021;41(04):483–94. [Google Scholar]
- 16.Wong SW, Lenzini S, Cooper MH, et al. Soft extracellular matrix enhances inflammatory activation of mesenchymal stromal cells to induce monocyte production and trafficking. Sci Adv. 2020;6(15):eaaw0158. doi: 10.1126/sciadv.aaw0158. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Tomlin H, Piccinini AM. A complex interplay between the extracellular matrix and the innate immune response to microbial pathogens. Immunology. 2018;155(2):186–201. doi: 10.1111/imm.12972. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Liang CC, Xing HT, Wang CY, et al. Resveratrol protection against IL-1β-induced chondrocyte damage via the SIRT1/FOXO1 signaling pathway. J Orthop Surg Res. 2022;17(1):406. doi: 10.1186/s13018-022-03306-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Liu NN, Huang YP, Shao YB, et al. The regulatory role and mechanism of lncTUG1 on cartilage apoptosis and inflammation in osteoarthritis. Arthritis Res Ther. 2023;25(1):106. doi: 10.1186/s13075-023-03087-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.黄 旦, 刘 健, 汪 元, et al. 刘健从脾治痹经验探讨. 中医药临床杂志. 2022;34(6):1070–3. [Google Scholar]
- 21.朱 子衡, 万 磊, 刘 健, et al. 新风胶囊对膝骨关节炎患者的临床疗效. 中成药. 2023;45(2):444–8. [Google Scholar]
- 22.周 巧, 刘 健, 郭 锦晨, et al. 健脾利湿通络法改善骨关节炎湿热证免疫炎症指标的系统评价和Meta分析. 风湿病与关节炎. 2022;11(1):21–8. [Google Scholar]
- 23.陈 景涛, 陈 有, 李 玉静, et al. 黄芪多糖抑制Toll样受体4/核因子κB p65通路治疗大鼠膝骨关节炎. 中国组织工程研究. 2023;27(31):5002–8. [Google Scholar]
- 24.岳 静, 王 世军. 薏苡仁及其组分对佐剂性关节炎大鼠抗炎镇痛的作用及其机制. 中国组织工程研究. 2023;27(26):4187–92. [Google Scholar]
- 25.郭 睿博, 孔 亮, 张 璐, et al. 雷公藤甲素联合硫酸软骨素脂质体对关节炎大鼠的治疗作用. 中国药理学通报. 2021;37(7):991–6. [Google Scholar]
- 26.曾 建春, 林 梓凌, 曾 意荣, et al. 樊粤光应用虫类药物治疗退行性骨关节炎经验. 广州中医药大学学报. 2021;38(8):1718–21. [Google Scholar]
- 27.Chow YY, Chin KY. The role of inflammation in the pathogenesis of osteoarthritis. Mediat Inflamm. 2020;2020:1–19. doi: 10.1155/2020/8293921. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Lian CJ, Wang XD, Qiu XJ, et al. Collagen type Ⅱ suppresses articular chondrocyte hypertrophy and osteoarthritis progression by promoting integrin β1-SMAD1 interaction. Bone Res. 2019;7:8. doi: 10.1038/s41413-019-0046-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Hu QC, Ecker M. Overview of MMP- 13 as a promising target for the treatment of osteoarthritis. Int J Mol Sci. 2021;22(4):1742. doi: 10.3390/ijms22041742. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Jiang LJ, Lin JC, Zhao S, et al. ADAMTS5 in osteoarthritis: biological functions, regulatory network, and potential targeting therapies. Front Mol Biosci. 2021;8:703110. doi: 10.3389/fmolb.2021.703110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Balaskas P, Goljanek-Whysall K, Clegg PD, et al. microRNA signatures in cartilage ageing and osteoarthritis. Biomedicines. 2023;11(4):1189. doi: 10.3390/biomedicines11041189. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Zhang GL, Sun YH, Wang YW, et al. miR-502-5p inhibits IL-1β-induced chondrocyte injury by targeting TRAF2. Cell Immunol. 2016;302:50–7. doi: 10.1016/j.cellimm.2016.01.007. [DOI] [PubMed] [Google Scholar]
- 33.Choi, Jo, Park, et al. NF-B signaling pathways in osteoarthritic cartilage destruction. Cells. 2019;8(7):734. doi: 10.3390/cells8070734. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Wang F, Liu JJ, Chen XL, et al. IL-1β receptor antagonist (IL-1Ra) combined with autophagy inducer (TAT-Beclin1) is an effective alternative for attenuating extracellular matrix degradation in rat and human osteoarthritis chondrocytes. Arthritis Res Ther. 2019;21(1):171. doi: 10.1186/s13075-019-1952-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Liu RX, Wu H, Song HJ. Knockdown of TRIM8 attenuates IL-1β-induced inflammatory response in osteoarthritis chondrocytes through the inactivation of NF-κB pathway. Cell Transplant. 2020;29:096368972094360. doi: 10.1177/0963689720943604. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Lin Z, Wu DY, Huang LP, et al. Nobiletin inhibits IL-1β-induced inflammation in chondrocytes via suppression of NF-κB signaling and attenuates osteoarthritis in mice. Front Pharmacol. 2019;10:570. doi: 10.3389/fphar.2019.00570. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Gilbert SJ, Bonnet CS, Blain EJ. Mechanical cues: bidirectional reciprocity in the extracellular matrix drives mechano-signalling in articular cartilage. Int J Mol Sci. 2021;22(24):13595. doi: 10.3390/ijms222413595. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Kuppa SS, Kim HK, Kang JY, et al. Polynucleotides suppress inflammation and stimulate matrix synthesis in an in vitro cell-based osteoarthritis model. Int J Mol Sci. 2023;24(15):12282. doi: 10.3390/ijms241512282. [DOI] [PMC free article] [PubMed] [Google Scholar]


