Abstract
目的
探讨NPHP1基因缺陷肾小管上皮细胞TNF-α信号通路激活及其调控的炎症因子表达。
方法
使用重组慢病毒LV-NPHP1-RNAi构建敲低NPHP1表达的人近端肾小管细胞株(HK2)细胞(NPHP1KD HK2)。通过实时荧光定量PCR、Western blot、酶联免疫吸附实验法检测各细胞株TNF-α表达、p38和C/EBPβ激活状态及其调控炎症因子CXCL5、CCL20、IL-1β、IL-6、MCP-1等表达情况。通过构建siRNA敲低野生型和NPHP1KD HK2细胞C/EBPβ表达,观察上述指标变化。
结果
敲低NPHP1表达后,NPHP1KD HK2细胞TNF-α、C/EBPβ、CXCL5、IL-1β和IL-6的mRNA表达量增加(P<0.05);Western blotting结果显示,phospho-p38、C/EBPβ表达上调(P<0.05);培养液上清IL-6水平增加(P<0.05)。使用siRNA敲低C/EBPβ表达后,NPHP1KDHK2细胞CSF2、CCL20、IL-1β和IL-6的mRNA表达水平下调(P<0.05);Western blot显示phospho-p38表达下调(P<0.05);培养液上清IL-6水平下降(P<0.001)。
结论
NPHP1基因缺陷的NPHP1KDHK2细胞中TNF-α信号通路被激活,其调控的下游印证因子表达上调。C/EBPβ可能是介导NPHP1KDHK2细胞TNF-α信号通路相关炎症因子表达的关键转录因子。
Keywords: 肾单位肾痨, TNF-α, C/EBPβ, 炎症因子, NPHP1
Abstract
Objective
To explore the activation of tumor necrosis factor-α (TNF-α) signaling pathway and the expressions of the associated inflammatory factors in NPHP1-defective renal tubular epithelial cells.
Methods
A human proximal renal tubular cell (HK2) model of lentivirus-mediated NPHP1 knockdown (NPHP1KD) was constructed, and the expressions of TNF-α, p38, and C/EBPβ and the inflammatory factors CXCL5, CCL20, IL-1β, IL-6 and MCP-1 were detected using RT-qPCR, Western blotting or enzyme-linked immunosorbent assay. A small interfering RNA (siRNA) was transfected in wild-type and NPHP1KDHK2 cells, and the changes in the expressions of TNF-α, p38, and C/EBPβ and the inflammatory factors were examined.
Results
NPHP1KDHK2 cells showed significantly increased mRNA expressions of TNF-α, C/EBPβ, CXCL5, IL-1β, and IL-6 (P < 0.05), protein expressions of phospho-p38 and C/EBPβ (P < 0.05), and IL-6 level in the culture supernatant (P < 0.05), and these changes were significantly blocked by transfection of cells with siRNA-C/EBPβ (P < 0.05).
Conclusion
TNF-α signaling pathway is activated and its associated inflammatory factors are upregulated in NPHP1KDHK2 cells, and C/EBPβ may serve as a key transcription factor to mediate these changes.
Keywords: nephronophthisis, tumor necrosis factor-α, C/EBPβ, inflammatory factor, NPHP1
肾单位肾痨(NPH)是一种常染色体隐性遗传性慢性间质性囊肿性肾病,是导致儿童及青少年肾衰竭最主要的遗传性疾病,占儿童肾衰竭患者的5%~15%[1, 2]。根据患者进入终末期肾病的平均年龄不同,将NPH分为婴儿型(肾衰竭平均年龄为1岁)、少年型(平均13岁)、青年型(平均19岁)和成人型/迟发型[3]。临床上以少年型最常见。研究发现NPH也是成人肾衰竭的重要病因[4]。NPH特征性肾脏病理改变为皮髓质交界处肾小管扩张和肾囊肿形成,肾小管基底膜增厚分层撕裂,弥漫肾间质纤维化和炎症细胞浸润[5]。NPH的肾间质纤维化和炎症出现在疾病的早期,其机制尚不清楚。
NPH致病基因目前已发现26种,其中NPHP1突变最常见,约占NHP病例的20%[6]。NPH致病基因编码蛋白大多数位于初级纤毛过渡区、inversin隔室及内转运(IFT)复合体亚基上[7],与初级纤毛的结构和功能有关[8]。纤毛主要分为动力纤毛和非动力纤毛。非动力纤毛,即初级纤毛,广泛分布于除淋巴细胞以外的各种静止细胞,主要感受细胞外信号,通过不同的细胞内信号途径调节组织细胞和器官的发育、分化和成熟[9]。初级纤毛结构和功能缺陷导致的疾病称为(初级)纤毛病。目前已发现多种初级纤毛相关的信号通路,如Wnt通路、Hedgehog通路、DNA损伤反应(DDR)通路、Hippo通路、cAMP通路和mTOR通路等[10]。目前研究认为这些信号通路可能参与介导初级纤毛病的发生发展,但具体机制不详。
课题组前期研究发现,NPHP1敲低的犬远曲小管上皮细胞,以及NPHP1和NPHP5缺陷患者尿液上皮细胞转录组测序结果均显示肿瘤坏死因子(TNF-α)信号通路相关信号因子被激活,TRAF2/5、C/EBPβ、IL-1β和IL-6等表达上调。TNF-α信号通路是调节免疫和炎症的关键信号通路之一。为探究TNF-α信号通路在NPHP1缺陷肾小管上皮细胞的激活情况及其在NPH发病中可能的作用,本研究通过体外敲低人近端肾小管上皮细胞株HK2细胞NPHP1表达(NPHP1KDHK2细胞),观察TNF信号通路的激活情况。结果显示,敲低NPHP1表达后,HK2细胞TNF及其调控的验证因子表达升高,调控相关炎症因子表达的转录因子C/EBPβ表达升高,提示TNF信号通路调控的炎症因子可能参与介导NPH疾病的发生发展。
1. 材料和方法
1.1. 细胞株与试剂来源
野生型人肾近曲小管上皮细胞株(HK2细胞)由南方医院肾内科聂静教授课题组惠赠。主要试剂:细胞/ 组织总RNA提取试剂盒、HiScipt Ⅱ逆转录试剂盒、高灵敏性染料法定量PCR检测试剂盒(南京诺唯赞生物科技股份有限公司),胎牛血清(Sigma),DMEM/F12、DMEM basic(Gibco),0.25%胰蛋白酶-EDTA(Gibco),104/mL青-链霉素(Gibco),嘌呤霉素(Sigma),1×磷酸盐缓冲液(1×PBS,0.0067 mol/L)(Gibco),转铁蛋白、重组人胰岛素(细胞培养级别)(北京索莱宝科技有限公司),GP-transfect-Mate(苏州吉玛基因股份有限公司),兔抗NPHP1多克隆抗体(Sigma),兔抗β-tubulin单克隆抗体(沈阳万类生物科技有限公司),兔抗CEBP beta单克隆抗体(上海Abcam),兔抗p38 MAPK、phospho-p38单克隆抗体(上海艾比玛特医药科技有限公司),山羊抗兔IgG(H+L)-HRP辣根过氧化物酶标记(杭州弗德生物科技有限公司)。
1.2. 实验方法
1.2.1. 体外人源NPHP1稳定低表达HK2细胞模型构建
构建敲低NPHP1基因表达的慢病毒短发夹RNA(LV-NPHP1-RNAi,干扰序列见表 1,上海吉凯基因公司),转染HK2细胞,构建体外人源NPHP1稳定低表达细胞HK2模型。按照说明书选择最佳实验条件,设计复感染指数梯度,并使用配套的HiTransG A感染增强液进行转染。按照嘌呤霉素工作浓度梯度,筛选加药培养48 h全部细胞死亡的最低浓度。
表 1.
干扰序列
Interference sequence
| Number | Accession NO. | Target Seq | GC |
| NPHP1-RNAi (106032-1) | NM_207181 | ccAAGTCGTATTTCATTGATT | 26.32% |
| Description | Homo sapiens nephrocystin 1 (NPHP1), transcript variant 2, mRNA | ||
1.2.2. 敲低C/EBPβ表达的小干扰RNA(siRNA)的构建与转染
siRNA-C/EBPβ及阴性对照由北京擎科生物公司合成,干扰序列见表 2。转染试剂GP-transfect-Mate,由苏州吉玛基因公司提供,实验过程严格按照说明书进行。
表 2.
干扰序列
Interference sequence
| Number | Sequence (5'→3') |
| C/EBPβ-RNAi-1 | UUCUUUAAAUAACACCACGGG |
| C/EBPβ-RNAi-2 | UUCCAUGGAUUUAAAGGCAGG |
| C/EBPβ-RNAi-3 | AAGAGGUCGGAGAGGAAGUCG |
| Negative control | UUCUCCGAACGUGUCACGUTT |
1.2.3. 细胞培养与实验分组
所有细胞放置于37 ℃、5% CO2细胞培养箱中培养。HK2细胞培养使用DMEM basic+10%FBS+1%双抗。NPHP1KDHK2细胞培养使用完全培养基:10%FBS+1%双抗+0.02%嘌呤霉素+88.98% DMEM basic。细胞分6组:野生型(WT)、野生敲低型(WT+siRNA-C/EBPβ)、野生空载型(WT+ siRNA- nc)、NPHP1敲低型(KD)、NPHP1敲低并C/EBPβ敲低型(KD+siRNA-C/EBPβ)、敲低空载型(KD+ siRNA-nc)。
1.2.4. 细胞免疫荧光
使用24孔细胞培养板制作细胞爬片,经过洗涤、固定、通透、封闭后,一抗室温封闭1 h,荧光二抗封闭1 h,滴加含DAPI的封片剂,于荧光显微镜下观察并拍摄,imageJ进行荧光定量。
1.2.5. 实时荧光定量PCR
qPCR引物由深圳华大基因合成,序列见表 3。通过细胞/组织总RNA提取试剂盒提取细胞总RNA,HiScipt Ⅱ逆转录试剂盒逆转录得到cDNA,高灵敏性染料法定量PCR检测试剂盒配置qPCR反应液,以上试剂盒都由南京诺唯赞生物科技有限公司提供,具体实验步骤严格按照说明书进行。
表 3.
qPCR引物序列
Sequences of qPCR primers
| Target gene | qPCR primer (5'→3') | Amplification products | GC (%) | Temperatures of anneal |
| GAPDH | GGAGCGAGATCCCTCCAAAAT (Upstream) | 197 bp | 52.38 | 59.86 ℃ |
| GGCTGTTGTCATACTTCTCATGG (Downstream) | 47.83 | 59.38 ℃ | ||
| NPHP1 | GCTACAGAAGGCACTATTAGGT (Upstream) | 177 bp | 45.45 | 57.33 ℃ |
| TGTGGCTCTGACTGTATGAATG (Downstream) | 45.45 | 58.13 ℃ | ||
| TNF-α | GCTGCACTTTGGAGTGATCG (Upstream) | 108 bp | 55.55 | 59.55 ℃ |
| TCACTCGGGGTTCGAGAAGA (Downstream) | 55.55 | 60.25 ℃ | ||
| C/EBPβ | GGAGCCCGTCGGTAATTT (Upstream) | 76 bp | 55.56 | 57.05 ℃ |
| TCTGCATGTGCGGTTGG (Downstream) | 58.82 | 57.87 ℃ | ||
| CCL2 | AGCCAGATGCAATCAATGCC (Upstream) | 119 bp | 50.00 | 59.25 ℃ |
| AGCTTCTTTGGGACACTTGCT (Downstream) | 47.62 | 60.13 ℃ | ||
| IL-1β | ACAGTGGCAATGAGGATG (Upstream) | 129 bp | 50.00 | 54.54 ℃ |
| TGTAGTGGTGGTCGGAGA (Downstream) | 55.56 | 56.74 ℃ | ||
| IL-6 | GTACATCCTCGACGGCATC (Upstream) | 98 bp | 57.89 | 57.82 ℃ |
| TCAGGTTGTTTTCTGCCAGT (Downstream) | 45.00 | 57.56 ℃ | ||
| CCL20 | GCGAATCAGAAGCAGCAAGC (Upstream) | 116b p | 55.00 | 60.52 ℃ |
| GATGTCACAGCCTTCATTGGC (Downstream) | 52.38 | 59.87 ℃ | ||
| CXCL5 | CAGACCACGCAAGGAGTTCA (Upstream) | 82 bp | 55.00 | 60.25 ℃ |
| CTTCCACCTTGGAGCACTGT (Downstream) | 55.00 | 59.89 ℃ | ||
| P38 | GGCAGGAGCTGAACAAGACA (Upstream) | 92 bp | 55.00 | 60.25 ℃ |
| AGCACACACAGAGCCATAGG (Downstream) | 55.00 | 59.75 ℃ | ||
| CSF2 | GAAACTTCCTGTGCAACCC (Upstream) | 121 bp | 52.63 | 56.73 ℃ |
| CATCTGGCCGGTCTCACTC (Downstream) | 63.16 | 59.86 ℃ | ||
| AP-1 | TCGCTGCCTCCAAGTGCCGAAA (Upstream) | 134 bp | 59.09 | 67.20 ℃ |
| AAGCTGTGCCACCTGTTCCCT (Downstream) | 57.14 | 64.32 ℃ | ||
| CREB5 | AAGACTGCCCAATAACAGCC (Upstream) | 150 bp | 50.00 | 58.16 ℃ |
| CCACCTCGCTGACCGATG (Downstream) | 66.67 | 60.20 ℃ |
1.2.6. Western blotting检测
使用RIPA蛋白裂解液(强)和苯甲基磺酰氟PMSF、蛋白酶抑制剂、磷酸酶抑制剂提取细胞总蛋白,BCA法测定蛋白浓度,加入蛋白Loading buffer金属浴15 min变性。配置10%SDSPAGE凝胶,按50 μg/孔的浓度上样,电泳分离蛋白各组分后,电转至PVDF膜上,5%BSA-TBST溶液封闭1 h。4 ℃孵育NPHP1(1∶1000)、C/EBPβ(1∶1000)、p38(1∶1000)、phospho-p38(1∶1000)一抗过夜(至少8 h)。TBST洗膜10 min,重复3次。加入1∶10 000稀释的对应二抗室温孵育1 h。再次TBST洗膜10 min,重复3次。ECL超敏发光显影并拍照。以β-tubulin为内参,使用ImageJ软件分析各条带的平均灰度值。各蛋白的表达水平=各蛋白灰度值/对应内参灰度值。
1.2.7. 酶联免疫吸附实验(ELISA)
ELISA试剂盒由武汉华美生物工程有限公司提供。细胞培养液上清的提取在无菌条件下进行,实验全程严格按照试剂盒说明书步骤进行。根据浓度梯度标准品A值拟合曲线,样品孔A值减去本底值即为样品A值,代入曲线方程计算浓度。
1.3. 统计学方法
采用GraphPad Prism9.0统计学软件分析。计量资料均以均数±标准差表示。两组资料比较采用t检验,多组资料比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2. 结果
2.1. 成功构建NPHP1低表达HK2细胞模型
结果显示,LV- NPHP1-RNAi(106032-1)转染的NPHP1KDHK2细胞NPHP1的mRNA表达降低74%(图 1A),其编码蛋白nephrocystin-1相对灰度值较NPHP1WTHK2细胞低,下降约30%(图 1B~C,P<0.05)。细胞免疫荧光图像显示,NPHP1的荧光显色主要在细胞质至细胞膜的部分。与NPHP1WTHK2细胞相比,NPHP1KDHK2细胞中TRITC荧光(红色)表达丰度明显下降(图 1D~E,P<0.05)。
图 1.
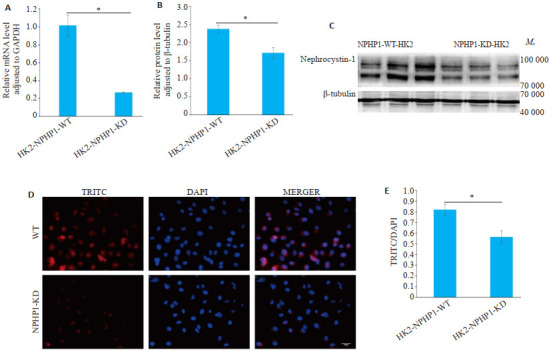
转染LV-NPHP1-RNAi后HK2细胞NPHP1的表达
Expression of NPHP1 in HK2 cells after LV-NPHP1-RNAi transfection. A: Relative NPHP1 mRNA level. B: Relative protein levels of nephrocystin-1 (n=3). C: Western blotting for detecting nephrocystin-1 expression in NPHP1WTHK2 and NPHP1KDHK2. D: Immunofluorescence staining images of NPHP1WTHK2 and NPHP1KDHK2 (scale bar=50 μm). E: Quantification of NPHP1 staining. *P < 0.05.
2.2. 敲低HK2细胞NPHP1表达,TNF-α及其调控的炎症因子CXCL5、CSF2、IL-1β、IL-6表达增加
qRT-PCR结果显示,NPHP1KDHK2细胞中TNF-α、转录因子C/EBPβ及其下游的CXCL5、IL-1β和IL-6的mRNA表达上调(图 2A~F,P<0.05)。提示NPHP1缺陷HK2细胞,TNF-α信号通路被激活。但TNF-α相关的炎症因子CCL2、CCL20的mRNA表达下调(图 2G、H)。
图 2.
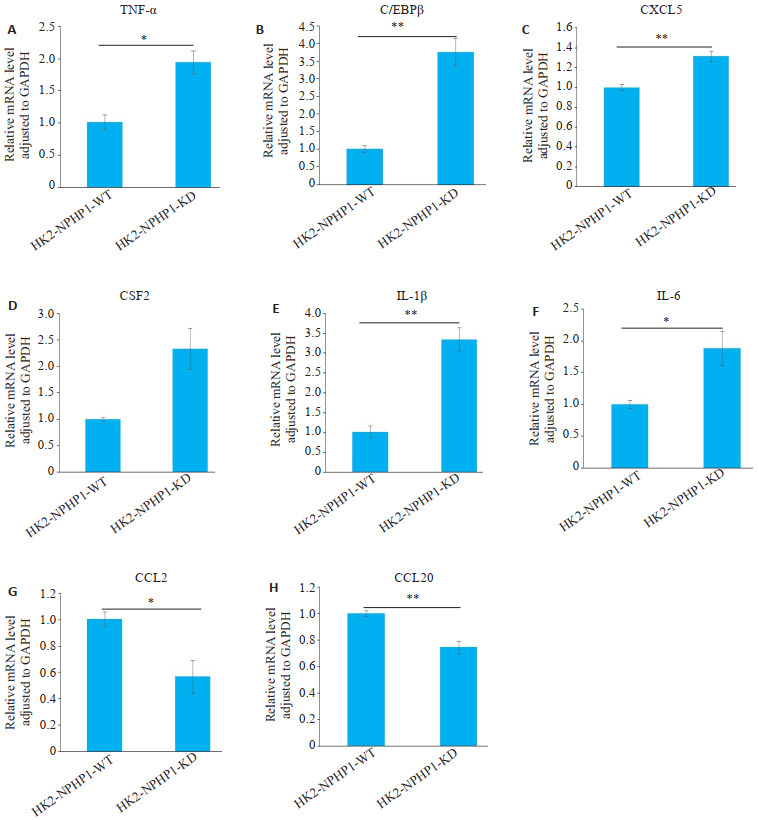
敲低NPHP1表达对TNF-α信号通路的影响
Effect of NPHP1 knockdown on TNF-α signaling pathway in HK2 cells. A-H: Relative mRNA levels normalized to GAPDH. Compared with NPHP1WT HK2 cells, the expression of TNF-α, C/EBPβ, CXCL5, IL-1β and IL-6 was up-regulated, and the expression of CCL2 and CCL20 was down-regulated in NPHP1KD HK2 cells (n=3). *P < 0.05; **P < 0.01.
2.3. C/EBPβ介导NPHP1KDHK2细胞TNF信号通路下游炎症因子表达
敲低HK2细胞NPHP1表达后,C/EBPβ的mRNA表达上调,差异有统计学意义(P<0.01);但AP-1和CREB5的mRNA表达与对照组比,差异无统计学意义(P> 0.05,图 3)。转染siRNA-C/EBPβ后,NPHP1WTHK2和NPHP1KDHK2细胞,C/EBPβ的mRNA表达下降,蛋白表达水平明显降低,C/EBPβ的蛋白亚基LAP*和LIP的表达趋势降低较为明显(P<0.05,图 4)。
图 3.
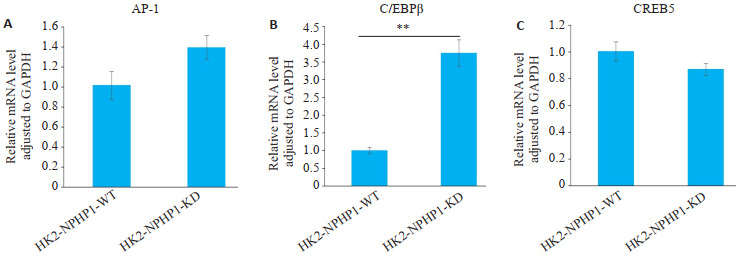
敲低NPHP1表达对TNF-α通路相关3种转录因子表达水平的影响
Relative mRNA expressions of the transcription factors AP-1 (A), C/EBPβ (B) and CREB5 (C) of TNF-α signaling pathway in NPHP1KD HK2 cells (n=3). **P < 0.01.
图 4.
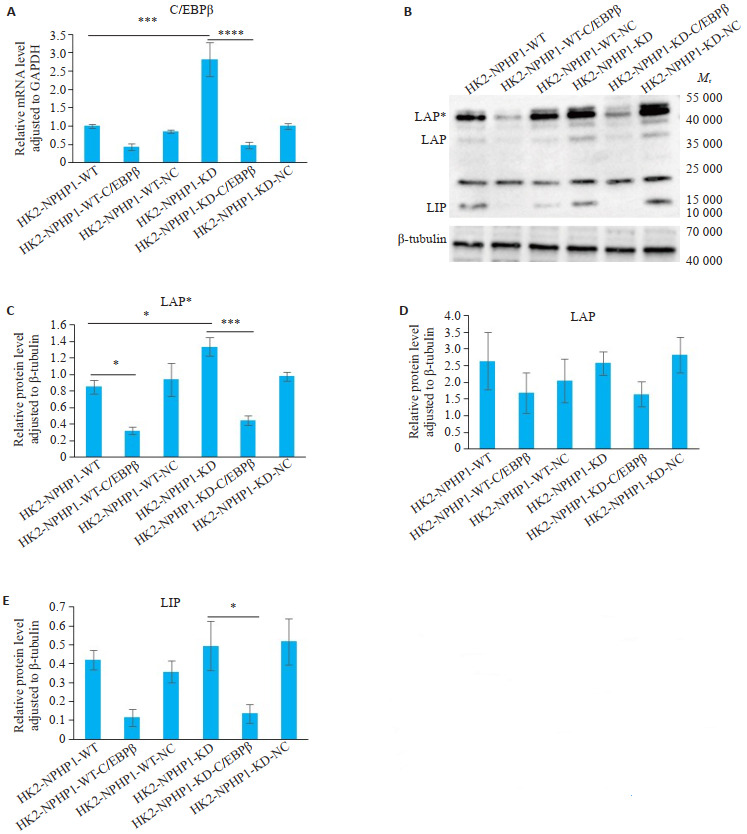
转染siRNA-C/EBPβ对各组细胞C/EBPβ表达的影响
C/EBPβ expression in each cell line after transfection with siRNA-C/EBPβ. A: Relative C/EBPβ mRNA level in cells transfected with siRNA-C/EBPβ was reduced, especially in the NPHP1KDHK2 cell line (n=6). B: Western blotting of C/EBPβ protein in NPHP1WT and NPHP1KD HK2 cells. The expression of C/EBPβ subunits in the transfected siRNA-C/EBPβ cells is significantly reduced. C-E: Relative LAP*/LAP/LIP protein levels adjusted to β-tubulin. The protein expressions of LAP* and LIP subunits are reduced in cells transfected with siRNA-C/EBPβ, especially in the NPHP1KD HK2 cell line. *P < 0.05; ***P < 0.001; ****P < 0.0001.
进一步验证敲低C/EBPβ表达,对NPHP1KDHK2细胞TNF信号通路调控炎症因子表达的影响。结果显示,敲低C/EBPβ表达,NPHP1KDHK2细胞CSF2、CCL20、CXCL5、IL-1β、IL-6的mRNA表达水平下降,而CCL2表达上调(P<0.05,图 5)。
图 5.
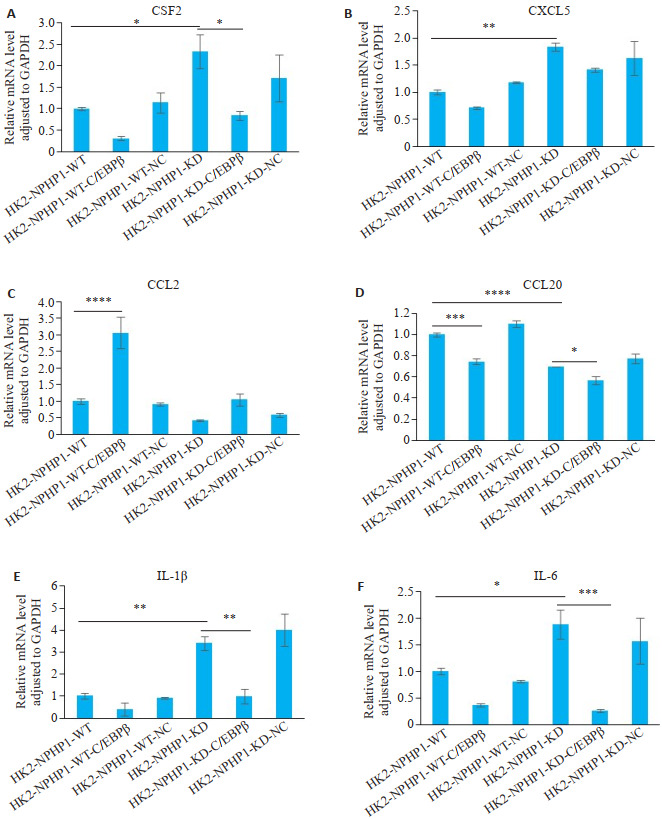
敲低HK2细胞C/EBPβ对TNF-α信号通路调控炎症因子mRNA表达水平的影响
Effect of C/EBPβ knockdown on the expression of inflammatory factors related to TNF-α signaling pathway in HK2 cell lines. A-F: Relative each target mRNA level adjusted to GAPDH. CSF2, CCL20, IL-1β, and IL-6 are decreased and CCL2 is increased with the downregulation of C/EBPβ, and the change of CXCL5 is not statistically significant. *P < 0.05; **P < 0.01; ***P < 0.001; ****P < 0.0001.
酶联免疫吸附实验结果显示,敲低转录因子C/EBPβ表达后,IL-6的分泌显著减少(P<0.001);IL-1β的分泌也减少,但因表达量较低,差异无统计学意义(P>0.05);另外MCP-1的分泌增加(P<0.001)。
2.4. 敲低C/EBPβ对TNF-α信号通路细胞内信号转导因子的影响
分析敲低NPHP1以及同时敲低C/EBPβ对p38表达及其活性的影响,结果显示,p38在各组细胞的mRNA和蛋白表达水平差异无统计学意义(图 7A~C)。但磷酸化P38的水平,在NPHP1KDHK2细胞明显升高,同时敲低C/EBPβ表达后显著下降(P<0.05,图 7B、D)。
图 7.
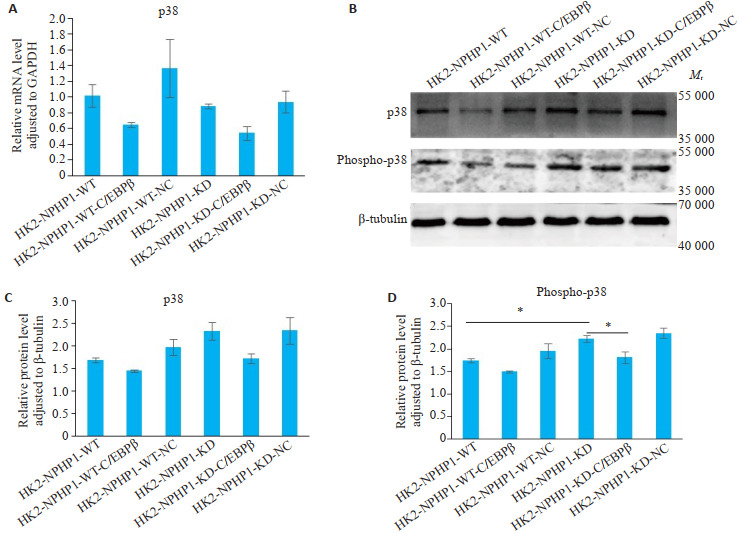
敲低各组HK2细胞C/EBPβ表达对P38活性的影响
Effect of C/EBPβ knockdown on the activation of p38 in each HK2 cell line. A-C: Both p38 mRNA and protein levels are downregulated after C/EBPβ knockdown in NPHP1WTHK2 cell line, but the changes are not significant between each cell groups. D: Phospho-p38 protein level is increased significantly in NPHP1KDHK2 cells compared with NPHP1WTHK2 cell, and is decreased significantly after C/EBPβ knockdown in NPHP1KDHK2 cells (Western blotting). *P < 0.05.
图 6.
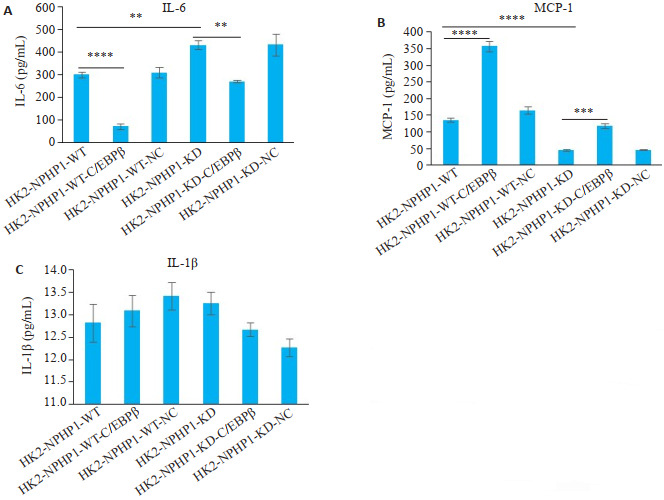
敲低HK2细胞C/EBPβ对TNF-α信号通路相关炎症因子蛋白表达的影响
Effect of C/EBPβ knockdown on the expression of inflammatory factors related to TNF-α signaling pathway in HK2 cell lines. A: Secretion of IL-6 in each cell line is increased significantly after C/EBPβ knockdown. B: Secretion of MCP-1 in each cell line is decreased after C/EBPβ knockdown. C: IL-1β secretion in each cell line show no significant changes after C/EBPβ knockdown. **P < 0.01; ***P < 0.001; ****P < 0.0001.
3. 讨论
目前已发现950余种纤毛相关基因,这些基因的突变可能会导致人类疾病发生,已有超过35种人类基因遗传性病被称为“纤毛病”,与180余种已确定的纤毛病相关蛋白有关,这些纤毛病通常以肾脏纤毛病为特征起病,严重影响肾脏发育和生理功能[12, 13]。纤毛是一种进化保守的细胞器,几乎所有稳定细胞都存在纤毛[14],这其中包括肾小管细胞。肾脏纤毛病由于纤毛的调节细胞极性功能失调,常常表现为囊肿性肾病。肾单位肾痨是一种属于初级纤毛基因缺陷所导致的遗传病。囊肿形成、间质纤维化和炎症是NPH的特征性病理改变,关于NPH囊肿和纤维化的研究已有相关成果[2, 15, 16]。但是肾脏炎症机制的探究尚不足。本研究根据NPHP1敲低的犬远曲小管上皮细胞,以及NPHP1和NPHP5缺陷患者尿液上皮细胞转录组测序结果,通过差异基因富集分析筛选,将研究聚焦在TNF-α信号通路。
TNF-α信号通路是调控细胞凋亡、炎症和免疫的主要机制,参与多种病理生理过程和多种疾病的发生发展[17]。肿瘤坏死因子受体1(TNFR1)是大多数细胞TNF起作用的媒介,而肿瘤坏死因子受体2(TNFR2)主要在免疫细胞、内皮细胞等中起作用[18]。TNF-R1识别TNF-α分子后转移至细胞膜的脂质筏上,诱导受体胞内段发生构象变化,使配体-受体复合物能够招募适应分子TNFR1相关的死亡结构蛋白(TRADD),TRADD进一步募集受体相互作用的丝氨酸/苏氨酸蛋白激酶1(RIPK1)[19-21]。至此TNFR1复合物Ⅰ的组装就完成了,该复合物是指导下游信号通路激活的关键分子。TNFR1复合物Ⅰ招募转化生长因子β激活激酶1(TAK1),进而介导p38激活[22]。而p38 MAPKs能够激活多种转录因子,包括CCAAT增强子结合蛋白β(C/EBPβ)、ATF1/2/6、血清反应因子附属蛋白1等[23]。C/EBPβ是维持上皮细胞稳定性所必需的[24],它的激活对体内细胞因子分泌至关重要[11, 25]。由此我们推测p38-C/EBPβ轴对NPH肾脏炎症损伤有重要调控作用[26, 27]。
本研究结果显示,在敲低NPHP1表达后,HK2细胞的TNF-α表达上调,phospho-p38磷酸化水平和C/EBPβ表达升高,其调控下游的炎症因子CXCL5、CSF2、IL-1β、IL-6的表达升高。结果提示TNF-α可能介导NPHP1基因缺失的炎症反应发生。TNF-α信号通路主要通过转录因子AP-1、C/EBPβ和CREB5介导下游炎症因子表达[28-30]。为进一步清理TNF-α信号通路在NPHP1KDHK2细胞中的传导链,阐明TNF-α信号通路的作用机制,我们筛选了AP-1、C/EBPβ和CREB5。结合文献及实验结果,认为p38-C/EBPβ轴可能是TNF-α在NPHP1KDHK2中信号传导的重要介质。为进一步证明该推论,本研究通过siRNA敲低转录因子C/EBPβ表达,实验结果显示,C/EBPβ低表达后,CCL20、CSF2、IL-1β、IL-6的表达也随之下调,证明在NPHP1基因缺陷的HK2细胞,C/EBPβ介导其调控的下游炎症因子表达。同时,我们还观察到,敲低C/EBPβ表达后,phospho-p38的表达水平受到抑制,提示TNF-α信号通路的p38-C/EBPβ轴存在一定的负反馈调控。后续研究将进一步阐明TNF-α细胞内的调控机制。既往有研究表明,在构建的NPH模型(LkbΔtub)小鼠中,CCL2的表达上调[31],但在本研究中的NPH的细胞模型,CCL2的表达会随着NPHP1基因的低表达而下调。这可能是体内实验与体外实验的差别,我们将于NPHP1KO的小鼠模型中再次验证。
综上所述,本研究表明,NPHP1基因缺陷导致TNF-α信号通路激活,C/EBPβ介导其下游炎症因子表达。NPHP1基因缺陷导致TNF-α信号通路激活介导炎症因子的高表达,可能参与NPH疾病的发生发展,但有待更多的研究证实。
Biography
黄丹梅,在读硕士研究生,E-mail: hdm_03@126.com
Funding Statement
广东省自然科学基金(2022A1515012307;2020A1515010286);北京白求恩公益基金会(SCE093DS);南方医科大学南方医院院长基金青年项目(2020C021)
Contributor Information
黄 丹梅 (Danmei HUANG), Email: hdm_03@126.com.
孙 良忠 (Liangzhong SUN), Email: sunlzh2018@smu.edu.cn.
References
- 1.Stokman MF, Saunier S, Benmerah A. Renal ciliopathies: sorting out therapeutic approaches for nephronophthisis. Front Cell Dev Biol. 2021;9:653138–45. doi: 10.3389/fcell.2021.653138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Wu XH, Wang HY, Chen HM, et al. Overexpression of smad7 inhibits the TGF-β/Smad signaling pathway and EMT in NPHP1-defective MDCK cells. Biochem Biophys Res Commun. 2021;582:57–63. doi: 10.1016/j.bbrc.2021.10.037. [DOI] [PubMed] [Google Scholar]
- 3.孙 良忠, 林 宏容, 岳 智慧, et al. 少年型肾单位肾痨13例临床特点和基因突变分析. 中华儿科杂志. 2016;54(11):834–9. doi: 10.3760/cma.j.issn.0578-1310.2016.11.009. [DOI] [Google Scholar]
- 4.Snoek R, van Setten J, Keating BJ, et al. NPHP1 (nephrocystin-1) gene deletions cause adult-onset ESRD. J Am Soc Nephrol. 2018;29(6):1772–9. doi: 10.1681/ASN.2017111200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Hu QL, Lai JY, Chen HM, et al. Reducing GEF-H1 expression inhibits renal cyst formation, inflammation, and fibrosis via RhoA signaling in nephronophthisis. Int J Mol Sci. 2023;24(4):3504–10. doi: 10.3390/ijms24043504. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Halbritter J, Bizet AA, Schmidts M, et al. Defects in the IFT-B component IFT172 cause Jeune and Mainzer-Saldino syndromes in humans. Am J Hum Genet. 2013;93(5):915–25. doi: 10.1016/j.ajhg.2013.09.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Srivastava S, Sayer JA. Nephronophthisis. J Pediatr Genet. 2014;3(2):103–14. doi: 10.3233/PGE-14086. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Srivastava S, Molinari E, Raman S, et al. Many genes- one disease genetics of nephronophthisis (NPHP) and NPHP-associated disorders. Front Pediatr. 2018;5:287–93. doi: 10.3389/fped.2017.00287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Anvarian Z, Mykytyn K, Mukhopadhyay S, et al. Cellular signalling by primary cilia in development, organ function and disease. Nat Rev Nephrol. 2019;15(4):199–219. doi: 10.1038/s41581-019-0116-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Luo FL, Tao YH. Nephronophthisis: a review of genotype-phenotype correlation. Nephrology. 2018;23(10):904–11. doi: 10.1111/nep.13393. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Bégay V, Baumeier C, Zimmermann K, et al. The C/EBPβ LIP isoform rescues loss of C/EBPβ function in the mouse. Sci Rep. 2018;8:841–7. doi: 10.1038/s41598-018-19364-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.McConnachie DJ, Stow JL, Mallett AJ. Ciliopathies and the kidney: a review. Am J Kidney Dis. 2021;77(3):410–9. doi: 10.1053/j.ajkd.2020.08.012. [DOI] [PubMed] [Google Scholar]
- 13.Reiter JF, Leroux MR. Genes and molecular pathways underpinning ciliopathies. Nat Rev Mol Cell Biol. 2017;18(9):533–47. doi: 10.1038/nrm.2017.60. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Fliegauf M, Benzing T, Omran H. When cilia go bad: cilia defects and ciliopathies. Nat Rev Mol Cell Biol. 2007;8(11):880–93. doi: 10.1038/nrm2278. [DOI] [PubMed] [Google Scholar]
- 15.Attanasio M, Uhlenhaut NH, Sousa VH, et al. Loss of GLIS2 causes nephronophthisis in humans and mice by increased apoptosis and fibrosis. Nat Genet. 2007;39(8):1018–24. doi: 10.1038/ng2072. [DOI] [PubMed] [Google Scholar]
- 16.Wang QY, Zou BJ, Wei XY, et al. Identification of renal cyst cells of type I Nephronophthisis by single-nucleus RNA sequencing. Front Cell Dev Biol. 2023;11:1192935–42. doi: 10.3389/fcell.2023.1192935. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Paul BM, Vanden Heuvel GB. Kidney: polycystic kidney disease. Wiley Interdiscip Rev Dev Biol. 2014;3(6):465–87. doi: 10.1002/wdev.152. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Gonzalez Caldito N. Role of tumor necrosis factor-alpha in the central nervous system: a focus on autoimmune disorders. Front Immunol. 2023;14:1213448–56. doi: 10.3389/fimmu.2023.1213448. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Jang DI, Lee AH, Shin HY, et al. The role of tumor necrosis factor alpha (TNF-α) in autoimmune disease and current TNF-α inhibitors in therapeutics. Int J Mol Sci. 2021;22(5):2719–26. doi: 10.3390/ijms22052719. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Moatti A, Cohen JL. The TNF-α/TNFR2 pathway: targeting a brake to release the anti-tumor immune response. Front Cell Dev Biol. 2021;9:725473–82. doi: 10.3389/fcell.2021.725473. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Brenner D, Blaser H, Mak TW. Regulation of tumour necrosis factor signalling: live or let die. Nat Rev Immunol. 2015;15(6):362–74. doi: 10.1038/nri3834. [DOI] [PubMed] [Google Scholar]
- 22.Bai BB, Ji ZL, Wang FF, et al. CTRP12 ameliorates post-myocardial infarction heart failure through down-regulation of cardiac apoptosis, oxidative stress and inflammation by influencing the TAK1-p38 MAPK/JNK pathway. Inflamm Res. 2023;72(7):1375–90. doi: 10.1007/s00011-023-01758-4. [DOI] [PubMed] [Google Scholar]
- 23.Cuadrado A, Nebreda A. Mechanisms and functions of p38 MAPK signalling. Biochem J. 2010;429(3):403–17. doi: 10.1042/BJ20100323. [DOI] [PubMed] [Google Scholar]
- 24.Ding H, Chen JJ, Qin JP, et al. TGF-β-induced α-SMA expression is mediated by C/EBPβ acetylation in human alveolar epithelial cells. Mol Med. 2021;27(1):1–12. doi: 10.1186/s10020-021-00283-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Hu B, Ullenbruch MR, Jin H, et al. An essential role for CCAAT/enhancer binding protein β in bleomycin-induced pulmonary fibrosis. J Pathol. 2007;211(4):455–62. doi: 10.1002/path.2119. [DOI] [PubMed] [Google Scholar]
- 26.Canovas B, Nebreda AR. Diversity and versatility of p38 kinase signalling in health and disease. Nat Rev Mol Cell Biol. 2021;22(5):346–66. doi: 10.1038/s41580-020-00322-w. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Liu X, Huang ZS, Zhang YY, et al. Lacidipine ameliorates the endothelial senescence and inflammatory injury through CXCR7/P38/C/EBP-β signaling pathway. Front Cardiovasc Med. 2021;8:692540–9. doi: 10.3389/fcvm.2021.692540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Chen TL, Zhang XD, Zhu GL, et al. Quercetin inhibits TNF-α induced HUVECs apoptosis and inflammation via downregulating NF-kB and AP-1 signaling pathway in vitro. Medicine. 2020;99(38):e22241–8. doi: 10.1097/MD.0000000000022241. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Qi YC, Duan GZ, Mao W, et al. Taurochenodeoxycholic acid mediates cAMP-PKA-CREB signaling pathway. Chin J Nat Med. 2020;18(12):898–906. doi: 10.1016/S1875-5364(20)60033-4. [DOI] [PubMed] [Google Scholar]
- 30.Xia PY, Zhang R, Ge GX. C/EBPβ mediates TNF-α-induced cancer cell migration by inducing MMP expression dependent on p38 MAPK. J Cell Biochem. 2015;116(12):2766–77. doi: 10.1002/jcb.25219. [DOI] [PubMed] [Google Scholar]
- 31.Quatredeniers M, Bienaimé F, Ferri G, et al. The renal inflammatory network of nephronophthisis. Hum Mol Genet. 2022;31(13):2121–36. doi: 10.1093/hmg/ddac014. [DOI] [PubMed] [Google Scholar]


