Abstract
Crimean-Congo hemorrhagic fever (CCHF), caused by Crimean-Congo hemorrhagic fever virus (CCHFV), is endemic in Africa, Asia, and Europe, but CCHF epidemiology and epizootiology is only rudimentarily defined for most regions. Here we summarize what is known about CCHF in Central, Eastern, and South-eastern Asia. Searching multiple international and country-specific databases using a One Health approach, we defined disease risk and burden through identification of CCHF cases, anti-CCHFV antibody prevalence, and CCHFV isolation from vector ticks. We identified 2313 CCHF cases that occurred in 1944–2021 in the three examined regions. Central Asian countries reported the majority of cases (2,026). In Eastern Asia, China was the only country that reported CCHF cases (287). In South-eastern Asia, no cases were reported. Next, we leveraged our previously established classification scheme to assign countries to five CCHF evidence levels. Six countries (China, Kazakhstan, Kyrgyzstan, Tajikistan, Turkmenistan, and Uzbekistan) were assigned to level 1 or level 2 based on CCHF case reports and the maturity of the countries’ surveillance systems. Two countries (Mongolia and Myanmar) were assigned to level 3 due to evidence of CCHFV circulation in the absence of reported CCHF cases. Thirteen countries in Eastern and South-eastern Asia were categorized in levels 4 and 5 based on prevalence of CCHFV vector ticks. Collectively, this paper describes the past and present status of CCHF reporting to inform international and local public-health agencies to strengthen or establish CCHFV surveillance systems and address shortcomings.
Keywords: Asia, Crimean-Congo hemorrhagic fever, Crimean-Congo hemorrhagic fever virus, Hyalomma, Tick
Highlights
-
•
CCHF is endemic in Africa, Asia, and Europe, but the disease's epidemiology and epizootiology is only rudimentarily defined.
-
•
We identified 2313 cases of CCHF that occurred from 1944 to 2021 in Central, Eastern, and South-eastern Asia.
-
•
We identified six countries with clear evidence of occasional or frequent outbreaks; two countries with likely circulation of CCHFV; and thirteen countries in which CCHFVs vector tick is present.
1. Introduction
Crimean-Congo hemorrhagic fever (CCHF; ICD-11: 1D49 (World Health Organization International Classification of Diseases 11th Revision, 2022) is a tick-borne viral disease occurring across Africa, Asia, and Europe (Hoogstraal, 1979; Ergonul and Whitehouse, 2007; Pigott et al., 2017; Blair et al., 2019; Belobo et al., 2021; Temur et al., 2021). Crimean-Congo hemorrhagic fever virus (CCHFV), the etiologic agent of CCHF (Simpson et al., 1967; Woodall et al., 1967; Woodall, 2007), is a negarnaviricot bunyaviral classified as an orthonairovirus in family Nairoviridae (Garrison et al., 2020; Kuhn et al., 2021). Although likely encountered for many centuries (جرجانی ,1391; Миндерер, 1825; Салаев, 1825; Ходукин, 1952; 付滨等, 2007; Mozafari et al., 2016), CCHF was first systematically described after a 1944–45 outbreak among Soviet military personnel on the Soviet Crimean peninsula (Соколов и др., 1945). During the past decade, the number of CCHF cases (as well as the associated case fatality rate) appears to have increased (Nasirian, 2020). During the last two decades, emergence or reemergence has occurred in several countries, including Greece (2008), Georgia (2009), Spain (2016), and Turkey (2002) (Blair et al., 2019; Belobo et al., 2021; Fanelli and Buonavoglia, 2021). Southern (Afghanistan, Iran, and Pakistan) and Western Asian countries (Iraq and Turkey) consistently report the highest numbers among global cases (Blair et al., 2019; Belobo et al., 2021).
CCHFV is primarily transmitted to vertebrates, including humans, by ixodid ticks predominantly classified in genus Hyalomma. Among them, Hyalomma marginatum, H. turanicum, and H. rufipes ticks are the most prevalent CCHFV vectors (Hoogstraal, 1979; Nasirian, 2020; Okely et al., 2020). Conditions in which ticks multiply lead to more tick bites and, consequently, the emergence or sustained circulation of CCHFV. Human tick bites are the primary mode of CCHFV transmission (Chapman et al., 1991; Vonesch et al., 2019). Domestic animals, including sheep and cattle, can also be infected with CCHFV by ticks; these animals have transient viremia without signs of disease. Thus, unprotected human exposure to viremic animals, especially among, for instance, abattoir workers, may lead to CCHFV transmission (Williams et al., 2000; Keshtkar-Jahromi et al., 2013; Mostafavi et al., 2017; Kasi et al., 2020). Furthermore, human-to-human transmission has been observed in medical staff exposed to CCHFV through aerosols or body fluids (Whitehouse, 2004; Mardani et al., 2007, 2009; Celikbas et al., 2014). Therefore, CCHF outbreaks are dependent on tick distribution as well as human and animal exposure to CCHFV.
The majority of CCHFV infections is asymptomatic or cause mild clinical signs. Clinical symptoms/signs may be nonspecific for mild cases, including headaches, myalgia, joint pain, fever, nausea, and vomiting. Rare severe cases may present with sudden-onset bruising and bleeding at injection sites. The disease can be fatal within days of onset (Schwarz et al., 1997; Ergonul, 2007; Al-Abri et al., 2019; Tripathi et al., 2020). The case-fatality rate of CCHF (5–80%) is affected by several factors, such as age, pre-existing medical conditions, availability of supportive care, virus strain, and route of transmission (Leblebicioglu, 2010; Tezer et al., 2010; Akuffo et al., 2016).
The World Health Organization (WHO) includes CCHF as a Blueprint priority disease, i.e., as a disease to be prioritized in research and development in public health emergency contexts (World Health Organization, 2020). This article is the third of our publication series on global CCHFV distribution to inform assessments of CCHF epidemiology, disease burden, and need for further investigation (Blair et al., 2019; Temur et al., 2021). Central, Eastern, and South-eastern Asia were selected for this article due to a lack of organized published CCHF-relevant data for these geographical regions.
2. Methods
2.1. Database searching and criteria
We used the United Nations geoscheme for (current) country inclusion in literature searches: Central Asia—Kazakhstan, Kyrgyzstan, Tajikistan, Turkmenistan, and Uzbekistan; Eastern Asia—China, Democratic People's Republic of Korea, Japan, Mongolia, and Republic of Korea; and South-eastern Asia—Brunei Darussalam, Cambodia, Indonesia, Lao People's Democratic Republic, Malaysia, Myanmar, Philippines, Singapore, Thailand, East Timor, and Viet Nam (United Nations Statistics Division, 2020). We first searched Embase, GIDEON, Google Scholar, ProMED, PubMed, Scopus, and Web of Science to collect and review scientific literature for any evidence of CCHFV endemicity in Central, Eastern, and South-eastern Asia (1944–July 2022), followed by searches using country- and/or language-specific databases of national societies and/or libraries and publishers. In addition, if indexed, information was obtained from conference presentations. Also considered were unpublished data obtained through personal communications with public-health authorities and experts (Table 1). Search terms, used in Boolean combinations, included “CCHFV”, “CCHF”, “CHF”, “Crimean”, “Crimean-Congo”, “Congo-Crimean”, “Congo virus”, “Crimean hemorrhagic fever”, “Nairoviridae”, “nairovirus”, and “orthonairovirus” or their non-English cognates with the names of each of the countries (or their predecessor names). We specifically retrieved studies on CCHF cases, CCHFV-specific serological analyses of human and animal samples, data on CCHFV isolation from ticks, and information on established CCHFV surveillance systems. For documentation of CCHFV vector prevalence, we considered Hyalomma ticks, with specific attention to H. marginatum, H. turanicum, and H. rufipes ticks in light of their ability to transmit CCHFV transstadially, transovarianally, and to vertebrates (Okely et al., 2020). Manuscripts were reviewed and included independent of publication language; referenced manuscripts are cited in the original language to the best of our abilities to aid the interested reader with retrieval.
Table 1.
Summary of unpublished data on CCHFV circulation and CCHF cases obtained by personal communications.
| Country | Unpublished Data |
|---|---|
| Indonesia | Nothing reported. |
| Japan | Nothing reported. |
| Kyrgyzstan | I. Fifteen confirmed CCHF cases were reported (2018–2021). |
| II. An ELISA test revealed CCHFV Antigen in 2 out of 218 collected ticks (2021). | |
| III. CCHFV was detected in ticks by PCR (1980s). | |
| IV. Due to insufficient laboratory capabilities in this country, regular CCHF identification is impossible. | |
| Singapore | Nothing reported. |
| Tajikistan | I. The Tajik Research Institute of Preventive Medicine (TRIPM) has been the lead institute for CCHF surveillance since 1944. |
| II. From 1998 to 2009, 18 districts in southern Tajikistan recorded CCHF cases; this number increased to 32 districts by 2020. | |
| III. Newly reported districts are located near previously affected districts. | |
| IV. A total of 81 CCHF patients died (1944 and 2020). | |
| Thailand | Nothing reported. |
| Turkmenistan | I. Per communications with the Turkmen Ministry of Health officials, CCHFV is listed as a monitored pathogen, but official situations reports are unavailable. |
| Uzbekistan | I. The Republican Specialized Center for Scientific and Practical Medicine of Epidemiology, Microbiology, Infectious and Parasitic Diseases (Республика ихтисослаштирилган эпидемиология, микробиология, юқумли ва паразитар касалликлар илмий-амалий тиббиëт маркази) maintains a CCHFV surveillance system through the country. |
2.2. Classification standard for dividing investigated countries to five levels
Our team developed and applied a One Health country-level CCHFV evidence classification scheme in two previous articles (Blair et al., 2019; Temur et al., 2021). This classification system combines vector, animal, human, and virus data to identify CCHFV circulation within regions. Countries are classified as follows: level 1—CCHF cases have been reported annually regularly via an established surveillance system; level 2—CCHF cases have been reported intermittently in the absence of a surveillance system; level 3—no CCHF cases have been reported and no surveillance has been implemented, but available data point toward the possibility of unreported cases of CCHF (animal/human serology or CCHFV detected in Hyalomma ticks); level 4—no CCHF cases have been reported, no surveillance has been implemented, no epidemiologic/epizootiologic studies have been done, but Hyalomma ticks are present; and level 5—no data are available.
For this study, we classified countries of Central, Eastern, and South-eastern Asia into the classification system based on the evidence acquired. (Note that we were unable to establish a category for countries that reported negative results due to the relatively small number of such reports and publications.)
3. Results
3.1. CCHF cases and CCHFV detection
3.1.1. Central Asia
The first CCHF cases that were unambiguously described clinically occurred in the 1930s and 1940s in Central Asia (Иоффе, 1944; Сиповский, 1944; Миxайлов, 1946; Ходукин, 1952; Шапиро and Баркаган, 1960). The disease was often referred to under the umbrella term “Central Asian hemorrhagic fever” (“Среднеазиатская геморрагическая лихорадка”), various local terms, such as “Uzbekistan hemorrhagic fever” (“Узбекистанская геморрагическая лихорадка”), or less-specific terms, including “acute infectious capillarotoxicosis” (“острый инфекционный капилляротоксикоз”) (Gajdusek, 1962).
3.1.1.1. Kazakhstan
In the Kazakh Soviet Socialist Republic (Kazakh SSR, today's Kazakhstan), the first reported cases of CCHF were recorded in 1948 during an outbreak in the areas of Maktaaral and Keles, South Kazakhstan Region (later Chimkent Region; today's Turkistan Region) (Рыбалко и др., 1963; Добрица, 1965; Nurmakhanov et al., 2015). Kazakhstan has both ongoing historical CCHF experience (Реформатская и др., 1965; Nurmakhanov et al., 2015; Укибаева т.б., 2021) and an established surveillance system. In 1965, upon establishment of central records, a retrospective analysis was conducted to identify probable human CCHF cases that met a newly established definition (Nurmakhanov et al., 2015; Укибаева т.б., 2021). A total of 801 CCHF human cases (101 deaths) were identified as having occurred from 1948 through the end of 2021 (Table 2). Kazakhstan's knowledge of CCHFV is exemplified by numerous publications on human serology, animal serology, and virus isolation from ticks spanning 70 years (Table 3). Surveillance of CCHFV is guided by The Committee for Sanitary and Epidemiological Surveillance of the Ministry of Health (Қазақстан Республикасының Денсаулық сақтау министрлігінің Санитариялық-эпидемиологиялық бақылау комитеті). Local hospitals use algorithms to identify, manage, and report CCHF cases; patients are isolated to prevent nosocomial spread. Diagnosis is confirmed via laboratory tests on pre-acute and acute clinical specimens, in addition to recording symptoms of patients, medical and epidemiological history, and physical examination results. Laboratory data include nonspecific and specific tests. Nonspecific tests include complete blood count, urinalysis, coagulation markers, blood chemistry, and fecal occult blood test. Specific tests include complement fixation-based tests and, more recently, enzyme-linked immunosorbent assay (ELISA) and molecular diagnostics (including real-time reverse transcription polymerase chain reaction [RT-qPCR] and conventional RT-PCR) (Объединенная комиссия по качеству медицинских услуг министерства здравоохранения PK). CCHF cases occur seasonally in Kazakhstan, peaking April–June (Nurmakhanov et al., 2015). Almaty, Guryev/Atyrau, South Kazakhstan/Chimkent/Turkistan, Kzyl-Orda/Kyzylorda, and Zhambyl/Jambyl Regions are CCHFV-endemic areas associated with multiple outbreaks (Смирнова и др., 1972; Hoogstraal, 1979; Дерновой и др., 1996; Дурумбетов и др., 2001; Yegemberdiyeva and Tuleuov, 2006; Егембердиева and Шерметова, 2008; Абуова и др., 2012; RK-NCPH, 2020; International Society for Infectious Diseases, 2021). Increased tick populations and/or increased human exposure to ticks have been identified as the major risk factor associated with CCHFV infections (Knust et al., 2012; Head et al., 2020). Mitigation efforts have included tick-bite prevention education for at-risk workers (sheep-shearers in endemic areas) and encouraging people to seek medical help for appropriate tick removal (Head et al., 2018). Statistics show that 1135 people sought medical advice in Kyzylorda Region after being bitten by ticks in 2012, compared to 188 in 2007 (Nurmakhanov et al., 2015), suggesting that public-education campaigns are increasingly effective.
Table 2.
Total confirmed CCHF cases in Central Asia (1944–2021).
| Country | Total confirmed cases | Total deaths | Year (s) | References |
|---|---|---|---|---|
| Kazakhstan | 801 | 101 | 1948–2021 | (Добрица, 1965; Чун-Сюн and Генис, 1965; Yegemberdiyeva and Tuleuov, 2006; Егембердиева и Шерметова, 2008; International Society for Infectious Diseases, 2014a, b, 2015; Nurmakhanov et al., 2015; Head et al., 2018; Abdiyeva et al., 2019; KTK, 2019; Турлиев и Усатаева, 2019; International Society for Infectious Diseases, 2020; RK-NCPH, 2020; International Society for Infectious Diseases, 2021) |
| Kyrgyzstan | 19 | NA | 1948, 1951, 1953, 2018–21 | (Прорешная, 1955; Hoogstraal, 1979)a |
| Tajikistan | 527 | 81a | 1944–2020 | (Tishkova et al., 2012; Atkinson et al., 2013; Ince et al., 2014)a |
| Turkmenistan | 14 | 10 | 1944, 1946 | (Миxайлов, 1946; Hoogstraal, 1979) |
| Uzbekistan | 665 | 66 | 1944–83, 1998–2007, 2001–4, 2013–15, 2017–18 | (Ходукин, 1952; Мусабаев, 1961; Мусабаев и др., 1962; Мелиев, 1967; Kadyrov et al., 2007; Комілов та ін., 2009b; Комилов, 2010; Бутенко и Трусова, 2013; Ermakova et al., 2020) |
| Total | 2026 | 258 | 1944–2021 |
Note: Total deaths are those among confirmed cases only. Therefore, fatality rate was not calculated. We were limited to available data, but this approach likely underestimates the true CCHF burden.
Data collected by personal communication.
Table 3.
Evidence for CCHFV circulation in Central Asia (1944–2021).
Note: Years are listed if there is evidence of anti-CCHFV antibodies in humans or animals, CCHFV vector endemicity, or CCHFV antigen or genome detection. NA, no data available.
Data collected by personal communication.
Year unclear per the cited publication.
3.1.1.2. Kyrgyzstan
There was scant information on CCHFV infection in the Kyrgyz SSR (today's Kyrgyzstan). The first probable human CCHF cases were recorded during the period 1948–53 (Прорешная, 1955), but the first virus isolation was confirmed during 1970–71 (Циркин и др., 1971; Карась и др., 1973). Four CCHF cases were recorded 1948–53 (Прорешная, 1955) and another 15 during 2018–21 (unpublished data collected by personal communication). The Laboratory of Virology of the Republican Center for Quarantine and Especially Dangerous Infections of the Ministry of Health and Social Development of Kyrgyz Republic (Кыргыз Республикасынын Саламаттык сактоо жана социалдык өнүктүрүү министрлигинин Карантиндик жана өтө коркунучтуу инфекциялар республикалык борборунун вирусологиялык лабораториясы) diagnoses CCHF and detects CCHFV in humans and ticks. Ticks collected from the northwest and southwest parts of southern Kyrgyzstan were found infected with the virus. For instance, in 2021, two of 218 collected ticks tested positive by ELISA (unpublished data collected by personal communication). Although several studies, including those resulting in virus isolations from ticks and animal serology data (Table 3), support ongoing CCHFV circulation in Kyrgyzstan, there is no established CCHFV surveillance. However, specimens from suspected cases may be sent to local laboratories for diagnostic evaluation. Lack of regulatory guidelines for CCHFV surveillance and the absence of routine tick testing for CCHFV are the main barriers to developing a surveillance system in the country. Furthermore, CCHF is not a reportable disease in Kyrgyzstan. The lack of regular CCHF identification is secondary to insufficient laboratory capabilities in this country (unpublished data collected by personal communication).
3.1.1.3. Tajikistan
In the Tajik SSR (today's Tajikistan), the first possible CCHF cases were described in 1944 (Иоффе, 1944; Сиповский, 1944; Черновский и др., 1968), whereas the first CCHFV isolation from ticks occurred in 1967 and the first CCHF-positive human serology data were obtained in 1968 (Смирнова и др., 1971a; Пак, 1975). Over the period 1944–2020, 527 CCHF human cases (81 deaths) were identified (Table 2). The Tajik Research Institute of Preventive Medicine (TRIPM) has been the sole authority responsible for CCHFV surveillance since 1944 (unpublished data collected by personal communication). Recent international collaborations have provided TRIPM with cutting-edge diagnostic capabilities. Hospitals in high-risk areas receive up-to-date information, raising awareness and prompting infection control. All hospitals and medical establishments are required to report any cases suspected to be CCHF to the TRIPM virology laboratory (unpublished data collected by personal communication). The annual number of cases fluctuates, with a range of 5–38. For the last 30 years, the majority of CCHF cases have occurred in the south. During 1998–2009, 18 districts recorded CCHF cases; this gradually increased to 32 districts in southern Tajikistan in 2020 (unpublished data collected by personal communication). The newly reporting districts are close in proximity to previously affected districts; reports are likely true first observations due to the recent rapid expansion of Hyalomma anatolicum ticks (unpublished data collected by personal communication). Hyalomma anatolicum ticks prefer drier and warmer conditions compared to H. marginatum ticks, the most common Hyalomma tick found in Europe (Atkinson et al., 2013). Indeed, >82% of ticks collected in endemic areas are H. anatolicum ticks. Most CCHF cases in Tajikistan have been traced back directly to tick bites and hence are thought to be due to H. anatolicum tick bites (Tishkova et al., 2012). No CCHF cases have been reported from the north of Tajikistan despite positive serology in animals; this lack of reporting is most likely due to lack of awareness of the disease among the population, low number of livestock population, and/or low human exposure to ticks (Atkinson et al., 2013).
3.1.1.4. Turkmenistan
In the Turkmen SSR (today's Turkmenistan), the first possible CCHF cases were described in 1946 (Миxайлов, 1946), whereas first serologic evidence of human CCHFV infections was obtained in 1966–68 (Миxайлов, 1946; Чунихин и др., 1969). At least 14 CCHF cases (10 deaths) were recorded in 1946 (Table 2). No additional CCHF cases have been reported since then. Thus, the current epidemiology of CCHFV is unknown. Per personal communication with the Turkmen Ministry of Health officials, a CCHFV surveillance system exists in the country, though we were unable to verify diagnostic capabilities and accuracy of this system.
3.1.1.5. Uzbekistan
In the Uzbek SSR (UzSSR, today's Uzbekistan), the first CCHF case was identified clinically in 1938, whereas the first CCHFV isolation from ticks occurred in 1949 (Ходукин, 1952; Gajdusek, 1956). During the period 1944–2018, 665 CCHF cases (66 deaths) were reported (Table 2). The Kyzylkum Desert has been the predominant CCHFV hotspot, with H. anatolicum ticks being the main reservoir (Hoogstraal, 1979). CCHFV has been spreading to new regions over the last two decades. By 1998, cases had been recorded in the Bukhara, Kashkadarya (Qashqadaryo), and Navoiy Regions; from 1998 onward, cases also occurred in Tashkent Region, followed by Jizzakh and Syrdarya Regions in 2001 and the Karakalpakstan Republic in 2003. Since 2012, 15–30 cases have been reported annually from this more-recently involved area. This rather impressive geographic spread of CCHFV could be due to tick expansion, increased human exposure, and/or improved diagnostic capability (Uzbek CDC, 2019). The Republican Specialized Center for Scientific and Practical Medicine of Epidemiology, Microbiology, Infectious and Parasitic Diseases (Республика ихтисослаштирилган эпидемиология, микробиология, юқумли ва паразитар касалликлар илмий-амалий тиббиëт маркази) maintains a CCHFV surveillance system, which has not yet been described in detail (personal communication).
3.1.2. Eastern and South-eastern Asia
3.1.2.1. China
In China, CCHF, under various names, has likely been known since the Hàn Dynasty (202 B.C.E. – 220 C.E.) (付滨等, 2007). “Xīnjiāng hemorrhagic fever (新疆出血热)” was the disease term first ascribed to cases of severe illness that occurred during 1959–66 in Maralbexi (Bāchǔ) County, Xīnjiāng Uygur Autonomous Region (新疆维吾尔自治区卫生防疫站, 1975; 柴君杰等, 2004a; 柴君杰等, 2004b; 冯崇惠等, 2004; 刘远恒等, 2004), which were later followed by sporadic cases mostly in the same and surrounding counties in and around the Tarim Basin of Xīnjiāng Uygur Autonomous Region (柴君杰等, 1985; 冯崇慧等, 1995; 唐青等, 1999; 柴君杰, 2004; Chai Junjie et al, 2004d, Chai Junjie et al, 2004c; 冯崇慧, 2004; 冯崇慧等, 2004; 刘远恒等, 2004; 阿不力提甫·阿不力孜等, 2005; Zhang et al., 2018). Characterization of the etiologic agent (冯崇慧, 1983; Yan Yuchen et al 1983a, Li Feng et al 1983; 严玉辰等, 1983a; 严玉辰等, 1983b) led to the identification of “Xīnjiāng hemorrhagic fever virus” as CCHFV in 1985 (Yen et al., 1985).
During the period 1964–2003, 287 CCHF cases (59 deaths) were identified in Xīnjiāng Uygur Autonomous Region (Table 4). CCHFV transmission in these areas occurred predominately through contact with livestock (Zhang et al., 2018); most CCHFV isolates come from desert areas especially in the south of Xīnjiāng Uygur Autonomous Region (Table 5). Therefore, the southern areas were the focus of past epidemiological surveys and increased surveillance. The main vectors of CCHFV in the southern region are H. asiaticum ticks (冯崇慧和白旭华, 1991; 戴翔等, 2006; Sun et al., 2009; Guo et al., 2017). Despite the presence of CCHFV RNA-positive H. asiaticum ticks in the Junggar Basin in the north of the region, no cases of CCHFV have been reported from there (Sun et al., 2009). No CCHF cases have been reported from China since 2003. However, several human and other animal serology studies and CCHFV isolation from ticks indicate that CCHFV circulation is ongoing and that CCHFV may be endemic in China beyond Xīnjiāng Uygur Autonomous Region (陈化新等, 1991; 侯宗柳等, 1992; 屠云人等, 1992; 蔡增林等, 1994a; 1994b; 1994c; 祁继深等, 1995; 任次早等, 1995; 邵锡如等, 1995; 黄好壮等, 1996; 李兆育等, 1998; 张婷等, 2007).
Table 4.
Total confirmed CCHF cases in Eastern and South-eastern Asia by country (1944–2021).
| Country | Total confirmed cases | Total deaths | Year (s) | References |
|---|---|---|---|---|
| Brunei Darussalam | NA | NA | NA | NA |
| Cambodia | NA | NA | NA | NA |
| Chinab | 287 | 59 | 1964–2003 | (刘远恒等, 2004; 新疆维吾尔自治区卫生防疫站, 1975; 冯崇慧和白旭华, 1991; 唐青等, 1999; Papa et al., 2002; 柴君杰, 2004; 柴君杰等, 2004a; 柴君杰等, 2004c; 唐青等, 2005; Sun et al., 2009; Zhou et al., 2013; Zhang et al., 2018; Teng et al., 2022)c |
| Democratic People's Republic of Korea | NA | NA | NA | NA |
| Indonesia | 0a | 0a | NA | NA |
| Japan | 0a | 0a | NA | NA |
| Lao People's Democratic Republic | NA | NA | NA | NA |
| Malaysia | NA | NA | NA | NA |
| Mongolia | NA | NA | NA | NA |
| Myanmar | NA | NA | NA | NA |
| Philippines | NA | NA | NA | NA |
| Republic of Korea | NA | NA | NA | (Im et al., 2019) |
| Singapore | 0a | 0a | NA | NA |
| Thailand | 0a | 0a | NA | NA |
| East Timor | NA | NA | NA | NA |
| Viet Nam | NA | NA | NA | NA |
Note: Total deaths are those among confirmed cases only. Therefore, fatality rate was not calculated. We were limited to available data, but this approach likely underestimates the true CCHF burden.
Communication with local health authorities confirmed that there has not been any CCHF case reported in the country.
No information was found in China Hong Kong Special Administrative Region and China Macao Special Administrative Region, and therefore they are not listed in the table. NA, no data available.
Teng et al. summarizes “331 cases” and “283 occurrence records of CCHFV” but no numbers of deaths.
Table 5.
Evidence for CCHFV circulation in South-eastern and Eastern Asia (1944–2021).
| Country | CCHF cases reported (year) | Human serology (year) | Animal serology (year) | Hyalomma ticks | CCHFV detected in ticks (year) | Level of evidence |
|---|---|---|---|---|---|---|
| Brunei Darussalam | NA | NA | NA | NA | NA | 5 |
| Cambodia | NA | NA | NA | NA | NA | 5 |
| China | 1959–73 (刘远恒等, 2004), 1965 (新疆维吾尔自治区卫生防疫站, 1975), 1966 (柴君杰, 2004, 柴君杰等, 2004a; Sun et al., 2009), 1968 (柴君杰, 2004, 柴君杰等, 2004c), 1978–80 (Sun et al., 2009), 1984 (唐青等, 1999, Papa et al., 2002), 1990 (柴君杰, 2004), 1997 (Papa et al., 2002), 2001–2 (唐青等, 2005), 2002 (Papa et al., 2002), 2004–5 (Sun et al., 2009; Zhou et al., 2013), 2016 (冯崇慧和白旭华, 1991; 柴君杰, 2004; Zhang et al., 2018) | 1988–90 (侯宗柳等, 1992), 1992 (蔡增林等, 1994b, a, 蔡增琳等, 1994), 1992–93 (任次早等, 1995), 1997b (李兆育等, 1998), 2001–2 (Saijo et al., 2005), 2002–3 (张婷等, 2007), 2004–5 (戴翔等, 2006, Sun et al., 2009), 2008 (Xia et al., 2011) | 1988 (陈化新等, 1991), 1988–90 (侯宗柳等, 1992), 1991–92 (屠云人等, 1992), 1992 (邵锡如等, 1995), 1993 (祁继深等, 1995), 1996 (黄好壮等, 1996), 2004–5 (Sun et al., 2009), 2001 (韩磊等, 2002; Qing et al., 2003), 2020 (Li et al., 2020) | Yes (邓国藩和姜在阶, 1991; Sun et al., 2009; Chen et al., 2010; Sheng et al., 2019; Zhao et al., 2020; Yang et al., 2021) | 1966 (Liang et al., 2018), 1968 (Yen et al., 1985), 1984 (Papa et al., 2002), 2001–2 (唐青等, 2005), 2004 (吕新军等, 2005), 2004–5 (Sun et al., 2009), 2004–5 (戴翔等, 2006), 2008 (Xia et al., 2011), 2012–14 (韩辉等, 2016; 杨宇 等, 2018), 2015 (Kong et al., 2022), 2016 (Zhang et al., 2018), 2014–17 (Moming et al., 2018), 2017 (Guo et al., 2017) | 2 |
| Democratic People's Republic of Korea | NA | NA | NA | NA | NA | 5 |
| Indonesia | 0a | NA | NA | NA | NA | 5 |
| Japan | 0a | NA | NA | NA | NA | 5 |
| Lao People's Democratic Republic | NA | NA | NA | NA | NA | 5 |
| Malaysia | NA | NA | NA | NA | NA | 5 |
| Mongolia | NA | 2010 (Wölfel et al., 2010), 2013–14 (Voorhees et al., 2018) | 1987 (Чунихин и др., 1987) | Yes (Narankhajid et al., 2018; Voorhees et al., 2018; Černý et al., 2019; Von Fricken et al., 2020) | 2013–14 (Voorhees et al., 2018) | 3 |
| Myanmar | NA | 2016–18 (Evans et al., 2021) | NA | Yes (Robbins et al., 2002; Evans et al., 2021) | NA | 3 |
| Philippines | NA | NA | NA | NA | NA | 5 |
| Republic of Korea | NA (Im et al., 2019) | NA (Im et al., 2019) | NA (Im et al., 2019) | NA (Im et al., 2019) | NA (Im et al., 2019) | 5 |
| Singapore | 0a | NA | NA | NA | NA | 5 |
| Thailand | 0a | NA | NA | NA | NA | 5 |
| East Timor | NA | NA | NA | NA | NA | 5 |
| Viet Nam | NA | NA | NA | Yes (Колонин, 2003) | NA | 4 |
Note: Years are listed if there is evidence of anti-CCHFV antibodies in humans or animals, CCHFV vector endemicity, or CCHFV antigen or genome detection.
Communication with local health authorities confirmed that there has not been any CCHF case reported in the country. NA, no data available.
Year unclear per the cited publication.
3.1.2.2. Other countries
No CCHF cases have been reported from South-eastern Asia. Positive results in human/animal serology studies in Mongolia and Myanmar in the presence of Hyalomma ticks (Table 5) suggest local CCHFV circulation, indicating that the lack of reported cases could be due to lack of diagnostic and surveillance capabilities. Larger-scale investigations to screen symptomatic (acute febrile) cases in Mongolia and Myanmar are recommended to define CCHFV burden in the region. In Malaysia, a human serology study among healthy individuals conducted in 2012–13 yielded only one positive result in an indigenous person living in the forest fringe areas of peninsular Malaysia (Lani et al., 2015). However, Hyalomma ticks are not known to exist in Malaysia, and hence the status of CCHFV in Malaysia remains dubious.
To the best of our knowledge, there are no published studies reporting any evidence of CCHFV circulation in Brunei Darussalam, Cambodia, Democratic People's Republic of Korea, Indonesia, Japan, Lao People's Democratic Republic, Philippines, Republic of Korea (Im et al., 2019), Singapore, Thailand, East Timor, and Viet Nam. Among these countries, Hyalomma ticks have been reliably identified only in Viet Nam (Колонин, 2003).
3.2. CCHFV tick vector distribution
Hyalomma ticks of various species are broadly distributed in Central Asia but virtually absent in countries of South-eastern Asia. Western China, southern Kazakhstan, Kyrgyzstan, Tajikistan, and Turkmenistan have the highest diversity and abundance of Hyalomma ticks, including presence of one of the major vectors of CCHFV, H. turanicum (Померанцев, 1950; 邓国藩和姜在阶, 1991; Apanaskevich and Horak, 2008). Ticks of very few Hyalomma species, mostly of H. asiaticum and H. scupense, are found farther east (Mongolia, central China, and eastern China) (邓国藩和姜在阶, 1991; Филиппова и др., 1995). Most countries of South-eastern Asia apparently are not suitable for a majority of Hyalomma ticks and lay outside of the normal distribution of ticks of the genus. There are a few records of H. isaaci ticks from western Myanmar (one) and northern Viet Nam (two) (Robbins et al., 2002; Колонин, 2003; Apanaskevich and Horak, 2008). These are the only records despite the fact that many areas of South-eastern Asia are well-studied, confirming that Hyalomma ticks are almost absent from the region. We excluded recent records (Leliana and Rizalsyah, 2015; Temmam et al., 2019) of Hyalomma ticks from Indonesia and Thailand, because they were not verified and most likely based on misidentifications. For example, one research team (Temmam et al., 2019) also collected “Dermacentor marginatus” ticks in Thailand; however, these ticks are western Palearctic and do not reside in South-eastern Asia. Because clearly documented evidence of the presence of Hyalomma ticks in South-eastern Asian countries (except Myanmar and Viet Nam) has not yet been published, we considered them absent from there.
4. Discussion
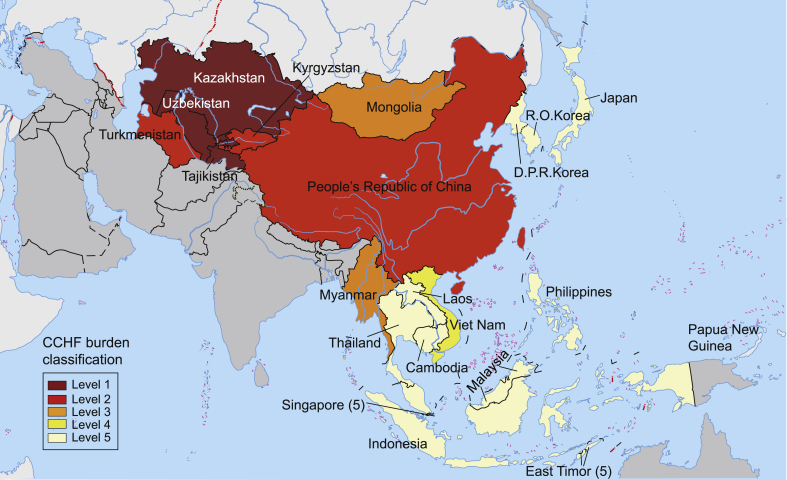
Reported CCHF cases (2313; 1944–December 2021), positive human and other animal serology, and presence of CCHFV tick vector populations were considered supportive evidence of CCHFV endemicity. Based on that evidence (Table 2, Table 3, Table 4, Table 5, Fig. 1).
-
1.
Kazakhstan, Tajikistan, and Uzbekistan are level 1 countries with diagnostic capabilities, which can provide immediate assistance during CCHF outbreaks. Field work to address the focal endemic ecology of CCHFV in the north may help to determine differences in tick or other reservoir host species and densities between the northern and southern regions—contributing to consistent and appropriate disease-control strategies. We suggest that these countries collaborate to strengthen their surveillance systems by setting up a regional diagnostic network and defining representative epidemiology of CCHF in Central Asia. This collaborative effort must also include active surveillance for CCHFV, including testing for CCHFV in Hyalomma ticks, human and animal serological testing, strengthening the healthcare infrastructure, providing information to communities on CCHFV transmission, and implementing protective measures in high-risk areas;
-
2.
China, Kyrgyzstan, and Turkmenistan are level 2 countries that have reported cases intermittently, with supportive evidence confirming CCHFV circulation. Therefore, setting up a surveillance system would be beneficial to these countries;
-
3.
Mongolia and Myanmar, with no confirmed cases but significant evidence of CCHFV circulation, are level 3 countries that would benefit from establishing a surveillance system to potentially identify human infections and conduct systematic studies, including human/animal serology and virus isolation from ticks, to better define CCHFV epidemiology and manage possible outbreaks;
-
4.
Viet Nam is a level 4 country because Hyalomma ticks are present in the absence of proof of CCHFV circulation. This country would benefit from studies that include tick sampling and testing, as well as human and animal serological testing, to look for CCHFV footprints; and
-
5.
All other examined countries are level 5 countries because Hyalomma ticks are practically absent.
Fig. 1.
One Health approach to understanding the burden of CCHF in Central, Eastern, and South-eastern Asia. CCHFV circulation is confirmed in countries of lower levels (1 and 2), but it is recommended that further investigation and surveillance need to be conducted in countries of higher levels (3, 4, and 5). This classification is based on potential policy implications for individual countries. A highlighted country's boundaries are unlikely to reflect the exact ecological distribution of CCHFV within the country. However, even a single focus of CCHFV activity within a country will require the entire country to respond to it. (There is no guarantee that depicted country boundaries accurately reflect the geographical area at risk, nor are they necessarily endorsed by the authors).
There are some limitations to our study. First, we searched public databases for indexed articles. Thus, we might have missed data that were not publicly available, such as those having circulated solely in official reports; but we also may have missed studies that were not indexed in the searched databases or studies that were not retrieved using our chosen keywords. Second, we assigned equal weight to all studies within each category (virus isolation, human serological testing, and animal serological investigations). However, the approaches and accuracy of the studies differ considerably among and within countries. Third, the creation of artificial geographic boundaries has no effect on viral ecology or transmission; however, ecological niches and ecotopes may differ substantially across adjacent regions. Consequently, CCHFV might be defined as endemic in two countries, with one having a homogenous virus distribution and the other only having a single hotspot. As a precaution, we assumed that countries adjacent to CCHFV-endemic countries might also be CCHFV-endemic, however, this may not to be the case. Fine-tuned ecological niche modeling (Pigott et al., 2017) may provide additional resolution, but it is out of the scope of this paper. Finally, we did not account for change in climate over time or altered biotopes due to human activity, both of which can affect migrations of CCHFV vectors and hosts, therefore changing prevalence.
5. Conclusions
Taken together, the data and recommendations presented here echo the call for further investigation on tick, human, and animal CCHFV surveillance by collaborating local governments and international public-health organizations (WHO and the World Organization for Animal Health) in Central, Eastern, and South-eastern Asia.
Conflict of interest
The authors declare no relevant financial or non-financial conflict of interests.
Acknowledgements
We thank Anya Crane and Elena N. Postnikova (NIH/NIAID/DCR/Integrated Research Facility at Fort Detrick, Frederick, MD, USA) for critically editing the manuscript. We thank Linda Gorman (Harrison Medical Library, Johns Hopkins Bayview Medical Center, Baltimore, MD, USA) for database search and providing publication updates during the study. We deeply thank the entire NIH and National Library of Medicine staffs for their tireless efforts to obtain rare foreign manuscripts for our work.
This work was supported in part through Laulima Government Solutions, LLC, prime contract with the U.S. National Institute of Allergy and Infectious Diseases (NIAID) under Contract No. HHSN272201800013C. J.H.K. performed this work as an employee of Tunnell Government Services (TGS), a subcontractor of Laulima Government Solutions, LLC, under Contract No. HHSN272201800013C.
The views and conclusions contained in this document are those of the authors and should not be interpreted as necessarily representing the official policies, either expressed or implied, of the U.S. Department of Health and Human Services, the U.S. Department of Defense, and U.S. Department of the Army, or of the institutions and companies affiliated with the authors, nor does mention of trade names, commercial products, or organizations imply endorsement by the U.S. Government.
Contributor Information
Jens H. Kuhn, Email: kuhnjens@mail.nih.gov.
Maryam Keshtkar-Jahromi, Email: maryam.keshtkar@jhmi.edu.
References
- Abdiyeva K., Turebekov N., Dmitrovsky A., Tukhanova N., Shin A., Yeraliyeva L., Heinrich N., Hoelscher M., Yegemberdiyeva R., Shapiyeva Z., Kachiyeva Z., Zhalmagambetova A., Montag J., Dobler G., Zinner J., Wagner E., Frey S., Essbauer S. Seroepidemiological and molecular investigations of infections with Crimean-Congo haemorrhagic fever virus in Kazakhstan. Int. J. Infect. Dis. 2019;78:121–127. doi: 10.1016/j.ijid.2018.10.015. [DOI] [PubMed] [Google Scholar]
- Ahmed J., Alp H., Aksin M., Seitzer U. Current status of ticks in Asia. Parasitol. Res. 2007;101(Suppl. 2):S159–S162. doi: 10.1007/s00436-007-0696-3. [DOI] [PubMed] [Google Scholar]
- Akuffo R., Brandful J.a.M., Zayed A., Adjei A., Watany N., Fahmy N.T., Hughes R., Doman B., Voegborlo S.V., Aziati D., Pratt D., Awuni J.A., Adams N., Dueger E. Crimean-Congo hemorrhagic fever virus in livestock ticks and animal handler seroprevalence at an abattoir in Ghana. BMC Infect. Dis. 2016;16:324. doi: 10.1186/s12879-016-1660-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Al-Abri S.S., Hewson R., Al-Kindi H., Al-Abaidani I., Al-Jardani A., Al-Maani A., Almahrouqi S., Atkinson B., Al-Wahaibi A., Al-Rawahi B., Bawikar S., Beeching N.J. Clinical and molecular epidemiology of Crimean-Congo hemorrhagic fever in Oman. PLoS Neglected Trop. Dis. 2019;13 doi: 10.1371/journal.pntd.0007100. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Apanaskevich D.A., Horak I.G. The genus Hyalomma Koch, 1844: v. re-evaluation of the taxonomic rank of taxa comprising the H. (Euhyalomma) marginatum Koch complex of species (Acari : Ixodidae) with redescription of all parasitic stages and notes on biology. Int. J. Acarol. 2008;34:13–42. [Google Scholar]
- Atkinson B., Chamberlain J., Jameson L.J., Logue C.H., Lewis J., Belobrova E.A., Valikhodzhaeva M., Mullojonova M., Tishkova F.H., Hewson R. Identification and analysis of Crimean-Congo hemorrhagic fever virus from human sera in Tajikistan. Int. J. Infect. Dis. 2013;17:e1031–e1037. doi: 10.1016/j.ijid.2013.04.008. [DOI] [PubMed] [Google Scholar]
- Belobo J.T.E., Kenmoe S., Kengne-Nde C., Emoh C.P.D., Bowo-Ngandji A., Tchatchouang S., Sowe Wobessi J.N., Mbongue Mikangue C.A., Tazokong H.R., Kingue Bebey S.R., Atembeh Noura E., Ka'e A.C., Guiamdjo Simo R.E., Modiyinji A.F., Ngongang D.T., Che E., Kenfack S., Nzukui N.D., Amvongo Adjia N., Babassagana I.T., Mahamat G., Mbaga D.S., Mbacham W.F., Sadeuh-Mbah S.A., Njouom R. Worldwide epidemiology of Crimean-Congo hemorrhagic fever virus in humans, ticks and other animal species, a systematic review and meta-analysis. PLoS Neglected Trop. Dis. 2021;15 doi: 10.1371/journal.pntd.0009299. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Blair P.W., Kuhn J.H., Pecor D.B., Apanaskevich D.A., Kortepeter M.G., Cardile A.P., Polanco Ramos A., Keshtkar-Jahromi M. An emerging biothreat: Crimean-Congo hemorrhagic fever virus in Southern and Western Asia. Am. J. Trop. Med. Hyg. 2019;100:16–23. doi: 10.4269/ajtmh.18-0553. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Bryant-Genevier J., Bumburidi Y., Kazazian L., Seffren V., Head J.R., Berezovskiy D., Zhakipbayeva B., Salyer S.J., Knust B., Klena J.D., Chiang C.-F., Mirzabekova G., Rakhimov K., Koekeev J., Kartabayev K., Mamadaliyev S., Guerra M., Blanton C., Shoemaker T., Singer D., Moffett D.B. Prevalence of Crimean-Congo hemorrhagic fever virus among livestock and ticks in Zhambyl Region, Kazakhstan, 2017. Am. J. Trop. Med. Hyg. 2022;106:1478–1485. doi: 10.4269/ajtmh.21-1092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Celikbas A.K., Dokuzoğuz B., Baykam N., Gok S.E., Eroğlu M.N., Midilli K., Zeller H., Ergonul O. Crimean-Congo hemorrhagic fever among health care workers, Turkey. Emerg. Infect. Dis. 2014;20:477–479. doi: 10.3201/eid2003.131353. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Černý J., Buyannemekh B., Needham T., Gankhuyag G., Oyuntsetseg D. Hard ticks and tick-borne pathogens in Mongolia—a review. Ticks Tick Borne Dis. 2019;10 doi: 10.1016/j.ttbdis.2019.101268. [DOI] [PubMed] [Google Scholar]
- Chapman L.E., Wilson M.L., Hall D.B., Leguenno B., Dykstra E.A., Ba K., Fisher-Hoch S.P. Risk factors for Crimean-Congo hemorrhagic fever in rural northern Senegal. J. Infect. Dis. 1991;164:686–692. doi: 10.1093/infdis/164.4.686. [DOI] [PubMed] [Google Scholar]
- Chen Z., Yang X., Bu F., Yang X., Yang X., Liu J. Ticks (Acari: Ixodoidea: Argasidae, Ixodidae) of China. Exp. Appl. Acarol. 2010;51:393–404. doi: 10.1007/s10493-010-9335-2. [DOI] [PubMed] [Google Scholar]
- Chumakov M.P., Smirnova S.E., Shalunova N.Y., Martianova L.I., Fleer G.P., Zgurskaya G.N., Maksumov S.S., Kasymov K.T., Pak T.P. Proofs of etiological identity of Crimean hemorrhagic fever and Central Asian hemorrhagic fever. Ενατον διεθνες συνεδριον τροπικης ιατρικης και ελονοσιας/Ninth international congress on tropical medicine and malaria. 1973;1:33–34. October 14-21, 1973 (abstract 42) [Google Scholar]
- Deka M.A. The geographic distribution of Crimean-Congo hemorrhagic fever in Tajikistan and Central Asia. Pap. Appl. Geogr. 2016;3:68–84. [Google Scholar]
- Ergonul O. In: Crimean-Congo Hemorrhagic Fever: A Global Perspective. Ergonul O., Whitehouse C.A., editors. Springer; Dordrecht, Netherlands: 2007. Clinical and pathologic features of Crimean-Congo hemorrhagic fever. [Google Scholar]
- Ergonul O., Whitehouse C.A., editors. Crimean-Congo Hemorrhagic Fever: A Global Perspective. Springer; Dordrecht, Netherlands: 2007. [Google Scholar]
- Ermakova L., Pshenichnaya N., Melnik V.A., Aslanov B. Overview of Crimean-Congo hemorrhagic fever 15-year morbidity within 2005-2019 based on ProMED-RUS reports. Int. J. Infect. Dis. 2020;101:202. [Google Scholar]
- Evans T.S., Myat T.W., Hom N.S., Ricks K.M., Maw M.T., Oo Z.M., Toe A.T., Aung N.T., Aung P., Aung T.H., Kuehnert P., Thant K.Z., Win Y.T., Thein W.Z., Gardner N.R., Schoepp R.J., Johnson C.K., Thu H.M. Seroepidemiologic survey of Crimean-Congo hemorrhagic fever virus in logging communities, Myanmar. Emerg. Infect. Dis. 2021;27:1709–1713. doi: 10.3201/eid2706.203223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Fanelli A., Buonavoglia D. Risk of Crimean Congo haemorrhagic fever virus (CCHFV) introduction and spread in CCHF-free countries in southern and Western Europe: a semi-quantitative risk assessment. One Health. 2021;13 doi: 10.1016/j.onehlt.2021.100290. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Gajdusek D.C. Hemorrhagic fevers in Asia: a problem in medical ecology. Geogr. Rev. 1956;46:20–42. [Google Scholar]
- Gajdusek D.C. Virus hemorrhagic fevers. Special reference to hemorrhagic fever with renal syndrome (epidemic hemorrhagic fever) J. Pediatr. 1962;60:841–857. doi: 10.1016/s0022-3476(62)80170-x. [DOI] [PubMed] [Google Scholar]
- Garrison A.R., Alkhovsky S.V., Avšič-Županc T., Bente D.A., Bergeron, Burt F., Di Paola N., Ergünay K., Hewson R., Kuhn J.H., Mirazimi A., Papa A., Sall A.A., Spengler J.R., Palacios G., ICTV Report Consortium ICTV virus taxonomy profile: Nairoviridae. J. Gen. Virol. 2020;101:798–799. doi: 10.1099/jgv.0.001485. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Guo R., Shen S., Zhang Y., Shi J., Su Z., Liu D., Liu J., Yang J., Wang Q., Hu Z., Zhang Y., Deng F. A new strain of Crimean-Congo hemorrhagic fever virus isolated from Xinjiang, China. Virol. Sin. 2017;32:80–88. doi: 10.1007/s12250-016-3936-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Head J.R., Bumburidi Y., Salyer S.J., Knust B., Kuralbekovna M.G., Moffett D.B. Prevalence of CCHF virus in ticks and people and public awareness in Zhambyl Region, Kazakhstan. Online J. Publ. Hlth. Informatics. 2018;10:e158. [Google Scholar]
- Head J.R., Bumburidi Y., Mirzabekova G., Rakhimov K., Dzhumankulov M., Salyer S.J., Knust B., Berezovskiy D., Kulatayeva M., Zhetibaev S., Shoemaker T., Nicholson W.L., Moffett D. Risk factors for and seroprevalence of tickborne zoonotic diseases among livestock owners, Kazakhstan. Emerg. Infect. Dis. 2020;26:70–80. doi: 10.3201/eid2601.190220. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Hoogstraal H. The epidemiology of tick-borne Crimean-Congo hemorrhagic fever in Asia, Europe, and Africa. J. Med. Entomol. 1979;15:307–417. doi: 10.1093/jmedent/15.4.307. [DOI] [PubMed] [Google Scholar]
- Im J.H., Baek J., Durey A., Kwon H.Y., Chung M.-H., Lee J.-S. Current status of tick-borne diseases in South Korea. Vector Borne Zoonotic Dis. 2019;19:225–233. doi: 10.1089/vbz.2018.2298. [DOI] [PubMed] [Google Scholar]
- Ince Y., Yasa C., Metin M., Sonmez M., Meram E., Benkli B., Ergonul O. Crimean-Congo hemorrhagic fever infections reported by ProMED. Int. J. Infect. Dis. 2014;26:44–46. doi: 10.1016/j.ijid.2014.04.005. [DOI] [PubMed] [Google Scholar]
- International Society for Infectious Diseases Crimean-Congo hemorrhagic fever - Kazakhstan (02) 2014. https://promedmail.org/promed-post/?id=2669321 ProMED Archive Number: 20140807.2669321.
- International Society for Infectious Diseases Crimean-Congo hemorrhagic fever - Kazakhstan, Pakistan. 2014. https://promedmail.org/promed-post/?id=2605464 ProMed Archive Number: 20140712.2605464.
- International Society for Infectious Diseases Crimean-Congo hemorrhagic fever - Kazakhstan (Zhambyl) 2015. https://promedmail.org/promed-post/?id=3446668 ProMed Archive Number: 20150618.3446668.
- International Society for Infectious Diseases Crimean-Congo hemorrhagic fever - Asia (04): Kazakhstan (SH) 2020. https://promedmail.org/promed-post/?id=7659170 ProMed Archive Number: 20200810.7659170.
- International Society for Infectious Diseases Конго-крымская геморрагическая лихорадка (2 случая) - Казахстан (Кызылординская область) 2021. https://promedmail.org/promed-post/?id=8341150 ProMed Archive Number: 20210502.8341150.
- Kadyrov A., Shermukhamedova D., Komilov N., Umurzakov S., Bryanseva E., Nazarbekova M. Reappearance of CCHF and other tick-borne arboviruses in the Syrdarya region of the Republic of Uzbekistan. Int. J. Antimicrob. Agents. 2007;29(Suppl. 2):S280. [Google Scholar]
- Kasi K.K., Sas M.A., Sauter-Louis C., Von Arnim F., Gethmann J.M., Schulz A., Wernike K., Groschup M.H., Conraths F.J. Epidemiological investigations of Crimean-Congo haemorrhagic fever virus infection in sheep and goats in Balochistan, Pakistan. Ticks Tick Borne Dis. 2020;11 doi: 10.1016/j.ttbdis.2019.101324. [DOI] [PubMed] [Google Scholar]
- Keshtkar-Jahromi M., Sajadi M.M., Ansari H., Mardani M., Holakouie-Naieni K. Crimean-Congo hemorrhagic fever in Iran. Antivir. Res. 2013;100:20–28. doi: 10.1016/j.antiviral.2013.07.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Knust B., Medetov Z.B., Kyraubayev K.B., Bumburidi Y., Erickson B.R., Macneil A., Nichol S.T., Bayserkin B.S., Ospanov K.S. Crimean-Congo hemorrhagic fever, Kazakhstan, 2009-2010. Emerg. Infect. Dis. 2012;18:643–645. doi: 10.3201/eid1804.111503. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kong Y., Yan C., Liu D., Jiang L., Zhang G., He B., Li Y. Phylogenetic analysis of Crimean-Congo hemorrhagic fever virus in inner Mongolia, China. Ticks Tick Borne Dis. 2022;13 doi: 10.1016/j.ttbdis.2021.101856. [DOI] [PubMed] [Google Scholar]
- Kuhn J.H., Adkins S., Alkhovsky S.V., Avšič-Županc T., Ayllón M.A., Bahl J., Ballinger A., Bandte M.J., Bahl M., Beer M., Bejerman N., Bergeron É., Biedenkopf N., Bigarré L., Blair C.D., Blasdell K.R., Bradfute S.B., Briese T., Brown P.A., Bruggmann R., Buchholz U.J., Buchmeier M.J., Bukreyev A., Burt F., Büttner C., Calisher C.H., Candresse T., Carson J., Casas I., Buchholz U.J., Buchmeier M.J., Bukreyev A., Burt F., Büttner C., Calisher C.H., Cao M., Casas I., Chandran K., Charrel R.N., Cheng Q., Chiaki Y., Chiapello M., Choi I.-R., Ciuffo M., Clegg J.C.S., Crozier I., Dal Bó E., De La Torre J.C., De Lamballerie X., De Swart R.L., Debat H., Dheilly N.M., Di Cicco E., Di Paola N., Di Serio F., Dietzgen R.G., Digiaro M., Dolnik O., Drebot M.A., Drexler J.F., Dundon W.G., Duprex W.P., Dürrwald R., Dye J.M., Easton A.J., Ebihara H., Elbeaino T., Ergünay K., Ferguson H.W., Fooks A.R., Forgia M., Formenty P.B.H., Fránová J., Freitas-Astúa J., Fu J., Fürl S., Gago-Zachert S., Gāo G.F., García M.L., García-Sastre A., Garrison A.R., Gaskin T., Gonzalez J.-P.J., Griffiths A., Goldberg T.L., Groschup M.H., Günther S., Hall R.A., Hammond J., Han T., Hepojoki J., Hewson R., Hong J., Hong N., Hongo S., Horie M., Hu J.S., Hu T., Hughes H.R., Hüttner F., Hyndman T.H., Ilyas M., Jalkanen R., Jiāng D., Jonson G.B., Junglen S., Kadono F., Kaukinen K.H., Kawate M., Klempa B., Klingström J., Kobinger G., Koloniuk I., Kondō H., Koonin E.V., Krupovic M., Kubota K., Kurath G., Laenen L., Lambert A.J., Langevin S.L., Lee B., Lefkowitz E.J., Leroy E.M., Li S., Li L., Lǐ J., Liu H., Lukashevich I.S., Maes P., De Souza W.M., Marklewitz M., Marshall S.H., Marzano S.-Y.L., Massart S., Mccauley J.W., Melzer M., Mielke-Ehret N., Miller K.M., Ming T.J., Mirazimi A., Mordecai G.J., Mühlbach H.-P., Mühlberger E., Naidu R., Natsuaki T., Navarro J.A., Netesov S.V., Neumann G., Nowotny N., Nunes M.R.T., Olmedo-Velarde A., Palacios G., Pallás V., Pályi B., Papa A., Paraskevopoulou S., Park A.C., Parrish C.R., Patterson D.A., Pauvolid-Corrêa A., Pawęska J.T., Payne S., Peracchio C., Pérez D.R., Postler T.S., Qi L., Radoshitzky S.R., Resende R.O., Reyes C.A., Rima B.K., Luna G.R., Romanowski V., Rota P., Rubbenstroth D., Rubino L., Runstadler J.A., Sabanadzovic S., Sall A.A., Salvato M.S., Sang R., Sasaya T., Schulze A.D., Schwemmle M., Shi M., Shí X., Shí Z., Shimomoto Y., Shirako Y., Siddell S.G., Simmonds P., Sironi M., Smagghe G., Smither S., Song J.-W., Spann K., Spengler J.R., Stenglein M.D., Stone D.M., Sugano J., Suttle C.A., Tabata A., Takada A., Takeuchi S., Tchouassi D.P., Teffer A., Tesh R.B., Thornburg N.J., Tomitaka Y., Tomonaga K., Tordo N., Torto B., Towner J.S., Tsuda S., Tu C., Turina M., Tzanetakis I.E., Uchida J., Usugi T., Vaira A.M., Vallino M., Van Den Hoogen B., Varsani A., Vasilakis N., Verbeek M., Von Bargen S., Wada J., Wahl V., Walker P.J., Wang L.-F., Wang G., Wang Y., Wang Y., Waqas M., Wèi T., Wen S., Whitfield A.E., Williams J.V., Wolf Y.I., Wu J., Xu L., Yanagisawa H., Yang C., Yang Z., Whitfield F.M., Williams L., Wolf Y.-Z., Yamasaki S., Yanagisawa J., Zhang Y.Z., Økland A.L. 2022 taxonomic update of phylum Negarnaviricota (Riboviria: Orthornavirae), including the large orders Bunyavirales and Mononegavirales. Arch. Virol. 2022;167:2857–2906. doi: 10.1007/s00705-022-05546-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Lani R., Mohd Rahim N.F., Hassan H., Yaghoobi R., Chang L.-Y., Abubakar S., Zandi K. First report on the seroprevalence of the Crimean-Congo haemorrhagic fever virus, a tick-borne virus, in Malaysia's Orang Asli population. Eur. Rev. Med. Pharmacol. Sci. 2015;19:461–466. [PubMed] [Google Scholar]
- Leblebicioglu H. Crimean-Congo haemorrhagic fever in Eurasia. Int. J. Antimicrob. Agents. 2010;36(Suppl. 1):S43–S46. doi: 10.1016/j.ijantimicag.2010.06.020. [DOI] [PubMed] [Google Scholar]
- Leliana, Rizalsyah T. Infestasi caplak Ixodidae pada sapi lokal aceh di balai pembibitan ternak unggul dan hijauan pakan ternak. (BPTU-HPT) Indrapuri Kabupaten. Aceh Besar. J. Eduk. Sains Biol. 2015;4:10–13. [Google Scholar]
- Li Y., Yan C., Liu D., He B., Tu C. Seroepidemiological investigation of Crimean-Congo hemorrhagic fever virus in sheep and camels of Inner Mongolia of China. Vector Borne Zoonotic Dis. 2020;20:461–467. doi: 10.1089/vbz.2019.2529. [DOI] [PubMed] [Google Scholar]
- Liang G., Li X., Gao X., Fu S., Wang H., Li M., Lu Z., Zhu W., Lu X., Wang L., Cao Y., He Y., Lei W. Arboviruses and their related infections in China: a comprehensive field and laboratory investigation over the last 3 decades. Rev. Med. Virol. 2018;28 doi: 10.1002/rmv.1959. [DOI] [PubMed] [Google Scholar]
- Mardani M., Rahnavardi M., Rajaeinejad M., Naini K.H., Chinikar S., Pourmalek F., Rostami M., Shahri M.H. Crimean-Congo hemorrhagic fever among health care workers in Iran: a seroprevalence study in two endemic regions. Am. J. Trop. Med. Hyg. 2007;76:443–445. [PubMed] [Google Scholar]
- Mardani M., Keshtkar-Jahromi M., Ataie B., Adibi P. Crimean-Congo hemorrhagic fever virus as a nosocomial pathogen in Iran. Am. J. Trop. Med. Hyg. 2009;81:675–678. doi: 10.4269/ajtmh.2009.09-0051. [DOI] [PubMed] [Google Scholar]
- Moming A., Yue X., Shen S., Chang C., Wang C., Luo T., Zhang Y., Guo R., Hu Z., Zhang Y., Deng F., Sun S. Prevalence and phylogenetic analysis of Crimean-Congo hemorrhagic fever virus in ticks from different ecosystems in Xinjiang, China. Virol. Sin. 2018;33:67–73. doi: 10.1007/s12250-018-0016-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Mostafavi E., Pourhossein B., Esmaeili S., Bagheri Amiri F., Khakifirouz S., Shah-Hosseini N., Tabatabaei S.M. Seroepidemiology and risk factors of Crimean-Congo hemorrhagic fever among butchers and slaughterhouse workers in southeastern Iran. Int. J. Infect. Dis. 2017;64:85–89. doi: 10.1016/j.ijid.2017.09.008. [DOI] [PubMed] [Google Scholar]
- Mozafari O., Shirzadi M.R., Shorofi S.A., Mozafari A. Crimean-Congo haemorrhagic fever in Persian traditional medicine. Iran. J. Public Health. 2016;45:1243–1244. [PMC free article] [PubMed] [Google Scholar]
- Narankhajid M., Yeruult C., Gurbadam A., Battsetseg J., Aberle S.W., Bayartogtokh B., Joachim A., Duscher G.G. Some aspects on tick species in Mongolia and their potential role in the transmission of equine piroplasms, Anaplasma phagocytophilum and Borrelia burgdorferi L. Parasitol. Res. 2018;117:3557–3566. doi: 10.1007/s00436-018-6053-x. [DOI] [PubMed] [Google Scholar]
- Nasirian H. New aspects about Crimean-Congo hemorrhagic fever (CCHF) cases and associated fatality trends: a global systematic review and meta-analysis. Comp. Immunol. Microbiol. Infect. Dis. 2020;69 doi: 10.1016/j.cimid.2020.101429. [DOI] [PubMed] [Google Scholar]
- Nurmakhanov T., Sansyzbaev Y., Atshabar B., Deryabin P., Kazakov S., Zholshorinov A., Matzhanova A., Sadvakassova A., Saylaubekuly R., Kyraubaev K., Hay J., Atkinson B., Hewson R. Crimean-Congo haemorrhagic fever virus in Kazakhstan (1948-2013) Int. J. Infect. Dis. 2015;38:19–23. doi: 10.1016/j.ijid.2015.07.007. [DOI] [PubMed] [Google Scholar]
- Okely M., Anan R., Gad-Allah S., Samy A.M. Mapping the environmental suitability of etiological agent and tick vectors of Crimean-Congo hemorrhagic fever. Acta Trop. 2020;203 doi: 10.1016/j.actatropica.2019.105319. [DOI] [PubMed] [Google Scholar]
- Papa A., Ma B., Kouidou S., Tang Q., Hang C., Antoniadis A. Genetic characterization of the M RNA segment of Crimean Congo hemorrhagic fever virus strains, China. Emerg. Infect. Dis. 2002;8:50–53. doi: 10.3201/eid0801.010087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pigott D.M., Deshpande A., Letourneau I., Morozoff C., Reiner Robert C., Jr., Kraemer M.U.G., Brent S.E., Bogoch I.I., Khan K., Biehl M.H., Burstein R., Earl L., Fullman N., Messina J.P., Mylne A.Q.N., Moyes C.L., Shearer F., Bhatt S., Brady O.J., Gething P.W., Weiss D.J., Tatem A.J., Caley L., Groeve T.D., Vernaccini L., Golding N., Horby P., Kuhn J.H., Laney S.J., Ng E., Piot P., Sankoh O., Murray C.J.L., Hay S.I. Local, national, and regional viral haemorrhagic fever pandemic potential in Africa: a multistage analysis. Lancet. 2017;390:2662–2672. doi: 10.1016/S0140-6736(17)32092-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Qing T., Saijo M., Lei H., Niikura M., Maeda A., Ikegami T., Xinjung W., Kurane I., Morikawa S. Detection of immunoglobulin G to Crimean-Congo hemorrhagic fever virus in sheep sera by recombinant nucleoprotein-based enzyme-linked immunosorbent and immunofluorescence assays. J. Virol. Methods. 2003;108:111–116. doi: 10.1016/s0166-0934(02)00267-7. [DOI] [PubMed] [Google Scholar]
- Rasulov I. Ticks status in Central Asia with a special emphasis on Uzbekistan. Parasitol. Res. 2007;101(Suppl. 2):S183–S186. doi: 10.1007/s00436-007-0691-8. [DOI] [PubMed] [Google Scholar]
- RK-NCPH . 2020. Эпидемиологическая ситуация по Конго-крымской геморрагической лихорадке на 10 июля 2020 года.http://rk-ncph.kz/ru/novosti/tekushchie-novosti/2020/585-epidemiologicheskaya-situatsiya-po-kongo-krymskoj-gemorragicheskoj-likhoradke-na-10-iyulya-2020-goda [Google Scholar]
- Robbins R.G., Platt S.G., Keirans J.E. First report of Hyalomma marginatum isaaci Sharif (Acari : Ixodida : Ixodidae) from the union of Myanmar, with a concurrent collection of H. hussaini Sharif. Proc. Entomol. Soc. Wash. 2002;104:1061–1063. [Google Scholar]
- Saijo M., Tang Q., Shimayi B., Han L., Zhang Y., Asiguma M., Tianshu D., Maeda A., Kurane I., Morikawa S. Recombinant nucleoprotein-based serological diagnosis of Crimean-Congo hemorrhagic fever virus infections. J. Med. Virol. 2005;75:295–299. doi: 10.1002/jmv.20270. [DOI] [PubMed] [Google Scholar]
- Schwarz T.F., Nsanze H., Ameen A.M. Clinical features of Crimean-Congo haemorrhagic fever in the United Arab Emirates. Infection. 1997;25:364–367. doi: 10.1007/BF01740819. [DOI] [PubMed] [Google Scholar]
- Sheng J., Jiang M., Yang M., Bo X., Zhao S., Zhang Y., Wureli H., Wang B., Tu C., Wang Y. Tick distribution in border regions of Northwestern China. Ticks Tick Borne Dis. 2019;10:665–669. doi: 10.1016/j.ttbdis.2019.02.011. [DOI] [PubMed] [Google Scholar]
- Simpson D.I.H., Knight E.M., Courtois G., Williams M.C., Weinbren M.P., Kibukamusoke J.W. Congo virus: a hitherto undescribed virus occurring in Africa. Part 1—human isolations—clinical notes. Afr. Med. J. 1967;44:86–92. [PubMed] [Google Scholar]
- Sun S., Dai X., Aishan M., Wang X., Meng W., Feng C., Zhang F., Hang C., Hu Z., Zhang Y. Epidemiology and phylogenetic analysis of Crimean-Congo hemorrhagic fever viruses in Xinjiang, China. J. Clin. Microbiol. 2009;47:2536–2543. doi: 10.1128/JCM.00265-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Temmam S., Chrétien D., Bigot T., Dufour E., Petres S., Desquesnes M., Devillers E., Dumarest M., Yousfi L., Jittapalapong S., Karnchanabanthoeng A., Chaisiri K., Gagnieur L., Cosson J.-F., Vayssier-Taussat M., Morand S., Moutailler S., Eloit M. Monitoring silent spillovers before emergence: a pilot study at the tick/human interface in Thailand. Front. Microbiol. 2019;10:2315. doi: 10.3389/fmicb.2019.02315. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Temur A.I., Kuhn J.H., Pecor D.B., Apanaskevich D.A., Keshtkar-Jahromi M. Epidemiology of Crimean-Congo hemorrhagic fever (CCHF) in Africa—underestimated for decades. Am. J. Trop. Med. Hyg. 2021;104:1978–1990. doi: 10.4269/ajtmh.20-1413. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Teng A.-Y., Che T.-L., Zhang A.-R., Zhang Y.-Y., Xu Q., Wang T., Sun Y.-Q., Jiang B.-G., Lv C.-L., Chen J.-J., Wang L.-P., Hay S.I., Liu W., Fang L.-Q. Mapping the viruses belonging to the order Bunyavirales in China. Infect. Dis. Poverty. 2022;11:81. doi: 10.1186/s40249-022-00993-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Tezer H., Sucaklı I.A., Saylı T.R., Celikel E., Yakut I., Kara A., Tunc B., Ergonul O. Crimean-Congo hemorrhagic fever in children. J. Clin. Virol. 2010;48:184–186. doi: 10.1016/j.jcv.2010.04.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Tishkova F.H., Belobrova E.A., Valikhodzhaeva M., Atkinson B., Hewson R., Mullojonova M. Crimean-Congo hemorrhagic fever in Tajikistan. Vector Borne Zoonotic Dis. 2012;12:722–726. doi: 10.1089/vbz.2011.0769. [DOI] [PubMed] [Google Scholar]
- Tripathi S., Bhati R., Gopalakrishnan M., Bohra G.K., Tiwari S., Panda S., Sahay R.R., Yadav P.D., Nag V.L., Garg M.K. Clinical profile and outcome of patients with Crimean Congo haemorrhagic fever: a hospital based observational study from Rajasthan, India. Trans. R. Soc. Trop. Med. Hyg. 2020;114:643–649. doi: 10.1093/trstmh/traa014. [DOI] [PubMed] [Google Scholar]
- United Nations Statistics Division Standard country or area codes for statistical use (M49) 2020. https://unstats.un.org/unsd/methodology/m49/ Geographic regions.
- Uzbek C.D.C. Uzbekistan; Mashhur: 2019. Data Collected from CDC Communication: Clinical Practice Guideline on CCHF, Tashkent. [Google Scholar]
- Von Fricken M.E., Voorhees M.A., Koehler J.W., Asbun C., Lam B., Qurollo B., Hogan K.M., Baasandagva U., Jigjav B., Schoepp R.J. Molecular characteristics of Rickettsia in ticks collected along the southern border of Mongolia. Pathogens. 2020;9 doi: 10.3390/pathogens9110943. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Vonesch N., Binazzi A., Bonafede M., Melis P., Ruggieri A., Iavicoli S., Tomao P. Emerging zoonotic viral infections of occupational health importance. Pathog. Dis. 2019;77 doi: 10.1093/femspd/ftz018. ftz018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Voorhees M.A., Padilla S.L., Jamsransuren D., Koehler J.W., Delp K.L., Adiyadorj D., Baasandagwa U., Jigjav B., Olschner S.P., Minogue T.D., Schoepp R.J. Crimean-Congo hemorrhagic fever virus, Mongolia, 2013-2014. Emerg. Infect. Dis. 2018;24:2202–2209. doi: 10.3201/eid2412.180175. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Whitehouse C.A. Crimean-Congo hemorrhagic fever. Antivir. Res. 2004;64:145–160. doi: 10.1016/j.antiviral.2004.08.001. [DOI] [PubMed] [Google Scholar]
- Williams R.J., Al-Busaidy S., Mehta F.R., Maupin G.O., Wagoner K.D., Al-Awaidy S., Suleiman A.J., Khan A.S., Peters C.J., Ksiazek T.G. Crimean-Congo haemorrhagic fever: a seroepidemiological and tick survey in the Sultanate of Oman. Trop. Med. Int. Health. 2000;5:99–106. doi: 10.1046/j.1365-3156.2000.00524.x. [DOI] [PubMed] [Google Scholar]
- Wölfel R., Altantuul D., Mossbrugger I., Zorig L., Enkhtuvshin B., Davaadorj R. Seroprevalence of zoonoses in Mongolia: surveillance and risk factor assessment. Am. J. Trop. Med. Hyg. 2010;83(5 Suppl. l):146–147. [Google Scholar]
- Woodall J.P. In: Crimean-Congo Hemorrhagic Fever: a Global Perspective. Ergonul O., Whitehouse C.A., editors. Springer; Dordrecht, Netherlands: 2007. Personal reflections. [Google Scholar]
- Woodall J.P., Williams M.C., Simpson D.I.H. Congo virus: a hitherto undescribed virus occurring in Africa. Part 2—identification studies. Afr. Med. J. 1967;44:93–98. [PubMed] [Google Scholar]
- World Health Organization . 2020. Prioritizing Diseases for Research and Development in Emergency Contexts.https://www.who.int/activities/prioritizing-diseases-for-research-and-development-in-emergency-contexts [Google Scholar]
- World Health Organization International Classification of Diseases 11th Revision . 2022. 1D49 Crimean-Congo Haemorrhagic Fever.https://icd.who.int/browse11/l-m/en [Google Scholar]
- Xia H., Li P., Yang J., Pan L., Zhao J., Wang Z., Li Y., Zhou H., Dong Y., Guo S., Tang S., Zhang Z., Fan Z., Hu Z., Kou Z., Li T. Epidemiological survey of Crimean-Congo hemorrhagic fever virus in Yunnan, China, 2008. Int. J. Infect. Dis. 2011;15:e459–e463. doi: 10.1016/j.ijid.2011.03.013. [DOI] [PubMed] [Google Scholar]
- Yang X., Gao Z., Wang L., Xiao L., Dong N., Wu H., Li S. Projecting the potential distribution of ticks in China under climate and land use change. Int. J. Parasitol. 2021;51:749–759. doi: 10.1016/j.ijpara.2021.01.004. [DOI] [PubMed] [Google Scholar]
- Yashina L., Petrova I., Seregin S., Vyshemirskii O., Lvov D., Aristova V., Kuhn J., Morzunov S., Gutorov V., Kuzina I., Tyunnikov G., Netesov S., Petrov V. Genetic variability of Crimean-Congo haemorrhagic fever virus in Russia and Central Asia. J. Gen. Virol. 2003;84:1199–1206. doi: 10.1099/vir.0.18805-0. [DOI] [PubMed] [Google Scholar]
- Yegemberdiyeva R.A., Tuleuov A.M. Characteristics of natural centers of Crimean-Congo hemorrhagic fever in the Republic of Kazakhstan. ICCAID. The First International Congress of Central Asia Infectious Diseases. Program and Abstract Book. 2006;(P56):94–95. Oct 30-Nov 2, 2006, Bishkek, Kyrgyzstan. [Google Scholar]
- Yen Y.-C., Kong L.-X., Lee L., Zhang Y.-Q., Li F., Cai B.-J., Gao S.-Y. Characteristics of Crimean-Congo hemorrhagic fever virus (Xinjiang strain) in China. Am. J. Trop. Med. Hyg. 1985;34:1179–1182. [PubMed] [Google Scholar]
- Zhang Y., Shen S., Fang Y., Liu J., Su Z., Liang J., Zhang Z., Wu Q., Wang C., Abudurexiti A., Hu Z., Zhang Y., Deng F. Isolation, characterization, and phylogenetic analysis of two new Crimean-Congo hemorrhagic fever virus strains from the northern region of Xinjiang Province, China. Virol. Sin. 2018;33:74–86. doi: 10.1007/s12250-018-0020-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Zhao L., Lv J., Li F., Li K., He B., Zhang L., Han X., Wang H., Johnson N., Lin X., Wu S., Liu Y. Identification and molecular analysis of ixodid ticks (Acari: Ixodidae) infesting domestic animals and tick-borne pathogens at the Tarim Basin of southern Xinjiang, China. Kor. J. Parasitol. 2020;58:37–46. doi: 10.3347/kjp.2020.58.1.37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Zhou Z., Meng W., Deng F., Xia H., Li T., Sun S., Wang M., Wang H., Zhang Y., Hu Z. Complete genome sequences of two Crimean-Congo hemorrhagic Fever viruses isolated in China. Genome Announc. 2013;1 doi: 10.1128/genomeA.00571-13. e00571–13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Абуова Г.Н., Пшеничная Н.Ю., Апсатаров ж.А., Оспанова З.А. Крымская-Конго геморрагическая лихорадка у беременных в Южно-Казахстанской области. Цитокины и воспаление. 2012;11:50–52. [Google Scholar]
- Аристова В.А., Неронов В.М., Веселовская О.В., Лущекина А.А.,, Курбанов М. О разведке природных очагов Крымской геморрагической лихорадки Юго-восточной Туркмении. Львов Д.К., editor. Экология вирусов (сборник трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского. 1973;Т. 1, с.:115–118. [Google Scholar]
- Байназаров М.М., Миркасимова Х.Х., Маматова Р.Н. Эпидемиологический мониторинг за переболевшими Крымской-Конго геморрагической лихорадкой в Джизакской области Республики Узбекистан. Илмий-амалий Тиббиëт Журнали. 2018;(2):57–61. [Google Scholar]
- Бердыев А.Б. Түркменистан ССР, СССР, Ылым; 1980. Экология иксодовых клещей Туркменистана и их роль в эпизоотологии природноочаговых болезней, Ашхабад. [Google Scholar]
- Бляхер И.A., Пак Т.П., Ясинский А.В. In: Чумаков М.П., editor. T. XIX. 1971. О внутрибольничной вспышке крымской геморрагической лихорадки в Таджикистане; pp. 130–133. (Вирусные геморрагические лихорадки. Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов Академии медицинских наук CCCР. Москва, РСФСР, СССР: Академия медицинских наук СССР). [Google Scholar]
- Бутенко А.М., Трусова И.Н. Заболеваемость крымской геморрагической лихорадкой в странах Европы, Африки и Азии (1943–2012 гг.) Эпидемиология и инфекционные болезни. 2013;18:46–48. [Google Scholar]
- Генис Д.Е., Смирнова С.Е., Згурская Г.Н., Чумаков М.П. In: Чумаков М.П., editor. T. XIX. 1971. Результаты изучения очага КГЛ в Кзыл-Ординской области Казахской ССР; pp. 92–99. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР). [Google Scholar]
- Гордеева З.Е., Костюков М.Л., Вышемирский О.И., Волкова Т.В. Выделение вируса крымской геморрагической лихорадки из крови сельскохозяйственных животных. Здравоохранение Таджикистана - Нигаҳдории тандурустии Тоҷикистон. 1990;(3):75–77. [Google Scholar]
- Гребенюк Р.В. Кыргыз ССР, СССР, Илим; 1966. Иксодовые клещи Киргизии, Фрунзе. [Google Scholar]
- Дандуров Ю.В., Пантелеев В.А., Борисов В.М., Смешко О.В., Архипов П.Н., Рубин С.Н., Рисалиев Д.Р., Александров А.К. Изоляция вируса Крымской геморрагической лихорадки из клещей Hyalomma plumbeum plumbeum Panz в Ошской области Киргизкой ССР. Материалы IX симпозиума «Экология вирусов». 1975:48–49. [Google Scholar]
- Данияров О.А., Пак Т.П., Костюков М.А., Буличев В.П., Гордеева З.Е. Итоги вирусологических исследований на крымскую геморрагическую лихорадку в Таджикистане. Материалы IX симпозиума «Экология вирусов». Душанбе, Таджикская Советская Социалистическая Республика, СССР: Дониш. c. 1975:29–30. [Google Scholar]
- Дерновой В.Г., Каримов С.К., Доскулов О.Н., Спатаев М.Б., Оспанов К.С., Кирющенко Жумалова, Э.Б., Маманов М.М., Кыздарбеков А.М., Абдикаримов М.А., Казаков С.В., Амиреев Ж., Надуев Д.Н. Вспышка крымской геморрагической лихорадки в Жамбылской области. Здравоохранение Казахстана. 1996;(4):21–23. [Google Scholar]
- Добрица П.Г. In: Чумаков М.П., editor. Т. VII. 1965. Эпидемиология и профилактика геморрагической лихорадки в Чимкентской области Южно-Казахстанского края; pp. 262–270. (Эндемические вирусные инфекции. Геморрагическая лихорадка с почечным синдромом, Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, астраханский вирус из клеща Hyalomma Pl. Plumbeum. Труды Института полиомиелита и вирусных энцефалитов Академии медицинских наук СССР: Медицина). [Google Scholar]
- Дурумбетов Е.Е., Айкимбаев A.M., Жетибаев В.К., Казаков С.В., Байтанаев А.О. Конго-крымская геморрагическая лихорадка в Жамбылской области Республики Казахстан. Вторая межгосударственная научно-практическая конференция по взаимодействию государств-участников СНГ в области санитарной охраны территорий. Алматы, Казахстан c. 2001:119–121. [Google Scholar]
- Егембердиева Р.А., Шерметова М.Б. Описание подтвержденного и вероятных случаев крымской- конго геморрагической лихорадки в Туркестанском районе Южно-Казахстанской области в 2007 году. Сибирс Мед Ж. 2008;82:131–133. [Google Scholar]
- Згурская Г.Н., Смирнова С.Е., Чумаков М.П. In: Актуальные проблемы вирусологии и профилактики вирусных заболеваний. Тезисы XVII научной сессии института, посвящëнной актуальным проблемам вирусологии и профилактики вирусных заболеваний. Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. Чумаков М.П., editor. 1972. Применение метода флюоресцирующих антител (МФА) для обнаружения вируса крымской геморрагической лихорадки (КГЛ) у спонтанно зараженных клещей. [Google Scholar]
- Иоффе В.Ю. Об одной своеобразной форме геморрагического диатеза. Клин. Мед. 1944;22:25–30. [Google Scholar]
- Карась Ф.Р., Варгина С.Г., Осипова Н.З., Гребенюк Ю.И., Стеблянко С.Н., Усманов Р.К., Циркин Ю.М., Тимофеев Е.М., Громашевский В.Л., Львов Д.К. In: Львов Д.К., editor. Т. 1. 1973. Изучение очагов арбовирусных инфекций на территории Киргизии; pp. 69–74. (Экология вирусов (сборник трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского). [Google Scholar]
- Каримов С.К., Кирющенко Т.В., Усебаева Г.К., Роговая С.Г. In: Вопросы медицинской вирусологии. Тезисы конференции (21-23 октября 1975 г.). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. Чумаков М.П., editor. 1975. К изучению крымской геморрагической лихорадки в Южных областях Казахстана; pp. 279–299. [Google Scholar]
- Касымов К.Т., Данияров О.А., Пак Т.П., Павлович А.Н., Смирнова С.Е., Чумаков М.П. In: Чумаков М.П., editor. T. XIX. 1971. Выделение и изучение вируса Крымской геморрагической лихорадки из клещей Hyalomma в Таджикистане; pp. 38–40. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР.). [Google Scholar]
- Касымов К.Т., Павлович А.Н., Данияров О.А. Результаты исследования в Таджикистане сывороток здоровых людей и животных в РСК и РДПА с антигеном вируса крымской геморрагической лихорадки. Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР. 1971;T. XIX, c.:80–85. [Google Scholar]
- Колонин Г.В. Новые данные по фауне иксодовых клещей Вьетнама. Зоол. Ж. 2003;82:1019–1021. [Google Scholar]
- Комилов Н.О. История изучения Крымской-Конго геморрагической лихорадки в Узбекистане. Военная медицина. 2010;(2):146–148. [Google Scholar]
- Комілов Н.О., Мусабаєв Є.І., Нематов А.С., Мустанов А.Н., Шермухамедова Д.А. Роль хребетних тварин у циркуляціï вірусу Кримськоï-Конго геморагічноï гарячки в природних осередках інфекціï на територіï Узбекистану. Інфекційні хвороби. 2009;(2):29–32. [Google Scholar]
- Комілов Н.О., Нематов А.С., Мустанов А.Н., Шермухамедова Д.А. Структура і епідеміологічний тип захворюваності людей на Кримську-Конго геморагічну гарячку в умовах Узбекистану. Інфекційні хвороби. 2009;(2):33–36. [Google Scholar]
- Костюков М.А., Камардинов Х.К., Коломийченко А.Л., Гордеева З.Е. Контактное заражение крымской геморрагической лихорадкой медицинских работников. Здравоохранение Таджикистана - Нигаҳдории тандурустии Тоҷикистон. 1993;(5):98–99. [Google Scholar]
- KTK Мальчик из Кыргызстана скончался от геморрагической лихорадки. 2019. https://www.ktk.kz/ru/newsfeed/article/2019/05/06/118652/
- Куйма А.У. In: Чумаков М.П., editor. Т. XIX. 1971. Круг хозяев и фенология развития Hyalomma anatolicum koch в очагах крымской геморрагической лихорадки в Дангаринском, районе Таджикистана; pp. 201–209. (Вирусные геморрагические лихорадки. Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов Академии медицинских наук CCCР. Москва, РСФСР, СССР: Академия медицинских наук СССР). [Google Scholar]
- Куйма А.У. In: Вопросы медицинской вирусологии. Тезисы конференции (21-23 октября 1975 г.). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. Чумаков М.П., editor. 1975. Некоторые особености распространения и численности переносчиков крымской геморрагической лихорадки в южном Таджикистане; pp. 310–311. [Google Scholar]
- Курбанов М.М., Березина Л.К., Закарян В.А., Киселева Н.В., Ватолин В.П. In: Экология вирусов (сборник трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского. Львов Д.К., editor. Т. 2. 1974. Результаты серологического исследования C 13 арбовирусами сывороток крови людей и сельскохозяйственных животных в зоне Каракумского канала и юго-востока ТССР; pp. 113–120. [Google Scholar]
- Курбанов М.М., Громашевский В.Л., Бердыев А., Скворцова Т.М., Киселева Н.В., Ватолин В.П. In: Экология вирусов (сборник трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского. Львов Д.К., editor. Т. 2. 1974. Выделение арбовирусов из клещей в зоне Каракумского канала; pp. 109–113. [Google Scholar]
- Кутманова А.З., Омуркулова Б.И., Джумагулова А.Ш., Алиев Г.К., Узакбаева А.З., Исаков К.М., Гайбулин Д.Ш., Брейнингер И.Г. Клещевые трансмиссивные инфекции в Кыргызской республике. Вестник КГМА им. И.К. Ахунбаева. 2013;(3–1):167–170. [Google Scholar]
- Лещинская Е.В., Бутенко А.М., Каринская Г.А., Мартыненко И.Н., Рубин С.Г., Столбов Д.Н., Зимина Ю.В., Дербеденева М.П., Чумаков М.П. Результаты клинико-эпидемического и сероэпидемиологического обследования здоровых людей в очагах крымской геморрагической лихорадки. Чумаков М.П., editor. Арбовирусы (клещевой и японский энцефалиты, геморрагические лихорадки и другие арбовирусные инфекции). Материалы XVI научной сессии института. Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. Т. 1969;2, c.:143–144. [Google Scholar]
- Львов Д.К., Тимофеева А.А., Громашевский В.Л., Карась Ф.Р., Скворцова Т.М., Леонова Г.Н., Сидорова Г.А., Пак Т.П., Никифоров Л.П., Данияров О.А., Березина Л.К., Костюков М.А., Закарян В.А., Чубкова А.И., Курбанов М.М., Ватолин В.П., Тимофеев Е.М., Варгина С.Г., Андреев В.П., Булычев В.П., Аристова В.А., Куйма А.У., Сазонов А.А., Мусатова А.И., Клименко С.М., Стеблянко С.М., Гофман Ю.П., Усманов Р.К., Гущин Б.В., Жезмер В.Ю., Погребенко А.Г., Акопян Г.С. In: Вопросы медицинской вирусологии. Тезисы конференции (21-23 октября 1975 г.). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. Чумаков М.П., editor. 1975. Новые арбовирусы, изолированные в СССР в 1969-74 гг; pp. 322–324. [Google Scholar]
- Максумов С.С., Мелиев А., Якубов Ш.Х., Садыкова В.Д., Расулов Б.Т. In: Материалы III съезда гигиенистов, санитарных врачей, эпидемиологов, микробиологов и инфекционистов Узбекистана (Ташкент, 11-14 сентября 1973 г.). Ташкент, УзССР, СССР: Медицина УзССР. Заирова К.С., editor. 1973. Основные итоги серологических исследований арбовирусов на территории Узбекистана; pp. 247–248. [Google Scholar]
- Мелиев A.M. 1967. Материалы по изучению геморрагической лихорадки в Узбекистане. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. Москва, РСФСР, СССР. [Google Scholar]
- Миxайлов Г.И. К эпидемиологии острой инфекционной геморрагической болезни. Клин. Мед. 1946;24:67–69. [Google Scholar]
- Миндерер . Описанная Докторомъ Iог. Март. Миндереромъ в 1770-1772 гг. Военно-медицинскiй журналъ; VI: 1825. XVII. О полутретедневной лихорадкѣ (hemitritaeus). 2 b. Полутретедневная лихорадка, по особеннымъ наблюденiямъ и опытамъ, учиненнымъ въ южныхъ странахъ. Россiи. 295–341. [Google Scholar]
- Мусабаев И.К. Некоторые особенности геморрагической лихорадки в Узбекистане. Медицинский журнал Узбекистана. 1961;(8):62–65. [PubMed] [Google Scholar]
- Мусабаев И.К., Хамидов Г.К., Закиров Х.З. К клинике геморрагической лихорадки в Узбекистане. Некоторые актуальные вопросы инфекционной патологии. Труды Ташкентского института усовершенствования врачей. 1962;9:141–147. [Google Scholar]
- Объединенная Комиссия По Качеству Медицинских Услуг министерства Здравоохранения, РК . 2019. Клинический протокол диагностики и лечения. Конго-Крымская геморрагическая лихорадка. от «29» марта 2019 года, Протокол №60) [Google Scholar]
- Онищенко Г.Г., Туманова И.Ю., Вышемирский О.И., Kuhn J., Серегин С.В., Тюнников Г.И., Петрова И.Д., Тишкова Ф.Х., Оспанов К.С., Казаков С.В., Каримов С.К., Есмагамбетова А.С., Нетесов С.В., Петров В.С. Исследования методами ИФА и ОТ-ПЦР вирусофорности иксодовых клещей, собранных в очагах Крымской–Конго геморрагической лихорадки Казахстана и Таджикистана в 2001-2002 гг. Вопр. Вирусол. 2005;50:23–26. [PubMed] [Google Scholar]
- Пак Т.П. Опыт эпидемиологического районирования крымской геморрагической лихорадки в условиях Таджикской ССР. Ж. Микробиол. Эпидемиол. Иммунобиол. 1972;49:112–116. [PubMed] [Google Scholar]
- Пак Т.П. Вопросы экологии вируса крымской геморрагической ликхорадки в Таджикской ССР. Львов Д.К., editor. Экология вирусов (сборник трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского. 1973;T. 1, c.:91–100. [Google Scholar]
- Пак Т.П. Структура ареала крымской геморрагической лихорадки в Таджикистане. Материалы IX симпозиума «Экология вирусов». Душанбе, Таджикская Советская Социалистическая Республика, СССР: Дониш. 1975:39–43. [Google Scholar]
- Пак Т.П., Михайлова Л.И. Таджикская Социалистическая Советская Республика, СССР, Ирфон; 1973. Крымская геморрагическая лихорадка в Таджикистане, Душанбе. [Google Scholar]
- Пак Т.П., Смирнова С.Е., Згурская Г.Н., Ясинский А.В., Бердыев Х.Б., Апостоли Л.А., Коровкин В.П., Фелдман Е.М., Дерлятко К.И., Головко Э.Н., Махмудов Р.Х., Чумаков М.П. In: Чумаков М.П., editor. Т. XIX. 1971. Результаты серологической разведки на крымскую геморрагическую лихорадку (КГЛ) в Таджикской ССР в 1969 г; pp. 72–79. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР.). [Google Scholar]
- Пак Т.П., Данияров О.А., Костюков М.А., Булычев В.П., Куйма А.У. Биоценотические взаимоотношения вируса крымской геморрагической лихорадки, иксодовых клещей и их прокормителей. Сообщение 1. Итоги вирусологических исследований иксодовых и аргасовых клещей в Таджикской ССР. Львов Д.К., editor. Экология вирусов (сборник трудов). Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского: Москва, РСФСР, СССР. Т. 1974;2, c.:135–139. [Google Scholar]
- Пак Т.П., Костюков М.А., Данияров О.А., Булычев В.П. О сопряженном очаге арбовирусных инфекций в Таджикистане. Материалы IX симпозиума «Экология вирусов». Душанбе, Таджикская Советская Социалистическая Республика, СССР: Дониш. 1975:38–39. [Google Scholar]
- Петрова И.Д., Кононова Ю.В., Чаусов Е.В., Шестопалов А.М., Тишкова Ф.Х. Генетические варианты вируса Крымской-Конго геморрагической лихорадки, циркулировавшие в 2009 г. В эндемичных районах Южного Таджикистана. Мол. Ген. Микробиол. Вирусол. 2013;(3):29–36. [Google Scholar]
- Пиров А. Диссертация на соискание ученой степени кандидата медицинских наук: 14.00.30. Место защиты. Таджикский государственный медицинский университет, Душанбе; Таджикистан: 2005. Особенности циркуляции вируса крымской - конго геморрагической лихорадки (К-КГЛ) в республике Таджикистан. [Google Scholar]
- Померанцев Б.И. 1950. Иксодовые клещи (Ixodidae). Фауна СССР. Паукообразные. Т. 4, вып 2, Москва, РСФСР, СССР: Академия наук СССР. [Google Scholar]
- Прорешная Т.Л. О геморрагической лихорадке. Сов Здравоохр Кирг. 1955;(1):3–9. [Google Scholar]
- Рахманов Э.Р., Хабибуллоев Ш.Б., Матинов Ш.К. Клинико-эпидемиологические особенности Крымско-Конго геморрагической лихорадки в республике Таджикистан. Вестник Авиценны. 2014;4(61):110–113. [Google Scholar]
- Реформатская А.Ф., Панькина М.В., Криницкий Н.И. Геморрагические лихорадки в Казахстане. Здравоохранение Казахстана. 1965;(5):12–13. [Google Scholar]
- Рыбалко С.И., Панькина М.В., Каннегисер Н.И., Бурлакова Т.С. Геморрагическая лихорадка в южных районах Казахстана. Мед. Паразитол. 1963;(5):619–620. [Google Scholar]
- Салаев . Военно-медицинскiй журналъ; VI: 1825. XVII. О полутридневной лихорадкѣ (Hemitritaeus). 1. a. Практическое наблюденiе о полутридневной лихорадкѣ (Dialeipyra semitertiana, comatose, lethargica), оказавшейся въ Крыму 1825 года. 341–389. [Google Scholar]
- Семашко И.В., Добрица П.Г., Башкирцев Б.И., Чумаков М.П. Результаты исследования сыворотки крови здоровых людей, животных и птиц на антитела к вирусу КГЛ-Конго, собранных в южных районах Казахстана. Материалы IX симпозиума «Экология вирусов». Душанбе, Таджикская Советская Социалистическая Республика, СССР: Дониш c. 1975:43–44. [Google Scholar]
- Сиповский П.В. Случаи своеобразного желудочно-кишечного кровотечения. Клин. Мед. 1944;22:64–67. [Google Scholar]
- Скворцова Т.М., Громашевский В.Л., Сидорова Г.А., Хуторецкая Н.В., Аристова В.А., Кондрашина Н.Г., Полякова А.Н., Мурадов Ш.М., Белоусов Е.М., Курченко Ф.П. In: Экология вирусов (сборник научных трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского. Львов Д.К., editor. 1982. Результаты вирусологического обследования членистоногих переносчиков на территории Туркмении; pp. 139–144. [Google Scholar]
- Смирнова С.Е., Згурская Г.Н., Непесова Н.М., Пак Т.П., Чумаков М.П., Чунихин С.П. In: Чумаков М.П., editor. Т. 2. 1969. Обследование крови животных в Средней Азии на антитела к вирусу крымской геморрагической лихорадки; pp. 146–147. (Арбовирусы (клещевой и японский энцефалиты, геморрагические лихорадки и другие арбовирусные инфекции). Материалы XVI научной сессии института. Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов.). [Google Scholar]
- Смирнова С.Е., Данияров О.А., Згурская Г.Н., Касымов К.Т., Павлович А.Н., Пак Т.П., Чумаков М.П., Ясинский А.В. In: Чумаков М.П., editor. Т. XIX. 1971. Серологическое обследование людей и животных на антитела к вирусу крымской геморрагической лихорадки в Таджикской ССР (по данным 1968 г.) pp. 66–71. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР.). [Google Scholar]
- Смирнова С.Е., Згурская Г.Н., Генис Д.Е., Чумаков М.П. In: Чумаков М.П., editor. Т. XIX. 1971. Выделение вируса Крымской геморрагической лихорадки из клещей Hyalomma anatolicum, собранных в Кзыл-Ординской области Казахской ССР; pp. 41–44. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР.). [Google Scholar]
- Смирнова С.Е., Непесова Н.М., Тачмурадов Г., Кирьянова А.М., Чумаков М.П. In: Чумаков м.П., editor. Т. XIX. 1971. Материалы по изучению крымской геморрагической лихорадки в Туркменской ССР; pp. 86–91. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР.). [Google Scholar]
- Смирнова С.Е., Генис Д.Е., Згурская Г.Н., Чумаков М.П. In: Актуальные проблемы вирусологии и профилактики вирусных заболеваний. Тезисы XVII научной сессии института, посвящëнной актуальным проблемам вирусологии и профилактики вирусных заболеваний. Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. Чумаков М.П., editor. 1972. Выделение вируса крымской геморрагической лихорадки из крови больного в Кзыл-Ординской области Казахской ССР; p. 372. [Google Scholar]
- Смирнова С.Е., Шанмугам Д.Ж., Непесова Н.М., Филипенко П.И., Мамаев В.И., Чумаков М.П. In: Чумаков М.П., editor. Т. XXII (1) 1974. Выделение вируса Крымской геморрагической лихорадки из клещей Нуаlomma asiaticum, собранных в Туркменской ССР; pp. 176–179. (Медицинская вирусология. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР). 227. [Google Scholar]
- Смирнова C.E., Мамаев В.И., Непесова H.M., Филипенко Н.И., Каляева В.Я., Чумаков М.П. Изучение циркуляции вируса крымской геморрагической лихорадки в Туркменской ССР. Ж. Микробиол. Эпидемиол. Иммунобиол. 1978;(1):92–97. [PubMed] [Google Scholar]
- Соколов А.Е., Чумаков М.П., Колачев A.A., editors. Крымская геморрагическая лихорадка (острый инфекционный капилляротоксикоз), Симферопoль, Крымская Советская Социалистическая Республика, РСФСР, СССР. Издание Отдельной Приморской Армии; 1945. [Google Scholar]
- Тимофеев Е.М. Выделение и идентификация новых арбовирусов в Киргизской ССР и изучение их физических, химических и биологических свойств. Диссертация на соискание ученой степени. кандидата медицинских наук. Москва. 1973 [Google Scholar]
- Тимофеев Е.М., Шахгильбян И.В., Рыбин С.Н., Гребенюк Ю.И., Карась Ф.Р. In: Экология вирусов (сборник трудов). Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт вирусологии имени Д. И. Ивановского. Львов Д.К., editor. 1973. Результаты серологического исследования C 15 арбовирусами сывороток крови людей и сельскохозяйственных животных в Юго-западных районах Ошской области Киргизской ССР; pp. 80–87. [Google Scholar]
- Туманова И.Ю., Серегин С.В., Вышемирский О.И., Гуторов В.В., Петрова И.Д., Тюнников Г.И., С О.К., Казаков С.В., Каримов С., Тишкова Ф.Х., Пиров А.П., Нетесов С.В., Петров В.С. Генетический мониторинг вируса Крымской-Конго геморрагической лихорадки в Казахстане и Таджикистане в период 2001-2003 гг. Мол. Ген. Микробиол. Вирусол. 2006;(2):36–41. [PubMed] [Google Scholar]
- Турлиев З.С., Усатаева Г.М. Эпидемиологическая ситуация в республике Казахстан по Конго-Крымской геморрагической лихорадке. Вестник КазНМУ. 2019;(2):20–23. [Google Scholar]
- Укибаева У.А., Омашева Г.М., Даниярова А.Б., Бойбосинов Э.У., Белходжаев А.А., Идаят М.Г. Қазақстанның оңтүстік өңіріндегі ҚКГҚ қоздырғышы айналымының алғышарттары және Қырым-Конго геморрагиялық қызбасының зертханалық диагностикасы. Вестник ҚазҰМУ. 2021;(1):29–34. [Google Scholar]
- Умурзaков Ш.Д., Кодиров А.М., Яковлев В.А., Эрматов И.М., Сарибоева Э.Ж. Қрим-конго геморрагик иситмасининг аҳоли орасида тарқалишида биологик омиллариниг таъсири. O'zbekiston tibbiyot jurnali. 2009;(6):13–16. [Google Scholar]
- Федорова С.Ж. Иксодовые клещи (Ixodidae) г. Бишкек. Мед. Паразитол. 2005;(4):34–38. [PubMed] [Google Scholar]
- Филиппова Н.А., Мусатов С.А., Панова И.В., Лобанов А.Л. Таксономическая структура политипического вида Hyalomma asiaticum (Ixodidae) Первый опыт использования баз данных по морфометрии. Паразитология. 1995;(2):65–82. [Google Scholar]
- Хашимов Д.М., Михайлова Л.И. In: Чумаков М.П., editor. XIX. 1971. Материалы к изучению клиники крымской геморрагической лихорадки в Таджикистане; pp. 134–139. (Вирусные геморрагические лихорадки - Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР Т.). [Google Scholar]
- Ходукин Н.И. 1952. Вопросы краевой патологии. Выпуск 2. Геморрагическая лихорадка в Узбекистане. Сборник статей, Ташкент, Узбекская ССР, СССР, Академии наук Узбекской ССР. [Google Scholar]
- Цилинский Я.Я., Лебедев А.Д., Пак Т.П., Громашевский В.Л., Тимофеев Е.М., Ершов Ф.И., Ципкин Ю.М., Львов Д.К. In: Итоги VI Симпозиума по изучению вирусов, экологически связанных с птицами. (Материалы симпозиума). 7-9 декабря 1971 г. г. Омск. Москва, РСФСР, СССР: Институт полиомиелита и вирусных энцефалитов АМН СССР, Институт вирусологии им. Д.И. Ивановского АМН СССР. Львов Д.К., editor. 1972. Выделение вируса Крымской геморрагической лихорадки (КГЛ) из клещей Hyalomma plumbeum в Таджикистане; pp. 94–97. [Google Scholar]
- Циркин Ю.М., Карась Ф.Р., Львов Д.К., Громашевский В.Л., Веселовская О.В., Гребенюк Ю.И. In: Материалы VI симпозиума по изучению вирусов, экологически связанных с птицами. Омск, РСФСР, СССР: Омский научно-исследовательский институт природно-очаговых инфекций. Министерство здравоохранения РСФСР, Институт вирусологии им. Д. И. Ивановского АМН СССР, Институт полиомиелита и вирусных энцефалитов АМН СССР, Тюменский научно-исследовательский институт краевой инфекционной патологии Министерство здравоохранения РСФСР. Львов Д.К., Майская К.И., editors. 1971. Выделение вируса Крымской геморрагической лихорадки из клещей Hyalomma plumbeum в Киргизии; pp. 98–102. 1971. [Google Scholar]
- Черновский K.M., Канторович P.A., Ясинский A.B., Кальмыков Е.С., Абдуллоходжаев З.Я., Бердыев Х.Б., Арскний В.Г. О заболеваниях геморрагической лихорадкой в Таджикской ССР. Здравоохранение Таджикистана. 1968;14:5–9. [Google Scholar]
- Чумаков М.П. In: Чумаков М.П., editor. Т. XXII (2) 1974. К 30-летию изучения в СССР КГЛ; pp. 5–18. (Медицинская вирусология. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР.). 277–278. [Google Scholar]
- Чумаков М.П., Бируля Н.Б., Бутенко A.M., Васюта Ю.С., Егорова П.С., Залуцкая Л.И., Зимина Ю.В., Лещинская Е.В., Повалишина Т.П., Стольбов Д.Н. К вопросу об эпидемиологии заболеваний типа крымской геморрагической лихорадки (КГЛ) в Астраханской области. Клещевой энцефалит, Кемеровская лихорадка, геморрагические лихорадки и другие арбовирусные инфекции. Mатериалы XI научной сессии Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов. c. 1964:263–266. [Google Scholar]
- Чумаков М.П., Смирнова С.Е., Шалунова Н.В., Мартьянова Л.И., Флеер Т.П., Садыкова В.Д., Максумов С.С. In: Чумаков М.П., editor. Т. XIX. 1971. Выделение и изучение вируса из крови больного крымской геморрагической лихорадкой в Самаркандской области Узбекской ССР: штамм Ходжа; pp. 21–29. (Вирусные геморрагические лихорадки. Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, геморрагическая лихорадка с почечным синдромом. Труды Института полиомиелита и вирусных энцефалитов Академии медицинских наук CCCР. Москва, РСФСР, СССР: Академия медицинских наук СССР.). [Google Scholar]
- Чумаков М.П., Вафакулов Б.Х., Заводова Т.И., Кармышева В.Я., Максумов С.С., Мартьянова Л.И., Робин В.И., Сухаренко С.Н. In: Чумаков М.П., editor. 1974. Случаи передачи вируса крымской геморрагической лихорадки в Узбекистане через контакты с кровью больной коровы и больного человека, а также через укусы клещей; pp. 29–34. (Медицинская вирусология. Труды Института полиомиелита и вирусных энцефалитов Академии медицинских наук CCCР. Москва, РСФСР, СССР: Академия медицинских наук СССР. Т. XXII (2)). 279. [Google Scholar]
- Чумаков М.П., Заводова Т.И., Мартьянова Л.И., Мухитдинов А.Г., Повалишина Т.П., Родин В.И., Розина В.Ф., Сафарова Р.А., Сухаренко С.И., Татаров А.Г., Хачатурова С.С., Чунихин С.П. In: Чумаков М.П., editor. Т. XXII (2) 1974. Обнаружение вируса крымской геморрагической лихорадки у нескольких видов кровососущих клещей, собранных в 1973 г. на территориях Киргизской и Узбекской ССР; pp. 35–39. (Медицинская вирусология. Труды института полиомиелита и вирусных энцефалитов АМН СССР. Москва, РСФСР, СССР: Академия медицинских наук СССР.). 279. [Google Scholar]
- Чун-Сюн Ф., Генис Д.Е. In: Эндемические вирусные лнфекции. Геморрагическая лихорадка с почечным синдромом, Крымская геморрагическая лихорадка, Омская геморрагическая лихорадка, астраханский вирус из клеща Hyalomma Pl. Plumbeum. Труды Института полиомиелита и вирусных энцефалитов. Москва, РСФСР, СССР: Медицина. Т. VII. Чумаков М.П., editor. 1965. Природный очаг клещевой геморрагической лихорадки в полупустынной зоне Южного Казахстана; pp. 312–314. [Google Scholar]
- Чунихин С.П., Чумаков М.П., Смирнова С.Е., Пак Т.П., Павлович А.Н., Куйма А.У. In: Чумаков М.П., editor. Т. 2. 1969. Биоценотические группировки млекопитающих и иксодовых клещей в очагах крымской геморрагической лихорадки на юге Средней Азии; pp. 156–157. (Арбовирусы (клещевой и японский энцефалиты, геморрагические лихорадки и другие арбовирусные инфекции). Материалы XVI научной сессии института. Москва, РСФСР, СССР: Академия медицинских наук СССР, Институт полиомиелита и вирусных энцефалитов.). [Google Scholar]
- Чунихин С.П., Ротшильд Е.В., Нимадава П., Решетников И.А., Ткаченко Е.А., Дзагурова Т.К. Результаты серологического и вирусологического обследования диких млекоптитающих и птиц Монголии на арбовирусы. Мед. Паразитол. 1987;(3):10–12. [PubMed] [Google Scholar]
- Шапиро С.Е., Баркаган З.С. К истории геморрагической лихорадки в Средней Азии. Вопр. Вирусол. 1960;(2):245–246. [PubMed] [Google Scholar]
- Юсупова Л.О., Мусабаев Э.И., Матназарова Г.С., Шермухамедова Д.А., Мустафаев Х.М., Миркасимова Х.Х., Калугина Л.Г. 2013. Арбовирусы приаральского региона Узбекистана. Биозащита и биобезопасность, V; pp. 16–22. [Google Scholar]
- Яшина Л.Н., Петров В.С., Вышемирский О.И., Аристова В.А., Москвина Т.М., Львов Д.К., Петрова И.Д., Гуторов В.В., Тюнников Г.И., Кузина И.И., Самохвалов Е.И., Серегин С.В.,, Нетесов С.В. Характеристика вируса Крымской-Конго геморрагической лихорадки, циркулирующего в России и республиках Средней Азии. Вопр. Вирусол. 2002;47:11–15. [PubMed] [Google Scholar]
- .اسماعیل بن حسن جرجانی, ذخیره خوارزمشاهی, 1391. ،مؤسسه احیای طب طبیعی، قم، ایران, 253-252
- 阿不力提甫·阿不力孜, 努尔比亚·吾不力阿西木, 塔依尔·吾不力 2003年新疆巴楚县2例新疆出血热病例诊治报告. 地方病通报. 2005;20:103. [Google Scholar]
- 蔡增林, 鲁志新, 胡玲美, 金显涛, 何亦祥 东北部分地区人血清检出新疆出血热病毒抗体. 中国人兽共患病杂志. 1994;13:191. [Google Scholar]
- 蔡增林, 鲁志新, 胡玲美, 金显涛, 何亦祥 东北部份地区人血清检出新疆出血热病毒抗体. 中国人兽共患病杂志. 1994;10:50. [Google Scholar]
- 蔡增琳, 鲁志新, 胡玲美, 金显涛, 何亦祥 东北地区人群中检出基孔肯尼亚及新疆出血热病毒抗体(摘要) 沈阳部队医药. 1994;7:458. [Google Scholar]
- 柴君杰 1968年新疆塔里木河上、中游地区出血热分布调查初报. 地方病通报. 2004;(19卷增刊):34–36. [Google Scholar]
- 柴君杰, 韩砚义, 张雁武 新疆巴楚地区病毒性出血热5例报告. 中华传染病杂志. 1985:257–259. [Google Scholar]
- 柴君杰, 韩砚义, 冯崇慧, 张玉珲, 玉山, 努尔, 刘远恒, 张雁武, 乔永寿, 李华国 1966年新疆巴楚县出血热病研究报告。I. 5例出血热病人的临床观察。地方病通报. 2004;(19卷增刊):1–5. [Google Scholar]
- 柴君杰, 肖成恩, 刘远恒, 张玉珲, 玉山, 努尔, 韩砚义, 冯崇慧, 乔永寿, 李华国 1966年新疆巴楚县出血热病研究报告 Ⅲ. 新疆巴楚出血热流行病学研究。地方病通报. 2004;(19卷增刊):15–22. [Google Scholar]
- 柴君杰, 玉山, 努尔, 冯崇慧, 李华国, 刘捷 1968年新疆巴楚出血热2例报告. 地方病通报. 2004;(19卷增刊):23–25. [Google Scholar]
- 柴君杰, 玉山, 努尔, 冯崇慧, 李华国, 刘捷 1968年新疆巴楚县阿克沙克马拉勒地区出血热疫源地的再观察. 地方病通报. 2004;(19卷增刊):28–30. [Google Scholar]
- 陈化新, 唐家权, 刘蓉晖, 任艺, 王惠民, 拉雅, 陈孝忠, 阿祥, 赵丹生, 毛兴海, 马名录, 王志刚, 道尔吉, 卫东, 冯崇慧, 刘宏斌, 丘福禧 首次从青海省绵羊血清中检出新疆出血热病毒IgG抗体. 中国媒介生物学及控制杂志. 1991;2:267–269. [Google Scholar]
- 戴翔, 木合塔尔, 冯崇慧, 孙素荣, 邰新萍, 王信惠, 布仁明德, 孟卫卫, 阿扎提, 张渝疆 塔里木盆地新疆出血热蜱类及宿主动物感染调查. 中华流行病学杂志. 2006;27:1048–1052. [PubMed] [Google Scholar]
- 邓国藩, 姜在阶 . 科学出版社; 北京, 中国: 1991. 中国经济昆虫志 第39册 蜱螨亚纲 硬蜱科. [Google Scholar]
- 冯崇慧 新疆出血热病毒抗原性的初步分析. 中华流行病学杂志. 1983;4:92–95. [PubMed] [Google Scholar]
- 冯崇慧 新疆维吾尔自治区1966~1990年克里米亚-刚果出血热病毒分离记录. 地方病通报. 2004;(19卷增刊):99–100. [Google Scholar]
- 冯崇慧, 白旭华 新疆准噶尔盆地南缘地区新疆出血热病毒自然疫源地的发现. 地方病通报. 1991;6:52–55. [Google Scholar]
- 冯崇慧, 李凡, 白旭华, 刘振东, 刘宏斌, 张峰 伊犁河谷地区克里米亚-刚果出血热调查. 中国媒介生物学及控制杂志. 1995;6:157. [Google Scholar]
- 冯崇慧, 刘雄飞, 王冬莉, 白旭华, 张晓兵, 刘全民, 刘宏斌, 顾媛, 章建民, 冯崇慧, 刘雄飞, 王冬莉, 白旭华, 张晓兵, 刘全民, 刘宏斌, 顾媛 1988年新疆巴楚地区出血热疫源地监测报告. 地方病通报. 2004;19(卷增刊):84–87. [Google Scholar]
- 付滨, 孟琳,高常柏 从疾病演变史探“伤寒”原义. 河南中医. 2007;27:1–5. [Google Scholar]
- 韩辉, 杨宇, 赵欣, 宋亚京, 徐宝梁 内蒙古口岸蜱类及其自然感染病原体监测. 寄生虫与医学昆虫学报. 2016;23:224–229. [Google Scholar]
- 韩磊, 唐青, 赵秀芹, 西条政幸, 陶晓霞 巴楚县2001年新疆出血热疫情的血清 学证实. 中华流行病学杂志. 2002;23:179–181. [PubMed] [Google Scholar]
- 侯宗柳, 黄文丽, 自登云, 张海林, 施华芳, 龚正达, 米竹青, 雷亚民 云南蜱媒病毒的血清流行病学研究云南蜱媒病毒的血清流行病学研究. 中国媒介生物学及控制杂志. 1992;3:173–176. [Google Scholar]
- 黄好壮, 陈玉本, 冯崇慧, 陈化新, 陈文洲, 邝继深, 王敏, 唐青, 王华, 张永华, 张浩燕 海南省克里米亚─刚果出血热病毒血清抗体检测结果分析. 中国媒介生物学及控制杂志. 1996;7:357–358. [Google Scholar]
- 李烽, 蔡保健, 严玉辰, 孔令雄, 高守一 新疆出血热病毒特性的研究:Ⅲ 新疆出血热病毒的电子显微镜观察. 中华流行病学杂志. 1983;4:135–136. [Google Scholar]
- 李兆育, 邢莉, 蔡增林 东北地区人血清五种虫媒病毒抗体调查. 大连大学学报. 1998;19:61–65. [Google Scholar]
- 刘远恒, 柴君杰, 肖成恩, 李文惠 新疆出血热140例流行病学分析. 地方病通报. 2004;(19卷增刊):47–49。. [Google Scholar]
- 吕新军, 唐青, 冯育明, 郅奇, 王诚, 徐丽宏, 李浩, 付士红, 王环宇, 金鑫, 梁国栋 . vol. 19. 2005. 新疆南部地区蜱传虫媒病毒分子生物学调查。中华实验和临床病毒学杂志; pp. 325–330。. [PubMed] [Google Scholar]
- 祁继深, 陈玉本, 吴纪经, 王敏, 陈文洲, 冯崇慧, 陈化新 海南省首次从牛血清检出克里米亚-刚果出血热病毒IgG抗体. 中国媒介生物学及控制杂志. 1995;6:158. [Google Scholar]
- 任次早, 王以根, 刘红, 罗兆庄 安徽省首次发现人群感染克里米亚—刚果出血热初报. 安徽预防医学杂志. 1995;8:32–33. [Google Scholar]
- 邵锡如, 拉雅, 薛伟建, 成鹰, 汪孝元, 王建青, 张晶, 覆春花 青海省查出新疆出血热自然疫源地. 青海医药杂志. 1995;25:1–2. [Google Scholar]
- 唐青, Prehaud C., Bouloy M., 冯崇慧, 赵秀芹, 陈化新,杨为松 新疆出血热病毒S基因片段的测序和分析. 中华微生物学和免疫学杂志. 1999;19:461–465. [Google Scholar]
- 唐青, 赵秀芹, 王环宇, 司马义巴吾东, 张玉贞, Saijo M., Morikawa S., 梁国栋, Kurane I. 新疆出血热病毒分子流行病学研究. 中华实验和临床病毒学杂志. 2005;19:312–318. [PubMed] [Google Scholar]
- 屠云人, 张佳珂, 阎侗有, 张灵麟, 金兆伟, 刘学成, 赖文红, 张尚贵 四川省新疆出血热血清流行病学研究. 中国媒介生物学及控制杂志. 1992;3:381–383. [Google Scholar]
- 新疆维吾尔自治区卫生防疫站 . 1975. 新疆出血热资料汇编, 乌鲁木齐市, 新疆维吾尔自治区, 中华人民共和国。. [Google Scholar]
- 严玉辰, 孔令雄, 蔡保健, 李烽, 张玉琴, 高守一 新疆出血热病毒特性的研究:Ⅱ 新疆出血热病毒的物理化学性质. 中华流行病学杂志. 1983;4:132–134. [Google Scholar]
- 严玉辰, 张玉琴, 孔令雄, 陈化新, 高守一 新疆出血热病毒特性的研究:Ⅰ 新疆出血热与克里米亚—刚果出血热病毒之间血清学关系的研究. 中华流行病学杂志. 1983;4:129–131. [Google Scholar]
- 杨宇, 高艳菲, 曹旸, 王静, 邓华, 王建成, 陈雪松, 刘丽娟, 徐宝梁 内蒙古满洲里口岸地区2012-2014年蜱携带病原体调查. 中国媒介生物学及控制杂志. 2018;29:147–150. [Google Scholar]
- 张婷, 牛俊奇, 姜艳芳, 王峰 吉林省新疆出血热病毒感染的临床研究. 中华实验和临床病毒学杂志. 2007;1:158–160. [Google Scholar]