Abstract
目的
增生性瘢痕是临床上最常见的病理性瘢痕,在其形成过程中,血管生成相关因子呈现出动态表达。现代研究发现Notch信号通路对于维持血管内皮细胞和血管网的构建与重塑有着极其重要的作用,而Notch信号通路与血管生成的相关性在增生性瘢痕中的研究鲜有报道。本研究旨在探讨增生性瘢痕模型中Notch信号通路与血管生成因子表达的相关性。
方法
将81只Sprague Dawley大鼠(SPF级)随机分成空白对照组、模型组和阻滞剂组。其中阻滞剂组采用恒温恒压电热烫伤仪,在75 ℃条件下,将一个直径为2 cm的圆形烫伤头置于大鼠背部10 s,造成大鼠深II°烧伤,待烧伤皮肤自然愈合(21~23 d上皮化)后得到增生性瘢痕模型大鼠,在造模后第1、3、5、7和14天5个时间点用注射器从瘢痕周围正常皮肤进针,在瘢痕基底局部按2 mg/kg注射0.1 mL γ-分泌酶阻滞剂的稀释液。模型组在造模后同法注射等量生理盐水;空白对照组不造模,用同法注射等量生理盐水。每组分别在第21、28、35天3个时间点随机选取9只大鼠采用空气栓塞法处死。采用免疫组织化学法检测I型胶原蛋白(collagen type I,COL-I)、III型胶原蛋白(collagen type III,COL-III)的蛋白质表达;采用蛋白质印迹法检测血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素1(angiopoietin 1,Ang1)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)的蛋白质表达。
结果
免疫组织化学结果显示:在第21、28、35天3个时间点,与空白对照组比较,模型组COL-I、COL-III的蛋白质表达上调(均P<0.05);与模型组相比,阻滞剂组COL-I、COL-III的蛋白质表达下降(均P<0.05)。蛋白质印迹法结果显示:在第21、28、35天3个时间点,与空白对照组相比,模型组VEGF、Ang1、TGF-β1、MMP-2的蛋白质表达量均显著升高(均P<0.05);除第21天外,在第28、35天阻滞剂组VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量低于模型组(均P<0.05)。
结论
在Sprague Dawley大鼠增生性瘢痕模型中,抑制Notch信号通路可以减弱COL-I、COL-III的表达,减轻创面瘢痕增生,下调VEGF、Ang1、TGF-β1、MMP-2的表达,抑制血管新生。可见在增生性瘢痕的形成过程中,血管生成相关因子的表达出现上调;当抑制Notch信号通路后,上调的血管生成因子出现下降趋势,增生性瘢痕的情况也得到缓解。说明Notch信号通路可能通过调控血管生成因子的表达来影响增生性瘢痕的形成。
Keywords: 增生性瘢痕, Notch信号通路, 血管生成
Abstract
Objective
Hypertrophic scar (HS) is the most common pathological scar in clinical practice. During its formation, angiogenesis-related factors show dynamic expression. Modern studies have found that Notch signaling pathway has an extremely important role in maintaining the construction and remodeling of vascular endothelial cells and vascular network. The correlation between Notch signaling pathway and angiogenesis in hypertrophic scar has been rarely reported. This study aims to investigate correlation between Notch signaling pathway and the expression of angiogenic factors in a proliferative scar model.
Methods
A total of 81 Sprague Dawley rats (SPF grade) were randomly assigned into a blank control group, a model group, and a blocker group. In the blocker group, a 2 cm diameter circular scald head was placed on the back of the rats for 10 s at 75 ℃ by using a constant temperature and pressure electrothermal scalding apparatus to form a rat deep II° burn model, and a hyperplastic scar model rat was obtained after natural healing of the wound skin (21 to 23 day epithelialization). A syringe was used to inject a needle from the normal skin around the scar at the 1st, 3rd, 5th, 7th, and 14th days after modeling. The γ-secretase inhibitor was injected locally at 2 mg/kg in a dilution of 0.1 mL at the base of the scar. The rats in the model group was injected with the same amount of saline after modeling; the rats in the blank control group was injected with the same amount of saline. Nine rats in each group was randomly killed by air embolization at the 21st, 28th, and 35th days, respectively. The protein expressions of collagen type I (COL-I) and collagen type III (COL-III) were detected by immunohistochemistry. The protein expressions of vascular endothelial growth factor (VEGF), angiopoietin 1 (Ang1), transforming growth factor-β1 (TGF-β1), and matrix metalloproteinase-2 (MMP-2) were detected by Western blotting.
Results
Immunohistochemical results showed that, at the 21st,28th, and 35th days, the protein expressions of COL-I and COL-III in the model group were up-regulated compared with the blank control group (all P<0.05) and the protein expressions of COL-I and COL-III in the blocker group were decreased compared with the model group (all P<0.05). Western blotting showed that, at the 21st, 28th, and 35th days, the protein expressions of VEGF, Ang1, TGF-β1, and MMP-2 in the model group were significantly higher than those in the blank control group (all P<0.05). Except for the 21st day, the protein expressions of VEGF, Ang1, TGF-β1, and MMP-2 in the blocker group were lower than those in the model group at the 28th and 35th days (all P<0.05).
Conclusion
In the Sprague Dawley rat proliferative scar model, inhibition of Notch signaling pathway could attenuate the expressions of COL-I and COL-III, reduce traumatic scar proliferation, down-regulate the expressions of VEGF, Ang1, TGF-β1, and MMP-2, and inhibit angiogenesis. The expressions of angiogenesis-related factors appeare to be up-regulated during the formation of proliferative scar. When the Notch signaling pathway is inhibited, the up-regulated angiogenic factors show a decreasing trend and the proliferative scar is alleviated, which suggests that Notch signaling pathway may affect the formation of hyperplastic scar by regulating the expression of angiogenic factors.
Keywords: hypertrophic scar, Notch signaling pathway, angiogenesis
增生性瘢痕是一种真皮纤维增生性疾病,主要是由于烧伤后组织过度再生和细胞外基质过度沉积所导致,伴有疼痛与瘙痒等不适,同时伴有不同程度的外观损害和功能障碍,对患者的生活、工作质量及社会交往均造成影响。近年已经证实,不管是在皮肤创面愈合还是在瘢痕形成的过程中,血管生成相关因子均呈现出动态表达的趋势[1]。Notch信号通路在血管生成过程中具有维持血管内皮细胞及促进血管网的构建和重塑等功能。有较多研究[2-5]表明Notch信号通路在抗肿瘤、抗纤维化等方面与血管生成相关,但在增生性瘢痕中的研究鲜有报道。本实验以Sprague Dawley (SD)大鼠深II°烧伤增生性瘢痕模型为研究对象,采用免疫组织化学(以下简称免疫组化)法检测I型胶原蛋白(collagen type I,COL-I)、III型胶原蛋白(collagen type III,COL-III)的蛋白质表达,采用蛋白质印迹法检测血管生成相关因子血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素(angiopoietin,Ang)1、转化生长因子-β1(transforming growth factor-β1,TGF-β1)及基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)的蛋白质表达,旨在探讨增生性瘢痕中Notch信号通路与血管生成因子表达的相关性。
1. 材料与方法
1.1. 动物与试剂
选取体重为180~220 g的无特定病原体(special pathogen free,SPF)级SD大鼠,雌雄不限,由湖南中医药大学SPF级动物实验室提供[环境许可证号:SYXK(湘)2013-0005]。3,5-二氟苯乙酰-L-丙氨酰-S-苯基甘氨酸t-丁酯{N-[N-(3,5-dil uorophenacetyl)-L-alanyl]-S-phenylglycine t-butyl ester,DAPT}是一种γ-分泌酶阻滞剂(gamma-secretase inhibitor,GSI),购自美国 Selleck公司;二甲基亚砜(DMSO)购自美国 Sigma公司;鼠抗多克隆Ⅰ、Ⅲ型胶原抗体,小鼠抗VEGF单克隆抗体,山羊抗Ang1多克隆抗体,小鼠抗TGF-β1单克隆抗体,小鼠抗MMP-2单克隆抗体及DAB显色试剂盒均购于北京中杉金桥生物技术有限公司;β-actin多克隆抗体购于北京博奥森生物技术有限公司;ECL化学发光检测试剂盒购于美国博士德生物工程有限公司;全蛋白质抽提试剂盒购于北京金匙医疗科技有限公司;BCA蛋白定量试剂盒购于北京索来宝科技有限公司。
1.2. 仪器
Motic BA410研究型显微镜(型号:BA410)和数码医学图像分析系统(型号:Motic Medical 6.0)为加拿大麦克奥迪公司产品。
1.3. 动物模型的建立
首先用备皮刀将大鼠背部皮肤剃毛,再用8% Na2S溶液脱毛,然后用清水冲洗干净,肉眼观察无局部损伤。画出待烧面积(待烧面积:根据体重计算出大鼠的总表面积乘以待烧面积的百分比);采用3%戊巴比妥钠(用量为30 mg/kg)麻醉大鼠;大鼠体位为俯卧位,将四肢用4号丝线分别固定于手术台两侧。采用恒温恒压电热烫伤仪,在75 ℃条件下,将一个直径为2 cm的圆形烫伤头置于大鼠背部10 s,造成大鼠深II°烧伤。待烧伤皮肤自然愈合(21~23 d上皮化)后行病理检查以证实SD大鼠深II°烧伤增生性瘢痕模型成功建立。本研究已获得湖南中医药大学第一附属医院医学伦理委员会批准(审批号:HN-LL-GZR-202001)。
1.4. 分组及干预方法
按照随机分组方法,将81只SD大鼠分成空白对照组、模型组、阻滞剂组,每组27只。空白对照组不进行造模,分别在第1、3、5、7和14天5个时间点用注射器从相同部位正常皮肤进针,局部注射 0.1 mL的等量生理盐水。模型组在造模后,分别在第1、3、5、7和14天5个时间点用注射器从瘢痕周围正常皮肤进针,并在瘢痕基底局部注射0.1 mL的等量生理盐水。阻滞剂组在造模后,分别在第1、3、5、7和14天5个时间点用注射器从瘢痕周围正常皮肤进针,并在瘢痕基底局部注射含有2 mg/kg DAPT的0.1 mL等量稀释液。每组分别在第21、28、35天3个时间点随机选取9只大鼠采用空气栓塞法处死。
1.5. 指标检测
1.5.1. 免疫组织化学法检测COL-I和COL-III的蛋白质表达
取增生性瘢痕组织切片采用常规方法脱蜡至水;用3% H2O2在室温下孵育10 min以灭活内源性过氧化物酶。添加一抗(1꞉100)于室温下孵育1~2 h;加入正常山羊血清封闭液封闭约20 min。丢弃剩余液体,滴加一抗,于4 ℃下过夜。加入生物标记二抗,于室温下孵育20~30 min;用显色剂(DAB溶液)显色5~ 10 min。当出现明显棕黄色时,停止反应;用自来水反复洗涤约10 min;以苏木精复染、梯度乙醇脱水、透明、封固;在生物显微镜下观察与摄取图像。同时设置PBS代替一抗作为阴性对照。每张切片在光学显微镜下观察,共取4个视野。利用Motic 6.0医学图像分析软件对每个视野阳性细胞的积分光密度值(integrated optical density,IOD)和目标分布区域面积进行测量与分析,平均光密度(average optical density,AOD)=IOD/面积。AOD值越高说明蛋白质表达量越高。
1.5.2. 蛋白质印迹法检测VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达
将瘢痕组织用干净的剪刀尽量剪碎,经匀浆、离心后提取上清液,采用BCA蛋白定量试剂盒测定蛋白质浓度。按照说明书要求配置浓缩胶及分离胶,进行蛋白质电泳后采用半干转印法将蛋白质转至PVDF膜上,用5%脱脂奶粉封闭,加一抗(1꞉500)于4 ℃下孵育,加二抗(1꞉1 000)于室温下孵育,用TBST漂洗后显影并曝光。用EPSON扫描仪扫描胶片,将图像输入计算机,并用Image J 软件检测与分析目标条带的蛋白质灰度值,同时设置β-actin为内参照。
1.6. 统计学处理
利用SPSS 20.0统计学软件进行数据分析。对计量资料采用均数±标准差( ±s)描述,符合正态分布和方差齐性的数据采用完全随机设计的多样本单因素方差分析。P<0.05为差异有统计学意义。
2. 结 果
2.1. 各组不同时间点增生性瘢痕组织COL-I和COL-III的蛋白质表达比较
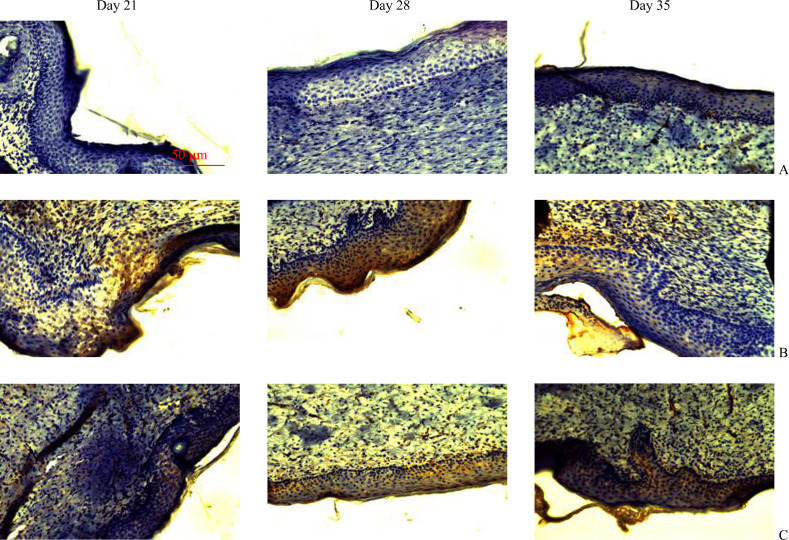
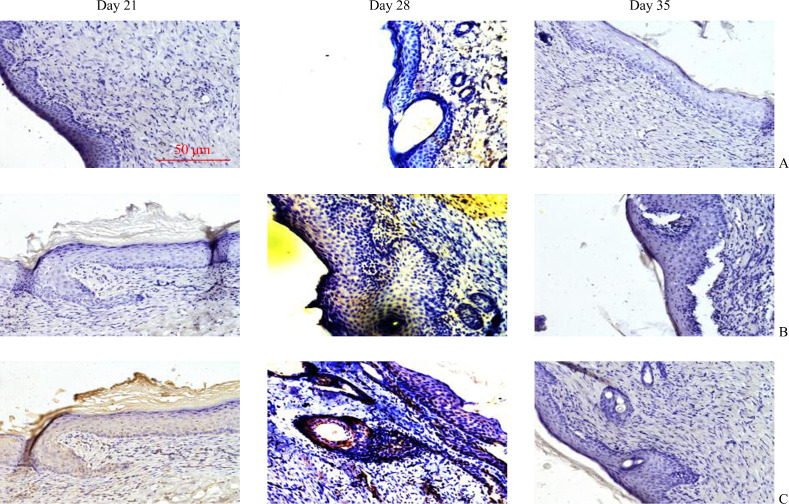
免疫组织化学结果显示:随着观察时间的推移,模型组COL-I和COL-III的蛋白质表达逐渐升高;阻滞剂组COL-I和COL-III的蛋白质表达逐渐降低(表1,图1,2)。模型组各个时间点的COL-I和COL-III蛋白质表达均高于空白对照组(均P<0.05);阻滞剂组各时间点的COL-I和COL-III蛋白质表达均低于模型组(均P<0.05)。
表1.
各组不同时间点COL-I和COL-III蛋白质表达的比较(n=9)
Table 1 Comparison of COL-I and COL-III protein expression in each group at different time points (n=9)
| Group | COL-I | COL-III | ||||
|---|---|---|---|---|---|---|
| Day 21 | Day 28 | Day 35 | Day 21 | Day 28 | Day 35 | |
| Blank control | 0.590±0.042 | 0.592±0.045 | 0.591±0.030 | 0.799±0.051 | 0.804±0.057 | 0.803±0.044 |
| Model | 0.740±0.059* | 0.742±0.069* | 0.747±0.063* | 1.908±0.214* | 1.918±0.158* | 1.965±0.225* |
| Blocker | 0.717±0.068† | 0.705±0.054† | 0.685±0.058† | 1.019±0.126† | 0.995±0.120† | 0.939±0.066† |
*P<0.05 vs the blank control group; †P<0.05 vs the model group.
图1.
各组COL-I在不同时间点的表达
Figure 1 Expression of COL-I at different time points in each group
A: Blank control group; B: Model group; C: Blocker group.
图2.
各组COL-III在不同时间点的表达
Figure 2 Expression of COL-III at different time points in each group
A: Blank control group; B: Model group; C: Blocker group.
2.2. 各组不同时间点增生性瘢痕组织VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达
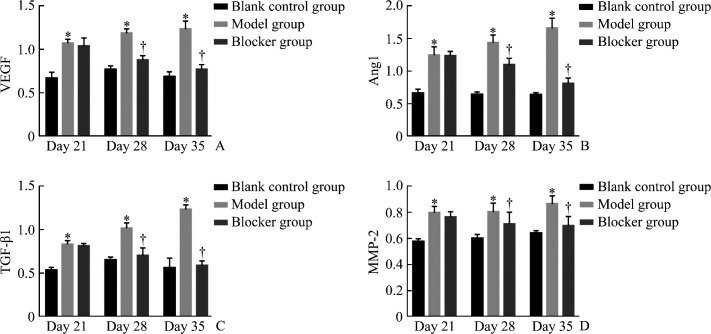
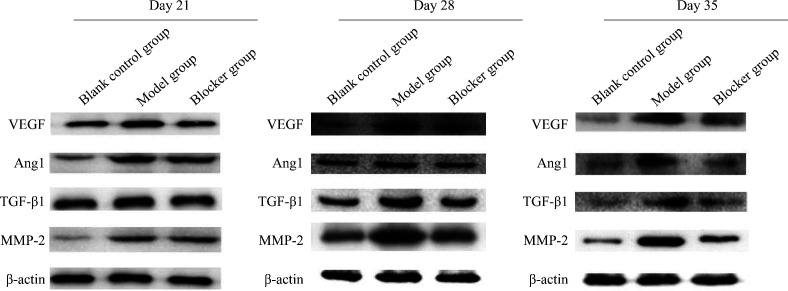
蛋白质印迹法结果显示:随着观察时间的推移,模型组VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量逐渐升高;阻滞剂组VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量逐渐降低(图3,4)。同时间点模型组VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量均高于空白对照组(均P<0.05);除第21天外,第28、35天阻滞剂组VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量均低于模型组(均P<0.05)。
图3.
各组VEGF(A)、Ang1(B)、TGF-β1(C)及MMP-2(D)在不同时间点的蛋白质相对表达量
Figure 3 Protein relative expression levels of VEGF (A), Ang1 (B), TGF-β1 (C), and MMP-2 (D) at different time points in each group
*P<0.05 vs the blank control group; †P<0.05 vs the model group.
图4.
蛋白质印迹法检测各组不同时间点VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达
Figure 4 Protein expression of VEGF, Ang1, TGF-β1, and MMP-2 at different time points in each group detected by Western blotting
3. 讨 论
瘢痕是皮肤烧伤后最常见的并发症之一,增生性瘢痕是临床上最常见的病理性瘢痕,烧伤后增生性瘢痕的发生率为91%[6]。过度的血管生成对创面愈合产生不良影响,导致瘢痕形成[7]。VEGF参与包括血管内皮细胞增殖、存活及血管新生等血管生成的几乎所有步骤[8]。VEGF在增生期瘢痕中呈高表达,抗VEGF治疗可显著减少血管生成,降低增生性瘢痕形成的概率[9]。继VEGF后,Ang是调节血管生长和保持血管稳定性的另一个重要因子。研究[10]发现在早期瘢痕中VEGF、Ang1、Ang2及Tie-2的表达显著升高,表明Ang/Tie-2系统促进创伤的正常愈合和瘢痕形成。TGF-β1具有多种生物学作用,它不仅有助于伤口的正常愈合,而且与多种纤维化疾病和增生性瘢痕有关。研究[11]发现与正常皮肤组织相比,增生性瘢痕中TGF-β1的mRNA呈高表达,提示TGF-β1可促进增生性瘢痕的形成。在增生性瘢痕形成的过程中起关键作用的是细胞外基质。MMP-2的活性能够促进增生性瘢痕成纤维细胞的迁移能力[12]。本研究结果显示:在增生性瘢痕形成过程中,模型组VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量高于空白对照组,COL-I和COL-III的蛋白质表达量也较空白对照组升高;经Notch信号通路抑制剂DAPT阻滞后,VEGF、Ang1、TGF-β1及MMP-2的蛋白质表达量下降,COL-I和COL-III的蛋白质表达量也随之下降。表明VEGF、Ang1、TGF-β1及MMP-2等血管生成相关因子的表达下调可以缓解增生性瘢痕的程度。
Notch信号通路在生理和病理环境中对血管的生成和血管内稳态的维持起重要作用。既往研究[13]表明调控Notch信号通路能够调控血管内皮细胞血管生成因子的表达,促进血管生成。Jagged1、Dll-1、Dll-4、Notch1以及Notch4等均在血管内皮细胞中表达。Jagged1是正常血管生成的关键调节因子[14],在血管形成过程中广泛表达于内皮细胞上,尤其在顶端细胞,它能通过直接传递Jagged1-Notch信号给顶端细胞来调节VEGF-R3的表达,以促进血管生成。通过截断Jagged1/Jagged2介导的Notch信号通路,可达到抑制肿瘤血管生成的目的[15]。Notch1受体是血管系统中最重要的Notch受体,其在协调血管生成中的关键作用已被广泛认识。CRISPR/Cas9介导的Notch1敲除能抑制多形性胶质母细胞瘤细胞的增殖和新生血管形成[16]。同时,Notch信号的病理激活可导致增生性瘢痕和纤维化疾病的发病[17-19]。通过敲除Jagged1抑制Notch信号转导通路,可使瘢痕成纤维细胞的增殖、迁移和侵袭能力降低[20]。最近有研究[21]表明:采用DAPT阻断Notch信号后,成纤维细胞的增殖能力明显降低,同时角质细胞生长因子、TGF-β1的合成能力亦明显降低。本研究结果显示:与模型组相比,使用DAPT抑制Notch信号通路后,阻滞剂组血管生成相关因子的蛋白质表达也受到抑制,瘢痕增生较模型组缓解。说明Notch信号通路对增生性瘢痕形成中的血管新生具有重要影响,Notch信号通路可通过调控血管生成因子的表达来影响增生性瘢痕的形成。
综上所述,本研究初步证实在增生性瘢痕中Notch信号通路与血管生成具有相关性。但由于Notch信号通路是一个在进化过程中高度保守的信号通路,本研究仅选取了部分血管生成相关因子进行初步探索,不能较为全面地阐释二者之间的关系,其具体作用机制还有待深入研究。
欢迎订阅2022年《中南大学学报(医学版)》
《中南大学学报(医学版)》原名《湖南医科大学学报》,创刊于1958年,为教育部主管、中南大学主办的医药卫生类综合性学术期刊。该刊已被美国医学文献分析和联机检索系统(Medline, PubMed)及其《医学索引》(IM)、荷兰《医学文摘》(EM)、Scopus、WHO西太平洋地区医学索引(WPRIM)、中国科学引文数据库(核心库) (CSCD),《WJCI报告》等国内外多家重要数据库和权威文摘期刊收录;是中国科技论文统计源期刊、中文核心期刊及中国期刊方阵“双效”期刊;为中国高校百佳科技期刊、中国精品科技期刊、RCCSE中国权威学术期刊(A+)和湖南省十佳科技期刊。
本刊为月刊,国际标准开本(A4幅面),每月月末出版。内芯采用进口亚光铜版纸印刷,图片彩色印刷。定价45元/册,全年540元。国内外公开发行。国内统一连续出版物号:CN 43-1427/R;国际标准连续出版物号:ISSN 1672-7347;国内邮发代号:42-10,国外邮发代号:BM422;欢迎新老用户向当地邮局(所)订阅,漏订或需增订者也可直接与本刊编辑部联系订阅。
欢迎投稿 欢迎订阅 地址: 湖南省长沙市湘雅路110号湘雅医学院75号信箱 邮编:410078
电话: 0731-84805495, 0731-84805496 Email: xbyxb@csu.edu.cn, xyxb2005@vip.163.com, xyxb2005@126.com
Http://xbyxb.csu.edu.cn
《中南大学学报(医学版)》编辑部
基金资助
国家自然科学基金(81473680);湖南省卫生健康委员会课题(20200667);湖南省教育厅科学研究项目(19C1428);湖南省高等学校“双一流”学科建设项目(湘教通[2018]469号)。
This work was supported by the National Natural Science Foundation (81473680), the Project of Hunan Provincial Health Commission (20200667), the Scientific Research Fund of Hunan Provincial Education Department (19C1428), and Hunan Provincial “Double First-class” Discipline Construction Project of Colleges and Universities (2018-469), China.
利益冲突声明
作者声称无任何利益冲突。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2021111195.pdf
参考文献
- 1. Wietecha MS, DiPietro LA. Therapeutic approaches to the regulation of wound angiogenesis[J]. Adv Wound Care (New Rochelle), 2013, 2(3): 81-86. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Huang QF, Li JH, Zheng JH, et al. The carcinogenic role of the Notch signaling pathway in the development of hepatocellular carcinoma[J]. J Cancer, 2019, 10(6): 1570-1579. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Tetzlaff F, Adam MG, Feldner A, et al. MPDZ promotes DLL4-induced Notch signaling during angiogenesis[J]. eLife, 2018, 7: e32860. [2021-04-10]. 10.7554/eLife.32860.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Kida Y, Zullo JA, Goligorsky MS. Endothelial sirtuin 1 inactivation enhances capillary rarefaction and fibrosis following kidney injury through Notch activation[J]. Biochem Biophys Res Commun, 2016, 478(3): 1074-1079. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Hu B, Phan SH. Notch in fibrosis and as a target of anti-fibrotic therapy[J]. Pharmacol Res, 2016, 108: 57-64. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Rathor N, Zhuang R, Wang JY, et al. Src-mediated caveolin-1 phosphorylation regulates intestinal epithelial restitution by altering Ca2+ influx after wounding[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 306(8): G650-G658. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. DiPietro LA. Angiogenesis and scar formation in healing wounds[J]. Curr Opin Rheumatol, 2013, 25(1): 87-91. [DOI] [PubMed] [Google Scholar]
- 8. Ferrara N. Vascular endothelial growth factor: basic science and clinical progress[J]. Endocr Rev, 2004, 25(4): 581-611. [DOI] [PubMed] [Google Scholar]
- 9. Kwak DH, Bae TH, Kim WS, et al. Anti-vascular endothelial growth factor (bevacizumab) therapy reduces hypertrophic scar formation in a rabbit ear wounding model[J]. Arch Plast Surg, 2016, 43(6): 491-497. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Staton CA, Valluru M, Hoh L, et al. Angiopoietin-1, angiopoietin-2 and Tie-2 receptor expression in human dermal wound repair and scarring[J]. Br J Dermatol, 2010, 163(5): 920-927. [DOI] [PubMed] [Google Scholar]
- 11. Qian W, Li N, Cao Q, et al. Thrombospondin-4 critically controls transforming growth factor β1 induced hypertrophic scar formation[J]. J Cell Physiol, 2018, 234(1): 731-739. [DOI] [PubMed] [Google Scholar]
- 12. Lee WJ, Ahn HM, Roh H, et al. Decorin-expressing adenovirus decreases collagen synthesis and upregulates MMP expression in keloid fibroblasts and keloid spheroids[J]. Exp Dermatol, 2015, 24(8): 591-597. [DOI] [PubMed] [Google Scholar]
- 13. Ran QS, Yu YH, Fu XH, et al. Activation of the Notch signaling pathway promotes neurovascular repair after traumatic brain injury[J]. Neural Regen Res, 2015, 10(8): 1258-1264. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14. Deng S, Zeng YQ, Wu LQ, et al. The regulatory roles of VEGF-Notch signaling pathway on aplastic anemia with kidney deficiency and blood stasis[J]. J Cell Biochem, 2019, 120(2): 2078-2089. [DOI] [PubMed] [Google Scholar]
- 15. Kangsamaksin T, Murtomaki A, Kofler NM, et al. NOTCH decoys that selectively block DLL/NOTCH or JAG/NOTCH disrupt angiogenesis by unique mechanisms to inhibit tumor growth[J]. Cancer Discov, 2015, 5(2): 182-197. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Han N, Hu GY, Shi L, et al. Notch1 ablation radiosensitizes glioblastoma cells[J]. Oncotarget, 2017, 8(50): 88059-88068. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. He T, Bai X, Jing J, et al. Notch signal deficiency alleviates hypertrophic scar formation after wound healing through the inhibition of inflammation[J]. Arch Biochem Biophys, 2020, 682: 108286. [DOI] [PubMed] [Google Scholar]
- 18. Wang P, Shu B, Xu YB, et al. Basic fibroblast growth factor reduces scar by inhibiting the differentiation of epidermal stem cells to myofibroblasts via the Notch1/Jagged1 pathway[J]. Stem Cell Res Ther, 2017, 8(1): 114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Jiang YL, Wang YY, Ma PF, et al. Myeloid-specific targeting of Notch ameliorates murine renal fibrosis via reduced infiltration and activation of bone marrow-derived macrophage[J]. Protein Cell, 2019, 10(3): 196-210. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Syed F, Bayat A. Notch signaling pathway in keloid disease: enhanced fibroblast activity in a Jagged-1 peptide-dependent manner in lesional vs. extralesional fibroblasts[J]. Wound Repair Regen, 2012, 20(5): 688-706. [DOI] [PubMed] [Google Scholar]
- 21. 楚菲菲, 王大雷, 闫伦, 等. 阻断Notch信号的角质形成细胞对成纤维细胞增殖及分泌功能的影响研究[J]. 中国美容医学, 2018, 27(8): 73-77. [Google Scholar]; CHU Feifei, WANG Dalei, YAN Lun, et al. Differences of cell proliferation and secretion in fibroblasts co-culture with Notch signaling occured keratinocytes[J]. Chinese Journal of Aesthetic Medicine, 2018, 27(8): 73-77. [Google Scholar]