Abstract
目的
奥氮平是最常用第2代抗精神病药,若长期服用会显著增加发生非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的风险,但其发病机制不明。肝内脂肪过度沉积是NAFLD的病理基础,且与肝内TG代谢障碍密切相关。载脂蛋白A5(apolipoprotein A5,ApoA5)是体内TG代谢的关键调节因子,促进肝细胞内TG蓄积,参与NAFLD发病。然而,奥氮平是否通过ApoA5诱发NAFLD尚无报道。本研究探讨ApoA5是否参与奥氮平相关NAFLD的发病。
方法
从动物实验、细胞实验及ApoA5基因敲低实验3个层次上进行探讨。将6周龄雄性C57BL/6J小鼠随机分为对照组、低剂量组、高剂量组,分别给予10% DMSO、3 mg/(kg·d)奥氮平、6 mg/(kg·d)奥氮平。干预8周后,测定各组小鼠的血脂4项、肝转氨酶2项和ApoA5水平。HepG2细胞分为对照组、低剂量组、中剂量组、高剂量组,分别给予0.1% DMSO、25 μmol/L奥氮平、50 μmol/L奥氮平、100 μmol/L奥氮平干预24 h。对100 μmol/L奥氮平预处理的HepG2细胞分别转染ApoA5 siRNA或scrambled siRNA(阴性对照)。采用油红O染色观察肝组织和肝细胞中的脂滴;HE染色观察肝组织脂质沉积情况;实时PCR检测ApoA5 mRNA表达水平;蛋白质印迹法检测ApoA5蛋白质表达水平。
结果
3或6 mg/(kg·d)的奥氮平干预后,各组小鼠体重差异无统计学意义(P>0.05),血浆TG、ALT和AST水平呈剂量依赖性升高,血浆ApoA5水平呈剂量依赖性降低(均P<0.05);但各组小鼠血浆胆固醇(HDL-C、LDL-C、TC)水平差异均无统计学意义(均P>0.05)。肝组织中ApoA5蛋白质水平呈剂量依赖性升高(均P<0.05),但各组ApoA5 mRNA表达差异无统计学意义(P>0.05)。对照组小鼠肝组织结构完整,肝细胞形态规则,细胞内仅见少量散在脂滴;给予3或6 mg/(kg·d)奥氮平的小鼠肝细胞内可见大量脂肪沉积,细胞呈气球样变,充盈着大量的脂滴空泡,细胞核位于细胞边缘,红色脂滴数量明显增多,且高剂量组更明显。25、50、100 μmol/L的奥氮平干预HepG2细胞24 h后,细胞内脂滴数量明显增多和体积明显增大,且给药剂量越高变化越明显;细胞中ApoA5蛋白质水平呈剂量依赖性升高(P<0.05),但各组ApoA5 mRNA表达差异无统计学意义(P>0.05)。与转染scrambled siRNA的HepG2细胞相比,转染ApoA5 siRNA的HepG2细胞内脂滴的数量明显减少,体积明显缩小。
结论
奥氮平短期干预,虽不显著增加小鼠体重,但可直接诱发高TG血症和NAFLD;奥氮平通过抑制肝脏ApoA5分泌(但不影响肝脏ApoA5合成),诱导NAFLD发病,提示ApoA5分泌障碍是奥氮平相关NAFLD发病的关键机制及干预靶点。
Keywords: 奥氮平, 载脂蛋白A5, 非酒精性脂肪性肝病, 三酰甘油
Abstract
Objective
Long-term treatment of olanzapine, the most widely-prescribed second-generation antipsychotic, remarkably increases the risk of non-alcoholic fatty liver disease (NAFLD), whereas the mechanism for olanzapine-induced NAFLD remains unknown. Excessive hepatic fat accumulation is the basis for the pathogenesis of NAFLD, which results from the disturbance of TG metabolism in the liver. Apolipoprotein A5 (ApoA5) is a key regulator for TG metabolism in vivo that promotes TG accumulation in hepatocytes, thereby resulting in the development of NAFLD. However, there are no data indicating the role of apoA5 in olanzapine-induced NAFLD. Therefore, this study aims to investigate the role of apoA5 in olanzapine-induced NAFLD.
Methods
This study was carried out via animal studies, cell experiment, and ApoA5 gene knockdown experiment. Six-week-old male C57BL/6J mice were randomized into a control group, a low-dose group, and a high-dose group, which were treated by 10% DMSO, 3 mg/(kg·d) olanzapine, and 6 mg/(kg·d) olanzapine, respectively for 8 weeks. The lipid levels in plasma, liver function indexes, and expression levels of ApoA5 were detected. HepG2 cells were treated with 0.1% DMSO (control group), 25 μmol/L olanzapine (low-dose group), 50 μmol/L olanzapine (medium-dose group), and 100 μmol/L olanzapine (high-dose group) for 24 h. HepG2 cells pretreated with 100 μmol/L olanzapine were transfected with siRNA and scrambled siRNA (negative control), respectively. We observed the changes in lipid droplets within liver tissues and cells using oil red O staining and fat deposition in liver tissues using HE staining. The mRNA and protein levels of ApoA5 were determined by real-time PCR and Western blotting, respectively.
Results
After intervention with 3 and 6 mg/(kg·d) olanzapine for 8 weeks, there was no significant difference in body weight among the 3 groups (P>0.05). Olanzapine dose-dependently increased the plasma TG, ALT and AST levels, and reduced plasma ApoA5 levels (all P<0.05), whereas there was no significant difference in plasma cholesterol (HDL-C, LDL-C, and TC) levels among the 3 groups (all P>0.05). Olanzapine dose-dependently up-regulated ApoA5 protein levels in liver tissues (all P<0.05), but there was no significant change in ApoA5 mRNA expression among groups (P>0.05). In the control group, the structure of liver tissues was intact, the morphology of liver cells was regular, and only a few scattered lipid droplets were found in the cells. In the olanzapine-treated group, there was a large amount of lipid deposition in hepatocytes, and cells were balloon-like and filled with lipid droplet vacuoles. The nucleus located at the edge of cell, and the number of lipid droplets was increased significantly, especially in the high-dose group. Likewise, when HepG2 cells were treated with olanzapine for 24 h, the number and size of lipid droplets were significantly elevated in a dose-dependent manner. Moreover, olanzapine dose-dependently up-regulated ApoA5 protein levels in HepG2 cells (all P<0.05), but there was no significant difference in ApoA5 mRNA expression among groups (P>0.05). Compared with the HepG2 cells transfected with scrambled siRNA, the number and size of lipid droplets in HepG2 cells transfected with ApoA5 siRNA were significantly reduced.
Conclusion
The short-term intervention of olanzapine does not significantly increase body weight of mice, but it can directly induce hypertriglyceridemia and NAFLD in mice. Olanzapine inhibits hepatic apoA5 secretion but does not affect hepatic apoA5 synthesis, resulting in the pathogenesis of NAFLD. Inhibition of apoA5 secretion plays a key role in the development of olanzapine-related NAFLD, which may serve as an intervention target for this disease.
Keywords: olanzapine, apolipoprotein A5, non-alcoholic fatty liver disease, triglycerides
精神分裂症是一种严重的精神疾病,其治疗手段主要是抗精神病药。第2代抗精神病药因具有作用谱广、锥体外系反应少等优点,已基本取代第1代抗精神病药,成为治疗精神分裂症的首选药物。然而,患者服用第2代抗精神病药尤其是奥氮平后,普遍存在脂代谢异常,突出表现为TG代谢紊乱、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)发病风险显著增加[1]。NAFLD是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性脂肪肝、酒精性脂肪性肝炎、肝硬化和肝细胞癌[2]。NAFLD是全球最常见慢性肝病,也是中国第一大慢性肝病。该病可使其他慢性肝病恶化,严重者导致肝硬化失代偿、肝细胞癌或移植肝复发,还可增加发生2型糖尿病和心血管病的风险[3]。药物是NAFLD的重要诱因,而奥氮平是导致NAFLD的主要药物,但目前该药致NAFLD的机制尚不清楚。
肝细胞内脂肪过度沉积是NAFLD发生的病理基础,其典型的病理特征表现为镜下肝细胞内脂滴显著增加。脂滴的主要成分是TG(脂肪实质也是TG),肝细胞内TG代谢(合成和水解)正常是维系脂滴稳态、防止脂肪变性的保障。TG水解障碍将造成脂肪过度沉积,脂滴数量增加、体积变大,诱发肝脂肪变性,并最终导致NAFLD[4]。TG代谢受多种因素影响,而载脂蛋白A5(apolipoprotein A5,ApoA5)是调节TG代谢的关键因子[5]。有研究[6-7]发现:ApoA5上调肝细胞内TG、促进脂滴形成,是NAFLD的正性调控因子。我们既往的研究[8]显示:治疗奥氮平相关脂代谢异常的二甲双胍恰是通过ApoA5途径发挥降脂作用的。上述证据提示,ApoA5可能参与奥氮平相关NAFLD的发病。本研究旨在探讨ApoA5对奥氮平相关NAFLD发病的确切作用及其机制。
1. 材料与方法
1.1. 材料
C57BL/6J小鼠购于湖南斯莱克景达实验动物公司;奥氮平购自美国MCE公司,用0.1% DMSO溶液溶解,配置成100 mmol/L母液储存,使用时用DMEM培养基稀释成相应浓度;人HepG2细胞购自美国模式培养物集存库;DMEM培养基和胎牛血清购自美国Hyclone公司;DMSO、油红O粉、小鼠ApoA5 ELISA试剂盒购于美国Sigma公司;油红O染色试剂盒和HE染色试剂盒购于德国Merck公司;人ApoA5 siRNA及scrambled siRNA由长沙安吉行生物科技有限公司构建;lipofectamine 3000 转染试剂盒、RNA提取试剂盒、cDNA反转录试剂盒及SYBR绿色荧光染料均购于美国Thermo Fisher公司;PCR引物由北京擎科新业生物技术有限公司合成;RIPA裂解液购于上海碧云天生物技术有限公司;BCA蛋白质定量检测试剂盒购于北京康为世纪生物科技有限公司;ApoA5抗小鼠单抗、ApoA5抗人单抗分别购于美国CST和美国Santa Cruz公司;内参tubulin单抗和HRP标记二抗购于美国Proteintech公司。
1.2. 方法
1.2.1. 动物分组
SPF清洁级6周龄雄性C57BL/6J小鼠,体重18~22 g,共18只,适应性喂养1周后,被随机分为对照组、低剂量组、高剂量组,每组6只。低剂量组、高剂量组给予分别3、6 mg/(kg·d)奥氮平,对照组给予等体积的10% DMSO溶液,均采取灌胃给药的方式。干预8周,期间每周称重。
1.2.2. 标本采集和生化指标的检测
干预8周后,禁食6 h,麻醉后处死小鼠。采集血标本,检测血脂4项、肝转氨酶2项和ApoA5水平。血脂4项包括TG、TC、HDL-C、LDL-C,肝转氨酶2项包括ALT、AST。ApoA5水平采用ELISA法检测。采血后迅速摘取小鼠肝脏,并予以生理盐水灌注清洗。取部分肝组织,用4%的多聚甲醛固定,进行脱水、包埋处理后切片;取另一部分肝组织,于液氮中冷冻后置于-80°C冰箱冻存,用于后续检测。实验动物使用符合中南大学动物管理委员会管理条例(审批号:2021364)。
1.2.3. 细胞分组和干预
人HepG2细胞用含有胎牛血清的DMEM培养基培养。传代后将细胞分为4组:对照组、低剂量组、中剂量组、高剂量组,分别给予0.1% DMSO溶液、25 μmol/L奥氮平、50 μmol/L奥氮平、100 μmol/L奥氮平,干预24 h。
1.2.4. ApoA5基因敲低实验
对奥氮平(100 μmol/L)预处理的HepG2细胞行ApoA5基因敲低实验。采用lipofectamine 3000转染试剂盒进行细胞转染:1)转染前1天,将适量HepG2细胞接种于6孔板中,用不含抗生素的培养基培养;当细胞融合度为70%~90%时准备转染。2)用Opti-MEN培养基稀释lipofectamine 3000。3)用Opti-MEN培养基稀释siRNA,制备ApoA5 siRNA或scrambled siRNA(阴性对照)预混液。4)向已稀释的lipofectamine 3000中加入siRNA预混液(1꞉1),在室温下孵育15 min,制备siRNA脂质体复合物。5)将siRNA脂质体复合物加入细胞,置于含5% CO2的培养箱中孵育48 h。
1.2.5. 油红O染色
采用油红O染色观察肝组织和肝细胞中的脂滴。对小鼠肝脏行6 μm冰冻切片。根据标准油红O染色方案对肝组织冰冻切片进行染色:用60%异丙醇洗涤后,采用油红O染色溶液染色30 min,再分别用60%异丙醇、蒸馏水洗涤,最后以苏木精复染。在显微镜下采集图像,计算阳性染色面积占总切片面积百分比,采用Image J软件计算脂滴体积。
制备油红O染色液:用0.5 g油红O粉溶于100%异丙醇100 mL制成原液,再用水(原液与水的体积比为6꞉4)稀释并过滤。用PBS洗涤各组HepG2细胞2次后,移至4%甲醛溶液中,在37 ℃下固定0.5 h,再用PBS洗涤3次,用油红O染色液在37 ℃下染色30 min,60%异丙醇脱色,在相差显微镜下观察脂滴。每孔添加100%异丙醇提取油红O染色的脂滴,于520 nm处测量吸光度值,采用GraphPad Prism软件进行分析。
1.2.6. HE染色
采用HE染色观察肝组织脂质沉积情况。将肝组织置于10%甲醛溶液中在4 ℃下过夜固定,用乙醇脱水进行石蜡包埋,切成6 μm厚切片,在60 ℃下烘烤2 h。将切片浸入二甲苯和梯度酒精中脱蜡后,置于苏木精中对细胞核进行染色,再以1%盐酸乙醇分化。随后,置于HE染色液中染色,再行梯度乙醇脱水、透明,以中性树脂封片,移至光学显微镜下观察。所有切片均纳入计数,每张切片随机选取5个视野(400×),每个视野保证肝细胞数20~40个,采用Image J软件计数。
1.2.7. 实时PCR
采用实时PCR检测ApoA5 mRNA表达水平。采用RNA提取试剂盒,从小鼠肝组织或HepG2肝细胞中提取总RNA。采用cDNA反转录试剂盒将RNA (2 μg)反转录为cDNA。应用实时PCR检测小鼠肝组织和HepG2肝细胞中ApoA5 mRNA表达水平。人ApoA5基因正向引物为:5'-GCCAGCGACTTCA-GGCTTT-3',反向引物为:5'-AGCTTGCTCAGAA-CCTTGCC-3';鼠ApoA5基因正向引物为:5'-TCCT-CGCAGTGTTCGCAAG-3',反向引物为:5'-GAAG-CTGCCTTTCAGGTTCTC-3'。用SYBR绿色荧光染料定量PCR扩增产物。采用GAPDH作为内参基因,计算ApoA5 mRNA的相对表达水平。实验重复3次,取平均值。
1.2.8. 蛋白质印迹法
采用蛋白质印迹法检测ApoA5蛋白质表达水平。将小鼠肝组织或HepG2细胞用PBS清洗3次,加入RIPA裂解液,在低温下离心后收集上清液,提取总蛋白质。采用BCA蛋白质定量检测试剂盒测定蛋白质浓度,加入上样缓冲液和PBS稀释后行蛋白质变性。每孔上样50 μg蛋白质,行SDS-PAGE、PVDF转膜,移至5%脱脂牛奶中,在室温下封闭1h,加入抗ApoA5、抗tubulin的一抗,于4 ℃下孵育过夜,加入HRP二抗于室温下孵育2 h。采用PierceTM ECL发光试剂显影,Image J V1.8.0软件分析蛋白质条带灰度值,以tubulin为内参蛋白质,计算目的蛋白质ApoA5的相对表达水平。实验重复3次,取平均值。
1.3. 统计学处理
采用GraphPad Prism软件(8.0版)进行数据分析。计量资料以均数±标准差( ±s)表示,2组比较采用t检验,3组以上比较采用单因素方差分析结合Tukey’s多重比较。P<0.05为差异有统计学意义。
2. 结 果
2.1. 奥氮平对小鼠血脂的影响
3或6 mg/(kg·d)的奥氮平干预8周后,各组小鼠体重差异无统计学意义(P>0.05),血浆TG水平呈剂量依赖性升高(均P<0.05);但各组小鼠血浆胆固醇(HDL-C、LDL-C、TC)水平差异均无统计学意义(均P>0.05,表1)。
表1.
各组小鼠的体重、血脂和转氨酶(n=6, ±s)
Table 1 Body weight, blood lipids, and transaminase of mice in each group (n=6, ±s)
| 组别 | 体重/g | TG/(mmol·L-1) | TC/(mmol·L-1) |
HDL-C/ (mmol·L-1) |
LDL-C/ (mmol·L-1) |
ALT/(U·L-1) | AST/(U·L-1) |
|---|---|---|---|---|---|---|---|
| 对照组 | 18.76±2.19 | 0.40±0.15 | 1.60±0.13 | 1.46±0.19 | 0.33±0.05 | 29.20±3.22 | 50.52±5.30 |
| 低剂量组 | 19.02±2.52 | 0.70±0.17* | 1.63±0.15 | 1.45±0.17 | 0.38±0.07 | 65.57±13.90* | 112.76±11.58* |
| 高剂量组 | 19.59±2.86 | 1.09±0.19*† | 2.18±0.20*† | 1.42±0.13 | 0.39±0.08 | 103.17±25.05*† | 170.53±19.87*† |
与对照组比较,*P<0.05;与低剂量组比较,†P<0.05。
2.2. 奥氮平对小鼠肝功能的影响
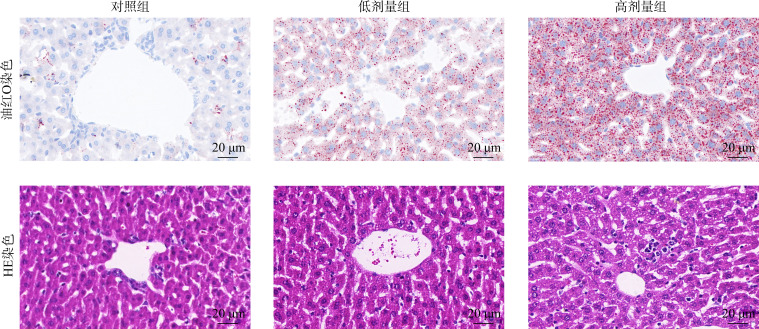
3或6 mg/(kg·d)的奥氮平呈剂量依赖性升高转氨酶ALT和AST的水平(均P<0.05,表1),提示奥氮平短期干预可损害小鼠肝功能。油红O染色结果显示:对照组小鼠肝细胞仅见少量散在脂滴;给予3或 6 mg/(kg·d)奥氮平的小鼠肝细胞内红色脂滴数量明显增多,且高剂量组脂滴数量显著多于低剂量组,部分脂滴融合为大脂滴(图1)。HE染色结果显示:对照组小鼠肝组织结构完整,肝细胞形态规则;给予3或6 mg/(kg·d)奥氮平的小鼠肝细胞内可见大量脂肪沉积,细胞呈气球样变,充盈着大量的脂滴空泡,细胞核位于细胞边缘,尤以高剂量组明显(图1)。
图1.
小鼠肝组织HE染色和油红O染色
Figure 1 HE and oil red O staining of liver tissues in mice
2.3. 奥氮平对小鼠血浆ApoA5水平及肝组织中ApoA5表达的影响
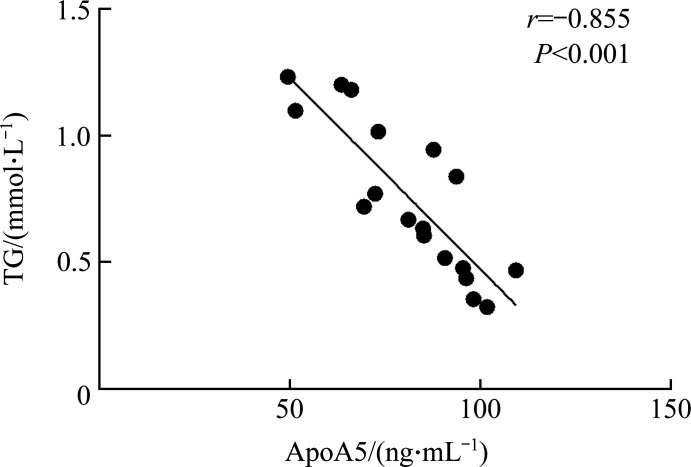
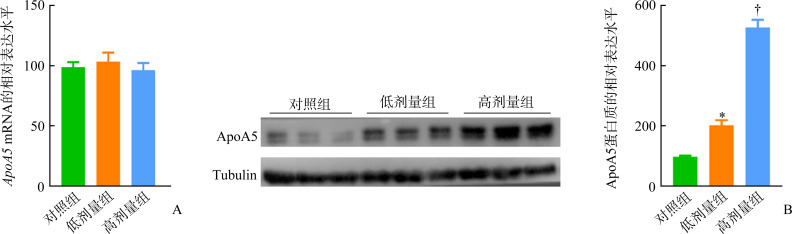
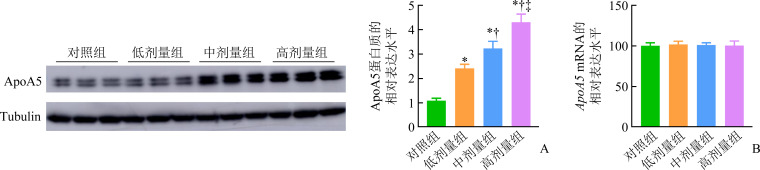
对照组、低剂量组、高剂量组小鼠血浆ApoA5水平分别为(101.46±23.56)、(83.74±16.25)、(62.48±11.78) ng/mL,奥氮平呈剂量依赖性地降低小鼠血浆ApoA5水平,组间比较差异均有统计学意义(均P<0.05)。相关性分析结果显示:血浆ApoA5水平与TG水平呈显著负相关(r=-0.855,P<0.001;图2),且多元回归分析表明:第8周时小鼠血浆ApoA5与TG独立相关(P=0.029,表2)。给予3或6 mg/(kg·d)奥氮平干预的小鼠肝组织中ApoA5蛋白质水平呈剂量依赖性地升高(P<0.05),但各组ApoA5 mRNA表达差异均无统计学意义(均P>0.05,图3)。
图2.
奥氮平干预小鼠血浆ApoA5水平与TG水平的相关性
Figure 2 Correlation between plasma ApoA5 levels and TG levels in olanzapine-treated mice
表2.
奥氮平干预小鼠血浆TG水平的多元回归分析
Table 2 Multiple regression analysis of independent contributors to plasma triglyceride levels in olanzapine-treated mice
| 自变量 | 未标准化系数 | 标准化系数 | 标准误 | P |
|---|---|---|---|---|
| 体重 | -0.059 | 0.282 | 0.222 | 0.514 |
| TC | 0.435 | 0.466 | 0.359 | 0.236 |
| HDL-C | -0.750 | -1.068 | 0.703 | 0.259 |
| LDL-C | -0.498 | -0.439 | 0.406 | 0.230 |
| ApoA5 | -0.706 | -0.762 | 0.004 | 0.029 |
图3.
小鼠肝组织中 ApoA5 mRNA(A)和ApoA5蛋白质(B)的表达
Figure 3 Expression of ApoA5 mRNA(A) and ApoA5 protein (B) in liver tissues of mice
*P<0.05 vs the control group; † P<0.05 vs the low-dose group.
2.4. 奥氮平对HepG2细胞中脂滴数量和ApoA5表达的影响
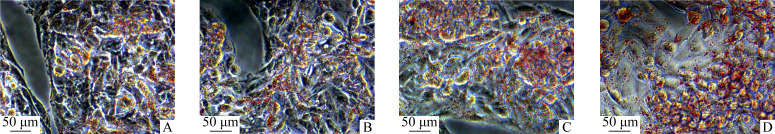
25、50、100 μmol/L的奥氮平干预HepG2细胞24 h后,油红O染色结果显示细胞内脂滴数量明显增多和体积明显增大,且给药剂量越高变化越明显(图4);细胞中ApoA5蛋白质水平呈剂量依赖性升高(P<0.05),但各组ApoA5 mRNA表达差异均无统计学意义(均P>0.05,图5)。
图4.
奥氮平增加HepG2细胞中脂滴的数量和体积
Figure 4 Olanzapine increases the number and volume of lipid droplets in HepG2 cells
A: Control group; B: Low-dose group; C: Medium-dose group; D: High-dose group.
图5.
奥氮平上调HepG2细胞中ApoA5蛋白质的表达水平(A),但并不影响 ApoA5 mRNA的表达水平(B)
Figure 5 Olanzapine up-regulates the expression levels of ApoA5 protein (A) in HepG2 cells, but does not affect the expression levels of ApoA5 mRNA (B)
*P<0.05 vs the control group; †P<0.05 vs the low-dose group; ‡P<0.05 vs the medium-dose group.
2.5. 沉默 ApoA5 基因对HepG2细胞内脂滴的影响
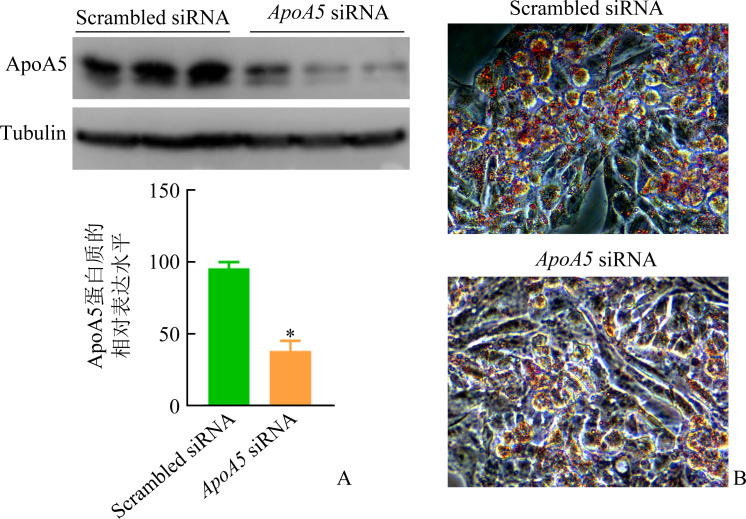
转染ApoA5 siRNA的HepG2细胞中ApoA5蛋白质的表达水平较转染Scrambled siRNA的HepG2细胞明显下降(图6A),表明siRNA成功地敲低了细胞ApoA5基因的表达水平。与转染scrambled siRNA的HepG2细胞相比,转染ApoA5 siRNA的HepG2细胞内脂滴的数量明显减少,体积明显缩小(图6B)。
图6.
转染 ApoA5 siRNA的HepG2细胞中ApoA5蛋白质的表达水平明显下降(A),且脂滴的数量明显减少,体积明显减小(B)
Figure 6 Expression levels of ApoA5 protein in HepG2 cells transfected with ApoA5 siRNA decrease significantly (A) and the number and volume of lipid droplets decreases significantly (B)
*P<0.05 vs the scrambled siRNA group.
3. 讨 论
奥氮平是治疗精神分裂症的一线药物,但长期服用此药可导致肥胖和脂代谢紊乱,增加发生NAFLD的风险。既往关于奥氮平相关NAFLD机制的研究主要聚焦在奥氮平引起的中枢神经系统改变。传统观点认为,奥氮平相关NAFLD发生源于该药“中枢脱靶效应”(或称“中枢途径”),表现为服药者多食少动(体质表型为肥胖)。其机制在于:1)该药作用于饱中枢和摄食中枢,抑制饱感、促进摄食,导致脂质合成增加;2)患者服药后镇静少动、能耗减少,导致脂质分解减少。最终,服药者出现脂代谢紊乱,临床表现为高脂血症和NAFLD[1]。然而,本研究显示:奥氮平短期干预,虽不显著增加小鼠体重,但可导致高TG血症和NAFLD;奥氮平体外干预HepG2细胞,导致脂滴显著增加,诱发细胞脂肪变性。这提示除中枢途径外,奥氮平可直接作用于肝,导致肝TG代谢紊乱、肝内脂肪过度沉积,最终诱发NAFLD。换而言之,外周途径(肝)参与奥氮平相关NAFLD发病,是奥氮平短期内致脂代谢紊乱的重要途径。
为揭示奥氮平相关NAFLD的发病机制,我们选择ApoA5作为关键因子,其理由在于:ApoA5通过抑制肝内TG水解,导致脂肪过度沉积和脂滴大量蓄积,最终诱发NAFLD[6-7]。人ApoA5编码基因位于染色体11q23,其蛋白质由343个氨基酸组成,分子量约39 kD。ApoA5是肝特异性表达的分泌型蛋白质,在肝细胞内质网合成后,该蛋白质被分泌至胞外、进入血液循环,分布于血浆脂蛋白颗粒上[5, 8]。
ApoA5是TG代谢的关键因子,但其在肝内、外调节TG代谢的作用相反。早期研究[5]显示:敲除小鼠ApoA5基因后,血浆TG水平升高达4倍,而过表达ApoA5基因后,小鼠血浆TG水平降低达65%。人ApoA5基因表达缺陷,可导致严重高TG血症[9]。人血浆ApoA5水平与TG水平呈显著负相关[10]。肝外(血液)ApoA5是血浆TG的负性调控因子。但后期研究发现:肝内的ApoA5抑制TG水解、促进脂滴形成,是NAFLD的促进因子。相关证据如下:1)NAFLD患者肝组织的ApoA5表达上调,与肝组织TG含量和脂滴数量呈正相关[6];2)激光共聚焦显微镜下可见肝细胞内ApoA5定位于脂滴外层,抑制脂滴TG水解[7];3)ApoA5基因沉默后,肝细胞内TG减少、脂滴消失,而ApoA5过表达显著增加肝细胞内TG和脂滴[6-7]。
本研究动物实验结果显示:奥氮平短期干预可成功诱发小鼠高TG血症,血浆ApoA5水平显著降低,且血浆ApoA5水平与TG水平呈显著负相关。结合既往研究[5-8]结论ApoA5是血浆TG代谢负性调控因子,笔者认为奥氮平可能通过降低小鼠血浆ApoA5水平,诱发高TG血症。本研究还发现:奥氮平短期干预导致小鼠发生NAFLD,小鼠肝ApoA5蛋白质水平明显升高,而ApoA5 mRNA表达水平差异无统计学意义。体外实验同样显示:奥氮平干预HepG2肝细胞后,ApoA5蛋白质表达显著上调,但ApoA5 mRNA表达无显著变化。而采用siRNA敲低HepG2细胞ApoA5基因可有效消除奥氮平致细胞脂肪变性作用,这提示奥氮平通过ApoA5途径诱发NAFLD。
那么,如何解释奥氮平所致肝内、外ApoA5结果的不一致呢?换而言之,奥氮平如何影响ApoA5代谢,诱发TG代谢紊乱,最终导致高TG血症和NAFLD呢?鉴于ApoA5在肝内、外调节TG作用不同——肝内抑制TG水解(促进脂肪变性)、肝外促进TG水解(降低血浆TG),而ApoA5是肝脏特异性表达的分泌性蛋白,故ApoA5的正常分泌意义重大:既可减少肝内ApoA5滞留,避免脂解障碍所致NAFLD;又可保证肝外ApoA5充足,促进血液TG水解、防止高TG血症[6-7]。因此,我们推测,奥氮平通过抑制肝细胞ApoA5分泌(表现为小鼠血浆ApoA5水平降低),而不是抑制肝细胞ApoA5合成(表现为小鼠肝组织和体外肝细胞中ApoA5 mRNA表达水平无显著改变),导致ApoA5分泌障碍、滞留肝细胞(表现为小鼠肝组织和体外肝细胞中ApoA5蛋白质水平显著升高),抑制肝内TG水解,促使脂肪过度沉积,最终诱发NAFLD。
综上,本研究首次证实:奥氮平短期干预,虽不显著增加体重,但可直接诱发高TG血症和NAFLD,其机制源自该药抑制肝脏分泌ApoA5。本研究将为奥氮平相关脂代谢紊乱的防治提供线索和干预靶点。
| 英文缩写 | 中文名称 | 英文缩写 | 中文名称 | 英文缩写 | 中文名称 |
|---|---|---|---|---|---|
| 5-FU | 5-氟尿嘧啶 | FDA | 美国食品药品管理局 | PaCO2 | 动脉血二氧化碳分压 |
| 5-HT | 5-羟色胺 | GFP | 绿色荧光蛋白 | PaO2 | 动脉血氧分压 |
| ABC法 | 抗生物素蛋白-生物素-过氧化物酶复合物法 | GSH | 谷胱甘肽 | PBS | 磷酸盐缓冲液 |
| ACh | 乙酰胆碱 | HAV | 甲型肝炎病毒 | PCR | 聚合酶链反应 |
| AIDS | 获得性免疫缺陷综合征 | Hb | 血红蛋白 | PET/CT | 正电子发射计算机体层显像仪 |
| ALT | 谷丙转氨酶 | HBV | 乙型肝炎病毒 | PI | 碘化丙啶 |
| AngII | 血管紧张素II | HCG | 人绒毛膜促性腺激素 | PI3K | 磷脂酰肌醇3激酶 |
| Annexin V-FITC | 膜联蛋V标记的异硫氰酸荧光素 | HDL-C | 高密度脂蛋白胆固醇 | PLT | 血小板 |
| APTT | 活化部分凝血活酶时间 | HE | 苏木精-伊红染色 | PT | 凝血酶原时间 |
| AST | 谷草转氨酶 | HGF | 肝细胞生长因子 | PVDF | 聚偏氟乙烯 |
| ATP | 三磷酸腺苷 | HIV | 人类免疫缺陷病毒 | RBC | 红细胞 |
| BCA | 二辛可宁酸 | HPF | 高倍视野 | real-time PCR | 实时聚合酶链反应 |
| BMI | 体重指数 | HR | 心率 | real-time RT-PCR | 实时反转录聚合酶链反应 |
| BP | 血压 | HRP | 辣根过氧化物酶 | RIPA | 放射免疫沉淀法 |
| BSA | 牛血清白蛋白 | HSP | 热激蛋白 | RNA | 核糖核酸 |
| BUN | 尿素氮 | IC50 | 半数抑制浓度 | ROS | 活性氧 |
| CCK-8 | 细胞计数试剂盒-8 | ICU | 重症监护病房 | RT-PCR | 反转录聚合酶链反应 |
| COX-2 | 环氧合酶-2 | IFN | 干扰素 | SABC | 链霉抗生物素蛋白-生物素-过氧化物酶复合物法 |
| Cr | 肌酐 | IL | 白细胞介素 | SCr | 血肌酐 |
| CRP | C反应蛋白 | iNOS | 诱导型一氧化氮合酶 | SDS-PAGE | SDS聚丙烯酰胺凝胶电泳 |
| CT | 计算机体层摄影 | IPG | 固相pH梯度 | SO2 | 血氧饱和度 |
| CV | 变异系数 | JNK | 氨基末端激酶 | SOD | 超氧化物歧化酶 |
| DAB | 二氨基联苯胺 | LDL-C | 低密度脂蛋白胆固醇 | SPF | 无特定病原体 |
| ddH2O | 双蒸水 | LPS | 内毒素/脂多糖 | SP法 | 链霉菌抗生物素蛋白-过氧化物酶法 |
| DMEM | 杜尔贝科改良伊格尔培养基 | MAP | 平均动脉压 | STAT | 信号转导及转录激活因子 |
| DMSO | 二甲基亚砜 | MAPK | 丝裂原激活的蛋白激酶 | TBIL | 总胆红素 |
| DNA | 脱氧核糖核酸 | MDA | 丙二醛 | TBST | Tris-盐酸洗膜缓冲液 |
| ECG | 心电图 | miRNA | 微RNA | TC | 总胆固醇 |
| ECL | 增强化学发光法 | MMP | 基质金属蛋白酶 | TG | 三酰甘油 |
| ECM | 细胞外基质 | MRI | 磁共振成像 | TGF | 转化生长因子 |
| EDTA | 乙二胺四乙酸 | mTOR | 哺乳动物雷帕霉素靶蛋白 | Th | 辅助性T细胞 |
| EEG | 脑电图 | MTT | 四甲基偶氮唑盐微量酶反应 | TLR | Toll样受体 |
| EGF | 表皮生长因子 | NADPH | 还原型烟酰胺腺嘌呤二核苷酸磷酸 | TNF | 肿瘤坏死因子 |
| ELISA | 酶联免疫吸附测定 | NF-κB | 核因子-κB | TUNEL | 原位末端脱氧核苷酸转移酶标记法 |
| eNOS | 内皮型一氧化氮合酶 | NK细胞 | 自然杀伤细胞 | VEGF | 血管内皮生长因子 |
| ERK | 细胞外调节蛋白激酶 | NO | 一氧化氮 | VLDL-C | 极低密度脂蛋白胆固醇 |
| ESR | 红细胞沉降率 | NOS | 一氧化氮合酶 | WBC | 白细胞 |
| FBS | 胎牛血清 | NS | 生理氯化钠溶液 | WHO | 世界卫生组织 |
本刊对部分常用词汇允许直接使用缩写,即首次出现时可不标注中文。
基金资助
国家自然科学基金(81974281);湖南省自然科学基金(2020JJ2052);中国心血管健康联盟进阶基金(2019-CCA-ACCESS-2020JJ2052)。
This work was supported by the National Natural Science Foundation (81974281), the Natural Science Foundation of Hunan Province (2020JJ2052), and the Chinese Cardiovascular Association-Access Fund (2019-CCA-ACCESS-2020JJ2052), China.
利益冲突声明
作者声称无任何利益冲突。
作者贡献
李蓉 实验的设计与操作,论文的撰写与修订;朱文强 实验的设计与操作;黄飘飘 实验材料的准备;丁晨 对实验数据的统计学分析;汤雅新、连平安 实验数据的收集;黄贤圣 实验的设计和指导,论文的修改。所有作者阅读并同意最终的文本。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/202206730.pdf
参考文献
- 1. Huhn M, Nikolakopoulou A, Schneider-Thoma J, et al. Comparative efficacy and tolerability of 32 oral antipsychotics for the acute treatment of adults with multi-episode schizophrenia: a systematic review and network meta-analysis[J]. Lancet, 2019, 394(10202): 939-951. 10.1016/S0140-6736(19)31135-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. 中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会 . 非酒精性脂肪性肝病防治指南(2018更新版)[J]. 实用肝脏病杂志, 2018, 21(2): 177-186. 10.3969/j.issn.1672-5069.2018.02.007. [DOI] [Google Scholar]; National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology, Chinese Medical Association; Fatty Liver Expert Committee, Chinese Medical Doctor Association . Guideline of prevention and treatment for nonalcoholic fatty liver disease: a 2018 update[J]. Journal of Practical Hepatology, 2018, 21(2): 177-186. 10.3969/j.issn.1672-5069.2018.02.007. [DOI] [Google Scholar]
- 3. Petroni ML, Brodosi L, Bugianesi E, et al. Management of non-alcoholic fatty liver disease[J]. BMJ, 2021, 372: m4747. 10.1136/bmj.m4747. [DOI] [PubMed] [Google Scholar]
- 4. Olzmann JA, Carvalho P. Dynamics and functions of lipid droplets[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 137-155. 10.1038/s41580-018-0085-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Pennacchio LA, Olivier M, Hubacek JA, et al. An apolipoprotein influencing triglycerides in humans and mice revealed by comparative sequencing[J]. Science, 2001, 294(5540): 169-173. 10.1126/science.1064852. [DOI] [PubMed] [Google Scholar]
- 6. Forte TM, Ryan RO. Apolipoprotein A5: extracellular and intracellular roles in triglyceride metabolism[J]. Curr Drug Targets, 2015, 16(12): 1274-1280. 10.2174/1389450116666150531161138. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Feng Q, Baker SS, Liu W, et al. Increased apolipoprotein A5 expression in human and rat non-alcoholic fatty livers[J]. Pathology, 2015, 47(4): 341-348. 10.1097/PAT.0000000000000251. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Zhu W, Ding C, Huang P, et al. Metformin Ameliorates Hepatic Steatosis induced by olanzapine through inhibiting LXRα/PCSK9 pathway [J]. Sci Rep. 2022;12(1): 5639. 10.1038/s41598-022-09610-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Gill PK, Dron JS, Dilliott AA, et al. Ancestry-specific profiles of genetic determinants of severe hypertriglyceridemia[J]. J Clin Lipidol, 2021, 15(1): 88-96. 10.1016/j.jacl.2020.11.007. [DOI] [PubMed] [Google Scholar]
- 10. Zhao SP, Hu S, Li J, et al. Association of human serum apolipoprotein A5 with lipid profiles affected by gender[J]. Clin Chim Acta, 2007, 376(1/2): 68-71. 10.1016/j.cca.2006.07.014. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
| 英文缩写 | 中文名称 | 英文缩写 | 中文名称 | 英文缩写 | 中文名称 |
|---|---|---|---|---|---|
| 5-FU | 5-氟尿嘧啶 | FDA | 美国食品药品管理局 | PaCO2 | 动脉血二氧化碳分压 |
| 5-HT | 5-羟色胺 | GFP | 绿色荧光蛋白 | PaO2 | 动脉血氧分压 |
| ABC法 | 抗生物素蛋白-生物素-过氧化物酶复合物法 | GSH | 谷胱甘肽 | PBS | 磷酸盐缓冲液 |
| ACh | 乙酰胆碱 | HAV | 甲型肝炎病毒 | PCR | 聚合酶链反应 |
| AIDS | 获得性免疫缺陷综合征 | Hb | 血红蛋白 | PET/CT | 正电子发射计算机体层显像仪 |
| ALT | 谷丙转氨酶 | HBV | 乙型肝炎病毒 | PI | 碘化丙啶 |
| AngII | 血管紧张素II | HCG | 人绒毛膜促性腺激素 | PI3K | 磷脂酰肌醇3激酶 |
| Annexin V-FITC | 膜联蛋V标记的异硫氰酸荧光素 | HDL-C | 高密度脂蛋白胆固醇 | PLT | 血小板 |
| APTT | 活化部分凝血活酶时间 | HE | 苏木精-伊红染色 | PT | 凝血酶原时间 |
| AST | 谷草转氨酶 | HGF | 肝细胞生长因子 | PVDF | 聚偏氟乙烯 |
| ATP | 三磷酸腺苷 | HIV | 人类免疫缺陷病毒 | RBC | 红细胞 |
| BCA | 二辛可宁酸 | HPF | 高倍视野 | real-time PCR | 实时聚合酶链反应 |
| BMI | 体重指数 | HR | 心率 | real-time RT-PCR | 实时反转录聚合酶链反应 |
| BP | 血压 | HRP | 辣根过氧化物酶 | RIPA | 放射免疫沉淀法 |
| BSA | 牛血清白蛋白 | HSP | 热激蛋白 | RNA | 核糖核酸 |
| BUN | 尿素氮 | IC50 | 半数抑制浓度 | ROS | 活性氧 |
| CCK-8 | 细胞计数试剂盒-8 | ICU | 重症监护病房 | RT-PCR | 反转录聚合酶链反应 |
| COX-2 | 环氧合酶-2 | IFN | 干扰素 | SABC | 链霉抗生物素蛋白-生物素-过氧化物酶复合物法 |
| Cr | 肌酐 | IL | 白细胞介素 | SCr | 血肌酐 |
| CRP | C反应蛋白 | iNOS | 诱导型一氧化氮合酶 | SDS-PAGE | SDS聚丙烯酰胺凝胶电泳 |
| CT | 计算机体层摄影 | IPG | 固相pH梯度 | SO2 | 血氧饱和度 |
| CV | 变异系数 | JNK | 氨基末端激酶 | SOD | 超氧化物歧化酶 |
| DAB | 二氨基联苯胺 | LDL-C | 低密度脂蛋白胆固醇 | SPF | 无特定病原体 |
| ddH2O | 双蒸水 | LPS | 内毒素/脂多糖 | SP法 | 链霉菌抗生物素蛋白-过氧化物酶法 |
| DMEM | 杜尔贝科改良伊格尔培养基 | MAP | 平均动脉压 | STAT | 信号转导及转录激活因子 |
| DMSO | 二甲基亚砜 | MAPK | 丝裂原激活的蛋白激酶 | TBIL | 总胆红素 |
| DNA | 脱氧核糖核酸 | MDA | 丙二醛 | TBST | Tris-盐酸洗膜缓冲液 |
| ECG | 心电图 | miRNA | 微RNA | TC | 总胆固醇 |
| ECL | 增强化学发光法 | MMP | 基质金属蛋白酶 | TG | 三酰甘油 |
| ECM | 细胞外基质 | MRI | 磁共振成像 | TGF | 转化生长因子 |
| EDTA | 乙二胺四乙酸 | mTOR | 哺乳动物雷帕霉素靶蛋白 | Th | 辅助性T细胞 |
| EEG | 脑电图 | MTT | 四甲基偶氮唑盐微量酶反应 | TLR | Toll样受体 |
| EGF | 表皮生长因子 | NADPH | 还原型烟酰胺腺嘌呤二核苷酸磷酸 | TNF | 肿瘤坏死因子 |
| ELISA | 酶联免疫吸附测定 | NF-κB | 核因子-κB | TUNEL | 原位末端脱氧核苷酸转移酶标记法 |
| eNOS | 内皮型一氧化氮合酶 | NK细胞 | 自然杀伤细胞 | VEGF | 血管内皮生长因子 |
| ERK | 细胞外调节蛋白激酶 | NO | 一氧化氮 | VLDL-C | 极低密度脂蛋白胆固醇 |
| ESR | 红细胞沉降率 | NOS | 一氧化氮合酶 | WBC | 白细胞 |
| FBS | 胎牛血清 | NS | 生理氯化钠溶液 | WHO | 世界卫生组织 |
本刊对部分常用词汇允许直接使用缩写,即首次出现时可不标注中文。