Abstract
目的
电针可通过增强自噬流、促进神经元再生、重塑轴突和髓鞘等实现对脊髓损伤的保护作用,但其在神经源性尿潴留中的作用尚不明确。本研究探讨电针通过增强腺苷活化蛋白激酶(AMP activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路介导的自噬治疗神经源性尿潴留的作用机制。
方法
建立骶髓损伤后神经源性尿潴留大鼠模型。将造模成功的大鼠随机分为模型组、电针组(采用电子刺激针对次髎、中极、三阴交行电针,每天1次,每次20 min,共7 d)、电针+AMPK抑制剂组(在电针组处理的基础上,在第1和4天,于L2~3椎间隙周围肌内注射100 μg的AMPK抑制剂compound C)。另设正常组不进行任何处理。采用多通道生理记录仪记录膀胱最大容量、膀胱基础压力、漏尿点压力、膀胱顺应性;HE染色观察膀胱组织形态;透射电镜观察自噬情况;免疫荧光染色观察微管相关蛋白1轻链3(LC3)II、Beclin1蛋白质的表达;蛋白质印迹法检测膀胱组织中AMPK、磷酸化的AMPK(p-AMPK)、mTOR、磷酸化的mTOR(p-mTOR)、LC3II、Beclin1的蛋白质表达水平。
结果
与正常组相比,模型组膀胱最大容量、漏尿点压力、膀胱顺应性,膀胱组织中p-AMPK、LC3II、Beclin1蛋白质表达水平升高,p-mTOR蛋白质表达水平降低(均P<0.05)。与模型组相比,电针组膀胱最大容量、膀胱顺应性、膀胱组织中p-mTOR蛋白质表达水平降低,p-AMPK蛋白、LC3II、Beclin1蛋白质水平升高(均P<0.05);与电针组相比,电针+AMPK抑制剂组膀胱最大容量、膀胱顺应性,膀胱组织中p-mTOR蛋白水平升高,p-AMPK、LC3II、Beclin1蛋白质水平降低(P<0.05)。模型组膀胱体积变大,各层次不清,出现不同程度变性,组织损伤严重,出现自噬小体;电针组膀胱较模型组小,各层次清晰可见,出现自噬小体;电针+AMPK抑制剂组各层次稍凌乱,出现损伤。
结论
电针通过AMPK/mTOR通路激活自噬,从而减轻脊髓损伤导致的神经源性尿潴留。
Keywords: 电针, 磷酸腺苷活化蛋白激酶, 哺乳动物雷帕霉素靶蛋白, 自噬, 神经源性尿潴留
Abstract
Objective
Electroacupuncture can enhance autophagic flow, promote neuronal regeneration, axonal and myelin remodeling to achieve the protection of spinal cord injury, but its role in neurogenic urine retention is not completely clear. This study aims to investigate whether the mechanism of electroacupuncture in the treatment of neurogenic urine retention is through autophagy mediated by adenosine monophosphate activated protein kinase (AMPK)/mammalian target of rapamycin (mTOR) pathway.
Methods
A rat model of neurogenic urine retention after sacral spinal cord injury was established. The rats with successful model were randomly divided into a model group, an electroacupuncture group (electro-acupuncture for Ciliao, Zhongji, and Sanyinjiao by electronic stimulation, once a day, 20 min each time for 7 days), and an electroacupuncture+AMP-activated protein kinase (AMPK) inhibitor group (on the basis of the treatment of electroacupuncture group, 100 μg of AMPK inhibitor compound C was injected intramuscularly around the L2-3 intervertebral space on the 1st and 4th day). The normal group did not receive any treatment. The maximum bladder volume, bladder basal pressure, leak point pressure, and bladder compliance were recorded by multi-channel physiological recorder; the morphology of bladder tissue was observed by HE staining; autophagy was observed under transmission electron microscope; the expressions of LC3II and Beclin1 protein were observed by immunofluorescence staining; the protein levels of AMPK, phosphorylated-AMPK (p-AMPK), mTOR, phosphorylated-mTOR (p-mTOR), microtubule associated protein 1 light chain 3 (LC3) II and Beclin1 in bladder tissue were detected by Western blotting.
Results
Compared with the normal group, the maximum bladder capacity, leak point pressure, bladder compliance, p-AMPK, LC3II, Beclin1 protein expressions in the bladder tissue of the model group increased, and the p-mTOR protein expressions were decreased (all P<0.05); compared with the model group, the maximum bladder capacity, bladder compliance, p-mTOR protein expression in the bladder tissue of the electroacupuncture group were decreased, and the p-AMPK, LC3II, and Beclin1 protein expressions were increased (all P<0.05); compared with the electroacupuncture group, the maximum bladder capacity, bladder compliance, p-mTOR protein expression in the bladder tissue of the electroacupuncture+AMPK inhibitor group were increased, the p-AMPK, LC3II, and Beclin1 protein expressions were decreased (all P<0.05). In the model group, the bladder became larger, with unclear and varying degrees of degeneration, severe tissue damage and autophagosome appeared; the bladder of the electroacupuncture group was smaller than that of the model group, and all levels were clearly visible with autophagy bodies; the layers were slightly disordered and damaged in the electroacupuncture + AMPK inhibitor group.
Conclusion
Electroacupuncture can activate autophagy through AMPK/mTOR pathway, thereby reducing neurogenic urine retention caused by spinal cord injury.
Keywords: electroacupuncture, adenine monophosphate activated protein kinase, mammalian target of rapamycin, autophagy, neurogenic urine retention
控制排尿的中枢神经系统或周围神经受损会导致膀胱、尿道功能障碍,排尿功能紊乱,造成逼尿肌反射亢进(尿失禁)或逼尿肌无反射(尿潴留),其中骶髓损伤表现为尿潴留[1]。目前治疗尿潴留的方法包括手术治疗、连续或间接导尿等,可减少残余尿量,从而减轻症状[2],但给患者带来极大痛苦,且不能从根本上治疗尿潴留。电针能兴奋瘫痪的肌肉、预防肌肉萎缩、刺激受损部位神经,进而促进细胞功能恢复[3];具有调节膀胱功能;抗泌尿系统感染的双重功效,且疗效确定、无创,临床应用价值较高[4],但其具体机制尚不清楚。自噬作为机体防御和自我保护的机制,可实现对细胞的循环和再利用[5]。磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路是自噬的重要调控通路,通过调控AMPK/mTOR通路可以激活自噬,从而减轻脊髓损伤[6]。且进一步研究[7]发现电针在脊髓损伤时可以增强自噬流、促进神经元再生、轴突和髓鞘重塑等,从而实现对脊髓损伤的保护,但其在神经源性尿潴留中的作用尚需进一步研究。本研究探讨电针治疗神经源性尿潴留的机制,以期为临床电针治疗提供实验依据。
1. 材料与方法
1.1. 动物
82只SPF级健康雄性Sprague-Dawley大鼠购自北京维通利华实验动物技术有限公司,体重(260±20) g。所有大鼠均在温度(23±2) ℃,湿度(50±5)%,12 h光照、12 h黑暗条件下生长,自由饮水、摄食,定期通风并更换垫料。本研究经天津中医药大学第一附属医院医学伦理委员会审核批准(审批号:2020-0182)。
1.2. 主要试剂和仪器
AMPK抑制剂compound C为美国Sigma公司产品,HE染色试剂盒为南京生航生物技术有限公司产品;AMPK、磷酸化的AMPK(p-AMPK)、mTOR、磷酸化的mTOR(p-mTOR)、微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)II、Beclin1一抗为英国Abcam公司产品。
电子Von Frey刺激针(型号:EVF3)为英国Bioseb公司产品,多通道生理记录仪(型号:OM-CP-OCTPRO)为美国OMEGA公司产品,光学显微镜(型号:DMIRB SARTORIUS)为德国Leica公司产品;全自动凝胶成像系统(型号:GelDoc EZ)为美国Bio-rad公司产品。
1.3. 方法
1.3.1. 动物分组与处理
参照文献[8]的方法,造模前12 h禁食,造模前2 h腹腔注射2×105 U青霉素预防感染。大鼠麻醉后,取俯卧位固定于鼠板上,剔除L2~3椎间隙及周围被毛并消毒,以L2~3椎间隙为中心纵向切开约2 cm,钝性分离肌肉、筋膜,切断棘间韧带并咬除椎板,用牙科探针横向穿过脊髓,挑起并切断脊髓,止血后缝合。造模后,单笼饲养大鼠,并保持温度为37 ℃,期间大鼠可自由饮水、摄食。大鼠出现前肢行走及后肢拖动、膀胱膨大、尿潴留即认为骶髓损伤后神经源性尿潴留大鼠模型造模成功。在63只造模大鼠中,造模切断脊髓过程中因失血过多死亡6只,最后57只大鼠造模成功,造模成功率90.48%。将57只模型大鼠随机分为模型组(M组)、电针组(E组)、电针+AMPK抑制剂组(E+AI组),每组19只。另取未进行任何处理的大鼠19只为正常组(N组)。
造模成功后,对E组大鼠采用电子Von Frey刺激针对次髎、中极、三阴交行电针[9],参照《实验针灸学》[10]及《实验动物穴位图谱》[11],采用人体腧穴定位的方法——骨度分寸法量取次髎、中极、三阴交穴;双侧次髎为一组,右侧接负极、左侧接正极;中极、三阴交为一组,中极接负极,三阴交接正极,三阴交隔日左右交替取穴。电针时间20 min、疏密波频率为10/50 Hz,以肢体轻微颤抖为度,每天1次,共7 d。E+AI组采用同E组一样的电针治疗,除此之外,在电针治疗的第1和4天,于L2~3椎间隙周围肌内注射100 μg的compound C。M组不进行以上处理。
1.3.2. 尿动力学检测
实验结束后,麻醉各组大鼠,排空大鼠膀胱,将F3导管导入尿道。采用微量灌注泵以0.1 mL/min恒速灌注恒温生理盐水,多通道生理记录仪记录膀胱最大容量、膀胱基础压力、漏尿点压力、膀胱顺应性。
1.3.3. HE染色观察膀胱组织形态
尿动力学检测结束后,麻醉各组大鼠,取膀胱组织,目测观察膀胱体积的变化情况。每组取6只大鼠膀胱颈组织在4%的多聚甲醛中固定12 h,经乙醇脱水后行透明、石蜡包埋、切片(厚5 μm)处理。将切片脱蜡后,用乙醇溶液复水,滴加苏木精染色30 min,用1%盐酸乙醇分化数秒、伊红染液染色90 s,乙醇脱水,行透明处理后封片,自然干燥。在光学显微镜下观察并拍照。
1.3.4. 透射电镜下观察自噬情况
尿动力学检测结束后,麻醉各组大鼠,取膀胱组织。每组取5只大鼠膀胱颈组织固定在4%的多聚甲醛+2.5%戊二醛混合液中,固定24 h后取出组织,经1%的锇酸固定、2%的醋酸水溶液快速染色、乙醇脱水、浸透、包埋后,置于60 ℃恒温箱中聚合,用超薄切片机切片(厚50~70 nm)。采用醋酸铀和枸橼酸铅进行双重染色,染色后用清水洗净,待切片干燥,置于载物台上,在透射电镜下(×30 000)观察自噬小体的形成与分布,选取合适视野拍照。
1.3.5. 免疫荧光染色检测LC3II、Beclin1的表达
将1.3.3中脱蜡后的切片置于3%的H2O2中在室温下水合10 min,滴加柠檬酸钠抗原修复液修复抗原,用山羊血清在37 ℃下封闭40 min,分别添加LC3II、Beclin1、NeuN一抗在4 ℃下孵育过夜,第2天在25 ℃下孵育1 h。在荧光显微镜下观察切片,黄绿色荧光为存在阳性蛋白质表达。选取合适视野,观察到细胞随机覆盖整个视野时拍照。采用ImageJ软件计数并统计阳性细胞数。
1.3.6. 蛋白质印迹法检测膀胱组织中AMPK、p-AMPK、mTOR、p-mTOR、LC3II、Beclin1蛋白质的表达
尿动力学检测结束后,麻醉各组大鼠,取膀胱组织。每组取8只大鼠膀胱颈组织置于-80 ℃冰箱中备用。试验时,从-80 ℃冰箱中取出膀胱颈组织,并称量30 mg;用外科手术剪剪碎组织,添加蛋白质裂解液后在冰上研磨并裂解20 min,在4 ℃下以12 000 r/min离心20 min,收集上清液。采用BCA法测定总蛋白质浓度,每孔上样20 μg,行SDS-PAGE后转膜。用5%脱脂奶粉封闭2 h;分别加入AMPK、p-AMPK、mTOR、p-mTOR、LC3II、Beclin1、GAPDH一抗,在4 ℃下孵育过夜;加入二抗,在室温下封闭1 h,采用ECL发光法避光显影,采用全自动凝胶成像系统进行半定量分析。
1.4. 统计学处理
采用GraphPad Prism 8.0软件进行统计学处理。计量数据采用均数±标准差( ±s)表示,多组间比较行单因素方差分析,进一步两两间比较行SNK-q检验。P<0.05为差异有统计学意义。
2. 结 果
2.1. 电针对大鼠尿动力学的影响
各组膀胱基础压力差异无统计学意义(P>0.05)。与N组相比,M组的膀胱最大容量、漏尿点压力、膀胱顺应性,E组和E+AI组的膀胱最大容量、膀胱顺应性均增加(均P<0.05);与M组相比,E组的膀胱最大容量、膀胱顺应性,E+AI组膀胱最大容量均降低(均P<0.05);与E组相比,E+AI组膀胱最大容量、膀胱顺应性均增加(均P<0.05,表1)。
表1.
各组大鼠尿动力学指标比较(n=19, ±s)
Table 1 Comparison of urodynamic parameters between groups (n=19, ±s)
| 组别 | 膀胱基础压力/cmH2O | 膀胱最大容量/mL | 漏尿点压力/cmH2O | 膀胱顺应性/(mL·cmH2O-1) |
|---|---|---|---|---|
| N组 | 26.13±3.13 | 1.13±0.11 | 37.46±3.98 | 0.086±0.003 |
| M组 | 30.43±4.12 | 4.42±0.32* | 58.19±6.25* | 0.201±0.006* |
| E组 | 28.46±3.27 | 2.43±0.24*† | 43.16±4.95 | 0.117±0.005*† |
| E+AI组 | 29.12±2.95 | 3.46±0.28*†‡ | 49.53±5.16 | 0.196±0.020*‡ |
1 cmH2O=0.098 kPa。N组:正常组,未进行任何处理的大鼠;M组:模型组,骶髓损伤后神经源性尿潴留模型大鼠不做其他处理;E组:电针组,骶髓损伤后神经源性尿潴留模型大鼠给予电针治疗;E+AI组:电针+AMPK抑制剂组,骶髓损伤后神经源性尿潴留模型大鼠给予电针治疗和AMPK抑制剂compound C处理。与N组比较,*P<0.05;与M组比较,†P<0.05;与E组比较,‡P<0.05。
2.2. 电针对大鼠膀胱组织形态的影响
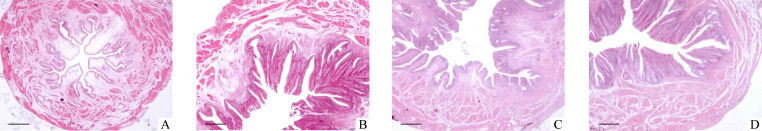
N组大鼠膀胱体积较小,在未充盈状态下各层膀胱组织皱缩,膀胱黏膜层、基膜和固有层结构完整。M组膀胱体积变大,膀胱组织层次不清,出现不同程度的变性,肌层较N组变厚,组织损伤严重甚至出现组织脱落,毛细血管扩张,中性粒细胞浸润明显;E组膀胱体积较M组小,各层次清晰,偶见中性粒细胞,未发现毛细血管扩张;E+AI组各层次稍微凌乱,黏膜层损伤严重,组织存在脱落、变性现象,毛细血管扩张(图1)。
图1.
4组大鼠膀胱组织形态(HE染色)
Figure 1 Bladder tissue morphology of rats in 4 groups (HE staining)
A: Normal group, rats without any treatment; B: Model group, rats of neurogenic urine retention after sacral spinal cord injury without any other treatment; C: Electroacupuncture group, rats of neurogenic urine retention after sacral spinal cord injury with electroacupuncture treatment; D: Electroacupuncture+AMPK inhibitor group, rats of neurogenic urine retention after sacral spinal cord injury with electroacupuncture and AMPK inhibitor treatment. Scale bar=200 μm.
2.3. 电针对大鼠膀胱组织中自噬小体的影响
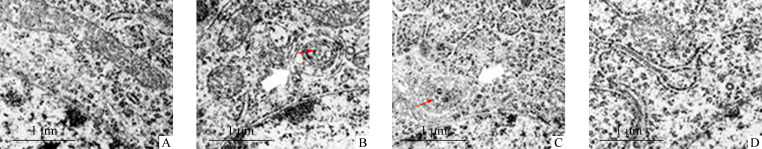
透射电镜下可见:M组、E组大鼠膀胱组织中有大量的自噬小体,E+AI组有少量的自噬小体,N组几乎无自噬小体(图2)。
图2.
透射电镜下4组大鼠膀胱组织中的自噬情况
Figure 2 Autophagy in bladder tissues of rats in 4 groups under transmission electron microscope
A: Normal group, rats without any treatment; B: Model group, rats of neurogenic urine retention after sacral spinal cord injury without any other treatment; C: Electroacupuncture group, rats of neurogenic urine retention after sacral spinal cord injury with electroacupuncture treatment; D: Electroacupuncture+AMPK inhibitor group, rats of neurogenic urine retention after sacral spinal cord injury with electroacupuncture and AMPK inhibitor treatment. Red arrow indicates autophagy. Scale bar=1 μm.
2.4. 电针对大鼠膀胱组织中自噬相关基因和信号转导通路的影响
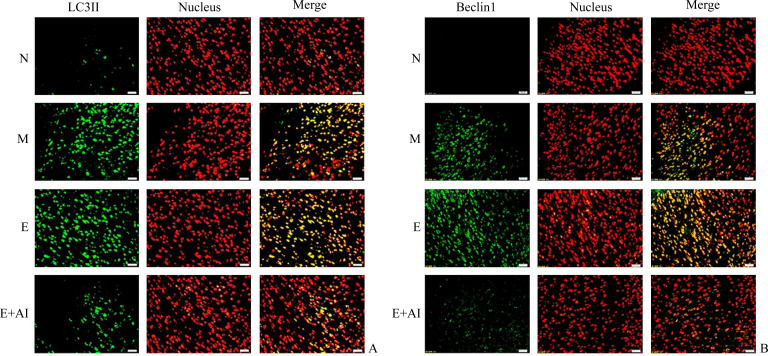
免疫荧光染色结果表明:与N组相比,M组、E组、E+AI组大鼠膀胱组织中自噬相关基因LC3II、Beclin1蛋白质表达水平均升高(均P<0.05);与M组相比,E组和E+AI组大鼠膀胱组织中LC3II、Beclin1蛋白质表达水平均升高(均P<0.05);与E组相比,E+AI组大鼠膀胱组织中LC3II、Beclin1蛋白质表达水平均降低(均P<0.05;图3,表2)。
图3.
免疫荧光染色示各组大鼠膀胱组织中LC3II(A)、Beclin1(B)的蛋白质表达
Figure 3 Protein expression of LC3 II (A) and Beclin1 (B) in bladder tissues of rats in each group shown by fluorescence staining
N: Normal group, rats without any treatment; M: Model group, rats of neurogenic urine retention after sacral spinal cord injury without any other treatment; E: Electroacupuncture group, rats of neurogenic urine retention after sacral spinal cord injury with electroacupuncture treatment; E+AI: Electroacupuncture+AMPK inhibitor group, rats of neurogenic urine retention after sacral spinal cord injury with electroacupuncture and AMPK inhibitor treatment. Scale bar=50 μm.
表2.
各组大鼠膀胱组织中LC3II、Beclin1蛋白质表达水平的比较 (n=6, ±s)
Table 2 Comparison of protein expression of LC3 II and Beclin1 in bladder tissues of rats between groups (n=6, ±s)
| 组别 | LC3II | Beclin1 |
|---|---|---|
| N组 | 16.21±2.18 | 8.45±1.26 |
| M组 | 103.16±12.27* | 136.48±14.16* |
| E组 | 168.48±17.42*† | 189.46±20.18*† |
| E+AI组 | 26.48±3.45*†‡ | 26.47±3.15*†‡ |
LC3II:微管相关蛋白1轻链3II。N组:正常组,未进行任何处理的大鼠;M组:模型组,骶髓损伤后神经源性尿潴留模型大鼠不做其他处理;E组:电针组,骶髓损伤后神经源性尿潴留模型大鼠给予电针治疗;E+AI组:电针+AMPK抑制剂组,骶髓损伤后神经源性尿潴留模型大鼠给予电针治疗和AMPK抑制剂compound C处理。与N组比较,*P<0.05;与M组比较,†P<0.05;与E组比较,‡P<0.05。
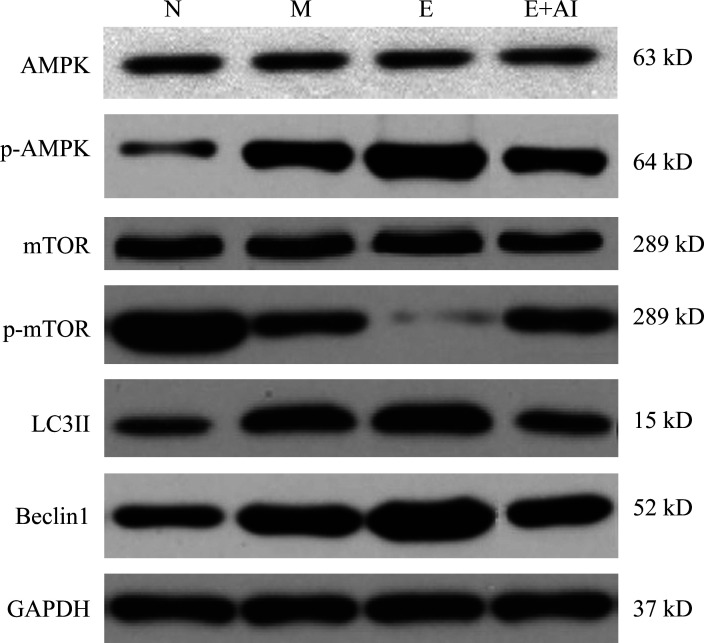
蛋白质印迹法结果表明:4组大鼠膀胱组织中AMPK、mTOR蛋白质表达水平差异均无统计学意义(均P>0.05)。与N组相比,M组、E组、E+AI组大鼠膀胱组织中p-AMPK、LC3II、Beclin1蛋白质表达水平均升高,p-mTOR蛋白质表达水平降低(均P<0.05);与M组相比,E组大鼠膀胱组织中p-AMPK、LC3II、Beclin1蛋白质表达水平均升高,p-mTOR蛋白质表达水平降低(均P<0.05),E+AI组p-AMPK、Beclin1蛋白质表达水平均降低(P<0.05);与E组相比,E+AI组大鼠膀胱组织中p-AMPK、LC3II、Beclin1蛋白质表达水平均降低,p-mTOR蛋白质表达水平升高(均P<0.05;图4,表3)。
图4.
4组膀胱组织蛋白水平检测
Figure 4 Detection of protein levels in bladder tissues of 4 groups
AMPK: AMP-activated protein kinase; p-AMPK: Phosphorylated AMP-activated protein kinase; mTOR: Mammalian target of rapamycin; p-mTOR: Phosphorylated mammalian target of rapamycin; LC3II: Microtubule associated protein 1 light chain 3II. N: Normal group; M: Model group; E: Electroacupuncture group; E+AI: Electroacupuncture + AMPK inhibitor group.
表3.
各组大鼠膀胱组织中AMPK、p-AMPK、mTOR、p-mTOR、LC3II、Beclin1蛋白质水平的比较(n=8, ±s )
Table 3 Comparison of protein expression of AMPK, p-AMPK, mTOR, p-mTOR, LC3II, and Beclin1 in bladder tissues of rats between groups (n=8, ±s )
| 组别 | AMPK | p-AMPK | mTOR | p-mTOR | LC3II | Beclin1 |
|---|---|---|---|---|---|---|
| N组 | 1.09±0.12 | 0.09±0.02 | 0.86±0.08 | 2.23±0.27 | 0.18±0.02 | 0.26±0.03 |
| M组 | 1.11±0.09 | 0.59±0.06* | 0.89±0.09 | 0.57±0.02* | 0.53±0.06* | 1.06±0.05* |
| E组 | 1.13±0.14 | 0.96±0.08*† | 0.95±0.07 | 0.03±0.01*† | 0.79±0.05*† | 1.73±0.09*† |
| E+AI组 | 1.12±0.09 | 0.36±0.03*†‡ | 0.87±0.09 | 0.53±0.04*‡ | 0.42±0.06*‡ | 0.68±0.07*†‡ |
AMPK:磷酸腺苷活化蛋白激酶;p-AMPK:磷酸化的磷酸腺苷活化蛋白激酶;mTOR:哺乳动物雷帕霉素靶蛋白;p-mTOR:磷酸化的哺乳动物雷帕霉素靶蛋白;LC3II:微管相关蛋白1轻链3II。N组:正常组,未进行任何处理的大鼠;M组:模型组,骶髓损伤后神经源性尿潴留模型大鼠不做其他处理;E组:电针组,骶髓损伤后神经源性尿潴留模型大鼠给予电针治疗;E+AI组:电针+AMPK抑制剂组,骶髓损伤后神经源性尿潴留模型大鼠给予电针治疗和AMPK抑制剂compound C处理。与N组比较,*P<0.05;与M组比较,†P<0.05;与E组比较,‡P<0.05。
3. 讨 论
尿潴留是临床常见病,临床上西医对骶髓损伤后神经源性尿潴留多采用导尿术、神经药物、骶神经根电刺激等治疗方法,虽能在一定程度上改善膀胱排尿功能,却有一定的局限性,且往往具有创伤性[12]。尿潴留属中医“癃闭”范畴,“癃”指尿液潴留膀胱、“闭”指膀胱闭塞、不能排出尿液,病机为脏腑、气血阴阳失调,膀胱气化功能障碍[13]。本研究发现:骶髓损伤后神经源性尿潴留大鼠出现膀胱最大容量、漏尿点压力、膀胱顺应性升高,提示骶髓损伤大鼠不能正常接收到膀胱尿液冲动信号,无法对尿道括约肌和膀胱逼尿肌做出有效调控,导致排尿反射功能失调,膀胱中长时间存在大量尿液且无法排出体外,导致尿潴留。
高武在《针灸聚英》中指出“次髎……,主大小便不利”。“中极”穴为膀胱之募穴,为足三阴与任脉之会,六腑病多取募穴,亦为治此病要穴。“三阴交”穴乃足三阴经交会穴,可通调下焦气机,有利于调整膀胱功能[14]。本文用次髎、中极、三阴交穴治疗尿潴留。其中“次髎”属足太阳膀胱经,主腰痛、疝气、月经不调、大小便不利等,可支配盆腔脏器的骶神经,连接排尿反射的传入神经与传出神经,可将膀胱中尿液增多的刺激传入排尿中枢等高级中枢,进而引起效应器逼尿肌及膀胱内括约肌节律性收缩和舒张运动,促使排尿反射[15];“中极”为膀胱之募穴,为足三阴与任脉之会,位于膀胱局部,刺激该穴可促使膀胱内括约肌节律性收缩和舒张运动,促使排尿反射[16];“三阴交”乃足三阴经交会穴,可通调下焦气机,改善膀胱功能,刺激该穴可通过反射弧由脊髓后跟激发腰骶部排尿中枢,进而影响排尿功能[17]。本研究发现:电针治疗神经源性尿潴留后大鼠膀胱最大容量、膀胱顺应性均明显降低,可能是刺激穴位后影响反射过程,刺激效应器发挥作用,进而缓解尿潴留症状。且电针可改善神经源性尿潴留中膀胱黏膜层、基膜和固有层结构层次不清,肌层变厚的现象,减轻膀胱组织的损伤和脱落、毛细血管的扩张、中性粒细胞的浸润。
目前,自噬在神经源性尿潴留中作用的相关研究较少。作为双刃剑,适度自噬可以清除机体内损伤细胞和组织,实现对机体的保护;但过度自噬与程序性死亡关系密切[18]。LC3属自噬标志性蛋白,自噬发生时LC3I与自噬表面磷脂酰乙酰胺结合形成LC3II,LC3II标志着自噬发生[19]。Beclin1是自噬过程中必需成分[20]。本研究发现:M组、E组均观察到自噬小体,提示在M组、E组均出现自噬现象;E组膀胱组织中LC3II、Beclin1蛋白质表达高于M组,提示神经源性尿滞留大鼠的膀胱组织发生了自噬,自噬可清除受损的组织和细胞,但清除水平有限;电针刺激后进一步激活自噬,自噬对机体的保护作用增强,但具体机制尚需进一步研究。
AMPK作为多个上游信号的调节器,成为细胞利用的中心环节,能够有效促进自噬[21]。mTOR作为下游重要调控基因,与AMPK发挥着相反作用,p-AMPK可激活ULK1,从而触发自噬级联反应,p-mTOR可强烈地抑制自噬[22]。同时,AMPK可通过直接磷酸化增强Beclin1的表达,从而增强自噬复合体中Beclin1的活性,增强自噬[23]。增加LC3II、Beclin1和p-AMPK蛋白质水平,降低p-mTOR蛋白质水平可以促进自噬,从而改善肾去神经支配的血管内皮功能障碍[24]。脊髓损伤尿潴留与神经元细胞自噬水平上升有关[25];压力性尿失禁大鼠中自噬相关蛋白质LC3的表达水平明显低于对照[26],这些均表明自噬在尿潴留或尿失禁中的重要性。本研究发现:骶髓损伤后神经源性尿潴留p-AMPK蛋白质水平升高,p-mTOR蛋白质水平降低;在电针基础上添加AMPK抑制剂可降低p-AMPK蛋白质水平,升高p-mTOR蛋白质水平,提示在膀胱组织中AMPK磷酸化激活后抑制mTOR磷酸化,促进LCII、Beclin1蛋白质的表达;电针刺激后进一步激活AMPK磷酸化,加强自噬,从而实现对脊髓损伤尿潴留的治疗作用。
综上,电针通过AMPK/mTOR通路激活自噬,实现对神经源性尿潴留大鼠的治疗作用,为临床上电针治疗尿潴留提供了依据,但自噬与尿潴留之间关系尚需进一步研究。
基金资助
天津市教委科研计划项目(2018KJ028)。
This work was supported by the Scientific Research Project of Tianjin Education Commission, China (2018KJ028).
利益冲突声明
作者声称无任何利益冲突。
作者贡献
李正飞,张任 实验的设计及实施,论文的构想、撰写和修订;赵国瑞 数据的整理及统计分析;匡尧 论文的构想、修改。所有作者阅读并同意最终的文本。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/202204488.pdf
参考文献
- 1. Schubert MF, Thomas JR, Gagnier JJ, et al. The AAHKS clinical research award: prophylactic tamsulosin does not reduce the risk of urinary retention following lower extremity arthroplasty: a double-blinded randomized controlled trial[J]. J Arthroplasty, 2019, 34(7S): S17-S23. 10.1016/j.arth.2019.03.039. [DOI] [PubMed] [Google Scholar]
- 2. Jackson J, Davies P, Leggett N, et al. Systematic review of interventions for the prevention and treatment of postoperative urinary retention[J]. BJS Open, 2018, 3(1): 11-23. 10.1002/bjs5.50114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. 孙志欣, 李南南, 石磊. 电针疗法对急性脑梗死患者的临床疗效及血清VEGF、NSE的影响[J]. 天津医药, 2018, 46(1): 56-59. 10.11958/20170945. [DOI] [Google Scholar]; SUN Zhixin, LI Nannan, SHI Lei. Effects of electroacupuncture on clinical efficacy, serum vascular endothelial growth factor and neuron specific enolase in patients with acute cerebral infarction[J]. Tianjin Medical Journal, 2018, 46(1): 56-59. 10.11958/20170945. [DOI] [Google Scholar]
- 4. Wang TS, Wang ZM, Zhao Y, et al. Effectiveness of electroacupuncture (EA) for the treatment of urinary incontinence (UI) in patients with spinal cord injury (SCI): A protocol of systematic review of randomized controlled trials[J/OL]. Medicine (Baltimore), 2020, 99(30): e21077(2020-07-24)[2021-06-14]. 10.1097/MD.0000000000021077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Li Z, Chen TS, Cao YW, et al. Pros and cons: autophagy in acute spinal cord injury[J]. Neurosci Bull, 2019, 35(5): 941-945. 10.1007/s12264-019-00368-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Lin S, Tian H, Lin JQ, et al. Zinc promotes autophagy and inhibits apoptosis through AMPK/mTOR signaling pathway after spinal cord injury[J]. Neurosci Lett, 2020, 736: 135263. 10.1016/j.neulet.2020.135263. [DOI] [PubMed] [Google Scholar]
- 7. 孙忠人, 田洪昭, 徐思禹, 等. 电针治疗脊髓损伤机制研究概述[J]. 针灸临床杂志, 2019, 35(4): 84-88. 10.3969/j.issn.1005-0779.2019.04.025. [DOI] [Google Scholar]; SUN Zhongren, TIAN Hongzhao, XU Siyu, et al. Mechanism review of electro-acupuncture treating spinal cord injury[J]. Journal of Clinical Acupuncture and Moxibustion, 2019, 35(4): 84-88. 10.3969/j.issn.1005-0779.2019.04.025. [DOI] [Google Scholar]
- 8. 卢壮, 黄钰岚, 阮成志, 等. 电针对骶髓损伤后神经源性膀胱尿潴留大鼠尿动力学的影响和机制研究[J]. 检验医学与临床, 2020, 17(19): 2841-2845, 2849. 10.3969/j.issn.1672-9455.2020.19.026. 32326144 [DOI] [Google Scholar]; LU Zhuang, HUANG Yulan, RUAN Chengzhi, et al. Effects and mechanism of electroacupuncture on urodynamics in urinary retention rats with neurogenic bladder after sacral cord injury[J]. Laboratory Medicine and Clinic, 2020, 17(19): 2841-2845, 2849. 10.3969/j.issn.1672-9455.2020.19.026. [DOI] [Google Scholar]
- 9. 许明, 张泓, 刘继生, 等. 电针对完全性脊髓损伤后神经源性膀胱大鼠脊髓组织中 Caspase-9、细胞色素C及凋亡蛋白酶激活因子-1表达的影响[J]. 中国康复理论与实践, 2017, 23(6): 628-633. 10.3969/j.issn.1006-9771.2017.06.002. [DOI] [Google Scholar]; XU Ming, ZHANG Hong, LIU Jisheng, et al. Effect of electroacupuncture on expression of caspase-9, cytochrome C and apoptotic protease activating factor 1 in spinal tissue in rats with neurogenic bladder after complete spinal cord injury[J]. Chinese Journal of Rehabilitation Theory and Practice, 2017, 23(6): 628-633. 10.3969/j.issn.1006-9771.2017.06.002. [DOI] [Google Scholar]
- 10. 李忠仁. 实验针灸学[M]. 北京: 中国中医药出版社, 2003. [Google Scholar]; LI Zhongren. Experimental acupuncture and moxibustion[M]. Beijing: China Traditional Chinese Medicine Publishing House, 2003. [Google Scholar]
- 11. 胡映秋, 王开阳, 扶流祥, 等. 电针对骶髓损伤后神经源性膀胱尿潴留大鼠尿动力学的影响和机制研究[J]. 中国当代医药, 2021, 28(30): 8-12. 10.3969/j.issn.1674-4721.2021.30.004. [DOI] [Google Scholar]; HU Yingqiu, WANG Kaiyang, FU Liuxiang, et al. Effects and mechanism of electroacupuncture on urodynamics in rats with neurogenic bladder retention after sacral spinal cord injury[J]. China Contemporary Medicine, 2021, 28(30): 8-12. 10.3969/j.issn.1674-4721.2021.30.004. [DOI] [Google Scholar]
- 12. Zhao JM, Wu MH, Chen SY, et al. TGF-β1 and connexin-43 expression in neurogenic bladder from rats with sacral spinal cord injury[J]. Neurourol Urodyn, 2018, 37(8): 2502-2509. 10.1002/nau.23767. [DOI] [PubMed] [Google Scholar]
- 13. 王美玲, 秦子舒, 太景伟, 等. 针刺联合指尖易筋推拿治疗宫颈恶性肿瘤术后尿潴留[J]. 吉林医药学院学报, 2020, 41(3): 198-199. 10.13845/j.cnki.issn1673-2995.2020.03.017. [DOI] [Google Scholar]; WANG Meiling, QIN Zishu, TAI Jingwei, et al. Acupuncture combined with finger tip manipulation to treat urinary retention after cervical cancer surgery [J]. Journal of Jilin Medical College, 2020, 41(3): 198-199. 10.13845/j.cnki.issn1673-2995.2020.03.017. [DOI] [Google Scholar]
- 14. 高武. 针灸聚英[M]. 北京: 中国中医药出版社, 2007. [Google Scholar]; GAO Wu. Acupuncture and Moxibustion Juying[M]. Beijing: China Traditional Chinese Medicine Publishing House, 2007. [Google Scholar]
- 15. 莫倩, 杨硕, 何婷, 等. 深刺三阴交/中髎(次髎)对急性尿潴留大鼠膀胱功能的影响[J]. 辽宁中医杂志, 2019, 46(9): 1980-1983. 10.13192/j.issn.1000-1719.2019.09.057. 31123764 [DOI] [Google Scholar]; MO Qian, YANG Shuo, HE Ting, et al. Effect of deep acupuncture at SP6/BL33 (BL32) on bladder function in rats with acute urinary retention[J]. Liaoning Journal Traditional Chinese Medicine, 2019, 46(9): 1980-1983. 10.13192/j.issn.1000-1719.2019.09.057. [DOI] [Google Scholar]
- 16. 刘会敏, 冷军, 郭文, 等. 基于数据挖掘技术分析针灸治疗脊髓损伤后神经源性膀胱的取穴规律[J]. 中国组织工程研究, 2020, 24(26): 4237-4242. 10.3969/j.issn.2095-4344.2769. 33111157 [DOI] [Google Scholar]; LIU Huimin, LENG Jun, GUO Wen, et al. The rules of acupoint selection in the treatment of neurogenic bladder after spinal cord injury with acupuncture and moxibustion: based on data mining technology[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2020, 24(26): 4237-4242. 10.3969/j.issn.2095-4344.2769. [DOI] [Google Scholar]
- 17. 刘访, 史仁杰, 曹波, 等. 针刺联合麦粒灸治疗肛肠疾病术后急性尿潴留: 随机对照研究[J]. 中国针灸, 2019, 39(7): 709-712. 10.13703/j.0255-2930.2019.07.008. [DOI] [PubMed] [Google Scholar]; LIU Fang, SHI Renjie, CAO Bo, et al. Postoperative acute urinary retention in anorectal diseases treated with acupuncture combined with grain-moxibustion: a randomized controlled trial[J]. Chinese Acupuncture and Moxibustion, 2019, 39(7): 709-712. 10.13703/j.0255-2930.2019.07.008. [DOI] [PubMed] [Google Scholar]
- 18. Zhang J, Chen LM, Xiong F, et al. Autophagy in regulatory T cells: A double-edged sword in disease settings[J]. Mol Immunol, 2019, 109: 43-50. 10.1016/j.molimm.2019.02.004. [DOI] [PubMed] [Google Scholar]
- 19. Liu X, Klionsky DJ. Regulation of JMY's actin nucleation activity by TTC5/STRAP and LC3 during autophagy[J]. Autophagy, 2019, 15(3): 373-374. 10.1080/15548627.2018.1564417. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Yang K, Guo W, Ren TT, et al. Knockdown of HMGA2 regulates the level of autophagy via interactions between MSI2 and Beclin1 to inhibit NF1-associated malignant peripheral nerve sheath tumour growth[J]. J Exp Clin Cancer Res, 2019, 38(1): 185. 10.1186/s13046-019-1183-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Jia J, Bissa B, Brecht L, et al. AMPK, a regulator of metabolism and autophagy, is activated by lysosomal damage via a novel galectin-directed ubiquitin signal transduction system[J]. Mol Cell, 2020, 77(5): 951-969. 10.1016/j.molcel.2019.12.028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22. Wang L, Jin GF, Yu HH, et al. Protective effect of tenuifolin against alzheimer's disease[J]. Neurosci Lett, 2019, 705: 195-201. 10.1016/j.neulet.2019.04.045. [DOI] [PubMed] [Google Scholar]
- 23. Gu X, Li Y, Chen K, et al. Exosomes derived from umbilical cord mesenchymal stem cells alleviate viral myocarditis through activating AMPK/mTOR-mediated autophagy flux pathway[J]. J Cell Mol Med, 2020, 24(13): 7515-7530. 10.1111/jcmm.15378. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Shi CJ, Xue WJ, Han BW, et al. Acetaminophen aggravates fat accumulation in NAFLD by inhibiting autophagy via the AMPK/mTOR pathway[J]. Eur J Pharmacol, 2019, 850: 15-22. 10.1016/j.ejphar.2019.02.005. [DOI] [PubMed] [Google Scholar]
- 25. 李格格. 基于NGF-PI3K/AKT/mTOR轴调节自噬探讨低频电刺激联合针刺“夹脊穴”干预大鼠脊髓损伤尿潴留的影响[D]. 沈阳: 辽宁中医药大学, 2020. [Google Scholar]; LI Gege. Based on the NGF-PI3K/AKT/mTOR axis to regulate autophagy to explore the effect of low-frequency electrical stimulation combined with acupuncture at “Jiaji points” on the intervention of urinary retention in rats with spinal cord injury[D]. Shenyang: Liaoning University Of Traditional Chinese Medicine, 2020. [Google Scholar]
- 26. 李男, 王学菊, 侯毅. 内质网应激在压力性尿失禁大鼠中的作用及意义[J]. 中国妇幼保健, 2018, 33(12): 2798-2802. 10.7620/zgfybj.j.issn.1001-4411.2018.12.55. [DOI] [Google Scholar]; LI Nan, WANG Xueju, HOU Yi. The role and significance of endoplasmic reticulum stress in stress urinary incontinence rats[J]. Maternal and Child Health Care of China, 2018, 33(12): 2798-2802. 10.7620/zgfybj.j.issn.1001-4411.2018.12.55. [DOI] [Google Scholar]