Abstract
目的
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种高度侵袭性的乳腺癌亚型,预后相对较差。新辅助化疗(neoadjuvant chemotherapy,NAC)是TNBC的主要治疗手段,但由于肿瘤的异质性,TNBC患者对化疗的反应存在显著差异。炎症与癌症的发生和发展息息相关,全身免疫炎症指数(systemic immune-inflammation index,SII)是一项全面反映机体炎症状态的指标。本研究旨在探讨SII与NAC治疗TNBC疗效及预后的相关性。
方法
收集2015年1月至2019年6月在中南大学湘雅医院接受NAC和系统治疗的TNBC患者资料,依据纳入和排除标准,最终纳入231例TNBC患者。根据患者化疗前1周的血常规结果计算NAC前SII,将患者分为NAC前低SII组(SII<412,115例)和NAC前高SII组(SII≥412,116例)。根据患者所有化疗结束后2~3个月的血常规结果计算化疗后SII,将患者分为化疗后低SII组(SII<474,115例)和化疗后高SII组(SII≥474,116例)。采用Pearson's χ2检验分析TNBC患者SII与其他临床特征的关系以及TNBC患者NAC疗效与临床特征的关系;采用二元logistic回归分析TNBC患者NAC疗效的独立影响因素;采用Kaplan-Meier曲线分析影响TNBC患者预后的因素;采用Cox回归模型分析TNBC患者预后的独立影响因素。
结果
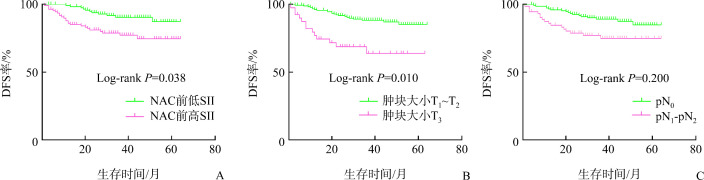
在NAC前,不同年龄、肿块大小组之间SII的差异均有统计学意义(分别P=0.007和P=0.002);在化疗后,不同年龄、肿块大小、组织学分级、淋巴结分期、Ki-67组之间SII的差异均无统计学意义(均P>0.05)。NAC前低SII组病理完全缓解(pathological complete response,pCR)率为15.7%,NAC前高SII组pCR率为6.0%。NAC前低SII组较NAC前高SII组pCR率更高(P=0.019)。淋巴结分期为pN0的患者156例,pCR率为14.7%;淋巴结分期为pN1~pN2的患者75例,pCR率为2.7%。淋巴结分期为pN0的患者较淋巴结分期为pN1~pN2的患者pCR率更高(P=0.006)。随访期间有34例患者发生局部复发或远处转移。Kaplan-Meier生存曲线显示:NAC前低SII、NAC前高SII患者的3年无病生存(disease-free survival,DFS)率分别为87.8%、82.8%,前者明显高于后者(P=0.005);肿块大小为T1~T2、T3患者的3年DFS率分别为89.0%、67.5%,前者明显高于后者(P=0.001);淋巴结分期为pN0、pN1~pN2患者的3年DFS率分别为87.8%、82.8%,前者明显高于后者(P=0.009)。Cox分析结果显示:NAC前SII和肿块大小是患者DFS的独立影响因素(分别P=0.038和P=0.010)。
结论
SII对预测TNBC患者NAC疗效及预后具有重要的临床意义,具有成为生物学标志物的潜力。
Keywords: 全身免疫炎症指数, 三阴性乳腺癌, 新辅助化疗, 预后
Abstract
Objective
Triple-negative breast cancer (TNBC) is a highly aggressive subtype of breast cancer with a relatively poor prognosis. Neoadjuvant chemotherapy (NAC) is the main treatment method. Due to the heterogeneity of the tumor, the chemotherapy response of TNBC patients is significantly different. Inflammation is closely related to the occurrence and development of cancer. The systemic immune-inflammation index (SII) is an indicator that can comprehensively reflect the state of systemic inflammation. This study aims to explore the association between SII and the NAC efficacy as well as the prognosis in TNBC.
Methods
The data of TNBC patients who underwent NAC and systemic treatment in Xiangya Hospital of Central South University from January 2015 to June 2019 were collected. According to the inclusion and exclusion criteria, 231 TNBC patients were finally included. The pre-NAC SII was calculated according to the blood routine results of the patients at 1 week before chemotherapy, and the patients were divided into a pre-NAC low SII group (SII<412, 115 cases) and a pre-NAC high SII group (SII≥412, 116 cases). The SII after chemotherapy was calculated according to the blood routine results of the patients at 2 to 3 months after the end of chemotherapy, and the patients were divided into a low SII group after chemotherapy (SII<474, 115 cases) and a high SII group after chemotherapy (SII≥474, 116 cases). Pearson's chi-square test was used to analyze the relationship between SII and other clinical characteristics of TNBC patients, and the relationship between the NAC efficacy and clinical characteristics of TNBC patients. Binary logistic regression analysis was used to find independent factors that affect the efficacy of NAC in TNBC patients. Kaplan-Meier curve analysis was used to analyze factors affecting the prognosis of TNBC patients. Cox regression model was used to find independent factors affecting the prognosis of TNBC patients.
Results
Before NAC, the differences in SII between groups with different ages and tumor sizes were significant (P=0.007 and P=0.002, respectively); after chemotherapy, there were no significant differences in SII between different ages, tumor sizes, histological grades, lymph node staging, and Ki-67 groups (all P>0.05). There were 115 patients with low SII before NAC, with a pathological complete response (pCR) rate of 15.7%; there were 116 patients with high SII before NAC, with a pCR rate of 6.0%. Patients with low SII before NAC had a higher pCR rate than patients with high SII before NAC, and the difference was statistically significant (P=0.019).There were 156 patients with lymph node staging pN0, with a pCR rate of 14.7%; and there were 75 patients with lymph node staging pN1-pN2, with a pCR rate of 2.7%. Patients with lymph node staging pN0 had a higher pCR rate than those with lymph node staging pN1-pN2, and the difference was significant (P=0.006). During the follow-up, 34 patients had local recurrence or distant metastasis. The Kaplan-Meier survival curve showed that the 3-year disease-free survival (DFS) rates for patients with low SII before NAC and high SII before NAC were 87.8% and 82.8%, respectively, and the former was significantly higher than the latter (P=0.005); the 3-year DFS rates for patients with tumor sizes of T1-T2 and T3 were 89.0% and 67.5%, respectively, and the former was significantly higher than the latter (P=0.001); the 3-year DFS rates for patients with lymph node staging of pN0 and pN1-pN2 were 87.8% and 82.8%, respectively, and the former was significantly higher than the latter (P=0.009). Cox analysis showed that SII before NAC and tumor size were independent influencing factors of patients’ DFS (P=0.038, P=0.010, respectively).
Conclusion
SII has important clinical significance in predicting the efficacy and prognosis of NAC in TNBC patients, and it has the potential to be a biomarker.
Keywords: systemic immune-inflammation index, triple-negative breast cancer, neoadjuvant chemotherapy, prognosis
三阴性乳腺癌(triple-negative breast cancer,TNBC)是乳腺癌的一种亚型,占所有乳腺癌的15%~20%[1]。TNBC属于侵袭性乳腺癌,癌细胞具有高度异质性、核分级高,容易在早期就发生进展或者远处转移[2-3]。此外,TNBC不表达雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2),对内分泌治疗与靶向治疗均不敏感,其治疗手段相对缺乏[4]。因此,与其他亚型乳腺癌相比,TNBC的预后较差。新辅助化疗(neoadjuvant chemotherapy,NAC)用于保乳手术前以增加手术的可行性、术前评估肿瘤对化学药物治疗(以下简称为化疗)的敏感性以及根除机体中可能存在的微转移性病灶,但是由于肿瘤的异质性,TNBC患者对化疗的反应也存在显著差异[5]。因此,寻找能够反映NAC疗效、评估TNBC患者预后的生物学标志物迫在眉睫。
炎症在癌症的发病机制中起重要作用,与肿瘤细胞的增殖、侵袭及血管的生成密切相关[6]。中性粒细胞、淋巴细胞、单核细胞和血小板是血细胞的重要组成成分,各种血细胞之间的比值也可作为反映全身炎症状态的指标[7],如淋巴细胞-单核细胞比(LMR)、中性粒细胞-淋巴细胞比(NLR)、血小板-淋巴细胞比(PLR)等指标可用来预测肝细胞癌、胰腺癌、小细胞肺癌、胃癌、食道癌和前列腺癌等多种肿瘤的化疗反应及预后[8-9]。全身免疫炎症指数(systemic immune-inflammation index,SII)由(N×P)/L计算得到(N、P和L分别代表中性粒细胞计数、血小板计数和淋巴细胞计数),与基于2种类型血细胞的比值(如NLR和PLR)相比,通过3种类型血细胞数量计算得到的SII可能是一种能更均衡反映机体炎症状态的指标[10]。本研究旨在评估SII与NAC治疗TNBC疗效及预后的相关性。
1. 对象与方法
1.1. 对象
纳入标准:1)接受手术、化疗等系统治疗;2)若NAC后达病理完全缓解(pathological complete response,pCR),穿刺标本免疫组织化学染色(以下简称为免疫组化)结果须为TNBC;若NAC后未达到pCR,穿刺和术后标本免疫组化结果均须为TNBC;3)病理类型为浸润性导管癌或小叶癌;4)癌组织免疫组化提示ER(-)或ER(<1%)、PR(-)或PR(<1%)、HER-2(-)~(2+),但是HER-2(2+)的患者癌组织荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测结果须为阴性;5)有完整的随访资料。pCR定义为在乳腺癌原发灶中未发现恶性肿瘤的组织学证据或仅残留原位癌成分,淋巴结无癌成分残留。分子分型、pCR的判断依照《中国抗癌协会乳腺癌的诊治指南与规范(2019年版)》标准,淋巴结分期参考《AJCC癌症分期手册》(第8版)中临床TNM分期标准。排除标准:1)男性乳腺癌;2)妊娠期或哺乳期乳腺癌;3)合并其他系统恶性肿瘤;4)合并其他严重疾病,如严重的心脑血管疾病、风湿免疫性疾病、急慢性炎症、肝肾功能不全等。根据纳入和排除标准,通过海泰电子病历系统收集2015年1月至2019年6月在中南大学湘雅医院乳腺科手术的231例TNBC患者的临床资料。
1.2. 方法
根据患者化疗前1周的血常规结果计算NAC前SII。以NAC前SII的中位数412作为阈值,将患者分为NAC前低SII组(SII<412,115例)和NAC前高SII组(SII≥412,116例)[11]。
患者在所有化疗结束后的2~3个月内行血常规检查,根据检查结果计算化疗后SII。以化疗后SII的中位数474作为阈值,将患者分为化疗后低SII组(SII<474,115例)和化疗后高SII组(SII≥474,116例)[11]。
所有患者术后2年内每3~6个月复查1次,术后3~5年内每6个月复查1次。主要通过电话随访并结合门诊复查资料来了解患者的预后及生存情况。无病生存(disease-free survival,DFS)时间是手术后至首次疾病复发或死亡之间的时间。该研究计划已得到湘雅医院医学伦理委员会的批准(审批号:2019030220)。
1.3. 统计学处理
采用SPSS 23.0统计学软件进行分析,计数资料采用例(%)表示。采用Pearson's χ2检验分析TNBC患者SII与其他临床特征的关系以及TNBC患者NAC疗效与临床特征的关系;采用二元logistic分析TNBC患者NAC疗效的独立影响因素;采用Kaplan-Meier曲线分析患者生存预后的影响因素;采用Cox回归模型分析TNBC患者预后的独立影响因素。P<0.05为差异具有统计学意义。
2. 结 果
2.1. TNBC患者SII与其他临床特征的关系
在NAC前,不同年龄、肿块大小组之间SII的差异均有统计学意义(分别P=0.007和P=0.002);在化疗后,不同年龄、肿块大小、组织学分级、淋巴结分期、Ki-67组之间SII的差异均无统计学意义(均P>0.05,表1)。
表1.
TNBC患者临床特征与SII的关系
Table 1 Relationship between SII and other clinical characteristics of patients with TNBC
| 临床特征 | NAC前SII | 化疗后SII | ||||
|---|---|---|---|---|---|---|
| 低/[例(%)] | 高/[例(%)] | P | 低/[例(%)] | 高/[例(%)] | P | |
| 年龄/岁 | ||||||
| ≤49 | 47(40.9) | 68(59.1) | 0.007 | 56(48.7) | 59(51.3) | 0.742 |
| >49 | 68(58.6) | 48(41.4) | 59(50.9) | 57(49.1) | ||
| 肿块大小 | ||||||
| T1~T2 | 104(54.4) | 87(45.6) | 0.002 | 97(50.8) | 94(49.2) | 0.506 |
| T3 | 11(27.5) | 29(72.5) | 18(45.0) | 22(55.0) | ||
| 组织学分级 | ||||||
| Ⅰ~Ⅱ | 58(50.0) | 58(50.0) | 0.947 | 59(50.9) | 57(49.1) | 0.742 |
| Ⅲ | 57(49.1) | 58(50.9) | 56(48.7) | 59(51.3) | ||
| 淋巴结分期 | ||||||
| pN0 | 84(53.8) | 72(46.2) | 0.093 | 81(51.9) | 75(48.1) | 0.348 |
| pN1~pN2 | 31(41.3) | 44(58.7) | 34(45.3) | 41(54.7) | ||
| Ki-67/% | ||||||
| ≤14 | 54(48.6) | 57(51.4) | 0.740 | 62(55.9) | 49(44.1) | 0.076 |
| >14 | 61(50.8) | 59(59.2) | 53(44.2) | 67(55.8) | ||
2.2. TNBC患者NAC疗效与SII等临床特征的关系
NAC前低SII患者pCR率为15.7%;NAC前高SII患者pCR率为6.0%。NAC前低SII的患者较NAC前高SII的患者pCR率高,且差异有统计学意义(P=0.019)。淋巴结分期为pN0的患者156例,pCR率为14.7%;淋巴结分期为pN1~pN2的患者75例,pCR率为2.7%。淋巴结分期为pN0的患者较淋巴结分期为pN1~pN2的患者pCR率高,且差异有统计学意义(P=0.006,表2)。二元logistic回归分析结果显示:NAC前SII及淋巴结分期是TNBC患者NAC后能否获得pCR的独立影响因素(表3)。
表2.
TNBC患者NAC疗效与临床特征的关系
Table 2 Relationship between curative effect of NAC and clinical indicators in patients with TNBC
| 临床特征 | pCR/[例(%)] | P | |
|---|---|---|---|
| 否 | 是 | ||
| NAC前SII | |||
| 低 | 97(84.3) | 18(15.7) | 0.019 |
| 高 | 109(94.0) | 7(6.0) | |
| 年龄/岁 | |||
| ≤49 | 101(87.8) | 14(12.2) | 0.510 |
| >49 | 105(90.5) | 11(9.5) | |
| 肿块大小 | |||
| T1~T2 | 168(88.0) | 23(12.0) | 0.267 |
| T3 | 38(95.0) | 2(5.0) | |
| 组织学分级 | |||
| Ⅰ~Ⅱ | 104(89.7) | 12(10.3) | 0.814 |
| Ⅲ | 102(88.7) | 13(11.3) | |
| 淋巴结分期 | |||
| pN0 | 133(85.3) | 23(14.7) | 0.006 |
| pN1~pN2 | 73(97.3) | 2(2.7) | |
| Ki-67/% | |||
| ≤14 | 101(91.0) | 10(9.0) | 0.393 |
| >14 | 105(87.5) | 15(12.5) | |
表3.
TNBC患者NAC疗效的二元logistic回归分析
Table 3 Binary logistic regression analysis of NAC curative effect in TNBC patients
| 影响因素 | b | SE | Waldχ2 | P | 95% CI |
|---|---|---|---|---|---|
| NAC前SII | -0.955 | 0.473 | 4.073 | 0.044 | 0.152~0.973 |
| 淋巴结分期 | -1.751 | 0.755 | 5.380 | 0.020 | 0.040~0.762 |
2.3. 生存分析
在231例TNBC患者中,随访期间有34例患者发生局部复发或远处转移。截至2020年8月,随访4~64(中位时间36)个月,3年DFS率为73.1%。Kaplan-Meier生存曲线(图1)显示:NAC前低SII、NAC前高SII患者的3年DFS率分别为87.8%、82.8%,前者明显高于后者,差异有统计学意义(P=0.005);肿块大小为T1~T2、T3患者的3年DFS率分别为89.0%、67.5%,前者明显高于后者,差异有统计学意义(P=0.001);淋巴结分期为pN0,pN1~pN2患者的3年DFS率分别为87.8%、82.8%,前者明显高于后者,差异有统计学意义(P=0.009)。Cox分析结果显示:NAC前SII和肿块大小是患者DFS的独立影响因素(分别 P=0.038和P=0.010;表4)。
图1.
生存曲线分析
Figure 1 Analysis of survival curve A: Patients in the low SII group before NAC have a higher 3-year DFS rate. B: Patients with a smaller tumor have a higher 3-year DFS rate. C: Patients with pN0 of lymph node staging have a higher 3-year DFS rate.
表4.
TNBC患者DFS与临床特征的关系
Table 4 Relationship between DFS and clinicopathological indicators of TNBC patients
| 影响因素 | 单因素分析P | 多因素分析 | ||
|---|---|---|---|---|
| HR | 95% CI | P | ||
| NAC前SII | 0.005 | 2.219 | 1.044~4.718 | 0.038 |
| 低 | ||||
| 高 | ||||
| 化疗后SII | 0.253 | |||
| 低 | ||||
| 高 | ||||
| 年龄/岁 | 0.917 | |||
| ≤49 | ||||
| >49 | ||||
| 肿块大小 | 0.001 | 2.716 | 1.274~5.790 | 0.010 |
| T1~T2 | ||||
| T3 | ||||
| 组织学分级 | 0.051 | |||
| I~Ⅱ | ||||
| Ⅲ | ||||
| 淋巴结分期 | 0.009 | 1.606 | 0.778~3.315 | 0.200 |
| pN0 | ||||
| pN1~pN2 | ||||
| Ki-67/% | 0.912 | |||
| ≤14 | ||||
| >14 | ||||
3. 讨 论
在全球范围内,乳腺癌已成为女性群体中最常见的恶性肿瘤。尽管对乳腺癌的研究已取得重要进展,但其仍然是影响女性健康的主要问题。TNBC是乳腺癌中最具侵袭性的亚型,不能从激素或靶向治疗中受益,早期就具有较高的转移和复发风险,预后较差[12]。NAC在TNBC的治疗中起重要作用,在NAC初期就能够获得与患者化疗敏感性有关的信息,有利于对患者实行个体化治疗。接受NAC治疗后达到pCR的TNBC患者相比较于未达到pCR的患者有更好的预后[13]。因此,探索能反映TNBC患者预后及监测NAC疗效的生物学标志物具有重要的意义。本研究结果表明:NAC前SII和淋巴结分期是接受NAC治疗的TNBC患者能否获得pCR的独立影响因素;NAC前SII和肿块大小是TNBC患者DFS的独立影响因素。
研究[14-15]发现:在TNBC患者中,高SII与较差的总生存时间(overall survival,OS)和DFS相关,SII是OS和DFS的独立影响因素。Chen等[16]的研究发现:SII具有可重复、方便和无创的优点,可作为预测接受NAC的乳腺癌患者预后的有效指标,具有成为影响乳腺癌治疗决策的生物标志物的潜力。低SII值的乳腺癌患者3年、5年和10年DFS率高于高SII值的乳腺癌患者[16]。术前SII可能是预测乳腺癌患者术后OS的可靠指标,对临床预测预后及制订个性化治疗策略具有重要意义[17]。荟萃分析[18]结果表明:在乳腺癌患者中,SII高的患者OS、DFS较差。SII是影响乳腺癌患者预后的独立因素。在接受NAC的乳腺癌患者中,治疗前SII与OS显著相关,并且用SII预测预后的效果优于NLR和PLR[19]。
炎症反应一方面通过诱导基因突变在癌症的发生中发挥作用,另一方面炎症反应促进癌症的侵袭和转移,因此炎症反应与癌症的发生和发展密切相关[20]。2014年,Hu等[21]首次将SII作为预测肝细胞癌根治性切除术后患者预后的指标。SII由中性粒细胞、血小板及淋巴细胞3种类型血细胞的数量关系决定。其中,中性粒细胞通过调节与血管生成有关的趋化因子、生长因子和蛋白酶,影响肿瘤的血液供应和生长速度[22-23];同时,中性粒细胞在炎症反应中发挥重要作用,可能介导肿瘤的侵袭和转移[24]。血小板释放腺嘌呤核苷酸,对循环肿瘤细胞(circulating tumor cell,CTC)的上皮-间质转化(epithelial-mesenchymal transition,EMT)有重要影响[25]。中性粒细胞和血小板二者共同作用可保护CTC免受血流动力学的剪切力破坏和躲避NK细胞的杀伤。血小板还可分泌趋化因子和细胞因子,促进肿瘤细胞的转移和增殖[26-27]。淋巴细胞可分泌细胞因子和介导有效的细胞免疫,在控制肿瘤的生长和发展中起至关重要的作用[28]。循环中的淋巴细胞还可以抑制肿瘤细胞的增殖和转移,术前淋巴细胞计数升高的患者被认为有更好的预后[29]。因此,SII作为一种综合性评价指标,能够更全面地反映全身炎症状态。SII对预测TNBC患者NAC的疗效及预后具有重要的临床意义。
在临床工作中,可通过血常规检查获得SII,具有容易获取、可重复且成本低廉等优点[10]。但在广泛使用SII作为预测性临床指标之前,仍需要大样本的前瞻性研究验证SII的可靠性。因本研究结论是从相对较小的临床样本中通过回顾性分析得出,混杂偏倚的存在可能会影响结果的准确性[30]。
从2012年第1期开始,本刊对大家较熟悉的以下常用词汇,允许直接使用缩写,即首次出现时可不标注中文。
| 5-FU | 5-氟尿嘧啶 | FDA | 美国食品药品管理局 | NS | 生理氯化钠溶液 |
| 5-HT | 5-羟色胺 | FITC | 异硫氰酸荧光素 | PaCO2 | 动脉血二氧化碳分压 |
| ABC法 | 抗生物素蛋白-生物素酶复合物法 | GFP | 绿色荧光蛋白 | PaO2 | 动脉血氧分压 |
| ACh | 乙酰胆碱 | GSH | 谷胱甘肽 | PBS | 磷酸盐缓冲液 |
| AIDS | 获得性免疫缺陷综合征 | HAV | 甲型肝炎病毒 | PCR | 聚合酶链反应 |
| ALT | 丙氨酸转氨酶 | Hb | 血红蛋白 | PI3K | 磷脂酰肌醇3激酶 |
| AngII | 血管紧张素II | HBV | 乙型肝炎病毒 | PLT | 血小板 |
| APTT | 活化部分凝血活酶时间 | HCG | 人绒毛膜促性腺激素 | PT | 凝血酶原时间 |
| AST | 天冬氨酸转氨酶 | HCV | 丙型肝炎病毒 | PVDF | 聚偏二氟乙烯膜 |
| ATP | 三磷酸腺苷 | HDL-C | 高密度脂蛋白胆固醇 | PET/CT | 正电子发射计算机体层显像仪 |
| bFGF | 碱性成纤维细胞转化生长因子 | HE | 苏木精-伊红染色 | RBC | 红细胞 |
| BMI | 体重指数 | HGF | 肝细胞生长因子 | RNA | 核糖核酸 |
| BP | 血压 | HIV | 人类免疫缺陷病毒 | ROS | 活性氧 |
| BSA | 牛血清白蛋白 | HR | 心率 | real-time PCR | 实时聚合酶链反应 |
| BUN | 尿素氮 | HRP | 辣根过氧化物酶 | real-time RT-PCR | 实时反转录聚合酶链反应 |
| CCr | 内生肌酐清除率 | HSP | 热休克蛋白 | RT-PCR | 反转录聚合酶链反应 |
| CCK-8 | 细胞计数试剂盒-8 | HPF | 高倍视野 | SABC法 | 链霉抗生物素蛋白-生物素酶复合物法 |
| COX-2 | 环氧化酶-2 | IC50 | 半数抑制浓度 | SDS-PAGE | 十二烷基硫酸钠-聚丙烯酰胺凝胶 |
| Cr | 肌酐 | ICU | 重症监护病房 | SCr | 血肌酐 |
| CRP | C反应蛋白 | IFN | 干扰素 | SO2 | 血氧饱和度 |
| CT | 计算机体层摄影 | IL | 白细胞介素 | SOD | 超氧化物歧化酶 |
| CV | 变异系数 | iNOS | 诱导型一氧化氮合酶 | SP法 | 标记的链霉抗生物素蛋白-生物素法 |
| DAB | 二氨基联苯胺 | IPG | 固相pH梯度 | SPF | 无特定病原体 |
| ddH2O | 双蒸水 | JNK | 氨基末端激酶 | STAT3 | 信号转导和转录激活因子3 |
| DMEM | 杜尔贝科改良伊格尔培养基 | LDL-C | 低密度脂蛋白胆固醇 | Tbil | 总胆红素 |
| DMSO | 二甲基亚砜 | LPS | 内毒素/脂多糖 | TBST | Tris-盐酸洗膜缓冲液 |
| DNA | 脱氧核糖核酸 | MAP | 平均动脉压 | TC | 总胆固醇 |
| ECG | 心电图 | MAPK | 丝裂原活化蛋白激酶 | TG | 三酰甘油 |
| ECL | 增强化学发光法 | MDA | 丙二醛 | TGF | 转化生长因子 |
| ECM | 细胞外基质 | MMP | 基质金属蛋白酶 | Th | 辅助性T细胞 |
| EDTA | 乙二胺四乙酸 | MRI | 磁共振成像 | TLRs | Toll样受体 |
| EEG | 脑电图 | mTOR | 雷帕霉素靶蛋白 | TNF | 肿瘤坏死因子 |
| EGF | 表皮生长因子 | MTT | 四甲基偶氮唑盐微量酶反应 | TUNEL | 原位末端标记法 |
| ELISA | 酶联免疫吸附测定 | NADPH | 烟酰胺腺嘌呤二核苷酸 | VEGF | 血管内皮生长因子 |
| eNOS | 内皮型一氧化氮合酶 | NF-κB | 核因子-κB | VLDL-C | 极低密度脂蛋白胆固醇 |
| ERK | 细胞外调节蛋白激酶 | NK细胞 | 自然杀伤细胞 | vWF | 血管性血友病因子 |
| ESR | 红细胞沉降率 | NO | 一氧化氮 | WBC | 白细胞 |
| FBS | 胎牛血清 | NOS | 一氧化氮合酶 | WHO | 世界卫生组织 |
基金资助
国家自然科学基金(81974420)。
This work was supported by the National Natural Science Foundation of China (81974420).
利益冲突声明
作者声称无任何利益冲突。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/202109958.pdf
参考文献
- 1. Zhang Y, He Q, Hu Z, et al. Long noncoding RNA LINP1 regulates repair of DNA double-strand breaks in triple-negative breast cancer[J]. Nat Struct Mol Biol, 2016, 23(6): 522-530. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Nie L, Wei Y, Zhang F, et al. CDK2-mediated site-specific phosphorylation of EZH2 drives and maintains triple-negative breast cancer[J]. Nat Commun, 2019, 10(1): 5114. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3. Hu MH, Wu TY, Huang Q, et al. New substituted quinoxalines inhibit triple-negative breast cancer by specifically downregulating the c-MYC transcription[J]. Nucleic Acids Res, 2019, 47(20): 10529-10542. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4. Annunziato S, Ruiter JR de, Henneman L, et al. Comparative oncogenomics identifies combinations of driver genes and drug targets in BRCA1-mutated breast cancer[J]. Nat Commun, 2019, 10(1): 397. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5. Schafer JM, Lehmann BD, Gonzalez-Ericsson PI, et al. Targeting MYCN-expressing triple-negative breast cancer with BET and MEK inhibitors[J]. Sci Transl Med, 2020, 12(534): eaaw8275. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6. Coussens LM, Werb Z. Inflammation and cancer[J]. Nature, 2002, 420(6917): 860-867. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Jain D, Hodonsky CJ, Schick UM, et al. Genome-wide association of white blood cell counts in Hispanic/Latino Americans: the Hispanic Community Health Study/Study of Latinos[J]. Hum Mol Genet, 2017, 26(6): 1193-1204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Proctor MJ, McMillan DC, Morrison DS, et al. A derived neutrophil to lymphocyte ratio predicts survival in patients with cancer[J]. Br J Cancer, 2012, 107(4): 695-699. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Okada S, Shimada J, Kato D, et al. Clinical significance of prognostic nutritional index after surgical treatment in lung cancer[J]. Ann Thorac Surg, 2017, 104(1): 296-302. [DOI] [PubMed] [Google Scholar]
- 10. Yilmaz A, Mirili C, Bilici M, et al. A novel predictor in patients with gastrointestinal stromal tumors: Systemic immune-inflammation index (SII)[J]. J BUON, 2019, 24(5): 2127-2135. [PubMed] [Google Scholar]
- 11. Dong X, Liu C, Yuan J, et al. Prognostic roles of neutrophil-to-lymphocyte ratio and stromal tumor-infiltrating lymphocytes and their relationship in locally advanced triple-negative breast cancer treated with neoadjuvant chemotherapy[J]. Breast Care, 2020: 1-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Bonotto M, Gerratana L, Poletto E, et al. Measures of outcome in metastatic breast cancer: insights from a real-world scenario[J]. Oncologist, 2014, 19(6): 608-615. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13. Liedtke C, Mazouni C, Hess KR, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer[J]. J Clin Oncol, 2008, 26(8): 1275-1281. [DOI] [PubMed] [Google Scholar]
- 14. Liu J, Shi Z, Bai Y, et al. Prognostic significance of systemic immune-inflammation index in triple-negative breast cancer[J]. Cancer Manag Res, 2019, 11: 4471-4480. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. Wang P, Yue W, Li W, et al. Systemic immune-inflammation index and ultrasonographic classification of breast imaging-reporting and data system predict outcomes of triple-negative breast cancer[J]. Cancer Manag Res, 2019, 11: 813-819. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Chen L, Kong X, Wang Z, et al. Pre-treatment systemic immune-inflammation index is a useful prognostic indicator in patients with breast cancer undergoing neoadjuvant chemotherapy[J]. J Cell Mol Med, 2020, 24(5): 2993-3021. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Hua X, Long ZQ, Zhang YL, et al. Prognostic value of preoperative systemic immune-inflammation index in breast cancer: A propensity score-matching study[J]. Front Oncol, 2020, 10: 580. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Zhang Y, Sun Y, Zhang Q. Prognostic value of the systemic immune-inflammation index in patients with breast cancer: a meta-analysis[J]. Cancer Cell Int, 2020, 20: 224. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Jiang C, Lu Y, Zhang S, et al. Systemic immune-inflammation index is superior to neutrophil to lymphocyte ratio in prognostic assessment of breast cancer patients undergoing neoadjuvant chemotherapy[J]. Biomed Res Int, 2020: 7961568. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20. Grivennikov SI, Greten FR, Immunity Karin M., inflammation, and cancer [J]. Cell, 2010, 140(6): 883-899. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Hu B, Yang XR, Xu Y, et al. Systemic immune-inflammation index predicts prognosis of patients after curative resection for hepatocellular carcinoma[J]. Clin Cancer Res, 2014, 20(23): 6212-6222. [DOI] [PubMed] [Google Scholar]
- 22. Cools-Lartigue J, Spicer J, McDonald B, et al. Neutrophil extracellular traps sequester circulating tumor cells and promote metastasis[J]. J Clin Invest, 2013, 123(8): 3446-3458. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23. Hung HY, Chen JS, Yeh CY, et al. Effect of preoperative neutrophil-lymphocyte ratio on the surgical outcomes of stage II colon cancer patients who do not receive adjuvant chemotherapy[J]. Int J Colorectal Dis, 2011, 26(8): 1059-1065. [DOI] [PubMed] [Google Scholar]
- 24. Tan KW, Chong SZ, Wong FHS, et al. Neutrophils contribute to inflammatory lymphangiogenesis by increasing VEGF-A bioavailability and secreting VEGF-D[J]. Blood, 2013, 122(22): 3666-3677. [DOI] [PubMed] [Google Scholar]
- 25. Labelle M, Begum S, Hynes RO. Platelets guide the formation of early metastatic niches[J]. Proc Natl Acad Sci USA, 2014, 111(30): E3053-E3061. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. Gil-Bernabé AM, Ferjancic S, Tlalka M, et al. Recruitment of monocytes/macrophages by tissue factor-mediated coagulation is essential for metastatic cell survival and premetastatic niche establishment in mice[J]. Blood, 2012, 119(13): 3164-3175. [DOI] [PubMed] [Google Scholar]
- 27. Schumacher D, Strilic B, Sivaraj KK, et al. Platelet-derived nucleotides promote tumor-cell transendothelial migration and metastasis via P2Y2 receptor[J]. Cancer Cell, 2013, 24(1): 130-137. [DOI] [PubMed] [Google Scholar]
- 28. Ogiya R, Niikura N, Kumaki N, et al. Comparison of tumor-infiltrating lymphocytes between primary and metastatic tumors in breast cancer patients[J]. Cancer Sci, 2016, 107(12): 1730-1735. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29. Ding PR, An X, Zhang RX, et al. Elevated preoperative neutrophil to lymphocyte ratio predicts risk of recurrence following curative resection for stage IIA colon cancer[J]. Int J Colorectal Dis, 2010, 25(12): 1427-1433. [DOI] [PubMed] [Google Scholar]
- 30. Li C, Tian W, Zhao F, et al. Systemic immune-inflammation index, SII, for prognosis of elderly patients with newly diagnosed tumors[J]. Oncotarget, 2018, 9(82): 35293-35299. [DOI] [PMC free article] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.
Supplementary Materials
从2012年第1期开始,本刊对大家较熟悉的以下常用词汇,允许直接使用缩写,即首次出现时可不标注中文。
| 5-FU | 5-氟尿嘧啶 | FDA | 美国食品药品管理局 | NS | 生理氯化钠溶液 |
| 5-HT | 5-羟色胺 | FITC | 异硫氰酸荧光素 | PaCO2 | 动脉血二氧化碳分压 |
| ABC法 | 抗生物素蛋白-生物素酶复合物法 | GFP | 绿色荧光蛋白 | PaO2 | 动脉血氧分压 |
| ACh | 乙酰胆碱 | GSH | 谷胱甘肽 | PBS | 磷酸盐缓冲液 |
| AIDS | 获得性免疫缺陷综合征 | HAV | 甲型肝炎病毒 | PCR | 聚合酶链反应 |
| ALT | 丙氨酸转氨酶 | Hb | 血红蛋白 | PI3K | 磷脂酰肌醇3激酶 |
| AngII | 血管紧张素II | HBV | 乙型肝炎病毒 | PLT | 血小板 |
| APTT | 活化部分凝血活酶时间 | HCG | 人绒毛膜促性腺激素 | PT | 凝血酶原时间 |
| AST | 天冬氨酸转氨酶 | HCV | 丙型肝炎病毒 | PVDF | 聚偏二氟乙烯膜 |
| ATP | 三磷酸腺苷 | HDL-C | 高密度脂蛋白胆固醇 | PET/CT | 正电子发射计算机体层显像仪 |
| bFGF | 碱性成纤维细胞转化生长因子 | HE | 苏木精-伊红染色 | RBC | 红细胞 |
| BMI | 体重指数 | HGF | 肝细胞生长因子 | RNA | 核糖核酸 |
| BP | 血压 | HIV | 人类免疫缺陷病毒 | ROS | 活性氧 |
| BSA | 牛血清白蛋白 | HR | 心率 | real-time PCR | 实时聚合酶链反应 |
| BUN | 尿素氮 | HRP | 辣根过氧化物酶 | real-time RT-PCR | 实时反转录聚合酶链反应 |
| CCr | 内生肌酐清除率 | HSP | 热休克蛋白 | RT-PCR | 反转录聚合酶链反应 |
| CCK-8 | 细胞计数试剂盒-8 | HPF | 高倍视野 | SABC法 | 链霉抗生物素蛋白-生物素酶复合物法 |
| COX-2 | 环氧化酶-2 | IC50 | 半数抑制浓度 | SDS-PAGE | 十二烷基硫酸钠-聚丙烯酰胺凝胶 |
| Cr | 肌酐 | ICU | 重症监护病房 | SCr | 血肌酐 |
| CRP | C反应蛋白 | IFN | 干扰素 | SO2 | 血氧饱和度 |
| CT | 计算机体层摄影 | IL | 白细胞介素 | SOD | 超氧化物歧化酶 |
| CV | 变异系数 | iNOS | 诱导型一氧化氮合酶 | SP法 | 标记的链霉抗生物素蛋白-生物素法 |
| DAB | 二氨基联苯胺 | IPG | 固相pH梯度 | SPF | 无特定病原体 |
| ddH2O | 双蒸水 | JNK | 氨基末端激酶 | STAT3 | 信号转导和转录激活因子3 |
| DMEM | 杜尔贝科改良伊格尔培养基 | LDL-C | 低密度脂蛋白胆固醇 | Tbil | 总胆红素 |
| DMSO | 二甲基亚砜 | LPS | 内毒素/脂多糖 | TBST | Tris-盐酸洗膜缓冲液 |
| DNA | 脱氧核糖核酸 | MAP | 平均动脉压 | TC | 总胆固醇 |
| ECG | 心电图 | MAPK | 丝裂原活化蛋白激酶 | TG | 三酰甘油 |
| ECL | 增强化学发光法 | MDA | 丙二醛 | TGF | 转化生长因子 |
| ECM | 细胞外基质 | MMP | 基质金属蛋白酶 | Th | 辅助性T细胞 |
| EDTA | 乙二胺四乙酸 | MRI | 磁共振成像 | TLRs | Toll样受体 |
| EEG | 脑电图 | mTOR | 雷帕霉素靶蛋白 | TNF | 肿瘤坏死因子 |
| EGF | 表皮生长因子 | MTT | 四甲基偶氮唑盐微量酶反应 | TUNEL | 原位末端标记法 |
| ELISA | 酶联免疫吸附测定 | NADPH | 烟酰胺腺嘌呤二核苷酸 | VEGF | 血管内皮生长因子 |
| eNOS | 内皮型一氧化氮合酶 | NF-κB | 核因子-κB | VLDL-C | 极低密度脂蛋白胆固醇 |
| ERK | 细胞外调节蛋白激酶 | NK细胞 | 自然杀伤细胞 | vWF | 血管性血友病因子 |
| ESR | 红细胞沉降率 | NO | 一氧化氮 | WBC | 白细胞 |
| FBS | 胎牛血清 | NOS | 一氧化氮合酶 | WHO | 世界卫生组织 |