Abstract
骨外尤因肉瘤发病率很低,起源于甲状腺的骨外尤因肉瘤更少有报道。骨外尤因肉瘤的临床表现无特异性,早期诊断困难,诊断主要依靠病理组织学及免疫组织化学检查。此病恶性程度高,局部复发及远处转移率较高,目前主要采取手术、化学治疗及放射治疗等综合治疗方案。中南大学湘雅二医院耳鼻咽喉头颈外科2018年收治1例30岁以左锁骨上肿块及吞咽梗阻感为首发表现的女性患者,术前检查显示甲状腺左侧叶后下方、气管-食管后方见囊性和实性混合肿块影。入院后患者行肿块切除术,术后病理结果显示为小圆形细胞恶性肿瘤,结合免疫组织化学结果考虑为骨外尤因肉瘤。患者随后进行了化学治疗和放射治疗,随访期间未见明显肿瘤复发及转移表现。
Keywords: 骨外尤因肉瘤, 甲状腺, 诊断, 治疗
Abstract
Extraskeletal Ewing sarcoma is a rare event, and extraskeletal Ewing sarcoma of the thyroid gland is even rarer. It has non-specific clinical manifestation and difficulty in early diagnosis. The diagnosis mainly depends on histology and immunohistochemistry. It possesses the features of high malignancy, high rate of local recurrence, and distant metastasis. Currently, the aggressive multimodal treatment contains surgery, chemotherapy, and radiotherapy. This study presented a case of extraskeletal Ewing sarcoma arising in the thyroid gland of a 30-year-old woman, who presented with supraclavicular mass and sense of dysphagia obstruction in Department of Otolaryngology, Head and Neck Surgery, Second Xiangya Hospital, Central South University in 2018. Imaging studies demonstrated a cystic-solid mass in inferior of the left leaf of thyroid gland and in the posterior of the trachea and esophagus. The patient underwent localized tumor resection. The pathological diagnosis revealed that it was a small round cell tumor, and the immunohistochemistry results were considered to be extraskeletal Ewing sarcoma. Subsequently, the patient was given chemotherapy and local radiation therapy. There was no evidence of tumor recurrence or metastasis.
Keywords: extraskeletal Ewing sarcoma, thyroid gland, diagnosis, treatment
骨外尤因肉瘤(extraskeletal Ewing sarcoma,EES)是一种起源于软组织的高度恶性的肿瘤,它和骨尤因肉瘤有相似的组织学和分子遗传学特点。EES属于尤因肉瘤,占所有尤因肉瘤的6%~47%[1]。EES的发病率很低,发生于甲状腺的病例报道非常罕见[2-6]。中南大学湘雅二医院耳鼻咽喉头颈外科(以下简称我科)2018年确诊1例原发于甲状腺的EES,现报告如下,并复习相关文献,以期提高临床工作者对该病的认识及诊断和治疗水平。
1. 临床资料
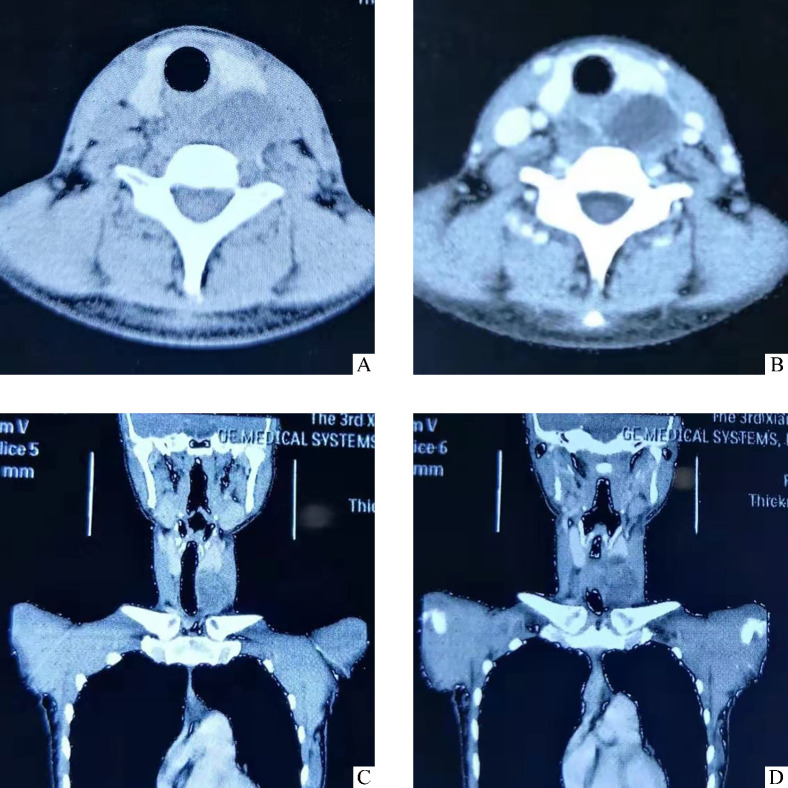
患者,女,30岁,汉族。因“左颈部进行性增大肿块伴吞咽梗阻感1月余”于2018年7月入我科治疗。患者不伴发热、疼痛,无乏力、声嘶及呼吸困难等不适。既往体健,无异常家族史。入院后体格检查:颈前锁骨上方偏左可扪及6 cm×4 cm大小肿物,肿块上缘约平环状软骨上缘,质软,表面光滑,边界清晰,活动欠佳,表面皮肤无红肿、溃疡等。入院后行术前相关检查。血常规、大小便常规、肝肾功能、电解质、血糖、凝血功能、肝炎全套、HIV及梅毒抗体、甲状旁腺素、甲状腺功能及抗体均未见明显异常。颈部B超显示:颈前囊性为主的混合回声包块,其内实性部分呈蜂窝样,横跨气管后方,食管被推挤向右侧,甲状腺右侧叶及峡部未见明显结节,左侧叶下极处与肿块分界欠清,颈部未见明显肿大淋巴结。颈胸部CT示:于甲状腺左侧叶后下方、气管-食管后方见囊性和实性混合肿块影,约 6.2 cm×4.8 cm×2.6 cm,增强扫描后实性部分明显不均匀强化,囊性部分无强化,病变边界较清,甲状腺左侧叶受压向前上方移位,食管侧后壁受压,纵隔未见明显异常密度及强化灶,未见明显肿大淋巴结影(图1)。
图1.
患者术前颈胸部CT
Figure 1 Cervical and thoracic CT before operation
A: Axial view of non-contrast CT scan; B: Axial view of contrast CT scan; C: Coronal view of contrast CT scan; D: Coronal view of non-contrast CT scan.
结合以上病史、体格检查及相关辅助检查结果,术前诊断考虑颈部肿物,性质待查。入院后与患者沟通,患者拒绝术前肿块细针穿刺活检。遂于2018年7月行颈部肿块切除术,术中可见胸锁乳突肌和带状肌之间的囊实性肿块,大小约6.0 cm×5.0 cm×3.0 cm,肿块包膜完整,囊壁极薄,在分离过程中囊壁极易破损,内有血性囊液。肿块将气管及食管推向右侧移位,甲状腺左侧叶被推挤向上移位。在分离过程中发现肿块与气管及食管均无明显关系,但与甲状腺左侧叶下极靠背侧处分界不清。术中取部分肿瘤组织送快速冰冻切片,可见小圆形细胞增生,遂同时切除部分甲状腺左侧叶组织。患者术后予放置负压引流管,并于术后第4天拔除。术后患者伤口恢复好,无明显并发症发生。
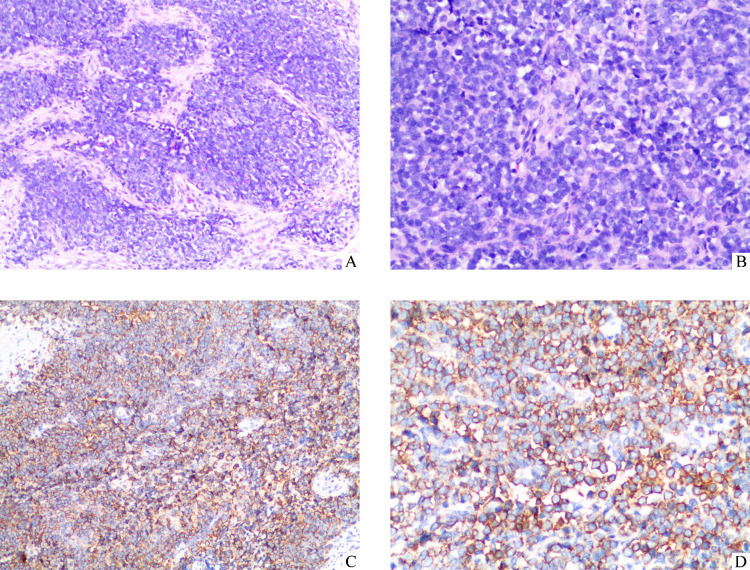
术后普通石蜡切片结果显示为小圆形细胞恶性肿瘤,结合免疫组织化学结果考虑为EES。免疫组织化学:CD99(+)、FLI-1(+)、CK(灶性+)、Ki-67(20%+)、S100(部分+)、神经元特异性烯醇化酶(neuron-specific enolase,NSE)(灶性+)、CD34(血管+)、CD31(血管+)、ERG(+)、Syn(-)、CgA(-)、HMB45(-)、SOX-10(-)、Melan-A(-)、白细胞共同抗原(leukocyte common antigen,LCA)(-)、WT-1(-)、Desmin(-)、MyoD1(-)、Myogenin(-)、人类疱疹病毒8型(human herpesvirus 8,HHV8)(-)(图2)。
图2.
甲状腺骨外尤因肉瘤的病理结果
Figure 2 Pathological results of EES for thyroid gland
A, B: Hematoxylin and eosin stain shows a uniform population of small round blue cells; C, D: Immunohistochemistry of CD99 shows diffuse strong membrane staining. A, C: ×100; B, D: ×200.
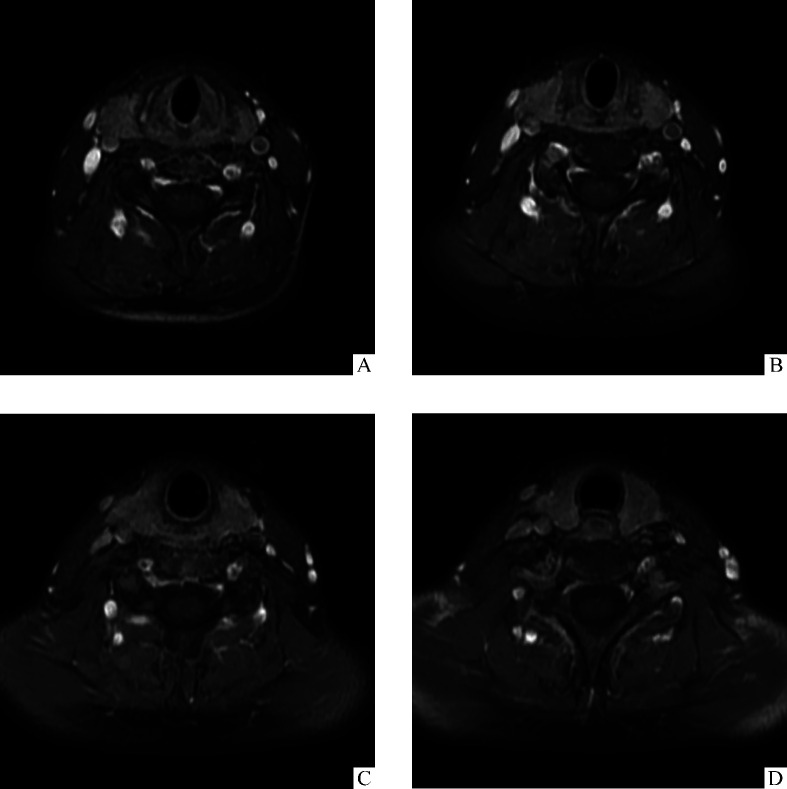
患者术后行PET-CT检查,结果为全身各部位均未见明显糖代谢异常增高灶。患者于2018年9月开始行化学治疗(以下简称化疗),VDC方案(多柔比星75 mg+硫酸长春地辛3 mg+环磷酰胺1 500 mg)和IE方案(异环磷酰胺14 g+依托泊苷700 mg)交替。2018年12月初开始行颈部放射治疗(以下简称放疗),总剂量50 Gy。患者术后定期复查,2019年12月复查颈部MRI未见明显复发征象(图3)。
图3.
术后17个月颈部MRI示肿瘤无复发
Figure 3 Cervical MRI after 17 months of the surgery shows there is no signs of tumor recurrence A-D: MRI of different anatomical section.
2. 讨 论
Tefft等[7]于1969年最早描述EES——一组起源于全身软组织的小圆细胞类恶性肿瘤,肿瘤细胞具有不同程度的神经外胚层分化能力。EES临床上罕见,发病率极低,可发生于任何年龄,但多见于青年人,约占全身各部位软组织肉瘤的1%[1]。EES可发生于肾、胰腺、颅内、肺或女性生殖器官等部位[8-13]。发生于头颈部的EES一般位于鼻腔、鼻窦、口咽部、皮肤软组织、咽旁间隙及喉部等[14-17]。而原发于甲状腺的EES极为罕见,国内尚未见相关报道,通过复习国外相关研究[2-6],笔者对原发于甲状腺的EES病例的临床资料进行了总结和归纳(表1)。
表1.
7例甲状腺骨外尤因肉瘤患者的临床和病理资料
Table 1 Clinical and pathological data of 7 patients with extraskeletal Ewing sarcoma of thyroid gland
| 文献 | 发表时间 | 年龄/岁 | 性别 | 临床症状 | 原发肿瘤大小 | 甲状腺 功能 | 既往病史 | 免疫组织化学 及染色体易位 | 治疗 | 预后 |
|---|---|---|---|---|---|---|---|---|---|---|
| Adapa等[2] | 2009年 | 9 | 女 | 右颈部光滑 无痛性肿块 | 4.0 cm×4.5 cm×6.0 cm | 正常 | 无 | CD99、Vimentin、NSE均(+);染色体易位(+) | 术前化疗(VDC/IE)+右侧甲状腺及带状肌切除+术后放疗 | 至术后6年未见明显复发及转移 |
| Maldi等[3] | 2012年 | 66 | 男 | PET-CT发现 左侧甲状腺 肿块 | 直径约4.5 cm | 正常 | 大B细胞淋巴瘤化疗后 | CD99、NSE、Vimentin, Syn均(+); 染色体易位(+) | 甲状腺全切术 | 术后8个月发现转移灶 |
| Chan等[4] | 2013年 | 23 | 男 | 右颈部无 痛性肿块 | 直径约4.7 cm | 正常 | 无 | CD99、Syn、Chromogranin均(+);染色体 易位(+) | 甲状腺全切术+颈淋巴结清扫+术后放化疗(VDC/IE) | |
| Chan等[4] | 2013年 | 67 | 女 | 颈部B超发现右侧甲状腺 结节增大 | 直径约4.0 cm | 左侧乳腺导管原位癌术后 放疗后 | CD99、Vimentin、Pankeratin、 AE1/3均(+); 染色体易位(+) | 甲状腺全切术+术后化疗(VDC/IE) | 至术后22个月未见明显复发及转移 | |
| Chirila等[5] | 2013年 | 48 | 男 | 颈部巨大肿块伴急性上呼吸道梗阻 | 10 cm× 10 cm | 之前被误诊为甲状腺淋巴瘤,并进行了化疗后 | CD99、 Vimentin均(+) | 甲状腺全切术+喉全切术+气管部分切除术+术后化疗(依托泊苷,卡铂) | 术后1个月死于脑转移 | |
| Kabata等[6] | 2017年 | 34 | 男 | 左颈部较大肿块伴声嘶、 吞咽困难 | 5.8 cm×6.0 cm | 正常 | 无 |
CD99、PAS、Syn、AE1/3、Cam5.2均(+); 染色体易位(+) |
术前化疗(VDC/IE)+左侧甲状腺切除+颈淋巴结清扫+术后放疗 | 至术后18个月未见明显复发及转移 |
| 本病例 | 36 | 女 | 左颈部肿块伴吞咽梗阻感 | 6.0 cm× 5.0 cm× 3.0 cm | 正常 | 无 | CD99、FLI-1、NSE、ERG均(+) | 甲状腺左侧叶部分切除+术后放化疗(VDC/IE) | 至术后17个月未见明显复发及转移 |
EES一般没有特异性的临床症状,最常见的临床症状就是肿块,且多为深部肿块,因为肿块生长迅速,所以患者发现时往往肿块已经比较大。次要的症状是出血,当肿块生长到一定的程度时,肿块内组织可发生坏死、出血;另外,由于肿块压迫还会导致局部的肌肉活动受限及其他组织受压产生的相关症状[18]。对于原发于甲状腺的EES,最常见的临床表现是颈部肿块,可伴声音嘶哑或者呼吸困难[2-6]。本例患者的主要症状除颈部肿块外,由于肿块压迫了食管,因此还存在吞咽梗阻感。
EES很少直接侵犯骨质,而且无明显钙化,X线征象没有骨尤因肉瘤所特有的洋葱皮样影像学特征,因此X线检查临床意义不大。B超一般显示肿块部位为低回声区或无回声区。CT多呈低密度软组织影,常因肿块内出血、坏死而显示为密度不均,增强后无特殊变化。本例患者CT影像中囊实混合性肿块的表现符合EES的CT表现。手术证实肿块中囊性部分的改变是肿块内的出血、坏死所致。在文献[2-6]报道的原发于甲状腺的6例EES中,CT表现以实质性肿块居多,而且多数病例有气管的受压移位改变,只有1例患者的肿瘤向喉及气管内浸润生长。EES的MRI表现以T1等信号,T2高信号多见,强化效应明显,呈不均匀改变[19]。而对于查找EES有无全身转移灶及评估肿瘤疗效方面,PET-CT有非常重要的作用。
EES的临床诊断困难,确诊主要依赖病理组织学及免疫组织化学检查。EES在病理上与骨尤因肉瘤相似,镜下肿瘤细胞的特点为:形态大小一致,呈小圆形或卵圆形,排列紧密,弥漫分布呈片状或不规则分叶状。病理上主要需与淋巴瘤、胚胎性横纹肌肉瘤、无色素的小细胞恶性黑色素瘤等小圆细胞肿瘤鉴别。EES的免疫组织化学表型具有向神经分化的特征性表达,以CD99、FLI-1、NSE和Syn高表达为相对特异性的诊断指标,部分患者S100、CgA也可呈阳性表达,但缺乏特异性,而LCA、TdT、CD30等淋巴瘤标志,CEA、EMA等上皮标志,ACT、MG等肌源性标志一般为阴性。一般认为CD99联合FLI-1高表达是确诊该病较为特异且敏感的免疫组织化学指标[20]。本例患者CD99、FLI-1、NSE及S100均为阳性,符合EES的诊断标准。另外,约85%的EES患者伴有t(11; 22)和q(q24, q12)染色体易位,这也被认为是EES的特异性诊断指标,有助于协助诊断[20]。在文献[2-6]报道的原发于甲状腺的6例EES中,CD99均为阳性,有3例NSE为阳性。对于染色体易位,除了1例患者未做此项检查外,另5例均为阳性[2-6]。
目前,主要根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中对尤因肉瘤的治疗方案处理原发于甲状腺的EES,多采用局部手术切除为主,联合术后化疗和/或放疗的综合治疗方案[21]。EES对放疗敏感,疗效较佳,推荐剂量为50~60 Gy。对于某些因解剖位置不适合手术或无法广泛切除肿瘤的患者,精确的放疗可能成为一种有效的治疗手段[22]。针对EES有多种化疗方案,VDC方案和IE方案交替使用是NCCN指南[23]中首选的治疗方案。化疗剂量和化疗周期数与疗效尚未建立明确的效应关系,在多数情况下需要根据化疗后影像学的变化来调整方案,但NCCN指南推荐化疗周期至少12周。Chirila等[5]报道的病例因前期病理误诊为淋巴瘤,导致化疗效果不佳,肿块广泛侵犯喉及气管,因此行甲状腺全切及喉、气管切除,但由于肿瘤已属晚期且全身转移,术后1个月患者死亡。Maldi等[3]报道大B细胞淋巴瘤患者化疗后,复查过程中发现原发于甲状腺的EES,行甲状腺全切,但由于其基础疾病较多,未行术后放化疗,此例患者术后8个月发现转移灶。其余4例原发于甲状腺的EES患者行手术切除及术前或术后放化疗预后尚可[2, 4, 6]。本例患者因甲状腺右侧叶无明显被肿瘤侵犯的征象,术前检查亦未发现颈部有明显肿大的淋巴结,故只做了甲状腺左侧叶部分及肿瘤切除,术后VDC和IE化疗方案交替使用,并加做了总剂量为50 Gy的放疗,术后17个月的MRI复查结果显示无明显复发及转移征象。由于甲状腺EES的病例数较少,化疗和/或放疗是术前做还是术后做,甲状腺的切除方式及颈淋巴结切除范围如何选择,这些问题目前尚无标准的答案。
EES非常罕见,术前诊断困难,最终需结合镜下病理和免疫组织化学证实。由于恶性程度高,生长迅速,常无痛感,但转移率高,较容易发生血行转移,预后较差。最佳治疗方案是早期手术切除原发灶并辅以局部化疗和/或放疗,术后需常规定期随访。
基金资助
国家自然科学基金(81502662);深圳市“医疗卫生三名工程”(SZSM201911006)。
This work was supported by the National Natural Science Foundation (81502662) and the “Sanming Project of Medicine” in Shenzhen (SZSM201911006), China.
利益冲突声明
作者声称无任何利益冲突。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/202105558.pdf
参考文献
- 1. Torabi SJ, Izreig S, Kasle DA, et al. Clinical characteristics and treatment-associated survival of head and neck Ewing sarcoma[J]. Laryngoscope, 2020, 130(10): 2385-2392. [DOI] [PubMed] [Google Scholar]
- 2. Adapa P, Chung TW, Popek EJ, et al. Extraosseous Ewing sarcoma of the thyroid gland[J]. Pediatr Radiol, 2009, 39(12): 1365-1368. [DOI] [PubMed] [Google Scholar]
- 3. Maldi E, Monga G, Rossi D, et al. Extraosseous Ewing sarcoma of the thyroid gland mimicking lymphoma recurrence: a case report[J]. Pathol Res Pract, 2012, 208(6): 356-359. [DOI] [PubMed] [Google Scholar]
- 4. Chan JM, Bilodeau E, Celin S, et al. Ewing sarcoma of the thyroid: report of 2 cases and review of the literature[J]. Head Neck, 2013, 35(11): E346-E350. [DOI] [PubMed] [Google Scholar]
- 5. Chirila M, Muresan M, Ciuleanu E, et al. Extraosseous Ewing sarcoma and peripheral primitive neuroectodermal tumor of the thyroid gland: case report and review[J]. Ear Nose Throat J, 2013, 92(4/5): 3-6. [DOI] [PubMed] [Google Scholar]
- 6. Kabata P, Kaniuka-Jakubowska S, Kabata W, et al. Primary Ewing sarcoma of the thyroid-eight cases in a decade: a case report and literature review[J]. Front Endocrinol (Lausanne), 2017, 8: 257. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Tefft M, Vawter GF, Mitus A. Paravertebral: “Round cell” tumors in children[J]. Radiology, 1969, 92(7): 1501-1509. [DOI] [PubMed] [Google Scholar]
- 8. Mashriqi N, Gujjarlapudi JK, Sidhu J, et al. Ewing’s sarcoma of the cervix, a diagnostic dilemma: a case report and review of the literature[J]. J Med Case Rep, 2015, 9: 255. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Machado L, AI-Hamdani A, Sankhla DK, et al. Extraosseous Ewing sarcoma of the vagina: a rare entity[J]. Ann Saudi Med, 2013, 33(2): 182-186. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. Saif MW, Kaley K. Extraosseous Ewing’s sarcoma of the pancreas: an uncommon but treatable disease[J]. Cureus, 2017, 9(11): e1882. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Shet N, Stanescu L, Deutsch G. Primary extraosseous Ewing sarcoma of the lung: case report and literature review[J]. Radiol Case Rep, 2015, 8(2): 832. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Sohail AH, Sachal M, Arif Maan MA, et al. Primary intracranial extraosseous Ewing’s sarcoma[J]. Childs Nerv Syst, 2019, 35(3): 541-545. [DOI] [PubMed] [Google Scholar]
- 13. Vrdoljak DV, Sitic S, Stanec M, et al. Primary Ewing’s sarcoma of the kidney: a case report[J]. Coll Antropol, 2012, 36(2): 673-676. [PubMed] [Google Scholar]
- 14. Adapa P, Chung TW, Popek EJ, et al. Extraosseous Ewing sarcoma of the thyroid gland[J]. Pediatr Radiol, 2009, 39(12): 1365-1368. [DOI] [PubMed] [Google Scholar]
- 15. Maroun CA, Khalifeh I, Tfayli A, et al. Primary Ewing sarcoma of the larynx with distant metastasis: a case report and review of the literature[J]. Curr Oncol, 2019, 26(4): e574-e577. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Khosla D, Verma S, Punia RS, et al. Extraosseous Ewing’s sarcoma of the parapharyngeal space -a rare entity-with review of literature[J]. Iran J Otorhinolaryngol, 2019, 31(102): 51-54. [PMC free article] [PubMed] [Google Scholar]
- 17. 杨奉玲, 赵宇, 黄石, 等. 头颈部骨外尤文氏肉瘤4例并文献复习[J]. 临床耳鼻咽喉头颈外科杂志, 2013, 27(18): 1000-1005. [PubMed] [Google Scholar]; YANG Fengling, ZHAO Yu, HUANG Shi, et al. Four cases of extraskeletal Ewing’s sarcoma in the head and neck and literature review[J]. Journal of Clinical Otorhinolaryngology Head and Neck Surgery, 2013, 27(18): 1000-1005. [PubMed] [Google Scholar]
- 18. Kennedy JG, Eustace S, Caulfield R, et al. Extraskeletal Ewing’s sarcoma: a case report and review of the literature[J]. Spine(Phila Pa 1976), 2000, 25(15): 1996-1999. [DOI] [PubMed] [Google Scholar]
- 19. Javery O, Krajewski K, O’regan K, et al. A to Z of Extraskeletal Ewing sarcoma family of tumors in adults: imaging features of primary disease, metastatic patterns, and treatment responses[J]. AJR Am J Roentgenol, 2011, 197(6): w1015-w1022. [DOI] [PubMed] [Google Scholar]
- 20. Ashraf MJ, Beigomi L, Azarpira N, et al. The small round blue cell tumors of the sinonasal area: Histological and immunohistochemical findings[J]. Iran Red Crescent Med J, 2013, 15(6): 455-461. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21. Biermann JS. Updates in the treatment of bone cancer[J]. J Natl Compr Canc Netw, 2013, 11(5 Suppl): 681-683. [DOI] [PubMed] [Google Scholar]
- 22. Donaldson SS. Ewing sarcoma: radiation dose and target volume[J]. Pediatr Blood Cancer, 2004, 42(5): 471-476. [DOI] [PubMed] [Google Scholar]
- 23. Womer RB, West DC, Krailo MD, et al. Randomized controlled trial of interval-compressed chemotherapy for the treatment of localized Ewing sarcoma: a report from the Children’s oncology group[J]. J Clin Oncol, 2012, 30(33): 4148-4154. [DOI] [PMC free article] [PubMed] [Google Scholar]