Abstract
目的
肺癌是世界上最常见的恶性肿瘤之一,其病死率排在众多恶性肿瘤之首。非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的病死率较高,总体5年存活率<15%。当NSCLC发生局部侵袭时,患者5年生存率仅为20%,而当发生远处转移时5年生存率更是低至4%。阿美替尼(almonertinib)是我国自主研发并拥有自主知识产权的创新药,其作为表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂主要用于EGFR T790M突变的局部晚期或转移性NSCLC患者。本研究旨在探讨阿美替尼对NSCLC细胞增殖、侵袭和迁移的影响。
方法
体外培养NSCLC H1975、PC-9细胞,采用CCK-8法、细胞凋亡实验、Transwell实验检测阿美替尼对H1975、PC-9细胞增殖、凋亡、侵袭及迁移的影响;蛋白质印迹法检测侵袭迁移相关蛋白质的表达。
结果
CCK-8实验结果显示阿美替尼呈时间和剂量依赖性抑制H1975、PC-9细胞增殖,PC-9细胞24、48 h的IC50值分别为5.422、1.302 µmol/L,H1975细胞24、48 h的IC50值分别为4.803、2.094 µmol/L。细胞凋亡实验结果显示1、2、4、8 µmol/L阿美替尼分别处理PC-9和H1975细胞24 h时,细胞凋亡率分别为(8.82±3.22)%、(9.53±4.24)%、(13.62±3.69)%、(42.10±1.76)%和(9.81±0.90)%、(10.51±1.49)%、(15.34±3.50)%、(28.97±2.57)%。Transwell实验结果显示阿美替尼抑制H1975、PC-9细胞侵袭和迁移。蛋白质印迹法结果显示:与对照组相比,1、2、4 µmol/L阿美替尼处理组PC-9和H1975细胞中MMP-9,MMP-2和Vimentin蛋白表达水平均明显降低,E-cadherin 蛋白表达水平明显升高(均P<0.05)。裸鼠实验结果发现:与对照组和阳性对照奥希替尼(AZD9291)组相比,阿美替尼治疗组肿瘤生长被显著抑制,裸鼠体重减轻,肿瘤体积显著减小,肿瘤质量也明显减轻(均P<0.05)。
结论
阿美替尼能够在体内外抑制H1975、PC-9细胞的增殖、侵袭、迁移,并促进H1975、PC-9细胞凋亡。其抑制侵袭的作用机制可能与抑制肿瘤细胞上皮间质转化和金属蛋白酶表达有关。
Keywords: 非小细胞肺癌, 表皮生长因子受体酪氨酸激酶抑制剂, 阿美替尼, 增殖, 侵袭, 上皮间质转化
Abstract
Objective
Lung cancer is one of the most common malignant tumors in the world, and its lethality ranks the first among many malignant tumors. For non-small cell lung cancer (NSCLC) patients, due to the high mortality rate, the overall 5-year survival rate is less than 15%. When NSCLC undergoes local invasion, the 5-year survival rate is only 20%, and it is even lower when distant metastasis occurs up to 4%. Almonertinib is an innovative drug independently researched and developed by China with independent intellectual property rights. As an epidermal growth factor receptor tyrosine kinase inhibitor, almonertinib is mainly used for locally advanced or metastatic NSCLC patients with epidermal growth factor receptor (EGFR) T790M mutation. This study aims to investigate the effects of almonertinib on the proliferation, invasion and migration of NSCLC cells in vitro.
Methods
NSCLC cells H1975 and PC-9 were cultured in vitro. The effects of almonertinib on the proliferation, apoptosis, invasion, and migration of H1975 and PC-9 cells were detected by CCK-8 assay, apoptotic assay and Transwell assay. The expression of invasion and migration related proteins was detected by Western blotting.
Results
The CCK-8 experiment showed that almonertinib inhibited the proliferation of H1975 and PC-9 cells in a time- and dose-dependent manner. The IC50 values in PC-9 cells at 24 and 48 h were 5.422 and 1.302 µmol/L, respectively. The IC50 values in H1975 cells at 24 and 48 h were 4.803 and 2.094 µmol/L, respectively. Almonertinib (1, 2, 4, 8 µmol/L)-treated PC-9 and H1975 cells for 24 h resulted in apoptosis rate at (8.82±3.22)%, (9.53±4.24)%, (13.62±3.69)%, (42.10±1.76)% and (9.81±0.90)%, (10.51±1.49)%, (15.34±3.50)%, (28.97±2.57)%, respectively. The transwell experiment showed that almonertinib inhibited the invasion and migration of H1975 and PC-9 cells. Western blotting showed that compared with the control group, the expression levels of MMP-9, MMP-2 and vimentin protein in PC-9 and H1975 cells in 1, 2 and 4 µmol/L almonertinib treatment group were significantly lower, and the expression level of E-cadherin protein was significantly higher (all P<0.05). The experimental results of nude mice showed that compared with the control group and the positive control ositinib (AZD9291) group, the tumor growth was significantly inhibited, the weight of nude mice, the tumor volume and the tumor mass were significantly reduced in the almonertinib treatment group (all P<0.05).
Conclusion
Almonertinib can inhibit the proliferation, invasion, and migration of NSCLCH1975 and PC-9 cells in vitro and vivo, and promote the apoptosis of H1975 and PC-9 cells. The underlying mechanism may be related to the inhibition of tumor cell epithelial mesenchymal transformation and metalloproteinase expression.
Keywords: non-small cell lung cancer, epidermal growth factor receptor tyrosine kinase inhibitor, almonertinib, proliferation, invasion, epithelial mesenchymal transformation
肺癌是世界上发病率最高的恶性肿瘤之一,已成为癌症相关死亡的首要原因。随着环境污染的加剧,肺癌的发病率和病死率逐年增加,严重危害了人们的生命健康。寻求科学有效的治疗手段是当前肺癌的研究热点[1]。根据病理类型,肺癌主要分为两种,即小细胞肺癌和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中后者占80%[2]。尽管以手术联合放射治疗和化学治疗(以下简称放化疗)为主的治疗方案大大延长了NSCLC患者的生存期,但最终依旧会发生癌细胞远处转移而导致治疗失败。研究[3-4]发现:NSCLC患者病死率较高,总体5年存活率<15%。当NSCLC发生局部侵袭时,患者5年生存率仅为20%,而当发生远处转移时5年生存率更是低至4%。分子靶向治疗是近年来NSCLC研究的热点之一,相较于传统的化疗药物,它具有靶向性强、毒副作用小的特点,是一类具有多种作用机制的新型抗肿瘤药物。
表皮生长因子受体(epidermal growth factor receptor,EGFR)家族及其配体在NSCLC的发生、发展和恶性程度方面扮演重要的角色[5],EGFR发生突变或者过表达会引起肿瘤的发生。而靶向EGFR突变的表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)已被证实在肺癌[6]、乳腺癌[7]、结肠癌[8]等多种类型肿瘤中取得较好的治疗效果而在临床广泛使用。EGFR-TKIs的主要作用机制是通过阻断EGFR分子内酪氨酸激酶的自磷酸化,抑制EGFR二聚体的形成及EGFR的激活,进而阻止MAPK、AKT和JNK等通路的信号转导,从而发挥抑制肿瘤发生、发展、增殖、分化、侵袭、转移、血管生成及促进细胞凋亡等[9-10]。阿美替尼(almonertinib)是一种具有自主知识产权的小分子EGFR-TKI,可靶向EGFR发挥抗肿瘤活性[11]。然而,阿美替尼对NSCLC细胞迁移和侵袭能力的作用尚未有文献报道。本研究以NSCLC PC-9和H1975细胞作为研究对象,观察阿美替尼对其增殖、凋亡、侵袭、迁移等的影响,并探讨其相关的作用机制。
1. 材料与方法
1.1. 细胞株和动物
人PC-9细胞株(EGFR-Del19突变)购自广州赛库生物技术有限公司,人H1975细胞株(EGFR-T790突变)购自南京科佰生物科技有限公司。SPF级BALB/C裸鼠(No. 202017845)购自常州卡文斯实验动物有限公司。
1.2. 主要试剂
阿美替尼为江苏豪森药业有限公司产品;E-cadherin、基质金属蛋白酶(matrix metallo-proteinase,MMP)-2、MMP-9、Vimentin和β-actin抗体均购自武汉三鹰生物技术有限公司;RPMI 1640培养基购自中国赛默飞世尔科技有限公司;胎牛血清购自浙江天行生物科技股份有限公司;CCK-8细胞增殖试剂盒、Annexin V-FITC/PI试剂盒、Transwell小室、胰酶细胞消化液、100×青霉素-链霉素溶液、RIPA裂解液、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、BCA蛋白浓度测定试剂盒均购自合肥志宏泰克生物技术有限公司。
1.3. 细胞培养
PC-9和H1975细胞接种于含有10%胎牛血清和青霉素1×105 U/L、链霉素100 mg/L的RPMI 1640培养基中,置于37 ℃、5% CO2饱和湿度的恒温培养箱中培养。所有实验均采用对数生长期细胞。
1.4. CCK-8法检测细胞存活率
收集呈对数期稳定生长的PC-9和H1975细胞,用细胞计数板计数,调整细胞密度至5×104个/mL,接种于96孔板中,每孔加入100 μL细胞悬液,置于37 ℃、5% CO2的恒温培养箱中,待细胞贴壁后,更换孔中培养液为含有阿美替尼(0、1、2、4、6、8、10 µmol/L)的RPMI 1640培养基,每个浓度设置5个复孔,分别孵育24、48 h时,每孔加入10 µL CCK-8溶液,避光,置于37 ℃培养箱中孵育2 h,用酶标仪测定450 nm处的吸光度,药物抑制率计算公式:药物抑制率=(对照组OD值-实验组OD值)/对照组OD值×100%。进一步计算出药物的半数抑制浓度(half inhibitory concentration,IC50)。
1.5. Annexin V-FITC/PI双染法检测细胞凋亡
将PC-9和H1975细胞接种至6孔板中,每孔加入2×105个细胞,再加入完全培养基,待细胞融合率为70%~80%时,吸去孔内培养基,更换为含有阿美替尼(0、1、2、4、8 µmol/L)的2 mL RPMI 1640培养基,孵育24 h。收集5×105个细胞于流式管中,用预冷的PBS清洗细胞,1 000 r/min离心8 min,弃上清,加入200 μL 1×Annexin V结合液重悬细胞,加入 3 μL Annexin V-FITC,置于冰上孵育15 min,再加入 5 μL PI染色液,轻轻混匀,避光、冰上孵育10 min;加入200 μL 1×Annexin V结合液,混匀,样品在1 h内用流式细胞仪检测。
1.6. Transwell侵袭实验
在Transwell上室内加入50 µL基质胶,置于37 ℃恒温箱中孵育30 min,待胶凝固。收集PC-9和H1975细胞,用无血清RPMI 1640培养基调整为含有阿美替尼(0、1、2、4 µmol/L)的细胞悬液(2×105个/mL),分别取100 µL加入上室;下室加入含10% 胎牛血清的培养液600 µL。每组设置2个复孔,实验重复 3次;培养48 h后取出Transwell小室,冲洗后用棉签轻轻擦去微孔膜上层细胞;用4%多聚甲醛室温固定15 min,结晶紫室温染色20 min。采用光学倒置显微镜(×100)下计数侵袭至微孔膜下层的细胞,每个样本观察5个视野,取平均值。
1.7. Transwell迁移实验
无需在Transwell上室内铺基质胶,其余步骤同1.6。
1.8. 蛋白质印迹法
将PC-9和H1975细胞接种至直径为100 mm的培养皿中,当细胞融合度为70%~80%时,加入阿美替尼(0、1、2、4 µmol/L)处理,24 h后提取蛋白质,BCA法测定蛋白质浓度。加入SDS-PAGE蛋白上样缓冲液,充分混匀,于96 ℃加热5 min。每种样品取终浓度30 μg上样电泳,采用湿转法电转移至PVDF膜,快速封闭液封闭20 min。按照不同分子量剪切PVDF膜,加入对应的抗体,4 ℃摇床、孵育过夜。次日用TBST在室温下清洗3次,每次5 min,加HRP标记的二抗,在室温下孵育1 h,显色曝光,采用Image J软件分析条带灰度值。
1.9. 体内实验
将H1975细胞离心,用PBS洗涤,再悬浮于无血清RPMI 1640培养基中。然后将细胞(3×106个/只)注射到4~6周龄裸鼠右肩后皮下。待肿瘤生长至100 mm3,随机分为3组,每组5只,均给予0.2 mL二甲基亚砜、5 mg/kg AZD9291和5 mg/kg阿美替尼灌胃,每2天1次。每次注射前监测裸鼠体重和肿瘤大小。肿瘤体积为长×宽2/2,整个过程持续21 d。所有动物研究均经蚌埠医学院实验动物教学与研究委员会批准(伦动科批字[2020]第36号)。
1.10. 统计学处理
应用Graphpad Prism 7.0软件对数据进行统计学分析并作图,计量资料以均数±标准差( ±s)表示,多组比较采用方差分析和LSD-t检验,P<0.05为差异具有统计学意义。
2. 结 果
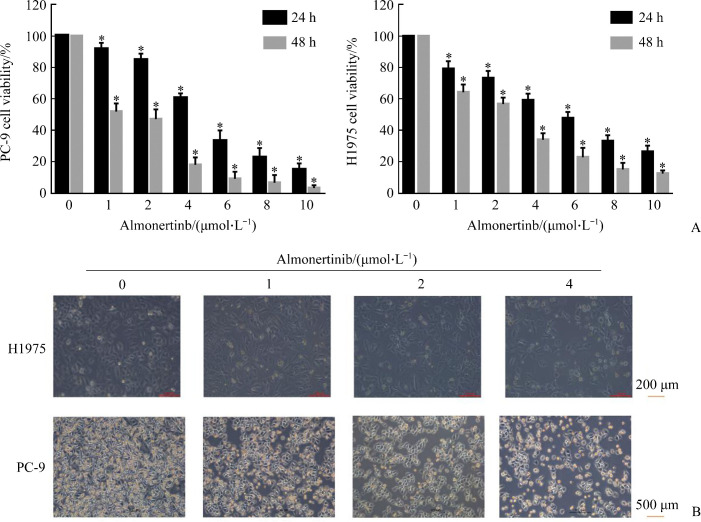
2.1. 阿美替尼抑制PC-9、H1975细胞增殖
CCK-8实验结果显示:随着药物浓度的增加和时间的延长,阿美替尼对PC-9和H1975细胞的抑制作用逐渐增强(图1),具有时间和剂量依赖性。PC-9细胞24、48 h的IC50值分别为5.422和1.302 µmol/L,H1975细胞24、48 h的IC50值分别为4.803和2.094 µmol/L。
图1.
阿美替尼抑制PC-9、H1975细胞增殖
Figure 1 Almonertinib inhibits the proliferation of PC-9 and H1975 cells
A: Histogram of cell viability of CCK-8 experiment, *P<0.05 vs almonertinib (0 μmol/L); B: Cell proliferation is observed under microscope at 48 h after culture.
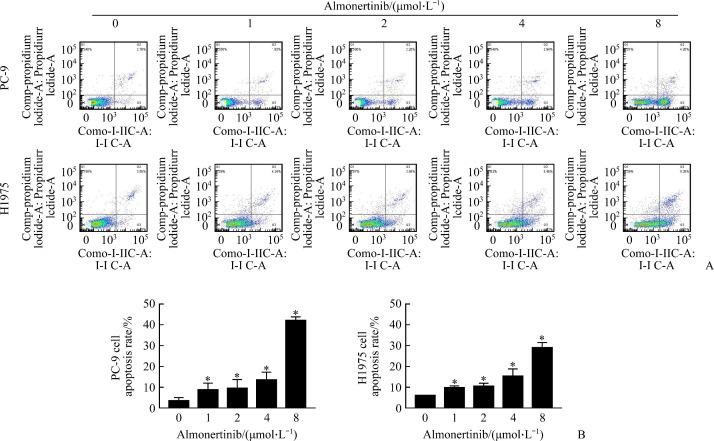
2.2. 阿美替尼诱导PC-9和H1975细胞凋亡
流式细胞仪检测结果示:H1975细胞对照组的细胞凋亡率为(6.05±0.11)%,1、2、4、8 µmol/L阿美替尼处理组分别为(9.81±0.90)%、(10.51±1.49)%、(15.34±3.50)%、(28.97±2.57)%。PC-9细胞对照组的细胞凋亡率为(3.60±1.50)%,阿美替尼(1、2、4、8 µmol/L)处理组分别为(8.82±3.22)%、(9.53±4.24)%、(13.62±3.69)%、(42.10±1.76)%。与对照组相比,随阿美替尼药物浓度增加,PC-9和H1975细胞凋亡率显著增加(P<0.05,图2)。
图2.
阿美替尼诱导PC-9和H1975细胞凋亡
Figure 2 Almonertinib induces the apoptosis of PC-9 and H1975 cells
A: Apoptosis of PC-9 and H1975 cells treated with different concentrations of almonertinib (1, 2, 4 and 8 µmol/L) by flow cytometry; B: Histogram of apoptosis rate, *P<0.05 vs almonertinib (0 μmol/L).
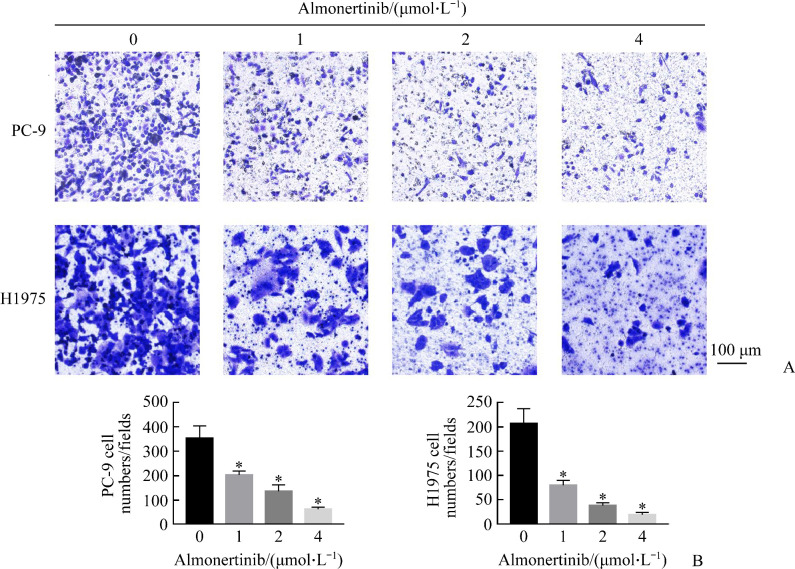
2.3. 阿美替尼抑制PC-9和H1975细胞迁移
Transwell细胞迁移实验结果显示:H1975细胞对照组的细胞迁移数为206.67±30.55,1、2、4 µmol/L阿美替尼处理组分别为80.00±10.00、38.67±5.51、19.67±4.72。PC-9细胞对照组的细胞迁移数为353.33±50.33,1、2、4 µmol/L阿美替尼处理组分别为202.67±16.16、136.00±26.23、62.67±8.33。与对照组相比,随阿美替尼药物浓度的增加,PC-9和H1975细胞迁移抑制率均显著增加(均P<0.05,图3)。
图3.
阿美替尼抑制PC-9和H1975细胞迁移
Figure 3 Almonertinib inhibits the migration of PC-9 and H1975 cells
A: Crystal violet staining results; B: Histogram of the number of cells stained with crystal violet through the loculeis, *P<0.05 vs almonertinib (0 μmol/L).
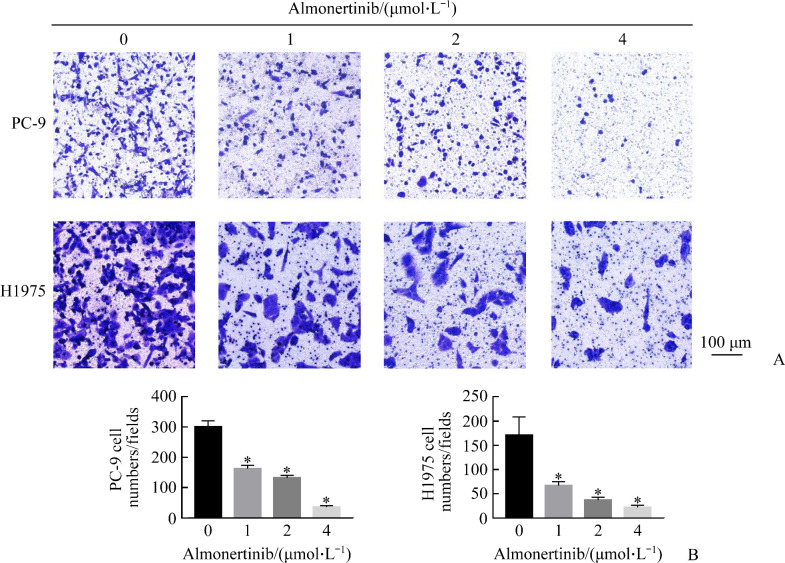
2.4. 阿美替尼抑制PC-9和H1975细胞侵袭
细胞侵袭实验结果显示:H1975细胞对照组的细胞侵袭数为171.33±37.75,阿美替尼(1、2、4 µmol/L)处理组分别为67.00±8.18、37.00±6.08、22.00±4.36。PC-9细胞对照组的细胞侵袭数为300.00±20.00,阿美替尼(1、2、4 µmol/L)处理组分别为162.00±11.13、132.00±8.00、35.33±5.03。与对照组相比,随阿美替尼药物浓度的增加,PC-9和H1975细胞侵袭抑制率均显著增加(均P<0.05,图4)。
图4.
阿美替尼抑制PC-9和H1975细胞侵袭
Figure 4 Almonertinib inhibits the invasion of PC-9 and H1975 cells
A: Crystal violet staining results; B: Histogram of the number of cells stained with crystal violet through the locule, *P<0.05 vs almonertinib (0 μmol/L).
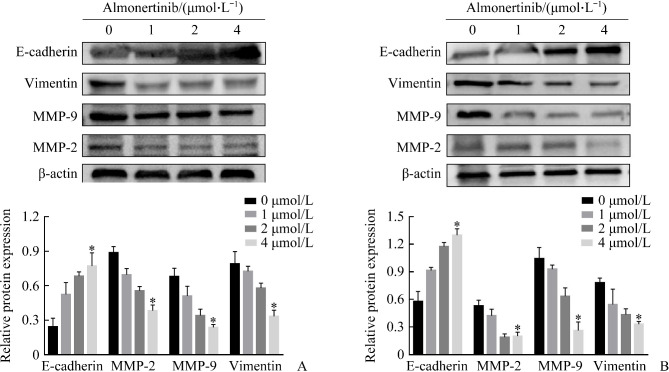
2.5. 阿美替尼对PC-9和H1975细胞侵袭、迁移相关蛋白质表达的影响
蛋白质印迹法结果显示:与对照组相比,1、2、4 µmol/L阿美替尼处理组PC-9和H1975细胞中MMP-9,MMP-2和Vimentin蛋白表达水平均明显降低,E-cadherin蛋白表达水平明显升高(均P<0.05,图5)。
图5.
蛋白质印迹检测侵袭、迁移相关蛋白质在PC-9和H1975细胞中的表达
Figure 5 Western blotting to detect the expression of invasion and migration related proteins in PC-9 and H1975 cells
A: Expression of invasion and migration-related proteins in PC-9 cells; B: Expression of invasion and migration-related proteins in H1975 cells. *P<0.05 vs almonertinib (0 μmol/L).
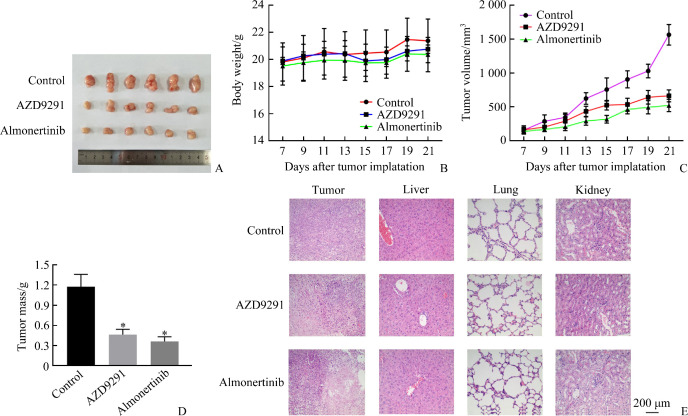
2.6. 阿美替尼抑制H1975肿瘤体内生长
将H1975细胞移植到BALB/c裸鼠体内,结果发现:与对照组和阳性对照奥希替尼(AZD9291)组相比,阿美替尼治疗组肿瘤生长被显著抑制(图6A)。此外,阿美替尼治疗组裸鼠体重减轻(图6B),肿瘤体积显著减小(图6C),肿瘤质量也明显减轻(图6D)。组织样本的苏木精-伊红(HE)染色显示阿美替尼治疗没有造成严重肝、肾和肺损害(图6E)。
图6.
阿美替尼对H1975裸鼠移植瘤生长有抑制作用
Figure 6 Almonertinib has an inhibitory effect on the growth of H1975 transplanted tumor in nude mice
A: Representative tumors in each group; B: Body weight of mice; C: Tumor volume of mice; D: Tumor mass of mice, *P<0.05 vs control; E: Liver, kidney, and lung tissues of mice.
3. 讨 论
肺癌是全球癌症相关死亡的主要原因,多年来一直稳居我国常见癌症及癌症相关死亡原因首位。在各种肺癌类型中,NSCLC占比最高[1]。大部分患者在初次诊断时已经转移,或者在初次手术或放疗后复发。因此,对于NSCLC患者,有效抑制肿瘤的迁移和侵袭将是改善患者预后的主要方法[12]。
靶向治疗因其疗效好、不良反应小而成为最具吸引力和前景的治疗方法之一。小分子EGFR-TKIs,如吉非替尼和厄洛替尼,已经成为EGFR突变NSCLC患者的首选治疗方法[13]。然而,第1、2代EGFR-TKIs在使用一段时间后,患者不可避免地会对其产生耐药,其中最具代表性的是T790突变。阿美替尼作为第3代EGFR-TKIs,可靶向EGFR发挥抗肿瘤活性,临床研究[10]显示其对肺癌有较好的治疗效果。本研究CCK-8实验结果表明:阿美替尼可呈时间和剂量依赖性抑制PC-9和H1975细胞的增殖,促使细胞凋亡。
上皮间质转化(epithelial mesenchymal transfor-mation,EMT)是一个由充分分化的上皮细胞转化为间充质表型的过程,伴有上皮标志物丢失、间充质特性获得、迁移增强的细胞骨架重组,是导致肿瘤细胞侵袭和转移的关键,在肿瘤的发展中起至关重要的作用[14]。临床研究[15]证明EMT在NSCLC的侵袭、转移过程中扮演重要的角色,即EMT可以促进NSCLC的侵袭与转移。肿瘤微环境在肿瘤侵袭、转移过程中起重要作用。EMT除直接增强肺癌细胞本身的侵袭、转移能力外,还可改变癌细胞所处的微环境,诱使癌细胞逃脱机体免疫监视而免受宿主攻击,从而进一步增强其侵袭、转移性[16]。此外,EMT的发生与EGFR-TKIs类药物耐药密切相关,逆转EMT可延迟对EGFR-TKIs类药物耐药的发生。研究[17]证实:EMT是NSCLC不良预后的重要表征,随着肺癌恶性程度的增高,肺癌细胞中上皮细胞标志物E-cadherin蛋白表达水平降低,间质细胞标志物Vimentin蛋白等表达增加。同时,MMP-2和MMP-9因参与肿瘤基底膜和ECM的降解,在肿瘤的发生、发展、侵袭、转移过程中起重要作用。蛋白质印迹法结果显示:随着阿美替尼剂量的升高,PC-9和H1975细胞E-cadherin蛋白上调,Vimentin、MMP-2和MMP-9蛋白下调。Transwell实验结果表明阿美替尼可以抑制PC-9和H1975细胞的侵袭、迁移能力。这些生物标志物变化提示阿美替尼可以有效逆转EMT。
裸鼠体内成瘤实验结果也显示阿美替尼在体内具有良好的抗肿瘤效果且对其他脏器的毒副作用较小。同时本课题组前期研究[7]发现阿美替尼可以通过抑制EGFR/PI3K/AKT信号通路,抑制TNBC MDA-MB-231细胞的增殖,诱导细胞自噬和凋亡。阿美替尼更多的抗肿瘤机制还有待进一步研究。
综上所述,阿美替尼作为一种我国自主研发的新型第3代靶向药,可抑制PC-9和H1975细胞增殖、迁移、侵袭,其机制可能是通过抑制肿瘤细胞EMT过程并抑制MMP的表达来发挥作用的,同时阿美替尼的毒副作用较小,作为一种新型的靶向制剂治疗NSCLC的效果值得进一步研究。
基金资助
国家“重大新药创制”科技重大专项(2019ZX09303001);国家自然科学基金(81973658);安徽省科技重大专项(201903a07020029);安徽省自然科学基金(1908085QH373)。
This study was supported by the National Major New Drug Creation Science and Technology Project (2019ZX09303001), the National Natural Science Foundation (81973658), Anhui Provincial Science and Technology Major Special Project (201903a07020029), and Anhui Provincial Natural Science Foundation (1908085QH373), China.
利益冲突声明
作者声称无任何利益冲突。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2021101045.pdf
参考文献
- 1. Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. [DOI] [PubMed] [Google Scholar]
- 2. Markham MJ, Wachter K, Agarwal N, et al. Clinical cancer advances 2020: annual report on progress against cancer from the American society of clinical oncology[J]. J Clin Oncol, 2020, 38(10): 1081. [DOI] [PubMed] [Google Scholar]
- 3. Saitoh M. Involvement of partial EMT in cancer progression[J]. J Biochem, 2018, 164(4): 257-264. [DOI] [PubMed] [Google Scholar]
- 4. Planchard D, Popat S, Kerr K, et al. Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(Suppl4): iv192-iv237. [DOI] [PubMed] [Google Scholar]
- 5. Lindeman NI, Cagle PT, Aisner DL, et al. Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: guideline from the college of American pathologists, the international association for the study of lung cancer, and the association for molecular pathology[J]. Arch Pathol Lab Med, 2018, 142(3): 321-346. [DOI] [PubMed] [Google Scholar]
- 6. Zhang ZR, Zhang MX, Liu H, et al. AZD9291 promotes autophagy and inhibits PI3K/Akt pathway in NSCLC cancer cells[J]. J Cell Biochem, 2019, 120(1): 756-767. [DOI] [PubMed] [Google Scholar]
- 7. 葛贤明, 周巧, 张语涵, 等. EGFR酪氨酸激酶抑制剂HS-10296诱导三阴乳腺癌MDA-MB-231细胞发生自噬和凋亡[J]. 南方医科大学学报, 2020, 40(7): 981-987. [DOI] [PMC free article] [PubMed] [Google Scholar]; GE Xianming, ZHOU Qiao, ZHANG Yuhan, et al. EGFR tyrosine kinase inhibitor HS-10296 induces autophagy and apoptosis in triplenegative breast cancer MDA-MB-231 cells[J]. Journal of Southern Medical University, 2020, 40(7): 981-987. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. Jin P, Jiang JW, Xie N, et al. MCT1 relieves osimertinib-induced CRC suppression by promoting autophagy through the LKB1/AMPK signaling[J]. Cell Death Dis, 2019, 10(8): 615. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Gerber DE, Oxnard GR, Govindan R. ALCHEMIST: Bringing genomic discovery and targeted therapies to early-stage lung cancer[J]. Clin Pharmacol Ther, 2015, 97(5): 447-450. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10. 刘慧慧, 王孟昭, 胡克, 等. EGFR-TKI在非小细胞肺癌中耐药机制的研究进展[J]. 中国肺癌杂志, 2013, 16(10): 535-540. [DOI] [PMC free article] [PubMed] [Google Scholar]; LIU Huihui, WANG Mengzhao, HU Ke, et al. Research progress of the resistance mechanism of non-small cell lung cancer to EGFR-TKIs[J]. Chinese Journal of Lung Cancer, 2013, 16(10): 535-540. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Yang JC, Camidge DR, Yang CT, et al. Safety, efficacy, and pharmacokinetics of almonertinib (HS-10296) in pretreated patients with EGFR-mutated advanced NSCLC: a multicenter, open-label, phase 1 trial[J]. J Thorac Oncol, 2020, 15(12): 1907-1918. [DOI] [PubMed] [Google Scholar]
- 12. Tian JR, Luo YE, Xiang JJ, et al. Combined treatment for non-small cell lung cancer and breast cancer patients with brain metastases with whole brain radiotherapy and temozolomide: a systematic review and meta-analysis[J]. J Neurooncol, 2017, 135(2): 217-227. [DOI] [PubMed] [Google Scholar]
- 13. Prabhu VV, Devaraj N. Epidermal growth factor receptor tyrosine kinase: apotential target in treatment of non-small-cell lung carcinoma[J]. J Environ Pathol Toxicol Oncol, 2017, 36(2): 151-158. [DOI] [PubMed] [Google Scholar]
- 14. Lin LJ, Han Q, Xiong Y, et al. Krüpple-like-factor 4 attenuates lung fibrosis via inhibiting epithelial-mesenchymal transition[J]. Sci Rep, 2017, 7(1): 15847. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15. 谷蕴婷, 张静. 上皮间质转化与肺非小细胞癌转移及其耐药性的研究进展[J]. 临床与病理杂志, 2018, 38(9): 2018-2021. 29956875 [Google Scholar]; GU Yunting, ZHANG Jing. Research progress of epithelial-mesenchymal transition with metastasis and drug-resistance in non-small cell lung cancer[J]. Journal of Clinical and Pathological Research, 2018, 38(9): 2018-2021. [Google Scholar]
- 16. Pastushenko I, Brisebarre A, Sifrim A, et al. Identification of the tumour transition states occurring during EMT[J]. Nature, 2018, 556(7702): 463-468. [DOI] [PubMed] [Google Scholar]
- 17. 彭娜, 康马飞. 上皮细胞-间充质转化与非小细胞肺癌预后和耐药关系研究进展[J]. 现代医药卫生, 2018, 34(21): 3327-3330. [Google Scholar]; PENG Na, KANG Mafei. Research progress on the relationship between epithelial cell-mesenchymal transition and non-small cell lung cancer prognosis and drug resistance[J]. Journal of Modern Medicine and Health, 2018, 34(21): 3327-3330. [Google Scholar]