Abstract
抗体介导排斥反应(antibody-mediated rejection,AMR)是肺移植术后一种少见而严重的并发症,无特征性病理表现,无系统的标准治疗方案,治疗效果及预后较差。现报告1例肺移植术后早期AMR的病例并进行相关文献复习。本病例为男性患者,于右肺移植术后第99天出现感冒症状,经对症治疗后好转,14 d后突发气促、发热,抗细菌、真菌、病毒及卡氏肺孢子虫治疗无效,予1 000 mg甲基强的松龙治疗无效,患者病情迅速加重,予气管插管使其维持呼吸。血清群体反应性抗体和供体特异性抗体检查示:人白细胞抗原(humen leukocyte antigen,HLA)II类抗体阳性,经纤维支气管镜对移植肺取活体组织行病理检查提示急性排斥反应。结合供体特异性抗体和临床表现诊断为AMR。予兔抗人胸腺细胞免疫球蛋白+利妥昔单抗注射液+血浆置换+免疫球蛋白治疗后患者的呼吸功能恢复正常,随访3年未发生慢性移植肺功能衰竭。肺移植后受者突然出现气促、发热,常规抗感染及抗细胞排斥反应治疗无效时应警惕其发生AMR。经纤维支气管镜移植肺活体组织检查、血清供体特异性抗体检测有助于明确诊断。治疗应抓紧时机,采用综合治疗的方法。
Keywords: 肺移植, 抗体介导排斥反应, 治疗
Abstract
Antibody-mediated rejection (AMR) is a rare and serious complication after lung transplantation, with no characteristic of pathological manifestation, no systematic standard treatment, and the poor efficacy and prognosis. We reported a case of early AMR after lung transplantation and the relevant literature has been reviewed. A male patient presented with symptoms of cold 99 days after transplantation and resolved after symptomatic treatment. He admitted to the hospital 14 days later because of a sudden dyspnea and fever. Anti-bacteria, anti-fungi, anti-virus, and anti-pneumocystis carinii treatment were ineffective, and a dose of 1 000 mg methylprednisolone did not work too. The patient’s condition deteriorated rapidly and tracheal intubation was done to maintain breathing. Serum panel reactive antibody and donor specific antibody showed postive in humen leukocyte antigen (HLA) II antibody. Pathological examination after transbronchial transplantation lung biopsy showed acute rejection. Clinical AMR was diagnosed combined the donor-specific antibody with the pathological result. The patient was functionally recovered after combined treatment with thymoglobuline, rituximab, plasmapheresis, and immunoglobulin. No chronic lung allograft dysfunction was found after 3 years follow up. We should alert the occurrence of AMR in lung transplantation recipient who admitted to hospital with a sudden dyspnea and fever while showed no effect after common anti-infection and anti-rejection treatment. Transbronchial transplantation lung biopsy and the presence of serum donor-specific antibody are helpful to the diagnosis. The treatment should be preemptive and a comprehensive approach should be adopted.
Keywords: lung transplantation, antibody-mediated rejection, treatment
肺移植已成为治疗良性终末期肺部疾病安全有效的手段。在过去的数十年里,由于手术技术、供受体选择及术后管理水平的提高,肺移植术后的短期存活率明显升高,但长期存活率仍然没有很大提高。据2016年国际心肺移植协会数据[1],肺移植术后中位生存期为5.8年,术后1年生存率为80%,5年生存率为54%,导致患者术后1年内死亡的主要原因为感染,但1年内需要住院治疗的急性排斥发生率高达28%。肺移植术后的排斥反应包括细胞性排斥反应(cellular rejection,CR)及抗体介导排斥反应(antibody-mediated rejection,AMR)。目前关于CR的诊断及治疗已经明确,常规采用激素冲击疗法可获得较好的治疗效果。而AMR临床诊断困难,且无标准的治疗方案,国内尚无相关报道。笔者总结1例肺移植后发生AMR的临床资料,结合文献探讨肺移植术后AMR的诊断和治疗方法,现报告如下。
1. 病例资料
患者,男,49岁,血型为A型,Rh(D)阳性,术前诊断为“矽肺3期,呼吸功能衰竭”。供者血型为A型,Rh(D)阳性。手术方式为右单肺移植术,应用他克莫司+吗替麦考酚酯+泼尼松预防排斥反应,术前未行诱导治疗,术后恢复顺利、出院。术后第99天时患者感轻微咳嗽、鼻塞,查体一般可,疑为感冒,予芬麻伪敏片口服,自感好转。14 d后患者凌晨突然出现气促,心率增快,于2017年5月17日5:28急诊收治入院。心电监护示:心率为140 次/min,血压为90/70 mmHg(1 mmHg=0.133 kPa),SpO2为75%,体温为38.3 ℃。血常规示白细胞为11×109/L,中性粒细胞百分比为82%,C反应蛋白为 196 mg/mL,红细胞沉降率为58 mm/h,降钙素原为7.8 ng/mL,他克莫司血药浓度为25.3 ng/mL,β-D-葡聚糖试验、半乳甘露聚糖抗原试验、病毒抗体检查均为阴性,疑诊感染。予美罗培南抗炎、卡泊芬净抗真菌、更昔洛韦抗病毒、磺胺类药抗卡氏肺孢子虫治疗,予以无创呼吸机辅助呼吸,患者病情稍稳定,SpO2为91%~92%,PaO2/FiO2为178,心率仍波动于130~140 次/min。 48 h后,患者渐感呼吸困难加重,呼吸费力,考虑急性排斥反应,予甲基强的松龙1 000 mg冲击治疗,患者病情无好转,对其行紧急气管插管。群体反应性抗体(panel reactive antibodies,PRA)及供体特异性抗体(donor-specific antibody,DSA)检查示:I类阴性,II类中度阳性。行肺部CT检查和经纤维支气管镜肺活体组织检查(transbronchial lung biopsy,TBLB),按照器官移植病理学临床技术操作规范[2]于右下肺背段和基底段行活体组织检查4~5次,取得的肺组织立即置10%中性甲醛固定液中固定。
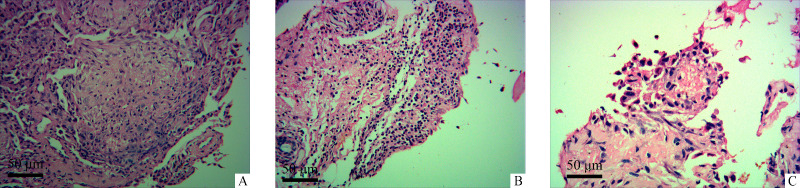
病理结果提示:部分终末细支气管、呼吸性细支气管及少数肺泡管内有明显增生纤维组织填塞,使部分上述终末细支气管、呼吸性细支气管的管腔明显狭窄和不完全闭塞,致局部肺组织呼吸单位的结构明显紊乱,增生纤维组织内可见大量淋巴细胞浸润(图1A);少数呼吸性细支气管黏膜上皮层内可见大量淋巴细胞、浆细胞浸润及少量黏膜上皮细胞坏死(图1B);少数微动脉分支内皮淋巴细胞浸润呈血管内皮炎表现(图1C)以及少许微动脉和小动脉分支内膜增生呈轻微慢性移植物动脉血管病表现;肺组织内多数肺泡间隔内可见大量淋巴细胞浸润。C4d免疫酶组织化学染色呈阴性。由于患者的移植肺组织内广泛地以淋巴细胞为主的单个核炎性细胞浸润、细支气管黏膜上皮淋巴细胞浸润和黏膜上皮坏死,以及少数终末细支气管和呼吸性细支气管内纤维组织增生填塞和少许微细动脉血管内膜增生,因此按照2007年肺移植排斥反应诊断标准[3]诊断为:1)移植肺中度急性细胞性排斥反应A3,其中气道排斥反应级别B2R; 2)移植肺轻度慢性/活动性细支气管性排斥反应、闭塞性细支气管及轻度慢性血管性排斥反应。结合患者显著的肺移植物功能衰竭,新发DSA及病理表现,诊断为AMR[4]。予兔抗人胸腺细胞免疫球蛋白(25 mg/次,4次)、利妥昔单抗(100 mg)、血浆置换(5次)、免疫球蛋白静脉滴注(20 g/次,5次)后患者的呼吸衰竭迅速好转,3 d后顺利拔除气管插管,改无创呼吸机辅助呼吸。根据氧合指数逐渐停止无创呼吸机,依次行鼻导管高流量吸氧及常规吸氧,最终患者恢复正常呼吸功能。3次血浆置换后复查PRA,结果示:I类阴性,II类弱阳性。2个月后血气分析及肺功能结果提示已恢复至AMR前,PRA阴性,复查肺部CT未见渗出性改变。随访3年,患者已恢复正常工作,无慢性移植肺功能丧失(chronic lung allograft dysfunction,CLAD)。患者的治疗经过及氧合指数变化见图2。
图1.
移植肺病理检查结果(HE染色)
Figure 1 Pathological examination of the transplanted lung (HE stain)
A: A lot of proliferative fibrous tissues and lymphocyte infiltration are presented in the respiratory unit of lung tissues; B: Infiltration of lymphocytes, plasma cells, and necrosis of a few mucosal epithelial cells can be observed in the mucosal epithelium of respiratory bronchioles. C: Endothelial lymphocyte infiltration of arteriole branches show capillaritis.
图2.

患者治疗经过及相应氧合指数变化
Figure 2 Patient treatment history and corresponding change in the oxygenation index TBLB: Transbronchial lung biopsy; AMR: Antibody-mediated rejection. 1 mmHg=0.133 kPa.
2. 讨 论
AMR又称体液排斥反应,其中参与的体液性因素主要为移植后产生的DSA。这种B淋巴细胞和浆细胞产生的针对供体抗原的抗体介导的免疫激活过程是AMR的核心。抗原-抗体复合物通过补体依赖和非依赖途径产生放大的免疫应答,导致组织病理学改变和不同程度的移植物功能障碍。AMR 是一种复杂的病理学、血清学临床过程,在肾和心同种异体移植物中的病理特征和诊断标准已被广泛认可,但其在肺移植中的病理特征、诊断及治疗尚不明确[5]。
2016年世界心肺移植协会工作小组制订了肺移植后AMR的诊断标准[3],最主要的条件为:检测到DSA及组织病理学特征。如果同时伴有排除其他原因所导致的移植肺功能衰竭及C4d染色阳性则可临床确诊为AMR,如缺少1项诊断为很可能AMR。但是AMR的特征性组织病理学表现——中性粒细胞性毛细血管炎、动脉炎等为非特异性改变,必须排除细菌/病毒感染、药物反应等所导致的肺组织损伤[4]。研究[5]表明:中性粒细胞性毛细血管炎及C4d染色都不能作为诊断AMR的必需条件。Aguilar等[6]按照2016年AMR的诊断标准对73例确诊/很可能AMR的病例进行分析,发现C4d在AMR患者中阳性率为38%,中性粒细胞性毛细血管炎在C4d阳性组发生率为54%,在C4d阴性组的发生率为29%,C4d阳性组和阴性组在临床表现及治疗效果/预后方面没有差别。本例患者PRA及DSA示HLA II抗体中度阳性,在3次血浆置换后仍表现为弱阳性,治疗后2个月复查,抗体转阴,结合其严重的移植肺功能衰竭、DSA阳性及病理学表现,笔者认为该患者应诊断为临床AMR。
导致急性排斥反应发生的原因很多,但最主要的是免疫抑制剂的低药物浓度和病毒感染。Brugiere等[7]报道1例肺移植术后3年因为膀胱癌手术降低了他克莫司浓度,停用了吗替麦考酚酯,3个月后患者发生AMR,虽然采用了血浆置换和注射免疫球蛋白,但患者仍于6个月后因闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)死亡。病毒感染能够影响机体的免疫功能,提高同种异体免疫反应。Martinu等[8]发现鼻病毒、流感病毒、人肺病毒、冠状病毒、呼吸道合胞病毒等社区获得性呼吸道感染会增加急性排斥反应的发生风险。Yamamoto等[9]报道1例肺移植术后11年因肺炎诱发AMR并导致患者突然死亡。本例患者发病前他克莫司血药浓度一直稳定于12~15 ng/mL,入院后他克莫司血药浓度为25.3 ng/mL,没有停用其他免疫抑制药物,因此排斥反应发生不是由降低免疫抑制药浓度所导致。本例患者在发病前2周发生感冒,服用药物后好转,尽管入院后我们进行了常规病毒学(巨细胞病毒、单纯疱疹病毒、EB病毒、流感病毒)检查,未发现明显感染的依据,但由于没有涵盖可能导致肺部感染的所有病毒(如鼻病毒、冠状病毒、呼吸道合胞病毒等),结合文献报道我们仍然认为很可能是呼吸道病毒感染诱发了该次急性体液排斥反应。
移植肺AMR的治疗目前没有系统的方案可循,大部分都是单中心的、有限的治疗经验,没有随机对照及不同治疗方案的头对头比较研究;且其发病率低,没有明确统一的诊断标准,尚不清楚是否所有病例有相同表现,故很难评价每种药物的疗效[5]。治疗通常采用消耗循环抗体的药物,抑制B细胞并减轻抗体介导的同种异体移植物伤害,一般包括下面几个方面:血浆置换,静脉滴注免疫球蛋白、CD20抗体利妥昔单抗及蛋白酶抑制剂硼替佐米等[10-12]。其中以血浆置换及静脉滴注免疫球蛋白和利妥昔单抗为最常用的方案[13]。尽管AMR导致的移植物功能衰竭是可逆的,但整体上治疗效果较差。一般认为AMR是导致CLAD的重要因素,显著降低患者的长期生存率[14]。Witt 等[15]报道:在21例由AMR导致的严重移植物功能衰竭而住院治疗的患者中,7例AMR发生在移植后45 d内,6例死于难治性AMR,其余15例康复出院。他们在长期随访中发现13例发生了CLAD,诊断AMR后的1年病死率为47%。Aguilar等[6]报道73例肺移植术后AMR患者,尽管采用了积极治疗,19例仍在30 d内死亡,病死率为26%;诊断AMR时有6例发生了CLAD,在随后的随访中又有36例发生了CLAD;DSA完全清除患者的长期生存率及未发生CLAD的概率显著高于DSA长期存在者。Neuhaus等[13]报道55例发生AMR患者的治疗效果,23.5%的患者发生了显著的移植物功能衰竭或者需要接受再次移植,10例患者在住院期间死亡,另外11例患者在出院后1年内死亡。上述结果充分表明肺移植患者发生AMR后的不良治疗效果和不良预后,也表明DSA的存在对患者长期生存的不良影响。对于本例患者,我们先采用了1 000 mg的激素进行冲击治疗,病情没有缓解,符合 AMR为激素抵抗型排斥反应类型。随后,我们采用100 mg抗胸腺细胞免疫球蛋白进一步清除T淋巴细胞,100 mg利妥昔单抗清除B淋巴细胞,5次血浆置换及输注免疫球蛋白以清除患者体内产生的DSA,减轻体液排斥反应对移植物的损害。治疗后患者的病情迅速缓解,脱离有创呼吸机的支持,未出现因治疗排斥反应导致的严重肺部感染等并发症。诊断AMR后2个月复查,患者的氧合指数/肺功能均恢复到AMR前水平,PRA恢复阴性,随访3年无CLAD发生。
综上,本例单肺移植3个月后发生AMR得到确诊并成功治疗,其成功治疗得益于准确的组织病理学诊断和治疗药物的合理应用。希望将来有更明确的肺移植AMR诊断标准以提高AMR患者的诊断一致性,在此基础上进行随机对照研究以评价各种治疗效果的有效性,制订出肺移植术后AMR的标准治疗方案,提高患者的治疗效果,改善患者的长期预后。
利益冲突声明
作者声称无任何利益冲突。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2021101172.pdf
参考文献
- 1. Yusen RD, Edwards LB, Dipchand AI, et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third adult lung and heart-lung transplant report-2016; Focus theme: Primary diagnostic indications for transplant[J]. J Heart Lung Transplant, 2016, 35(1): 1170-1184. [DOI] [PubMed] [Google Scholar]
- 2. 中华医学会器官移植学分会 . 器官移植病理学临床技术操作规范(2019版)——肺移植[J]. 器官移植, 2019, 10(4): 383-392. [Google Scholar]; Organ Transplantation Branch of Chinese Medical Association . Clinical technical operation guidelines for pathology of organ transplantation (2019 Edition)—lung transplantation[J]. Organ Transplantation, 2019, 10(4): 383-392. [Google Scholar]
- 3. Stewart S, Fishbein MC, Snell GI, et al. Revision of the 1996 working formulation for the standardization of nomenclature in the diagnosis of lung rejection[J]. J Heart Lung Transplant, 2007, 26(12): 1229-1242. [DOI] [PubMed] [Google Scholar]
- 4. Wallace WD, Li N, Andersen CB, et al. Banff study of pathologic changes in lung allograft biopsy specimens with donor-specific antibodies. [J]. J Heart Lung Transplant, 2016, 35(1): 40-48. [DOI] [PubMed] [Google Scholar]
- 5. Levine DJ, Glanville AR, Aboyoun C, et al. Antibody-mediated rejection of the lung: A consensus report of the International Society for Heart and Lung Transplantation[J]. J Heart Lung Transplant, 2016, 35(4): 397-406. [DOI] [PubMed] [Google Scholar]
- 6. Aguilar PR, Carpenter D, Ritter J, et al. The role of C4d deposition in the diagnosis of antibody-mediated rejection after lung transplantation[J]. Am J Transplant, 2018, 18(4): 936-944. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7. Brugiere O, Roussel J, Suberbielle C. Minimizing immuno-suppression as a trigger for a fatal antibody-mediated rejection after lung transplantation. [J]. Transpl Int, 2015, 28(7): 876-877. [DOI] [PubMed] [Google Scholar]
- 8. Martinu T, Pavlisko EN, Chen DF, et al. Acute allograft rejection: cellular and humoral processes. [J]. Clin Chest Med, 2011, 32(2): 295-310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9. Yamamoto H, Yoshida K, Koizumi T, et al. Late-onset rejection of a unilateral donor lung with vascular C4d deposition in bilateral living-donor lobar lung transplantation: an autopsy case report[J]. Intern Med, 2014, 53(15): 1645-1650. [DOI] [PubMed] [Google Scholar]
- 10. Kulkarni HS, Bemiss BC, Hachem RR. Antibody-mediated rejection in lung transplantation. [J]. Curr Transplant Rep, 2015, 2(4): 316-323. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11. Roux A, Bendib Le Lan I, Holifanjaniaina S, et al. Antibody-mediated rejection in lung transplantation: clinical outcomes and donor-specific antibody characteristics[J]. Am J Transplant, 2016, 16(4): 1216-1228. [DOI] [PubMed] [Google Scholar]
- 12. 中华医学会器官移植学分会 . 中国肺移植免疫抑制治疗及排斥反应诊疗规范(2019版)[J/OL]. 中华移植杂志(电子版), 2019, 13(2): 94-98[2021-07-28]. DOI: 10.3877/cma.j.issn.1674-3903.2019.02.004. [DOI] [Google Scholar]; Organ Transplantation Branch of Chinese Medical Association . Chinese standard for immunosuppressive therapy and rejection diagnosis and treatment of lung transplantation (2019 Edition) [J/OL]. Chinese Journal of Transplantion. Electronic Edition, 2019, 13(2): 94-98[2021-07-28].DOI: 10.3877/cma.j.issn.1674-3903.2019.02.004. [DOI] [Google Scholar]
- 13. Neuhaus K, Hohlfelder B, Bollinger J, et al. Antibodymediated rejection management following lung transplantation[J/OL]. Ann Pharmacother, 2021: 10600280211012410[2021-07-28]. 10.1177/10600280211012410. [DOI] [PubMed] [Google Scholar]
- 14. Halverson LP, Hachem RR. Antibody-mediated rejection and lung transplantation[J]. Semin Respir Crit Care Med, 2021, 42(3): 428-435. [DOI] [PubMed] [Google Scholar]
- 15. Witt CA, Gaut JP, Yusen RD, et al. Acute antibody-mediated rejection after lung transplantation[J]. J Heart Lung Transplant, 2013, 32(10): 1034-1040. [DOI] [PMC free article] [PubMed] [Google Scholar]