Abstract
Ulnar-Mammary综合征(Ulnar-Mammary syndrome,UMS)是由TBX3基因突变所致的一种罕见单基因遗传病。本文报告1个UMS家系,先证者为15岁男性患者,表现为乳腺发育不良、尺侧肢体缺陷、身材矮小和发育迟缓。全外显子测序发现其TBX3基因的第6外显子存在1294_1301dup变异。用Sanger测序验证家系中其他成员,结果提示患者母亲也携带同样的突变,但仅表现为左侧小指发育异常。仅单侧手指受累而无任何系统器官受累的UMS患者鲜有报道。予患者重组人生长激素(recombinant human growth hormone,rhGH)和人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)治疗1年半,身高及第二性征均得到明显改善。该疾病的临床表现异质性强,容易误诊漏诊,当诊断不明时,基因检测有助于辅助诊断。
Keywords: Ulnar-Mammary综合征, TBX3基因, 表型, 激素替代治疗
Abstract
Ulnar-Mammary syndrome (UMS) is a rare monogenic disorder caused by mutations of the TBX3 gene. This paper reported a family of UMS. The proband, a 15-year old man, was presented with mammary gland dysplasia, ulnar limb defect, short stature, and delayed growth. Whole exome sequencing revealed a 1294_1301dup mutation in exon 6 of the TBX3 gene. Sanger sequencing was used to verify other members of the family, which suggested his mother also carried the same mutation,but merely resulting in the dysplasia of her left little finger. Notably, unilateral finger involvement without any systemic organ involvement was unusual in UMS patients. The proband then was treated with recombinant human growth hormone (rhGH) and human chorionic gonadotropin (hCG). After a year and a half, his height and secondary sexual characteristics were significantly improved. The clinical manifestations of the disease are highly heterogeneous, which is easy to be misdiagnosed and missed. When the diagnosis is unclear, genetic testing is helpful for auxiliary diagnosis.
Keywords: Ulnar-Mammary syndrome, TBX3 gene, phenotype, hormone replacement therapy
Ulnar-Mammary综合征(Ulnar-Mammary syndrome,UMS)MIM 181450,又称Schinzel综合征,由Schinzel等[1]于1987年首次报道,是一种罕见的常染色体显性遗传病,可影响多个器官及系统,包括乳腺、骨骼、口腔、内分泌及生殖系统等。Bamshad等[2]证实TBX3基因为致病基因,并将其定位于染色体12q23-q24.1。本病较为罕见,发病率尚不明确。临床医生对该病认识不足,容易误诊和漏诊。本文报告1个UMS家系并复习相关文献,旨在提高临床医生对本病的认识,为临床诊治该病提供参考。
1. 病例资料
先证者,男,15岁,因“生长发育迟缓4年”于2020年3月就诊于中南大学湘雅医院(以下简称我院)。患者足月出生,有1姐1妹,父母为非近亲婚配。患者出生时可见双手尺侧对称性赘生物畸形,无骨骼结构,1周岁时将其切除。3周岁时,患者再次手术,纠正轻度腭裂和舌系带过长。患者自幼较少出汗。4年前开始身高明显低于正常同龄人伴阴茎短小。现上中学,学习成绩中等。本研究已获得患者本人及监护人知情同意,并通过中南大学湘雅医院医学伦理委员会审批(审批号:202105093)。
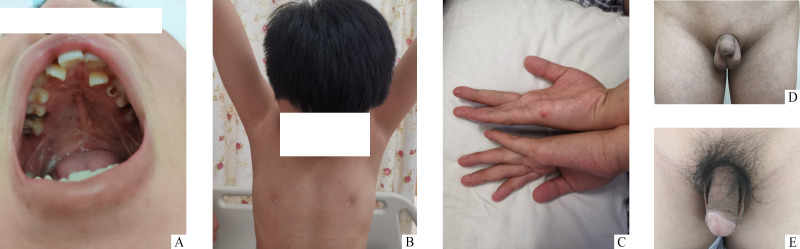
入院体格检查显示:身高为151 cm(在标准身高以下3个标准差),体重40 kg,BMI 17.5 kg/m2,头围53.5 cm,体型匀称,指尖距为148 cm,上部量为83 cm,下部量为76 cm。患者面容特殊,鼻基底及鼻头宽,睑裂上斜。患者口腔上颚可见手术瘢痕,牙列拥挤(图1A)。无乳头,乳晕色浅,无腋毛生长(图1B)。嗅觉无异常。双手尺侧可见手术后遗留切迹(图1C)。外生殖器处于Marshall-Tanner 1期(图1D),无阴毛生长,阴茎长约2.5 cm。双侧睾丸体积分别为3 mL(左侧)和4 mL(右侧)。腹部和下肢体格检查无异常。
图1.
患者体征
Figure 1 Physical sign of the patient
A: Surgical scar on the upper jaw and crowded teeth; B: Absence of the nipple, areola hypopigmentation, and axillary hair loss; C: Visible surgical scar on the ulnar side; D: External genitalia dysplasia before treatment; E: External genitalia development a year and a half later.
常规生物化学检查及甲状腺功能正常。内分泌激素评估结果显示:胰岛素样生长因子(insulin-like growth factors,IGF)-1水平降低(192.0 ng/mL,参考值237.0~996.0 ng/mL)。低血糖生长激素(growth hormone,GH)兴奋试验显示:血糖值低,GH均<5 ng/mL,提示GH缺乏。促性腺激素释放激素(gonadotropin releasing hormone,GnRH)兴奋试验显示:促黄体生成素(luteinizing hormone,LH)峰值正常但延迟,提示可能存在下丘脑性性腺功能减退(表1)。人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)兴奋试验刺激后48 h睾酮可升高至3.55 ng/mL,提示Leydig细胞储备功能可。患者骨龄约12岁。影像学检查:垂体MRI检查无异常。尺骨X线检查、心脏彩超、腹部彩超和心电图均无阳性发现。结合患者身材矮小、面容特殊、乳腺及生殖器发育不良等特点,考虑矮小相关综合征,遂予以完善染色体及基因检测。染色体:46,XY。全外显子测序:患者TBX3基因的第6外显子存在第1 294位点至1 301位点碱基重复(NM_005996.3:c.1294_1301dup)。此变异造成437位的脯氨酸被替换为丙氨酸(p.Pro437Alafs*178),导致翻译链提前终止。随后应用Sanger测序验证其家系中其他成员,结果提示母亲携带相同的突变(图2)。
表1.
兴奋试验结果
Table 1 Results of stimulation test
| 临床指标 | 时间/min | 正常参考值 | |||||
|---|---|---|---|---|---|---|---|
| 0 | 15 | 30 | 60 | 90 | 120 | ||
| 低血糖GH兴奋试验 | |||||||
| BS/(mmol·L-1) | 5.44 | 1.70 | 3.30 | 5.17 | 5.19 | 5.96 | 4.40~7.00 |
| GH/(ng·mL-1) | 0.14 | 0.21 | 3.22 | 2.34 | 0.65 | 0.16 | <10 |
| ACTH/(pmol·L-1) | 6.86 | 4.88 | 5.99 | 6.64 | 3.48 | 2.57 | 1.60~13.90 |
| 游离皮质醇/(μg·dL-1) | 11.40 | 9.06 | 8.99 | 12.86 | 8.39 | 5.62 | 6.20~19.40 |
| 左旋多巴GH兴奋试验 | |||||||
| GH/(ng·mL-1) | 0.18 | — | 0.08 | 0.06 | 0.08 | 0.05 | <10 |
| GnRH兴奋试验 | |||||||
| LH/(IU·L-1) | 2.70 | 9.53 | 17.48 | 22.73 | 24.58 | 23.47 | 0.57~12.07 |
| FSH/(IU·L-1) | 6.22 | 7.68 | 9.33 | 11.98 | 14.39 | 15.57 | 0.95~11.95 |
GH:生长激素;BS:血糖;ACTH:促肾上腺皮质激素;GnRH:促性腺激素释放激素;LH:促黄体生成素;FSH:促卵泡激素。
图2.
家族中各成员基因测序图
Figure 2 Sequence analysis of the whole family
患者母亲基本情况:生长发育正常,无自觉不适,身高160 cm,体重59 kg。14岁初潮,月经周期规律,无异常的妊娠或分娩史,哺乳正常。体格检查无明显阳性体征,仅表现为左手小指近端指间关节无法主动或被动弯曲,伴指间皱褶缺失(图3)。
图3.
患者母亲体征
Figure 3 Physical signs of the patient’s mother
A: Absence of interphalangeal creases of the left little finger; B: Limitation of flexion at the proximal interphalangeal joint.
综合患儿临床表现、生化及基因检测结果,患儿被确诊为UMS。结合患者GH缺乏和hCG兴奋试验结果,予以hCG针2 000 U每周一次肌肉注射和重组人生长激素(recombinant human growth hormone,rhGH)4 IU每晚一次皮下注射治疗,并根据病情调整剂量。在治疗过程中,患者出现亚临床甲状腺功能减退,补充左甲状腺素片。治疗约一年半后,患者身高达到175 cm,睾酮水平也明显升高,达4.7 ng/mL(正常参考值范围0.65~7.78 ng/mL),患者自诉有遗精,第二性征发育得到明显改善,外生殖器发育达到Marshall-Tanner 4期(图1E),甲状腺功能恢复正常,遂停止rhGH和hCG治疗,嘱其定期随访复查。
2. 讨 论
UMS是一种以尺侧肢体发育不全、乳腺发育异常和外生殖器发育不良为特征的罕见疾病[1]。大部分UMS患者都存在肢体发育不全,累及上肢肢体为主,包括多指、并指、屈曲指、缺指、第5指指骨末节发育不良等,严重者可有手或前臂缺失[3-4]。患者也可存在乳腺外观正常但泌乳能力下降,乳头缺失、内陷,乳头和乳晕色素减退等乳腺异常。此外患者还可存在汗腺发育不全,表现为出汗减少,腋毛缺失。若有生殖器受累,可表现为阴茎短小、披肩样阴囊、隐睾等[5]。可伴随生殖器发育异常、身材矮小、青春期延迟等。本例先证者尺侧多指、乳头缺失、无腋毛、阴茎短小、身材矮小等临床表现与UMS常见表现符合。此外,其面容也较为特殊,鼻基底及鼻头宽,睑裂上斜,同时存在牙列拥挤、腭裂、舌系带发育异常等畸形。查阅文献发现,部分UMS患者还存在面部特征及“中线发育畸形”。Joss等[6]发现12例UMS患者均具有相似的面部特征,如宽鼻头,宽下颌,突出的下巴和过长的舌系带等。文献[7]详细归纳了UMS患者“中线发育畸形”,包括宽鼻尖、喙鼻尖、鼻尖裂、唇裂、腭裂、悬雍垂裂、舌尖裂、牙齿异常、脊柱侧弯、舌系带发育异常等。近年来,随着UMS病例报道逐渐增多,其表现型也逐渐扩大,包括心脏畸形(房间隔缺损、室间隔缺损、心脏传导阻滞)、肥胖、腹股沟疝等[5, 8]。
目前普遍认为UMS患者TBX3基因突变后无法结合DNA导致TBX3 蛋白的单倍体剂量不足[9]。TBX3基因突变以移码突变和无义突变为主,在已报道的病例中仅3例为错义突变[7, 10]。本例先证者TBX3基因突变为移码突变,导致437位的脯氨酸被替换为丙氨酸,翻译链提前终止。通过对人类基因突变数据库(Human Gene Mutation Database,HGMD)等在线数据库的检索,发现Bamshad等[11]在对多个家族的UMS患者的研究中也报告了相同的突变位点。TBX3是转录因子T-box基因家族的成员,其共享一个高度保守的DNA结合域(T区),表达产物为真核生物的转录调控因子[12]。在胚胎期乳腺发育中,TBX3持续在乳腺芽中表达,最后在乳头周围的间质中表达[13-14]。TBX3和Wnt、Fgf信号通路共同参与乳腺的发育,对乳腺基板及乳腺芽的发生至关重要[15]。敲除TBX3基因的小鼠表现为乳腺导管减少和乳头缺失[14]。TBX3可影响顶端外胚层嵴调控肢芽的发生[16],如TBX3表达早期缺失,可破坏Shh信号转导从而导致少指,后期缺失可影响Hedgehog通路导致多指[17]。本例先证者与该机制所造成的临床表现基本符合。UMS患者中大多数常见的临床特征与TBX3表达区域一致,然而它在其他组织中的表达似乎没有临床意义。
身材矮小及发育迟缓是UMS患者就诊的常见原因,考虑其均继发于GH和性激素分泌异常。TBX3可在下丘脑神经元中表达,推测可能通过下丘脑-垂体-性腺轴,影响性激素水平及性腺发育[18]。男性患者发育迟缓较女性更为严重[7]。患者外生殖器发育不全、青春期延迟,GnRH兴奋试验可以被兴奋,但反应延迟,综合考虑由于下丘脑促性腺激素释放激素缺乏引起的特发性低促性腺激素型性腺功能减退症(idiopathic hypogonadotropic hypogonadism,IHH)。UMS患者可表现为体质性青春发育延迟(constitutional delay of growth and puberty,CDGP)或IHH[7]。目前尚缺乏临床证据辨别UMS患者中IHH和CDGP。
缺乏TBX3基因表达的小鼠可导致垂体漏斗部和 Rathke 囊(垂体前叶的前体)发育不全[19]。UMS患者影像学也可见垂体前叶发育不良,垂体柄薄等结构异常[20]。垂体前叶主要分泌GH、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、促甲状腺激素(thyroid stimulating hormone,TSH)、促卵泡激素(follicle-stimulating hormone,FSH)、LH等激素。本例先证者身材矮小,IGF-1水平低,结合低血糖GH兴奋试验提示患者GH缺乏。而患者ACTH和TSH水平无异常,无甲状腺及肾上腺异常相关表现。
国内外对于UMS患者的激素替代治疗方案不尽相同。女性患者发育迟缓往往表现较轻微,仅需生长激素替代治疗即可[7]。而对男性患者,则需综合患者的生长发育速度及垂体功能情况制订激素替代治疗方案。Schinzel等[21]报道的UMS家系中的先证者在14~22岁之间予以补充睾酮及促性腺激素后身高及外生殖器达到正常成年人水平,但其精液分析仍存在异常;而先证者的侄子尽管在6岁时开始激素(GH及hCG)替代治疗,效果仍欠佳。在Galazzi等[7]的研究中,患者的激素替代方案为hCG及FSH,尽管其疗效尚可,但停药后IHH复发。国内报道的第1例UMS患者[8]在13岁时予以rhGH治疗,1年后身高得到明显改善,但未予雄激素替代治疗。对本例患者hCG及GH治疗明显促进了身高和第二性征发育,患者已有遗精,但精液是否正常有待进一步检查,需继续跟踪随访。
先证者母亲仅表现为手指异常。Al-Qattan等[22]在2020年报道了1例患者仅表现为双侧小指近端指间关9节皱褶缺失及屈曲受限,即小指背侧化伴有第4掌指间隙的加深,并认为这是UMS患者的新表型。单侧小指受累而无其他器官受累罕见。尽管众多UMS病例被报道,目前该疾病的家族间和家族内的变异程度大,其机制仍未明确。Kumar等[23]通过蛋白质组学研究发现TBX3与多种mRNA剪接因子和RNA代谢蛋白质相互作用。TBX3在体内可调节选择性剪接,并直接与选择性剪接的mRNA结合。UMS患者突变的多样性可能是由于破坏了该蛋白的转录调节和前体mRNA的剪接功能。既往也有研究[24]指出发生在T结构域内部或上游的突变,因在很大程度上参与促进/抑制靶基因的转录,从而表现出更严重的表型。TBX3在皮肤、眼睛、肝、胰腺、肺、肾中均有表达[25],但UMS患者未能发现这些器官的受累,这可能意味着TBX3特定表达水平对其在组织或器官中的功能至关重要。笔者推测在未受UMS影响的组织和器官中,可能存在其他修饰物或其他T-box转录因子,可以改变或修饰TBX3。然而,要确定UMS变异的确切机制,仍需进一步研究。
Limb-Mammary综合征是一种TP63基因突变所致的常染色体显性遗传病,临床表现与UMS极为相似,主要表现为手足发育异常,乳腺和乳头发育不全,少见表现还可有泪管闭锁、指甲发育不良、牙齿发育不全和腭裂等[26]。其临床鉴别困难,诊断主要靠基因检测。
UMS作为一类临床表现异质性强的非致死性遗传性疾病,当表现轻微时不易被重视,直至家族中具有严重表型的患者出现。本研究中先证者予以rhGH及hCG治疗,期间辅以补充甲状腺素治疗后,患者身高及第二性征发育得到明显改善。先证者母亲表现轻微,目前国内尚无类似报道,临床容易漏诊。这提示临床表型严重的UMS患者需尽早激素替代治疗进行干预,以减少对其生长及生育的影响。
综上所述,本研究报道了1个UMS的家系,并证实TBX3基因是UMS的致病基因。该疾病的临床表现异质性很强,容易误诊漏诊,当诊断不明时,基因检测有助于辅助诊断。
利益冲突声明
作者声称无任何利益冲突。
作者贡献
彭宁 数据采集和分析,论文撰写;郭敏 数据分析;蒋铁建 论文审阅。所有作者阅读并同意最终的文本。
原文网址
http://xbyxb.csu.edu.cn/xbwk/fileup/PDF/2022121769.pdf
参考文献
- 1. Schinzel A. Ulnar-mammary syndrome[J]. J Med Genet, 1987, 24(12): 778-781. 10.1136/jmg.24.12.778. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2. Bamshad M, Lin RC, Law DJ, et al. Mutations in human TBX3 alter limb, apocrine and genital development in ulnar-mammary syndrome[J]. Nat Genet, 1997, 16(3): 311-315. 10.1038/ng0797-311. [DOI] [PubMed] [Google Scholar]
- 3. Bamshad M, Root S, Carey JC. Clinical analysis of a large kindred with the Pallister Ulnar-mammary syndrome[J]. Am J Med Genet, 1996, 65(4): 325-331. [DOI] [PubMed] [Google Scholar]
- 4. Ramirez RN, Kozin SH. Ulnar-mammary syndrome[J]. J Hand Surg Am, 2014, 39(4): 803-805. 10.1016/j.jhsa.2014.01.024. [DOI] [PubMed] [Google Scholar]
- 5. Chen H. Ulnar-mammary syndrome[M]// Atlas of Genetic Diagnosis and Counseling. New York, NY: Springer New York, 2017: 2931-2936. [Google Scholar]
- 6. Joss S, Kini U, Fisher R, et al. The face of ulnar mammary syndrome?[J]. Eur J Med Genet, 2011, 54(3): 301-305. 10.1016/j.ejmg.2010.12.010. [DOI] [PubMed] [Google Scholar]
- 7. Galazzi E, Duminuco P, Moro M, et al. Hypogonadotropic hypogonadism and pituitary hypoplasia as recurrent features in Ulnar-Mammary syndrome[J]. Endocr Connect, 2018, 7(12): 1432-1441. 10.1530/EC-18-0486. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8. 王晓艳, 陈秀丽, 吴海瑛, 等. TBX3基因突变导致Ulnar-Mammary综合征一例的临床及分子遗传学分析并文献复习[J]. 中华内分泌代谢杂志, 2020, 36(7): 593-597. 10.3760/cma.j.cn311282-20191225-00577. [DOI] [Google Scholar]; WANG Xiaoyan, CHEN Xiuli, WU Haiying, et al. Clinical and genetic analysis of Ulnar-Mammary syndrome caused by TBX3 de novo mutation in a boy and literature review[J]. Chinese Journal of Endocrinology and Metabolism, 2020, 36(7): 593-597. 10.3760/cma.j.cn311282-20191225-00577. [DOI] [Google Scholar]
- 9. Wollnik B, Kayserili H, Uyguner O, et al. Haploinsufficiency of TBX3 causes Ulnar-mammary syndrome in a large Turkish family[J]. Ann Genet, 2002, 45(4): 213-217. 10.1016/s0003-3995(02)01144-9. [DOI] [PubMed] [Google Scholar]
- 10. Bamshad M, Krakowiak PA, Watkins WS, et al. A gene for Ulnar-mammary syndrome maps to 12q23-Q24.1[J]. Hum Mol Genet, 1995, 4(10): 1973-1977. 10.1093/hmg/4.10.1973. [DOI] [PubMed] [Google Scholar]
- 11. Bamshad M, Le T, Watkins WS, et al. The spectrum of mutations in TBX3: Genotype/Phenotype relationship in ulnar-mammary syndrome[J]. Am J Hum Genet, 1999, 64(6): 1550-1562. 10.1086/302417. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12. Carlson H, Ota S, Campbell CE, et al. A dominant repression domain in Tbx3 mediates transcriptional repression and cell immortalization: relevance to mutations in Tbx3 that cause Ulnar-mammary syndrome[J]. Hum Mol Genet, 2001, 10(21): 2403-2413. 10.1093/hmg/10.21.2403. [DOI] [PubMed] [Google Scholar]
- 13. Chapman DL, Garvey N, Hancock S, et al. Expression of the T-box family genes, Tbx1-Tbx5, during early mouse development[J]. Dev Dyn, 1996, 206(4): 379-390. [DOI] [PubMed] [Google Scholar]
- 14. Davenport TG, Jerome-Majewska LA, Papaioannou VE. Mammary gland, limb and yolk sac defects in mice lacking Tbx3, the gene mutated in human ulnar mammary syndrome[J]. Development, 2003, 130(10): 2263-2273. 10.1242/dev.00431. [DOI] [PubMed] [Google Scholar]
- 15. Eblaghie MC, Song SJ, Kim JY, et al. Interactions between FGF and Wnt signals and Tbx3 gene expression in mammary gland initiation in mouse embryos[J]. J Anat, 2004, 205(1): 1-13. 10.1111/j.0021-8782.2004.00309.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16. Khan SF, Damerell V, Omar R, et al. The roles and regulation of TBX3 in development and disease[J]. Gene, 2020, 726: 144223. 10.1016/j.gene.2019.144223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17. Emechebe U, Kumar PP, Rozenberg JM, et al. T-box3 is a ciliary protein and regulates stability of the Gli3 transcription factor to control digit number[J/OL]. Elife, 2016, 5: e07897[2022-03-29]. 10.7554/eLife.07897. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18. Eriksson KS, Mignot E. T-box 3 is expressed in the adult mouse hypothalamus and medulla[J]. Brain Res, 2009, 1302: 233-239. 10.1016/j.brainres.2009.08.101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19. Pontecorvi M, Goding CR, Richardson WD, et al. Expression of Tbx2 and Tbx3 in the developing hypothalamic-pituitary axis[J]. Gene Expr Patterns, 2008, 8(6): 411-417. 10.1016/j.gep.2008.04.006. [DOI] [PubMed] [Google Scholar]
- 20. Linden H, Williams R, King J, et al. Ulnar Mammary syndrome and TBX3: expanding the phenotype[J]. Am J Med Genet A, 2009, 149A(12): 2809-2812. 10.1002/ajmg.a.33096. [DOI] [PubMed] [Google Scholar]
- 21. Schinzel A, Illig R, Prader A. The Ulnar-Mmammary syndrome: an autosomal dominant pleiotropic gene[J]. Clin Genet, 1987, 32(3): 160-168. 10.1111/j.1399-0004.1987.tb03347.x. [DOI] [PubMed] [Google Scholar]
- 22. Al-Qattan MM, Maddirevula S, Alkuraya FS. A de novo TBX3 mutation presenting as dorsalization of the little fingers: a forme fruste phenotype of Ulnar-mammary syndrome[J]. Eur J Med Genet, 2020, 63(1): 103615. 10.1016/j.ejmg.2019.01.005. [DOI] [PubMed] [Google Scholar]
- 23. Kumar PP, Franklin S, Emechebe U, et al. TBX3 regulates splicing in vivo: A novel molecular mechanism for Ulnar-mammary syndrome[J/OL]. PLoS Genet, 2014, 10(3): e1004247[2022-04-01]. 10.1371/journal.pgen.1004247. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24. Meneghini V, Odent S, Platonova N, et al. Novel TBX3 mutation data in families with Ulnar-Mammary syndrome indicate a genotype-phenotype relationship: mutations that do not disrupt the T-domain are associated with less severe limb defects[J]. Eur J Med Genet, 2006, 49(2): 151-158. 10.1016/j.ejmg.2005.04.021. [DOI] [PubMed] [Google Scholar]
- 25. Washkowitz AJ, Gavrilov S, Begum S, et al. Diverse functional networks of Tbx3 in development and disease[J]. Wiley Interdiscip Rev Syst Biol Med, 2012, 4(3): 273-283. 10.1002/wsbm.1162. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26. van Bokhoven H, Jung M, Smits APT, et al. Limb mammary syndrome: a new genetic disorder with mammary hypoplasia, ectrodactyly, and other hand/foot anomalies maps to human chromosome 3q27[J]. Am J Hum Genet, 1999, 64(2): 538-546. 10.1086/302246. [DOI] [PMC free article] [PubMed] [Google Scholar]